Method Article
Microscopia intravital y trombos de inducción en el lóbulo de la oreja de un ratón sin pelo
* Estos autores han contribuido por igual
En este artículo
Resumen
El modelo de oreja del ratón sin pelo SKH1-Hr hr permite microscopía de fluorescencia intravital de la microcirculación y la inducción de trombos fototóxico sin preparación quirúrgica previa en el lecho microvascular examinado. Por lo tanto, la oreja del ratón sin pelo es un excelente modelo in vivo para estudiar las interacciones complejas durante la formación de trombos microvasculares, la evolución de trombos, y la trombólisis.
Resumen
complicaciones trombóticas de las enfermedades vasculares son una de las principales causas de morbilidad y mortalidad en los países industrializados. Debido a las complejas interacciones entre los componentes sanguíneos celulares y no celulares durante la formación de trombos, estudios fiables de la fisiología y la patofisiología de la trombosis sólo pueden llevarse a cabo in vivo. Por lo tanto, este artículo presenta un modelo de oreja en ratones sin pelo y se centra en el análisis in vivo de la microcirculación, la formación de trombos, y la evolución de trombos. Mediante el uso de microscopía de fluorescencia intravital y la intravenosa (iv) la aplicación de los respectivos colorantes fluorescentes, un análisis repetitivo de la microcirculación en la aurícula fácilmente se puede realizar, sin la necesidad de la preparación quirúrgica. Además, este modelo puede ser adaptado para estudios in vivo de los diferentes temas, incluyendo la cicatrización de heridas, lesión por reperfusión, o angiogénesis. En resumen, la oreja de los ratones sin pelo es un modelo ideal para el en vivo estudio de la microcirculación de la piel en condiciones fisiológicas o fisiopatológicas y para la evaluación de su reacción a diferentes tratamientos sistémicos o tópicos.
Introducción
El propósito del presente artículo es describir la técnica de la microscopía intravital aplicada a la aurícula del ratón sin pelo para la observación directa y el análisis de la microcirculación, la formación de trombos, y la evolución de trombos. Con una tasa de incidencia de 1 en 1000, trombosis venosa sigue siendo una causa común de morbilidad. Aunque el diagnóstico, estrategias de prevención y terapias se han desarrollado en los últimos años, un tercio de la trombosis venosa se manifiesta como una embolia pulmonar 1. La trombosis arterial juega un papel crítico en las enfermedades cardiovasculares, que son la causa más común de muerte en los países industrializados. La trombosis arterial basado en la ruptura de las placas ateroscleróticas está involucrado en ataques cardiacos, infartos mesentéricas, y apoplejía. Cada cirugía expone estructuras subendoteliales a componentes de la sangre, cambia la dinámica de flujo de sangre, e inmoviliza el paciente. En la cirugía de endoprótesis de la extremidad inferior, órgano transplantation y trombosis cirugía de colgajo son causas frecuentes de complicaciones. trombosis microvascular en particular, con frecuencia provoca daños irreversibles, debido a la falta de síntomas clínicos. Del mismo modo, la trombosis microvascular juega una regla fundamental en varias enfermedades, incluyendo la púrpura trombótica trombocitopénica, sepsis, coagulación intravascular diseminada, síndrome antifosfolípido, y la insuficiencia venosa crónica, entre otros.
Varios de los nuevos medicamentos para la terapia y prevención de la trombosis se han desarrollado en los últimos años, pero los fármacos antiplaquetarios y anticoagulantes todavía tienen efectos secundarios, antagonistas de la falta, y cuentan con efectos de larga duración. Estas deficiencias conducen a problemas en la atención médica de emergencia. Por lo tanto, se necesita más investigación para descubrir los procesos complejos que se producen durante la trombosis, que difícilmente puede ser simulada in vitro.
El ratón sin pelo HR SKH1-Hr fue descubierta 1926 en un zoológico de Londres.Debido a un defecto genético en el cromosoma 14, el animal pierde su piel después del día postnatal 10. Esto hace que la aurícula bien vascularizado accesible para microscopía intravital de los vasos. El espesor medio de la oreja es de 300 m. Se compone de dos capas de la dermis, que están separados por el cartílago. En el lado dorsal convexa del cartílago, 3 haces vasculares entran en el lóbulo de la oreja. arcos vasculares apical y shunts basales conectan los tres haces. Las vénulas tienen diámetros comprendidos entre 200 micras (basal) y 10 m (apical). Capilares de malla fina rodean el cabello folículos vacíos 2. La anatomía del ratón sin pelo HR SKH1-Hr hace que la aurícula un modelo potente y rentable para la investigación de la trombosis.
Protocolo
Todos los experimentos in vivo (7221.3-1-006 / 15) se llevaron a cabo de acuerdo con la legislación alemana sobre protección de los animales y la Guía del NIH para el Cuidado y Uso de Animales de Laboratorio (Instituto de Recursos Animales de Laboratorio, Consejo Superior de Investigaciones Científicas).
1. Mantener general de los animales
- Realice los experimentos con ratones hr SKH1-HR macho de 4 a 6 semanas. Utilizar animales con un peso entre 20 y 25 g.
- Mantener a los animales en una instalación libre de patógenos y en condiciones estandarizadas de 24 a 26 ° C y alrededor de 60% de humedad relativa, con acceso constante a agua y alimento ad libitum.
- Mantener hasta cinco animales macho en una jaula. Proporcionar ropa de cama y material de enriquecimiento durante el alojamiento de los animales para su bienestar.
2. Predisposición de los Animales
- Pesar un ratón y cargar el fármaco respectivo (por ejemplo, el cannabinoide, 5 mg / kg de peso corporal (BW)) en una jeringa de insulina. Administrar el fármaco min 30 antes de la inducción del trombo.
- Al mantener el cuello del ratón entre el pulgar y el dedo índice y la cola del ratón con el dedo meñique, estirar el animal e inyectar el fármaco por vía intraperitoneal (ip) en el cuadrante inferior izquierdo del abdomen. Ponga el animal de nuevo en la jaula durante 15 min.
- Preparar la anestesia con ketamina (90 mg / kg de peso corporal) y xilazina (25 mg / kg de peso corporal). 15 min antes de la inducción del trombo, anestesiar al ratón. Ponga el ratón en la jaula, tirar de la cola ligeramente, e inyectar el ip anestésicos con una jeringa de insulina.
- Ponga el ratón de nuevo en la jaula hasta el inicio de la anestesia. Para verificar la anestesia suficiente, pellizcar la cola con unas pinzas.
- Cargar 0,05 ml de dextrano descongelado isotiocianato de fluoresceína marcado con (FITC-dextrano; 5%, 150 kDa) en una jeringa de insulina. Mientras llenado de la jeringa, garantizar que no queden burbujas de aire, ya que incluso pequeñas intravenously (iv) las burbujas de aire administrados por la OMPI puede ser letal para el animal.
- Coloque el ratón anestesiado en una placa de calentamiento en la posición boca abajo. Ajustar la placa de calentamiento a 37 ° C.
- Ponga pomada ocular en la córnea del ratón. Desinfectar la piel y el uso de instrumentos estériles.
- Cosa dos suturas de polipropileno 7/0 en el borde craneal y caudal de la oreja derecha. Coloque los puntos de sutura tan cerca del borde y como proximal a la base como sea posible (Figura 1B).
- Desplazar el ratón a la posición dorsal. Fijar todas las patas a la plataforma acrylglass el uso de tiras adhesivas. Enganche una sutura bajo los dientes delanteros y la posición de la cabeza en la dorsiflexión pegando la sutura a la acrylglass con tiras adhesivas.
- Translocate el animal sobre la plataforma bajo el estereomicroscopio operación. Utilice magnificación de 16X.
3. Preparación de la vena yugular y la inyección de FITC-dextrano izquierda
Nota: para micrófonoroscopy de la oreja derecha, preparar la vena yugular izquierda.
- El uso de un bisturí, crear una incisión de 5 mm en la piel en el lado izquierdo del cuello en una dirección cráneo-caudal. Diseccionar el tejido subcutáneo con un micropinzas y micro tijeras. Cualquiera de los vasos de cruce se liga con poliéster 8/0 suturas o con electrocoagulación.
- Liberar la vena de su adventicia usando micropinzas y micro tijeras sin tocar el recipiente.
- Usar la jeringa de insulina preparada para la inyección del colorante fluorescente. agarrar con cuidado la pared del vaso con las micropinzas, sin perforar la vena. Penetran en la pared del vaso dilatado con la jeringa e inyectar iv FITC-dextrano.
- Detener la hemorragia después de la retirada de la jeringa usando hisopos de algodón. Evitar la sangre y teñir la contaminación de la oreja.
4. Colocación de la oreja derecha de intravital microscopía de fluorescencia
- Transferir el animal sobre la placa de calentamiento a una acrylglass construction con una ranura para la placa de calentamiento y un plano de 0,5 cm de alto para el posicionamiento del oído.
- Fijar el animal cara hacia abajo en la placa de calentamiento mediante tiras adhesivas. Coloque el cartílago relativamente fuerte y convexa en la base de la oreja al lado de la 0,5 cm de alto avión para el oído (Figura 1B) de manera que la parte apical de la oreja puede colocarse plana en el avión.
- Añadir una gota de temperatura ambiente 0,9% NaCl al plano acrylglass el fin de posicionar el oído. Coloque la oreja derecha, con las suturas preestablecidas en su cóncava lado ventral hacia abajo, sobre la gota de 0.9% de NaCl. El uso de hisopos de algodón, absorber la caída de NaCl y dejar que las fuerzas capilares se unen el plano oído a la acrylglass.
- Cinta de las suturas para la acrylglass para fijar la posición de la oreja.
- Añadir una gota de 0.9% NaCl temperatura ambiente a la cara dorsal convexa de la oreja. Con cuidado, poner un cubreobjetos (0,5 cm de diámetro) en la oreja sin comprimir los vasos basales entran ºe oreja. El uso de bastoncillos de algodón, eliminar la mayor cantidad posible de NaCl de debajo del cubreobjetos con el fin de minimizar la distancia entre el cubreobjetos y los vasos diana oído.
5. intravital microscopía de fluorescencia y el trombo inducción de la oreja derecha
- Ajuste el microscopio de fluorescencia intravital para la visualización FITC-dextrano (450 - 490 nm; FT: 510; LP: 520). Utilice una lámpara de mercurio de 100 W-variable como una fuente de luz. Conectar una alta resolución, cámara CCD en blanco y negro a una grabadora de DVD.
- Transferir el animal en la acrylglass que contiene la placa de calentamiento con el oído secuestrado fija a la mesa del microscopio de fluorescencia intravital.
- El uso de 20 aumentos (20X / 0.95 abertura numérica) y la intensidad de luz del 20%, la búsqueda de un vaso venoso 50 - 60 micras de diámetro y con un flujo de sangre anterógrado de 400 a 600 m / s.
- Añadir una gota de agua a temperatura ambiente a la cubreobjetos de inmersión en agua de la 63x magnification objetivo (63X / 0.95 abertura numérica). Use una jeringa con una cánula 1 mm de diámetro y colocar la gota en el objetivo del microscopio. Añadir agua suficiente para ponerse en contacto con el cubreobjetos y el objetivo con la gota de agua.
- Inmediatamente después de la aplicación de la gota de agua, comenzar a grabar el recipiente durante 20 s con 20% de intensidad de la luz para la medición en línea de la corriente de diámetro y sangre.
- Iniciar la inducción trombo 5 min después de la inyección de FITC-dextrano. Para este fin, elevar la intensidad de la luz a 100%.
- Durante la inducción de trombos, cerrar la abertura del microscopio durante 2 s en un plazo de 30-s para comprobar el flujo de sangre. En caso de persistencia de flujo sanguíneo, abrir la abertura de nuevo. En el caso de flujo sanguíneo detenido, observar el recipiente durante 30 s.
NOTA: El recipiente se clasifica como ocluida si el flujo se detiene durante 30 s o más o si la sangre fluye de forma retrógrada. Si el flujo sanguíneo ortógrada comienza de nuevo, abrir completamente la abertura y Contin ue la inducción de trombos hasta que se produce la oclusión del vaso como se describe anteriormente. Durante la inducción del trombo temprano, aseguran que los tiempos cuando la abertura se cerró para comprobar el flujo de la sangre son tan cortos como sea posible a fin de mantener casi continua epi-iluminación. Más tarde, durante el crecimiento de trombos, el recipiente se perfunde con el tinte fluorescente menos, por lo que se puede observar continuamente. - Seleccionar y ocluir vasos 5 por oído. Limitar el momento de la inducción del trombo bajo el microscopio para aproximadamente 1 h después de la inyección de FITC-dextrano.
6. Actividades de seguimiento
- Realizar un cierre de la herida del cuello usando polipropileno transcutánea 6/0 suturas.
- Durante la recuperación de la anestesia, poner el ratón de nuevo en la jaula y calentar el animal usando luz infrarroja.
- La transferencia de los datos registrados de la grabadora DVD al software que permite la medición del diámetro de los vasos y la velocidad del flujo sanguíneo.
- Deje que el animal se recupere y eliminar todas inyectado FITC-dextrano durante 48 h.
- Vuelva a ejecutar las etapas descritas anteriormente, esta vez la preparación de la vena yugular derecha y la oreja izquierda.
8. Tejido Asservation
- Después de microscopía de fluorescencia intravital de la oreja izquierda, muestra de 0,5 ml de sangre a partir del plexo retrobulbar vena del ojo usando un capilar de vidrio. penetrar con cuidado el ángulo palpebral interior con los movimientos de rosca, hasta que la sangre venosa fluye a través del capilar. Recoger la sonda en un tubo de sangre ácido etilendiaminotetraacético (EDTA).
- Después de tomar muestras de sangre, sacrificar el animal mediante la inyección de 500 mg / kg de ketamina bw en la vena caudal.
- Contar las células de sangre usando un analizador de hematología para una evaluación cuantitativa de leucocitos, eritrocitos, plaquetas, hemoglobina y hematocrito.
- Centrifugar la sangre EDTA restante a 2500 xg y temperatura ambiente durante 10 men. Pipeta y congelar el plasma sanguíneo para investigaciones posteriores.
- Con unas tijeras, corte las aurículas y fijarlos en formaldehído al 4% para el examen histológico.
Resultados
Efectos del tratamiento sobre Cannabinoides trombogénesis
Tras la inyección de 0,05 ml de FITC-dextrano, la inducción de trombos fototóxico conduce a una lesión endotelial y la formación de un tapón de plaquetas parietal (Figuras 2 y 3). En el presente estudio, la inducción de trombos después de la inyección ip de los cannabinoides (5 mg / kg de peso corporal) o vehículo dio lugar a una oclusión de los vasos trombótica en todas las vénulas (Figura 4). En los animales tratados con vehículo, el tiempo para la formación de trombos fue de 430 s (25 percentil: 330 s; percentil 75: 637 s). Ni cannabidiol (CBD), ni la administración WIN55,212-2 (WIN) mostraron una influencia relevante sobre los tiempos de oclusión de los vasos. Sin embargo, la anandamida cannabinoide endógeno reduce significativamente el tiempo necesario para la formación de trombos y la oclusión del vaso trombótica a 270 s (25 percentil: 240s; Percentil 75: 360 s, P <0,05 frente a vehículo).
Para probar si la hidrólisis de la anandamida y la posterior conversión de la ciclooxigenasa dependiente de su producto, ácido araquidónico, está implicado en la formación de trombos por la anandamida, la indometacina inhibidor de la ciclooxigenasa inespecífica se combinó con la anandamida en otro conjunto de experimentos (Figura 5). Una vez más, tras la inyección de 0,1 ml de FITC-dextrano, la anandamida (10 mg / kg de peso corporal) reducido los tiempos de formación de trombos, en comparación con vehículo (p <0,05 frente a vehículo). Mientras que el tratamiento con indometacina sola no tuvo efecto sobre los tiempos de oclusión venulares, la inhibición de la ciclooxigenasa en los animales de anandamida tratados con la formación de trombos significativamente prolongada a 300 s (25 percentil: 240 s; percentil 75: 420 s), en comparación con la mediana de 160 s (percentil 25: 100 s; percentil 75: 200 s) después de tre anandamida atment solamente (P <0,05 frente a la anandamida). Veces oclusión de los vasos después de tratamiento con vehículo y la indometacina / anandamida co-administración no difirieron significativamente 2.
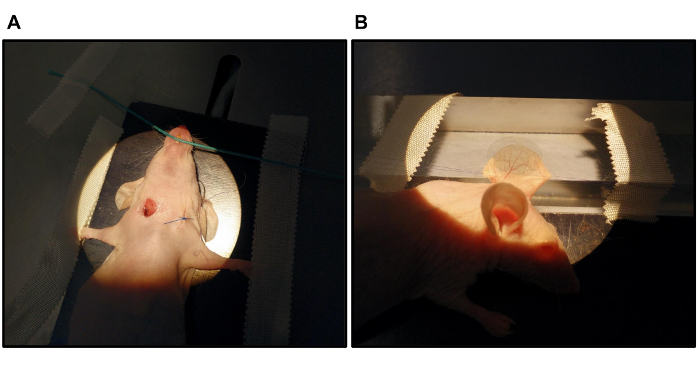
Figura 1. Preparación de la vena yugular (A) y la colocación de la Oreja para Microscopia intravital (B). (A) Utilizando el microscopio estereoscópico operación, se prepara la vena yugular derecha. Las suturas para la colocación de la oreja izquierda se cosen antes de la inyección de FITC-dextrano. La herida de la disección previa de la vena yugular izquierda se cierra con suturas transcutáneas (B). La oreja izquierda se fija con polipropileno 7/0 suturas. Un cubreobjetos se coloca cuidadosamente sin comprimir los vasos basales del oído. Una placa de calentamiento mantiene la temperatura corporal del animal durante todo el experimento.om / archivos / ftp_upload / 55174 / 55174fig1large.jpg" target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
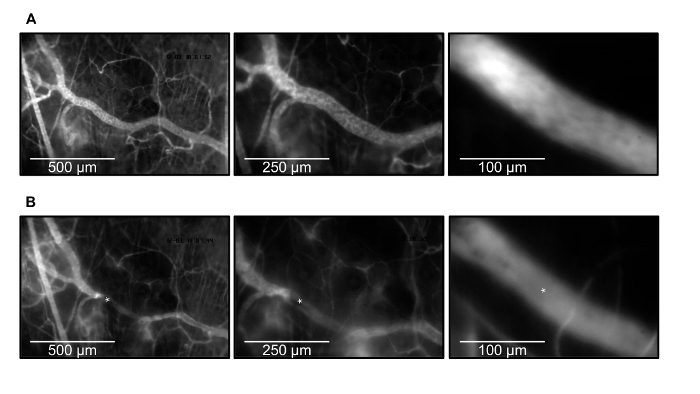
Figura 2. Microscopía intravital y trombos de inducción. El mismo vénula se muestra antes de la inducción (A) y después (B) de trombos en 10X, 20X, y magnificación 63X (de izquierda a derecha). El plasma sanguíneo se tiñe con 0,05 ml de fluoresceína dextrano marcado con isotiocianato de (FITC-dextrano, 5%). El trombo está marcado con *. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Venulares trombo inducción. El mismo vénula se muestra acabenmi (A), después de 100 s (B), y después de 300 s (C) de epi-iluminación por medio de microscopía de fluorescencia intravital. especies reactivas de oxígeno son generados por la luz azul epi-iluminación (450 - 490 nm) de FITC-dextrano y menoscaban el endotelio. Por lo tanto, las plaquetas se activan y se adhieren a las estructuras subendoteliales expuestas, resultando en la formación primaria trombo parietal (B) y, posteriormente, en la oclusión del vaso trombótica completa (C). Esta figura se ha modificado a partir de Grambow 3. El trombo está marcado con *. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Diagrama de flujo Viendo el protocolo experimental. </ Strong> tratamiento de cannabinoides mediante inyección ip del cannabinoide respectivo (5/10 mg / kg de peso corporal) se realizó 30 minutos antes de IVM y la inducción de la formación de trombos en el oído derecho en el día 0. IVM se limitó a 1 h. 47 h más tarde, el día 2, el mismo protocolo se aplicó a la oreja izquierda del ratón antes de muestreo de la sangre. Esta figura se ha modificado a partir de Grambow 3. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. venular formación de trombos después de solo tratamiento de cannabinoides y ciclooxigenasa inhibición. veces la oclusión de las vénulas en ratones sometidas a la inducción de trombos luz / colorante. (A) Los animales fueron tratados con el vehículo que contiene DMSO-(VEH) o con la anandamida cannabinoides (AEA), WIN55,212-2 (WIN), o cannabidiol (CBD) (5 mg / kg de peso corporal; n = 5). 0,05 ml de 5% de FITC-dextrano se inyectó iv antes de la inducción del trombo. En otro ambiente, 0,1 ml de 5% de FITC-dextrano (B) anandamida (10 mg / kg de peso corporal) se combinó con la indometacina (Indo) (5 mg / kg de peso corporal) para evaluar el impacto de los productos de la ciclooxigenasa-dependiente de la formación de trombos por anandamida (n = 5). Kruskal-Wallis ANOVA de una vía en filas fue seguido de análisis post hoc de Dunn (A y B). Los valores se dan como la mediana y IQR (5º, 25º, 75º, y 95º percentiles). * P <0,05 frente a vehículo, # P <0,05 frente a la anandamida, § P <0,05 frente a indometacina. Esta figura se ha modificado a partir de Grambow 3. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay varios pasos críticos para el éxito de la inducción de trombos en el lóbulo de la oreja de los ratones hr SKH1-HR. Para la solución de problemas, las respectivas etapas del protocolo se indican entre paréntesis.
condiciones de examen son ideales en los animales jóvenes a la edad de 4 - 6 semanas y con baja cornificación de la epidermis. En animales de mayor edad, la calidad de la visualización de los vasos es peor y menos comparable debido a la distancia mayor entre la superficie de la piel y los vasos diana (paso 1.1).
Para evitar la extravasación de FITC-dextrano en la zona de examen, las suturas de fijación deben ser colocados como marginalmente como sea posible. En las proximidades de los puntos de sutura, tinte fluorescente puede extravasación y reducir el contraste entre el espacio extravascular y los vasos. Esta extravasación del colorante progresa lentamente. Si las suturas se cosen como se ha mencionado anteriormente 15 min antes de la inyección de FITC-dextrano, buenacondiciones de examen de microscopía intravital se aseguran (paso 2.8).
FITC-dextrano se elimina lentamente por vía renal. La combinación del colorante fluorescente con dextrano de alto peso molecular (150 kDa) retrasa la extravasación y la excreción. En el presente estudio, el tiempo para la microscopía y el trombo inducción se limita a 1 h para evitar la influencia de la excreción y bajas concentraciones de plasma de colorante fluorescente en tiempo de formación de trombos.
Mientras que el llenado de las jeringas, no hay burbujas de aire deben permanecer para la inyección, ya que incluso pequeñas burbujas de aire IV-administran en la jeringa puede ser letal para el animal (paso 2.5). Al tirar de la jeringa de la vena yugular después de la inyección iv, sangrado normal se produce (paso 2.6). La contaminación de la oreja examinado posteriormente con sangre o FITC-dextrano hace microscopía intravital sustancialmente difícil o incluso imposible. Por lo tanto, se recomienda la preparación de la oreja contralateral y la vena yugular.
La inyección del colorante fluorescente debe ser lo más precisa y completa como sea posible, ya que la administración de tinte incorrecto influiría notablemente los tiempos de oclusión (paso 3.3). No se recomiendan las inyecciones en la vena de la cola y retrobulbar plexo vena. Ellos no son tan fiables como la administración en la vena yugular, a pesar de que son menos invasivos para el animal. Por lo tanto, FITC-dextrano se inyectó en la vena yugular del ratón para asegurar la absorción inmediata y completa del colorante. Si es necesario en el protocolo experimental acceso continuo a la arteria carótida o la vena yugular, la implantación quirúrgica de un catéter tunelizado por vía subcutánea se puede realizar.El cubreobjetos se debe aplicar cuidadosamente, sin ninguna presión adicional (paso 4.5). De lo contrario, el flujo sanguíneo en todo el oído es más lento debido a la compresión de los vasos basales, lo que podría disminuir los tiempos de oclusión durante la inducción de trombos. La colocación precisa deel cubreobjetos se puede verificar con el microscopio estereoscópico. Las vénulas tienen que ser continuamente lleno, especialmente en los bordes del cubreobjetos. El cubreobjetos se debe utilizar para garantizar el contacto de la gota de agua con el objetivo del microscopio de fluorescencia intravital. La inmersión tiene que ser obtenida durante toda la inducción del trombo con el fin de asegurar la epi-iluminación de la embarcación con la intensidad de luz de 100%. La mejor forma de lograr la colocación estable de la gota de agua es mediante el uso del cubreobjetos. Poner la gota sobre hidratada envoltura de plástico translúcido o directamente sobre la piel causa de drenaje del agua y la inmersión inconstante.
Importancia y limitaciones del lóbulo de la oreja de la HR sin pelo SKH1 Hr-Ratón
El hr ratón sin pelo SKH1-Hr permite la formación de imágenes funcional directa de los vasos en el lóbulo de la oreja usando microscopía intravital 2, 4, 5. La histología de la oreja se asemeja a la anatomía de la piel humana 2. Toda la red microvascular, que consiste en vénulas, arteriolas, y capilares hasta 100 micras de diámetro, pueden ser visualizados y examinados en tiempo real. Esto hace que la oreja de los ratones sin pelo un modelo adecuado para el estudio de la cicatrización de heridas 6, 7, solapas axial-patrón 2, 5, fugas macromolecular 5, y el trombo microvascular formación 8, 9, 10. La disponibilidad de buques de hasta 100 m de diámetro es un límite para el modelo. tensión de cizallamiento, el flujo de sangre, y la arquitectura recipiente difieren en los vasos pequeños y grandes. Por lo tanto, los modelos como la arteria carótida o los vasos femorales pueden ser más adecuados para estudios centrados en la formación de trombos macrovascular.
Todos los modelos alternativos de visualización intravital de la microcirculación, tales como la mejilla del hámster 11, la cámara dorsal del pliegue cutáneo del ratón 12, 13, o el músculo cremáster de la rata 9, 10 requieren una preparación quirúrgica. Los vasos de la oreja del ratón sin pelo son accesibles sin cualquier riesgo de daño a los tejidos por la cirugía, así que no hay influencia en los parámetros de medición por la inflamación, la vasoconstricción, y la activación de la hemostasia en el lóbulo de la oreja del ratón sin pelo 14. A pesar de que hay una preparación quirúrgica es necesario, la resolución y la claridad son comparables a otros modelos (por ejemplo, la cámara dorsal del pliegue cutáneo y preparación cremáster). Con el fin de lograr una alta calidad de imagen, el protocolo debe ser seguido a fondo, y los ratones jóvenes con menos cornificación de tdermis que tiene que ser utilizado.
Debido a su localización superficial, los vasos del oído fácilmente pueden ser estudiadas mediante microscopía de fluorescencia intravital. Permiten la termorregulación en el animal a través de su ajuste del diámetro del vaso. Por lo tanto, tanto la habitación y la temperatura del cuerpo tienen que ser estandarizado para lograr resultados reproducibles. Todos los buques lóbulo de la oreja representan vasos periféricos en el tejido dérmico. En comparación con los vasos centrales, vasos periféricos se caracterizan por diferentes estructuras histológicas y la expresión del receptor. Por lo tanto, otros modelos (por ejemplo, la preparación de vénulas mesentéricas y arteriolas) puede ser más razonable para el examen de las cuestiones específicas relativas vasos centrales.
Otra limitación del modelo descrito es la restricción asociada con el uso de ratones sin pelo hr SKH1-HR, que no son tan comunes como otras cepas de ratón. Por lo tanto, la cría de los ratones sin pelo transgénico puede ser la mano de obrapagarés y costoso. Química y la depilación mecánica puede causar la inflamación local y no elimina la raíz del cabello, lo que puede afectar la calidad de visualización. Como buena calidad de visualización y baja distancia entre la superficie y el vaso diana es crucial para la inducción de trombos fiable; otros modelos (por ejemplo, la cámara de pliegue cutáneo dorsal) del ratón pueden ser más adecuados para los estudios que requieren ciertas cepas de ratón con la piel. Por otro lado, el modelo lóbulo de la oreja permite la simulación de diversas condiciones patológicas. Por ejemplo, la microcirculación en el tejido perfundido críticamente puede ser examinada después de la ligadura de dos de los tres haces neurovasculares 15. Análisis de la microcirculación durante la cicatrización de heridas es otro ejemplo adecuado para el uso de la oreja del modelo de ratón sin pelo 16.
Para algunas preguntas experimentales, es importante examinar el mismo animal en diferentes momentos a ASSEss la secuencia de tiempo de un tratamiento. En el estudio experimental publicado recientemente, la inducción de trombos en la oreja izquierda no fue alterada por el tratamiento previo de la oreja derecha 3. Por lo tanto, otra ventaja del modelo es la posibilidad de inducción de trombos en cada oído del mismo ratón en dos puntos de tiempo diferentes. En cuanto a la protección animal, el procedimiento experimental es mínimamente invasivo para los animales, y los ratones no tienen que recuperarse de la cirugía o llevar una cámara dorsal del pliegue cutáneo entre los experimentos. En cada animal, al menos cinco recipientes apropiados por mazorca pueden ser ocluidos por inducción trombo fototóxico, tanto los datos pueden ser recogidos con un pequeño número de animales.
Importancia y limitaciones de Microscopia intravital y trombo Inducción
Microscopía de fluorescencia intravital permite la visualización de la microcirculación en tiempo real 5. Después de la administración iv, FITC-dextran tiñe el plasma sanguíneo. Se permite la observación del crecimiento de trombos desde el principio de la inducción hasta que la oclusión del vaso completo. Los glóbulos blancos y rojos pueden ser identificados como lagunas en el medio de contraste. Para investigaciones adicionales (por ejemplo, las interacciones de granulocitos-endotelio), las células blancas de la sangre se pueden teñir con rodamina-6G.
El análisis de grabación y fuera de línea del experimento permite la medición in vivo de la velocidad de glóbulos rojos, la vasomoción arteriolar, la densidad capilar, y el diámetro microvascular. Estos parámetros desempeñan un papel importante en la formación de trombos, la perfusión del colgajo, y la cicatrización de heridas. Observación por microscopia intravital puede cuantificar directa y continuamente estos parámetros de perfusión dinámicas y su alteración durante el experimento 5. Otras técnicas, como lavado xenón, los niveles de oxígeno del tejido, Doppler láser, o difusión de colorante, también son mínimamente invasivo, pero que están restringidas por tél medición indirecta del flujo sanguíneo. Esto puede afectar a la validez de los resultados experimentales. Por lo tanto, se prefieren los métodos directos.
La reacción del colorante fluorescente y la luz de una determinada longitud de onda en los resultados de la liberación de especies reactivas de oxígeno, que dañan localmente el endotelio 17. El tiempo de exposición de las partículas de la sangre fluidez es 1,000x menor en comparación con el endotelio. Por lo tanto, el efecto trombogénico es primario, debido a una lesión endotelial fototóxico y no debido a la activación de plaquetas fototóxico directa 18. Las plaquetas se activan a través del contacto a la matriz subendotelial expuesta y forman un tapón de plaquetas 19 (Figura 3). Este mecanismo de trombogénesis juega un papel destacado en muchas situaciones, tales como angina de pecho inestable y anastomosis vascular.
Light / colorante trombo inducción es menos invasiva que la altmétodos ernative de crear lesiones endoteliales a través de catéter de balón 20, la corriente eléctrica 21, el láser 22, o inflamación 19. inducción del trombo con la luz / colorante también actúa estrictamente a nivel local en el haz de luz del objetivo. Por lo tanto, los vasos vecinos no están directamente afectados y pueden utilizarse para la posterior inducción de trombos. colorante trombo inducción / luz se puede realizar en ambos vénulas y arteriolas. En el presente estudio, las vénulas se trataron exclusivamente porque epi-iluminación de las arteriolas puede causar vasoespasmo, lo que podría afectar a la oclusión veces 19.
La anestesia se realizó mediante la combinación de xilazina y ketamina, que se establece en la medicina veterinaria y experimental. Los fármacos se inyectaron ip. Con la dosis mencionada anteriormente, la anestesia suficientes con la tolerancia de la cirugía para 30 min y dormir durante 1,5 - 2 h se logró.
El oído del ratón sin pelo HR SKH1-Hr está bien establecida en la cicatrización de heridas y la investigación solapa. Varios estudios han utilizado con éxito el modelo para la inducción de trombos y la trombólisis 3, 23, 24, 25, 26. Si el protocolo se realiza correctamente, la microscopía intravital en el lóbulo de la oreja del ratón sin pelo HR SKH1-Hr es una herramienta fiable, fácil y eficiente para el estudio de la formación de trombos y la microcirculación. Es simple para simular varias condiciones patológicas, mientras que el modelo ofrece un excelente entorno experimental para evaluar los parámetros cruciales de la microcirculación in vivo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores no tienen reconocimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| SKH-1/hr mice | Charles River | 477 | can be purchased from other vendors |
| standard laboratory food | ssniff Spezialdiaeten | V1594-0 | can be purchased from other vendors |
| operation stereomicroscope | Leica | M651/M655 | can be purchased from other vendors |
| intravital microscope | Zeiss | Axiotech Vario 100 | can be purchased from other vendors |
| objective (20X/0.95) | Zeiss | 20x/0,50 W; Plan-NEOFLUAR | can be purchased from other vendors |
| objective (63X/0.95) | Zeiss | 63x/0,95 W; ACHROPLAN | can be purchased from other vendors |
| black and white CCD-camera | Pieper | FK 6990 IQ-S | can be purchased from other vendors |
| DVD-recorder | Panasonic | DMR-EX99V | can be purchased from other vendors |
| sodium chloride | Braun | 5/12612055/1011 | can be purchased from other vendors |
| Ketamine 10% | Bela pharm | F3901-6 | can be purchased from other vendors |
| Xylazine 2% | Bayer | 6293841.00.00 | can be purchased from other vendors |
| FITC-dextran 5% | Sigma | 46945-100MG-F | can be purchased from other vendors |
| dexapanthenol 5% eye ointment | Bayer | 6029009.00.00 | can be purchased from other vendors |
| formaldehyde 4% | Sigma | HT501128-4L | can be purchased from other vendors |
| DMSO | Sigma | 472301 | can be purchased from other vendors |
| coverslips 5 x 5 x 1 mm | Menzel | L4339 | can be purchased from other vendors |
| Adhesive strips | Leukosilk | 4683400 | can be purchased from other vendors |
| centrifuge | Beckman Coulter | CLGS 15 | can be purchased from other vendors |
| hematology analyzer | Sysmex | KX-21 A6980 | can be purchased from other vendors |
| EDTA-blood tube | Sarstedt | 201,341 | can be purchased from other vendors |
| cotton swabs | Sanyo | 604-A-1 | can be purchased from other vendors |
| infrared light | Beurer | 5/13855 | can be purchased from other vendors |
| single use synringe | Braun | 2020-08 | can be purchased from other vendors |
| insulin syringe | Braun | 9161502 | can be purchased from other vendors |
| disposable hypodermic needles | Braun | 465 7640 | can be purchased from other vendors |
| end-to-end capillary | Sarstedt | 19,447 | can be purchased from other vendors |
| heating plate | Klaus Effenberg | OP-T 185/03 | can be purchased from other vendors |
| scissors 14.5 cm | Aesculap | BC259R | can be purchased from other vendors |
| needle Holder | Aesculap | BM081R | can be purchased from other vendors |
| microforceps | Aesculap | BD331R | can be purchased from other vendors |
| microscissors | Aesculap | OC496R | can be purchased from other vendors |
| scalpel 21 | Dahlhausen | 11.000.00.511 | can be purchased from other vendors |
| Prolene 7-0 | Ethicon | XNEH7470 | can be purchased from other vendors |
| Prolene 6-0 | Ethicon | XN8706.P33 | can be purchased from other vendors |
| electrocautery | Servoprax | H40140 | can be purchased from other vendors |
| acrylglass pad | integrated heating, 0.5 cm high plane |
Referencias
- White, R. H. The epidemiology of venous thromboembolism. Circulation. 107 (23), I4-I18 (2003).
- Benavides, F., Oberyszyn, T. M., VanBuskirk, A. M., Reeve, V. E., Kusewitt, D. F. The hairless mouse in skin research. J Dermatol Sci. 53 (1), 10-18 (2009).
- Grambow, E., Strüder, D., Klar, E., Hinz, B., Vollmar, B. Differential effects of endogenous, phyto and synthetic cannabinoids on thrombogenesis and platelet activity. Biofactors. , (2016).
- Eriksson, E., Boykin, J. V., Pittman, R. N. Method for in vivo microscopy of the cutaneous microcirculation of the hairless mouse ear. Microvasc Res. 19 (3), 374-379 (1980).
- Barker, J. H., et al. The hairless mouse ear for in vivo studies of skin microcirculation. Plast Reconstr Surg. 83 (6), 948-959 (1989).
- Goertz, O., et al. Evaluation of a novel polihexanide-preserved wound covering gel on dermal wound healing. Eur Surg Res. 44 (1), 23-29 (2010).
- Goertz, O., et al. Determination of microcirculatory changes and angiogenesis in a model of frostbite injury in vivo. J Surg Res. 168 (1), 155-161 (2011).
- Roesken, F., et al. A new model for quantitative in vivo microscopic analysis of thrombus formation and vascular recanalisation: the ear of the hairless (hr/hr) mouse. Thromb Haemost. 78 (5), 1408-1414 (1997).
- Sorg, H., et al. Antithrombin is as effective as heparin and hirudin to prevent formation of microvascular thrombosis in a murine model. Thromb Haemos. 96 (3), 371-377 (2006).
- Sorg, H., et al. Efficacy of antithrombin in the prevention of microvascular thrombosis during endotoxemia: an intravital microscopic study. Thromb Res. 121 (2), 241-248 (2007).
- Kovács, I. B., Sebes, A., Trombitás, K., Csalay, L., Görög, P. Proceedings: Improved technique to produce endothelial injury by laser beam without direct damage of blood cells. Thromb Diath Haemorrh. 34 (1), 331(1975).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. Eur Cell Mat. 20 (22), 147-167 (2011).
- Grambow, E., et al. Effect of the hydrogen sulfide donor GYY4137 on platelet activation and microvascular thrombus formation in mice. Platelets. 25 (3), 166-174 (2014).
- Fiebig, E., Ley, K., Arfors, K. E. Rapid leukocyte accumulation by spontaneous rolling and adhesion in the exteriorized rabbit mesentery. Int J Microcirc Clin Exp. 10 (2), 127-144 (1991).
- Harder, Y., et al. Gender-specific ischemic tissue tolerance in critically perfused skin. Langenbecks. Arch Surg. 395 (1), 33-40 (2010).
- Langer, S., et al. Effect of polyvinylpyrrolidone-iodine liposomal hydrogel on wound microcirculation in SKH1-hr hairless mice. Eur Surg Res. 38 (1), 27-34 (2006).
- Saniabadi, A. R., Umemura, K., Matsumoto, N., Sakuma, S., Nakashima, M. Vessel wall injury and arterial thrombosis induced by a photochemical reaction. Thromb Haemost. 73 (5), 868-872 (1995).
- Herrmann, K. S., et al. Platelet aggregation induced in the hamster cheek pouch by a photochemical process with excited fluorescein isothiocyanate-dextran. Microvasc Res. 26 (2), 238-249 (1983).
- Rumbaut, R. E., Slaff, D. W., Burns, A. R. Microvascular thrombosis models in venules and arterioles in vivo. Microcirculation. 12 (3), 259-274 (2005).
- Lee, W. M., Lee, K. T. Advanced coronary atherosclerosis in swine produced by combination of balloon-catheter injury and cholesterol feeding. Exp Mol Pathol. 23 (3), 491-499 (1975).
- Callahan, A. B., Lutz, B. R., Fulton, G. P., Degelman, J. Smooth muscle and thrombus thresholds to unipolar stimulation of small blood vessels. Angiology. 11, 35-39 (1960).
- Rosen, E. D., et al. Laser-induced noninvasive vascular injury models in mice generate platelet- and coagulation-dependent thrombi. Am J Pathol. 158 (5), 1613-1622 (2001).
- Agero, U., et al. Effect of mutalysin II on vascular recanalization after thrombosis induction in the ear of the hairless mice model. Toxicon. 50 (5), 698-706 (2007).
- Menger, M. D., Rösken, M., Rücker, M., Seiffge, D., Vollmar, B. Antithrombotic and thrombolytic effectiveness of rhirudin in microvessels. Langenbecks Arch Chir. 115 (1), 19-20 (1998).
- Bilheiro, R. P., et al. The thrombolytic action of a proteolytic fraction (P1G10) from Carica candamarcensis. Thromb Res. 131 (4), 175-182 (2013).
- Kram, L., Grambow, E., Mueller-Graf, F., Sorg, H., Vollmar, B. The anti-thrombotic effect of hydrogen sulfide is partly mediated by an upregulation of nitric oxide synthases. Thromb Res. 132 (2), 112-117 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados