Method Article
Nuevo enfoque para la grabación simultánea de la actividad nerviosa simpática Renal y presión arterial con la infusión intravenosa en consciente, libre de ratones.
En este artículo
Resumen
Ratones anestesiados exhiben la presión arterial sistémica no fisiológico, que impide una evaluación significativa del tono autonómico, dada la íntima relación entre la presión arterial y el sistema nervioso autónomo. Así, se describe un método novedoso para la actividad del nervio simpático renal al mismo tiempo récord y la presión arterial con la infusión intravenosa en ratones conscientes.
Resumen
Los nervios simpáticos renales contribuyen significativamente a los fenómenos fisiológicos y patofisiológicos. Evaluación de la actividad nerviosa simpática renal (RSNA) es de gran interés en muchas áreas de investigación tales como la enfermedad renal crónica, hipertensión, insuficiencia cardíaca, diabetes y obesidad. Evaluación inequívoca del papel del sistema nervioso simpático así es imprescindible para la correcta interpretación de resultados experimentales y la comprensión de procesos de la enfermedad. RSNA ha sido tradicionalmente medida en roedores anestesiados, incluyendo ratones. Sin embargo, ratones generalmente exhiben muy baja la presión arterial sistémica e inestabilidad hemodinámica durante varias horas durante la anestesia y la cirugía. Interpretación significativa de RSNA es confundido por esta situación no fisiológica, dada la íntima relación entre tono nervioso simpático y el estado cardiovascular. Para hacer frente a esta limitación de los enfoques tradicionales, hemos desarrollado un nuevo método para medir la RSNA en ratones conscientes, moviéndose libremente. Ratones fueron crónicamente instrumentados con radio telemetría para monitoreo continuo de presión arterial, así como un catéter de infusión venosa yugular y electrodo bipolar diseñado para la grabación directa de RSNA. Después de un período de recuperación de 48-72 horas, la tasa de supervivencia fue del 100% y todos los ratones se comportaban normalmente. En este momento, RSNA se registró con éxito en el 80% de los ratones, con las señales viables adquiridas hasta 4 y 5 días post-cirugía en 70% y el 50% de los ratones, respectivamente. Fisiológica presión arterial se registraron en todos los ratones (116±2 mmHg; n = 10). RSNA registrado aumentó con comer y aseo personal, tan bien establecido en la literatura. Además, RSNA fue validado por bloqueo ganglionar y la modulación de la presión arterial con agentes farmacológicos. En este documento, se describe un método eficaz y manejable para registro claro de RSNA en ratones conscientes, moviéndose libremente.
Introducción
Interés en el uso de ratones en varias áreas de la investigación biomédica continúan expandiéndose con el desarrollo de innumerables modelos genéticamente. En su mayor parte, avances técnicos han mantenido a la par con el aumento del uso de ratones en fisiología y ahora es una impresionante selección de dispositivos miniaturizados desarrollado específicamente para la medición de parámetros fisiológicos importantes en ratones. Aunque dispositivos telemétricos para dirigen medidas de autonómica tono nervioso en ratas conscientes han estado disponibles por más de una década, dispositivos miniaturizados para la evaluación de la actividad nerviosa en ratones conscientes no están disponibles actualmente. Los investigadores suelen eluden esta limitación mediante la evaluación de la contribución del sistema nervioso autónomo con métodos indirectos (es decir, catecolaminas en plasma u orina, farmacológica bloqueo autonómico, análisis espectral de los patrones de sangre presión/pulso)1.
Mientras que estos métodos proporcionan información valiosa, el resultado es una imagen global del tono autonómico en general, en lugar de revelar la discreta contribución de las poblaciones aisladas de los nervios para el fenómeno bajo investigación. También puede grabar directamente de la actividad de nervios específicos ha sido ejecutado en ratones anestesiados, que plantea una multitud de preocupaciones. Es sumamente difícil mantener estable la presión arterial dentro del rango fisiológico en un ratón anestesiado durante varias horas después de la cirugía. De hecho, en estos tipos de experimentos, la presión arterial es a menudo no denunciada o presentada en niveles extremadamente bajos (es decir, 60-80 mmHg vs > 100mmHg en un ratón consciente)2. La fragilidad del sistema cardiovascular en una preparación de ratón anestesiado a menudo excluye la evaluación significativa de la actividad del sistema nervioso autónomo, dada la relación codependiente entre presión arterial y el tono simpático3, 4.
Para hacer frente a esta limitación, un nuevo método para grabar directamente de la actividad nerviosa simpática renal (RSNA) en consciente, ratones desenfrenados, imperturbados dentro de sus jaulas hogar fue desarrollado. Tanto el enfoque experimental y quirúrgico para la exitosa implementación de esta técnica se describe en detalle. Esta preparación permite que el investigador registrar simultáneamente la presión arterial mediante radiotelemetría además de RSNA, con la capacidad añadida a infundir por vía intravenosa agentes de interés sin molestar el ratón.
Veinticuatro horas después de la cirugía, ratones se comportan normalmente y no presentan signos de dolor o angustia. Grabaciones experimentales pueden inicia la cirugía después de 48 a 72 horas mientras el ratón descansa cómodamente en su casa jaula con acceso ilimitado a alimentos, agua y enriquecimiento ambiental. Se presentan claras huellas RSNA y las respuestas características de esta población del nervio normales movimientos físicos del animal (por ejemplo, comer y aseo personal) se demuestran además de modulación farmacológica de la presión arterial sistémica. La calidad y la especificidad de la señal RSNA está más validado por bloqueo ganglionar. Este manuscrito incluye el complemento audiovisual a una descripción publicado al principio de esta técnica5.
Protocolo
Todos los procedimientos experimentales están de acuerdo con los institutos nacionales de salud guía para el cuidado y uso de animales de laboratorio y fueron aprobados por el cuidado institucional del Animal y uso de la Universidad de Mississippi Medical Center.
1. animales y vivienda
- Ratones de la casa (24-35 g) a su llegada a las instalaciones de animales de laboratorio institucional.
- Ofrecer ratones estándar chow roedor y agua ad libitum en todas las etapas del protocolo experimental en un ambiente controlado de temperatura y humedad.
2. modificado para requisitos particulares fabricación del electrodo Implantable RSNA
Nota: Construir el electrodo implantable de RSNA al menos unos días antes del procedimiento quirúrgico programado para curado y tiempo de esterilización (descrito a continuación).
- Cortar tres tiras iguales aislado inoxidable múltiple trenzado del alambre de acero, 250 mm (diámetro de alambre desnudo 0,0254 mm, 0,14 mm recubierto). Utilice una hoja de bisturí (preferiblemente #11) a aproximadamente 15 mm del material aislante para exponer el metal subyacente de un extremo de cada una de las longitudes de cable de la tira.
- La soldadura de un solo hombre conector (latón con la galjanoplastia de oro) para el extremo desnudo de sólo dos de los cables para crear cables de los electrodos bipolares (Figura 1A). Deje el final de la tercera longitud de alambre. Esto funcionará como el cable de tierra.
- Deslice un corto (~2.0 - 2,5 cm) pieza de tubería de encogimiento de calor de diámetro de 1,6 mm sobre el conector y el cable para cubrir completamente la articulación recién soldada entre el conector del cable y el pin.
Nota: La punta del conector que va conectado en el amplificador headstage debe permanecer expuesta. - Mantenga el cable por encima de una pistola de aire caliente con un par de pequeñas pinzas o pinzas hemostáticas que encoja el tubo sensible al calor y aislar eléctricamente la conexión entre el conector y el cable. Repita para el segundo cable/conector.
- Corte una longitud de 200 mm de tubería de polietileno (PE 90; diámetro interior 0,86 mm, diámetro externo 1,27 mm). Grupo los tres cables (dos plomos + cable de tierra) e introducir los extremos sin tocar en la tubería de PE 90, les enhebrado juntos a través de que el extremo abierto del tubo (Figura 1B).
Nota: El PE 90 tubería funciones como una envoltura para agrupar y proteger el electrodo lleva y alambre de tierra.- Identificar el cable de tierra y tire de ella a través de la vaina de PE 90 un poco más para distinguirla de los cables de los electrodos bipolares.
3. construcción de la punta del electrodo
- Visualizar los extremos sin tocar los cables de electrodo con un microscopio de disección. Enrosque los tres cabos sueltos del electrodo a través de un pedazo largo de 5 m m - de pequeños tubos de polietileno (PE 10, diámetro interno 0,28 mm, diámetro externo mm 0,61) que unen los cables del electrodo.
- Hilo una pieza de 1,5 mm de este tubo 10 PE en los cables de tres electrodos. Avanzar en esta tubería a 2,0 mm de la pieza inicial de 5 mm de 10 PE.
- Pase una segunda pieza de 1,5 mm de tubería de 10 PE en las puntas de los dos cables de electrodo bipolar para cubrir y aislar las puntas y separarlas del cable de tierra (Figura 1).
- Corte cualquier exceso de longitud de los cables con tijeras.
- Pegue los pedazos individuales del PE 10 tubo con los cables del electrodo con una pequeña gota de pegamento del cianocrilato de fórmula líquida. Coloque una aguja de 25 calibre blunted en el extremo del tubo de pegamento para mejorar el control y reducir derrames.
- Coloque la punta de la aguja en el cruce de la PE 10 y alambre, y dispense una pequeña gota de pegamento y visualizar el interior de la tubería de PE del pegamento.
- Deje que el pegamento se curan completamente durante la noche.
4. buena preparación de la punta del electrodo para la grabación
- Tira la capa aislante de las puntas del electrodo bipolar y la punta del cable de conexión con una hoja de bisturí #11. No molestar o dañar el subyacente alambres trenzados múltiples como esto afectará la calidad de la señal de la RSNA.
- Agarre el electrodo construido entre el 5,0 mm y 1,5 mm PE 10 anclajes con curva pinzas y doblar los alambres para formar un ángulo de 90° (Figura 1).
Nota: Esta maniobra debe colocar los cables de electrodo bipolar sobre el cable a tierra, en una posición óptima para el paquete del nervio de la horquilla.
5. construcción del anclaje Pedestal
- Construir un pedestal para estabilizar el electrodo lleva a la región escapular medio del ratón sobre exteriorización cortando un trozo de 3 cm de la tubería de polietileno (diámetro interno 2,70 mm, diámetro exterior 4.00 mm).
- Sujete el tubo con unas pinzas y fundir un extremo sobre una pistola de calor. Presione el extremo caliente del tubo perpendicular a una superficie metálica fría para crear un borde redondeado o "brida".
- Enrosque este pedestal en el electrodo construido, tal que la brida esté orientada hacia la punta del electrodo.
Nota: La combinación de la vaina de PE 90 y pedestal protege los cables de los electrodos una vez exteriorizados del animal.
6. esterilización del electrodo Implantable terminado
- Paquete electrodo terminado individualmente en bolsas de esterilización y ozono esterilizar (TSO3) antes de la implantación.
Nota: Consulte con el servicio de esterilización hospital local con respecto a determinado tipo de procedimiento y bolsa de esterilización como esto difiere entre las instituciones.
7. anestesia y preparación para la cirugía
- Administrar analgesia 20 minutos previos al inicio de la cirugía (2 mg/kg de meloxicam, S.C.). Coloque el ratón en una cámara de inducción con oxígeno de grado médico 100%. Ajuste para aumentar el porcentaje de anestésico en incrementos de 0.5 a 4% de isoflurano vaporizador. Evaluar el plano quirúrgico mediante la evaluación de la respuesta refleja a la presión suave sobre los dedos de los pies o cojines del pie delantero y trasero de los miembros así como disminución de la frecuencia respiratoria.
- Traslado del animal a la mesa quirúrgica y mantener la anestesia con isoflurano de 1.5 a 2% mediante una espiga una vez que ha alcanzado el plano quirúrgico y no exhibe el reflejo del pellizco del dedo del pie. Repetir periódicamente la respuesta del pellizco del dedo del pie y evaluar la frecuencia respiratoria a lo largo de todo el procedimiento quirúrgico. Aplique ungüento oftálmico para ojos para evitar la sequedad.
- Mantener la temperatura normal del cuerpo de los animales en todo momento con cojines rellenos de gel de calor isotérmica y mesa quirúrgica correspondiente. Almacenar cojines isotermos en un baño de agua de 37° C y reemplazar almohadillas tan a menudo como sea necesario durante la cirugía para mantener la temperatura corporal fisiológica.
- Administrar el glicopirrolato (50-70 μg/kg, por vía subcutánea (S.C.)) para evitar la producción excesiva de secreciones de las vías respiratorias inmediatamente después de la inducción de la anestesia. Administrar esta dosis del glycopyrrolate una segunda vez en el punto medio de la intervención quirúrgica (paso 9.1).
- Llevar a cabo todos los procedimientos quirúrgicos en condiciones asépticas. Asegúrese de que todas las herramientas quirúrgicas han sido esterilizadas antes de la cirugía programada. Limpiar el campo quirúrgico como se describe a continuación (7.2.1) y mantener la esterilidad durante el procedimiento.
- Use una mascarilla, bata de aislamiento esterilizada y guantes estériles, de un solo uso. Limpie todos los grandes equipos como lámpara de cuello de cisne, disección alcance y mesa quirúrgica con etanol al 70%. Periódicamente durante el procedimiento, aplicar etanol al 70% a los guantes quirúrgicos para garantizar la esterilidad.
- Quitar el pelo del flanco izquierdo del animal, región ventral del cuello y región dorsal midscapular con cortar el pelo de animal pequeño seguido por crema depilatoria (fórmula de piel sensible).
- Limpiar la piel de estos dos campos quirúrgicos con 3 alternar aplicaciones de solución de limpieza quirúrgico (10% povidona yodada) y etanol al 70%. Preparar el campo quirúrgico con una aplicación final de la solución de limpieza quirúrgica.
8. cirugía implantación del electrodo RSNA
- Coloque el ratón sobre su lado derecho con el extremo rostral señalando a la izquierda del cirujano, exponiendo el flanco izquierdo del animal. Haga una incisión de 5 mm en la piel de la región midscapular con un bisturí (#11).
Nota: Este es el sitio en el cual los cables de los electrodos RSNA se ser exteriorizados.- Hacer una segunda incisión (< 20 mm) en la piel que cubría el flanco izquierdo, perpendicular a la espina dorsal y 2 mm de caudal a la caja torácica. Una aguja de acero inoxidable de 13G por vía subcutánea de esta incisión a la incisión en el dorsal de la salida del túnel.
Nota: Presentar los filos de la aguja para dejar un suave borde no cortante. - Pasar el electrodo implantable esterilizado de RSNA (pasos 2 - 6) a través de la aguja de 13G. Tire la aguja 13G para dejar la punta del electrodo en el músculo abdominal en el flanco izquierdo. Deja un segmento de los cables de los electrodos de mentira debajo de la piel y deja las longitudes restantes salen de la incisión dorsal.
- Hacer una segunda incisión (< 20 mm) en la piel que cubría el flanco izquierdo, perpendicular a la espina dorsal y 2 mm de caudal a la caja torácica. Una aguja de acero inoxidable de 13G por vía subcutánea de esta incisión a la incisión en el dorsal de la salida del túnel.
- Coloque la punta del electrodo al lado. Hacer una incisión en el músculo abdominal subyacente directamente la incisión de piel en 8.1.1. Separar la grasa y tejido conectivo en el músculo de la espalda con pequeños aplicadores con punta de algodón para exponer el riñón izquierdo.
- Abrir el campo quirúrgico con micro-retractores y retraiga el riñón. No para estirar el paquete neurovascular renal, que irreversiblemente dañar los nervios renales e impide la grabación de una señal RSNA viable.
Nota: Micro-retractores de acero pueden ser modelados de un clip de papel estándar y una longitud de seda 4-0. Asegúrese de que estos separadores también se esterilizan con los instrumentos quirúrgicos con el fin de preservar la técnica aséptica.
- Abrir el campo quirúrgico con micro-retractores y retraiga el riñón. No para estirar el paquete neurovascular renal, que irreversiblemente dañar los nervios renales e impide la grabación de una señal RSNA viable.
- Visualizar el paquete neurovascular renal con la ayuda de un microscopio de disección de alta potencia. Identificar el paquete del nervio renal, que normalmente (pero no siempre) funciona junto a la arteria renal y la vena. Diseccionar el paquete del nervio de los tejidos circundantes con pinzas finas y rectas.
Nota: El paquete del nervio renal aparece opaco, con una "cuerda" reflexiva apariencia, única en comparación con los vasos linfáticos, que aparecen claro.- Manipular el paquete del nervio lo menos posible. No toque, estiramiento o recoger el paquete del nervio en cualquier momento. No rompen los finos vasos sanguíneos que irrigan el nervio, o el conducto linfático renal porque esto compromete la viabilidad del nervio y producir linfa continuo fluido agrupación alrededor del nervio/electrodo, que obstruya o borrar completamente la señal del nervio.
- Dejar el paquete del nervio renal intacto, que ayudará a preservar la viabilidad a largo plazo del nervio así como mantener un contacto estable entre el nervio y el electrodo (es decir, un nervio seccionado puede deslizarse fuera de electrodos con el tiempo y los movimientos naturales del cuerpo).
- Introducir la punta del electrodo RSNA en el abdomen. Ajustar su posición tal que el alambre electrodo bipolar punta y de la tierra es perpendicular al paquete neurovascular renal. Además ajustar la posición del electrodo que el cable de tierra tiene buen contacto con los tejidos subyacentes y el electrodo de no comprimir los vasos renales, comprometiendo la circulación renal (Figura 1).
- Levantar el paquete del nervio renal con pinzas angulares. Deslice la punta del electrodo por debajo del nervio, dejando el nervio en contacto directo con ambos cables.
- Un pequeño trozo de la película de parafina se deslizan entre los cables del nervio/bipolar y el tercer cable (tierra) (Figura 1).
Nota: Remojo esterilizar la película de parafina en etanol al 70% durante 24 horas y enjuague con solución salina fisiológica estéril antes de la implantación. - Quitar cualquier sangre o líquido alrededor del nervio/electrodo con absorbente pequeño spears como cualquier líquido a la izquierda alrededor del nervio o cables del electrodo serán impedir o extinguir la señal del nervio.
- Probar rápidamente la calidad de la señal RSNA si lo desea (programa de instalación que se describe a continuación).
Nota: Esto debe hacerse rápidamente ya que exposición al aire se seca el nervio y comprometer su viabilidad. - Aplicar un elastómero de silicona de dos componentes a la unidad del nervio/electrodo, asegurándose de que las piscinas de silicona debajo y alrededor del nervio para proporcionar aislamiento eléctrico completo (es decir, no simplemente una gota en la parte superior el nervio).
Nota: Asegúrese de que las puntas de los electrodos también están cubiertas en la silicona. El cable de tierra debe permanecer en contacto con el tejido subyacente y así elastómero no necesita piscina por debajo de este cable. Evite aplicar una cantidad innecesariamente grande de elastómero de silicona, ya que potencialmente puede impedir el flujo sanguíneo renal o desplazarse con los movimientos naturales del cuerpo con el tiempo. - Permite 1-2 minutos para el elastómero de silicona curar totalmente, luego levante con cuidado los bordes exteriores de la silicona "pegote" con pinzas y aplique una pequeña cantidad de líquido adhesivo quirúrgico fórmula.
Nota: tenga cuidado de no para aplicar una cantidad excesiva de este pegamento, ya que puede limitar la circulación o difundir al nervio y comprometer su viabilidad.
- Un pequeño trozo de la película de parafina se deslizan entre los cables del nervio/bipolar y el tercer cable (tierra) (Figura 1).
- Cerrar la incisión abdominal con suturas absorbibles, discontinuas (5-0). Cerca de la piel de manera similar con el mismo material de sutura.
9. implantación de la presión arterial Radiotelemeter
- Vuelva a colocar el ratón en su parte posterior, con el extremo rostral hacia el cirujano. Ajuste de nariz anestesia según sea necesario. Administrar la segunda dosis de glicopirrolato en este punto (véase 7.1.3).
- Hacer una incisión del midline en la piel de la región del cuello con un bisturí (#11), desde justo por debajo de la mandíbula inferior del animal y que se extiende justo por encima de la caja torácica. Separan el tejido glandular para exponer los músculos subyacentes del cuello. Exponer la arteria carótida común izquierda y separar los tejidos circundantes.
Nota: Tener mucho cuidado para no dañar el nervio vago como esto puede conducir a aumento de la mortalidad post quirúrgico.- Pasar tres pedazos de material de sutura de seda 6-0 por debajo de la arteria. Colocar una sutura rostral tan lejos como sea posible y atarla para ocluir el vaso. Coloque una segunda sutura a mitad de camino a lo largo de la longitud del vaso y atar flojo. Coloque la última sutura caudalmente posible y atar flojo.
- Retraiga la sutura más rostral y fijar a la nariz con un trozo pequeño de cinta umbilical. Retraiga la sutura más caudal con pinza micro mosquito para restringir el flujo sanguíneo en el vaso.
- Haga una pequeña incisión en la pared del vaso con una tijera fina primavera rostral como sea posible. Introducir el catéter de radiotelemeter de la presión arterial de ratón en la nave y el avance de la sutura caudal.
- Lazo de la sutura media para temporalmente estabilice el catéter, suelte la retracción caudal y avanzar el catéter 10 mm. Tie la sutura alrededor de catéter para asegurar su lugar.
- El cuerpo del telémetro a un bolsillo subcutáneo a lo largo del flanco derecho del túnel.
10. implantación y exteriorización del catéter venoso yugular
- Utilizar pequeños aplicadores con punta de algodón para exponer la vena yugular derecha. Pasar dos pedazos de material de sutura de seda 6-0 alrededor de la nave.
- Colocar una sutura rostral en la medida posible y lazo para ocluir el vaso. Coloque la segunda sutura lo más caudalmente posible y retraer suavemente para detener el flujo de sangre en el vaso.
- Utilice tijeras resorte fino para hacer una pequeña incisión en la pared del vaso como cerca de la sutura rostral como sea posible. Cateterizar la vena con tubería estirada de calor (D.E. 1,02 mm, estirada a OD 0,64 mm), que se la llena con solución salina fisiológica estéril.
Nota: Asegúrese de que la punta del catéter se corta con un bisturí para producir un bisel redondeado para evitar la perforación de los vasos. Determinar el volumen de líquido en el catéter (espacio muerto) como referencia (ver pasos abajo de 14,4 14,6).- Haga avanzar el catéter de 8 mm en la vena. Asegure el catéter atando las suturas de seda alrededor de la embarcación y catéter, así como la aplicación de una pequeña gota de pegamento de cianocrilato fórmula gel.
- Coloque el ratón sobre su lado izquierdo. Túnel del catéter intravenoso del cuello para salir en la región dorsal midscapular utilizando una aguja de acero inoxidable de 13G.
- Vuelva a colocar el ratón en su parte posterior. Cerrar la incisión en el cuello con suturas discontinuas.
- Coloque el animal en la posición propensa. Pase un pequeño botón subcutáneo en el catéter venoso. Fije el botón debajo de la piel con suturas. El resorte de acero inoxidable correspondiente del hilo de rosca sobre el catéter venoso y fijarlo con el botón de piel para proteger el catéter.
11. asegurar el electrodo exteriorizada conduce
- Asegure el pedestal de polietileno protege que el electrodo lleva al músculo subyacente con adhesivo tisular. Suturar la piel sobrepuesta sobre la brida para mayor apoyo.
12. post quirúrgico recuperación
- Aplique un ungüento antibiótico para todas las incisiones.
- Administrar medicamentos analgésicos. Administrar dosis adicionales de analgésicos según sea necesario durante el período de recuperación si el animal muestra signos de dolor o angustia.
- Coloque el ratón en una jaula metabólica con lecho de astillas de madera y papel toalla para recuperar. Monitorear continuamente al animal y no la deje desatendida hasta que recupera la conciencia y puede mantener recumbency esternal. Introducir el enriquecimiento ambiental, alimentos y agua (ad libitum) en este punto.
- Electrodo de bobina conduce fuera de la jaula hasta el tiempo del experimento.
- Coloque la jaula sobre una almohadilla de calor caliente durante las primeras 24 horas de recuperación. Conecte el resorte de acero inoxidable y catéter intravenoso a un sistema giratorio de la infusión para la infusión continua de solución salina fisiológica durante el período de recuperación (0.5 mL/hr).
- Garantizar los animales alojados individualmente en un dedicado debido a la naturaleza del catéter exteriorizado y electrodo conduce.
13. experimental configuración para registro de presión y RSNA
- Equiparse con una mesa antivibraciones superior acero inoxidable con una simple jaula de Faraday.
Nota: Esta jaula de Faraday puede ser construida con una malla de pantalla de aluminio y marco de madera. Eléctricamente a tierra la jaula de Faraday/tabla para eliminar cualquier ruido eléctrico. - Colocar un receptor de radiotelemetría de la presión arterial dentro de la jaula de Faraday.
- Conecte el receptor de radiotelemetría para el adaptador de salida de presión asociados. Conecte este adaptador a un sistema de adquisición de datos para registrar la presión arterial en línea.
- Dos conectores de perno femenino de la soldadura que son complementarios a los conectores de perno masculino de electrodo (latón con la galjanoplastia de oro) a los extremos de un vinculado, blindado PVC aisló el cable. La soldadura de los extremos opuestos de este cable emparejado para enchufes de plátano. Conecte los enchufes de plátano a una via headstage (amplificación de X 10).
- Conectar este preamplificador a un amplificador diferencial. Ajuste para amplificar la señal del nervio x10, 000. Ajustar la configuración de filtro de la siguiente manera: corte bajo, 100Hz; Corte alto, 1000 Hz.
- Coloque la jaula casera con el ratón sobre el receptor de radiotelemetría situado dentro de la jaula de Faraday 48 a 72 horas después de la cirugía. Activar la sonda de radiotelemetría para grabar las señales de la presión arterial.
Nota: Aclimate el ratón colocando la jaula casera en el programa de instalación en el transcurso de 1 semana antes de la cirugía es óptimo. - Desenrolle los cables de los electrodos y enchufe los conectores del electrodo bipolar correspondiente hembra conectores descritos anteriormente (13.4) para comenzar a grabar RSNA.
- Visualizar y grabar simultáneamente las señales de presión en línea con una computadora, mientras que la infusión de suero fisiológico o solución de interés. Grabar datos a una velocidad mínima de 2500 muestras por segundo.
14. Protocolo Experimental y validación del RSNA señal de la muestra
- Asegúrese de que los ratones son cómodos en su hogar jaula, libre con libre acceso al alimento y agua. Siga las pautas de cuidado institucional de los animales para verificar el comportamiento y apariencia normal.
- Casa de los ratones en la misma temperatura y humedad controladas sala en que RSNA grabación llevará a cabo. Asegurarse de la infusión intravenosa como se describe anteriormente.
- Permitir al menos 30 minutos de estabilización una vez que el animal se encuentra en la configuración del registro descrita antes de grabar una hora de la presión arterial inicial y los datos RSNA. Asegúrese de que el animal descanse tranquilamente durante la grabación ya que el movimiento natural se asocia con aumento del tono simpático. Nota Cuando el animal se mueve directamente en el rastro digital durante la grabación por lo que esto puede tenerse en cuenta durante el análisis.
- Prueba el baroreflejo respuesta primero lentamente inyectar un bolo de nitroprusiato de sodio (2,5 μg/g de peso corporal en un volumen de 25 μl de solución salina) en la línea de infusión. Descargue lentamente la línea con suero fisiológico de 50 μl. Asegúrese de que se elimina el espacio muerto del catéter. Registrar la presión arterial y RSNA para 2 a 5 minutos.
- Lentamente inyectar un bolo de fenilefrina (20 μg/g de peso en 25 μl de solución salina). Lavar con suero fisiológico de 50 μl. Asegúrese de que se elimina el espacio muerto del catéter. Registrar la presión arterial y RSNA durante 10 a 15 minutos.
- Verificar la naturaleza postganglionar de la señal del nervio inyectando lentamente un bolo de lo bloqueador ganglionar, hexametonio (50 μg/g de peso corporal en solución salina 25 μl) en la línea de infusión. Lavar con solución salina ~ 50 μl. Asegúrese de que se elimina el espacio muerto del catéter. Continuar grabando durante varios minutos.
- Use la actividad residual que queda después de la administración de hexametonio como una estimación del ruido de fondo para su uso en el análisis de la RSNA (descrito a continuación).
- Eutanasia el ratón con una sobredosis de isoflurano (dosis escalonada en incrementos de 0,5 hasta 5%) y continuar la grabación RSNA durante 30 minutos. Nota: La señal restante puede usarse como una estimación del ruido de fondo para el análisis de la RSNA.
15. Análisis de datos
- Uso software de adquisición de datos para analizar cruda presión de sangre y rastros RSNA.
- Integrar digitalmente y rectificación de onda completa el rastro RSNA crudo utilizando este software. Seleccione "Absoluta Integral" para la configuración integral; aplicar un decaimiento constante de tiempo de 0,1 segundos6.
- Analizar la señal integrada de RSNA (Visualiza en unidades de µV·s) para cada segmento del protocolo experimental. No cuenta los segmentos de la grabación cuando el animal pasó a estar en movimiento. Tomar al menos 3 mediciones de línea de base y porciones experimentales del experimento, respectivamente.
- Analizar la RSNA en el nivel de presión mínimo y máximo alcanzado de nitroprusiato de sodio o fenilefrina, respectivamente para evaluar la sensibilidad del barorreflejo.
- Promedio de las mediciones individuales tomadas por encima de cada parte del protocolo experimental para obtener un único valor.
- Cuantificar la respuesta RSNA calculando el cambio de porcentaje de RSNA desde el inicio, que se señala en el 100%7. Análisis estadístico completo según corresponda.
Nota: En este ejemplo, el análisis estadístico de la respuesta de RSNA fenilefrina y nitroprusiato de sodio se completó con la prueba de t del estudiante; significado fue aceptado con valores de P < 0.05.
Resultados
Siguiendo el protocolo descrito, tasa de supervivencia fue de 100% - todos los ratones instrumentados en este estudio sobrevivió y se recuperó bien tras la intervención quirúrgica. Dentro de las 24 horas de preparación quirúrgica, todos los ratones se comportó normalmente, exposición de comida típica, comportamientos exploratorios y peluquería. Animales no mostraron ningún signo de dolor o angustia en este momento. 48 horas después de la cirugía, una señal clara y verificable de la RSNA se registró en 10 de los 12 ratones. Esta señal se mantuvo en estos ratones 72 horas después de la cirugía, sin embargo una RSNA verdadera señal se registró en 7 (70%) de los ratones por día 4 y en sólo 5 ratones (50%) por cirugía posterior al día 5. Los ratones que no mostró una señal RSNA de alta calidad debido a la contaminación o ruido eléctrico por las señales del electrocardiograma todavía estaban en buena salud hasta el momento del euthanization.
Significa la presión arterial en los ratones conscientes 48 horas después de la cirugía fue de 116±2 mmHg, con un ritmo promedio correspondiente de 596±22 (n = 10). Grabación simultánea de una muestra representativa de la presión arterial y la RSNA en este tiempo demostró claramente visibles y característico rítmicos ráfagas de RSNA (Figura 2). Los incrementos típicos de RSNA con actividades normales como comer y aseo personal, directamente observado y observado por el personal, también estuvieron presentes (Figura 3). Alta calidad RSNA también registró secuencialmente en el 50% de los ratones bajo investigación hasta 5 días después de la preparación quirúrgica (Figura 4). La presión arterial y la frecuencia cardiaca se mantuvo estables durante el período de investigación de 5 días y los valores no eran diferentes de las que hemos registrado después de hasta 10 días de recuperación post quirúrgica (tabla 1)8.
Para validar la señal RSNA y verificar que en efecto es arrastrado con el barorreflejo arterial, presión arterial farmacológicamente fue manipulada con una inyección intravenosa de nitroprusiato de sodio y la fenilefrina. RSNA característico aumentó en respuesta a la reducción inducida por nitroprusiato de sodio de la presión arterial; por el contrario, RSNA fue prácticamente silenciado tras el aumento de la presión arterial (Figura 5) inducida por la fenilefrina. Cuantitativamente, nitroprusiato de sodio disminuye la presión arterial a 62±3 mmHg, que correspondió a una elevación de RSNA para 77±9% por encima de los niveles iniciales (n = 5; P < 0.05, figura 6). Del mismo modo, después de la administración de fenilefrina, presión arterial alcanzado 137±6 mmHg, que reducido RSNA 79±2% por debajo del nivel basal (n = 5; P < 0.05, figura 6). Además, RSNA fue completamente eliminada tras bloqueo ganglionar hexametonio (Figura 7), estableciendo la naturaleza post-gangliónica de la señal de la RSNA.

Figura 1: construcción y colocación del electrodo implantable del nervio simpático renal. Representación esquemática del diseño y la colocación recomendada del electrodo implantable del nervio simpático renal. (A) bipolar había equipado con conectores y un tercer cable de tierra. (B) cables están roscados a través de la tubería de 90 de polietileno (PE) para proteger los conductores exteriorizados. (C) diseño de la punta del electrodo con el fin de separar el cable de tierra de los cables bipolares. (D) Punta del electrodo es doblada en un ángulo de 90° para facilitar la posición óptima; el paquete del nervio renal se coloca perpendicular a los cables bipolares y película de cera laboratorio aísla los cables desde el cable de tierra que está en contacto con el tejido subyacente. Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.
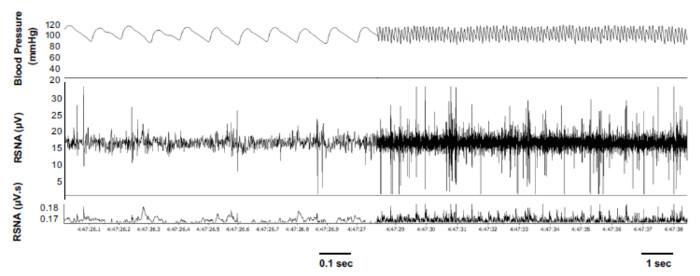
Figura 2: Representante de grabación de la presión arterial y renal simpática nerviosa actividad (RSNA). Rastro de muestra demostrando grabación simultánea de arterial la presión arterial sistémica, RSNA y RSNA integrado en un ratón consciente, tranquilo descanso 48 horas después de la preparación quirúrgica. Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Respuesta de la actividad nerviosa simpática renal (RSNA) a la actividad física normal. Representante de rastro con registro simultáneo de la presión sistémica de sangre arterial, RSNA y RSNA integrado en dos horas de ratones conscientes 48 y 72 después de la cirugía inicial y (A) al inicio de la preparación activa o (B) tranquilo comiendo. La flecha grande indica el comienzo de la actividad física del resto. Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Viabilidad de señal de actividad nerviosa simpática renal a largo plazo (RSNA). Secuenciales grabaciones representativas de la presión arterial y la RSNA en un ratón consciente, tranquilo descanso varios días después de la preparación quirúrgica. (A) 2 días, (B) 3, (C) 4 días y después de la cirugía (D) 5 días. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Arrastre de la señal de actividad (RSNA) nervio simpático renal con el barorreflejo arterial. Representante de grabación de la presión arterial y RSNA en un ratón consciente en reposo durante (A) línea de base y después la posterior administración intravenosa de nitroprusiato de sodio (B) seguido de fenilefrina (C). Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Cuantificación de la respuesta simpática renal a la presión arterial arterial. Respuesta cuantitativa de la presión arterial y actividad nerviosa simpática renal (RSNA) a manipulación farmacológica fenilefrina y nitroprusiato de sodio. (A) significa que la presión arterial al inicio del estudio (barra negra; 116±2 mmHg) y posterior administración intravenosa de nitroprusiato de sodio (barra gris; 62±3 mmHg) y fenilefrina (barra libre, 137±6 mmHg). (B) correspondiente respuesta RSNA nitroprusiato de sodio (barra gris; 77±9%) o fenilefrina (bar abierto; - 79±2%). RSNA se expresa un cambio porcentual desde el inicio, media ± SEM. * diferencia significativa desde el inicio (p < 0.05, n = 5). Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Post-gangliónica naturaleza de la actividad nerviosa simpática renal (RSNA). Representante de rastro de la presión arterial y RSNA en (A) inicial, (B) inmediatamente después de bloqueo ganglionar hexametonio y (C) post-mortem. Reproducido con permiso5. Haga clic aquí para ver una versión más grande de esta figura.
| Identificación animal | 2D | 3D | 4d | 5d | |
| A | mmHg | 112 | 110 | 108 | 109 |
| BPM | 657 | 551 | 626 | 616 | |
| B | mmHg | 115 | 107 | 111 | 110 |
| BPM | 582 | 652 | 662 | 668 | |
| C | mmHg | 115 | 118 | 113 | 111 |
| BPM | 591 | 599 | 689 | 664 | |
| D | mmHg | 114 | 115 | 116 | 110 |
| BPM | 457 | 513 | 599 | 531 | |
| E | mmHg | 109 | 109 | 103 | 105 |
| BPM | 632 | 687 | 699 | 689 |
Tabla 1: Media arterial presión y frecuencia cardiaca valores basales en ratones instrumentados más de 5 días consecutivos después de la cirugía. Reproducido con permiso5.
Discusión
Aquí hemos esbozado, demostrado y validado un nuevo método para la evaluación específica de RSNA en ratones conscientes, libres para moverse y descansar cómodamente en sus jaulas hogar. Después de la implantación quirúrgica de una radiotelemeter de la presión arterial, un catéter de infusión intravenosa permanente y un electrodo RSNA bipolar diseñado, ratones se recuperaron de la cirugía y quedaron inalterados durante 48 a 72 horas. Ratones permanecieron cómodamente asentados en su casa jaula en todo momento (incluyendo periodos experimentales) con acceso ilimitado a alimentos, agua y enriquecimiento ambiental. Toda manipulación experimental subsiguiente por el investigador era remota y desasosiego los animales. Con respecto a la calidad y la interpretación de la señal de la RSNA, este enfoque eliminado completamente las complicaciones fisiológicas indeseables e inevitables de anestesia y trauma quirúrgico, así como moderación y otras fuentes de estrés físico y mental a el animal. Por lo tanto, efectivamente se eliminaron estos graves factores de confusión que invariablemente afectan la interpretación de las mediciones de actividad comprensiva del nervio.
Todos los ratones estaban en buena salud y tan pronto como después de la cirugía 24 horas, muestran comportamientos típicos tales como brillo, actividad, respuesta, comer, beber, aseo personal, así como comportamiento lúdico y exploratorio. Todos los animales exhiben estas características y activamente con el enriquecimiento ambiental proporcionado independientemente de si fue o no una señal RSNA viable capaces de grabarse. Aunque el tiempo de recuperación necesario para completamente restaurar la presión arterial normal siguiente implantación de la sonda de radiotelemetric al parecer es como 4-7 días9, presión arterial regresa a la normalidad mucho antes, como lo demuestran los valores registrados aquí para la presión arterial y ritmo cardíaco. De hecho, estos parámetros cardiovasculares son equivalentes a ésos divulgados previamente en semejantemente instrumentados animales que fueron permitidos hasta 10 días para recuperarse de la cirugía8,10.
La opción de utilizar sondas de radiotelemetric para la medición de la presión arterial por un catéter lleno de líquido fue deliberada, ya que esto reduce la tensión en los ratones y también rinde más clara y fiable de la sangre y las señales de presión de pulso y frecuencia cardiaca valores11. Tecnología telemétrica para registrar la presión arterial representa una ventaja adicional ya que la necesidad de lavar con frecuencia y mantener que el líquido llena el catéter arterial con solución salina heparinizada, que inevitablemente le molesta el animal, se elimina completamente. Además, el enfoque quirúrgico exteriorizar, anclaje y la protección de los cables de electrodo bipolar y catéter intravenoso es ideal en comparación con otros informes que describen el almacenamiento temporal de los plomos en un bolsillo subcutáneo12, desde nuestro enfoque evita incluso breve re-anestesia y la manipulación quirúrgica del animal inmediatamente antes de la grabación experimental, que sin lugar a dudas perturban el ratón y comprometer la calidad y la interpretabilidad de exquisitamente sensible del sistema nervioso autónomo datos.
Este método produce verdaderas señales RSNA, la calidad que se demuestran por las característica estallidos de actividad eléctrica claramente distinguible del ruido de fondo en un ambiente relajado, descansando tranquilamente ratón. Además, RSNA demostró respuesta típica a la actividad física en el animal como el aseo personal y tranquila comiendo según lo divulgado en la literatura13,14. Dada la característica aumenta en RSNA con movimiento natural o vigilancia del animal, así es imperativo señalar y excluir a estos periodos de tiempo con el fin de análisis experimental y concentrarse en los segmentos de la grabación durante el cual el animal está descansando tranquilamente. Esto ayuda a prevenir la posible interpretación de los datos. Otros factores que pueden conducir a interpretaciones erróneas de datos incluyen ruido eléctrico o interferencia, así como contaminación de la señal ECG pulsos15. Movimiento excesivo de la porción exteriorizada de los cables de los electrodos también puede influir en la calidad de la señal RSNA y puede aparecer como una línea de base inestable o "vacilante". A veces estas fuentes de interferencia de señal puede apareceran espontáneamente desaparecen durante un registro perfectamente claro y deben excluirse del análisis5,15,16. Una consideración adicional es el tiempo en el cual se obtienen las grabaciones. Es importante tener en cuenta que la presión arterial y RSNA varían con el ritmo circadiano, por lo que es ideal para llevar a cabo experimentos al mismo tiempo del día para evitar este factor de confusión potencial. En este estudio, no observamos una variabilidad significativa de la presión arterial y RSNA debido a oscilaciones circadianas como grabamos todos los parámetros entre 10:00 y 18:00 - en el ciclo de la luz del día de la instalación de alojamiento de los animales. Otro componente importante de este informe es la validación de la señal de la RSNA, que como se demuestra, de hecho es arrastrada con el barorreflejo arterial. Dada la rápida reducción y elevación de RSNA en paralelo con la caída inducida farmacológicamente y aumento en la presión arterial sistémica, el barorreflejo arterial estaba ciertamente intacta - que demuestra que la implantación oclusiva de las radiotelemetría catéter en una arteria carótida no interfiere con la función cardiovascular normal. La virtual desaparición de la señal de la RSNA al bloqueo ganglionar hexametonio más confirma grabación de RSNA postganglionar.
Sería ideal para proporcionar un período de recuperación después de la cirugía para los ratones, sin embargo, nosotros y otros en este campo reconocen que mantener la viabilidad a largo plazo de nervios autónomos en animales crónicamente instrumentados, especialmente ratones, sigue siendo un reto. Aunque la calidad de la señal RSNA disminuyó en el transcurso de la cirugía después de varios días, fue posible registrar confiablemente RSNA verdadero durante al menos 3 días consecutivos en todos los ratones y hasta 5 días en aproximadamente la mitad de los animales. Este logro en sí mismo significa un gran avance en el campo de los estudios autonómicos en ratones. Además, este método maximiza el uso de los preciosos animales transgénicos, ya que es posible grabar múltiples experimental y control de ensayos en el mismo animal en diferentes días, por supuesto, lo que permite la aleatorización de la orden de ensayo y grabación de línea de base adecuada antes de cada experimento17. Es alentador ver informes de éxito de grabaciones de nervio comprensivo a largo plazo en roedores consciente18,19,20 incluyendo los avances en telemetría nervio tecnologías para ratas de grabación 15,21. La miniaturización de esta tecnología para su uso en el ratón consciente es próxima y mientras tanto, nos esforzamos para mejorar esta técnica para aumentar la longevidad de las fibras del nervio simpáticas para ampliar la ventana experimental y tal vez permitir una mayor tiempo de recuperación después de la cirugía. Sin embargo, este método seguirá siendo un alternativa/complemento útil y fácilmente accesible y asequible a la evolución futura en nervio telemétrico tecnología de grabación en los ratones, que requieren una inversión en equipo dedicado y dispositivo de regular mantenimiento.
La necesidad de técnicas confiables para evaluar la función cardiovascular y autonómica en ratones nunca ha sido tan grande, considerando el interés creciente en el ratón transgénico modelos en el campo de la investigación biomédica. Se hicieron grandes progresos en muchas áreas de la fisiología, sin embargo hay todavía mucho para ir en cuanto a la estandarización y optimización de métodos para la evaluación de la función autonómica en el ratón. Hasta la fecha, existe una medición que describe informe de actividad del nervio sensorial en el ratón consciente12. Este enfoque describe la medición de la actividad del nervio sensorial de la vejiga e implica anestesia y la manipulación quirúrgica de catéteres colocados por vía subcutánea inmediatamente antes de la grabación experimental, así como la contención física de los ratones durante el curso el protocolo experimental12. Se conocen estos factores estresores que se evitan completamente con el enfoque actual, que ciertamente puede ser adaptado para la grabación de una variedad de nervios de interés además de los nervios renales. Más recientemente, las mediciones del nervio simpático en ratones conscientes se han divulgado, sin embargo, estas mediciones se realizan en gran parte horas después de la preparación quirúrgica, sin mencionar de administración analgésica22. Aparte de estos informes, la función autonómica se ha evaluado lo contrario exclusivamente en ratones anestesiados. Una revisión exhaustiva de la literatura produce una multitud de enfoques, horas larga duración experimental, combinaciones o dosis de anestésicos, ventilación mecánica y a menudo creativas medidas para mantener los ratones en un estado que lleva algo parecido a la fisiológica (es decir, oxígeno soplado directamente hacia la nariz del animal)23,24,25,26,27,28,29, 30,31. Entre estos estudios, informes de los valores de presión arterial son ausentes o abismalmente baja - por debajo del rango fisiológico de las presiones arteriales sistémica2. Esto es problemático en muchos niveles, pero especialmente tan cuando la correcta evaluación de la función autonómica en estos animales se refiere, dado el vínculo establecido entre la presión arterial y el tono autonómico. Agentes anestésicos impactan directamente el tono simpático, con muchos informes sugiriendo que anestesia amortigua la actividad comprensiva. De hecho, evidencia demuestran uretano, el anestésico más ampliamente solicitado para aguda del nervio grabación experimentos32, dependiente de la dosis disminuye RSNA33 e inhibe el barorreflejo arterial34. Por el contrario, otros informes sugieren que uretano aumenta el tono simpático35. Concedido, este tipo de estudios suelen compara actividad experimental del nervio como un cambio de base registrado, sin embargo el estado alterado del sistema nervioso autónomo en las condiciones antes descrita sin lugar a dudas excluye la detección de cambios discretos en nervio actividad.
El reto de este método radica principalmente en la habilidad quirúrgica necesaria para la preparación exitosa del ratón para grabación consciente nervio. Sin embargo la inversión en perfeccionar estas habilidades más es compensada por la calidad y fiabilidad de los datos RSNA directos producido. Este enfoque evita totalmente las limitaciones que plantea la evaluación indirecta de control autonómico como niveles de catecolamina del plasma, que son muy lábiles en ratones y están limitados por la cantidad de sangre que puede ser humanamente recopilados36. Además, estimación de bloqueo autonómico tanto farmacológicas como nivel de catecolaminas plasma general autonómica tono1 a diferencia de las discretas aportaciones de poblaciones específicas del nervio, que generalmente son de más interés. Evaluación matemática del tono autonómico mediante análisis espectral de la energía de rastros de la presión arterial y la frecuencia cardiaca es útil para la evaluación de la función autonómica en seres humanos, sin embargo esta técnica no puede ser adaptable para ratones36,37. Por lo tanto, el muestreo directo de la actividad nerviosa en un ratón cómodo descanso, consciente es ideal cerca refleja el Estado autonómico natural, intacto de la asignatura y facilita la evaluación sofisticado de la contribución de los nervios de las fenómenos fisiológicos de interés.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
S.M.H. fue apoyado por becas postdoctorales de los institutos canadienses para investigación de la salud (CIHR), corazón & Fundación tiempos de Canada (HSFC) y Alberta Innova Health Solutions (AiHS); J.E.H. es apoyado por una donación del corazón nacional, pulmón y sangre Instituto PO1HL-51971.
Materiales
| Name | Company | Catalog Number | Comments |
| Teflon-coated stainless steel multiple stranded wire | A-M Systems | 793200 | 0.001in diameter bare; 0.0055in diameter coated |
| #11 Scalpel Blade | Fisher Scientific | ALMM9011 | |
| Soldering Iron and solder | Any make or model suitable | ||
| Male miniature pin connectors | A-M Systems | 520200 | Brass with gold plating |
| Female miniature pin connectors | A-M Systems | 520100 | Brass with gold plating |
| Heat Shrink tubing | Radio Shack | Model #: 278-1610 | Catalog #: 2781610 | 1.6 mm diameter |
| Polyethylene 90 (PE90) tubing | VWR | CA-63018-703 | 0.86mm inner diameter; 1.27mm outer diameter |
| Dissecting microscope | Leica Microsystems | Leica M80 | Any make or model also suitable |
| Polyethylene 10 (PE10) tubing | Braintree Scientific | PE10 50 FT | 0.28mm inner diameter; 0.61mm outer diameter |
| Super Glue Liquid | Loctite | n/a | Liquid Formula; any brand suitable |
| Super Glue Gel | Loctite | n/a | Gel Formula; any brand suitable |
| Polyethylene tubing | Scientific Commodities | BB31695-PE/13 | For pedestal 2.7mm inner diameter; 4.0mm outer diameter |
| Hospital Sterilization Services & Ozone Sterilization packets | Contact local hospital sterilization services | ||
| Isoflurane anesthesia | Abbott | 05260-05 | |
| Deltaphase isothermal heat pads & surgical table | Braintree Scientific | 39OP | Keep heat pads warm in a 37°C water bath; Corresponding surgical table essential |
| Glycopyrrolate | Amdipharm Mercury Company Limited | n/a | |
| Isoflurane vaporizer system & flow gauge | Braintree Scientific | VP I | Include medical grade oxygen supply |
| Tissue scissors | Fine Science Tools | 14173-12 | |
| Fine spring scissors | Fine Science Tools | 15006-09 | |
| Small cotton-tipped applicators | Fisher Scientific | 23400100 | |
| Fine Straight Forceps | Fine Science Tools | 11254-20 | #5, FST by Dumont Biologie Tip |
| Angled Forceps | Fine Science Tools | 11251-35 | #5/45 FST by Dumont |
| Small Absorbent Spears | Fine Science Tools | 18105-03 | |
| Parafilm | Sigma Aldrich | BR701605 ALDRICH | |
| Kwik-Sil 2 component Silicone Polymer | World Precision Instruments (WPI) | KWIK-SIL | Purchase extra specialized tips from WPI |
| 5-0 Polysorb Suture | Tyco Healthcare | n/a | |
| 6-0 Silk Suture | Braintree Scientific | SUT-S 104 | Deknatel brand, spool |
| Radiotelemetry Probe | Data Sciences International (DSI) | TA11-PAC10 | |
| Radiotelemetry Receiver | Data Sciences International (DSI) | PhysioTel RPC-1 | |
| Ambient Pressure Reference | Data Sciences International (DSI) | Apr-01 | |
| Pressure Output Adapter | Data Sciences International (DSI) | R11CPA | |
| Rena Pulse Tubing | Braintree Scientific | RPT-040 | |
| Infusion Swivel | Instech Solomon | 375/D/22 | |
| Swivel Support Arm & Mount | Instech Solomon | SMCLA | |
| Polysulfone button | Instech Solomon | LW62S/6 | |
| Stainless steel spring | Instech Solomon | PS62 | |
| Vetbond surgical adhesive | 3M | n/a | |
| Triple Antibiotic Ointment | Fougera | n/a | |
| PowerLab 8 Channel Data Acquisition System & Software | ADInstruments | PowerLab 8/35 | |
| PVC Insulated Cable | Belden | PVC Audio Connection Cable 32 AWG | |
| Preamplification Headstage | Dagan Corporation | Model 4002 | |
| Differential Amplifier | Dagan Corporation | EX4-400 | |
| Sodium Nitroprusside | Sigma Aldrich | 71778-25G | |
| Phenylephrine | Sigma Aldrich | P6126-5G | |
| Sterile Physiological Saline 0.9% NaCl | Beckton Dickinson | Contact local hospital supplier | |
| hexamethonium | Sigma Aldrich | H0879-5G | |
| Stainless Steel top anti vibration table | n/a | n/a | Custom designed in-house; Solid steel plate on a benchtop is also suitable |
| Faraday cage | n/a | n/a | Custom designed and constructed in-house |
| Small animal hair trimmer | n/a | n/a | Drugstore, men's beard trimmer suitable |
| Dipilatory Cream | n/a | n/a | Veet brand, sensitive skin formula |
| 10% Povidone Iodine | Purdue Products | Betadiene | |
| 70% Ethanol | n/a | n/a | |
| Steel microretractors | n/a | n/a | Made in-house. Bend a steel paper clip & loop 4-0 silk to form a retractor |
| Hemostats | Fine Science Tools | 13011-12 | |
| Heat Gun | Fisher Scientific | 09-201-27 |
Referencias
- Young, C. N., Davisson, R. L. In vivo assessment of neurocardiovascular regulation in the mouse: principles, progress, and prospects. Am J Physiol Heart Circ Physiol. 301 (3), H654-H662 (2011).
- Kass, D. A., Hare, J. M., Georgakopoulos, D. Murine cardiac function: a cautionary tail. Circ Res. 82 (4), 519-522 (1998).
- Charkoudian, N., Wallin, B. G. Sympathetic neural activity to the cardiovascular system: integrator of systemic physiology and interindividual characteristics. Compr Physiol. 4 (2), 825-850 (2014).
- Guyenet, P. G. The sympathetic control of blood pressure. Nat Rev Neurosci. 7 (5), 335-346 (2006).
- Hamza, S. M., Hall, J. E. Direct recording of renal sympathetic nerve activity in unrestrained, conscious mice. Hypertension. 60 (3), 856-864 (2012).
- DeBeck, L. D., Petersen, S. R., Jones, K. E., Stickland, M. K. Heart rate variability and muscle sympathetic nerve activity response to acute stress: the effect of breathing. Am J Physiol Regul Integr Comp Physiol. 299 (1), R80-R91 (2010).
- Krowicki, Z. K., Kapusta, D. R. Microinjection of glycine into the hypothalamic paraventricular nucleus produces diuresis, natriuresis, and inhibition of central sympathetic outflow. J Pharmacol Exp Ther. 337 (1), 247-255 (2011).
- do Carmo, J. M., et al. Control of blood pressure, appetite, and glucose by leptin in mice lacking leptin receptors in proopiomelanocortin neurons. Hypertension. 57 (5), 918-926 (2011).
- Brockway, B. P., Mills, P. A., Azar, S. H. A new method for continuous chronic measurement and recording of blood pressure, heart rate and activity in the rat via radio-telemetry. Clin Exp Hypertens A. 13 (5), 885-895 (1991).
- Tallam, L. S., Silva, da, A, A., Hall, J. E. Melanocortin-4 receptor mediates chronic cardiovascular and metabolic actions of leptin. Hypertension. 48 (1), 58-64 (2006).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J Pharmacol Toxicol Methods. 44 (2), 361-373 (2000).
- Zvara, P., et al. A non-anesthetized mouse model for recording sensory urinary bladder activity. Front Neurol. 1, 127(2010).
- Hagan, K. P., Bell, L. B., Mittelstadt, S. W., Clifford, P. S. Effect of dynamic exercise on renal sympathetic nerve activity in conscious rabbits. J Appl Physiol. 74 (5), 2099-2104 (1985).
- Matsukawa, K., Ninomiya, I. Changes in renal sympathetic nerve activity, heart rate and arterial blood pressure associated with eating in cats. J Physiol. 390, 229-242 (1987).
- Stocker, S. D., Muntzel, M. S. Recording sympathetic nerve activity chronically in rats: surgery techniques, assessment of nerve activity, and quantification. Am J Physiol Heart Circ Physiol. 305 (10), 6(2013).
- Burke, S. L., Lambert, E., Head, G. A. New approaches to quantifying sympathetic nerve activity. Curr Hypertens Rep. 13 (3), 249-257 (2011).
- Smith, F. G. Techniques for recording renal sympathetic nerve activity in awake, freely moving animals. Methods. 30 (2), 122-126 (2003).
- Miki, K., Kosho, A., Hayashida, Y. Method for continuous measurements of renal sympathetic nerve activity and cardiovascular function during exercise in rats. Exp Physiol. 87 (1), 33-39 (2002).
- Yoshimoto, M., Miki, K. Measurement of renal sympathetic nerve activity in freely moving mice. J Physiol. 560, (2004).
- Yoshimoto, M., Miki, K., Fink, G. D., King, A., Osborn, J. W. Chronic angiotensin II infusion causes differential responses in regional sympathetic nerve activity in rats. Hypertension. 55 (3), 644-651 (2010).
- Salman, I. M., Sarma Kandukuri,, Harrison, D., L, J., Hildreth, C. M., Phillips, J. K. Direct conscious telemetry recordings demonstrate increased renal sympathetic nerve activity in rats with chronic kidney disease. Front Physiol. 6, 218(2015).
- Morgan, D. A., Despas, F., Rahmouni, K. Effects of leptin on sympathetic nerve activity in conscious mice. Physiol Rep. 3 (9), (2015).
- Alfie, M. E., Sigmon, D. H., Pomposiello, S. I., Carretero, O. A. Effect of high salt intake in mutant mice lacking bradykinin-B2 receptors. Hypertension. 29 (1 Pt 2), 483-487 (1997).
- Dietz, J. R., Landon, C. S., Nazian, S. J., Vesely, D. L., Gower, W. R. Effects of cardiac hormones on arterial pressure and sodium excretion in NPRA knockout mice. Exp Biol Med (Maywood). 229 (8), 813-818 (2004).
- Zhang, W., et al. Cyclosporine A-induced hypertension involves synapsin in renal sensory nerve endings. Proc Natl Acad Sci U S A. 97 (17), 9765-9770 (2000).
- Szczesny, G., Veihelmann, A., Massberg, S., Nolte, D., Messmer, K. Long-term anaesthesia using inhalatory isoflurane in different strains of mice-the haemodynamic effects. Lab Anim. 38 (1), 64-69 (2004).
- Tank, J., et al. Sympathetic nerve traffic and circulating norepinephrine levels in RGS2-deficient mice. Auton Neurosci. 136 (1-2), 52-57 (2007).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Zuurbier, C. J., Emons, V. M., Ince, C. Hemodynamics of anesthetized ventilated mouse models: aspects of anesthetics, fluid support, and strain. Am J Physiol Heart Circ Physiol. 282 (6), H2099-H2105 (2002).
- Farnham, M. M., O'Connor, E. T., Wilson, R. J., Pilowsky, P. M. Surgical preparation of mice for recording cardiorespiratory parameters in vivo. J Neurosci Methods. 248, 41-45 (2015).
- Cuellar, J. M., Antognini, J. F., Carstens, E. An in vivo method for recording single unit activity in lumbar spinal cord in mice anesthetized with a volatile anesthetic. Brain Res Brain Res Protoc. 13 (2), 126-134 (2004).
- Carruba, M. O., Bondiolotti, G., Picotti, G. B., Catteruccia, N., Da Prada, M. Effects of diethyl ether, halothane, ketamine and urethane on sympathetic activity in the rat. Eur J Pharmacol. 134 (1), 15-24 (1987).
- Wang, G. F., Mao, X. J., Chen, Z. J. Urethane suppresses renal sympathetic nerve activity in Wistar rats. Eur Rev Med Pharmacol Sci. 18 (10), 1454-1457 (2014).
- Xu, H., et al. Effects of induced hypothermia on renal sympathetic nerve activity and baroreceptor reflex in urethane-anesthetized rabbits. Crit Care Med. 28 (12), 3854-3860 (2000).
- Shimokawa, A., Kunitake, T., Takasaki, M., Kannan, H. Differential effects of anesthetics on sympathetic nerve activity and arterial baroreceptor reflex in chronically instrumented rats. J Auton Nerv Syst. 72 (1), 46-54 (1998).
- Janssen, B. J., Smits, J. F. Autonomic control of blood pressure in mice: basic physiology and effects of genetic modification. Am J Physiol Regul Integr Comp Physiol. 282 (6), R1545-R1564 (2002).
- Nunn, N., Feetham, C. H., Martin, J., Barrett-Jolley, R., Plagge, A. Elevated blood pressure, heart rate and body temperature in mice lacking the XLalphas protein of the Gnas locus is due to increased sympathetic tone. Exp Physiol. 98 (10), 1432-1445 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados