Method Article
Neuer Ansatz zur gleichzeitigen Erfassung von renalen sympathischen Nerven-Aktivität und Blutdruck mit intravenösen Infusion in dem Bewusstsein, hemmungslose Mäuse.
In diesem Artikel
Zusammenfassung
Narkotisierten Mäuse zeigen unphysiologischen systemischen Blutdruck, die aussagekräftige Beurteilung der autonomen Ton gegeben die intime Beziehung zwischen Blutdruck und das vegetative Nervensystem ausschließt. Somit ist eine neuartige Methode zur gleichzeitig aufzeichnen renalen sympathischen Nerven-Aktivität und Blutdruck mit intravenösen Infusion in bewusste Mäuse skizziert.
Zusammenfassung
Renalen sympathische Nerven tragen wesentlich zum physiologische und pathophysiologische Phänomene. Bewertung der renalen sympathischen Nerven-Aktivität (RSNA) ist von großem Interesse in vielen Bereichen der Forschung wie chronische Nierenerkrankungen, Bluthochdruck, Herzinsuffizienz, Diabetes und Fettleibigkeit. Eindeutige Bewertung der Rolle des sympathischen Nervensystems ist daher unerlässlich für die richtige Interpretation der Versuchsergebnisse und Verständnis von Krankheitsprozessen. RSNA wurde traditionell bei anästhesierten Nagetieren, einschließlich Mäusen gemessen. Allerdings zeigen Mäuse in der Regel sehr geringen systemischen Blutdruck und hämodynamische Instabilität für mehrere Stunden während der Anästhesie und Chirurgie. Sinnvolle Interpretation der RSNA ist durch diese unphysiologischen Zustand, da die intime Beziehung zwischen nervös Sympathikotonus und Herz-Kreislauf-Status verwechselt. Um diese Einschränkung der traditionellen Ansätzen zu begegnen, haben wir eine neue Methode zur Messung der RSNA in bewusst, frei beweglichen Mäusen entwickelt. Mäuse wurden mit Radio-Entfernungsmesser für die kontinuierliche Überwachung von Blutdruck und eine Vena venöse Infusion Katheter sowie speziell angefertigte bipolare Elektrode für die direkte Aufnahme der RSNA chronisch instrumentiert. Nach einer Erholungsphase von 48-72 Stunden Überlebensrate lag bei 100 % und alle Mäuse verhielt sich normal. Zu diesem Zeitpunkt verzeichnete RSNA erfolgreich in 80 % der Mäuse, mit lebensfähigen Signale bzw. bis zu 4 und 5 Tage nach der Operation bei 70 % und 50 % der Mäuse, erworben. Physiologische Blutdrücke verzeichneten alle Mäuse (116±2 MmHg; n = 10). Aufgezeichnete RSNA erhöht mit Essen und Pflege, in der Literatur so gut eingerichtet. Darüber hinaus wurde RSNA ganglionic Blockade und Modulation des Blutdrucks mit pharmakologischer Substanzen überprüft. Hier ist eine effektive und handhabbare Methode für klare Aufnahmen der RSNA in bewusst, frei beweglichen Mäuse beschrieben.
Einleitung
Interesse an der Nutzung von Mäusen in mehreren Bereichen der biomedizinischen Forschung weiterhin mit der Entwicklung von unzähligen gentechnisch hergestellten Modelle zu erweitern. Zum größten Teil technischen Fortschritt Schritt gehalten haben, mit dem verstärkten Einsatz von Mäusen in Physiologie und es gibt jetzt eine beeindruckende Auswahl an miniaturisierten Geräten entwickelt speziell für die Messung wichtigen physiologischen Parameter bei Mäusen. Obwohl telemetrische Geräte für die direkte Messung des autonomen nervösen Ton bei der bewussten Ratte wurden für mehr als ein Jahrzehnt, miniaturisierte Geräte für die Beurteilung der Nerven-Aktivität in bewusste Mäuse sind derzeit nicht verfügbar. Ermittler in der Regel umgehen diese Einschränkung durch die Auswertung des Beitrags des vegetativen Nervensystems mit indirekten Methoden (d.h. Plasma oder Urin Katecholamine, pharmakologische Blockade autonomer und spektrale Analyse der Muster des Blutes Druck/Puls)1.
Während diese Ansätze wertvolle Informationen liefern, ist das Ergebnis ein globales Bild der gesamten autonomen Ton, anstatt enthüllt den diskreten Beitrag der isolierten Populationen von Nerven auf das Phänomen untersucht. Alternativ hat direkte Aufnahme der Aktivität von bestimmten Nerven bei narkotisierten Mäusen ausgeführt wurde, stellt eine Vielzahl von Anliegen. Es ist außerordentlich schwierig, stabilen Blutdruck im physiologischen Bereich in einem narkotisierten Maus für mehrere Stunden nach der Operation zu erhalten. In der Tat in diesen Arten von Experimenten, Blutdruck ist oft nicht gemeldete oder präsentiert auf einem extrem niedrigen Niveau (d. h. 60-80 MmHg Vs > 100mmHg in einer bewussten Maus)2. Die Zerbrechlichkeit des Herz-Kreislauf-Systems in einem narkotisierten Maus Vorbereitung oft ausgestellt schließt sinnvolle Beurteilung der vegetativen Nerven-Aktivität, da die Co-abhängige Beziehung zwischen Blutdruck und Sympathikotonus3 4.
Um diese Einschränkung, eine neue Methode für die direkte Aufnahme des renalen sympathischen Nerven-Aktivität (RSNA) in dem Bewusstsein, hemmungslose Mäuse, ungestört in ihrer Heimat Käfige wurde entwickelt. Sowohl die chirurgische und experimentellen Ansatz für eine erfolgreiche Umsetzung dieser Technik wird im Detail beschrieben. Diese Vorbereitung ermöglicht die Ermittler zu arteriellen Drucks über radiotelemetrische neben RSNA, mit der zusätzlichen Möglichkeit intravenös Agenten von Interesse ziehen ohne zu stören die Maus gleichzeitig aufnehmen.
Vierundzwanzig Stunden nach der Operation, Mäuse verhalten sich normal und weisen keine Anzeichen von Schmerzen oder Stress auf. Experimentelle Aufnahmen können dann 48 bis 72 Stunden nach der Operation beginnen, während die Maus bequem in seinem Hause Käfig mit uneingeschränkten Zugang zu Nahrung, Wasser und Umweltanreicherung ruht. Deutliche Spuren der RSNA werden vorgestellt und die charakteristischen Reaktionen dieser Nerv Bevölkerung zur normalen physischen Bewegungen des Tieres (z.B. Essen, Pflege) sind neben pharmakologischen Modulation der systemische Blutdruck unter Beweis gestellt. Die Qualität und Besonderheit der RSNA Signal wird weiter durch ganglionic Blockade validiert. Diese Handschrift enthält die audiovisuelle Ergänzung zu einer zunächst veröffentlichte Beschreibung von dieser Technik5.
Protokoll
Alle experimentellen Verfahren stehen im Einklang mit den nationalen Instituten der Health Guide für die Pflege und Verwendung von Labortieren und wurden durch die institutionelle Animal Care and Use Committee von der University of Mississippi Medical Center genehmigt.
(1) Tiere und Gehäuse
- Hausmäuse (24-35 g) bei der Ankunft in der institutionellen Tier Laboreinrichtung.
- Bieten Sie Mäuse, standard Nagetier Chow und Leitungswasser ad libitum in allen Phasen des experimentellen Protokolls in einer kontrollierten Umgebung von Temperatur und Luftfeuchtigkeit.
2. maßgeschneiderte Herstellung von implantierbaren RSNA Elektrode
Hinweis: Konstruieren der implantierbaren RSNA Elektrode mindestens ein paar Tage vor dem geplanten chirurgischen Eingriff, Heilung und Sterilisation Zeit (siehe unten) unterzubringen.
- Schneiden Sie drei gleiche Längen der isolierten Multiple-Stranded Edelstahldraht, 250 mm (Drahtdurchmesser nackten 0,0254 mm, 0,14 mm beschichtet). Verwenden Sie eine Skalpellklinge (vorzugsweise #11), um ca. 15 mm des Isolationsmaterials, das zugrunde liegende Metall von einem Ende des jeweils die Länge des Drahtes aussetzen entfernen.
- Löten Sie einen einzigen männlichen poligen (Messing mit Vergoldung) bis zum abisolierte Ende nur von zwei der Drähte um bipolare Elektrode führt (Abbildung 1A) zu erstellen. Lassen Sie das Ende der dritten Länge des Drahtes kahl. Dies fungiert als das Erdungskabel.
- Schlüpfen Sie einen kurzen (~2.0 - 2,5 cm) Stück 1,6 mm Durchmesser Wärme-Schrumpf Schlauch über die Pin-Anschluss und Kabel komplett neu Lötverbindung zwischen den Draht und Pin Stecker abdecken.
Hinweis: Die Spitze des Pin-Anschluss, die der Verstärker Headstage gesteckt werden muss ausgesetzt bleiben. - Halten Sie den Draht über eine Heißluftpistole mit ein paar kleinen Zange oder Futterzange wärmeempfindlichen Schrumpfschlauch und die Verbindung zwischen den poligen Stecker und das Kabel elektrisch zu isolieren. Wiederholen Sie für den zweiten Draht/Pin-Anschluss.
- Ein 200 mm Schnittlänge Polyethylen-Rohre (PE 90; Innendurchmesser 0,86 mm, Außendurchmesser 1,27 mm). Gruppe der drei Leitungen (zwei führt + Erdungskabel) und führen die unberührte enden in der PE 90 Schlauch, Einfädeln sie zusammen durch das offene Ende des Schlauches (Abbildung 1 b).
Hinweis: Die PE 90 Schläuche Funktionen wie ein Mantel zu gruppieren und zu schützen die Elektrode führt und Erdungskabel.- Identifizieren Sie das Massekabel und durchziehen Sie die PE 90 Scheide ein wenig weiter zur Unterscheidung von der bipolare Elektrode führt.
3. Aufbau der Elektrodenspitze
- Visualisieren Sie die unberührte Enden der Elektrodenleitungen mit einem sezierenden Mikroskop. Fädeln Sie die drei losen Enden der Elektrode durch ein 5 mm - langes Stück kleiner Polyethylen-Rohre (PE 10, Innendurchmesser 0,28 mm, Außendurchmesser 0,61 mm), der Elektrodenleitungen aneinander zu binden.
- Fädeln Sie ein 1,5 mm Stück dieser PE 10 Schlauch auf die drei Elektrodenleitungen. Dieser Schlauch 2,0 mm entfernt von der ursprünglichen 5 mm Stück PE 10 ruhen voraus.
- Fädeln Sie ein zweites Stück 1,5 mm PE 10 Schläuche auf die Spitzen der zwei bipolare Elektrode führt zum Decken und isolieren Sie die Tipps und trennen Sie sie von der Masseleitung (Abbildung 1).
- Schneiden Sie eine Überlänge der Drähte mit einer Schere.
- Kleben Sie die einzelnen Teile des PE 10 Schläuche an die Elektrodenleitungen mit einem kleinen Tropfen flüssigen Formel Cyanacrylat-Klebstoff. Platzieren Sie eine stumpfen 25 Gauge-Nadel am Ende der Kleber Tube zur Verbesserung der Kontrolle und Reduzierung verschütten.
- Legen Sie die Nadelspitze an der Kreuzung zwischen der PE 10 und Draht, dann Tropfen Sie einen kleinen Kleber und visualisieren Sie Leim Beschichtung innen das PE-Rohr.
- Lassen Sie den Kleber über Nacht vollständig zu heilen.
4. feine Vorbereitung der Elektrodenspitze Aufnahme
- Streifen Sie die isolierende Beschichtung aus die bipolare Elektrodenspitzen und die Spitze der das Erdungskabel mit einem #11 Skalpellklinge. Nicht stören Sie oder beschädigen Sie der zugrunde liegenden mehrere Litzen wie dies auf die Qualität des Signals RSNA Auswirkungen wird.
- Griff der konstruierten Elektrode zwischen 5,0 mm und 1,5 mm PE 10 Anker mit Zange gebogen und biegen Sie die Drähte um einen 90 ° Winkel (Abbildung 1) bilden.
Hinweis: Dieses Manöver sollte die bipolare Elektrode führt über den Schutzleiter in eine optimale Position der Nervenbündel Wiege position.
5. Bau von der Verankerung Sockel
- Konstrukt ein Podest, die Elektrode zu stabilisieren zu Mitte Skapulier und Umgebung: die Maus auf Exteriorisation führt durch Schneiden ein 3 cm Stück Polyethylen-Rohre (Innendurchmesser 2,70 mm, Außendurchmesser 4,00 mm).
- Fassen Sie den Schlauch mit der Pinzette und schmelzen Sie einem Ende bei einer Heißluftpistole. Drücken Sie das beheizte Ende der Schlauch senkrecht zu einer kühlen Metall Oberfläche zum Erstellen einer abgerundeten Kante oder "Flansch".
- Fädeln Sie diese Sockel auf die konstruierten Elektrode so, dass der Flansch auf der Elektrodenspitze zeigt.
Hinweis: Die Kombination aus PE 90 Mantel und Sockel schützt die Elektrodenkabel vom Tier einmal verwirklicht.
6. Sterilisation der abgeschlossenen implantierbare Elektrode
- Paket der abgeschlossenen Elektrode einzeln in Sterilisation Taschen und Ozon sterilisieren (TSO3) vor der Implantation.
Hinweis: Wenden Sie sich an lokalen Krankenhaus Sterilisation-Einrichtung in Bezug auf spezifische Art von Sterilisationsbeutel und Verfahren wie dies unterscheidet sich zwischen den Institutionen.
7. Narkose und Vorbereitung für die Operation
- 20 Minuten vor Beginn der Operation (2 mg/kg Meloxicam, S.C) Analgesie zu verwalten. Platzieren Sie den Mauszeiger in eine Induktion-Kammer mit 100 % medizinischem Sauerstoff infundiert. Einstellungen Sie Vaporizer-um die Erhöhung des Isoflurane Narkose in Schritten von 0,5 bis 4 % erreichen. Operative Ebene durch die Beurteilung der reflex auf sanften Druck auf den Zehen oder Fuß-Pads von fore bewerten und hinteren Gliedmaßen sowie Verlangsamung der Atemfrequenz.
- Übertragen Sie das Tier auf dem OP-Tisch und erhalten Sie Anästhesie mit 1,5 bis 2 % Isofluran über eine Nosecone zu, sobald es chirurgische Flugzeug erreicht hat und nicht mehr den Zehe-Prise Reflex Exponate. Die Toe-Prise Antwort in regelmäßigen Abständen zu wiederholen und Atemfrequenz während des gesamten chirurgischen Verfahrens zu beurteilen. Gelten Sie ophthalmologischen Salbe für Augen, Trockenheit zu verhindern.
- Pflegen Sie die normale Körpertemperatur des Tieres zu allen Zeiten mit Gel gefüllte Isotherm Wärme-Pads und entsprechenden OP-Tisch. Speichern Sie isothermen Pads in einem 37° C-Wasserbad und ersetzen Sie Pads so oft wie nötig, um physiologische Körpertemperatur während der Operation zu.
- Verwalten von Glykopyrrolat (50-70 µg/kg, subkutan (S.C)), übermäßige Produktion von Sekreten der Atemwege sofort nach Induktion der Anästhesie zu verhindern. Verwalten Sie diese Dosis von Glykopyrrolat ein zweites Mal in der Mitte des chirurgischen Eingriffs (Schritt 9.1).
- Durchzuführen Sie alle chirurgischen Eingriffe unter aseptischen Bedingungen. Stellen Sie sicher, dass alle chirurgischen Instrumente autoklaviert vor der geplanten Operation gewesen sein. Reinigen Sie das OP-Feld zu, wie unten (7.2.1) beschrieben und erhalten Sie Sterilität während des Verfahrens zu.
- Eine Gesichtsmaske, autoklaviert Isolierung Kleid und steril, Einweg-Handschuhe zu tragen. Reinigen Sie alle Großgeräte wie Schwanenhals-Lampe, sezieren, Umfang und OP-Tisch mit 70 % Ethanol. In regelmäßigen Abständen während des Verfahrens gelten Sie 70 % igem Ethanol für die OP-Handschuhe, Sterilität zu gewährleisten.
- Entfernen Sie Haare aus der linken Flanke, ventralen Halsregion und dorsalen midscapular Region des Tieres mit kleinen Tieren Haarschneidemaschinen, gefolgt von Enthaarungscreme (empfindliche Haut Formel).
- Reinigen Sie die Haut der beiden chirurgischen Felder mit 3 abwechselnd Anwendungen der chirurgischen Reinigungslösung (10 % Povidon-Jod) und 70 % Ethanol. Bereiten Sie das OP-Feld mit einer endgültigen Anwendung des chirurgischen Reinigungslösung.
8. chirurgische Implantation der RSNA Elektrode
- Positionieren Sie den Mauszeiger auf der rechten Seite mit dem rostral Ende nach links des Operateurs, Freilegung der linken Flanke des Tieres zeigt. Machen Sie einen 5 mm Schnitt in der Haut der midscapular Region mit einem Skalpell (#11).
Hinweis: Dies ist die Website, bei dem der RSNA Elektrodenkabel verwirklicht werden.- Ein zweiter Einschnitt (< 20 mm) in die Haut über der linken Flanke, senkrecht zur Wirbelsäule und 2 mm kaudalen um den Brustkorb. Tunnel 13G Edelstahl Nadel subkutan aus dieser Einschnitt zu Einschnitt an der dorsalen Austrittsstelle.
Hinweis: Datei die scharfen Kanten der Nadel, um eine glatte, nicht Schneide verlassen. - Die 13G Nadel sterilisierte implantierbare RSNA Elektrode (Schritte 2 - 6) durchlaufen. Ziehen Sie die 13G Nadel zurück um die Elektrodenspitze auf die Bauchmuskulatur an der linken Flanke liegen zu lassen. Lassen Sie ein Segment der Elektrode führt unter der Haut liegen, und lassen Sie die restlichen Längen aus der dorsalen Schnitt.
- Ein zweiter Einschnitt (< 20 mm) in die Haut über der linken Flanke, senkrecht zur Wirbelsäule und 2 mm kaudalen um den Brustkorb. Tunnel 13G Edelstahl Nadel subkutan aus dieser Einschnitt zu Einschnitt an der dorsalen Austrittsstelle.
- Ort der Elektrodenspitze zur Seite. Machen Sie einen Schnitt in die Bauchmuskulatur, direkt hinter der Hautinzision in 8.1.1 gemacht. Trennen Sie das Fett- und Bindegewebe entlang der Rückenmuskel durch kleine Baumwoll-bestückte Applikatoren, die linke Niere verfügbar zu machen.
- Öffnen Sie das OP-Feld mit Mikro-Retraktoren aus- und Einfahren der Niere. Tun, nicht um das renal neurovaskuläre Bündel, dehnen die irreversibel schädigen die Nieren Nerven und Aufnahme eines lebensfähigen RSNA Signals entgegen.
Hinweis: Stahl Mikro-Retraktoren können aus einer standard Büroklammer und einer Länge von 4-0 Seide umgearbeitet werden. Stellen Sie sicher, dass diese Retraktoren mit chirurgischen Instrumenten auch sterilisiert sind, um aseptische Technik zu bewahren.
- Öffnen Sie das OP-Feld mit Mikro-Retraktoren aus- und Einfahren der Niere. Tun, nicht um das renal neurovaskuläre Bündel, dehnen die irreversibel schädigen die Nieren Nerven und Aufnahme eines lebensfähigen RSNA Signals entgegen.
- Visualisieren Sie das renal neurovaskuläre Bündel mit Hilfe von high-Power sezieren Mikroskop. Identifizieren Sie die renale Nervenbündel, die in der Regel (aber nicht immer) neben der renalen Arterie und Vene verläuft. Das Nervenbündel aus dem umliegenden Gewebe mit feinen, geraden Zange zu sezieren.
Hinweis: Die renale Nervenbündel wird opak, mit ein "Seil" reflektierende aussehen, einzigartig im Vergleich zu der Lymphgefäße, die klar erscheinen.- Das Nervenbündel möglichst wenig zu manipulieren. Nicht berühren, Strecken oder das Nervenbündel jederzeit abholen. Stören Sie nicht die feinen Blutgefäßen liefern den Nerv oder die renale Lymphe Kanal, weil dadurch Lebensfähigkeit des Nervs gefährden und produzieren kontinuierliche Lymphe Flüssigkeit zu bündeln, um die Nerven/Elektrode, die behindern oder das Nervensignal vollständig zu vernichten.
- Verlassen die renale Nervenbündel intakt, die helfen, langfristige Lebensfähigkeit des Nervs bewahren sowie stabile Kontakt zwischen den Nerv und die Elektrode (d. h. ein geschnittenen Nerv aus der Elektroden mit der Zeit und natürlichen Körperbewegungen rutschen kann).
- Die Elektrodenspitze RSNA in die Bauchhöhle einzuführen. Stellen Sie seine Position, so dass die bipolare Elektrode Spitze und Boden Draht senkrecht auf die renale neurovaskuläre Bündel. Passen Sie die Position der Elektrode weiter, so, dass die Masseleitung guten Kontakt mit der darunter liegende Gewebe hat und die Elektrode nicht, die renal Gefäße komprimieren, Kompromisse bei der renale Durchblutung (Abbildung 1).
- Heben Sie die renale Nervenbündel mit abgewinkelten Pinzette. Schieben Sie die Elektrodenspitze unter den Nerv, so dass des Nervs in direktem Kontakt mit beide Drähte.
- Rutschen Sie ein kleines Stück von Paraffin Film zwischen den Nerven/bipolare Kabel und das dritte (Masse) Kabel (Abbildung 1).
Hinweis: Einweichen sterilisieren den Paraffin-Film in 70 % igem Ethanol für 24 Stunden und Spülen in steriler physiologischer Kochsalzlösung vor der Implantation. - Entfernen kein Blut oder Flüssigkeit aus rund um die Nerven/Elektrode mit kleinen Absorptionsmittel Speere wie jede Flüssigkeit übrig um den Nerv oder Elektrodenleitungen behindern oder das Nervensignal zu löschen werden.
- Testen Sie schnell die Qualität des Signals RSNA Wunsch (Setup unten beschrieben).
Hinweis: Dies muss schnell erfolgen wie an der Luft den Nerv trocknet und die Rentabilität des Unternehmens gefährden. - Wenden Sie ein zwei-Komponenten-Silikon-Elastomer auf Nerv/Elektrodeneinheit, sicherzustellen, dass die Silikon-Pools unter und um den Nerv zu komplette galvanische Trennung (d. h. nicht einfach nur ein Tropfen auf den Nerv an).
Hinweis: Sicherstellen Sie, dass die Elektrodenspitzen auch im Silikon beschichtet sind. Das Massekabel sollte Kontakt mit dem darunter liegenden Gewebe und Elastomer muss somit nicht Pool unter diesen Draht. Vermeiden Sie Anwendung eine unnötig große Menge an Silikon-Elastomer, da dies potentiell renale Blutfluss behindern kann, oder mit natürlichen Körperbewegungen mit der Zeit verdrängt werden. - 1-2 Minuten für die Silikon-Elastomer, vollständig zu heilen dann heben Sie vorsichtig die äußeren Rändern des Silikons "Glob" mit der Pinzette und eine kleine Menge des flüssigen Formel chirurgischen Klebstoff zu ermöglichen.
Hinweis: Achten Sie darauf kein Übermaß an dieser Leim, gelten Zirkulation beeinträchtigen oder breitete sich auf den Nerv und die Rentabilität des Unternehmens gefährden.
- Rutschen Sie ein kleines Stück von Paraffin Film zwischen den Nerven/bipolare Kabel und das dritte (Masse) Kabel (Abbildung 1).
- Schließen Sie den Bauchschnitt mit diskontinuierlichen, resorbierbare Fäden (5-0). Schließen Sie die darüber liegende Haut in ähnlicher Weise mit den gleichen Nahtmaterial.
9. die Implantation der Blutdruck Radiotelemeter
- Positionieren Sie die Maus auf dem Rücken mit dem rostral Ende in Richtung der Chirurg. Passen Sie Anästhesie Nosecone nach Bedarf an. Verwalten Sie die zweite Dosis der Glykopyrrolat an dieser Stelle (siehe 7.1.3).
- Machen Sie einen Mittellinie Schnitt in der Haut des Halsbereiches mit einem Skalpell (#11), beginnend mit knapp unterhalb des Tieres Unterkiefer und Verlängerung nur über den Brustkorb. Trennen Sie das Drüsengewebe, die zugrunde liegenden Nackenmuskulatur aussetzen. Setzen Sie die linke gemeinsame Halsschlagader und trennen Sie vom umgebenden Gewebe.
Hinweis: Achten Sie nicht zu den Nervus Vagus zu beschädigen, da dies zu erhöhten postoperative Mortalität führen kann.- Geben Sie drei Stücke von 6-0 Seide Nahtmaterial unter der Arterie. Positionieren Sie eine Naht Rostral so weit wie möglich zu und binden Sie es um das Schiff zu verdecken. Positionieren Sie eine zweite Naht in der Mitte entlang der Länge des Schiffes und binden Sie locker zu. Positionieren Sie die letzte Naht so kaudal und binden Sie locker.
- Einfahren der rostral-die meisten Naht und Nosecone mit einem kleinen Stück Nabelschnur Klebeband befestigen. Einfahren der kaudalen-die meisten Naht mit Mikro-Moskito-Zangen, Blutfluss im Gefäß zu beschränken.
- Machen Sie einen kleinen Schnitt in der Gefäßwand als Rostral mit feinen Feder Schere. Führen Sie die Maus Blutdruck Radiotelemeter Katheter in das Schiff und voraus auf die Caudale Naht.
- Binden Sie die mittlere Naht um vorübergehend stabilisieren den Katheter, lassen Sie die Caudale Retraktion und fördern die Katheter 10 mm. Tie Naht um Katheter zu sichern.
- Tunnel der Telemeter Körper einer subkutanen Tasche entlang der rechten Flanke.
10. die Implantation und Exteriorisation von Vena Venenkatheter
- Verwenden Sie kleine Baumwoll-bestückte Applikatoren, um der rechten Halsschlagader verfügbar zu machen. Übergeben Sie zwei Stücke von 6-0 Seide Nahtmaterial rund um das Schiff.
- Positionieren Sie eine Naht Rostral so weit wie möglich und Bindung an das Schiff zu verdecken. Positionieren Sie die zweite Naht so kaudal und zurückzuziehen Sie sanft, um Blutfluß in das Schiff zu stoppen.
- Verwenden Sie feine Feder Schere, um einen kleinen Schnitt in der Gefäßwand möglichst nahe an die rostral Naht wie möglich zu machen. Katheterisierung die Vene mit Hitze-gestreckten Schlauch (O.D 1,02 mm, gestreckt, OD 0,64 mm), die Pre ist mit steriler physiologischer Kochsalzlösung gefüllt.
Hinweis: Sicherstellen Sie, dass die Katheterspitze mit einem Skalpell, eine abgerundete Abschrägung zur Vermeidung Schiff Perforation zu produzieren geschnitten wird. Volumen der Flüssigkeit in den Katheter (Totraum) als Referenz zu bestimmen (siehe Schritte 14,4-14.6 unten).- Fördern Sie den Katheter ca. 8 mm in die Vene. Sichern Sie den Katheter durch die seidenen Fäden rund um das Schiff und Katheter sowie die Anwendung eines kleinen Tropfens Gel-Formel Cyanacrylat-Klebstoff zu binden.
- Platzieren Sie den Mauszeiger auf der linken Seite. Tunnel der intravenöse Katheter vom Hals an der dorsalen midscapular Region mit einer 13 G-Edelstahl-Nadel zu beenden.
- Positionieren Sie die Maus auf dem Rücken. Schließen Sie den Hals Schnitt mit diskontinuierlichen Nähte.
- Legen Sie das Tier in die Bauchlage. Fädeln Sie eine kleine subkutane Taste auf den Venenkatheter. Sichern Sie den Knopf unter der Haut mit Nähten. Fädeln Sie die entsprechenden Edelstahl-Feder über den Venenkatheter und sichern Sie sie auf die Schaltfläche "Haut", um den Katheter zu schützen.
11. Sicherung Beispiel Elektrode führt
- Polyäthylen Sockel Schutz führt die Elektrode auf die darunter liegenden Muskeln mit Gewebe-Klebeband zu sichern. Naht der darüberliegenden Haut über den Flansch für weitere Unterstützung.
12. postoperative Erholung
- Gelten Sie antibiotische Salbe für alle Einschnitte.
- Verabreichen Sie schmerzstillende Medikamente. Verwalten Sie zusätzliche Dosen von schmerzstillenden Medikamenten wie während der Erholungsphase benötigt, wenn das Tier Anzeichen von Schmerzen oder Ängste.
- Platzieren Sie den Mauszeiger in einem metabolischen Käfig gesäumt von Hackschnitzel-Bettwäsche und Papiertuch zu erholen. Das Tier ständig zu überwachen und nicht unbeaufsichtigt lassen es bis es Bewusstsein wiedererlangt und sternalen liegen pflegen. Umweltanreicherung und Nahrung und Wasser (Ad Libitum) an dieser Stelle vorstellen.
- Spule Elektrode führt außerhalb des Käfigs bis zum Zeitpunkt des Experiments.
- Legen Sie den Käfig über eine warm Wärmekissen für die ersten 24 Stunden der Erholung. Verbinden Sie Edelstahlfeder und intravenöse Katheter mit einem Schwenk/Infusion System für kontinuierliche Infusion von physiologischer Kochsalzlösung während der Erholungsphase (0,5 mL/h).
- Sicherzustellen, dass das Tier bleibt einzeln untergebracht in einem speziellen Käfig aufgrund der Beschaffenheit des exteriorized Katheter und Elektrode führt.
13. Versuchsaufbau für die Aufnahme Blutdruck und RSNA
- Statten Sie eine Edelstahl Top Anti-Vibrations-Tabelle mit einem einfachen Faraday-Käfig.
Hinweis: Dieser Faraday-Käfig kann mit einem hölzernen Rahmen und Aluminium Siebgewebe aufgebaut werden. Elektrisch Boden der Tabelle/Faraday-Käfig um jede elektrische Störungen zu beseitigen. - Stellen Sie einen Blutdruck radiotelemetrische Empfänger innerhalb der Faraday-Käfig.
- Schließen Sie die radiotelemetrische Receiver an den damit verbundenen Druck-Ausgabe-Adapter. Schließen Sie diesen Adapter an ein Datenerfassungssystem zur Aufzeichnung des Blutdrucks online.
- Lot zwei weibliche Stiftleisten, die komplementär zu der Elektrode männlichen Stiftleisten (Messing mit Vergoldung) an den Enden einer gekoppelten, geschirmte PVC isolierte Kabel. Löten Sie die gegenüberliegenden Enden des dieser gekoppelten Kabel mit Bananensteckern. Verbinden Sie die Bananensteckern mit einem sorgt Headstage (10 X Verstärkung).
- Verbinden Sie dieser Vorverstärker mit einem Differenzverstärker. Passen Sie die Einstellungen für Nervensignal X10, 000 zu verstärken. Filtereinstellungen wie folgt anpassen: Low-cut, 100Hz; Hoch geschnitten, 1000 Hz.
- Legen Sie mit der Maus auf die radiotelemetrische Empfänger befindet sich innerhalb der Faraday-Käfig 48 bis 72 Stunden nach dem Eingriff nach Hause Käfig. Schalten Sie die radiotelemetrische Sonde, Blutdruck-Signale aufzuzeichnen.
Hinweis: Die Maus akklimatisieren, indem man die Heimat Käfig in das Setup im Laufe von 1 Woche vor der Operation ist optimal. - Wickeln Sie das Elektrodenkabel und stecken Sie die Pin-Anschlüsse der bipolare Elektrode in entsprechenden weiblichen Stiftleisten (13,4) beschriebenen, mit der Aufnahme der RSNA.
- Anzeige und Aufzeichnung gleichzeitig Blutdruck-Signale mit einem Computer während der Infusion physiologischer Kochsalzlösung oder Lösung von Interesse. Daten zu einem Mindestsatz von 2500 Samples pro Sekunde.
14. Beispiel experimentelles Protokoll und Validierung der RSNA Signal
- Sicherstellen Sie, dass die Mäuse in ihrem Hause Käfig, hemmungslos mit freiem Zugang zu Futter und Wasser vertraut sind. Richtlinien Sie für die Überprüfung von normalem Aussehen und Verhalten institutionelle Pflege der Tiere.
- Haus die Mäuse in die gleiche Temperatur und Luftfeuchtigkeit kontrolliert Zimmer in denen RSNA Aufnahme stattfinden wird. Stellen Sie sicher, dass intravenöse Infusion weiter wie oben beschrieben.
- Lassen Sie mindestens 30 Minuten für eine Stabilisierung, sobald das Tier in der Recording-Setup vor der Aufnahme eine Stunde Grundlinie Blutdruck und RSNA Daten beschriebenen befindet. Sicherstellen Sie, dass das Tier ruhig ruht während der Aufnahme, da natürlicher Bewegung Sympathikotonus Erhöhung zugeordnet wurde. Hinweis: Wenn das Tier bewegt wird direkt auf die digitale Spur während der Aufnahme, so dass dies während der Analyse nicht berücksichtigt werden kann.
- Testen Sie langsam die Baroreflex Resonanz der ersten Injektion einen Bolus von Natrium Nitroprusside (2,5 µg/g Körpergewicht in einem Volumen von 25 µL Kochsalzlösung) in den Infusionsschlauch. Spülen Sie langsam die Zeile mit ~ 50 µL physiologischer Kochsalzlösung. Stellen Sie sicher, dass Katheter Totraum deaktiviert ist. Blut Druck und RSNA für 2 bis 5 Minuten.
- Injizieren Sie langsam einen Bolus von Phenylephrin (20 µg/g Körpergewicht in 25 µL Kochsalzlösung). Mit ~ 50 µL physiologischer Kochsalzlösung spülen. Stellen Sie sicher, dass Katheter Totraum deaktiviert ist. Blut Druck und RSNA für weitere 10 bis 15 Minuten.
- Überprüfen Sie die Postganglionäre Natur das Nervensignal durch die Injektion langsam eines Bolus der ganglionic Blocker, Hexamethonium (50 µg/g-Körpergewicht in 25 µL Kochsalzlösung) in den Infusionsschlauch. Mit ~ 50 µL Kochsalzlösung spülen. Stellen Sie sicher, dass Katheter Totraum deaktiviert ist. Aufnahme für einige Minuten weiter.
- Verwenden Sie die Restaktivität, die bleibt nach Hexamethonium Verwaltung als eine Schätzung von Hintergrundgeräuschen für den Einsatz in der Analyse der RSNA (siehe unten).
- Einschläfern der Maus mit einer Überdosis Isofluran (schrittweise Dosierung in Schritten von 0,5 bis 5 %) und weiter Aufnahme RSNA für weitere 30 Minuten. Hinweis: Die restlichen Signal kann auch als eine Schätzung von Hintergrundgeräuschen für Analyse der RSNA verwendet werden.
15. die Datenanalyse
- Verwendung Datenerfassungs-Software, raw Blutdruck und RSNA Spuren zu analysieren.
- Digital zu integrieren und Vollweg-korrigieren die rohe RSNA Spur mit dieser Software. Wählen Sie "Absolute Integral" für integrale Einstellungen; eine konstante Zeitwert von 0,1 Sekunden6anwenden.
- Analysieren Sie das integrierte RSNA Signal (angezeigt in Einheiten von µV·s) für jedes Segment des experimentellen Protokolls. Ignorieren Sie Segmente der Aufnahme, wenn das Tier zufällig zu bewegen. Nehmen Sie mindestens 3 Messungen für Basis- und experimentellen Teile des Experiments, beziehungsweise.
- Analysieren Sie RSNA auf dem Niveau von minimalen und maximalen Blutdruck für Natrium Nitroprusside oder Phenylephrin, bzw. um Baroreflex Empfindlichkeit zu beurteilen.
- Durchschnitt der einzelnen Messungen über für jeden Teil des experimentellen Protokolls um einen einzelnen Wert zu erzielen.
- Quantifizieren der RSNA Antwort durch die Berechnung der prozentuale Veränderung der RSNA vom Ausgangswert, bei 100 %7bezeichneten. Komplette statistische Auswertung je nach Bedarf.
Hinweis: In diesem Beispiel wurde mit einem Student t -Test statistische Analyse der Antwort der RSNA Natrium Nitroprusside und Phenylephrin abgeschlossen; Bedeutung nahm mit P -Werten < 0,05.
Ergebnisse
Im Anschluss an das beschriebene Protokoll wurde Überlebensrate 100 % - alle Mäuse, die in dieser Studie überlebten und erholte sich auch nach dem chirurgischen Eingriff instrumentiert. Innerhalb von 24 Stunden nach der OP Vorbereitung, alle Mäuse normalerweise Verhalten ausstellen, typisches Essen, Pflege und exploratives Verhalten. Keine Tiere zeigten Anzeichen von Schmerzen oder Ängste zu diesem Zeitpunkt. 48 Stunden nach der Operation, verzeichnete eine überprüfbare und klares Signal der RSNA 10 von insgesamt 12 Mäuse. Dieses Signal wurde in diesen Mäusen 72 Stunden nach der Operation beibehalten, aber eine wahre RSNA signal wurde aufgenommen in 7 (70 %) von Mäusen bei Tag 4 und in nur 5 (50 %)-Mäusen durch 5. Tag nach der Operation. Mäuse, die eine qualitativ hochwertige RSNA Signal durch elektrisches Rauschen oder Kontamination von Elektrokardiogramm-Signalen nicht aufweisen waren bis zum Zeitpunkt der Euthanization noch bei guter Gesundheit.
Meine arteriellen Drucks in der bewussten Mäuse 48 Stunden nach der Operation war 116±2 MmHg, mit einer entsprechenden mittlere Herzfrequenz von 596±22 Bpm (n = 10). Gleichzeitige Aufnahme einer repräsentativen Stichprobe von Blutdruck und RSNA zu diesem Zeitpunkt zeigte deutlich sichtbar und charakteristischen rhythmischen platzt der RSNA (Abbildung 2). Die typische erhöht sich der RSNA erwartet mit normalen Aktivitäten wie Essen und Pflege, wie direkt beobachtet und festgestellt durch Personal, waren ebenfalls anwesend (Abbildung 3). Qualitativ hochwertige RSNA wurde auch sequentiell in 50 % der Mäuse untersucht bis zu 5 Tage nach der OP-Vorbereitung (Abbildung 4) notiert. Blutdruck und Herzfrequenz für die 5-tägige Untersuchungszeitraum stabil geblieben und Werte unterschieden sich nicht von denen, die wir verzeichnen nach bis zu 10 Tagen der postoperativen Erholung (Tabelle 1)8.
Um zu überprüfen das RSNA Signal und stellen Sie sicher, dass es in der Tat mit der arterielle Baroreflex mitgerissen wird, wurde Blutdruck pharmakologisch mit eine intravenöse Injektion von Natrium Nitroprusside und Phenylephrin manipuliert. RSNA erhöht charakteristisch als Reaktion auf die Natrium Nitroprusside-induzierte Reduktion des arteriellen Drucks; im Gegensatz dazu war RSNA praktisch mundtot gemacht nach der Phenylephrin-induzierten Anstieg des arteriellen Druck (Abbildung 5). Quantitativ, Natrium Nitroprusside verringert Blutdruck 62±3 MmHg, was zu einer Erhöhung der RSNA 77±9 % über dem Ausgangswert entsprach (n = 5; P < 0,05, Abbildung 6). In ähnlicher Weise nach Phenylephrin Verwaltung, erreichte die arteriellen Druck 137±6 MmHg, die RSNA um 79±2 % unter Grundniveau reduziert (n = 5; P < 0,05, Abbildung 6). Darüber hinaus war RSNA eliminiert ganglionic Blockade mit Hexamethonium (Abbildung 7), nach Festlegung der Post-ganglionic Natur des Signals RSNA.

Abbildung 1: Aufbau und Platzierung der implantierbaren renalen sympathischen Nerven Elektrode. Schematische Darstellung des Entwurfs und empfohlene Platzierung der implantierbaren renalen sympathischen Nerven Elektrode. (A) bipolare führt mit Pin-Anschlüsse und ein Drittel Erdungskabel. (B) Drähte sind Gewinde durch Polyethylen (PE) 90 Schlauch um die exteriorized führt zu schützen. (C) Design der Elektrodenspitze um die Masseleitung die bipolare Kabel trennen. (D) die Elektrodenspitze gebogen ist in einem 90 ° Winkel zur optimalen Position zu erleichtern; die renale Nervenbündel ist senkrecht zu der bipolaren führt und Wachs-basierte Labor Film isoliert die führt von der Masseleitung, die in Kontakt mit dem darunter liegenden Gewebe ist. Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.
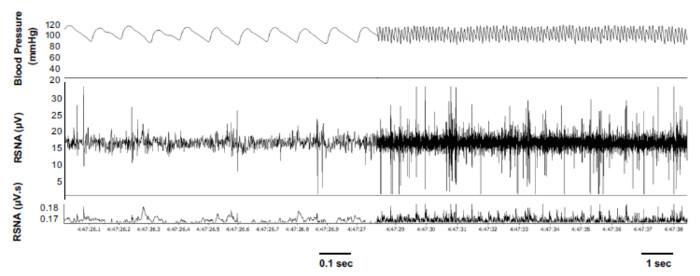
Abbildung 2: Vertreter, die Aufnahme des arteriellen Drucks und renalen sympathischen Nerven Aktivität (RSNA). Probe Spuren zeigen gleichzeitige Aufnahme des systemischen arteriellen Blutdrucks, RSNA und integrierte RSNA in einer bewussten, still ruhenden Maus 48 Stunden nach der OP-Vorbereitung. Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Reaktion der renalen sympathischen Nerven-Aktivität (RSNA) auf normale körperliche Aktivität. Vertreter verfolgen mit gleichzeitiger Aufnahme des systemischen arteriellen Blutdrucks, RSNA und integrierte RSNA in zwei bewusste Mäuse, 48 und 72 Stunden nach der Operation an der Basislinie und (A) bei Beginn der aktiven Pflege oder (B) ruhig essen. Der große Pfeil kennzeichnet Beginn der körperlichen Aktivität vom Rest. Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Langfristige renalen sympathischen Nerven-Aktivität (RSNA) signalisieren Lebensfähigkeit. Sequentielle repräsentative Aufnahmen von Blutdruck und RSNA in einer bewussten, still ruhenden Maus einige Tage nach der OP-Vorbereitung. (A) 2 Tage, (B) 3 Tage, (C) 4 Tage und (D) 5 Tage nach der Operation. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Mitnahme des renalen sympathischen Nerven Aktivität (RSNA) Signals mit der arterielle Baroreflex. Repräsentative Aufnahme des arteriellen Blutdruckes und RSNA in einer bewussten Maus in Ruhe während (A) Grundlinie und nach der anschließenden intravenöse Gabe von Natrium (B) Nitroprusside gefolgt von Phenylephrin (C). Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 6: Quantifizierung der renalen sympathischen Empfindlichkeit auf den arteriellen Blutdruck. Quantitative Reaktion der arterielle Blutdruck und renalen sympathischen Nerven-Aktivität (RSNA) auf pharmakologische Manipulation mit Natrium Nitroprusside und Phenylephrin. (A) bedeuten Sie arteriellen Druck an der Basislinie (schwarzer Balken; 116±2 MmHg) und nach weiteren intravenöse Gabe von Natrium Nitroprusside (grauer Balken; 62±3 MmHg) und Phenylephrin (offene Bar; 137±6 MmHg). (B) entsprechend RSNA Reaktion während Natrium Nitroprusside (grauer Balken; 77±9 %) oder Phenylephrin (offene Bar; -79±2 %). RSNA drückt sich eine prozentuale Veränderung gegenüber dem Ausgangswert, Mittelwert ± SEM * signifikanter Unterschied gegenüber dem Ausgangswert (p < 0,05, n = 5). Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 7: Post-ganglionic Natur der renalen sympathischen Nerven Aktivität (RSNA). Repräsentative Spur des arteriellen Blutdruckes und RSNA bei Studienbeginn (A) (B) unmittelbar nach ganglionic Blockade mit Hexamethonium und (C) Post-Mortem. Reproduziert mit Erlaubnis5. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Tier-ID | 2D | 3D | 4D | 5d | |
| A | mmHg | 112 | 110 | 108 | 109 |
| BPM | 657 | 551 | 626 | 616 | |
| B | mmHg | 115 | 107 | 111 | 110 |
| BPM | 582 | 652 | 662 | 668 | |
| C | mmHg | 115 | 118 | 113 | 111 |
| BPM | 591 | 599 | 689 | 664 | |
| D | mmHg | 114 | 115 | 116 | 110 |
| BPM | 457 | 513 | 599 | 531 | |
| E | mmHg | 109 | 109 | 103 | 105 |
| BPM | 632 | 687 | 699 | 689 |
Tabelle 1: Mittlere arterielle Druck und Herzfrequenz Ausgangswerte instrumentierten Mäuse mehr als 5 aufeinander folgenden Tagen nach der Operation. Reproduziert mit Erlaubnis5.
Diskussion
Hierin haben wir beschrieben, gezeigt und validiert eine neuartige Methode zur gezielte Auswertung der RSNA in bewusste Mäuse, frei zu bewegen und ruhen bequem in ihrer Heimat Käfigen. Im Anschluss an chirurgische Implantation einer arteriellen Druck-Radiotelemeter, eine innewohnende intravenöse Infusion Katheter und eine speziell angefertigte bipolare Elektrode RSNA Mäuse von der Operation erholt und 48 bis 72 Stunden lang ungestört gelassen wurden. Mäuse blieben bequem sesshaften in ihrem Hause Käfig zu allen Zeiten (einschließlich experimentellere Perioden) mit uneingeschränkten Zugang zu Nahrung, Wasser und Umweltanreicherung. Alle anschließenden experimentelle Manipulation durch den Prüfarzt war abgelegen und keine Unruhe der Tiere. Bezüglich der Qualität und Auslegung der RSNA Signal entfernt dieser Ansatz vollständig unerwünschten und unvermeidbaren physiologischen Komplikationen der Anästhesie und chirurgische Trauma sowie Zurückhaltung und andere Quellen der physischen und psychischen Stress das Tier. Somit wurden diese schweren Störfaktoren, die unweigerlich Auswirkungen auf die Interpretation der sympathische Aktivität Messungen effektiv eliminiert.
Alle Mäuse gesund waren und bereits 24 Stunden nach der Operation, typische Verhaltensweisen wie Helligkeit, Aktivität, Reaktionsfähigkeit, Essen, trinken, Pflege sowie spielerische und exploratives Verhalten angezeigt. Alle Tiere ausgestellt diese Eigenschaften und aktiv mit den zur Verfügung gestellten Umweltanreicherung unabhängig davon, ob eine tragfähige RSNA Signal aufgezeichnet werden konnte. Obwohl die Recovery-Zeit völlig verpflichtet Wiederherstellung normalen Blutdruck, die folgenden Implantation der Radiotelemetric Sonde angeblich ist solange 4-7 Tage9, arteriellen Druck normal viel früher zurückgibt, wie gezeigt durch die Werte Hier berichtet für Blutdruck und Herzfrequenz. In der Tat sind diese Herz-Kreislauf-Parameter gleichwertig mit den zuvor berichtet in ebenso instrumentierte Tiere die sich durften 10 Tage zu erholen von Chirurgie8,10.
Die Wahl Radiotelemetric Sonden zur Messung des Blutdrucks über eine flüssigkeitsgefüllte Katheter zu verwenden war gewollt, da dies reduziert die Belastung in den Mäusen und auch mehr klare und verlässliche Blut und Drucksignale Puls und Herzfrequenz Werte11 ergibt. Mit telemetrischen Technik zur Aufzeichnung des Blutdrucks stellt einen weiteren Vorteil, da häufig spülen und halten die Flüssigkeit arterielle Katheter mit heparinisierten Kochsalzlösung gefüllt, die unweigerlich das Tier stört, müssen vollständig eliminiert wird. Auch der Ansatz der chirurgisch exteriorizing, Verankerung und die intravenöse Katheter und bipolare Elektrode führt zu schützen ist ideal im Vergleich zu anderen Berichte beschreiben Zwischenlagerung von Leads in einer subkutanen Tasche12, seit unser Ansatz vermeidet sogar kurze Re-Anästhesie und chirurgische Manipulation des Tieres sofort vor der experimentelle Aufnahme, die zweifellos lassen die Maus und beeinträchtigen die Qualität und die Interpretierbarkeit des exquisit sensible Nervensystem Daten.
Diese Methode führt zu wahren RSNA Signale, deren Qualität demonstriert die charakteristischen platzt der elektrischen Aktivität deutlich unterscheidbar von Hintergrundgeräuschen in einer entspannten, leise Maus ruhen. Darüber hinaus zeigte RSNA typische Reaktion auf körperliche Aktivität in das Tier wie Pflege und ruhig essen wie in der Literatur13,14berichtet. Die charakteristischen steigt in RSNA erwartet mit natürlicher Bewegung oder Wachheit des Tieres gegeben, es ist also zwingend zu beachten und diese Zeiträume für die Zwecke der experimentellen Analyse ausschließen und sich auf Segmente der Aufnahme während der die Tier ist still ruhen. Dies hilft, um mögliche Fehlinterpretationen der Daten zu verhindern. Andere Faktoren, die zu Daten Fehlinterpretationen führen können gehören elektrische Störungen oder Interferenzen sowie Signal Kontamination mit ECG Impulse15. Übermäßige Bewegung des exteriorized Teils der Elektrodenkabel kann auch Einfluss auf die Qualität des Signals RSNA und kann als eine instabile oder "schwankenden" Grundlinie erscheinen. Zeitweise diese Quellen Signal Störungen können erscheinen und spontan verschwinden bei einer perfekt klare Aufnahme und Analyse5,15,16ausgeschlossen werden sollte. Eine weitere Überlegung ist der Zeitpunkt, an dem die Aufnahmen erhalten werden. Es ist wichtig zu beachten, dass Blutdruck und RSNA mit den zirkadianen Rhythmus unterscheiden, so ist es ideal für Experimente zur gleichen Zeit des Tages, diese potenziell verwirrende Faktor zu vermeiden. In dieser Studie wir erhebliche Variabilität des Blutdruckes und RSNA wegen zirkadianen Oszillationen nicht beobachten, wie wir alle Parameter zwischen 10:00 und 18:00 - auch innerhalb des Tageslicht-Zyklus der Tierhaltung Anlage aufgezeichnet. Ein weiterer wichtiger Bestandteil dieses Berichts ist die Validierung der RSNA-Signal, wie gezeigt, in der Tat mit der arterielle Baroreflex mitgerissen wird. Angesichts der raschen Reduktion und Höhe der RSNA parallel mit dem pharmakologisch induzierte Drop und Erhöhung in systemischen Blutdruck, arterielle Baroreflex war sicherlich intakt - die selbst zeigt, dass okklusiven Implantation der radiotelemetrische Katheter in einer Halsschlagader beeinträchtigen normale Herz-Kreislauf-Funktion nicht. Das virtuelle Verschwinden der RSNA Signal auf ganglionic Blockade mit Hexamethonium weiter bestätigt Aufnahme des Postganglionäre RSNA.
Es wäre ideal, um eine längere postoperative Erholung der Mäuse bieten aber wir und andere in diesem Bereich erkennen, dass die Aufrechterhaltung der langfristigen Rentabilität der vegetativen Nerven bei chronisch instrumentierten Tieren, vor allem Mäuse, schwierig bleibt. Obwohl die Signalqualität RSNA im Laufe von einigen Tagen nach der Operation verringert, war es noch möglich, zuverlässig wahr RSNA für mindestens 3 aufeinander folgenden Tagen in alle Mäuse und für bis zu 5 Tage in etwa der Hälfte der Tiere aufzunehmen. Diese Leistung an sich bedeutet einen Durchbruch auf dem Gebiet der autonomen Studien an Mäusen. Darüber hinaus maximiert diese Methode die Nutzung wertvoller transgener Tiere, wie es möglich ist, mehrere experimentelle aufzuzeichnen und Studien im gleichen Tier an verschiedenen Tagen, natürlich, zulassend Randomisierung Probeauftrag und ordnungsgemäße Grundlinie Aufnahme zu kontrollieren vor jedem Experiment17. Es ist ermutigend zu sehen, erfolgreiche Berichte der sympathischen Nerven Langzeitaufzeichnungen in bewusste Nagetiere18,19,20 inklusive Zuführungen in telemetrischen Nerv Aufnahme Technologien für Ratten durchgeführt 15,21. Miniaturisierung dieser Technologie für den Einsatz in der bewussten Maus steht und in der Zwischenzeit streben wir nach Verbesserung dieser Technik zur Erhöhung der Langlebigkeit der sympathischen Nervenfasern und verlängern Sie das experimentelle Fenster vielleicht erlauben einen längeren postoperative Erholungszeit. Jedoch bleibt diese Methode nützlich und leicht zugängliche und erschwingliche Alternative/Ergänzung zu jeder zukünftigen Entwicklungen im telemetrischen Nerv Aufnahmetechnik bei Mäusen, die eine Investition in spezielle Ausrüstung und regelmäßige Gerät benötigen Wartung.
Der Bedarf an zuverlässigen Techniken für die Beurteilung der Herz-Kreislauf- und autonome Funktion bei Mäusen war noch nie so groß sein, wenn man bedenkt das wachsende Interesse an transgenen Maus Modelle auf dem Gebiet der biomedizinischen Forschung. Große Fortschritte wurden in vielen Bereichen der Physiologie, aber es ist noch weit zu gehen in Bezug auf die Standardisierung und Optimierung der Ansätze für die Bewertung der autonomen Funktion in der Maus. Bis heute ist ein Bericht beschreibt Messung der sensorischen Nerven-Aktivität in der bewussten Maus12. Dieser Ansatz stellt die Messung der Blase sensorischen Nerven-Aktivität und beinhaltet Anästhesie und chirurgische Manipulation der subkutan platzierten Katheter unmittelbar vor experimentelle Aufnahme sowie physische Zurückhaltung der Mäuse im Laufe der experimentelle Protokoll12. Diese Faktoren sind Stressoren bekannt, die vollständig mit den gegenwärtigen Ansatz vermieden werden, die sicherlich für die Aufnahme einer Vielzahl von Nerven des Interesses neben renal Nerven zugeschnitten werden können. In jüngerer Zeit, sympathische Messungen in bewusste Mäuse gemeldet wurden, jedoch diese Messungen sind weitgehend durchgeführt, chirurgische Vorbereitung, ohne Erwähnung des analgetische Verwaltung22Stunden nach. Abgesehen von diesen Berichten wurde autonome Funktion sonst ausschließlich bei narkotisierten Mäusen bewertet. Eine gründliche Überprüfung der Literatur ergibt sich eine Vielzahl von Ansätzen, stundenlangen experimentelle Dauer, Narkose Kombinationen/Dosen, Beatmung und oft kreative Maßnahmen ergriffen, um die Mäuse in einem Zustand trägt einen Anschein zu stützen die physiologische (z. B. Sauerstoff direkt in Richtung des Tieres Nase geblasen)23,24,25,26,27,28,29, 30,31. Unter diesen Studien liegen Berichte über Blutdruckwerte fehlend oder verschwindend gering - unterhalb des physiologischen Bereichs des systemischen arteriellen Druck2. Dies ist problematisch, auf vielen Ebenen, aber vor allem so wenn es richtige Beurteilung der autonomen Funktion bei diesen Tieren geht, die hergestellte Verbindung zwischen Blutdruck und autonome Ton gegeben. Anästhetika selbst Auswirkungen direkt Sympathikotonus, mit vielen Berichten, was darauf hindeutet, dass die Narkose Aktivität des sympathischen Nervensystems dämpft. In der Tat Beweise zeigen, dass Urethan, das am häufigsten gewählte Anästhetikum für akute Nerv Aufnahme Experimente32, Dosis Abhängigkeit verringert RSNA33 und hemmt die arterielle Baroreflex-34. Dagegen andere Berichte deuten darauf hin, dass Urethan Sympathikotonus35erhöht. Zugegeben, solche Studien in der Regel experimentelle Nerven-Aktivität als ein Wechsel von einer aufgezeichneten Baseline vergleichen, schließt jedoch die veränderte Zustand des vegetativen Nervensystems unter den beschriebenen Bedingungen unbestreitbar Erkennung von diskreten Veränderungen in Nervenzellen Aktivität.
Die Herausforderung dieser Methode liegt hauptsächlich in der chirurgischen Geschick erforderlich für erfolgreiche Vorbereitung der Maus auf bewusste Nerv Aufnahme. Aber die Investition in diese Fähigkeiten durch die Qualität und Zuverlässigkeit der direkten RSNA Daten mehr als ausgeglichen wird produziert. Dieser Ansatz umgeht völlig die Einschränkungen, die durch indirekte Bewertungen der autonome Kontrolle wie Katecholamin-Plasmaspiegel, die ziemlich labile bei Mäusen und sind durch die Menge des Blutes, die menschlich gesammelten36möglicherweise begrenzt. Darüber hinaus Plasma Katecholamin sowie pharmakologischen autonome Blockade Schätzung insgesamt autonome Ton1 im Gegensatz zu der diskreten Beiträge der spezifische Nerv Populationen, die in der Regel von größerem Interesse sind. Mathematische Auswertung der autonomen Ton über macht Spektralanalyse von Blutdruck und Herzfrequenz Spuren eignet sich für die Bewertung der autonomen Funktion an Probanden, aber dieses Verfahren möglicherweise nicht anpassungsfähig für Mäuse36,37. Daher ist direkte Probenahme von Nerven-Aktivität in eine bewusste, bequem ruhen Maus ideal, da sie eng den natürlichen, intakten autonomen Status des Subjekts spiegelt und anspruchsvolle Bewertung des Beitrags der ausgewählten Nerven erleichtert physiologische Phänomene des Interesses.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
S.M.H. unterstützte postdoctoral Fellowships der kanadischen Institute für Gesundheit Forschung (CIHR), Herz & Stroke Foundation von Kanada (HSFC) und Alberta innoviert Health Solutions (AiHS); J.E.H. wird durch einen Zuschuss aus dem National Heart, Lungen- und Blut-Institut PO1HL-51971 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Teflon-coated stainless steel multiple stranded wire | A-M Systems | 793200 | 0.001in diameter bare; 0.0055in diameter coated |
| #11 Scalpel Blade | Fisher Scientific | ALMM9011 | |
| Soldering Iron and solder | Any make or model suitable | ||
| Male miniature pin connectors | A-M Systems | 520200 | Brass with gold plating |
| Female miniature pin connectors | A-M Systems | 520100 | Brass with gold plating |
| Heat Shrink tubing | Radio Shack | Model #: 278-1610 | Catalog #: 2781610 | 1.6 mm diameter |
| Polyethylene 90 (PE90) tubing | VWR | CA-63018-703 | 0.86mm inner diameter; 1.27mm outer diameter |
| Dissecting microscope | Leica Microsystems | Leica M80 | Any make or model also suitable |
| Polyethylene 10 (PE10) tubing | Braintree Scientific | PE10 50 FT | 0.28mm inner diameter; 0.61mm outer diameter |
| Super Glue Liquid | Loctite | n/a | Liquid Formula; any brand suitable |
| Super Glue Gel | Loctite | n/a | Gel Formula; any brand suitable |
| Polyethylene tubing | Scientific Commodities | BB31695-PE/13 | For pedestal 2.7mm inner diameter; 4.0mm outer diameter |
| Hospital Sterilization Services & Ozone Sterilization packets | Contact local hospital sterilization services | ||
| Isoflurane anesthesia | Abbott | 05260-05 | |
| Deltaphase isothermal heat pads & surgical table | Braintree Scientific | 39OP | Keep heat pads warm in a 37°C water bath; Corresponding surgical table essential |
| Glycopyrrolate | Amdipharm Mercury Company Limited | n/a | |
| Isoflurane vaporizer system & flow gauge | Braintree Scientific | VP I | Include medical grade oxygen supply |
| Tissue scissors | Fine Science Tools | 14173-12 | |
| Fine spring scissors | Fine Science Tools | 15006-09 | |
| Small cotton-tipped applicators | Fisher Scientific | 23400100 | |
| Fine Straight Forceps | Fine Science Tools | 11254-20 | #5, FST by Dumont Biologie Tip |
| Angled Forceps | Fine Science Tools | 11251-35 | #5/45 FST by Dumont |
| Small Absorbent Spears | Fine Science Tools | 18105-03 | |
| Parafilm | Sigma Aldrich | BR701605 ALDRICH | |
| Kwik-Sil 2 component Silicone Polymer | World Precision Instruments (WPI) | KWIK-SIL | Purchase extra specialized tips from WPI |
| 5-0 Polysorb Suture | Tyco Healthcare | n/a | |
| 6-0 Silk Suture | Braintree Scientific | SUT-S 104 | Deknatel brand, spool |
| Radiotelemetry Probe | Data Sciences International (DSI) | TA11-PAC10 | |
| Radiotelemetry Receiver | Data Sciences International (DSI) | PhysioTel RPC-1 | |
| Ambient Pressure Reference | Data Sciences International (DSI) | Apr-01 | |
| Pressure Output Adapter | Data Sciences International (DSI) | R11CPA | |
| Rena Pulse Tubing | Braintree Scientific | RPT-040 | |
| Infusion Swivel | Instech Solomon | 375/D/22 | |
| Swivel Support Arm & Mount | Instech Solomon | SMCLA | |
| Polysulfone button | Instech Solomon | LW62S/6 | |
| Stainless steel spring | Instech Solomon | PS62 | |
| Vetbond surgical adhesive | 3M | n/a | |
| Triple Antibiotic Ointment | Fougera | n/a | |
| PowerLab 8 Channel Data Acquisition System & Software | ADInstruments | PowerLab 8/35 | |
| PVC Insulated Cable | Belden | PVC Audio Connection Cable 32 AWG | |
| Preamplification Headstage | Dagan Corporation | Model 4002 | |
| Differential Amplifier | Dagan Corporation | EX4-400 | |
| Sodium Nitroprusside | Sigma Aldrich | 71778-25G | |
| Phenylephrine | Sigma Aldrich | P6126-5G | |
| Sterile Physiological Saline 0.9% NaCl | Beckton Dickinson | Contact local hospital supplier | |
| hexamethonium | Sigma Aldrich | H0879-5G | |
| Stainless Steel top anti vibration table | n/a | n/a | Custom designed in-house; Solid steel plate on a benchtop is also suitable |
| Faraday cage | n/a | n/a | Custom designed and constructed in-house |
| Small animal hair trimmer | n/a | n/a | Drugstore, men's beard trimmer suitable |
| Dipilatory Cream | n/a | n/a | Veet brand, sensitive skin formula |
| 10% Povidone Iodine | Purdue Products | Betadiene | |
| 70% Ethanol | n/a | n/a | |
| Steel microretractors | n/a | n/a | Made in-house. Bend a steel paper clip & loop 4-0 silk to form a retractor |
| Hemostats | Fine Science Tools | 13011-12 | |
| Heat Gun | Fisher Scientific | 09-201-27 |
Referenzen
- Young, C. N., Davisson, R. L. In vivo assessment of neurocardiovascular regulation in the mouse: principles, progress, and prospects. Am J Physiol Heart Circ Physiol. 301 (3), H654-H662 (2011).
- Kass, D. A., Hare, J. M., Georgakopoulos, D. Murine cardiac function: a cautionary tail. Circ Res. 82 (4), 519-522 (1998).
- Charkoudian, N., Wallin, B. G. Sympathetic neural activity to the cardiovascular system: integrator of systemic physiology and interindividual characteristics. Compr Physiol. 4 (2), 825-850 (2014).
- Guyenet, P. G. The sympathetic control of blood pressure. Nat Rev Neurosci. 7 (5), 335-346 (2006).
- Hamza, S. M., Hall, J. E. Direct recording of renal sympathetic nerve activity in unrestrained, conscious mice. Hypertension. 60 (3), 856-864 (2012).
- DeBeck, L. D., Petersen, S. R., Jones, K. E., Stickland, M. K. Heart rate variability and muscle sympathetic nerve activity response to acute stress: the effect of breathing. Am J Physiol Regul Integr Comp Physiol. 299 (1), R80-R91 (2010).
- Krowicki, Z. K., Kapusta, D. R. Microinjection of glycine into the hypothalamic paraventricular nucleus produces diuresis, natriuresis, and inhibition of central sympathetic outflow. J Pharmacol Exp Ther. 337 (1), 247-255 (2011).
- do Carmo, J. M., et al. Control of blood pressure, appetite, and glucose by leptin in mice lacking leptin receptors in proopiomelanocortin neurons. Hypertension. 57 (5), 918-926 (2011).
- Brockway, B. P., Mills, P. A., Azar, S. H. A new method for continuous chronic measurement and recording of blood pressure, heart rate and activity in the rat via radio-telemetry. Clin Exp Hypertens A. 13 (5), 885-895 (1991).
- Tallam, L. S., Silva, da, A, A., Hall, J. E. Melanocortin-4 receptor mediates chronic cardiovascular and metabolic actions of leptin. Hypertension. 48 (1), 58-64 (2006).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J Pharmacol Toxicol Methods. 44 (2), 361-373 (2000).
- Zvara, P., et al. A non-anesthetized mouse model for recording sensory urinary bladder activity. Front Neurol. 1, 127(2010).
- Hagan, K. P., Bell, L. B., Mittelstadt, S. W., Clifford, P. S. Effect of dynamic exercise on renal sympathetic nerve activity in conscious rabbits. J Appl Physiol. 74 (5), 2099-2104 (1985).
- Matsukawa, K., Ninomiya, I. Changes in renal sympathetic nerve activity, heart rate and arterial blood pressure associated with eating in cats. J Physiol. 390, 229-242 (1987).
- Stocker, S. D., Muntzel, M. S. Recording sympathetic nerve activity chronically in rats: surgery techniques, assessment of nerve activity, and quantification. Am J Physiol Heart Circ Physiol. 305 (10), 6(2013).
- Burke, S. L., Lambert, E., Head, G. A. New approaches to quantifying sympathetic nerve activity. Curr Hypertens Rep. 13 (3), 249-257 (2011).
- Smith, F. G. Techniques for recording renal sympathetic nerve activity in awake, freely moving animals. Methods. 30 (2), 122-126 (2003).
- Miki, K., Kosho, A., Hayashida, Y. Method for continuous measurements of renal sympathetic nerve activity and cardiovascular function during exercise in rats. Exp Physiol. 87 (1), 33-39 (2002).
- Yoshimoto, M., Miki, K. Measurement of renal sympathetic nerve activity in freely moving mice. J Physiol. 560, (2004).
- Yoshimoto, M., Miki, K., Fink, G. D., King, A., Osborn, J. W. Chronic angiotensin II infusion causes differential responses in regional sympathetic nerve activity in rats. Hypertension. 55 (3), 644-651 (2010).
- Salman, I. M., Sarma Kandukuri,, Harrison, D., L, J., Hildreth, C. M., Phillips, J. K. Direct conscious telemetry recordings demonstrate increased renal sympathetic nerve activity in rats with chronic kidney disease. Front Physiol. 6, 218(2015).
- Morgan, D. A., Despas, F., Rahmouni, K. Effects of leptin on sympathetic nerve activity in conscious mice. Physiol Rep. 3 (9), (2015).
- Alfie, M. E., Sigmon, D. H., Pomposiello, S. I., Carretero, O. A. Effect of high salt intake in mutant mice lacking bradykinin-B2 receptors. Hypertension. 29 (1 Pt 2), 483-487 (1997).
- Dietz, J. R., Landon, C. S., Nazian, S. J., Vesely, D. L., Gower, W. R. Effects of cardiac hormones on arterial pressure and sodium excretion in NPRA knockout mice. Exp Biol Med (Maywood). 229 (8), 813-818 (2004).
- Zhang, W., et al. Cyclosporine A-induced hypertension involves synapsin in renal sensory nerve endings. Proc Natl Acad Sci U S A. 97 (17), 9765-9770 (2000).
- Szczesny, G., Veihelmann, A., Massberg, S., Nolte, D., Messmer, K. Long-term anaesthesia using inhalatory isoflurane in different strains of mice-the haemodynamic effects. Lab Anim. 38 (1), 64-69 (2004).
- Tank, J., et al. Sympathetic nerve traffic and circulating norepinephrine levels in RGS2-deficient mice. Auton Neurosci. 136 (1-2), 52-57 (2007).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Zuurbier, C. J., Emons, V. M., Ince, C. Hemodynamics of anesthetized ventilated mouse models: aspects of anesthetics, fluid support, and strain. Am J Physiol Heart Circ Physiol. 282 (6), H2099-H2105 (2002).
- Farnham, M. M., O'Connor, E. T., Wilson, R. J., Pilowsky, P. M. Surgical preparation of mice for recording cardiorespiratory parameters in vivo. J Neurosci Methods. 248, 41-45 (2015).
- Cuellar, J. M., Antognini, J. F., Carstens, E. An in vivo method for recording single unit activity in lumbar spinal cord in mice anesthetized with a volatile anesthetic. Brain Res Brain Res Protoc. 13 (2), 126-134 (2004).
- Carruba, M. O., Bondiolotti, G., Picotti, G. B., Catteruccia, N., Da Prada, M. Effects of diethyl ether, halothane, ketamine and urethane on sympathetic activity in the rat. Eur J Pharmacol. 134 (1), 15-24 (1987).
- Wang, G. F., Mao, X. J., Chen, Z. J. Urethane suppresses renal sympathetic nerve activity in Wistar rats. Eur Rev Med Pharmacol Sci. 18 (10), 1454-1457 (2014).
- Xu, H., et al. Effects of induced hypothermia on renal sympathetic nerve activity and baroreceptor reflex in urethane-anesthetized rabbits. Crit Care Med. 28 (12), 3854-3860 (2000).
- Shimokawa, A., Kunitake, T., Takasaki, M., Kannan, H. Differential effects of anesthetics on sympathetic nerve activity and arterial baroreceptor reflex in chronically instrumented rats. J Auton Nerv Syst. 72 (1), 46-54 (1998).
- Janssen, B. J., Smits, J. F. Autonomic control of blood pressure in mice: basic physiology and effects of genetic modification. Am J Physiol Regul Integr Comp Physiol. 282 (6), R1545-R1564 (2002).
- Nunn, N., Feetham, C. H., Martin, J., Barrett-Jolley, R., Plagge, A. Elevated blood pressure, heart rate and body temperature in mice lacking the XLalphas protein of the Gnas locus is due to increased sympathetic tone. Exp Physiol. 98 (10), 1432-1445 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten