Method Article
Adultos Mouse hipertensión venosa: Modelo: arteria carótida común a la vena yugular externa anastomosis.
En este artículo
Resumen
Se describe un método para crear un modelo fiable de la hipertensión venosa cerebral en el ratón adulto. Este modelo ha sido ampliamente descrito y probado en la rata. Este nuevo homólogo en los ratones se abre la posibilidad de utilizar animales modificados genéticos y por lo tanto amplía las aplicaciones del modelo.
Resumen
La comprensión de la fisiopatología de las malformaciones arteriovenosas cerebrales y fístulas arteriovenosas ha mejorado gracias a los modelos animales. Un modelo de rata creación de una fístula artificial entre la arteria carótida común (CCA) y la vena yugular externa (VYE) ha sido ampliamente descrito y demostrado técnicamente factible. Esta construcción provoca una hipertensión venosa cerebral consistente (CVH), y por lo tanto ha ayudado a estudiar la contribución de la hipertensión venosa a la formación, los síntomas clínicos y el pronóstico de MAV cerebrales y FAV durales. Modelos de ratones equivalentes sólo se han descrito y apenas han mostrado problemas con estenosis de la fístula. Un modelo murino establecido permitiría el estudio de la fisiopatología no sólo, sino también las terapias genéticas potenciales para estas enfermedades cerebrovasculares.
Se presenta un modelo de la fístula arteriovenosa que produce una hipertensión venosa intracraneal duradera en el ratón. Microquirúrgica anastomosis of murino CCA y VYE puede ser difícil debido a la anatomía diminuta y con frecuencia resultará en una fístula no patente. En este protocolo paso a paso nos dirigimos a todos los importantes desafíos encontrados durante este procedimiento. Evitar la retracción excesiva de la vena durante la exposición, usando 11-0 suturas en lugar de 10-0, y hacer una anastomosis término-lateral cuidadosamente planificada son algunos de los pasos críticos. Aunque este método requiere conocimientos avanzados de microcirugía y una curva de aprendizaje ya que el equivalente en la rata, que se puede desarrollar de forma coherente.
Este nuevo modelo ha sido diseñado para integrar las técnicas de ratones transgénicos con un sistema experimental previamente establecida que ha demostrado ser útil para estudiar las malformaciones arteriovenosas cerebrales y FAV durales. Al abrir la posibilidad de usar ratones transgénicos, un espectro más amplio de modelos válidos se puede lograr y tratamientos genéticos también puede ser probado. El constructo experimental también podría ser adaptado además para el estudio de otsus enfermedades cerebrovasculares relacionados con la hipertensión venosa como la migraña, la amnesia global transitoria, ceguera monocular transitoria, etc.
Introducción
Los modelos animales de hipertensión venosa cerebral han demostrado ser una herramienta clave en la comprensión de la fisiopatología de las malformaciones arteriovenosas cerebrales y fístulas arteriovenosas 1-7. El más utilizado es el modelo de rata creado a través de una fístula artificial entre la arteria carótida común (CCA) y la vena yugular externa (VYE), lo que provoca una hipertensión venosa cerebral consistente (CVH) en la rata 1,8-10. Modelos de ratones equivalentes, abriendo la posibilidad de utilizar diferentes cepas de ratones transgénicos, permitirían un estudio más en no sólo fisiopatología sino también potenciales terapias genéticas para estas enfermedades cerebrovasculares. Además, la construcción experimental también podría ser adaptado además para el estudio de otras enfermedades cerebrovasculares relacionadas con la hipertensión venosa como la migraña, amnesia global transitoria, ceguera monocular transitoria, etc. 11 Sin embargo, los intentos anteriores para construir estos modelos de ratones have demostró las dificultades con la permeabilidad de la fístula debido a la anatomía diminutivo 5,12. A continuación, describimos nuestro protocolo paso a paso para una anastomosis exitosa de la murino CCA y VYE que se traduce en una fístula patente a largo plazo y una hipertensión venosa durable en el ratón.
Protocolo
1. Preparación del ratón
- Inducir la anestesia general en el ratón con el gas isoflurano. Inyectar 0,15 ml de brupenorphine intraperitoneal para el tratamiento del dolor. Antes de continuar, compruebe si el nivel de anestesia es satisfactoria pinchando patas del ratón.
- Ponga el mouse en decúbito dorsal con las cuatro extremidades fijados por cinta adhesiva. Quitar el pelo del cuello y la parte superior del pecho con unas tijeras. A través de inyección subcutánea, administrar 0,2-0,4 ml de 0,9% de solución salina para mantener el ratón hidratado durante el procedimiento quirúrgico.
- Preparar el campo operatorio después de un estricto método estéril. El área de la incisión de la piel se debe limpiar con un 90% de alcohol.
2. La disección de la arteria carótida común y la vena yugular externa
- Haga una línea media incisión cervical horizontal a través de la zona del cuello inferior del ratón. Después de la profundización de la herida, elevar las glándulas salivales y el tejido blando cervical utilizando por losutura raction (Figura 1). Exponer la vena yugular externa derecha (VYE) lateral al músculo esternocleidomastoideo (ECM). Este paso se debe realizar bajo el microscopio, ya que la tracción excesiva sobre la vena podría dañarlo y provocar su trombosis.
- Diseccionar cuidadosamente la VYE derecha a lo largo de su curso desde la clavícula hasta la base del cráneo. Por lo general, pinza bipolar eléctricos, se coagulan y se dividen las ramas para preparar una longitud adecuada para la posterior colocación de clip temporal y anastomosis.
- Lateral a la tráquea y medial al SMC, explorar la arteria carótida común (CCA). Se debe ser cuidadosamente expuesta desde la clavícula hasta más allá de su bifurcación en las arterias carótidas externa e interna. Durante esta etapa, se debe prestar atención de nuevo para evitar la tracción excesiva a la VYE que luego pudiera comprometer la permeabilidad de la anastomosis.
3. Preparación de la anastomosis
- Ligar la CCA con 10-0 Nylon justo proximal a su bifurcación. A continuación, aplicar un clip temporal sobre el proximal CCA tan cerca de la clavícula como sea posible.
- Una vez que el flujo ha sido interrumpido, seccionar la arteria justo debajo de la ligadura de bifurcación y regar con solución salina para lavar cualquier resto de la sangre en el interior del lumen. Evitar la coagulación bipolar en este paso, desde la lesión térmica a la pared de la arteria podría poner la anastomosis futuro en peligro.
- A fin de mejorar la visibilidad de los bordes de la VYE, la pared medial está marcado con un marcador azul a lo largo del curso de la venotomía planeado. Una vez que el VYE está marcado, utilizar una sutura 10-0 para ligar el extremo distal como caudal como sea posible y aplicar un clip vascular temporal en el extremo proximal como craneal como sea posible.
- Con una fina aguja 30 G y 0,5 ml de la jeringa, hacer una abertura inicial a lo largo de la zona marcada de la VYE e inmediatamente irrigar el lumen con solución salina para evitar la formación de trombos. A continuación, extender el venotomía con las microtijerashasta que la longitud es de aproximadamente 2-3 veces el diámetro de la CCA. Evite violento estiramiento y prestar atención a mantener un filo agudo y ordenada.
- Aproximar el final de la CCA a la VYE. Hacer una incisión de corte lateral en el extremo donante de la CCA para ajustar el diámetro a la longitud al tamaño de venotomía (Figura 2).
4. De extremo a lado anastomosis
- Utilice una sutura de nylon 11-0 monofilamento para la anastomosis-CCA-a VYE de extremo a lateral. La sutura de la pared medial de la anastomosis en una dirección cráneo-caudal es el paso inicial. Cada puntada debe ser colocado desde fuera en la pared venosa primera (Figura 3) y desde dentro hacia fuera de la pared arterial (Figura 4) siguiente. Esto mantendrá el nudo en la superficie exterior de los vasos anastomóticos en todo momento (Figura 5). De cualquier interrumpidos o suturas continuas pueden ser utilizados, pero todas las suturas continuas deben ser apretados como el paso final.
- Ona vez que la pared medial ha sido suturada, repita el procedimiento a partir del caudal a craneal con la pared lateral. Ahora cada puntada debe ser colocado desde fuera en la pared arterial primero y desde dentro hacia fuera de la pared venosa siguiente. La irrigación salina ayudará a mantener el lumen de la anastomosis visible en todo momento durante el procedimiento.
- Después de terminar todos los pasos de la anastomosis, retire el clip temporal de la vena de primera y de la arteria siguiente. La sangre arterial fluirá en el VYE con poca o ninguna supuración de la anastomosis (ver vídeos modelo VH y el modelo VH 2). El sangrado mínimo debe dejar sin utilizar compresión de algodón sobre la anastomosis. Esto debe evitarse con el fin de prevenir la trombosis de la vena delicada.
- Una vez que el flujo pulsátil a través de la anastomosis se confirma y se observa ningún sangrado aparente, irrigar el campo quirúrgico con solución salina y cerrar la incisión cervical con una sutura de nylon 6-0. Finalmente, administrar 0,15 ml más de intrapbrupenorphine eritoneal para el manejo del dolor postoperatorio y 0,2-0,4 ml de 0,9% de solución salina subcutánea para reponer cualquier pérdida de sangre durante la cirugía.
Resultados
Un resultado positivo de la modelo es una fístula arteriovenosa patente que induce hipertensión venosa en el cerebro murino. Para validar el modelo que inicialmente midió la presión venosa intracraneal en el seno sagital de los ratones a los 2, 3 y 4 semanas después de la cirugía. 6 ratones diferentes fueron asignados a cada grupo de tiempo. La presión en los senos fue de 8,8 ± 1,2 mmHg en el grupo midieron dos semanas después de la cirugía. En los 6 ratones medidos 3 semanas después de la cirugía, la presión en los senos fue de 4,7 ± 1,4 mmHg. Por último, los 6 ratones medido 4 semanas después de la cirugía tuvo una presión en los senos de 3,9 ± 0,6 mmHg (Figura 6). Postoperatoria presión en los senos 2 semanas fue significativamente mayor que la presión del seno a las 3 y 4 semanas (ambos p <0,001).
Sin embargo, la técnica compleja requerida para medir la presión en los senos no es necesario para asegurar la permeabilidad de la fístula y la hipertensión venosa sobre una base regular. En lugar de ello, el resultado deseado puede ser checked por inspección directa de la fístula y por signos clínicos de hipertensión venosa en el ratón.
La permeabilidad de la fístula se puede inspeccionar directamente al final del procedimiento quirúrgico por dos métodos. La primera de ellas consiste en la obstrucción temporal del cráneo VYE al área anastomsis con pinzas de joyero. Este punto es ahora la única salida de la sangre que sale de la CCA. Si la anastomosis de extremo a lado es patente, el distensible VYE hinchará inmediatamente como se muestra en la prueba de vídeo permeabilidad 1. El segundo método se realiza mediante la oclusión de la vena distal del injerto a la anastomosis y lentamente vaciado o "ordeñar" se con un par de pinzas de joyero. Como se muestra en el segundo video de prueba de permeabilidad, una vez que se libera la oclusión, una anastomosis de patentes debe rellenar rápidamente el segmento de vaciado.
Si el modelo está trabajando, la ampliación del ojo del ratón Cabe señalar 24 hr después de la cirugía. Esta may ser debido a drenaje venoso compuesto de la cabeza y el cuello. Aunque ambos ojos se ampliada después de la cirugía, el fenómeno es más prominente en el lado operado como se puede observar en la Figura 7.

Figura 1:. Incisión de la piel Una línea media incisión cervical horizontal a través de la zona del cuello inferior del ratón y una tracción suave de las glándulas salivales expone la vena yugular externa derecha (VYE). Tenga en cuenta la localización superficial de la VYE que merece una incisión en la piel cuidado para evitar cualquier daño a la vena delicada.
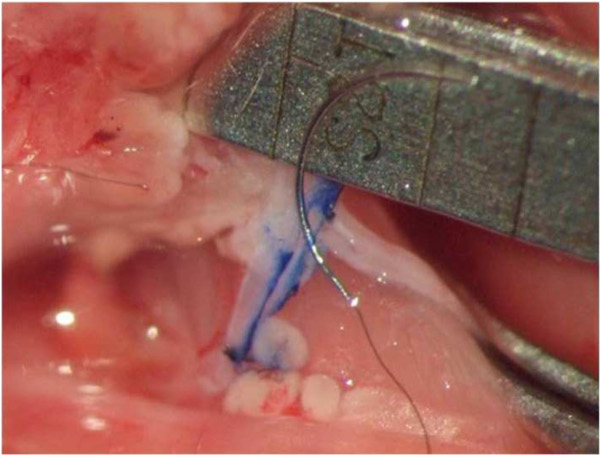
Figura 2:. Preparación de la anastomosis La pared medial de la VYE ha sido marcado con una línea azul a lo largo del curso de la venotomía planeado. A inci lado de corteSion en el extremo donante de la CCA se realiza para ajustar el diámetro de la arteria de la longitud a la venotomía.

Figura 3:. Fuera en la pared medial de la anastomosis está siendo suturado en una dirección cráneo-caudal con el 11-0 puntada primera colocado desde fuera en la pared venosa.

Figura 4:.-Dentro de la aguja es conducido aquí desde dentro hacia fuera de la pared arterial para completar una sutura en la pared medial de la manera apropiada para evitar que el nudo en la superficie exterior de la anastomosis.
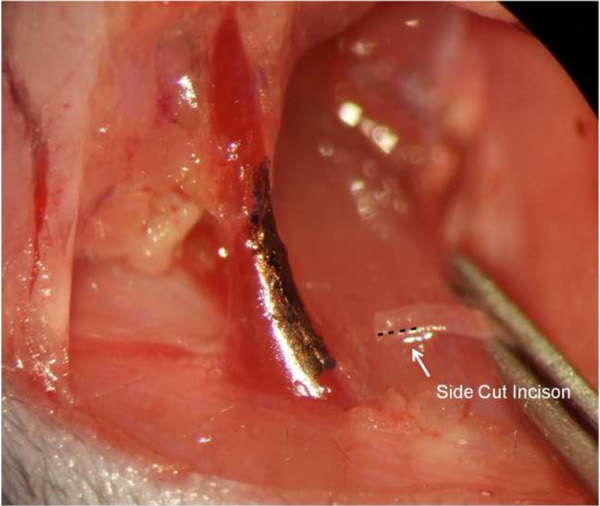
Figura 5: Mantener el nudo fuera Nota ho.w el nudo de la sutura interrumpida elegido en este caso permanece fuera del lumen de los vasos para evitar la formación de trombos que ocluir la fístula.
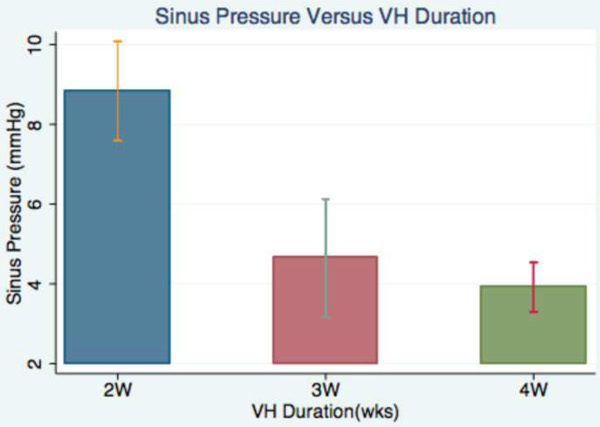
Figura 6:. Análisis de la presión Sinus Esta tabla Bart muestra gráficamente la diferencia en la presión intracraneal sinusal se mide en mm de Hg a 2, 3 y 4 semanas después de la cirugía.
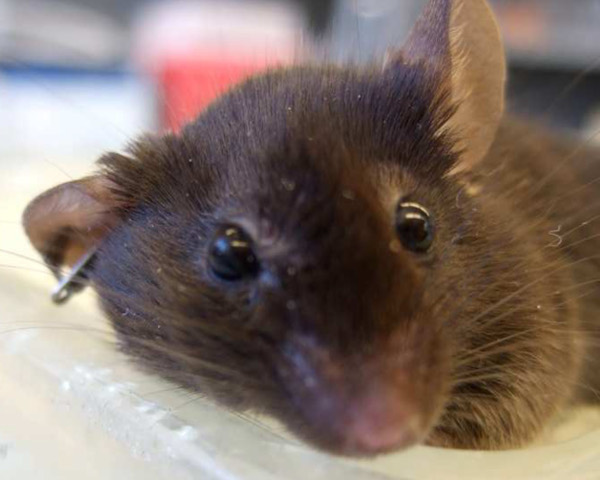
Figura 7:. Proptosis Un día después de la cirugía, ambos ojos se agrandan, pero la ampliación ojo derecho (ipsilateral a la cirugía) es más prominente.
Discusión
La hipertensión venosa cerebral sostenida ha estado estrechamente relacionada con las manifestaciones clínicas más graves y mal pronóstico en pacientes con FAV durales y MAV cerebrales 3. Estos efectos de la CVH han sido ampliamente estudiado en modelos de rata 1,2,8. Un modelo equivalente en el ratón permitiría el uso de animales modificados genéticamente que en última instancia permitir que el análisis de las vías moleculares implicados en la patogénesis de la hipertensión venosa y su relación con AVF dural y AVM cerebral.
Aquí, se presenta un método para crear la hipertensión venosa cerebral en el ratón adulto a través de una fístula carotídeo-yugular de extremo a lateral. Este nuevo modelo mejora los modelos fístula carótida-yugular bien descritos en la rata mediante la traducción al ratón y permitiendo de este modo la posibilidad mencionada anteriormente de la investigación de vías moleculares y terapias de genes.
Problemas comunes encontrados y Sugerencias
La anastomosis CCA-a-VYE de extremo a extremo para los ratones es relativamente difícil debido al diminuto tamaño y la fragilidad de los vasos afectados. El diámetro de la VYE es de aproximadamente 2 mm y el diámetro de la CCA es de unos 0,6 mm. El uso de los instrumentos y las suturas adecuadas es un punto crítico para lograr un modelo de éxito. Utilizamos número 55 fórceps como un soporte de aguja en una mano y como un fórceps para manejar los tejidos en el otro. Estas pinzas delicadas consiguen a menudo sus puntas dañadas y pueden dañar las paredes de los buques a causa de ella. Esto puede ser fácilmente evitado por ver bajo el microscopio los consejos de todos los micro-instrumentos antes de cada procedimiento. La sutura es igualmente importante. La anastomosis debe realizarse con 11-0 suturas (AROS Micro sutura, Aurosurgical, Newport Beach, CA, USA). Los intentos utilizando 10-0 resultaron en un sangrado excesivo del sitio de anastomosis o daños a las paredes de los vasos que pueden promover la formación de trombos.Otro pro comúnblema está dañando la vena con una tracción excesiva, la compresión, o disección a lo largo de su curso. Por lo tanto, la exposición VYE debe ser cuidadosamente realizada bajo el microscopio para identificar el plano adecuado de disección. Todas las ramas pequeñas que drenan en que también se deben identificar y coagular. Esto evitará la hemorragia no controlada que requiere la compresión de la vena y proporcionará suficiente redundancia para evitar una tensión excesiva.
No es raro tener una mala función de la fístula después de quitar los clips temporales. En este caso, el primer paso debe ser buscar posibles puntos de tensión o angulación en el CCA. Además la disección de la arteria o la resección parcial del músculo esternocleidomastoideo va a resolver este problema. Sin embargo, si la función pobres continúa después de estas maniobras, se debe sospechar la trombosis de la anastomosis. En ese caso, en lugar de volver a abrir el sitio de la anastomosis y eliminar el trombo, se recomienda realizar una nuevaanastomosis craneal a la anterior. En nuestra experiencia, una tercera anastomosis es imposible. No hay suficiente longitud de la VYE y el ratón no tolera la anestesia durante un largo período de tiempo.
Limitaciones de la Técnica
Las principales limitaciones de esta técnica incluyen: (1) la anatomía diminutivo de los vasos requiere habilidades microquirúrgicas avanzadas y una curva de aprendizaje más largo que para el modelo equivalente en la rata; (2) la permeabilidad de la anastomosis es a menudo comprometida por la formación de trombos y la longitud de la VYE ratón solamente permitirá un intento adicional para resolver este problema; y (3) la cirugía puede tomar hasta tres horas, exponiendo el ratón para un período largo anestesia. Sin embargo, a raíz de las sugerencias técnicas propuestas por encima y manteniendo el ratón cálido e hidratada durante el procedimiento, una patente CCA-a-VYE puede llevar a cabo con éxito y un alto índice de supervivencia de los animales obtenidos en nuestra experiencia.
aplicaciones de la técnica
Un modelo venosa cerebral fiable y duradero hipertensión en ratones es una herramienta importante que puede servir a un amplio número de propósitos en la investigación cerebrovascular 13-16. Mediante la adición de la tecnología de octavos de final de ratones transgénicos, este nuevo modelo debería facilitar aún más la investigación relacionado con el gen in vivo para todas las patologías asociadas a la hipertensión venosa cerebral.
Anteriormente, otros autores han descrito el modelo de hipertensión venosa en la rata y lo han utilizado para estudiar la fisiopatología de la duramadre FAV y MAV cerebral 4,5,8,9. Ahora describir el método para traducir con éxito este mismo modelo para los ratones, por lo tanto, la apertura de sus posibles aplicaciones a todo tipo de pruebas de tratamiento genético.
Conclusión
Estamos aquí demostrar un protocolo para lograr una patente anastomosis CCA-a-VYE en el ratón adulto. Esta fístula ofreceuna hipertensión venosa cerebral duradero que ha sido una herramienta útil para desarrollar diferentes modelos de enfermedades cerebrovasculares en la rata. Al proporcionar este paso inicial para desarrollar esos mismos modelos en los ratones, abrimos la posibilidad de probar los tratamientos genéticos para las enfermedades cerebrovasculares.
Divulgaciones
Los procedimientos experimentales con animales de laboratorio fueron aprobados por el Comité Institucional Cuidado de Animales y el Empleo de la Universidad de California, San Francisco (UCSF).
Los autores no tienen conflictos de interés potenciales relacionados con los medicamentos y materiales utilizados en este procedimiento.
Agradecimientos
Este proyecto está parcialmente financiado por el NIH T32 GM008440 a Espen Walker, R01 NS27713 a William L.Young, P01 NS44155 a William L.Young y Hua Su, R21 NS070153 a Hua SU y por la Asociación Americana del Corazón AHA 10GRNT3130004 a Hua Su. Dr. Ana Rodríguez-Hernández es apoyado por una beca de "la Obra Social La Caixa"
Materiales
| Name | Company | Catalog Number | Comments |
| 10-0 Sterile Microsuture | Arosurgical Ic. | VT5A010Q10 | |
| 11-0 Sterile Microsuture | Arosurgical Ic | VT4A00N07 | |
| DUROTIP Scissors | Aesculap | BC210R | |
| Micro-Adson Tissue Forceps | Aesculap | BD510R | |
| Microscissors | Aesculap | OC496R | |
| Micro Forceps #5 Jewelers | Aesculap | BD331R | |
| Angled Jewelers Forceps | Aesculap | BD329R | |
| Micro Suture Forceps | Aesculap | BD338R | |
| DUROGRIP Needle Holder | Aesculap | BM009R |
Referencias
- Bederson, J. B., Wiestler, O. D., Brüstle, O., Roth, P., Frick, R., Yaşargil, M. G. Intracranial venous hypertension and the effects of venous outflow obstruction in a rat model of arteriovenous fistula. Neurosurgery. 29, 341-350 (1991).
- Gao, P., Zhu, Y., Ling, F., Shen, F., Lee, B., Gabriel, R. A., Hao, Q., Yang, G. Y., Su, H., Young, W. L. Nonischemic cerebral venous hypertension promotes a pro-angiogenic stage through HIF-1 downstream genes and leukocyte-derived MMP-9. J. Cereb. Blood Flow Metab. 29, 1482-1490 (2009).
- Kim, H., Su, H., Weinsheimer, S., Pawlikowska, L., Brain Young, W. L. arteriovenous malformation pathogenesis: a response-to-injury paradigm. Acta Neurochir. Suppl. 111, 83-92 (2011).
- Lawton, M. T., Arnold, C. M., Kim, Y. J., Bogarin, E. A., Stewart, C. L., Wulfstat, A. A., Derugin, N., Deen, D., Young, W. L. Radiation arteriopathy in the transgenic arteriovenous fistula model. Neurosurgery. 62, 1129-1138 (2008).
- Lawton, M. T., Stewart, C. L., Wulfstat, A. A., Derugin, N., Hashimoto, T., Young, W. L. The transgenic arteriovenous fistula in the rat: an experimental model of gene therapy for brain arteriovenous malformations. Neurosurgery. 54, 1463-1471 (2004).
- Schaller, B., Graf, R., Sanada, Y., Tolnay, M., Rosner, G., Wienhard, K., Heiss, W., D, Hemodynamic changes after occlusion of the posterior superior sagittal sinus: an experimental PET study in cats. AJNR Am J Neuroradiol. 24, 1876-1880 (2003).
- Zhu, Y., Lawton, M. T., Du, R., Shwe, Y., Chen, Y., Shen, F., Young, W. L., Yang, G. Y. Expression of hypoxia-inducible factor-1 and vascular endothelial growth factor in response to venous hypertension. Neurosurgery. 59, 687-696 (2006).
- Herman, J. M., Spetzler, R. F., Bederson, J. B., Kurbat, J. M., Zabramski, J. M. Genesis of a dural arteriovenous malformation in a rat model. J. Neurosurg. 83, 539-545 (1995).
- Terada, T., Higashida, R. T., Halbach, V. V., Dowd, C. F., Tsuura, M., Komai, N., Wilson, C. B., Hieshima, G. B. Development of acquired arteriovenous fistulas in rats due to venous hypertension. J. Neurosurg. 80, 884-889 (1994).
- Yassari, R., Sayama, T., Jahromi, B. S., Aihara, Y., Stoodley, M., Macdonald, R. L. Angiographic, hemodynamic and histological characterization of an arteriovenous fistula in rats. Acta Neurochir (Wien). 146, 495-504 (2004).
- Solheim, O., Skeidsvoll, T. Transient global amnesia may be caused by cerebral vein thrombosis. Med. Hypotheses. 65, 1142-1149 (2005).
- Yang, B., Shergill, U., Fu, A. A., Knudsen, B., Misra, S. The mouse arteriovenous fistula model. J Vasc Interv Radiol. 20, 946-950 (2009).
- Choi, E. J., Choi, E. J., Walker, E. J., Shen, F., Oh, S. P., Arthur, H. M., Young, W. L., Su, H. Minimal Homozygous Endothelial Deletion of Eng with VEGF Stimulation Is Sufficient to Cause Cerebrovascular Dysplasia in the Adult Mouse. Cerebrovascular diseases. 33, 540-547 (2012).
- Hao, Q., Su, H., Marchuk, D. A., Rola, R., Wang, Y., Liu, W., Young, W. L., Yang, G. Y. Increased tissue perfusion promotes capillary dysplasia in the ALK1-deficient mouse brain following VEGF stimulation. Am. J. Physiol. Heart Circ. Physiol. 295, H2250-H2256 (2008).
- Su, H., Hao, Q., Shen, F., Zhu, Y., Lee, C. Z., Young, W. L., Yang, G. Y. Development of a cerebral microvascular dysplasia model in rodents. Acta Neurochir. Suppl. 105, 185-189 (2008).
- Walker, E. J., Su, H., Shen, F., Degos, V., Jun, K., Young, W. L. Bevacizumab Attenuates VEGF-Induced Angiogenesis and Vascular Malformations in the Adult Mouse Brain. Stroke; a journal of cerebral circulation. , (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados