Method Article
Un modelo de ratón inducida por láser de la hipertensión ocular crónica a Caracterizar los defectos visibles
En este artículo
Resumen
Hipertensión ocular crónica se induce mediante fotocoagulación con láser de la malla trabecular en los ojos de ratón. La presión intraocular (PIO) es elevada durante varios meses después del tratamiento con láser. La disminución de la agudeza visual y la sensibilidad al contraste de los animales experimentales se vigila por medio de la prueba de optomotor.
Resumen
El glaucoma, con frecuencia asociado con la presión intraocular (PIO) elevada, es una de las principales causas de ceguera. Se pretende establecer un modelo de ratón de la hipertensión ocular para imitar glaucoma alta tensión humana. Aquí iluminación láser se aplica al limbo corneal para fotocoagular la salida del humor acuoso, la inducción de ángulo cerrado. Los cambios en la PIO se controlan usando un tonómetro de rebote antes y después del tratamiento con láser. Un ensayo de comportamiento optomotor se utiliza para medir los cambios correspondientes en la capacidad visual. Se muestra el resultado representativo de un ratón que desarrolla PIO elevación sostenida después de la iluminación láser. Una disminución de la agudeza visual y la sensibilidad al contraste se observa en este ocular ratón hipertensiva. Juntos, nuestro estudio introduce un sistema modelo valioso para investigar la degeneración neuronal y los mecanismos moleculares subyacentes en ratones glaucomatosos.
Protocolo
Procedimientos
C57BL/6J ratones (Jackson Laboratory, Bar Harbor, ME) se crían en la Instalación de Cuidado de Animales de la Universidad de Northwestern. Todos los animales se utilizan de acuerdo con los protocolos aprobados por la Universidad de Northwestern Institucional Cuidado de Animales y el empleo Comisión y conforme a las directrices sobre el uso de animales en Investigación de Neurociencia de la NIH.
1. La fotocoagulación con láser
El procedimiento de fotocoagulación con láser es una modificación de los protocolos previamente publicados 5-7.
- Anestesiar a un ratón viejo 40-60 días por una inyección intraperitoneal de ketamina (100 mg / kg, Butler Schein Animal Health, OH) y xilazina (10 mg / kg, Lloyd Inc. de Iowa, Shenandoah, IA).
- Dilatar la pupila del ojo derecho del animal experimental por el tratamiento tópico con una o dos gotas de solución de sulfato de atropina 1% (Alcon Laboratorios, Inc., Fort Worth, TX).
- Después midriasis, aplanar la unacámara de nterior para mejorar la inducción láser 6. Inserte una micropipeta de vidrio con punta afilada (World Precision Instruments Inc., Sarasota, FL) en el espacio anterior bajo la lámpara de hendidura (SL-3E, Topcon, Oakland, NJ) para drenar el fluido en la cámara anterior.
- Restringir el ratón en un soporte de cono de plástico (Braintree Sci Inc., MA) y atado en una plataforma hecha en casa (Ver Figura 1). Mantenga el ratón con inmovilización y expone el ojo derecho del ratón para la fuente de luz detrás de la lámpara de hendidura. Alinear el ojo derecho del ratón anestesiado bajo la lámpara de hendidura.
- Mientras sostiene el retenedor de ratón con las dos manos, aplicar la iluminación láser para el limbo corneal utilizando un láser de argón (Ultima 2000SE, coherente, Santa Clara, CA). Entregar aproximadamente 80-100 puntos de láser (514 nm, 100 mW, 50 ms de pulso, y 200 micras punto) perpendicularmente alrededor de la circunferencia de la malla trabecular. Los ratones C57BL / 6 tienen iris pigmentada que sirve como una barrera para cualquier potencial energía perdida 7.
- Inculcar tópica 0,5% moxifloxacino (Alcon Labs, Inc., Fort Worth, TX) en la superficie ocular para desinfectar el área tratada con láser y el 0,5% Proparacaine (Bausch & Lomb, Rochester, NY) para aliviar el dolor.
- Mantenga al animal en una almohadilla eléctrica (Sunbeam Products Inc, Boca Raton, FL) para la recuperación durante aproximadamente una hora hasta que esté completamente despierto.
- El ojo izquierdo es sin tratar para servir como un control.
2. Las mediciones de PIO
- Coloque el ratón despierto en un tubo de carga en el soporte de cono de plástico y luego siente en la plataforma (véase la Figura 2A).
- Espere cinco a diez minutos para dejar que el ratón consigue adaptarse a la posición de soporte. Acérquese al tonómetro de rebote (TonoLab, Colonial Medical Supply, Franconia, NH) en el ojo del ratón hasta que la punta de la sonda es de 2 a 3 mm de la superficie de la córnea 14.
- Presione el botón de medición para que la punta de la sonda alcanzó la superficie centralde la córnea suavemente. Tres series consecutivas de seis mediciones de PIO del mismo ojo se adquieren y se promediaron como el IOP del ojo. El ojo control no tratado se mide siempre primero para conseguir una lectura de referencia para el ojo tratado con láser que se mide a continuación.
3. Prueba optomotor
La agudeza visual y la sensibilidad al contraste se prueban 14,15. Los dos ojos de ratones individuales se examinan por separado mediante la inversión de la dirección de rejilla a la deriva, es decir, una rejilla de la deriva las agujas del reloj se utiliza para identificar la función visual del ojo izquierdo y una rejilla a la deriva en sentido antihorario para el ojo derecho 16. Cada prueba dura aproximadamente 15 minutos y se repite por dos observadores de forma independiente.
- Coloque el ratón y dejar que el ratón se mueva libremente sobre una plataforma elevada rodeada por cuatro monitores de ordenador (Figura 3A-B).
- Configurar los monitores para que se muestren a la deriva horizontal sinusoidalrejillas como estímulos visuales con luminancia media de 39 cd / m 2. La dirección de movimiento de la rejilla debe alternar consecutivamente entre las agujas del reloj y en sentido contrario.
- Analizar los movimientos del animal. Los movimientos de los animales en-concierto con las rejillas de la deriva se consideran "positivo" dentro de 15 segundos después de que el estímulo visual está encendido y luego se aumenta gradualmente. La respuesta más alta inductora de estímulo visual se define como la agudeza visual del animal 17.
- Examine la sensibilidad al contraste en tres frecuencias preseleccionadas espaciales: 0,075, 0,16 y 0,3 ciclos por grado (cpd). El umbral de contraste para cada ojo se define como el contraste más bajo que provoca respuestas visuales a la frecuencia prefijada. La sensibilidad al contraste es el recíproco del umbral 17.
Resultados
Como se describe en los Procedimientos, iluminación con láser está dirigido a la malla trabecular en la región limbar a fotocoagular la salida del humor acuoso, la inducción de ángulo cerrado (Figura 1). La mayoría de los ojos lasered mostraron ningún daño físico significativo, desprendimiento de pigmento o infección, de acuerdo con los resultados anteriores 6. Cuando un pequeño grupo de ratones (menos del 5% de todos los animales lasered) mostraron signos físicos de daños graves, tales como pelotas desinfladas oculares graves cataratas, desprendimiento de pigmento significativa o sangrado, les sacrificados inmediatamente. Alrededor del 30% de los ojos lasered desarrollado cicatrices corneales menores, y la mayoría de ellos se recuperó dentro de 1-2 semanas después del tratamiento con láser.
Encontramos PIO elevada en casi todos los ojos tratados con láser de más de un centenar de ratones. La IOP de los animales experimentales se controlará mediante un tonómetro de rebote (Figura 2). Figura 2B muestra un ejemplo de los cambios de la IOP antes y después del tratamiento con láser. Antes del tratamiento con láser, las líneas de base de IOP de los dos ojos del ratón no mostraron ninguna diferencia: 15.7 mmHg (a la derecha) vs 14,7 mmHg (izquierda, Día 0, Figura 2B). Siete días después de-tratamiento con láser, la PIO del ojo tratada (derecha) aumentó casi 2 veces a 30,7 mm Hg, en comparación con el ojo no tratado (15,7 mmHg). La presión intraocular del ojo tratado con láser se mantuvo elevada a 26-28 mm de Hg durante aproximadamente 4 meses: a los 4 meses después del tratamiento, la PIO media de ojo tratado fue de 26 mm de Hg, significativamente mayor que la de ojo izquierdo sin tratar (16,3 mm Hg). Posteriormente, la presión intraocular del ojo tratado se redujo lentamente y alcanzó 18,7 mmHg a los 6 meses (24 semanas) después del tratamiento (ojo no tratado: 15,3 mm de Hg). Nuestros datos demuestran que la elevación de la PIO sostenida se logra durante más de 4 meses.
A continuación confirmó la pérdida de la visión mediante la prueba de optomotor (Figura 3). Las medidas de prueba optomotor aspectos de la visión espacial a través de la cabeza reflexiva-tracking movimientos. Figura 3C muestra la disminución de la agudeza visual del animal que se examinó en la Figura 2B. Antes de que el tratamiento con láser, los dos ojos mostraron una agudeza normal (izquierda: 0,375 cpd; Derecha: 0.397 cpd, Figura 3C). En dos meses después del tratamiento con láser, la agudeza visual del ojo derecho (PIO elevada) se redujo significativamente en comparación con el ojo de control izquierdo (Left: 0.45 cpd; Derecha: 0.228 cpd, Figura 3C). La agudeza de los ojos con PIO elevada se mantuvo baja a los 5-6 meses después del tratamiento con láser (Izquierda: 0.378 cpd; derecha:. 0 258 cpd, Figura 3C). Del mismo modo, se observó una sensibilidad al contraste inferior del ojo derecho con PIO elevada (Figura 3D). En dos meses después del tratamiento con láser, la sensibilidad al contraste del control ojo izquierdo fue 6,13, mientras que el ojo derecho era 1.91 a 0.075 cpd. La sensibilidad al contraste del ojo izquierdo de control fue de 5.53 y 2.67 a 0.16 y 0.3 cpd, mientras que el ojo derecho fue de 4,28 y 1.45, respectivamente (Figura 3D).
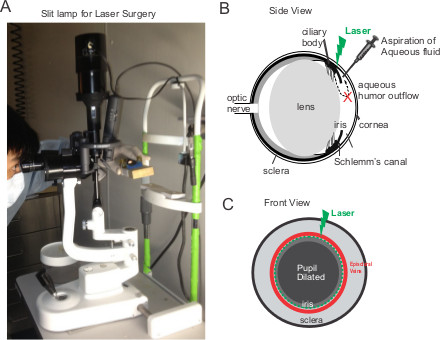
Figura 1. La fotocoagulación con láser de la salida del humor acuoso en los ojos de ratón. (A) Una foto de la lámpara de hendidura para el tratamiento con láser. El operador mantiene el ratón con inmovilización y luego alinea el ojo derecho del ratón para la fuente de luz de la lámpara de hendidura. (BC) Esquema de vista lateral y vista frontal del ojo. El operador sostiene los inmovilizadores de ratón con las dos manos mientras 80-100 puntos de láser se aplican a la zona entre las venas epiesclerales y de la pupila dilatada.
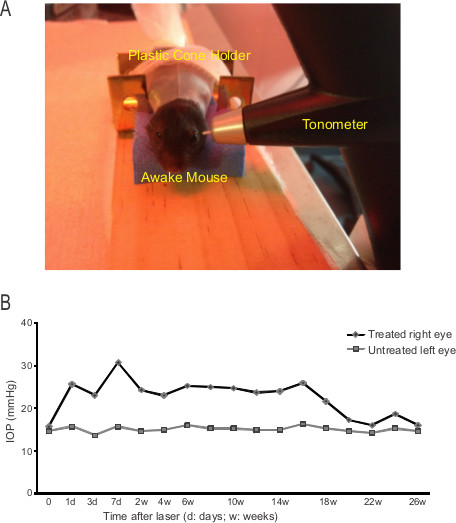
Figura 2. PIO aumentó después del tratamiento con láser. (A) La configuración para medir la IOP usando un tonómetro de rebote. (B)Los cambios de la PIO de un ratón experimental después del tratamiento con láser. Cada punto es la media de tres series consecutivas de seis mediciones de la PIO.

Figura 3. La disminución de la agudeza visual y la sensibilidad al contraste con la elevación de la PIO. (A) Esquema de la configuración de optomotor. (B) Un ratón en la plataforma central en el aparato optomotor con rejillas que aparecen en cuatro monitores circundantes. (C) La agudeza y la sensibilidad al contraste del ratón examinado en la Figura 2B.
Discusión
Se presenta por encima de que la hipertensión ocular sostenida puede ser inducida por iluminación con láser en ojos de ratón. En comparación con el modelo de inyección de solución salina 18 y el cauterio modelo de vena 11 ambos de los cuales requieren amplios conocimientos de microcirugía, la iluminación con láser es relativamente simple y fácil de realizar. Por lo general, se puede realizar la iluminación láser para 4-6 ratones en 2-3 horas. Los pasos críticos para lograr la elevación de la PIO sostenido son el aplanamiento de la cámara anterior antes de láser y los parámetros para la iluminación láser. Drenar el líquido en la cámara anterior facilitado para orientar el láser a la zona de la malla trabecular y minimizar las lesiones a la cercana cuerpo ciliar y los vasos sanguíneos 6. También se han descrito diferentes tipos de láser, por ejemplo, algunos estudios utilizaron un láser de diodo con longitud de onda de 532 nm de 5,6 y otros utilizados 810 nm impulsos de energía 7 para orientar la malla trabecular y las venas epiesclerales en el reg limbalde iones. Con el fin de maximizar el daño ángulo, hemos aumentado el número de puntos de láser en comparación con los modelos láser reportados previamente 5-7. Con nuestra configuración experimental, casi cada ratón tratado con láser tenía más de 50% de aumento de la PIO durante la primera semana después del tratamiento con láser, entre los cuales un 60% tienen PIO elevada durante más de 2 meses. Por el contrario, una inyección intraocular de microperlas a los ojos del ratón puede provocar una elevación de ~ 30% de la PIO durante un par de semanas 8 (otro estudio sugirió un efecto de más larga de elevación de la PIO 9,10), y la oclusión de las venas limbal y epiescleral en albino ratones CD-1 sólo indujeron un aumento de la PIO aguda durante unos 13 días.
La medición exacta de la PIO es importante en la determinación de los efectos de láser en los ojos de ratón. Anestesia alteró significativamente la medición de la PIO y la formación del comportamiento de los ratones reducido variación PIO en animales despiertos 9,19. Aquí, los animales experimentales fueron gada de unos minutos para descansar y adaptarse a la posición restringida antes de la medición con el fin de obtener lecturas consistentes de la PIO. Para confirmar la medición de la PIO es fiable y no depende de la persona que realiza el examen, los mismos animales fueron examinados por dos o tres probadores diferentes y sus diferencias de lecturas de PIO están generalmente dentro de 5-15%.
Debido a la variabilidad de la duración y el grado de elevación de la PIO, diferente pérdida de CGR se ha informado en diferentes modelos animales. Por ejemplo, una pérdida del 20% de los axones se ha observado en los ojos de ratones con inyección de microperlas 8. Alrededor del 20% de la CGR murió en los ojos de ratas a las seis semanas después de la iluminación láser a la malla trabecular, mientras que alrededor del 60% de la CGR murió con iluminación láser, tanto en la malla trabecular y las venas epiesclerales 5. Nuestros datos muestran un 20-30% de pérdida de CGR, a los 2 meses después del tratamiento con láser en los ojos de ratón. Sin embargo, todos estos modelos animales diferentes de crónica ohipertensión cular, sin inflamación o daño a otras partes de los ojos significativa nos proporcionan el potencial para medir los efectos a largo plazo de la hipertensión ocular en la estructura de la retina y la función visual en el tiempo.
Tomando ventaja de la naturaleza no invasiva del ensayo de comportamiento visual que permite pruebas de serie como una función de las condiciones cambiantes, los cambios de la agudeza visual y la sensibilidad al contraste pueden ser monitorizados para meses después de la inducción de la hipertensión ocular. La prueba optomotor proporciona una evaluación rápida de la función visual, por otra parte, los dos ojos pueden ser probados por separado, lo que facilita enormemente nuestros experimentos porque uno de los ojos del ratón objetivo es tratado con láser y el otro se deja intacta como control. Al mismo tiempo, se observa que el reflejo optomotor a veces es difícil de utilizar debido a la alta actividad y errante atención de algunos ratones 12.
Combinado con el poder de ratón genéticamentecs, nuestro modelo proporciona una lectura excepcional con el que investigar los mecanismos patológicos en el glaucoma de alta tensión. Por ejemplo, el uso de Thy-1-YFP ratones transgénicos, que tiene un pequeño número de RGCs marcadas 10,20-22, los cambios estructurales dendríticas de CGR individuales se pueden obtener imágenes en ojos con hipertensión ocular sostenida. Hemos demostrado que la degeneración dendrítica de CGR depende de la ubicación y subtipos en ojos con hipertensión ocular 23. Apoptosis de las células o las vías de señalización neuroprotectores se pueden manipular más in vivo para identificar los mecanismos moleculares subyacentes de la degeneración y la supervivencia de RGC en el glaucoma.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Los autores son empleados de tiempo completo de la Universidad Northwestern.
Los autores no recibieron ninguna financiación que fue proporcionada por las empresas que producen los reactivos e instrumentos utilizados en este artículo.
Agradecimientos
La obra contenida en este documento ha sido apoyado por el premio Douglas Johnson H. Dr. de Glaucoma Research de la Fundación Panamericana de la Salud Asistencia (XL), la Greve Premio Académico Especial William & Mary de la investigación para prevenir la ceguera (XL), el Sociedad de Illinois para la Prevención de la Ceguera (HC) y NIH subvención R01EY019034 (XL).
Materiales
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| moxifloxacin | Alcon Labs, Inc. | NDC 0065-4013-03 | 0.5 %, Rx only |
| Proparacaine Hydrochloride | Bausch & Lomb | NDC 24208-730-06 | 0.5 %, Rx only |
| Ophthalmic Solution USP | Bausch & Lomb | NDC 24208-730-06 | .5 %, Rx only |
| ketamine | Butler Schein Animal Health | NDC 11695-0550-1 | 100 mg / kg |
| xylazine | LLOYD Inc. of Iowa | NADA 139-236 | 10 mg / kg |
| atropine sulfate solution | Alcon Labs, Inc. | NDC 61314-303-02 | 1 %, Rx only |
| Equipment | |||
| Slit Lamp, TOPCON | Visual Systems Inc | SL-3E | powered by PS-30A |
| OptoMotry 1.8.0 virtual | CerebralMechanics Inc. | ||
| opto-kinetic testing system | CerebralMechanics Inc. | ||
| Tonometer, TonoLab, for mice | Colonial Medical Supply | ||
| Heating pad | Sunbeam Products Inc | 722-810 | |
| Argon laser | Coherent Inc | Ultima 2000SE | |
| DECAPICONE Plastic cone holder | Braintree Sci Inc. | MDC-200 | for mouse |
Referencias
- Gupta, N., Yucel, Y. H. Glaucoma as a neurodegenerative disease. Curr. Opin. Ophthalmol. 18, 110-114 (2007).
- Quigley, H. A. Neuronal death in glaucoma. Prog. Retin. Eye Res. 18, 39-57 (1999).
- McKinnon, S. J., Schlamp, C. L., Nickells, R. W. Mouse models of retinal ganglion cell death and glaucoma. Experimental Eye Research. 88, 816-824 (2009).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J. Glaucoma. 16, 483-505 (2007).
- Levkovitch-Verbin, H., et al. Translimbal laser photocoagulation to the trabecular meshwork as a model of glaucoma in rats. Investigative Ophthalmology & Visual Science. 43, 402-410 (2002).
- Aihara, M., Lindsey, J. D., Weinreb, R. N. Experimental mouse ocular hypertension: establishment of the model. Investigative Ophthalmology & Visual Science. 44, 4314-4320 (2003).
- Grozdanic, S. D. Laser-induced mouse model of chronic ocular hypertension. Investigative ophthalmology & visual science. 44, 4337-4346 (2003).
- Sappington, R. M., Carlson, B. J., Crish, S. D., Calkins, D. J. The microbead occlusion model: a paradigm for induced ocular hypertension in rats and mice. Investigative ophthalmology & visual science. 51, 207-216 (2010).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Experimental Eye Research. 92, 512-520 (2011).
- Kalesnykas, G., et al. Retinal ganglion cell morphology after optic nerve crush and experimental glaucoma. Investigative Ophthalmology & Visual Science. 53, 3847-3857 (2012).
- Shareef, S. R., Garcia-Valenzuela, E., Salierno, A., Walsh, J., Sharma, S. C. Chronic ocular hypertension following episcleral venous occlusion in rats. Experimental Eye Research. 61, 379-382 (1995).
- Chiu, K., Chang, R., So, K. F. Laser-induced chronic ocular hypertension model on SD rats. J. Vis. Exp. (10), e549 (2007).
- Fu, C. T., Sretavan, D. Laser-induced ocular hypertension in albino CD-1 mice. Investigative Ophthalmology & Visual Science. 51, 980-990 (2010).
- Rangarajan, K. V. Detection of visual deficits in aging DBA/2J mice by two behavioral assays. Curr. Eye Res. 36, 481-491 (2011).
- Wang, L., et al. Direction-specific disruption of subcortical visual behavior and receptive fields in mice lacking the beta2 subunit of nicotinic acetylcholine receptor. J. Neurosci. 29, 12909-12918 (2009).
- Douglas, R. M., et al. Independent visual threshold measurements in the two eyes of freely moving rats and mice using a virtual-reality optokinetic system. Visual Neuroscience. 22, 677-684 (2005).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45, 4611-4616 (2004).
- Morrison, J. C., et al. A rat model of chronic pressure-induced optic nerve damage. Experimental Eye Research. 64, 85-96 (1997).
- Cone, F. E., et al. The effects of anesthesia, mouse strain and age on intraocular pressure and an improved murine model of experimental glaucoma. Experimental Eye Research. 99, 27-35 (2012).
- Liu, X., et al. Brain-derived neurotrophic factor and TrkB modulate visual experience-dependent refinement of neuronal pathways in retina. J. Neurosci. 27, 7256-7267 (2007).
- Liu, X., et al. Regulation of neonatal development of retinal ganglion cell dendrites by neurotrophin-3 overexpression. The Journal of Comparative Neurology. 514, 449-458 (2009).
- Sun, W., Li, N., He, S. Large-scale morphological survey of mouse retinal ganglion cells. The Journal of Comparative Neurology. 451, 115-126 (2002).
- Feng, L., et al. Sustained Ocular Hypertension Induces Dendritic Degeneration of Mouse Retinal Ganglion Cells that Depends on Cell-type and Location. Investigative Ophthalmology & Visual Science. , (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados