Method Article
Ein Laser-induzierten Maus-Modell der chronischen Ocular Hypertension zu Sehfehler Charakterisierung
In diesem Artikel
Zusammenfassung
Chronische Augenhypertension induziert wird mittels Laserkoagulation der Trabekelnetzwerk in Maus Augen. Der Augeninnendruck (IOP) wird für mehrere Monate nach der Laser-Behandlung erhöht. Die Abnahme der Sehschärfe und Kontrastempfindlichkeit von Versuchstieren werden anhand des optomotor Test.
Zusammenfassung
Glaukom, häufig mit erhöhtem Augeninnendruck (IOP) verbunden sind, ist eine der führenden Ursachen für Erblindung. Wir versuchten, ein Maus-Modell von Augenhypertension die menschliche High-Tension Glaukom imitieren zu etablieren. Hier Laserbeleuchtung mit dem Hornhautrand, um die wässerige Abfluß photocoagulate, induzieren Engwinkel. Die Änderungen des IOP erfolgt über ein Rebound-Tonometer vor und nach der Laserbehandlung. Ein optomotor Verhaltens-Test wird verwendet, um die entsprechenden Änderungen in der visuellen Leistungsfähigkeit zu messen. Die repräsentatives Ergebnis von einer Maus, die nachhaltig IOP Erhebung nach der Laser-Beleuchtung entwickelt gezeigt. Eine verminderte Sehschärfe und Kontrastempfindlichkeit wird in diesem Augeninnendruck Maus beobachtet. Gemeinsam stellt unsere Studie einen wertvollen Modellsystem zur neuronalen Degeneration und die zugrunde liegenden molekularen Mechanismen in glaukomatöse Mäusen zu untersuchen.
Protokoll
Verfahren
C57BL/6J-Mäusen (Jackson Laboratory, Bar Harbor, ME) sind an der Northwestern University Animal Care Facility angehoben. Alle Tiere werden in Übereinstimmung mit den Protokollen von der Northwestern University Institutional Animal Care und Verwenden Ausschuss gestellt und den Leitlinien für die Verwendung von Tieren in Neuroscience Forschung vom NIH genehmigt werden.
1. Laserphotokoagulation
Das Verfahren der Laserkoagulation von zuvor veröffentlichten Protokollen 5-7 modifiziert.
- Anesthetize eine 40-60 Tage alten Maus durch eine intraperitoneale Injektion von Ketamin (100 mg / kg, Butler Schein Tiergesundheit, OH) und Xylazin (10 mg / kg, Lloyd Inc. von Iowa, Shenandoah, IA).
- Dilate die Pupille des rechten Auges des Versuchstieres durch topische Behandlung mit einem oder zwei Tropfen von 1% Atropin-Sulfat-Lösung (Alcon Labs, Inc., Fort Worth, TX).
- Nach Mydriasis, glätten die einnterior Kammer zu verbessern Laserinduktion 6. Legen Sie eine Glasmikropipette mit scharfen Spitze (World Precision Instruments Inc, Sarasota, FL) in den vorderen Raum unter der Spaltlampe (SL-3E, Topcon, Oakland, NJ) ablaufen lassen die Flüssigkeit in die vordere Kammer.
- Haltet die Maus in einem Kunststoff-Kegel Halter (Braintree Sci Inc., MA) und bis auf eine hausgemachte Plattform gebunden (siehe Abbildung 1a). Halten Sie die Maus mit Verzögerer und macht das rechte Auge der Maus auf die Lichtquelle hinter der Spaltlampe. Richten des rechten Auges des narkotisierten Maus unter der Spaltlampe.
- Halten Sie die Maus Restrainer mit beiden Händen, gelten die Laserbeleuchtung der Hornhaut Limbus mit einem Argon-Laser (Ultima 2000SE, Coherent, Santa Clara, CA). Liefern 80-100 Laserspots (514 nm, 100 mW, 50 ms Puls und 200 um spot) senkrecht um den Umfang des trabekulären Netzwerks. Die C57BL / 6 Mäuse pigmentierten Iris, die als Barriere für alle p dientotential Streuenergie 7.
- Instill aktuell 0,5% Moxifloxacin (Alcon Labs, Inc., Fort Worth, TX) auf der Augenoberfläche, um den Laser-behandelte Fläche und 0,5% Proparacaine (Bausch & Lomb, Rochester, NY), Schmerzen zu lindern desinfizieren.
- Halten Sie das Tier auf einem Heizkissen (Sunbeam Products Inc, Boca Raton, FL) für die Verwertung für etwa eine Stunde, bis er ganz wach ist.
- Das linke Auge ist unbehandelt als Kontrolle zu dienen.
2. IOP Maße
- Legen Sie die Maus wach in eine Röhre, in der Kunststoff-Kegel Halter laden und dann zurückhalten es auf der Plattform (siehe Abbildung 2A).
- Lassen Sie fünf bis zehn Minuten, damit die Maus an den Inhaber Position angepasst bekommen. Nähern Sie sich dem Rebound-Tonometer (TonoLab, Colonial Medical Supply, Franconia, NH) an der Maus, bis das Auge Sondenspitze ist 2-3 mm von der Oberfläche der Hornhaut 14.
- Drücken Sie die Taste, um die Messung lassen sich die Sondenspitze traf die Mitte Oberflächevon Hornhaut sanft. Drei aufeinanderfolgende Sätze von sechs Messungen der IOP desselben Auges erfasst und gemittelt als IOP des Auges. Die unbehandelten Kontrolle Auge wird immer zuerst eine Basislinie für die Laser-behandelten Auge, das nächste wird gemessen bekommen gemessen.
3. Optomotorischen-Test
Sehschärfe und Kontrastempfindlichkeit sind 14,15 getestet. Die beiden Augen einzelner Mäuse werden einzeln durch die Umkehrung der Richtung driftet Gitter untersucht, dh im Uhrzeigersinn Driften Gitter verwendet wird, um die visuelle Funktion des linken Auges und des gegen den Uhrzeigersinn treibt Gitter für das rechte Auge 16 zu identifizieren. Jeder Test dauert etwa 15 min und wird durch zwei Beobachter unabhängig wiederholt.
- Platzieren Sie die Maus und lassen Sie die Maus frei bewegen auf einer erhöhten Plattform von vier Computermonitore (3A-B) umgeben.
- Stellen Sie die Monitore so dass sie horizontal treiben Display sinusförmigeGittern als visuelle Reize zur mittleren Leuchtdichte von 39 cd / m 2. Die Bewegungsrichtung des Gitters sollten sich abwechseln nacheinander zwischen Uhrzeigersinn und gegen den Uhrzeigersinn.
- Analysieren Sie die Bewegungen des Tieres. Bewegungen des Tieres in Abstimmung mit den treibenden Gitter werden als "positive" innerhalb von 15 Sekunden nach der visuelle Reiz ist und dann allmählich erhöht. Die höchste Antwort-auslösenden visuellen Stimulus als das Tier die Sehschärfe 17 definiert.
- Untersuchen Sie die Kontrastempfindlichkeit bei drei vorgewählten räumlichen Frequenzen: 0,075, 0,16 und 0,3 Zyklen pro Grad (cpd). Der Kontrast Schwelle für jedes Auge wird als die niedrigste dagegen die visuelle Reaktionen hervorruft bei der Pre-festen Frequenz definiert. Der Kontrast-Empfindlichkeit ist der reziproke Wert der Schwelle 17.
Ergebnisse
Wie in den Verfahren beschrieben, ist die Laser-Beleuchtung an der Trabekelnetzwerk im Limbus Region, um die Kammerwasserabfluss photocoagulate Ziel, Induktion Winkel Verschluss (Abbildung 1). Die meisten gelaserten Augen zeigten keine erheblichen Sachbeschädigungen, Pigment Ablösung oder Infektion, im Einklang mit früheren Befunden 6. Wenn eine kleine Gruppe von Mäusen (weniger als 5% aller gelaserten Tiere) körperliche Anzeichen von schweren Schäden wie entleert Augäpfel, schwere Katarakt, signifikante Pigment Ablösung oder Blutungen zeigten, eingeschläfert wir sie sofort. Rund 30% der gelaserten Augen entwickelt kleinere Hornhautnarben, und die meisten von ihnen wieder in 1-2 Wochen nach der Laserbehandlung.
Wir fanden erhöhten IOP in fast alle Laser-behandelten Augen von mehr als hundert Mäuse. Die IOP von Versuchstieren wird überwacht mit einem Rebound-Tonometer (Abbildung 2). 2B zeigt ein Beispiel für die Veränderungen von IOP vor und nach der Laserbehandlung. Vor Laserbehandlung zeigten die IOP Grundlinien der beiden Augen der Maus keinen Unterschied: 15,7 mmHg (rechts) vs 14,7 mmHg (links, Tag 0, 2B). Sieben Tage nach der Laser-Behandlung erhöhte sich der IOP des behandelten (rechte) Auge fast 2-fach bis 30,7 mmHg, im Vergleich zur unbehandelten Auge (15,7 mmHg). Die IOP von Laser behandelten Auge blieb bei 26-28 mmHg für ca. 4 Monate erhöht: bei 4 Monate nach der Behandlung betrug die mittlere IOP von 26 mmHg behandelten Auge, deutlich höher als die der unbehandelten linken Auge (16,3 mmHg). Anschließend wird das IOP des behandelten Auges langsam ab und erreicht 18,7 mmHg nach 6 Monaten (24 Wochen) nach der Behandlung (unbehandelte Auge: 15,3 mmHg). Unsere Daten zeigen, dass nachhaltige IOP Höhe für mehr als 4 Monate erreicht.
Wir bestätigten die nächsten Sehverlust mit dem optomotor Test (Abbildung 3). Die optomotor Test misst Aspekte des räumlichen Sehens über reflexive Kopf-tracking Bewegungen. 3C zeigt die Abnahme der Sehschärfe des Tieres in 2B untersucht. Vor der Laser-Behandlung zeigten beide Augen normale Sehschärfe (Links: 0.375 cpd; Rechts: 0.397 cpd; 3C). An zwei Monate nach der Laserbehandlung, verringerte sich die Sehschärfe des rechten Auges (erhöhten IOP) signifikant mit dem linken Auge Kontrolle verglichen (links: 0,45 cpd; Rechts: 0.228 cpd; 3C). Die Sehschärfe des Auges mit erhöhten IOP blieb bei 5-6 Monaten niedrig nach der Laserbehandlung (Links: 0.378 cpd; Rechts:. 0 258 cpd; 3C). In ähnlicher Weise wurde eine untere Kontrastempfindlichkeit des rechten Auges mit erhöhten IOP beobachtet (Fig. 3D). An zwei Monate nach der Laserbehandlung, verließ die Kontrastempfindlichkeit des Auges Kontrolle war 6,13, während das rechte Auge war 1.91 bei 0.075 cpd. Die Kontrastempfindlichkeit der Steuerung linke Auge war 5,53 und 2,67 auf 0,16 und 0,3 cpd, während das rechte Auge war 4.28 und 1.45 bzw. (Fig. 3D).
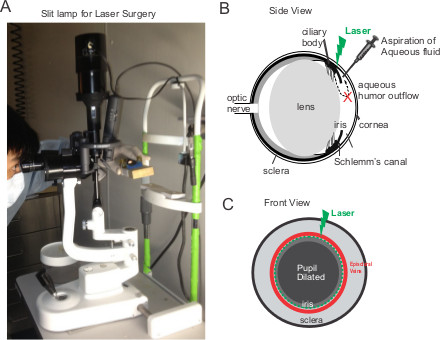
Abbildung 1. Laserphotokoagulation der Kammerwasserabflusses in Maus Augen. (A) Ein Foto von der Spaltlampe für Laser-Behandlung. Der Betreiber hält die Maus mit Verzögerer und richtet dann das rechte Auge der Maus auf die Lichtquelle der Spaltlampe. (BC) Schematische Seitenansicht und Front-Ansicht des Auges. Der Bediener kann also die Maustaste Verzögerer mit beiden Händen, während 80-100 Laserspots auf den Bereich zwischen den Episkleralvenen und dem erweiterten Pupille angewendet werden.
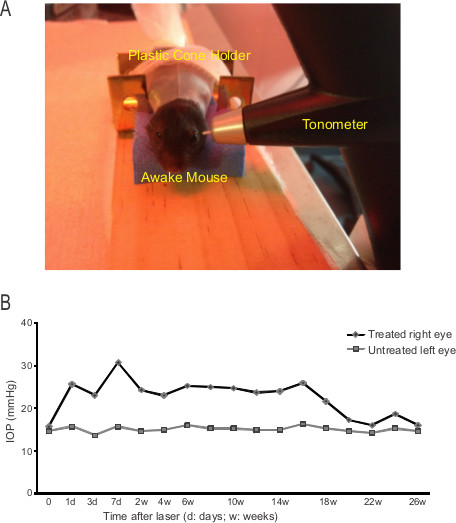
Abbildung 2. IOP erhöht nach der Laserbehandlung. (A) Das Setup IOP messen mit einem Rebound-Tonometer. (B)Änderungen des IOP eines experimentellen Maus nach der Laserbehandlung. Jeder Punkt ist der Mittelwert von drei aufeinander folgenden Sätzen von sechs Messungen des Augeninnendrucks.

Abbildung 3. Abnahme der Sehschärfe und Kontrastempfindlichkeit mit IOP Höhe. (A) Schematische Darstellung des optomotor Setup. (B) Eine Maus auf der Plattform in der Mitte optomotor Gerät mit Gittern auf vier umliegenden Monitoren angezeigt. (C) Die Sehschärfe und Kontrastempfindlichkeit der Maus untersucht in 2B.
Diskussion
Wir berichten über diesem anhaltenden Augenhypertension können durch Laser-Beleuchtung in Mäuseaugen induziert werden. Im Vergleich zur Injektion von Kochsalzlösung Modell 18 und der Vene cautery Modell 11 beide umfangreichen mikrochirurgischen Fähigkeiten erfordern, ist die Laserbestrahlung relativ einfach und leicht durchzuführen. Normalerweise können wir den Laser-Beleuchtung für 4-6 Mäuse in 2-3 Stunden durchzuführen. Die kritischen Schritte aufrechterhalten IOP Höhe erreichen sind die vordere Kammer Abflachung vor der Laserbehandlung und die Parameter für Laserbestrahlung. Entleeren Sie die Flüssigkeit in die vordere Kammer erleichtert, den Laser auf die Trabekelnetzwerk Zielgebiet und Minimierung der Verletzung des in der Nähe des Ziliarkörpers und Blutgefäße 6. Verschiedene Arten von Laser wurde ebenfalls berichtet, zum Beispiel verwendet einige Studien einen Diodenlaser mit einer Wellenlänge von 532 nm 5,6 und andere verwendet 810 nm Energiepulse 7, um das trabekuläre Netzwerk und Episkleralvenen Ziel in dem Limbus region. Um den Winkel Schaden zu maximieren, haben wir die Anzahl von Laser-Spots im Vergleich zu den früher berichteten Lasermodelle 5-7 erhöht. Mit unserem Versuchsaufbau, hatte fast jeder Laser-behandelten Maus mehr als 50% ige Erhöhung des IOP nach der ersten Woche nach der Laserbehandlung, unter denen etwa 60% erhöht IOP für mehr als 2 Monate hatte. Im Gegensatz dazu kann eine intraokulare Injektion von Mikrokügelchen in Mäuseaugen entlocken eine ~ 30% Erhöhung der IOP für ein paar Wochen 8 (eine andere Studie vorgeschlagen, eine längere Wirkung der IOP Höhe 9,10), und die Okklusion von Limbus und Episkleralvenen in Albino CD-1-Mäusen nur eine akute IOP Erhebung für ein paar Tage 13 induziert.
Die genaue Messung des IOP ist bei der Bestimmung der Auswirkungen auf Laser Maus Augen wichtig. Anästhesie signifikant verändert die IOP-Messung und Verhaltenstraining von Mäusen reduziert IOP Variation wach Tiere 9,19. Hier waren die Versuchstiere gIven ein paar Minuten, um sich auszuruhen und sich an der zurückhaltenden Position vor der Messung, um konsistente Messwerte von IOP bekommen. Um zu bestätigen, die IOP-Messung ist zuverlässig und nicht abhängig von der Person, die den Test durchgeführt, wurden die gleichen Tiere von zwei oder drei verschiedenen Testern und ihre Unterschiede von IOP Lesungen sind in der Regel innerhalb von 5-15% untersucht.
Aufgrund der Variabilität der die Dauer und das Ausmaß der Erhebung IOP hat verschiedene RGC Verlust in verschiedenen Tiermodellen berichtet. Zum Beispiel wurde ein Verlust von 20% der Axone in Mäuseaugen wurde mit Mikrokügelchen Injektion 8 beobachtet. Rund 20% der RGCs starb in Ratte Augen auf sechs Wochen nach der Laser-Beleuchtung an der Trabekelnetzwerk, während rund 60% der RGCs mit Laserbeleuchtung sowohl auf Trabekelnetzwerk und Episkleralvenen 5 gestorben. Unsere Daten zeigten eine 20-30% der RGC Verlust bei 2 Monate nach der Laser-Behandlung in Maus Augen. Doch alle diese verschiedenen Tiermodellen für chronisch osondere Hypertonie ohne nennenswerte Entzündung oder Schäden an anderen Teilen der Augen liefern uns das Potenzial, die langfristigen Auswirkungen von erhöhtem Augeninnendruck auf die retinale Struktur und das visuelle Funktion im Laufe der Zeit zu messen.
Cytos Biotechnology nutzt die nicht-invasive Art der visuellen Verhaltens-Assay, der seriellen Tests in Abhängigkeit von sich verändernden Bedingungen erlaubt, können die Veränderungen der Sehschärfe und Kontrastempfindlichkeit für Monate nach der Induktion von erhöhtem Augeninnendruck überwacht werden. Die optomotor Test liefert eine rasche Beurteilung der Sehfunktion, außerdem die beiden Augen separat getestet werden, das erleichtert unsere Experimente, weil ein Auge des Ziels Maus mit Laser behandelt und die andere bleibt intakt als Kontrolle. Gleichzeitig wird darauf hingewiesen, dass die optomotor Reflex ist manchmal schwierig zu verwenden aufgrund der hohen Aktivität und wandernden Aufmerksamkeit einigen Mäusen 12.
Kombiniert mit der Macht der Maus genetischcs, bietet unser Modell eine hervorragende Auslese, mit denen die pathologischen Mechanismen in High-Tension Glaukom untersuchen. Zum Beispiel, mit Thy-1-YFP transgenen Mäusen hat, die eine kleine Anzahl von markierten RGCs 10,20-22, können die dendritischen strukturellen Veränderungen einzelner RGCs in Augen mit verzögerter okulärer Hypertension abgebildet werden. Wir haben gezeigt, dass die dendritischen Degeneration RGCs vor Ort und Subtypen in erhöhtem Augeninnendruck Augen 23 abhängt. Apoptose oder neuroprotektive Signalwege können weitere in vivo manipuliert werden, um die zugrunde liegenden molekularen Mechanismen der RGC Degeneration und Überleben in Glaukom identifizieren.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Die Autoren sind Vollzeit-Mitarbeiter von der Northwestern University.
Die Autoren erhielten keine Mittel, die von Unternehmen, die Reagenzien und Instrumente in diesem Artikel verwendet produzieren bereitgestellt.
Danksagungen
Die Arbeit in diesem Papier enthaltenen Informationen wurden von der Dr. Douglas H. Johnson Award für Glaukomforschung vom American Health Assistance Foundation (XL), die William & Mary Greve Besondere Scholar Award von der Forschung zur Verhütung Blindheit (XL), unterstützt die Illinois Gesellschaft zur Verhütung von Blindheit (HC) und NIH R01EY019034 (XL).
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| moxifloxacin | Alcon Labs, Inc. | NDC 0065-4013-03 | 0.5 %, Rx only |
| Proparacaine Hydrochloride | Bausch & Lomb | NDC 24208-730-06 | 0.5 %, Rx only |
| Ophthalmic Solution USP | Bausch & Lomb | NDC 24208-730-06 | .5 %, Rx only |
| ketamine | Butler Schein Animal Health | NDC 11695-0550-1 | 100 mg / kg |
| xylazine | LLOYD Inc. of Iowa | NADA 139-236 | 10 mg / kg |
| atropine sulfate solution | Alcon Labs, Inc. | NDC 61314-303-02 | 1 %, Rx only |
| Equipment | |||
| Slit Lamp, TOPCON | Visual Systems Inc | SL-3E | powered by PS-30A |
| OptoMotry 1.8.0 virtual | CerebralMechanics Inc. | ||
| opto-kinetic testing system | CerebralMechanics Inc. | ||
| Tonometer, TonoLab, for mice | Colonial Medical Supply | ||
| Heating pad | Sunbeam Products Inc | 722-810 | |
| Argon laser | Coherent Inc | Ultima 2000SE | |
| DECAPICONE Plastic cone holder | Braintree Sci Inc. | MDC-200 | for mouse |
Referenzen
- Gupta, N., Yucel, Y. H. Glaucoma as a neurodegenerative disease. Curr. Opin. Ophthalmol. 18, 110-114 (2007).
- Quigley, H. A. Neuronal death in glaucoma. Prog. Retin. Eye Res. 18, 39-57 (1999).
- McKinnon, S. J., Schlamp, C. L., Nickells, R. W. Mouse models of retinal ganglion cell death and glaucoma. Experimental Eye Research. 88, 816-824 (2009).
- Pang, I. H., Clark, A. F. Rodent models for glaucoma retinopathy and optic neuropathy. J. Glaucoma. 16, 483-505 (2007).
- Levkovitch-Verbin, H., et al. Translimbal laser photocoagulation to the trabecular meshwork as a model of glaucoma in rats. Investigative Ophthalmology & Visual Science. 43, 402-410 (2002).
- Aihara, M., Lindsey, J. D., Weinreb, R. N. Experimental mouse ocular hypertension: establishment of the model. Investigative Ophthalmology & Visual Science. 44, 4314-4320 (2003).
- Grozdanic, S. D. Laser-induced mouse model of chronic ocular hypertension. Investigative ophthalmology & visual science. 44, 4337-4346 (2003).
- Sappington, R. M., Carlson, B. J., Crish, S. D., Calkins, D. J. The microbead occlusion model: a paradigm for induced ocular hypertension in rats and mice. Investigative ophthalmology & visual science. 51, 207-216 (2010).
- Ding, C., Wang, P., Tian, N. Effect of general anesthetics on IOP in elevated IOP mouse model. Experimental Eye Research. 92, 512-520 (2011).
- Kalesnykas, G., et al. Retinal ganglion cell morphology after optic nerve crush and experimental glaucoma. Investigative Ophthalmology & Visual Science. 53, 3847-3857 (2012).
- Shareef, S. R., Garcia-Valenzuela, E., Salierno, A., Walsh, J., Sharma, S. C. Chronic ocular hypertension following episcleral venous occlusion in rats. Experimental Eye Research. 61, 379-382 (1995).
- Chiu, K., Chang, R., So, K. F. Laser-induced chronic ocular hypertension model on SD rats. J. Vis. Exp. (10), e549 (2007).
- Fu, C. T., Sretavan, D. Laser-induced ocular hypertension in albino CD-1 mice. Investigative Ophthalmology & Visual Science. 51, 980-990 (2010).
- Rangarajan, K. V. Detection of visual deficits in aging DBA/2J mice by two behavioral assays. Curr. Eye Res. 36, 481-491 (2011).
- Wang, L., et al. Direction-specific disruption of subcortical visual behavior and receptive fields in mice lacking the beta2 subunit of nicotinic acetylcholine receptor. J. Neurosci. 29, 12909-12918 (2009).
- Douglas, R. M., et al. Independent visual threshold measurements in the two eyes of freely moving rats and mice using a virtual-reality optokinetic system. Visual Neuroscience. 22, 677-684 (2005).
- Prusky, G. T., Alam, N. M., Beekman, S., Douglas, R. M. Rapid quantification of adult and developing mouse spatial vision using a virtual optomotor system. Investigative Ophthalmology & Visual Science. 45, 4611-4616 (2004).
- Morrison, J. C., et al. A rat model of chronic pressure-induced optic nerve damage. Experimental Eye Research. 64, 85-96 (1997).
- Cone, F. E., et al. The effects of anesthesia, mouse strain and age on intraocular pressure and an improved murine model of experimental glaucoma. Experimental Eye Research. 99, 27-35 (2012).
- Liu, X., et al. Brain-derived neurotrophic factor and TrkB modulate visual experience-dependent refinement of neuronal pathways in retina. J. Neurosci. 27, 7256-7267 (2007).
- Liu, X., et al. Regulation of neonatal development of retinal ganglion cell dendrites by neurotrophin-3 overexpression. The Journal of Comparative Neurology. 514, 449-458 (2009).
- Sun, W., Li, N., He, S. Large-scale morphological survey of mouse retinal ganglion cells. The Journal of Comparative Neurology. 451, 115-126 (2002).
- Feng, L., et al. Sustained Ocular Hypertension Induces Dendritic Degeneration of Mouse Retinal Ganglion Cells that Depends on Cell-type and Location. Investigative Ophthalmology & Visual Science. , (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten