Method Article
Eine minimalinvasive, visualisierte Methode zur Platzierung von Nasojejunaltuben
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Studie wird eine am Krankenbett visualisierte Methode vorgestellt, um die Platzierung der Nasojejunalkanüle bei Patienten auf der Intensivstation zu verbessern, die Effizienz zu steigern und die Beschwerden der Patienten zu reduzieren.
Zusammenfassung
Mangelernährung ist ein häufiges Problem bei schwerkranken Patienten, das oft auf Krankheiten, Verletzungen oder Operationen zurückzuführen ist. Längeres Fasten führt zu Darmproblemen, was die Bedeutung einer frühen enteralen Ernährung, insbesondere durch die jejunale Ernährung, unterstreicht. Während die enterale Ernährung von entscheidender Bedeutung ist, gibt es bei den derzeitigen Techniken Komplikationen. Nasojejunale (NJ) Tuben werden häufig verwendet, wobei die Platzierungsmethoden als chirurgisch oder nicht-chirurgisch eingestuft werden. Nicht-chirurgische Methoden, einschließlich endoskopischer Führung, haben unterschiedliche Erfolgsquoten, wobei die endoskopisch assistierte Platzierung am erfolgreichsten ist, aber spezielles Fachwissen und Logistik erfordert.
In dieser Studie wird eine am Krankenbett visualisierte Methode für die Platzierung von NJ-Sonden vorgestellt, um die Erfolgsraten zu verbessern und die Beschwerden der Patienten auf der Intensivstation (ICU) zu reduzieren. In dieser Studie mit 19 Intensivpatienten erreichte die Methode eine anfängliche Erfolgsrate von 94,74 % bei einer durchschnittlichen Einführzeit von 11,2 ± 6,4 min. Diese visualisierte Methode demonstriert die Effizienz und reduziert den Bedarf an zusätzlicher Bildgebung, und die Einführung eines miniaturisierten Endoskops ist vielversprechend, das eine erfolgreiche Intubation am Krankenbett ermöglicht und die Beschwerden des Patienten minimiert. Anpassungen an der Führungsdrahtlinse und dem Katheter sind notwendig, bieten aber Möglichkeiten für zukünftige Verfeinerungen.
Einleitung
Mangelernährung manifestiert sich häufig als häufige Komplikation bei kritisch kranken Patienten, die sie unfähig macht, Nahrung normal zu sich zu nehmen oder zu verdauen, hauptsächlich als Folge von Krankheiten, Verletzungen oder chirurgischen Eingriffen 1,2,3,4. Zwischen 30 % und 60 % der hospitalisierten Patienten leiden weiterhin an Mangelernährung5. Daher wird die Bereitstellung einer frühzeitigen enteralen Ernährungsunterstützung als entscheidend erachtet6. Die Einführung einer frühen jejunalen Ernährung dient nicht nur der Aufrechterhaltung der Integrität der Magen-Darm-Funktion und dem Schutz der Darmschleimhautbarriere, sondern trägt auch zu einer verbesserten Immunität und einer Verringerung von Komplikationen bei 7,8. Es besteht ein Konsens über die Notwendigkeit einer ergänzenden Ernährungsunterstützung, wobei die Evidenz darauf hindeutet, dass sie die Ergebnisse für Patienten verbessern kann 9,10. In solchen Situationen kann die Nahrung über eine Sonde verabreicht werden, die entweder in den Magen oder in den Dünndarm eingeführt wird, die als enterale Ernährung (EN) bekannt ist. Die Erforschung der Wirksamkeit von enteralen Zugangsgeräten und Platzierungstechniken ist immer wichtiger geworden.
Das blinde Einführen von nasogastrischen (NG) Sonden am Krankenbett ist in der Regel erfolgreich. Die Sondenernährung kann beginnen, sobald eine Röntgenaufnahme bestätigt, dass die NG-Sondenspitze korrekt im Magen positioniert ist11. Während einer kritischen Erkrankung kann sich die Magenentleerung jedoch verzögern, was zu einem erhöhten Magenrestvolumen (GRVs) während der EN-Entbindungführt 12. Hohe GRVs stellen ein Aspirationsrisiko dar, was Gesundheitsdienstleister dazu veranlasste, die EN-Verabreichungeinzustellen 12. Als Lösung ist die Nasojejunalsonde (NJ) eine häufig eingesetzte Methode zur Verabreichung von Nahrung an schwerkranke Patienten. Derzeit gibt es zahlreiche Verfahren zur Platzierung von NJ-Schläuchen, die in erster Linie als chirurgische oder nicht-chirurgische Ansätze klassifiziert werden. Es gibt mehrere nicht-chirurgische Methoden zum Platzieren eines nasojejunalen (NJ) Tuugies, einschließlich des blinden Einführens, der Röntgenfluoroskopie mit elektromagnetischer Abtastung (z. B. Cortrak, ENvue), der ultraschallgesteuerten Platzierung und der endoskopischen Führung 13,14,15,16.
Die blinde Platzierung einer NJ-Sonde am Krankenbett wurde ausgiebig untersucht, aber die Erfolgsrate dieses Verfahrens variiert stark und reicht von 17 % bis 83 % bei Patienten17,18. In Ermangelung einer geführten Sondenplatzierung wird es schwierig zu wissen, wann der NJ-Schlauch erfolgreich durch den Pylorus geführt wurde. Darüber hinaus besteht die Gefahr, dass der Katheter versehentlich in die Atemwege gelangt, insbesondere bei kritischen Patienten, die bewusstlos sind. Unter den nicht-chirurgischen Methoden erweist sich die endoskopisch assistierte Sondenplatzierung mit einer Erfolgsquote von 73,3 % bis 97,6 % als die erfolgreichste14,19,20. In der Regel erfordert die endoskopische Platzierung eines NJ-Schlauchs in der Regel die Expertise eines Gastroenterologen in einem Endoskopieraum. Darüber hinaus kann der relativ große Durchmesser des Verdauungsendoskops zu erheblichen Beschwerden für den Patienten führen, was häufig die Anwendung einer Vollnarkose erforderlich macht.
Darüber hinaus stellt die Verlegung von Patienten in den gastrointestinalen Endoskopieraum eine große logistische Herausforderung dar, insbesondere für kritisch kranke Patienten auf der Intensivstation. Diese Patienten weisen häufig instabile Vitalparameter auf, darunter Schock und schweres Atemversagen. Schwerkranke Patienten sind einem hohen Risiko ausgesetzt und es ist wahrscheinlich, dass es während des Transports zu unerwünschten Ereignissen kommt21. Es wurden verschiedene Methoden zur Platzierung von NJ-Schläuchen mit direkter endoskopischer Visualisierung diskutiert. Diese Methoden haben in kleinen Studien Erfolgsraten von 80 % bis 90 % berichtet 22,23,24. Diese Verfahren sind jedoch oft zeitaufwändig, technisch anspruchsvoll und erfordern eine steile Lernkurve.
Aus diesem Grund verwenden wir in unserer Einrichtung ein Miniatur-Visualisierungsgerät, um den NJ-Schlauch bei Patienten am Krankenbett einzuführen. Dies stellt sicher, dass die Spitze des Schlauchs den Pylorus durchquert und ein versehentliches Eindringen in die Atemwege vermieden wird, und das alles unter kontinuierlicher visueller Überwachung. Unser Ziel mit dieser Methode ist es, medizinischem Fachpersonal, insbesondere auf der Intensivstation, einen neuen Ansatz zu bieten, um die Erfolgsrate der NJ-Sondenplatzierung bei kritisch kranken Patienten zu verbessern und letztendlich die Beschwerden der Patienten zu minimieren.
Protokoll
Diese Studie wurde von der Ethikkommission für klinische Forschung des Volkskrankenhauses des Landkreises Anji genehmigt. Alle Eingriffe wurden in Übereinstimmung mit institutionell anerkannten Protokollen und mit der informierten Zustimmung der Patienten durchgeführt.
1. Patientenauswahl und -vorbereitung
- Wählen Sie Patienten anhand der folgenden Ein- und Ausschlusskriterien aus.
- Festlegung der Einschlusskriterien für Patienten mit akuter gastrointestinaler Dysfunktion; Personen, die sich einer mechanischen Beatmung unterziehen, Bewusstseinsstörungen haben oder sich in einem komatösen Zustand befinden; Menschen, die Schwierigkeiten beim Schlucken oder Kauen haben; Personen, die die Magenernährung nicht vertragen oder unter Magenretention leiden; Patienten mit Pankreatitis, einem hypermetabolischen Zustand oder Mangelernährung; Personen, die zu Reflux neigen, wie z. B. Menschen mit traumatischen Hirnverletzungen, die sich einer Chemotherapie gegen Tumore unterziehen usw.; Patienten mit entzündlichen Darmerkrankungen, gastroösophagealen Fisteln oder Kurzdarmsyndrom; Personen mit anderen Erkrankungen, einschließlich Patienten, die sich einer Mund-, Rachen- oder Speiseröhrenoperation unterzogen haben; und älter als 18 Jahre sein.
- Legen Sie die Ausschlusskriterien so fest, dass es sich um Blutungen im oberen Magen-Darm-Trakt handelt. Pylorusödem oder Obstruktion; paralytischer oder mechanischer Darmverschluss; Darmperforation, Nekrose oder Resorptionsstörungen; Vorgeschichte der Magen-Darm-Chirurgie; schwerer Stresszustand oder Schock; Ösophagusstriktur oder Kardiastenose oder -obstruktion; und andere Erkrankungen, wie schwere ösophagogastrische Fundusvarizen, Nasenobstruktion, akute oder chronische Sinusitis usw.
- Präoperative Beurteilung
- Beurteilen Sie vor dem Eingriff den Ernährungszustand, das Bewusstsein, den Allgemeinzustand, die Schluckfunktion, die Mund- und Nasenerkrankungen, die Magen-Darm-Funktion und das Kooperationsniveau des Patienten.
- Um dieses Protokoll zu befolgen, verwenden Sie das speziell für Intensivpatienten entwickelte Bewertungssystem Nutrition Risk in the Critically Ill (NUTRIC) als primäres Instrument zur Bewertung des Ernährungsrisikos25. Der NUC-Score umfasst die folgenden Parameter: Alter, Acute Physiology and Chronic Health Evaluation (APACHE) II26, Sequential Organ Failure Assessment (SOFA) Score26, Anzahl der Komorbiditäten, Tage von der Krankenhauseinweisung bis zur Aufnahme auf die Intensivstation, Interleukin-6-Spiegel (falls verfügbar). Der Gesamt-NUTRIC-Score reicht von 0 bis 10, wobei höhere Werte auf ein höheres Ernährungsrisiko hinweisen. Werte von 0-4 bedeuten ein geringes Ernährungsrisiko, während Werte von 5-9 ein hohes Ernährungsrisiko anzeigen.
HINWEIS: Detaillierte Informationen zum NIREC-Bewertungssystem sowie zu den APACHE II- und SOFA-Bewertungen finden Sie in der ergänzenden Tabelle S1.
- Um dieses Protokoll zu befolgen, verwenden Sie das speziell für Intensivpatienten entwickelte Bewertungssystem Nutrition Risk in the Critically Ill (NUTRIC) als primäres Instrument zur Bewertung des Ernährungsrisikos25. Der NUC-Score umfasst die folgenden Parameter: Alter, Acute Physiology and Chronic Health Evaluation (APACHE) II26, Sequential Organ Failure Assessment (SOFA) Score26, Anzahl der Komorbiditäten, Tage von der Krankenhauseinweisung bis zur Aufnahme auf die Intensivstation, Interleukin-6-Spiegel (falls verfügbar). Der Gesamt-NUTRIC-Score reicht von 0 bis 10, wobei höhere Werte auf ein höheres Ernährungsrisiko hinweisen. Werte von 0-4 bedeuten ein geringes Ernährungsrisiko, während Werte von 5-9 ein hohes Ernährungsrisiko anzeigen.
- Erläutern Sie den Patienten vor ihrer Teilnahme den Zweck, die Risiken, den Nutzen und die Rechte von Einzelpersonen als Studienteilnehmer. Holen Sie eine Einverständniserklärung von potenziellen Teilnehmern oder deren Angehörigen ein und dokumentieren Sie diese schriftlich. Stellen Sie die Kooperationsbereitschaft des Patienten während des Eingriffs sicher.
- Verwenden Sie die NUTRIC Nutrition Scoring Table25 (speziell für schwerkranke Patienten entwickelt), um den Ernährungszustand des Patienten zu bewerten.
- Führen Sie präoperatives Fasten für 6-8 Stunden durch, mit der Option der gastrointestinalen Dekompression.
- Beurteilen Sie vor dem Eingriff den Ernährungszustand, das Bewusstsein, den Allgemeinzustand, die Schluckfunktion, die Mund- und Nasenerkrankungen, die Magen-Darm-Funktion und das Kooperationsniveau des Patienten.
- Vorbereitung der Artikel
- Untersuchen Sie die Haupteinheit für die Platzierung der tragbaren Visualisierung NJ-Röhrchen auf ihre Funktionalität (Abbildung 1), überprüfen Sie die Unversehrtheit und das Verfallsdatum der Einweg-Visualisierungs-NJ-Röhrchenverpackung, bereiten Sie die Metoclopramid Hydrochlorid-Injektion, 2% Lidocain-Gel und steriles flüssiges Paraffinöl gemäß den Anweisungen des Arztes vor, besorgen Sie sich sterile Handtücher, Spritzen, Kochsalzlösung, Handschuhe und Klebeband.
HINWEIS: Detaillierte Informationen zur Vorbereitung von Artikeln finden Sie in der Zusatzdatei 1.
- Untersuchen Sie die Haupteinheit für die Platzierung der tragbaren Visualisierung NJ-Röhrchen auf ihre Funktionalität (Abbildung 1), überprüfen Sie die Unversehrtheit und das Verfallsdatum der Einweg-Visualisierungs-NJ-Röhrchenverpackung, bereiten Sie die Metoclopramid Hydrochlorid-Injektion, 2% Lidocain-Gel und steriles flüssiges Paraffinöl gemäß den Anweisungen des Arztes vor, besorgen Sie sich sterile Handtücher, Spritzen, Kochsalzlösung, Handschuhe und Klebeband.
2. Verfahren zur Platzierung von NJ-Sonden
- Überprüfen Sie vor dem Einsetzen des Schlauchs den Namen des Patienten, die Krankenhausnummer und den Namen des Eingriffs, um die Richtigkeit sicherzustellen.
- Schließen Sie das Netzteil (220 V, 60 Hz) an die visualisierte NJ-Röhrenplatzierungs-Haupteinheit an und schalten Sie sie durch Drücken der START-Taste ein.
- Öffnen Sie die Verpackung des Visualisierungs-NJ-Röhrchens und tauchen Sie das Röhrchen in eine sterile Behandlungsbiegung. Spülen Sie das Röhrchenlumen mit 2 x 20 mL steriler Kochsalzlösung.
- Führen Sie das Führungsdraht-Endoskop in den Hohlraum des NJ-Schlauchs ein, verbinden Sie den Ballon und den Wassersack und stellen Sie die Sehlinse für die richtige Visualisierung ein. Tragen Sie steriles flüssiges Paraffin auf die Außenseite des NJ-Rohrs auf, um eine ordnungsgemäße Schmierung zu gewährleisten.
- Wenn der Patient bei Bewusstsein ist, tragen Sie eine angemessene Menge 2% Lidocain-Gel auf ein Wattestäbchen auf und tragen Sie es dann auf die Nasenschleimhaut des Patienten auf, um eine Oberflächenanästhesie zu erreichen.
- Positionieren Sie den Patienten in Rückenlage, wobei das Bett in einem Winkel von 30-45° angehoben ist (Abbildung 2A).
- Führen Sie den Schlauch unter visueller Beobachtung durch das Nasenloch des Patienten ein und schieben Sie den Schlauch langsam etwa 1-2 cm nach vorne (Abbildung 2A). Wenn die Spitze des Schlauchs den Oropharynx erreicht und der Patient bei Bewusstsein ist, weisen Sie ihn an, freiwillig zu schlucken. Bei bewussten Komapatienten neigen Sie den Kopf und das Kinn nach unten, um die Halswirbelsäule zu strecken und den Eintritt in die Speiseröhre zu erleichtern. Kontinuierliche visuelle Beobachtung, um eine Fehlplatzierung in der Luftröhre zu vermeiden.
HINWEIS: Achten Sie auf die Durchgängigkeit der Nasengänge des Patienten. Wenn Schwierigkeiten aufgrund von Problemen wie einer Nasenscheidewandverkrümmung auftreten, wird empfohlen, das gegenüberliegende Nasenloch zu versuchen. - Achten Sie darauf, dass Sie beim langsamen Vorschieben des Schlauchs in Richtung Speiseröhre auf Widerstände achten, um eine mögliche Schädigung der Speiseröhrenschleimhaut zu vermeiden. In der Speiseröhre angekommen, beobachten Sie die blassrosa Schleimhaut mit Längsfalten.
- Während der Passage durch die Engstellen der Speiseröhre ist eine dynamische visuelle Beobachtung zu beobachten, indem Sie den Schlauch zum Einführen sanft drehen. Verzichten Sie auf gewaltsame Aktionen, navigieren Sie vorsichtig durch die drei schmalen Punkte, injizieren Sie je nach Bedarf Luft oder Kochsalzlösung und stellen Sie sicher, dass die Führungsdrahtlinse am vorderen Ende des visualisierten NJ-Tubus sauber ist, um ein klares Bild zu erhalten.
HINWEIS: In der normalen Speiseröhre gibt es drei Engstellen. Die erste Verengung befindet sich am Anfang der Speiseröhre, die zweite dort, wo sie sich hinter dem linken Hauptbronchus kreuzt, und die dritte am Haatus der Speiseröhre, wo sie durch das Zwerchfell verläuft. Die Schleimhaut der normalen Speiseröhre ist feucht, glatt und rosa, während die untere Schleimhaut der Speiseröhre leicht grau ist. Es gibt 7-10 vertikale Falten auf der Schleimhaut, und die Höhle erscheint konvex. - Fahren Sie fort, den Schlauch unter visueller Beobachtung langsam mit den Atembewegungen des Patienten zu schieben, jeweils etwa 1-2 cm.
- Wenn der Schlauch durch den gastroösophagealen Übergang (die Z-Linie) in die Magenhöhle eintritt, beobachten Sie die dunkelrosa Magenschleimhaut und die Peristaltik. Die Schleimhautoberfläche weist typischerweise unregelmäßige Falten und Vertiefungen auf (Abbildung 2B).
HINWEIS: Der gastroösophageale Übergang (die Z-Linie) ist ein anatomischer Punkt, der die Verschiebung von der Speiseröhrenschleimhaut zur Magenschleimhaut abgrenzt. Unter endoskopischer Beobachtung kann man den Übergang von einer blassrosa oder rosafarbenen Speiseröhrenschleimhaut zu einer dunkleren roten oder orange-gelben Magenschleimhaut erkennen. Das Vorhandensein einer erheblichen Menge an Mageninhalt kann die Platzierung der Sonde beeinträchtigen. Es wird empfohlen, eine präoperative Fastenzeit von 6-8 Stunden durchzusetzen und vor dem Eingriff eine kontinuierliche gastrointestinale Dekompression in Betracht zu ziehen. - Wenn die Sicht in den Magen unklar erscheint, injizieren Sie Kochsalzlösung (jeweils 10-20 ml) in den NJ-Schlauch, um alle Hindernisse zu entfernen, die die vordere Führungsdrahtlinse bedecken.
- Wenn sich der Schlauch im Magen kräuselt oder biegt, ziehen Sie den NJ-Schlauch auf eine Länge von 55-65 cm zurück und ziehen Sie ihn vorsichtig zurück, während Sie gleichzeitig den visualisierten Führungsdraht vorschieben, bis er sich reibungslos bewegt.
HINWEIS: Wir erkennen Kräuseln während des Eingriffs, indem wir die Flugbahn und Bewegung des Schlauchs mithilfe von Echtzeit-Visualisierungstechniken wie der Retroflex-Ansicht akribisch beobachten, um das Aufwickeln zu erkennen. Dazu gehört die Überwachung des Fortschritts der Sonde durch den Magen-Darm-Trakt und das Notieren von Abweichungen oder Schleifen, die auf eine Kräuselung hinweisen können. Bei Bedarf können wir das Vorhandensein von Lockenbildung auch durch Röntgenaufnahmen des Abdomens bestätigen. - Unter kontinuierlicher dynamischer visueller Beobachtung setzen Sie das Einführen der Sonde langsam fort, passen Sie sich an die Magenperistaltik an und suchen Sie nach dem Pylorus.
- Wenn der Pylorus nicht gefunden wird, ziehen Sie den visualisierten Endoskop-Führungsdraht vorübergehend zurück und stellen Sie die Länge des NJ-Schlauchs auf 55-65 cm ein. Bringen Sie den Patienten in eine rechte Seitenlage, injizieren Sie ca. 100-200 ml Kochsalzlösung/Luft und führen Sie den visualisierten Endoskop-Führungsdraht wieder ein. Identifizieren Sie die Position durch die Magen-Darm-Schleimhaut, nehmen Sie entsprechende Anpassungen vor und führen Sie langsam ein.
- Sobald der Pylorus bestätigt ist, drehen Sie den Griff, um die Ausrichtung des Schlauchs anzupassen und den Durchgang durch den Pylorus präziser zu erleichtern. Stellen Sie sicher, dass die Position und Richtung des Rohrs während des langsamen Vorschubs kontinuierlich beobachtet wird, und nehmen Sie bei Bedarf die notwendigen Anpassungen für eine optimale Navigation vor.
- Nachdem der Schlauch den Pylorus passiert und in den Zwölffingerdarm eingedrungen ist, sind die typischen fingerartigen Zotten der Zwölffingerdarmschleimhaut zu beobachten (Abbildung 2C). Drehen Sie den visualisierten Endoskop-Führungsdraht vorsichtig und ziehen Sie ihn teilweise zurück, indem Sie gleichzeitig Wasser (ca. 20 ml) einträufeln, während Sie den Schlauch vorschieben (um ein Abknicken zu verhindern), und führen Sie ihn langsam ein.
HINWEIS: Die Methode der Wasserinstillation erleichtert die Darmentleerung und sorgt für ein klares Bild. Identifizieren Sie die Position durch die Zwölffingerdarmschleimhaut, um Schleimhautschäden zu vermeiden. - Fahren Sie mit dem langsamen Einführen des Katheters fort und bewegen Sie sich nacheinander durch den Zwölffingerdarm, durch absteigende, quer und aufsteigende Teile des Zwölffingerdarms. Positioniere den Röhrenkopf im Jejunum.
- Nachdem Sie den Tubus platziert haben, ziehen Sie die Führungsdrahtlinse langsam ein.
- Andere Methoden zur Überprüfung der Rohrplatzierung
- Aspirieren Sie die Verdauungsflüssigkeit mit einer Spritze, beobachten Sie die Farbe und das Volumen und messen Sie den pH-Wert. Wenn sich die Röhrchenspitze im Darmlumen befindet, erwarten Sie <10 ml Flüssigkeit mit einer goldgelben Farbe und einem pH-Wert > 7,0. Wenn sich die Sondenspitze im Magen befindet, erwarten Sie >20 ml Flüssigkeit, die hellgrün, klar, farblos oder braun erscheinen kann, mit einem pH-Wert < 5,0.
HINWEIS: Diese Methode ist während des Platzierungsprozesses nicht unbedingt erforderlich. Darüber hinaus kann der pH-Wert der aspirierten Flüssigkeit durch Faktoren wie Medikamente oder Ernährungslösungen beeinflusst werden. - Führen Sie einen Vakuumtest durch, indem Sie sanft Luft einblasen und ansaugen, um einen Unterdruck zu erzeugen. Das Einspritzen von 10 ml Luft und das Ansaugen von <5 ml deutet darauf hin, dass der Schlauch durch den Pylorus gelaufen ist.
HINWEIS: Der Kontakt der Spitze mit der Wand kann die Ergebnisse beeinträchtigen. - Röntgenaufnahme des Abdomens: Lassen Sie den Patienten flach liegen und machen Sie eine Röntgenaufnahme am Krankenbett. Wenn das Röntgenbild den Verlauf der Röhre in einer "C"-Form gegen den Uhrzeigersinn zeigt, befindet sich die Röhrenspitze in der Zwölffingerdarmhöhle.
- Aspirieren Sie die Verdauungsflüssigkeit mit einer Spritze, beobachten Sie die Farbe und das Volumen und messen Sie den pH-Wert. Wenn sich die Röhrchenspitze im Darmlumen befindet, erwarten Sie <10 ml Flüssigkeit mit einer goldgelben Farbe und einem pH-Wert > 7,0. Wenn sich die Sondenspitze im Magen befindet, erwarten Sie >20 ml Flüssigkeit, die hellgrün, klar, farblos oder braun erscheinen kann, mit einem pH-Wert < 5,0.
- Fixierung des Schlauchs
- Wenn die Nasenhaut des Patienten intakt ist, wenden Sie die Zickzack-Methode mit einer High-Lift-Plattform an. Bei Hautschäden an der Nasenhaut führen Sie die Schmetterlingsfixierungsmethode mit einer High-Lift-Plattform durch.
HINWEIS: Detaillierte Informationen zur Sondenfixierung und Pflegedetails für den NJ-Schlauch finden Sie in der ergänzenden Datei 1.
- Wenn die Nasenhaut des Patienten intakt ist, wenden Sie die Zickzack-Methode mit einer High-Lift-Plattform an. Bei Hautschäden an der Nasenhaut führen Sie die Schmetterlingsfixierungsmethode mit einer High-Lift-Plattform durch.
Ergebnisse
Klinische Ergebnisse
In dieser Studie wurden insgesamt 19 kritisch kranke Patienten auf der Intensivstation unter Visualisierungsanleitung einer NJ-Sonde platziert. Unter den Probanden befanden sich 12 Männer (63,16 %) und 7 Frauen (36,84 %) mit einem Durchschnittsalter von 64,47 ± 13,43 Jahren. Diagnosen waren u.a. schwere Lungenentzündung (n = 6, 31,58%), Sepsis (n = 1, 5,26%), erfolgreiche Wiederbelebung durch Herzstillstand (n = 1, 5,26%), akute Pankreatitis (n = 1, 5,26%), akute Verschlimmerung einer chronisch obstruktiven Lungenerkrankung (n = 3, 15,79%), Kleinhirnatrophie (n = 1, 5,26%), Hirnblutung (n = 4, 21,05%), Hirninfarkt (n = 1, 5,26%), Schädel-Hirn-Trauma (ohne Schädelbasisfraktur) (n = 1, 5,26 %), Bewusstseinsstörungen (n = 15, 78,95 %) und Patienten, die invasiv beatmet werden mussten (n = 18, 94,74 %) (Tabelle 1). Die NUTRIC-Scores dieser Patienten bei der Aufnahme auf die Intensivstation betrugen 6,68 ± 1,11 (Tabelle 1). Alle diese Patienten stellten sich mit einer akuten gastrointestinalen Dysfunktion vor, die mit einem hohen Risiko für gastroösophagealen Reflux und Aspiration einherging.
Durch die Anwendung der oben genannten Methode erreichte die Erfolgsquote bei der Platzierung der Sonde 100%. Konkret betrug die anfängliche Erfolgsrate der ersten Sonde 94,74 %, wobei die zweite Sonde in einem Fall erfolgreich platziert wurde. Die durchschnittliche Einfügezeit betrug 11,21 ± 6,44 min (Tabelle 2). Die häufigsten Langzeitkomplikationen waren versehentliche Sondenentfernungen14. Nach einem versehentlichen Ziehen des Schlauches während der Verwendung des NJ-Schlauchs oder wenn der Verdacht bestand, dass sich der Schlauch während des Platzierens im Magen wickelt, bestätigen wir die Spitzenposition des Schlauches durch Röntgenaufnahmen des Abdomens. Bei fünf Patienten konnte die Positionierung der Röhrenspitze im absteigenden Abschnitt des Zwölffingerdarms durch abdominale Röntgenaufnahmen bestätigt werden (Abbildung 3), während die übrigen Fälle unter direkter Visualisierung bestätigt wurden. Zu den Komplikationen gehörten leichte gastrointestinale Blutungen (1 Fall, ohne sichtbares Blut im Stuhl, ohne Hämatemesis und ein positiver okkulter Bluttest in der Magenflüssigkeit, Tabelle 2). Es gab keine Fälle von gastrointestinalen Perforationen und keine Fälle von versehentlichem Eintritt in die Atemwege (Tabelle 2).
Bei Patienten, die sich einer minimalinvasiven visualisierten Sondenplatzierung unterzogen, kam es während des Sondenplatzierungsprozesses zu einem leichten Anstieg der Herzfrequenz (HR) und der Atemfrequenz (R) im Vergleich zu den Werten vor der Sondenplatzierung (P < 0,05, Tabelle 3). Der mittlere arterielle Druck (MAP) zeigte einen leichten Anstieg ohne statistischen Unterschied (P > 0,05, Tabelle 3). Nach 2-wöchiger enteraler Ernährungsunterstützung zeigten diese Patienten einen signifikanten Anstieg der Serumalbumin- und Präalbuminspiegel im Vergleich zu den Werten vor der Platzierung (P < 0,05, Tabelle 3), was einen statistisch signifikanten Unterschied zeigt. Nach Ernährungsunterstützung und anderen umfassenden Behandlungsmaßnahmen zeigten die Patienten eine signifikante Abnahme der APACHE II- und SOFA-Werte26 im Vergleich zu ihren Werten bei der Aufnahme auf die Intensivstation, was auf einen statistisch signifikanten Unterschied hindeutet (P < 0,05, Tabelle 3). Die durchschnittliche Dauer des Krankenhausaufenthalts für diese Patienten betrug 34,74 ± 20,38 Tage, wie in Tabelle 2 dargestellt.
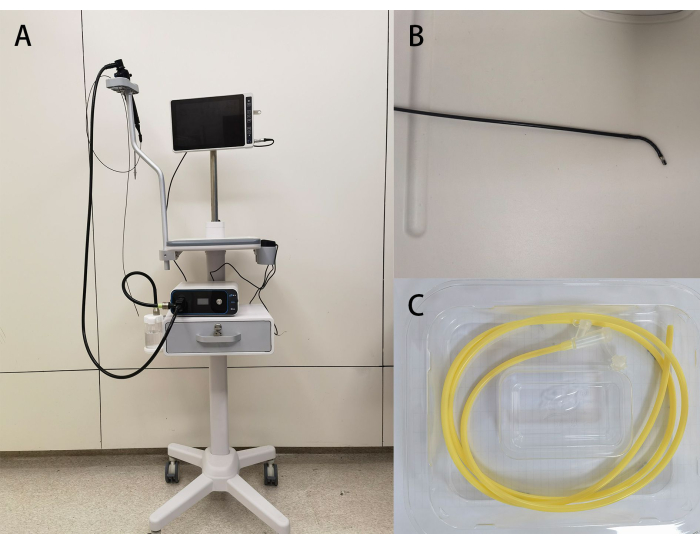
Abbildung 1: Gerätebilder. (A) Ein Überblick über den Bildprozessor für medizinische Endoskope; (B) die Lenkfähigkeit des Führungsdrahtendoskops; (C) die begleitende Nasojejunalsonde zum Einmalgebrauch. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
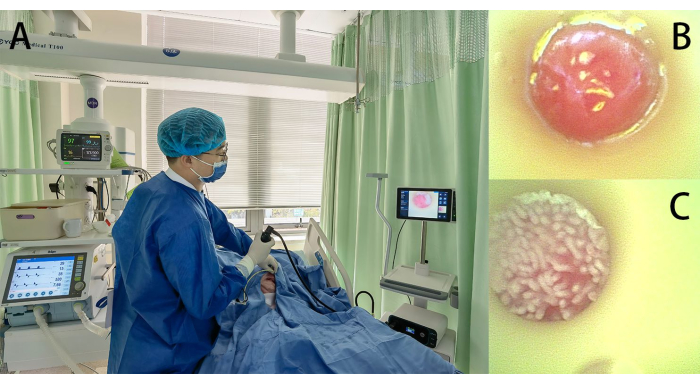
Abbildung 2: Platzierung des Nasojejunalkanüls. (A) Das Verfahren während der Operation; (B) das endoskopische Bild der Magenschleimhaut, das vom Führungsdraht-Endoskop aufgenommen wurde; (C) das endoskopische Bild der Dünndarmschleimhaut, das vom Führungsdraht-Endoskop aufgenommen wurde und das Vorhandensein von Dünndarmzotten zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Röntgenbild des Abdomens. Die NJ-Sondenspitze befindet sich im absteigenden Abschnitt des Zwölffingerdarms, während sich ein aufgerollter Teil des Schlauchs im Magen befindet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| N=19, (Mittelwert ± SD) | |
| Charakteristisch | |
| Alter (Mittelwert ± SD) | 64.47±13.43 kg |
| Sex nein. (%) | |
| Männlich | 12 (63.16) |
| Weiblich | 7 (36.84) |
| Krankheiten Nr. (%) | |
| Schwere Lungenentzündung | 6 (31.58) |
| Sepsis | 1 (5.26) |
| AECOPD | 3 (15.79) |
| Erfolgreiche Wiederbelebung nach Herzstillstand | 1 (5.26) |
| Kleinhirnatrophie | 1 (5.26) |
| Hirnblutung | 4 (21.05) |
| Hirninfarkt | 1 (5.26) |
| Schädel-Hirn-Trauma (ohne Schädelbasisfraktur) | 1 (5.26) |
| Verändertes Bewusstsein | 15 (78.95) |
| Patienten, die eine invasive mechanische Beatmung benötigen | 18 (94.74) |
| Bewusstseins-Zustands-Nr. (%) | |
| Koma | 15 (78.95) |
| Bewusst | 4 (21.05) |
| NUTRIC-Punkt# | 6.68±1.11. |
Tabelle 1: Demografische und klinische Merkmale der Patienten zu Studienbeginn. #Der NUTRIC-Score wird nur bei der Aufnahme auf die Intensivstation bewertet. Abkürzungen: AECOPD = akute Exazerbation einer chronisch obstruktiven Lungenerkrankung, NUTRIC Score = Der Ernährungsrisiko-Score für kritische Erkrankungen, Krankenhausaufenthalt (Tage) = die Summe der Zeit, die auf der Intensivstation verbracht wurde, um die Behandlung zu überwachen, plus die Zeit, die nach dem Verlassen der Intensivstation auf der allgemeinen Station verbracht wurde, SD = Standardabweichung; Mittelwert ±Standardabweichung.
| N=19, (Mittelwert ± SD) | |
| Durchschnittliche Einfügezeit (min) | 11.21 ± 6.44 Uhr |
| Erfolgsquote bei der Erstplatzierung der Sonde Nr. (%) | 18 (94.74) |
| Die Position der NJ Tube Tip Nr. (%) | |
| Zwölffingerdarm-Zwiebel | 1 (5.26) |
| Absteigender Teil des Zwölffingerdarms | 3 (15.79) |
| Transerser Teil des Zwölffingerdarms | 2 (10.53) |
| Aufsteigender Teil des Zwölffingerdarms | 5 (26.32) |
| Oberer Teil des Jejunums | 8 (42.10) |
| *Röntgen-Nr. (%) | 5 (26.32) |
| Entlüftungs-Nr. (%) | 1 (5.26) |
| Gaslrointestinale Perforation Nr. (%) | 0 (0) |
| Fälle von versehentlichem Eindringen in die Atemwege Nr. (%) | 0 (0) |
| Krankenhausaufenthalt (Tage) | 34,74 ± 20,38 |
Tabelle 2: Erfolgsrate der ersten Sondenplatzierung, durchschnittliche Einführzeit, Komplikationsrate und Krankenhausaufenthalt. *Röntgenaufnahmen Anzahl der Patienten, bei denen die Position der Spitze der NJ-Röhre durch ein Röntgenbild des Abdomens bestätigt wurde. Abkürzungen: Krankenhausaufenthalt (Tage) = die Summe der Zeit, die auf der Intensivstation verbracht wurde, um die Behandlung zu überwachen, plus die Zeit, die nach dem Verlassen der Intensivstation auf der allgemeinen Abteilung verbracht wurde, SD = Standardabweichung; Mittelwert ±Standardabweichung.
| Vor der Katheterisierung | Während der Katheterisierung | p-Wert | |
| (n=19) | (n=19) | ||
| (Mittelwert ±SD) | (Mittelwert ±SD) | ||
| KARTE (mmHg) | 93.37±15.96 kg | 96.39±11.67 kg | 0.288 |
| Herzfrequenz (bpm) | 83.11±15.61 | 92.21±14.92 | 0.000 |
| R (bpm) | 17.32±3.77 Uhr | 19.53±3.45 Uhr | 0.009 |
| Vor der Katheterisierung | Nach der Katheterisierung | ||
| ALB (g/L) | 27.10±5.05* | 34.51±5.08** | 0.000 |
| Präalbumin (mg/L) | 135,38±52,80* | 208.69±47.85** | 0.000 |
| APACHE II-Punktzahl | 20.26±5.05* | 10.84±4.15 Uhr*** | 0.000 |
| SOFA Punktzahl | 9.53±4.11* | 2.47±2.72*** | 0.000 |
Tabelle 3: Vitalparameter, APACHE II- und SOFA-Werte sowie Laborergebnisse. *Bei Aufnahme auf die Intensivstation. **Enterale Ernährungstherapie nach 2 Wochen. Bei der Verlegung aus der Intensivstation. Herzfrequenz, Atemfrequenz, mittlerer arterieller Druck, APACHE II- und SOFA-Scores, Serumalbumin und Serumpräalbumin wurden einer statistischen Analyse mit Hilfe von t-Tests bei gepaarten Stichproben unterzogen. Der Normalbereich für Serumalbumin liegt bei 40-55 g/L und der Normalbereich für Serumpräalbumin bei 200-430 mg/L. Abkürzungen: HR = Herzfrequenz, R = Atemfrequenz, MAP = mittlerer arterieller Druck. APACHE II-Score = Akutphysiologie- und chronischer Gesundheitszustand II-Score, SOFA-Score = sequentieller Organversagens-Score, SD = Standardabweichung.
Ergänzende Akte 1: Die Krankenpflege von NJ Tube. Die detaillierten Informationen zur pflegerischen Versorgung für die NJ Sonde. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle S1: Das NIREC-Punktesystem, die APACHE II- und SOFA-Punkte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wir verwendeten ein kleines Visualisierungstool, um NJ-Schläuche am Bett des Patienten einzuführen. Durch den Einsatz von Visualisierungsmethoden und die Anpassung der Patientenpositionierung erreichten wir eine Erfolgsquote von 94,47 % für die Erstplatzierung der Sonde. Die durchschnittliche Zeit für das Einführen des Schlauchs betrug nur 11,21 ± 6,44 min (Tabelle 2). Ein Patient scheiterte zunächst bei der Intubation, wurde aber erfolgreich intubiert, nachdem er 20 Minuten vor dem zweiten Versuch eine intramuskuläre Injektion von 10 mg Metoclopramid erhalten hatte (Tabelle 2).
In den letzten Jahren haben zahlreiche Studien die Anwendung verschiedener Methoden und Techniken in der enteralen Ernährungsunterstützung gezeigt. In einigen Studien wurde die Anwendbarkeit und Wirksamkeit verschiedener Arten von Sonden in bestimmten Kontexten diskutiert, wie z. B. Nasogastric-Sonden, NJ-Sonden und Magenfistelsonden 27,28,29. Aufgrund des häufigen Auftretens von Funktionsstörungen des Magens bei Patienten auf der Intensivstation, die zu einem hohen Risiko für gastroösophagealen Reflux und Aspiration führen, besteht eine erhöhte Wahrscheinlichkeit, eine Aspirationspneumonie zu entwickeln und eine Verschlechterung des Atemversagens zu verschlimmern. Daher kann für Patienten ohne Kontraindikationen für die enterale Ernährung eine NJ-Sonde die bevorzugte Option sein. Die effektive Positionierung des NJ-Schlauchs an einem genauen Ort stellt jedoch eine Schwierigkeit für klinische Gesundheitsdienstleister dar.
Jüngste Fortschritte haben Techniken wie ultraschallgeführte, magnetisch geführte, perkutane punktionsgeführte und endoskopisch geführte Methoden eingeführt, um die Präzision und Sicherheit der Platzierung von enteralen Ernährungssonden zu verbessern 16,29,30,31. Für die Platzierung der NJ-Sonde wird eine magnetische Spitzenführung verwendet, bei der ein Führungsdraht mit magnetischer Spitze verwendet wird, um die Sonde durch den Magen-Darm-Trakt in den Dünndarm zu navigieren15. Die universelle Anwendbarkeit ist jedoch eingeschränkt, da magnetische Bildgebungsgeräte benötigt werden, die nicht in allen medizinischen Einrichtungen verfügbar sind. Das Vorhandensein magnetischer Gegenstände in der Nähe des Patienten kann ebenfalls die genaue Platzierung des Schlauchs beeinträchtigen32. Ultraschall am Krankenbett ist wertvoll für die Bestätigung der NJ-Sonde33. Bei Patienten mit anatomischen Variationen oder Fettleibigkeit können jedoch Herausforderungen auftreten, die die genaue Visualisierung der Röhrenspitzen beeinträchtigen. Mageninhalt oder Luft im Magen-Darm-Trakt können die Genauigkeit des Ultraschalls beeinträchtigen und die Bestätigung der Sondenplatzierungerschweren 34.
Unabhängig davon, ob die NJ-Sonde von einem Magnetkopf geführt oder mit Ultraschalllokalisierung positioniert wird, bleibt die schnelle und genaue Navigation durch den Pylorus eine Herausforderung. Dieser Prozess erfordert immer noch einen erfahrenen, hochqualifizierten und geduldigen operierenden Arzt. Eine erfolgreiche Platzierung ist in der Regel mit einem erheblichen Zeitaufwand verbunden, und bei Patienten mit komplizierter Anatomie kann sich eine erfolgreiche Platzierung als besonders schwierig erweisen. Darüber hinaus können noch ergänzende röntgenologische Untersuchungen wie Röntgenaufnahmen am Krankenbett erforderlich sein, um die genaue Lage der Röhrenspitze, wie z. B. das Vorhandensein im Dünndarm, genau zu bestimmen. Befindet sich die Sondenspitze nicht im Dünndarm oder ist sie zu tief positioniert, ist eine Neupositionierung oder Anpassung der Sondenspitze erforderlich, was oft wiederholte Röntgenuntersuchungen erforderlich macht. Dies setzt den Patienten mehreren Röntgenstrahlen aus, was zu erhöhten Gesundheitskosten beiträgt. In dieser Studie ermöglichte die direkte Visualisierung der Dünndarmschleimhaut durch das Endoskop die unmittelbare Bestätigung der Position der Eileiterspitze. Nach einem versehentlichen Ziehen des Schlauchs während der Verwendung des NJ-Schlauchs oder wenn der Verdacht bestand, dass sich der Schlauch während der Platzierung im Magen wickelte, validierten wir die Position der Sondenspitze durch Röntgenuntersuchungen am Krankenbett bei einer Untergruppe von Patienten weiter (n = 5, Tabelle 2). Folglich machten die NJ-Röhrchen, die in dieser Studie mit der visuellen Methode platziert wurden, keine zusätzlichen bildgebenden Untersuchungen erforderlich.
Die endoskopisch geführte NJ-Sondenplatzierung ist ein fortschrittliches Verfahren, bei dem ein Endoskop verwendet wird, um den Schlauch in den Dünndarm zu führen35. Diese Methode ist im Allgemeinen Patienten mit schwieriger oder komplexer Anatomie vorbehalten oder solchen, die bereits erfolglose Versuche unternommen haben, eine NJ-Sonde zu platzieren. Dennoch hat das Verdauungsendoskop einen größeren Durchmesser und kann nur durch den Mund eingeführt werden, was zu erhöhten Beschwerden für den Patienten führen kann. Die endoskopisch geführte Platzierung einer NJ-Sonde ist im Vergleich zur Standard-Gastroskopie häufig ein zeitaufwändigerer Eingriff. In bestimmten Fällen kann eine Vollnarkose für den gesamten Platzierungsprozess erforderlich sein. In dieser Studie erleichterte die Verwendung eines miniaturisierten Endoskops mit integriertem Führungsdraht und Linse mit einem Gesamtdurchmesser von nur 2 mm den transnasalen Zugang, was zu einer Verringerung der Patientenbeschwerden beitrug. Während des Platzierungsprozesses kam es zu einem leichten Anstieg der Herzfrequenz und der Atemfrequenz des Patienten mit einem leichten, statistisch nicht signifikanten Anstieg des durchschnittlichen arteriellen Drucks (P > 0,05, Tabelle 3). Darüber hinaus wurden alle Patienten in dieser Studie erfolgreich am Krankenbett intubiert, wodurch die Notwendigkeit entfiel, kritisch kranke Patienten zu verlegen und die damit verbundenen Risiken zu mindern.
Ähnlich wie herkömmliche Endoskope verfügt das in dieser Studie verwendete Mini-Endoskop über eine Lenkfunktion. Dieses Design erleichtert die erfolgreiche Platzierung von NJ-Schläuchen, auch bei Patienten mit komplexer Anatomie. Bei der "Through-the-Scope"-Methode wird eine kleine Ernährungssonde (7F oder 10F) durch den Biopsiekanal des Endoskops in das Jejunum geführt, woraufhin das Endoskop zurückgezogen und die Sonde an Ort und Stelle belassen wird. Der Eingriff ist abgeschlossen, nachdem der Schlauch vom oralen in den nasalen Zugang überführt wurde. Bosco et al.36 berichteten von einer Erfolgsquote von 90% mit dieser Technik, bei einer durchschnittlichen Eingriffszeit von 19 Minuten. Diese Methode hat jedoch Einschränkungen. Nur Röhrchen mit kleinem Durchmesser passen in den Biopsiekanal. Zusätzlich zu der Anforderung eines therapeutischen oberen Endoskops, um die 10F-NJ-Sonde "durch das Oszilloskop" zu führen, muss auch ein Mund-Nasen-Transfer durchgeführt werden. In dieser Studie konnten wir eine 14F NJ-Sonde einführen. Der größere Durchmesser des NJ-Schlauchs ermöglicht die Verwendung einer größeren Vielfalt an Nahrungsflüssigkeiten in klinischen Anwendungen und reduziert gleichzeitig das Risiko einer Verstopfung.
Die perkutane endoskopische Gastrostomiesonde mit Jejunalverlängerung (PEG-J) ist ein Verfahren zur enteralen Ernährung von Patienten, die keine orale oder gastrische Ernährung vertragen37. Die PEG-J-Technik ist zwar effektiv bei der enteralen Ernährung, hat aber Nachteile, die Aufmerksamkeit erfordern. Das Einsetzen einer PEG-J-Sonde erfordert ein hohes Maß an Fachwissen und Erfahrung und ist ein invasives Verfahren, das möglicherweise nicht für alle Patienten geeignet ist38. Zudem zieht sich der Platzierungsprozess in die Länge. Unsere Methode hingegen wurde effizient mit einer relativ kurzen Dauer und minimalem Trauma abgeschlossen, was sie besonders für bewusste Patienten geeignet macht. Darüber hinaus wurden bei keinem der Studienteilnehmer Hinweise auf eine gastrointestinale Perforation und keine Fälle von versehentlichem Eintritt in die Atemwege festgestellt. Es gab nur einen Fall mit einem geringfügigen Auftreten von Magenblutungen (Tabelle 2).
In dieser Studie sanken die APACHE II- und SOFA-Scores dieser kritisch kranken Patienten nach einer enteralen Ernährungsunterstützungstherapie und anderen umfassenden Managementbehandlungen im Vergleich zu ihren Werten bei der Aufnahme auf die Intensivstation signifikant (Tabelle 3). Die durchschnittliche Dauer des Krankenhausaufenthalts betrug 34,74 ± 20,38 Tage, wie in Tabelle 2 dargestellt. Dies zeigt, dass die visualisierungsgesteuerte Sondenplatzierungsmethode einen frühen Beginn der enteralen Ernährungsunterstützungstherapie ermöglicht und dadurch den Zustand und die Prognose des Patienten verbessert.
Nichtsdestotrotz ist es wichtig, die Grenzen dieser Studie anzuerkennen, insbesondere um ein klares Bild mit der Führungsdrahtlinse des Mikroendoskops zu erhalten, ist es zwingend erforderlich, dass das Kopfende des NJ-Schlauchs offen bleibt. Folglich sind Anpassungen an der Position des Kopfes der Führungsdrahtlinse und des Katheters erforderlich, bevor mit der Platzierung des Schlauchs begonnen wird. Diese Anpassung ist wichtig, um zu verhindern, dass das Kopfende der Führungsdrahtlinse den Katheter überragt, wodurch das Risiko von Verletzungen der Magen-Darm-Schleimhaut, Blutungen und Perforationen verringert wird. In zukünftigen Studien planen wir, das Design von Führungsdrahtlinsen und NJ-Tuben zu verbessern, um die Bildschärfe zu verbessern und die damit verbundenen Risiken zu mindern.
Zusammenfassend lässt sich sagen, dass die beschriebene Methode unkompliziert, sicher und effizient ist, was eine schnelle Implementierung am Krankenbett ermöglicht und sich besonders für kritisch kranke Patienten auf der Intensivstation eignet. Diese visualisierte Methode bietet eine vielversprechende Alternative für die Platzierung von NJ-Sonden bei kritisch kranken Patienten auf der Intensivstation, verbessert die Erfolgsraten und minimiert die Beschwerden der Patienten. Weitere Verfeinerungen im Design und zusätzliche Studien sind erforderlich, um die Technik zu optimieren und mögliche Einschränkungen zu beseitigen.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Studie wurde von verschiedenen Kollegen aus der Klinik für Intensivmedizin und der Abteilung für Orthopädie des Krankenhauses unterstützt. Diese Forschung erhielt externe Mittel aus dem Medical and Health Science and Technology Program der Provinz Zhejiang (2019RC170) und dem Allgemeinen wissenschaftlichen Forschungsprojekt des Bildungsministeriums der Provinz Zhejiang (Y201941857).
Materialien
| Name | Company | Catalog Number | Comments |
| Disposable nasogastrointestinal tube | JiangSu Jianzhiyuan Medical Instrument Technology Co., Ltd. | W -4.7-1400mm -4.7-1400mm | The outer diameter of the guide tube is 4.7 mm. |
| Lidocaine Hydrochloride Gel | Manufacturers are not limited | For local anaesthesia | |
| Medical Endoscopy Image Processor | JiangSu Jianzhiyuan Medical Instrument Technology Co., Ltd. | HD1080 | The diameter of the guide wire lens is 2 mm. |
| Metoclopramide Dihydrochloride Injection | Manufacturers are not limited | Promote gastric motility | |
| SPSS 20.0 software | International Business Machines Corporation | Statistical analysis | |
| Sterile liquid paraffin oil | Manufacturers are not limited | For catheter lubrication |
Referenzen
- van Zanten, A. R. H., De Waele, E., Wischmeyer, P. E. Nutrition therapy and critical illness: practical guidance for the ICU, post-ICU, and long-term convalescence phases. Crit Care. 23 (1), 368(2019).
- Lambell, K. J., Tatucu-Babet, O. A., Chapple, L. A., Gantner, D., Ridley, E. J. Nutrition therapy in critical illness: a review of the literature for clinicians. Crit Care. 24 (1), 35(2020).
- Zaher, S. Nutrition and the gut microbiome during critical illness: A new insight of nutritional therapy. Saudi J Gastroenterol. 26 (6), 290-298 (2020).
- Ozdemir, U., Yildiz, S., Aygencel, G., Turkoglu, M. Ultrasonography-guided post-pyloric feeding tube insertion in medical intensive care unit patients. J Clin Monit Comput. 36 (2), 451-459 (2022).
- de-Aguilar-Nascimento, J. E., et al. ACERTO guidelines of perioperative nutritional interventions in elective general surgery. Rev Col Bras Cir. 44 (6), 633-648 (2017).
- Jia, Z. Y., et al. Screening of nutritional risk and nutritional support in general surgery patients: a survey from Shanghai, China. Int Surg. 100 (5), 841-848 (2015).
- Wan, B., Fu, H., Yin, J. Early jejunal feeding by bedside placement of a nasointestinal tube significantly improves nutritional status and reduces complications in critically ill patients versus enteral nutrition by a nasogastric tube. Asia Pac J Clin Nutr. 24 (1), 51-57 (2015).
- Jiang, W., et al. Early enteral nutrition in neonates with partial gastrectomy: a multi-center study. Asia Pac J Clin Nutr. 25 (1), 46-52 (2016).
- McClave, S. A., et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N). JPEN J Parenter Enteral Nutr. 40 (2), 159-211 (2016).
- Corrigan, M. L., Bobo, E., Rollins, C., Mogensen, K. M. Academy of Nutrition and Dietetics and American Society for Parenteral and Enteral Nutrition: Revised 2021 standards of practice and standards of professional performance for registered dietitian nutritionists (competent, proficient, and expert) in nutrition support. Nutr Clin Pract. 36 (6), 1126-1143 (2021).
- Caulfield, K. A., Page, C. P., Pestana, C. Technique for intraduodenal placement of transnasal enteral feeding catheters. Nutrition in Clinical Practice. 6 (1), 23-26 (1991).
- Blaser, A. R., Starkopf, J., Kirsimagi, U., Deane, A. M. Definition, prevalence, and outcome of feeding intolerance in intensive care: a systematic review and meta-analysis. Acta Anaesthesiol Scand. 58 (8), 914-922 (2014).
- Lai, C. W., Barlow, R., Barnes, M., Hawthorne, A. B. Bedside placement of nasojejunal tubes: a randomised-controlled trial of spiral- vs straight-ended tubes. Clin Nutr. 22 (3), 267-270 (2003).
- Wiggins, T. F., DeLegge, M. H. Evaluation of a new technique for endoscopic nasojejunal feeding-tube placement. Gastrointest Endosc. 63 (4), 590-595 (2006).
- Taylor, S. J., Karpasiti, T., Milne, D. Safety of blind versus guided feeding tube placement: Misplacement and pneumothorax risk. Intensive Crit Care Nurs. 76, 103387(2023).
- Mumoli, N., et al. Bedside abdominal ultrasound in evaluating nasogastric tube placement: A multicenter, prospective, cohort study. Chest. 159 (6), 2366-2372 (2021).
- Hillard, A. E., Waddell, J. J., Metzler, M. H., McAlpin, D. Fluoroscopically guided nasoenteric feeding tube placement versus bedside placement. South Med J. 88 (4), 425-428 (1995).
- Cresci, G., Martindale, R. Bedside placement of small bowel feeding tubes in hospitalized patients: a new role for the dietitian. Nutrition. 19 (10), 843-846 (2003).
- Patrick, P. G., Marulendra, S., Kirby, D. F., DeLegge, M. H. Endoscopic nasogastric-jejunal feeding tube placement in critically ill patients. Gastrointest Endosc. 45 (1), 72-76 (1997).
- Schwab, D., et al. Endoscopic placement of nasojejunal tubes: a randomized, controlled, prospective trial comparing suitability and technical success for two different tubes. Gastrointest Endosc. 56 (6), 858-863 (2002).
- Fanara, B., Manzon, C., Barbot, O., Desmettre, T., Capellier, G. Recommendations for the intra-hospital transport of critically ill patients. Crit Care. 14 (3), 87(2010).
- Neumann, D. A., DeLegge, M. H. Gastric versus small-bowel tube feeding in the intensive care unit: A prospective comparison of efficacy. Crit Care Med. 30 (7), 1436-1438 (2002).
- Levy, H. Nasogastric and nasoenteric feeding tubes. Gastrointest Endosc Clin N Am. 8 (3), 529-549 (1998).
- Dranoff, J. A., Angood, P. J., Topazian, M. Transnasal endoscopy for enteral feeding tube placement in critically ill patients. Am J Gastroenterol. 94 (10), 2902-2904 (1999).
- Rahman, A., et al. Identifying critically-ill patients who will benefit most from nutritional therapy: Further validation of the "modified NUTRIC" nutritional risk assessment tool. Clin Nutr. 35 (1), 158-162 (2016).
- Mutchmore, A., Lamontagne, F., Chasse, M., Moore, L., Mayette, M. Automated APACHE II and SOFA score calculation using real-world electronic medical record data in a single center. J Clin Monit Comput. 37 (4), 1023-1033 (2023).
- Zanley, E., et al. Guidelines for gastrostomy tube placement and enteral nutrition in patients with severe, refractory hypoglycemia after gastric bypass. Surg Obes Relat Dis. 17 (2), 456-465 (2021).
- Chen, M. C., Chao, H. C., Yeh, P. J., Lai, M. W., Chen, C. C. Therapeutic efficacy of nasoenteric tube feeding in children needing enteral nutrition. Front Pediatr. 9, 646395(2021).
- Wang, L., Tian, Z., Liu, Y. Nasoenteric tube versus jejunostomy for enteral nutrition feeding following major upper gastrointestinal operations: a meta-analysis. Asia Pac J Clin Nutr. 26 (1), 20-26 (2017).
- Liu, Z., et al. Evaluation of ultrasound-guided Freka-Trelumina enteral nutrition tube placement in the treatment of acute pancreatitis. BMC Gastroenterol. 20 (1), 21(2020).
- Chen, Y., et al. A multifaceted comparative analysis of image and video technologies in gastrointestinal endoscope and their clinical applications. Front Med (Lausanne). 10, 1226748(2023).
- Roy, S., Santosh, K. C. Analyzing overlaid foreign objects in chest X-rays-clinical significance and artificial intelligence tools. Healthcare (Basel). 11 (3), 308(2023).
- Ferraboli, S. F., Beghetto, M. G. Bedside ultrasonography for the confirmation of nasogastric tube placement: agreement between nurse and physician. Rev Gaucha Enferm. 43, 20220211(2022).
- Valla, F. V., Cercueil, E., Morice, C., Tume, L. N., Bouvet, L. Point-of-care gastric ultrasound confirms the inaccuracy of gastric residual volume measurement by aspiration in critically ill children: GastriPed Study. Front Pediatr. 10, 903944(2022).
- Lu, G., et al. Endoscopic- versus x-ray-guidance for placement of nasojejunal tubes in critically ill patients: a systematic review and meta-analysis of randomized controlled trials. Am J Transl Res. 14 (4), 2134-2146 (2022).
- Bosco, J. J., et al. A reliable method for the endoscopic placement of a nasoenteric feeding tube. Gastrointest Endosc. 40 (6), 740-743 (1994).
- Zafar, M., et al. Complexities of long-term care with gastro-jejunal (GJ) feeding tubes and enteral migration during COVID-19 pandemic times: A case report. Cureus. 14 (8), e27870(2022).
- Hawk, H., Valdivia, H. Bedside methods for transpyloric feeding tube insertion in hospitalized children: A systematic review of randomized and non-randomized trials. JPediatr Nurs. 60, 238-246 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten