Method Article
Verhaltenscharakterisierung eines Angelman-Syndrom-Mausmodells
In diesem Artikel
Zusammenfassung
Dieses Manuskript stellt eine Reihe von hochgradig reproduzierbaren Verhaltenstests vor, um ein Mausmodell mit Angelman-Syndrom zu validieren.
Zusammenfassung
Dieses Manuskript beschreibt eine Reihe von Verhaltenstests, die zur Charakterisierung des Angelman-Syndroms (AS)-ähnlichen Phänotypen in einem etablierten Mausmodell der AS zur Verfügung stehen. Wir verwenden das Rotarod-Lernparadigma, eine detaillierte Ganganalyse und einen Nestbautest, um motorische Beeinträchtigungen bei Tieren zu erkennen und zu charakterisieren. Wir testen die Emotionalität der Tiere im Freiland- und erhöhten Plus-Labyrinth-Tests, sowie die Wirkung im Schwanzaufhängungstest. Wenn AS-Mäuse im Freilandversuch getestet werden, sollten die Ergebnisse mit Vorsicht interpretiert werden, da motorische Dysfunktionen das Verhalten der Mäuse im Labyrinth beeinflussen und die Aktivitätswerte verändern.
Die Reproduzierbarkeit und Wirksamkeit der vorgestellten Verhaltenstests wurde bereits in mehreren unabhängigen Uba3a-Mauslinien mit unterschiedlichen Knockout-Varianten validiert, was diese Testreihe als hervorragendes Validierungswerkzeug in der AS-Forschung etabliert. Modelle mit entsprechender Konstrukt- und Gesichtsvalidität werden weitere Untersuchungen zur Aufklärung der Pathophysiologie der Erkrankung und zur Entwicklung kausaler Therapien rechtfertigen.
Einleitung
Das Angelman-Syndrom (AS) ist eine seltene neurologische Entwicklungsstörung. Der häufigste genetische Ursprung von AS ist eine große Deletion der 15q11-q13-Region des mütterlichen Chromosoms, die bei fast 74 % der Patienten gefunden wird1. Die Deletion dieser Region führt zum Verlust von UBE3A, dem Hauptverursacher von AS, das für eine E3-Ubiquitin-Ligase kodiert. Das väterliche Allel des UBE3A-Gens in Neuronen wird in einem Prozess stillgelegt, der als Prägung bezeichnet wird. Folglich erlaubt die väterliche Prägung des Gens nur die mütterliche Expression im Zentralnervensystem (ZNS)2. Daher führt die Deletion des UBE3A-Gens vom mütterlichen Chromosom zur Entwicklung von AS-Symptomen. Beim Menschen manifestiert sich AS im Alter von etwa 6 Monaten, mit einer Entwicklungsverzögerung, die in allen Entwicklungsstadien anhält und bei den betroffenen Personen zu schweren schwächenden Symptomen führt 3,4. Zu den Kernsymptomen der Störung gehören das Defizit der Fein- und Grobmotorik, einschließlich ruckartiger ataktischer Gang, schwere Sprachstörungen und geistige Behinderung. Etwa 80% der AS-Patienten leiden zudem unter Schlafstörungen und Epilepsie. Bisher gibt es nur symptomatische Medikamente, die epileptische Anfälle reduzieren und die Schlafqualität verbessern1. Daher wird die Entwicklung robuster Tiermodelle mit reproduzierbaren Verhaltensphänotypen zusammen mit einer verfeinerten Phänotypisierungsanalyse unerlässlich sein, um die pathophysiologischen Mechanismen der Störung aufzuklären und wirksame Medikamente und Behandlungen zu finden.
Die Komplexität der menschlichen Erkrankung, die das ZNS betrifft, erfordert, dass Modellorganismen ein vergleichbares Genom, eine vergleichbare Physiologie und ein vergleichbares Verhalten besitzen. Mäuse sind aufgrund ihres kurzen Fortpflanzungszyklus, ihrer geringen Größe und ihrer relativ einfachen DNA-Modifikation als Modellorganismus beliebt. Im Jahr 1984 schlug Paul Willner drei grundlegende Validierungskriterien für Krankheitsmodelle vor: das Konstrukt, das Gesicht und die prädiktive Validität, die verwendet werden, um den Wert des Modells zu bestimmen5. Vereinfacht gesagt, spiegelt die Konstruktvalidität die biologischen Mechanismen wider, die für die Entwicklung der Störung verantwortlich sind, die Gesichtsvalidität rekapituliert ihre Symptome und die prädiktive Validität beschreibt das Ansprechen des Modells auf therapeutische Medikamente.
Um den oben genannten Prinzipien gerecht zu werden, haben wir die häufigste genetische Ätiologie, eine große Deletion des mütterlichen 15q11.2-13q-Locus einschließlich des UBE3A-Gens, gewählt, um AS-Modellmäuse zu erzeugen. Wir verwendeten die CRISPR/Cas9-Technik, um eine 76.225 bp lange Region zu löschen, die sich über das gesamte UBE3A-Gen erstreckt und sowohl die kodierenden als auch die nicht-kodierenden Elemente des Gens umfasst, in Mäusen aus einem C57BL/6N-Hintergrund6. Anschließend haben wir die Tiere gezüchtet, um UBE3A+/− heterozygote Mäuse zu erhalten. Für die Gesichtsvalidierung des Modells verwendeten wir Tiere aus Kreuzungen von UBE3A+/−-Weibchen und Wildtyp-Männchen, um UBE3A+/- Nachkommen (Stamm mit der Bezeichnung C57BL/6NCrl-UBE3A/Ph und später als UBE3A mGenedel/+ bezeichnet) und Kontrollwurfgeschwister zu gewinnen. Wir testeten ihre Fein- und Grobmotorik, ihre Emotionalität und ihren Affekt, um die Kernsymptome des AS zu rekapitulieren. In einem früheren Artikel haben wir auch die kognitiven Funktionen der Tiere untersucht, da AS-Patienten auch an einer geistigen Behinderung leiden6. Wir fanden jedoch keine kognitiven Beeinträchtigungen bei UBE3AmGenedel/+ Mäusen, was möglicherweise auf das junge Alter der Tiere zum Zeitpunkt des Versuchs zurückzuführenist 7. Eine spätere Untersuchung der älteren Tiere, die etwa 18 Wochen alt waren, ergab ein Defizit in der Verhaltensflexibilität während des Umkehrlernens im Ortspräferenzparadigma. Die Komplexität der für diese Analyse verwendeten Geräte erfordert jedoch ein separates methodisches Modul, das hier nicht enthalten ist.
Die hier vorgestellten Verhaltenstests gehören dank ihres hohen prädiktiven Wertes und ihrer ausreichenden Konstruktvalidität zu den gängigen Phänotypisierungswerkzeugen in der Genforschung 8,9,10. Wir nutzten diese Tests, um ein Mausmodell für AS zu validieren, indem wir die Kernsymptome der menschlichen Krankheit auf reproduzierbare, altersunabhängige Weise rekapitulierten. Die Emotionalität des Tieres wurde im erhöhten Plus-Labyrinth und im Freifeldversuch bewertet. Beide Tests basieren auf dem Annäherungs-Vermeidungs-Konflikt, bei dem die Tiere auf der Suche nach Nahrung, Unterschlupf oder Paarungsmöglichkeiten eine neue Umgebung erkunden und gleichzeitig angstlösende Kompartimente meiden11. Zusätzlich wird der Freilandtest verwendet, um die Bewegungsaktivität einer Maus zu testen8. Der Schwanzsuspensionstest wird häufig in der Depressionsforschung eingesetzt, um nach neuen Antidepressiva oder depressiven Phänotypen in Maus-Knockout-Modellen zu suchen12. Dieser Test bewertet die Verzweiflung, die Tiere im Laufe der Zeit in einer unentrinnbaren Situation entwickeln. Motorisches Lernen und detaillierte Gangeigenschaften wurden auf dem Rotarod bzw. im DigiGait bestimmt. Die Ausdauer des Tieres auf dem beschleunigenden Stab charakterisiert seine Gleichgewichts- und Bewegungskoordinationsfähigkeiten, während die detaillierte Analyse der Schrittmuster einer Maus eine sensible Bewertung neuromuskulärer Beeinträchtigungen im Zusammenhang mit vielen neurogenerativen Bewegungsstörungen darstellt13,14,15. Der Nestlet-Zerkleinerungstest ist Teil der Standardmethodik zur Erkennung impulsiven Verhaltens bei Nagetieren, und da er das natürliche Bauverhalten von Nagetieren nutzt, zeigt er das Wohlbefinden des Tieres an16,17.
Die Größe der Versuchsgruppen war das Ergebnis eines Kompromisses, um die Anforderungen der 3R-Regel zu erfüllen und die Zuchtleistung der Kolonien effizient zu nutzen. Um jedoch eine statistische Aussagekraft zu erhalten, hatten die Gruppen nicht weniger als 10 Individuen, da eine ausreichende Anzahl von Brutpaaren gebildet wurde. Leider führte die Zuchtleistung nicht immer zu einer ausreichenden Anzahl von Tieren.
Protokoll
Alle Tiere und Experimente, die in dieser Studie verwendet wurden, wurden einer ethischen Überprüfung unterzogen und in Übereinstimmung mit der europäischen Richtlinie 2010/63/EU durchgeführt. Die Studie wurde von der Tschechischen Zentralkommission für Tierschutz genehmigt. Die Mäuse wurden in einzeln belüfteten Käfigen untergebracht und bei einer konstanten Temperatur von 22 ± 2 °C mit einem 12-stündigen Hell-Dunkel-Zyklus gehalten. Die Mäuse wurden ad libitum mit Mäusefutter und Wasser versorgt. Die Mäuse wurden in Gruppen von drei bis sechs Tieren pro Käfig untergebracht. Vor der Prüfung wurde keine andere Handhabung als das Wiegen durchgeführt. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien und Geräten, die in diesem Protokoll verwendet werden.
1. Allgemeine Erwägungen vor und während der Prüfung
HINWEIS: Aus Gründen der Übersichtlichkeit und Verständlichkeit werden vor der Beschreibung der einzelnen Tests allgemeine Bemerkungen gemacht. Dies gilt für jeden Versuch, mit der offensichtlichen Ausnahme des Nestlet-Zerkleinerungstests, der in einem Stallraum durchgeführt wird und keine Versuchsgeräte erfordert.
- Halten Sie die Tiere mindestens 14 Tage vor dem Test in der Forschungseinrichtung unter, um Stress durch den Transport und Veränderungen der Umgebung zu minimieren.
- Notieren Sie das Gewicht der Tiere vor dem Testen, da das Gewicht ein häufiger Störfaktor in der Verhaltensforschung ist.
- Lassen Sie die Tiere nach dem Transport aus ihrem Stallraum mindestens 1 Stunde lang im Versuchsraum akklimatisieren, um den Transportstress zu minimieren, wann immer ein solcher Transport stattfindet (d. h. alle unten beschriebenen Tests mit Ausnahme der Nestchenzerkleinerung, die im Stallraum durchgeführt wird).
- Markieren Sie jedes Tier am Schwanz mit einem ungiftigen Marker auf Wasserbasis, um eine schnelle Identifizierung während des Experiments zu ermöglichen.
- Entfernen Sie nach jedem Versuch den gesamten Urin und Kot, der von den Tieren während der Versuche in der Versuchsvorrichtung abgelagert wurde.
- Wischen Sie alle Versuchsgeräte vor und nach jedem Versuchstier mit 75%igem Alkohol ab. Die Reinigung entfernt olfaktorische Spuren, die sich während des Tests abgelagert haben, und trägt dazu bei, stabile Versuchsbedingungen zu erhalten.
- Transportieren Sie die Tiere mit so viel Sorgfalt wie möglich aus ihrem Heimatkäfig zum Versuchsapparat, vorzugsweise in einem kleinen, undurchsichtigen Behälter, und lassen Sie sie dann frei frei, sofern keine anderen Manipulationen erforderlich sind.
- Setzen Sie jedes Tier nach dem Test in einen provisorischen Käfig, um zu verhindern, dass es die ungetesteten Tiere im häuslichen Käfig beeinflusst.
- Testen Sie Männchen und Weibchen an aufeinanderfolgenden Tagen. Wechseln Sie die Reihenfolge der verschiedenen Genotypen während des Tests, um unvorhersehbare Umweltfaktoren zwischen den Versuchsgruppen auszugleichen.
- Setzen Sie die Tiere wieder in ihren häuslichen Käfig, nachdem alle Tiere getestet wurden, und bringen Sie sie zurück in den Stallraum.
- Bei wiederholten Tierversuchen ist zwischen den einzelnen Tests ein Mindestabstand von 1 Tag einzuhalten.
2. Verhaltenstests
- Erhöhtes Plus-Labyrinth (EPM)
HINWEIS: Beide Geschlechter der Mäusestämme C57BL/6NCrl und UBE3AmGenedel/+ wurden für diese Studie im Alter von 9-12 Wochen getestet. Das Gewicht der Tiere lag zum Zeitpunkt des Versuchs zwischen 22 und 36 g bei den Männchen und 18 bis 28 g bei den Weibchen.- Platzieren Sie das Plus-förmige Labyrinth auf der Testplattform direkt unter der Kamera. Stellen Sie mit dem Potentiometer an der Wand die Lichtintensität mit Hilfe eines Luxometers auf 70 Lux in der Mitte ein, wobei der Sensor während der Einstellung in der Mitte des Labyrinths platziert wird.
- Öffnen Sie die Software mit einem Doppelklick auf das Symbol der Viewer-Software und laden Sie die Konfiguration für EPM-Tests, indem Sie auf das Symbol oben links auf der Registerkarte Konfiguration klicken. Laden Sie das EPM-Plug-in aus dem Menü Datei . Füllen Sie die Tierinformationen über die Computertastatur aus - Tier-ID, Genotyp, Geschlecht und die Versuchsinformationen (Datum, Lichtintensität) - in den entsprechenden Feldern der Registerkarte Experiment . Überprüfen Sie, ob die Position der Zone, die offenen Arme und die geschlossenen Arme ordnungsgemäß konfiguriert sind. Stellen Sie mit Hilfe einer visuellen Steuerung und einer Computermaus sicher, dass die virtuell umrissenen Zonen mit den entsprechenden EPM-Zonen in der Videovorschau übereinstimmen.
- Der EPM ist ein Test, der verwendet wird, um die allgemeine Angst eines Tieres zu bewerten, die auf einem Konflikt zwischen Annäherung und Vermeidung basiert. Nagetiere neigen von Natur aus dazu, gut beleuchtete, ungeschützte Bereiche (offene Arme) zu meiden, zugunsten sichererer Bereiche (geschlossene Arme). Da dieser vollautomatische Test auf einem Video-Tracking-System basiert, kann die Software automatisch die in jeder Zone verbrachte Zeit sowie die Anzahl der Eingänge berechnen.
- Nehmen Sie die Tiere während des Versuchs mit einer industriellen, infrarotlichtempfindlichen Kamera auf Video auf. Lassen Sie die Software die Position des Tieres während der Aufzeichnung in Echtzeit erkennen. Anschließend lässt die Software die Spuren des Tieres automatisch auswerten, um alle Parameter zu berechnen, die das Verhalten des Tieres im Labyrinth beschreiben. Verwenden Sie die Zeit, die in den angstlösenden offenen Armen verbracht wurde, und den Prozentsatz der Besuche mit offenen Armen, um den Grad des angstähnlichen Verhaltens bei den Tieren zu bewerten.
HINWEIS: Das maßgefertigte Labyrinth besteht aus infrarotlichtdurchlässigem Material und wird auf einer Infrarot-Lichtquellenplattform mit Leuchtdiode (LED) platziert. - Platzieren Sie den Mauszeiger auf dem Pfeilsymbol oben links auf der Registerkarte Erfassung . Nehmen Sie ein Tier mit der Hand aus dem häuslichen Käfig und legen Sie es vorsichtig in die Mitte des EPM. Starten Sie das Protokoll mit einem Linksklick auf die Computermaus und verlassen Sie sofort den Experimentierraum.
- Sobald das Aufzeichnungsprotokoll nach 5 Minuten freier Labyrinth-Erkundung abgeschlossen ist, speichern Sie die aufgezeichneten Daten, indem Sie in dem Fenster, das nach der Protokollbeendigung angezeigt wird, auf OK klicken, benennen Sie die Datei entsprechend und klicken Sie auf Speichern. Exportieren Sie die Ergebnisse für jedes getestete Tier in eine .csv-Datei für die Offline-Analyse, indem Sie auf das Symbol im linken vertikalen Bereich der Registerkarte Datenanalyse klicken.
- Nehmen Sie das Tier von Hand aus dem Labyrinth und setzen Sie es in den provisorischen Käfig. Fahren Sie mit der Untersuchung aller Tiere auf die gleiche Weise fort. Kopieren Sie die Ergebnisse für alle getesteten Tiere in eine Notepad-Datei zur Offline-Analyse, indem Sie auf das Symbol Ergebnisse kopieren auf der Registerkarte "Ergebnisse" des Labyrinth-Plugins " Erhöhtes Plus " klicken.
HINWEIS: Die Soft- und Hardware kann voneinander abweichen und die entsprechenden Handbücher müssen befolgt werden. Darüber hinaus kann der Versuchsaufbau, wie z. B. die Beleuchtung oder die Platzierung des Computers, je nach Bauart der Tieranlage variieren.
- Test im offenen Feld (OF)
HINWEIS: Der Freilandtest bewertet die Gesamtbewegung eines Tieres, die durch Erkundungsverhalten in einer neuen Umgebung ausgelöst wird. Darüber hinaus wird es häufig als Screening-Instrument verwendet, um allgemeine Angstzustände in einem ungeschützten, gut beleuchteten Raum zu erkennen. Dabei handelt es sich um einen vollautomatischen Test, bei dem ein Video-Tracking-System zum Einsatz kommt, das auch im vorherigen Test verwendet wurde.- Platzieren Sie die vier OF-Testboxen auf der Testplattform direkt unter der Kamera. Stellen Sie mit dem Potentiometer an der Wand die Lichtintensität in der Mitte jedes OF-Tests mit Hilfe eines Luxometers auf 200 Lux ein, wobei der Sensor während der Einstellung in der Mitte jedes Kastens platziert wird.
- Öffnen Sie die Software mit einem Doppelklick auf das Symbol der Viewer-Software und laden Sie die Konfiguration für die OF-Tests, indem Sie auf das Symbol oben links auf der Registerkarte Konfiguration klicken. Füllen Sie die Tierinformationen über die Computertastatur aus - Tier-ID, Genotyp, Geschlecht und Versuchsinformationen (Datum, Lichtintensität) - in den entsprechenden Feldern der Registerkarte Experiment . Prüfen Sie, ob die Position der Zone (Mitte und Peripherie) mit den OF-Testboxen übereinstimmt, und passen Sie sie bei Bedarf an. Stellen Sie mit Hilfe einer visuellen Steuerung und einer Computermaus sicher, dass die virtuell umrissenen Zentrums- und Peripheriezonen mit den entsprechenden OF-Testzonen in der Videovorschau übereinstimmen.
- Nehmen Sie die Tiere während des Versuchs mit einer industriellen, infrarotlichtempfindlichen Kamera auf Video auf. Lassen Sie die Software die Position des Tieres während der Aufzeichnung in Echtzeit erkennen und die Spuren des Tieres automatisch auswerten, um alle Parameter zu berechnen, die das Verhalten des Tieres in der OF-Testbox beschreiben. Die zurückgelegte Strecke, die durchschnittliche Geschwindigkeit und die Ruhezeit sind Parameter, die verwendet werden, um die Aktivität der Tiere in einer neuen Umgebung zu bewerten, während die Anzahl der Zentrumseintritte und die Dauer im Zentrum das angstähnliche Verhalten bei Tieren beschreiben.
HINWEIS: Das maßgefertigte Labyrinth besteht aus infrarotlichtdurchlässigem Material und wird auf einer LED-Infrarot-Lichtquellenplattform platziert. - Platzieren Sie den Mauszeiger auf dem Pfeilsymbol oben links auf der Registerkarte Erfassung . Nehmen Sie vier Tiere von Hand aus dem Käfig und legen Sie sie vorsichtig in die Ecke jeder OF-Testbox. Starten Sie das Protokoll mit einem Linksklick auf eine Computermaus und verlassen Sie sofort den Experimentierraum.
- Wenn das Protokoll nach 10 Minuten freier Labyrinth-Erkundung abgeschlossen ist, speichern Sie die Daten, indem Sie in dem Fenster, das nach der Beendigung des Protokolls angezeigt wird, auf OK klicken, benennen Sie die Datei entsprechend, und klicken Sie auf Speichern. Exportieren Sie die Ergebnisse für jedes getestete Tier in eine .csv-Datei für die Offline-Analyse, indem Sie auf das Symbol im linken vertikalen Bereich der Registerkarte Datenanalyse klicken.
- Entnehmen Sie die Tiere von Hand aus dem Labyrinth und setzen Sie sie in den provisorischen Käfig. Fahren Sie mit der Untersuchung aller Tiere auf die gleiche Weise fort. Analysieren Sie die exportierten Daten.
HINWEIS: Die Soft- und Hardware kann voneinander abweichen und die entsprechenden Handbücher müssen befolgt werden. Darüber hinaus kann der Versuchsaufbau, wie z. B. die Beleuchtung, die Anzahl der Labyrinthe oder die Platzierung des Computers, je nach Bau der Tieranlage variieren.
- Heckaufhängungstest (TST)
HINWEIS: Drei Mäuse werden gleichzeitig mit der automatischen Schwanzaufhängungsvorrichtung getestet.- Halten Sie die Lichtintensität des Raumes bei 100-120 Lux.
- Verbinden Sie das TST-System über ein USB-Kabel mit dem Computer. Stecken Sie den USB-Dongle in den Computer und starten Sie die Software mit einem Doppelklick auf das BIO-TST-Softwaresymbol . Passen Sie auf der Registerkarte Einstellungen unter Global die Aufnahmedauer auf 360 s an. Wählen Sie auf der Registerkarte "Experiment" die Option "Neue Liste der Probanden " aus, und erstellen Sie eine neue Experimentdatei und eine neue Liste der getesteten Probanden, indem Sie den Anweisungen auf der geöffneten Registerkarte folgen.
- Starten Sie den Lauf, indem Sie auf der Registerkarte Akquisition auf Lauf starten | weiter klicken. Bereiten Sie die Tiere auf den Test vor, indem Sie einseitiges Klebeband, wie z. B. das poröse medizinische Klebeband, um 3/4 des Schwanzes des Tieres wickeln, beginnend mit der Basis.
- Führen Sie den Aufhängehaken durch das Klebeband und hängen Sie das Tier daran auf. Beginnen Sie sofort nach dem Aufhängen des Hakens mit der Datenerfassung für jedes einzelne Tier, indem Sie auf das Start-Symbol unter der visualisierten Position für jedes Tier klicken und beobachten Sie die Tiere während des Tests kontinuierlich.
- Klicken Sie nach Abschluss der Erfassung für die erste Gruppe von Tieren auf Den nächsten Lauf einleiten, nehmen Sie die Tiere vom Haken, lösen Sie das Klebeband von ihren Schwänzen, schneiden Sie das Klebeband vorsichtig mit einer Schere entlang des Schwanzes ab und setzen Sie die Tiere in den provisorischen Käfig.
- Reinigen Sie das Gerät mit 75%igem Alkohol und Papiertaschentüchern und fahren Sie mit den übrigen Tieren wie oben beschrieben fort. Wählen Sie auf der Registerkarte Analyse die letzten 4 Minuten der Erfassung für die Analyse aus, wählen Sie dann alle gültigen Ausführungen im Analysezeitraum aus, klicken Sie auf Ausgewählte Probanden analysieren, wählen Sie das gewünschte Datenformat aus und klicken Sie auf Ausgewählte Daten exportieren, um die gesammelten Daten für die weitere Analyse zu exportieren.
HINWEIS: Der Test dauert 6 Minuten. Während der ersten 2 Minuten werden sich die Tiere heftig wehren, aber da die Verzweiflungsreaktion während der restlichen 4 Minuten vorherrscht, wird die Immobilitätszeit während dieser Zeit für die Analyse herangezogen. Die Soft- und Hardware kann unterschiedlich sein, und die entsprechenden Handbücher müssen befolgt werden. Darüber hinaus kann die Ausrüstung selbst variieren (z. B. Anzahl der Prüfplätze).
- Ganganalyse
- Schalten Sie das Laufband ein und stellen Sie die Bandgeschwindigkeit manuell auf 20 cm/s auf dem Gerätefeld ein, indem Sie auf das Symbol + oder - neben der Geschwindigkeitsanzeige klicken. Schalten Sie das Gerätelicht ein, indem Sie den Knopf im Uhrzeigersinn drehen. Starten Sie die DigiGait Imager-Software, indem Sie auf das Softwaresymbol doppelklicken und die Verschlusszeit auf 100 für Albino-Mäuse oder 130 für schwarze/dunkle Mäuse im Feld für die Verschlusszeit einstellen.
- Nehmen Sie das erste Tier von Hand aus dem Heimkäfig und legen Sie es vorsichtig auf das Laufband. Schließen Sie die Tür zum Tierraum. Prüfen Sie visuell, ob der Schwanz des Tieres nicht zwischen Tür und Rahmen eingeklemmt ist.
- Lassen Sie die Maus vor der Aufnahme das Laufband erkunden. Stellen Sie sicher, dass das Tier in der Lage ist, den Test durchzuführen, indem Sie das Laufband für ~3 s auf eine langsame Gehgeschwindigkeit einstellen und dann anhalten, wobei Sie das Tier kontinuierlich beobachten.
- Starten Sie das Band, indem Sie die Start-Taste auf der Gerätetafel drücken, und nehmen Sie ca. 10 s lang auf. Stellen Sie sicher, dass eine klare und flüssige Fortbewegung von mindestens 10-15 Schritten beobachtbar ist. Stoppen Sie den Gurt, indem Sie die Stopp-Taste auf dem Gerätefeld drücken, und setzen Sie die Maus von Hand in den provisorischen Haltekäfig ein.
- Prüfen Sie die Aufnahme auf eine Sequenz von Bildern mit fließenden Schritten, indem Sie auf WIEDERGABE klicken und die Aufnahme mit der visuellen Steuerung im BEARBEITEN-Modus überprüfen. Wählen Sie 10-15 fließende Bewegungen aus, indem Sie ihre Start- und End-Frame-Nummern manuell in die entsprechenden Felder schreiben (From frame# für den ersten Frame und To für den letzten Frame ). Füllen Sie die Informationen des Tieres aus - Tier-ID, Geburtsdatum, Geschlecht, Gewicht, Bandgeschwindigkeit und Gurtwinkel - und kommentieren Sie bei Bedarf in den entsprechenden Feldern. Speichern Sie die Datei zur weiteren Analyse, indem Sie auf Speichern klicken.
- Reinigen Sie das Band mit Wasser und fahren Sie mit den restlichen Tieren auf die gleiche Weise fort. Wählen Sie KAMERA , um mit der Aufnahme des nächsten Tierspaziergangs fortzufahren. Wenn Aufzeichnungen für alle Tiere vorliegen, fahren Sie mit der Analyse fort.
HINWEIS: Tiere, die nicht in der Lage sind, mit einer bestimmten Geschwindigkeit des Bandes zu laufen, sind von der Prüfung ausgeschlossen. Basierend auf unserer Erfahrung beobachten wir, dass ältere Tiere (über 50 Wochen) mehr Schwierigkeiten beim Gehen auf dem Laufband haben, mit einer variablen Häufigkeit zwischen 2% und 50% je nach Genotyp. Tierische Abfälle werden in Schalen auf der Vorder- oder Rückseite des Laufbandes gesammelt. Die Tabletts werden nach jeder Studie geleert und mit warmem Seifenwasser gewaschen. Der Gürtel wird mit einem feuchten Tuch abgewischt. - Führen Sie eine Ganganalyse durch, die auf einer vollautomatischen Analyse von Videoaufzeichnungen von Tierfußabdrücken basiert. Passen Sie die Daten in der DigiGait Analysis-Software an.
ANMERKUNG: Die Ganganalyse liefert nicht nur ein Maß für die motorische Koordination, sondern auch eine detaillierte kinematische Beschreibung, die auf der Analyse des dynamischen Gangsignals basiert und den zeitlichen Verlauf der Pfotenplatzierung durch sequentielle Schritte darstellt. Folgende Parameter werden von der Software automatisch gemessen: Schwungdauer, Prozentsatz der Schrittdauer beim Schwingen, Bremsdauer, Prozentsatz der Schrittdauer beim Bremsen, Vortriebsdauer, Prozentsatz des Schritts beim Vortrieb, Standdauer, Prozentsatz des Schritts im Stand, Schrittdauer, Bremsprozentsatz des Standes, Vortriebsprozentsatz der Standphase, Verhältnis von Schwung zu Stand, Schrittlänge, Schrittfrequenz, Pfotenwinkel, Pfotenwinkelvariabilität, Standbreite, Schrittwinkel, Schrittlängenvariabilität, Schrittbreitenvariabilität, Schrittwinkelvariabilität, Schrittwinkelvariabilität, Variationskoeffizient der Schrittlänge, Variationskoeffizient der Standbreite, Variationskoeffizient des Schrittwinkels, Variationskoeffizient der Schwungdauer, Pfotenbereich bei Spitzenstand, Pfotenbereichsvariabilität bei Spitzenstand, Dauer des gemeinsamen Standes der Hintergliedmaße, Prozentsatz des geteilten Standes, Verhältnis der Dauer des linken und rechten hinteren Standes, Gangsymmetrie, maximale Veränderungsrate des Pfotenbereichs in Kontakt mit dem Laufbandband während der Bremsphase, maximale Änderungsrate des Pfotenbereichs in Kontakt mit dem Laufbandband während der Antriebsphase, Tau-Vortrieb, Pfotenüberlappungsabstand, Positionierung der Pfotenplatzierung, Ataxiekoeffizient, Mittellinienabstand, Achsenabstand und Pfotenwiderstand. Die Software ermöglicht eine kleine Korrektur des Schrittspurrauschens, die vor der statistischen Analyse abgeschlossen werden sollte. Die Soft- und Hardware kann unterschiedlich sein, und die entsprechenden Handbücher müssen befolgt werden.
- Rotarod
HINWEIS: Der Rotarod-Test wird verwendet, um die motorischen Funktionen von Nagetieren zu beurteilen - Gleichgewicht und motorische Koordination. Der Test erfordert, dass eine Maus auf einem rotierenden Stab mit einem festen Durchmesser (5 cm) läuft, wobei sich die Rotation über einen bestimmten Zeitraum (5 min) beschleunigt, bis das Tier nicht mehr auf dem Boden bleiben kann.- Schalten Sie das Rotarod-Gerät ein, indem Sie den Ein-/Ausschalter am Gerät drücken, und starten Sie die Software durch Doppelklick auf das Symbol der Rod-Software. Initialisieren Sie eine neue Datei auf der Registerkarte Datei und speichern Sie sie unter dem entsprechenden Namen. Geben Sie im Fenster "Setup" die Details des Experiments ein, z. B. das Datum, den Namen des Benutzers und eventuelle Kommentare. Stellen Sie das Geschwindigkeitsprofil auf 300 s, die Anfangsgeschwindigkeit auf 4 U/min und die Anschlussgeschwindigkeit auf 40 U/min ein.
- Bereiten Sie einen Zeitplan für die getesteten Tiere im Feld Tier vor und weisen Sie jedem Tier seine Position auf der Stange zu. Die Positionen werden in der Software nicht explizit angegeben, aber sie entsprechen der Listenzeile; Die erste Zeile würde z. B. die erste Position des Stabes angeben, die fünfte Zeile die fünfte Position des Stabs usw. Denken Sie daran, jede Rutenposition zwischen den Versuchsgruppen auszugleichen.
HINWEIS: Fünf Tiere können gleichzeitig getestet werden. - Schließen Sie das Setup-Fenster , indem Sie auf Schließen klicken, und öffnen Sie das Messfenster, indem Sie auf Messen klicken. Starten Sie die erste Drehung der Rute bei 4 Umdrehungen pro Minute , indem Sie auf Start/Stopp klicken und die ersten fünf Tiere auf die ihnen zugewiesenen Positionen setzen. Wenn sich alle Tiere auf der Stange befinden, starten Sie das Testprotokoll, indem Sie auf Profil starten klicken, und die Stange beschleunigt allmählich auf 40 U/min innerhalb von 5 Minuten. Wenn ein Tier von der Stange fällt, legen Sie es vor Beginn des Protokolls wieder in die Rute zurück.
HINWEIS: Tiere bleiben in der Regel nicht lange genug auf der Stange, um beim ersten Versuch alle Mäuse auf einmal darauf zu platzieren. Es ist wichtig, geduldig zu sein, wenn man die Tiere mit der konstanten Rotationsgeschwindigkeit zu Beginn auf die Stange setzt. Der Zweck des Tests besteht nicht darin, die Ausdauer des Tieres auf der Stange bei einer festen Rotationsgeschwindigkeit zu bestimmen, sondern die Geschwindigkeit zu ermitteln, bei der das Tier nicht in der Lage ist, auf der Stange zu bleiben. Die Geschwindigkeit des Stabes ist proportional zur Latenz, mit der man auf ihm bleibt. Es wird also verwendet, um das Gleichgewicht des Tieres auszudrücken. - Bringen Sie die Tiere in den provisorischen Käfig, nachdem alle Tiere von der Stange gefallen sind oder 5 Minuten vergangen sind. Entfernen Sie alle tierischen Abfälle und reinigen Sie die Stange und das Tablett mit Alkohol.
- Klicken Sie auf Tiere -> , um mit der nächsten Gruppe von Tieren auf die gleiche Weise fortzufahren. Nachdem Sie alle Tiere getestet haben, schließen Sie das Fenster Messen , indem Sie auf Schließen und dann auf Anzeigen klicken, um die erfassten Daten anzuzeigen. Exportieren Sie die erfassten Daten im .csv-Dateiformat zur weiteren Analyse, indem Sie auf CSV exportieren klicken.
- Testen Sie jedes Tier an der Stange dreimal im Abstand von 15 Minuten. Verwenden Sie den gemittelten Wert der Latenz, um für weitere statistische Analysen über die drei Versuche zu fallen. Bewerten Sie das motorische Lernen des Tieres, indem Sie den Test an 5 aufeinanderfolgenden Tagen wiederholen.
HINWEIS: Die Soft- und Hardware kann voneinander abweichen und die entsprechenden Handbücher müssen befolgt werden. Darüber hinaus kann die Ausrüstung selbst variieren, z. B. in der Anzahl der Prüfpositionen, der Gesamtkonstruktion und den Stangenabmessungen.
- Nestlet-Schredder-Nestbau
- Trennen Sie die Tiere 1 Woche lang in einzelne Polycarbonat-Mäusekäfige mit Standardausstattung (Einstreu, Futternetz und Wasserversorgung). Nehmen Sie ca. 12 g Baumwollnestchen mit einer Pinzette, notieren Sie das Gewicht manuell mit einer Waage und legen Sie es zufällig in einen Käfig, aber auf die gegenüberliegende Seite der Wasserversorgung. Bringen Sie die Käfige mit den Tieren zurück in den Stallraum.
- Wiegen Sie jedes Nestchen in den nächsten 4 Tagen jeden Tag zur gleichen Zeit manuell mit einer Waage. Notieren Sie die Gewichte auf Papier oder in einer vorgefertigten Tabelle. Stellen Sie sicher, dass jedes Nestchen beim Wiegen trocken ist. Wenn nicht, trocknen Sie es auf einem Heizkissen ab und setzen Sie alle Nestchen gleichzeitig in die ihnen zugewiesenen Käfige an der Stelle zurück, an der die Maus ihr Nest gebaut hat. Wenn das Nestchen in mehrere Teile zerrissen ist, wiegen Sie das größte.
- Für die Datenanalyse wird die Abnahme des Nestlet-Gewichts an jedem Tag relativ zum Ausgangsgewicht ausgedrückt und als Prozentsatz des verwendeten Materials dargestellt.
HINWEIS: Das Zurückbringen von Männchen in einen gemeinsamen Käfig kann zu erhöhter Aggression und unerwünschten Verletzungen bei den Tieren führen. Daher sollte der Nestlet-Zerkleinerungstest gegen Ende des Testschemas angesetzt werden, um das Tierwohl nicht zu gefährden.
Ergebnisse
Erhöhte Plus-, Labyrinth- und Freifeldtests
Die EPM- und OF-Tests nutzen die natürliche Neigung von Nagetieren, neue Umgebungen zu erkunden18,19. Die Erkundung wird von einem Annäherungs-Vermeidungs-Konflikt bestimmt, bei dem Nagetiere zwischen der Erkundung einer neuen Umgebung und der Vermeidung möglicher Gefahren wählen. Tiere erkunden unbekannte Orte auf der Suche nach Unterschlupf, sozialen Kontakten oder Nahrungssuche. Neue Orte können jedoch Risikofaktoren wie Raubtiere oder Konkurrenten beinhalten. Sowohl der OF-Test als auch der EPM bestehen aus sicheren und riskanten Kompartimenten – der Peripherie und der Mitte im OF-Test und geschlossenen und offenen Armen im EPM. Nagetiere bevorzugen von Natur aus dunkle, geschlossene Fächer im Vergleich zu offenen, erhöhten und hell beleuchteten Bereichen. So charakterisiert eine reduzierte Exploration der riskanten/angstabhängigen Anteile, ausgedrückt als Abnahme der Anzahl der Besuche und der Besuchsdauer oder als erhöhte Latenz bis zum ersten Besuch, das angstähnliche Verhalten der Tiere 8,11. Die Ruhezeit, die Durchschnittsgeschwindigkeit und die zurückgelegte Gesamtstrecke liefern zusätzliche Informationen über die spontane Aktivität der Tiere. Keiner der Parameter, die sich auf angstähnliches Verhalten beziehen, war in UBE3AmGenedel/+ Mutanten weder im OF-Test noch im EPM verändert (Abbildung 1D-G). UBE3AmGenedel/+-Tiere zeigten jedoch eine signifikante Hypoaktivität, was sich in einer kürzeren zurückgelegten Strecke, einer niedrigeren Durchschnittsgeschwindigkeit und einer längeren Ruhezeit im OF-Test widerspiegelte (Abbildung 1A-C).

Abbildung 1: Spontane Aktivität und Angstreaktion auf eine neue Umgebung im EPM- und OF-Test. (A-E) Erkundung des offenen Feldes. Die UBE3AmGenedel/+ Tiere liefen eine kürzere Strecke (A) mit einer niedrigeren Durchschnittsgeschwindigkeit (B) und einer längeren Ruhezeit (C). Die Anzahl der Besuche und die Dauer im Zentrum unterschieden sich nicht zwischen den Tieren (D,E). Eine Zwei-Wege-ANOVA ergab einen signifikanten Hauptgenotyp-Effekt ohne signifikante Interaktion zwischen Genotyp und Geschlecht (Genotyp-Effekt: p < 0,01; Genotyp /Geschlechts-Interaktion: p > 0,7). Der prozentuale Anteil der Besuche in offenen und geschlossenen Armen hing nicht vom Genotyp (F) ab, und auch die Zeit, die in den angstlösenden offenen Armen verbracht wurde, unterschied sich nicht zwischen den Versuchsgruppen (G). Eine Zwei-Wege-ANOVA ergab keine signifikanten Haupteffekte oder Genotyp/Geschlechts-Interaktionen (Genotyp-Effekt: p > 0,9; Genotyp/Geschlechts-Interaktion: p > 0,9). Die im Boxplot dargestellten Daten zeigen den Medianwert, den Interquartilsabstand und den Wertebereich. Signifikante Post-hoc-Testergebnisse sind mit * gekennzeichnet. Die Daten für Kontrolltiere (weiblich n = 10, männlich n = 11) sind rot und Mutanten (weiblich n = 9, männlich n = 10) blau dargestellt. Diese Abbildung wurde von Syding et al.6 übernommen. Abkürzungen: EPM = erhöht plus Labyrinth; OF = offenes Feld. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Test der Heckaufhängung
Der TST misst die Verzweiflung von Tieren, die in einer unentrinnbaren Situation entwickelt wurden. Wenn Nagetiere am Schwanz hängen, werden sie nach einer anfänglichen Phase intensiver Aktivität schnell unbeweglich. Die Dauer der Immobilität gibt Aufschluss über das Ausmaß der "Verzweiflung". Zahlreiche Labore haben gezeigt, dass eine breite Palette klinisch wirksamer Antidepressiva die Immobilitätsdauer verkürzt 9,20,21. Dieser unkomplizierte Test wird häufig für das Screening auf potenzielle antidepressive Substanzen verwendet und kann auch zur Charakterisierung des Phänotyps verschiedener Tierstämme sowie transgener Mäuse in Studien verwendet werden, die die neurobiologischen Grundlagen depressiver Zustände untersuchen 9,21. UBE3AmGenedel/+ Tiere waren signifikant länger immobil als ihre Kontroll-Wurfgeschwister, was auf ihr depressionsähnliches Verhalten hindeutet (Abbildung 2).

Abbildung 2: Immobilitätszeit im Heckaufhängungstest. UBE3AmGenedel/+ Tiere zeigten eine längere Immobilität während der Schwanzaufhängung. Eine bidirektionale ANOVA zeigte signifikante Haupteffekte, aber keine Signifikanz in der Genotyp/Geschlechts-Interaktion (Genotyp-Effekt: p < 0,001; Geschlechtseffekt: p < 0,001 ; Genotyp/Geschlechts-Interaktion: p > 0,5). Die im Boxplot dargestellten Daten zeigen den Medianwert, den Interquartilsabstand und den Wertebereich. Signifikante Post-hoc-Testergebnisse sind mit * gekennzeichnet. Die Daten für Kontrolltiere (weiblich n = 10, männlich n = 14) sind rot und Mutanten (weiblich n = 10, männlich n = 11) blau dargestellt. Diese Abbildung wurde von Syding et al.6 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Rotarod und Ganganalyse
Die Geschichte der Rotarod-Tests in Modellen neuromotorischer Defizite reicht bis in die Mitte des 20. Jahrhunderts zurück 22. Der Rotarod wird verwendet, um das Gleichgewicht und die Bewegungskoordination der Tiere zu beurteilen, da sich ihre Beeinträchtigungen in einer deutlich kürzeren Latenz beim Fallen von der rotierenden Stange14 manifestieren. Wiederholte Tests auf dem Rotarod werden verwendet, um die motorischen Lernfähigkeiten von Tieren zu untersuchen. Die rasante Entwicklung moderner Geräte und digitaler Technologien hat eine automatisierte, präzise und unvoreingenommene Bewertung von Phänotypen des Bewegungsapparates von Nagetieren auf der Grundlage detaillierter Beschreibungen ihres Ganges ermöglicht23. Die automatisierte Ganganalyse ersetzte die Fußabdruckanalyse und ist auch empfindlicher gegenüber neuromuskulären Defiziten14,24,25. Veränderungen der räumlich-zeitlichen Charakteristika des Tiergangs sind spezifisch für die modellierte nosologische Einheit26,27,28. UBE3AmGenedel/+ Mutanten wiesen einen robusten Wechsel der Gangindizes auf (Abbildung 3A-G), was durch eine reduzierte Latenz beim Sturz aus dem Rotarod bestätigt wird (Abbildung 3H).
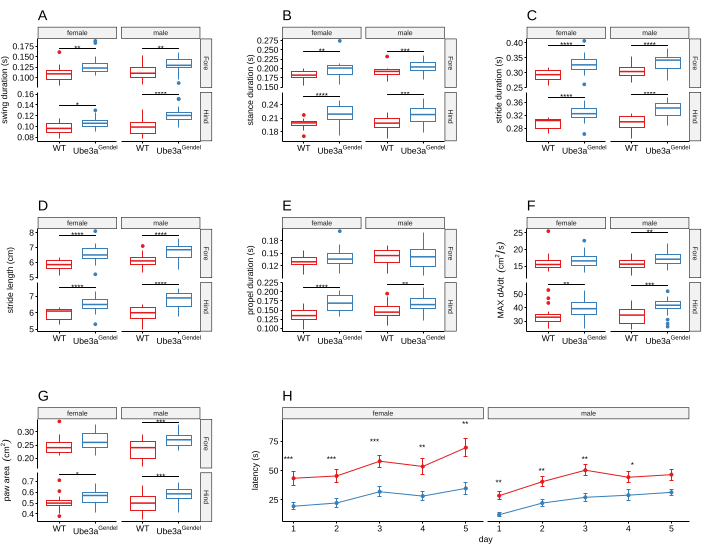
Abbildung 3: Detaillierte Ganganalyse und motorisches Lernen am Rotarod. (A-G) Die Gangindizes von UBE3AmGenedel/+ Tieren waren verändert. UBE3AmGenedel/+ Tiere hatten einen längeren Schwung (A) und Stand (B), was zu einer längeren Schrittdauer und -länge (C,D) führte. Die Vortriebsdauer (E) und die Verzögerung (F) der Hintergliedmaßen wurden ebenfalls erhöht. Die Analyse ergab auch eine größere Pfotenfläche im Spitzenstand (G). Weder die metrischen Parameter noch das Gewicht der Tiere unterschieden sich (Daten nicht gezeigt), was darauf hindeutet, dass die beobachteten Unterschiede nicht auf Unterschiede in der Tiergröße zurückzuführen sind. Eine Zwei-Wege-ANOVA mit wiederholten Messungen zeigte einen signifikanten Haupteffekt des Genotyps ohne signifikante Genotyp/Geschlechts-Interaktion ( Genotyp-Effekt: p < 0,001; Genotyp/Geschlechts-Interaktion: p > 0,2). (H) Die Ergebnisse der Rotarod-Leistung zeigen eine kürzere Latenz bis zum Sturz bei UBE3AmGenedel/+-Tieren. Eine Zwei-Wege-ANOVA mit wiederholten Messungen ergab signifikante Haupteffekte ohne signifikante Wechselwirkung (Genotyp-Effekt: p < 0,001; Geschlechts-Effekt: p < 0,01; Genotyp/ Geschlechts-Interaktion: p > 0,1). Die im Boxplot dargestellten Gangparameter zeigen den Medianwert, den Interquartilsabstand und den Wertebereich an. Signifikante Post-hoc-Testergebnisse sind mit * gekennzeichnet. Die Daten der Falllatenz werden in einem Liniendiagramm als Mittelwert ± SEM dargestellt, die Daten für Kontrolltiere (weiblich n = 10, männlich n = 14) in rot und Mutanten (weiblich n = 10, männlich n = 11) in blau. Diese Abbildung wurde von Syding et al.6 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Nestlet-Schreddern - Nestbau
Der Nestlet-Zerkleinerungstest dient in erster Linie dazu, stereotypes Zwangsverhalten bei Mäusen zu erkennen29,30. Mäuse zeigen jedoch eine natürliche Tendenz, das vorhandene Material für den Bau ihres Nestes zu zerreißen. Die Unfähigkeit, ein Baumwollnest zu zerkleinern, wird daher als Indikator für sein Wohlbefinden verwendet, das durch eine neurologische Entwicklungsstörung beeinträchtigt wird16,31. Die UBE3AmGenedel/+-Tiere verwendeten signifikant weniger Material für den Bau ihrer Nester, und dieser Unterschied war besonders ausgeprägt zwischen transgenen Weibchen und ihren Kontroll-Artgenossen (Abbildung 4A).
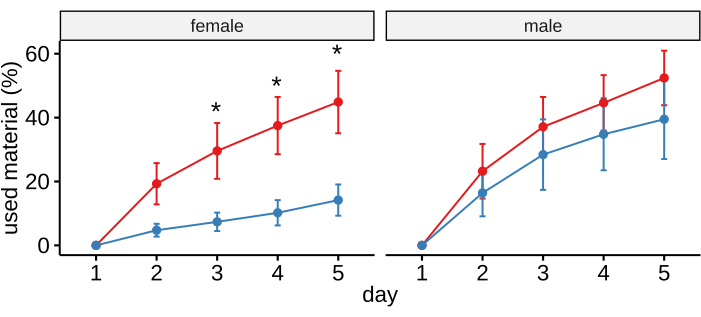
Abbildung 4: Verwendung von Nestlet-Material für den Nestbau. UBE3AmGenedel/+ Tiere zerkleinerten weniger Baumwollmaterial als ihre Kontrollwurfgeschwister. Die Daten wurden in ausgerichtete Ränge umgewandelt, um die Normalitätsvoraussetzung zu erfüllen. Eine Varianzanalyse mit wiederholten Messungen ergab einen signifikanten Genotyp-Effekt ohne Signifikanz der Genotyp-Geschlechts-Interaktion (Genotyp-Effekt: p < 0,05; Genotyp/Geschlechts-Interaktion: p > 0,4). Die im Liniendiagramm dargestellten Daten zeigen den Mittelwert ± REM. Signifikante Post-hoc-Testergebnisse sind mit * gekennzeichnet. Die Daten für Kontrolltiere (weiblich n = 10, männlich n = 14) sind rot und Mutanten (weiblich n = 10, männlich n = 11) blau dargestellt. Diese Abbildung wurde von Syding et al.6 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Zeitskala für Tests
Jede Gruppe (Kontroll- und Versuchsgruppe) wird an den gleichen Tagen den gleichen Tests unterzogen. Eine Pause von 1 Tag zwischen den Tests wird verwendet, um mögliche Verschleppungseffekte zu minimieren. Wenn möglich, werden Weibchen und Männchen an aufeinanderfolgenden Tagen getestet; Andernfalls werden die Weibchen nach dem Test der Männchen getestet (Abbildung 5)6.

Abbildung 5: Zeitskala für das Testen. UBE3AmGenedel/+ Tiere und ihre Kontrollen wurden in zwei Kohorten getestet. Die Testzeitskala für die erste Kohorte ist im oberen Bereich und für die zweite Kohorte im unteren Bereich dargestellt. Die Tage, an denen die Männchen getestet wurden, sind blau angegeben, während die Tage, an denen die Weibchen getestet wurden, grün markiert sind. Tage, an denen beide Geschlechter getestet wurden, sind gelb markiert. An den Wochenenden wurde nicht getestet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Zahlen wurden von Syding et al.6 in Übereinstimmung mit der MDPI-Lizenzrichtlinie übernommen.
Diskussion
AS-Modelle, die in verschiedenen murinen Stämmen erstellt wurden, werden in der Regel mit Tests des emotionalen Zustands, der motorischen Funktionen und der kognitiven Fähigkeiten von Tieren validiert, um den Vergleich mit menschlichen Symptomen zu erleichtern31,32. Ein motorisches Defizit in AS-Modellen ist der konsistenteste Befund in allen Laboren, gefolgt von einem unveränderten Emotionalitätszustand der Mutanten und Schwierigkeiten beim Nesterbau31,32,33. Im Gegensatz dazu ist die kognitive Beeinträchtigung entweder leicht oder fehlt 7,31,33. Die Diskrepanz im kognitiven Phänotyp scheint vom Alter der getesteten Tiere abzuhängen, wie Huang et al.7 zeigen. Daher wurde für diese Arbeit eine Reihe von Tests auf der Grundlage ihrer Reproduzierbarkeit sowie ihrer Alters- und Speziesunabhängigkeit ausgewählt, da vergleichbare Ergebnisse sowohl in Maus- als auch in Ratten-AS-Modellen beobachtet werden 6,31,32.
Kritisch sollte man bedenken, dass die wiederholte Versuchung von Tieren in verschiedenen Versuchsanordnungen eine sorgfältige Reihenfolge erfordert, beginnend mit den Tests, die am empfindlichsten auf vorherige Manipulation reagieren, und gleichzeitig mit minimalen Auswirkungen auf die folgenden Tests, wie z. B. die EPM- und OF-Tests34. Weitere Bedenken betreffen den Nestlet-Schreddertest, bei dem die Tiere in Einzelhaltung gehalten werden, was bekanntermaßen ein stressiger Zustand ist35. Die anschließende Bündelung von Männchen in einem gemeinsamen Käfig führt oft zu erhöhter Aggression aufgrund der Etablierung von Hierarchien. Somit sollte der Nestlet-Zerkleinerungstest den Testplan abschließen. Es ist auch eine gute Praxis, Männchen vor Weibchen zu testen, um zu vermeiden, dass das Verhalten der Männchen durch nachlaufende weibliche Riechspuren beeinflusst wird. Der Wechsel von Tieren, die zu verschiedenen Versuchsgruppen gehören, während der Versuche ist in der Verhaltensforschung von entscheidender Bedeutung, um die Auswirkungen unvorhersehbarer Faktoren auf das Verhalten der Tiere auszugleichen. Es ist bekannt, dass der Umgang mit Tieren vor der Testung im EPM ihre beobachtete Stressreaktion beeinflusst. Daher muss der Umfang der Handhabung für alle Tiere gleich sein36. Es ist auch sehr wichtig, die Haltungsbedingungen (einzeln vs. Gruppen), die Beleuchtung während des Versuchs, den Zeitpunkt des Tests und vor der Testerfahrung für jedes Tier aufrechtzuerhalten, da all diese Faktoren die Reaktion einer Maus im EPM- und OF-Test beeinflussen und die Ergebnisse verzerren können37.
Trotz der vorgestellten Tests, die zu etablierten Screening-Tools in der Arzneimittelentwicklung gehören, und der Phänotypisierung genetisch veränderter Mäuse, die laborübergreifend reproduzierbare Ergebnisse liefern, können einige Tests noch geringfügigen Modifikationen unterliegen. Da motorische Beeinträchtigungen das Hauptmerkmal des Phänotyps eines AS-Tiermodells sind, könnte der Rotarod-Test auf 1 Tag statt auf 5 aufeinanderfolgende Tage beschränkt werden. Zusätzlich könnten Parameter, die die Qualität eines gebauten Nestes beschreiben, in den Nestlet-Zerkleinerungstest38 einbezogen werden.
Eine deutliche Einschränkung der vorgestellten Ergebnisse ist die Mehrdeutigkeit ihrer Interpretation. Insbesondere das motorische Defizit von AS-Tieren kann Veränderungen bei bewegungsbasierten Aufgaben wie dem OF-Test und EPM erklären. Analog dazu kann eine verlängerte Immobilitätszeit im TST eine Folge der größeren körperlichen Ermüdung sein, die AS-Tiere während dieses anspruchsvollen Tests entwickeln, im Gegensatz zu depressivem Verhalten. Auch im Nestchen-Zerkleinerungstest kann der reduzierte Baumwollverbrauch eher auf den neuromuskulären Phänotyp als auf den Verlust des Nestbauinstinkts zurückzuführen sein. Die Interpretation von Schrittlängenänderungen ist nicht eindeutig, da in einigen Mausmodellen der Parkinson-Krankheit eine Verkürzung beobachtet wird, während bei alternden Mäusen eine Verlängerung beobachtet wird39,40. Wir glauben jedoch, dass eine Zunahme der Gesamtschrittlänge eine Folge einer längeren Schwungdauer ist. Die Schwungdauer nimmt mit den Schmerzen zu und verlängert sich in Arthritismodellen, was bedeutet, dass eine längere Schwungdauer bei Mäusen möglicherweise eine korrekte Positionierung der Gliedmaßen vor dem Tragen des Gewichts ermöglichen könnte41,42. Die Antriebsdauer bezieht sich auf die Zeitspanne, die ein Tier benötigt, um eine Vorwärtsbewegung zu initiieren und aufrechtzuerhalten. Daher kann eine kurze Dauer bei gesunden Tieren auf eine größere Kraft und eine bessere Kontrolle hindeuten. Diese Befunde charakterisieren nicht nur dieses AS-Mausmodell, sondern deuten auch auf eine Beeinträchtigung des Gangs hin. Um die physiologischen Grundlagen einer solchen Beeinträchtigung aufzuklären, sind jedoch genauere Untersuchungen erforderlich, wie z. B. die Bestimmung der Muskelkraft und die Untersuchung neuromuskulärer Verbindungen/Übertragungen.
Trotz des interpretatorischen Dilemmas liefert die vorgestellte Reihe von Verhaltenstests reproduzierbare Ergebnisse, die in allen Laboren konsistent sind, und kann als elegantes Validierungswerkzeug für neue murine Modelle des Angelman-Syndroms und neue therapeutische Ansätze dienen 6,31,32,43,44,45.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Forschung wurde von der Tschechischen Akademie der Wissenschaften RVO 68378050, LM2018126 Tschechischen Zentrum für Phänogenomik von MEYS CR, OP RDE CZ.02.1.01/0.0/0.0/16_013/0001789 (Upgrade des Tschechischen Zentrums für Phänogenomik: Entwicklung hin zur Translationsforschung durch MEYS und ESIF), OP RDE CZ.02.1.01/0.0/0.0/18_046/0015861 (CCP Infrastructure Upgrade II von MEYS und ESIF) und OP RDI CZ.1.05/2.1.00/19.0395 (höhere Qualität und Kapazität für transgene Modelle durch MEYS und EFRE) unterstützt. Darüber hinaus wurde diese Studie von der NGO "Association of Gene Therapy (ASGENT)", Tschechien (https://asgent.org/) und LM2023036 Tschechischen Zentrum für Phänogenomik finanziert, das vom Ministerium für Bildung, Jugend und Sport der Tschechischen Republik zur Verfügung gestellt wird.
Materialien
| Name | Company | Catalog Number | Comments |
| Cages, individually ventilated | Techniplast | ||
| DigiGait | Mouse Specifics, Inc., 2 Central Street Level Unit 110 Framingham, MA 01701, USA | Equipment was tendered, no catalogue number was provided, nor could be find on company's web site | Detailed analysis of mouse gait, hardware and software provided. |
| FDA Nestlet squares | Datesand Ltd., 7 Horsfield Way, Bredbury, Stockport SK6, UK | Material was bought from Velaz vendor via direct email request. Velaz do not provide any catalogue no. | Cotton nestlets for nest building test. Nestlet discription: 2-3 g each, with diameter around 5 x 5 x 0.5cm. |
| Mouse chow | Altramion | ||
| Rotarod | TSE Systems GmbH, Barbara-McClintock-Str.4 12489 Berlin, Germany | Equipment was tendered, no catalogue number was provided, nor could be find on company's web site | Rotarod for 5 mice, hardware and software provided. Drum dimensions: Diameter: 30 mm, width per lane: 50 mm, falling distance 147 mm. |
| Tail Suspension Test | Bioseb, In Vivo Research Instruments, 13845 Vitrolles FRANCE | Reference: BIO-TST5 | Fully automated equipment for immobility time evaluation of 3 mice hanged by tail, hardware and software provided |
| Transpore medical tape | Medical M, Ltd. | P-AIRO1291 | The tape used to attach an animal to the hook by its tail. |
| Viewer - Video Tracking System | Biobserve GmbH, Wilhelmstr. 23 A 53111 Bonn, Germany | Equipment with software were tendered, no catalogue number was provided, nor could be find on company's web site | Software with custom made hardware: maze, IR base, IR sensitive cameras. Custom-made OF dimensions: 42 x 42 cm area, 49 cm high wall, central zone area: 39 cm2. A custom-made EPM was elevated 50 cm above the floor, with an open arm 79 cm long, 9 cm wide, and closed arm 77 cm long, 7.6 cm wide. |
Referenzen
- Kalsner, L., Chamberlain, S. J. Prader-Willi, Angelman, and 15q11-q13 duplication syndromes. Pediatric Clinics of North America. 62 (3), 587-606 (2015).
- Yamasaki, K., et al. Neurons but not glial cells show reciprocal imprinting of sense and antisense transcripts of Ube3a. Human Molecular Genetics. 12 (8), 837-847 (2003).
- Clayton-Smith, J., Laan, L. Angelman syndrome: a review of the clinical and genetic aspects. Journal of Medical Genetics. 40 (2), 87-95 (2003).
- Jolleff, N., Ryan, M. M. Communication development in Angelman's syndrome. Archives of Disease in Childhood. 69 (1), 148-150 (1993).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Syding, L. A., et al. Generation and characterization of a novel Angelman syndrome mouse model with a full deletion of the Ube3a gene. Cells. 11 (18), 2815 (2022).
- Huang, H. -. S., et al. Behavioral deficits in an Angelman syndrome model: effects of genetic background and age. Behavioural Brain Research. 243, 79-90 (2013).
- Choleris, E., Thomas, A. W., Kavaliers, M., Prato, F. S. A detailed ethological analysis of the mouse open field test: effects of diazepam, chlordiazepoxide and an extremely low frequency pulsed magnetic field. Neuroscience and Biobehavioral Reviews. 25 (3), 235-260 (2001).
- Cryan, J. F., Mombereau, C., Vassout, A. The tail suspension test as a model for assessing antidepressant activity: review of pharmacological and genetic studies in mice. Neuroscience and Biobehavioral Reviews. 29 (4-5), 571-625 (2005).
- Walf, A. A., Frye, C. A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nature Protocols. 2 (2), 322-328 (2007).
- Carola, V., D'Olimpio, F., Brunamonti, E., Mangia, F., Renzi, P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behavioural Brain Research. 134 (1-2), 49-57 (2002).
- Yan, H. -. C., Cao, X., Das, M., Zhu, X. -. H., Gao, T. -. M. Behavioral animal models of depression. Neuroscience Bulletin. 26 (4), 327-337 (2010).
- Preisig, D. F., et al. High-speed video gait analysis reveals early and characteristic locomotor phenotypes in mouse models of neurodegenerative movement disorders. Behavioural Brain Research. 311, 340-353 (2016).
- Knippenberg, S., Thau, N., Dengler, R., Petri, S. Significance of behavioural tests in a transgenic mouse model of amyotrophic lateral sclerosis (ALS). Behavioural Brain Research. 213 (1), 82-87 (2010).
- Farr, T. D., Liu, L., Colwell, K. L., Whishaw, I. Q., Metz, G. A. Bilateral alteration in stepping pattern after unilateral motor cortex injury: a new test strategy for analysis of skilled limb movements in neurological mouse models. Journal of Neuroscience Methods. 153 (1), 104-113 (2006).
- Jirkof, P. Burrowing and nest building behavior as indicators of well-being in mice. Journal of Neuroscience Methods. 234, 139-146 (2014).
- Wulaer, B., et al. Repetitive and compulsive-like behaviors lead to cognitive dysfunction in Disc1Δ2-3/Δ2-3 mice. Genes, Brain, and Behavior. 17 (8), 12478 (2018).
- Glickman, S. E., Hartz, K. E. Exploratory behavior in several species of rodents. Journal of Comparative and Physiological Psychology. 58, 101-104 (1964).
- La-Vu, M., Tobias, B. C., Schuette, P. J., Adhikari, A. To approach or avoid: an introductory overview of the study of anxiety using rodent assays. Frontiers in Behavioral Neuroscience. 14, 145 (2020).
- Karolewicz, B., Paul, I. A. Group housing of mice increases immobility and antidepressant sensitivity in the forced swim and tail suspension tests. European Journal of Pharmacology. 415 (2-3), 197-201 (2001).
- Liu, X., Gershenfeld, H. K. Genetic differences in the tail-suspension test and its relationship to imipramine response among 11 inbred strains of mice. Biological Psychiatry. 49 (7), 575-581 (2001).
- Dunham, N. W., Miya, T. S. A note on a simple apparatus for detecting neurological deficit in rats and mice. Journal of the American Pharmaceutical Association. 46 (3), 208-209 (1957).
- Dorman, C. W., Krug, H. E., Frizelle, S. P., Funkenbusch, S., Mahowald, M. L. A comparison of DigiGait and TreadScan imaging systems: assessment of pain using gait analysis in murine monoarthritis. Journal of Pain Research. 7, 25-35 (2013).
- Stroobants, S., Gantois, I., Pooters, T., D'Hooge, R. Increased gait variability in mice with small cerebellar cortex lesions and normal rotarod performance. Behavioural Brain Research. 241, 32-37 (2013).
- Vandeputte, C., et al. Automated quantitative gait analysis in animal models of movement disorders. BMC Neuroscience. 11, 92 (2010).
- Amende, I., et al. Gait dynamics in mouse models of Parkinson's disease and Huntington's disease. Journal of Neuroengineering and Rehabilitation. 2, 20 (2005).
- Hampton, T. G., et al. Gait disturbances in dystrophic hamsters. Journal of Biomedicine & Biotechnology. 2011, 235354 (2011).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1(G93A) mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Li, X., Morrow, D., Witkin, J. M. Decreases in nestlet shredding of mice by serotonin uptake inhibitors: comparison with marble burying. Life Sciences. 78 (17), 1933-1939 (2006).
- Murphy, M., et al. Chronic adolescent Δ9-tetrahydrocannabinol treatment of male mice leads to long-term cognitive and behavioral dysfunction, which are prevented by concurrent cannabidiol treatment. Cannabis and Cannabinoid Research. 2 (1), 235-246 (2017).
- Sonzogni, M., et al. A behavioral test battery for mouse models of Angelman syndrome: A powerful tool for testing drugs and novel Ube3a mutants. Molecular Autism. 9, 47 (2018).
- Dodge, A., et al. Generation of a novel rat model of Angelman syndrome with a complete Ube3a gene deletion. Autism Research. 13 (3), 397-409 (2020).
- Born, H. A., et al. Strain-dependence of the Angelman syndrome phenotypes in Ube3a maternal deficiency mice. Scientific Reports. 7 (1), 8451 (2017).
- File, S. E., Mabbutt, P. S., Hitchcott, P. K. Characterisation of the phenomenon of "one-trial tolerance" to the anxiolytic effect of chlordiazepoxide in the elevated plus-maze. Psychopharmacology. 102 (1), 98-101 (1990).
- Liu, N., et al. Single housing-induced effects on cognitive impairment and depression-like behavior in male and female mice involve neuroplasticity-related signaling. The European Journal of Neuroscience. 52 (1), 2694-2704 (2020).
- Ueno, H., et al. Effects of repetitive gentle handling of male C57BL/6NCrl mice on comparative behavioural test results. Science Reports. 10 (1), 3509 (2020).
- Rodgers, R. J., Dalvi, A. Anxiety, defence and the elevated plus-maze. Neuroscience and Biobehavioral Reviews. 21 (6), 801-810 (1997).
- Deacon, R. M. J., Penny, C., Rawlins, J. N. P. Effects of medial prefrontal cortex cytotoxic lesions in mice. Behavioural Brain Research. 139 (1-2), 139-155 (2003).
- Fernagut, P. O., Diguet, E., Labattu, B., Tison, F. A simple method to measure stride length as an index of nigrostriatal dysfunction in mice. Journal of Neuroscience Methods. 113 (2), 123-130 (2002).
- Wooley, C. M., Xing, S., Burgess, R. W., Cox, G. A., Seburn, K. L. Age, experience and genetic background influence treadmill walking in mice. Physiology & Behavior. 96 (2), 350-361 (2009).
- Lakes, E. H., Allen, K. D. Gait analysis methods for rodent models of arthritic disorders: reviews and recommendations. Osteoarthritis and Cartilage. 24 (11), 1837-1849 (2016).
- Deuis, J. R., Dvorakova, L. S., Vetter, I. Methods used to evaluate pain behaviors in rodents. Frontiers in Molecular Neuroscience. 10, 284 (2017).
- Tanas, J. K., et al. Multidimensional analysis of behavior predicts genotype with high accuracy in a mouse model of Angelman syndrome. Translational Psychiatry. 12 (1), 426 (2022).
- Silva-Santos, S., et al. Ube3a reinstatement identifies distinct developmental windows in a murine Angelman syndrome model. The Journal of Clinical Investigation. 125 (5), 2069-2076 (2015).
- Milazzo, C., et al. Antisense oligonucleotide treatment rescues UBE3A expression and multiple phenotypes of an Angelman syndrome mouse model. JCI Insight. 6 (15), e145991 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten