Method Article
Ein großes Tiermodell für pulmonale Hypertonie und rechtsventrikuläres Versagen: Ligatur der linken Lungenarterie und progressive Hauptbelarterienbandierung bei Schafen
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt die Operationstechnik und den experimentellen Ansatz zur Entwicklung einer schweren rechtsventrikulären Drucküberlastung, um ihre adaptiven und maladaptiven Phänotypen zu modellieren.
Zusammenfassung
Dekompensiertes rechtsventrikuläres Versagen (RVF) bei pulmonaler Hypertonie (PH) ist tödlich, mit begrenzten medizinischen Behandlungsmöglichkeiten. Die Entwicklung und Erprobung neuartiger Therapeutika für PH erfordert ein klinisch relevantes Großtiermodell mit erhöhtem pulmonalem Gefäßwiderstand und RVF. Dieses Manuskript diskutiert die neueste Entwicklung des zuvor veröffentlichten SCHAF-PH-RVF-Modells, das die Ligatur der linken Lungenarterie (PA) und den Haupt-PA-Verschluss verwendet. Dieses Modell von PH-RVF ist eine vielseitige Plattform, um nicht nur die Schwere der Erkrankung, sondern auch die phänotypische Reaktion des RV zu kontrollieren.
Erwachsene Schafe (60-80 kg) unterzogen sich einer linken PA-Ligatur (LPA), der Platzierung der Haupt-PA-Manschette und dem Einsetzen des RV-Druckmonitors. PA-Manschette und RV-Drucküberwachung wurden an subkutane Ports angeschlossen. Die Probanden unterzogen sich 9 Wochen lang zweimal pro Woche einer progressiven PA-Bandierung mit sequentiellen Messungen des RV-Drucks, des PA-Manschettendrucks und des gemischten venösen Blutgases (SvO2). Zu Beginn und am Endpunkt dieses Modells wurden die ventrikuläre Funktion und die Abmessungen mittels Echokardiographie bewertet. In einer repräsentativen Gruppe von 12 Tierpersonen stieg der mittlere RV- und systolische Druck von 28 ± 5 bzw. 57 ± 7 mmHg in Woche 1 auf 44 ± 7 bzw. 93 ± 18 mmHg (mittlere ± Standardabweichung) in Woche 9. Die Echokardiographie zeigte charakteristische Befunde von PH-RVF, insbesondere RV-Dilatation, erhöhte Wanddicke und Septumverbiegung. Der Längstrend von SvO2 - und PA-Manschettendruck zeigt, dass die Rate der PA-Bandierung titriert werden kann, um unterschiedliche RV-Phänotypen hervorzurufen. Eine schnellere PA-Banding-Strategie führte zu einem steilen Rückgang der SvO2 -< 65%, was auf eine RV-Dekompensation hindeutet, während eine langsamere, schnellere Strategie zur Aufrechterhaltung des physiologischen SvO2 bei 70% -80% führte. Ein Tier, das die beschleunigte Strategie erlebte, entwickelte bis Woche 9 mehrere Liter Pleuraerguss und Aszites. Dieses chronische PH-RVF-Modell bietet ein wertvolles Werkzeug für die Untersuchung molekularer Mechanismen, die Entwicklung diagnostischer Biomarker und die Ermöglichung therapeutischer Innovationen zur Behandlung von RV-Anpassung und Fehlanpassung von PH.
Einleitung
Dekompensiertes rechtsventrikuläres (RV) Versagen ist die vorherrschende Ursache für Morbidität und Mortalität bei Patienten mit pulmonaler Hypertonie (PH). RV-Versagen ist für über 50% der Krankenhausaufenthalte bei Patienten mit PH verantwortlich und ist eine häufige Todesursache in dieser Patientenpopulation1,2. Obwohl aktuelle medizinische Behandlungen für PH zeitweilige Maßnahmen bieten können, kehren sie das Fortschreiten der Krankheit nicht um. Daher ist die einzige Langzeitbehandlung die Lungentransplantation. Um neuartige medizinische Behandlungen und Interventionen für PH und RVF zu erforschen und zu testen, wird ein klinisch relevantes Tiermodell benötigt, um die komplexe Pathophysiologie der Krankheit zu rekapitulieren. Insbesondere besteht ein großer klinischer Bedarf, RV-orientierte Therapeutika für PH-Patienten zu entwickeln, um die RV-Funktion zu verbessern. Bis heute haben sich die meisten veröffentlichten Tierstudien zu PH- und RV-Dysfunktion auf kleine Säugetiere wie Mäuse und Ratten verlassen3. Auf der anderen Seite gab es nur eine Handvoll großer Tiermodelle, um die Krankheit und die RV-Pathophysiologie aus abnormaler Nachlast zu untersuchen4,5,6,7. Darüber hinaus enthält keines der zuvor veröffentlichten Großtiermodelle Beschreibungen experimenteller Verfahren zur kontrollierten Titration der Krankheitsschwere, die differenziell zu kompensierten versus dekompensierten RV-Versagensphänotypen führen. Ein Tiermodell von PH, das titriert werden kann, um akutes und chronisches RV-Versagen mit unterschiedlichem Grad an Kompensation zu induzieren, wird benötigt, um Krankheitsmechanismen zu untersuchen und neuartige Diagnostika und Therapeutika für PH und RVF in die klinische Praxis zu entwickeln, zu testen und zu übersetzen. Ein solches Modell in einem großen Tier ist besonders wertvoll für die Entwicklung mechanischer Kreislaufunterstützungsgeräte8.
Hier wird ein chronisches, großtieres PH-RVF-Modell vorgestellt, das die Ligatur der linken Lungenarterie (PA) und die progressive Haupt-PA-Bandierung bei erwachsenen Schafen verwendet9,10. Die Ligatur des linken PA (LPA) erhöht den pulmonalen Gefäßwiderstand und verringert die PA-Kapazität11,12. Der progressive PA-Banding-Ansatz ermöglicht eine präzise Titration der Krankheitsschwere und die Anpassung des RV. Diese Plattform kann auch leicht für die Längsschnittuntersuchung des Krankheitsverlaufs in Richtung RV-Dekompensation genutzt werden. Die Verfahren und Prozesse, die zur Durchführung dieses Modells erforderlich sind, werden als Ressource für Forscher vorgestellt, die an einer großen Tierplattform interessiert sind, um neuartige Behandlungen für PH und RVF zu entwickeln.
Protokoll
Das Institutional Animal Care and Use Committee am Vanderbilt University Medical Center genehmigte das Protokoll. Die beschriebenen Verfahren wurden in Übereinstimmung mit dem Us National Research Council's Guide for the Care and Use of Laboratory Animals, 8. Auflage, durchgeführt. Die Übersicht und der Zeitplan des experimentellen Verfahrens sind in Abbildung 1 dargestellt. Ergänzende Tabelle 1 beschreibt das Geschlecht, das Gewicht, die Rasse, die Schafquelle und andere relevante Informationen, die für die Reproduzierbarkeit hilfreich sein können.
1. Einen Tag vor der Operation, Vorbereitung des Tieres
- Halten Sie das Futter 24-40 h vor dem chirurgischen Eingriff zurück, um den Pansen des Tieres zu dekomprimieren.
- Tragen Sie 12 h vor dem Eingriff ein 50 μg/h Fentanylpflaster auf eine abgescherte Stelle auf dem Schafsdorn auf. Reinigen Sie den Bereich mit Chlorhexidin, um Lanolinölrückstände vor dem Auftragen zu entfernen. Decken Sie das Pflaster mit einem elastischen Schlauchverband ab und schützen Sie es.
2. Tag der Operation, präoperative Schritte im Vorbereitungsraum
- Verabreichen Sie Tiletamin/Zolazepam intramuskulär (2,2-5 mg/kg) und geben Sie 1%-3% Isofluran gemischt mit 80%-100% Sauerstoff über eine Gesichtsmaske ab, um eine Anästhesie zu induzieren.
- Positionieren Sie das Schaf auf dem Vorbereitungstisch und sichern Sie seine Beine.
- Intubieren Sie mit einem 10 mm Endotrachealtubus und starten Sie die mechanische Beatmung im Volumenkontrollmodus (Tidalvolumen, TV = 10 ml/kg, Atemfrequenz, RR = 15 Atemzüge pro Minute).
- Rasieren Sie das Operationsfeld vom Hals des Schafes bis zum Oberbauch, wie unten beschrieben.
- Rasieren Sie den vorderen Hals des Schafes, um die Haut über den Jugularvenen für die zentralvenöse Katheterisierung freizulegen (siehe Schritt 3.7).
- Rasieren Sie den anterolateralen Thorax bilateral in Vorbereitung auf die Thorakotomie (siehe Schritt 4.1).
- Rasieren Sie die linke Seite des Rumpfes von der Brust bis zum Rücken (d. h. so dorsal, wie es der Tisch mit dem Subjekt in Rückenlage zulässt) und von der Brust bis zur hinteren Flanke kaudal, um die Implantation subkutaner Ports vorzubereiten (siehe Schritte 4.12-4.15).
- Führen Sie einen 20 G Angiokatheter in die Ohrmuschelarterie ein, um den arteriellen Druck zu überwachen und Blutgasproben zu entnehmen.
- Legen Sie einen Silikonschlauch mit einem Innendurchmesser von 3/8 "-1/2" für die Pansendekompression. Die orogastrische Sonde verbleibt während des gesamten Eingriffs im Pansen.
- Transportieren Sie das Tier aus dem präoperativen Vorbereitungsraum in den Operationssaal.
3. Operationstag, präoperative Schritte im OP-Trakt
- Schließen Sie die Schafe wieder an das Beatmungsgerät im Operationssaal an und setzen Sie die Beatmung mit der gleichen Einstellung in Schritt 2.3 fort (Isofluran 1%-3%, TV = 10 ml/kg, RR = 15 Atemzüge pro Minute)
- Schließen Sie die Sensoren für Pulsoximetrie (SpO2), arteriellen Blutdruck, Temperatur, Endgezeitenkapnogramm und Elektrokardiogramm (EKG) an den Anästhesiemonitor an.
- Schließen Sie die Sensoren für Vitalfunktionen an das Tier an.
- Legen Sie das Pulsoximeter auf die Zunge des Tieres.
- Legen Sie den Temperaturfühler in das Rektum.
- Verbinden Sie 3-Kanal-Elektrokardiogramm-Sonden: Legen Sie die rote Leine auf das linke Hinterbein, die weiße Leine auf das rechte Vorderbein und die schwarze Leine auf das linke Vorderbein.
- Verbinden Sie das männliche Luer-Ende des Drei-Wege-Absperrhahns mit dem Angiokatheter der Ohrmuschelarterie und verbinden Sie das gegenüberliegende weibliche Luer-Ende mit dem Druckmessumformer zur Überwachung der arteriellen Leitung mit einem entsprechend dimensionierten Druckschlauch.
- Richten Sie den Messumformer auf der Ebene des Operationstisches aus.
- Öffnen Sie den Drei-Wege-Absperrhahn am Messumformer.
- Scrollen Sie mit dem Hauptknopf des Vitalmonitors, um den arteriellen Blutdruckkanal hervorzuheben, und drücken Sie dann den Knopf, um den Kanal auszuwählen.
- Wählen Sie ZERO IBP aus, um den Messumformer auf Null zu setzen.
- Verbinden Sie den männlichen Lueranschluss der Kapnographie-Monitorleitung mit dem weiblichen Luer-Anschluss am Beatmungsrohr, um das CO2-Endtidalen zu überwachen.
- Richten Sie die IV-Pumpen für die kontinuierliche Flüssigkeitsverabreichung und die Unterstützung von Inotropen oder Vasopressoren ein.
- Perforieren Sie das Septum auf dem Kochsalzbeutel mit dem IV-Verabreichungsset. Stellen Sie sicher, dass der INFUSIONSschlauch vor dem Perforieren des Beutels eingeklemmt ist, um ein Verschütten zu verhindern.
- Richten Sie den Schlauch des IV-Verabreichungssets aus und passen Sie ihn in die IV-Walzenpumpe ein und prüfen Sie, ob die auf der Pumpe angegebene Richtung mit der Richtung der Flüssigkeitsverabreichung übereinstimmt.
HINWEIS: Stellen Sie sicher, dass das IV-Verabreichungsset mit der IV-Pumpe kompatibel ist. - Schalten Sie die Pumpe ein und geben Sie PRIME an, um die gesamte Luft in der Leitung zu entfernen.
- Positionieren Sie die Schafe für den operativen Eingriff.
- Drehen Sie das Schaf aus der Rückenlage in eine teilweise rechte seitliche Dekubitusposition.
- Befestigen Sie den rechten Vorderfuß nach unten und sichern Sie den linken Vorderfuß, während Sie ihn cephalad und seitlich mit Seil oder atraumatischen Gurten zurückziehen.
- Führen Sie eine transthorakale Echokardiographie zur Beurteilung der ventrikulären Anatomie und Funktion durch. Die Sonographie ist auch nützlich, um den optimalen Interkostalraum zu bestimmen, der den chirurgischen Zugang sowohl zur Hauptpulmonalarterie als auch zur linken Lungenarterie erleichtert.
- Reinigen Sie das Operationsfeld frei von Schmutz und anderen Verunreinigungen mit Seife oder Schrubbbürste. Bereiten Sie den Hals und die Brust mit Chlorhexidin- oder Betadinlösung vor und drapieren Sie das Operationsfeld steril.
- Mit Ultraschallführung oder anatomischen Orientierungspunkten können Sie mit einer Findernadel oder einem Angiokath auf die linke oder rechte innere Jugularvene zugreifen. Führen Sie mit der Seldinger-Technik einen 7-französischen Drei-Lumen-Zentralvenenkatheter in die Vena jugularis interna für den intravenösen Zugang und die zentrale Venendrucküberwachung ein.
- Verwenden Sie den proximalen Port für die Drucküberwachung und den distalen Port für die Verabreichung von Flüssigkeiten und Medikamenten.
- 20 mg/kg Cefazolin und 5 mg/kg Enrofloxacin intravenös verabreichen. Wiederholen Sie die Dosierung von Cefazolin alle 2-4 h während des Eingriffs.
- Verabreichen Sie einen 500 ml Bolus normaler Kochsalzlösung, um die Vorbelastung vor der Operation zu erhöhen. Beginnen Sie mit einer intravenösen Erhaltungsflüssigkeitsrate von 15 ml / kg / h.
4. Operativer Ablauf
- Führen Sie eine muskelschonende Mini-Thorakotomie (Länge < 8 cm) im linken vierten Interkostalraum durch, um eine mediastinale Exposition zu erhalten. Wählen Sie die Mini-Thorakotomie, um die postoperative Genesung zu beschleunigen.
- Nach der Teilung der Haut den darunter liegenden Muskel (Pectoralis major) längs entlang seiner Fasern spalten, die leicht schräg zum Interkostalraum verlaufen. Platzieren Sie einen selbsthaltenden Retraktor, um die Muskelschicht zu verteilen und die Brustwand freizulegen.
- Teilen Sie den Serratus anterior und den darunter liegenden Interkostalmuskel in den ausgewählten Interkostalraum und achten Sie darauf, sofort zur Rippe zu bleiben.
- Betreten Sie den Pleuraraum und setzen Sie dann fort, die Interkostalmuskeln nach hinten in Richtung Wirbelsäule und anteromedial in Richtung Brustbein vollständig freizugeben, um versehentliche Rippenfrakturen oder Luxationen am Brustbein zu verhindern. Vermeiden Sie eine Schädigung der Brustgefäße medial.
- Platzieren Sie die selbsthaltenden Retraktoren, um den Rippenraum und das darüber liegende Weichgewebe zu öffnen. Verwenden Sie einen kleinen oder mittleren Finochietto-Retraktor, um die Rippen zu trennen, und einen Tuffier-Retraktor (5 cm Retraktorklinge), um senkrecht zum Finochietto im Interkostalraum zu sitzen, der das Weichgewebe innerhalb des Interkostalraums zurückzieht, um die Exposition zu verbessern.
- Schneiden Sie das Perikard anterior zum Nervus phrenicus ein, ohne es zu verletzen, und erstellen Sie einen Perikardbrunnen mit 2-0 Seidennähten, um die Haupt-PA und RV freizulegen.
- Beurteilen Sie die Exposition und stellen Sie sicher, ob der geeignete Interkostalraum betreten wurde. Im Idealfall sind die proximale PA und das linke Vorhofanhang direkt unter dem Schnitt gut sichtbar, was darauf hindeutet, dass der optimale Interkostalraum ausgewählt wurde, um sowohl der Haupt-PA als auch der LPA ausgesetzt zu sein.
- Wenn die Exposition als unzureichend erachtet wird, um sowohl die Haupt-PA als auch die LPA sicher zu erreichen, zögern Sie nicht, einen zusätzlichen Interkostalraum zu öffnen, um alle notwendigen Schritte der Operation durchzuführen. Dies ist jedoch bei entsprechender Auswahl der Inzision nicht erforderlich.
- Sezieren Sie die Haupt-PA und isolieren Sie sie mit einem Nabelband. Stellen Sie eine ausreichende posteriore Dissektion für die eventuelle Okkluderplatzierung und die PA-Durchflusssonde so distal wie möglich auf der Haupt-PA sicher.
- Platzieren Sie eine sterile Durchflusssonde in einer Schüssel mit Wasser oder Kochsalzlösung auf dem sterilen Feld, um die Datenerfassungssoftware zu kalibrieren. Übergeben Sie den elektrischen Stecker am anderen Ende an einen nicht sterilen Bezeichner, um die Sonde mit dem Messgerät zu verbinden.
- Einzelheiten zum Anschluss und zur Kalibrierung von PA-Durchflusssonden und -messgeräten finden Sie in den ergänzenden Dokumenten.
- Tragen Sie eine großzügige Menge steriles Ultraschallgel in die Nut der PA-Durchflusssonde auf.
- Setzen Sie den Silikonliner in die Nut der PA-Durchflusssonde ein und tragen Sie eine zusätzliche Schicht Ultraschallgel auf den Liner auf.
- Platzieren Sie die PA-Durchflusssonde auf der PA und erfassen Sie PA-Durchflussmesswerte auf dem Durchflussmesser und der Datenerfassungsschnittstelle.
- Die Platzierung der PA-Durchflusssonde kann zu einem teilweisen Verschluss der PA führen, der die linksventrikuläre Vorlast und den mittleren arteriellen Druck verringern kann. Achten Sie bei der PA-Durchflusserfassung sorgfältig auf die Hämodynamik.
- Überprüfen Sie auf dem Bildschirm des Durchflussmessers, ob die Stärke des PA-Durchflusssignals 5 bar beträgt. Wenn das Messgerät weniger als 5 bar anzeigt, stellen Sie einen ausreichenden Kontakt zwischen der Durchflusssonde und der Haupt-PA sicher. Tragen Sie bei Bedarf zusätzliches Ultraschallgel auf.
- Platzieren Sie eine sterile Durchflusssonde in einer Schüssel mit Wasser oder Kochsalzlösung auf dem sterilen Feld, um die Datenerfassungssoftware zu kalibrieren. Übergeben Sie den elektrischen Stecker am anderen Ende an einen nicht sterilen Bezeichner, um die Sonde mit dem Messgerät zu verbinden.
- Vollständige intraperikardiale Dissektion von LPA und umschließen Sie es mit einem Nabelband.
- Verwenden Sie einen kleinen Schwammstab oder einen dünnen formbaren Retraktor zum kaudalen Zurückziehen des linken Vorhofanhangs.
HINWEIS: Die Exposition gegenüber der LPA wird durch kaudales Zurückziehen des linken Vorhofanhangs, Cephalad-Retraktion der Haupt-PA und seitliches Zurückziehen des Perikards direkt vor der Stelle, an der das LPA das Perikard verlässt, erleichtert.
- Verwenden Sie einen kleinen Schwammstab oder einen dünnen formbaren Retraktor zum kaudalen Zurückziehen des linken Vorhofanhangs.
- Legen Sie einen hochleistungsfähigen Silikon-Gefäßverschluss um die Haupt-PA (Abbildung 2A,B, Kreis). Die Okkludergröße kann basierend auf dem PA-Durchmesser eingestellt werden; Stellen Sie sicher, dass die Passform eng anliegt. Verwenden Sie eine 0-Seidennaht auf einer Keith-Nadel, um die Enden des Gefäßverschlusses zusammen mit einem U-Stich zu sichern. Sobald sie um die Haupt-PA gesichert sind, schieben Sie den Okkluder distal entlang der Haupt-PA.
- Umgeben Sie die proximale Haupt-PA mit einem 1/2 "Penrose-Drain, um die Dissektion zu erleichtern und Platz für die Platzierung einer Strömungssonde bei nachfolgenden reoperativen Operationen zu reservieren. Schneiden Sie den Penrose-Abfluss so zu, dass er locker um die PA passt, und sichern Sie die Penrose mit einer laufenden 4-0 Prolene-Naht an sich (Abbildung 2B).
- Richten Sie eine RV-Druckleitung zur Überwachung der RV-Drücke ein (Abbildung 2B, weißer Pfeil).
- Wählen Sie eine Position für die RV-Druckleitung in der RV-Abflusstrakt-freien Wand. Platzieren Sie eine 5-0 monofilamente, nicht resorbierbare Polypropylen-Geldbörsenschnurnaht mit Pfanden, die den ausgewählten Ort umgeben, und setzen Sie eine vaskuläre Schlinge ein. Machen Sie die Pledgets aus einem sterilen OP-Handschuh.
- Bereiten Sie die RV-Druckleitung vor: Schneiden Sie das männliche Ende des sterilen 36-Zoll-Druckschlauchs in einem Winkel von 30 ° ab, um das Einführen durch das Myokard zu erleichtern. Verwenden Sie eine 2-0 Seidenbindung, um die Drucklinie in einer optimalen Tiefe für die Platzierung im Wohnmobil zu markieren.
- Machen Sie mit einem 11-Klingen-Skalpell eine kleine Kardiotomie in der RVOT-freien Wand innerhalb der zuvor platzierten Handtaschennaht. Kontrollieren Sie die Blutung mit manuellem Druck oder durch Festziehen der Snare an der Handtaschenschnurnaht.
HINWEIS: Erhalten Sie in diesem Schritt eine Baseline-Biopsie der RV-freien Wand, indem Sie RV-Gewebe innerhalb der Handtaschenschnurnaht entnehmen. Diese Biopsiestelle kann dann als Einstiegspunkt für die RV-Druckleitung dienen. - Setzen Sie das geschnittene Ende des Druckschlauchs in den RV-Ausflusstrakt (RVOT) ein und befestigen Sie es. Binden Sie die Geldbörsenschnur fest und befestigen Sie dann die Geldbörse am Druckschlauch, um die Druckleitung zu sichern.
- Erweitern Sie den RVOT-Schlauch, indem Sie einen zusätzlichen Druckschlauch an die RVOT-Druckleitung anschließen.
- Übergeben Sie den zusätzlichen Druckschlauch an einen nicht sterilen Beauftragten, um den Schlauch an einen Druckmessumformer anzuschließen und die Messung des Basis-RV-Drucks zu überwachen. Richten Sie den Druckaufnehmer wie folgt ein.
- Verbinden Sie das männliche Luer-Ende des IV-Administrationssets mit dem weiblichen Luer-Ende des Schallkopfes.
- Verbinden Sie das weibliche Luer-Ende des Druckschlauchs mit dem männlichen Luer-Ende des Wandlers.
- Spike die IV-Verabreichung in einen heparinisierten Kochsalzbeutel (2 IE / ml).
- Stecken Sie den Salzbeutel in einen Druckbeutel und pumpen Sie den Druckbeutel auf 250-300 mmHg, wie auf dem Messgerät angegeben.
- Saugen Sie die Leitung vollständig an, indem Sie das Ventil am Wandler lösen, um eine ordnungsgemäße Entlüftung zu gewährleisten.
- Befolgen Sie die ergänzenden Methoden für die Kalibrierung von Wandlern.
- Nachdem Sie die LPA sorgfältig seziert haben, umschließen Sie sie mit einem Nabelband. Ligaten Sie die LPA, indem Sie das Nabelschnurband festbinden. Beachten Sie die hämodynamische Reaktion des Tieres auf die Ligatur, falls dies für die Studie relevant ist. Erhöhen Sie die minutengenaue Beatmung, um die erhöhte Totraumbeatmung zu kompensieren, die bei der LPA-Ligatur entsteht. Diese Beatmungsgeräteanpassungen mildern die respiratorische Azidose.
- Injizieren Sie langsam bis zu 3 ml Kochsalzlösung in den Haupt-PA-Okkluder, um sicherzustellen, dass es keine Leckage gibt, während Sie den RV-Druck von der RVOT-Druckleitung überwachen. Sobald die RV-Reaktion bestätigt ist, ziehen Sie die eingeflößte Kochsalzlösung zurück.
- Bringen Sie die RVOT-Druckleitung und den PA-Okkluderschlauch einen Interkostalraum unterhalb des Thorakotomieschnitts aus der Brust.
- Bilden Sie zwei subdermale Taschen entlang der Faszienschicht am linken Rücken des Schafes so weit hinten in Richtung Wirbelsäule, wie es innerhalb des sterilen Feldes möglich ist. Diese dienen als Standorte für verweilende Ports (Abbildung 2C).
- Tunneln Sie mit einem Thoraxrohrzieher die RVOT-Druckleitung und den Okkluderschlauch vom Brustschnitt bis zu den linken Dorsum-Port-Stellen.
- Befestigen Sie sowohl den Okkluderschlauch als auch die RV-Druckleitung an den Widerhakenanschlüssen des Anschlusses. Verankern Sie den Okkluder und den Druckschlauch mit zusätzlichen Anschlüssen um die Anschlussverbinder. Verwenden Sie den mitgelieferten Anschlussanschluss mit Widerhaken, um die Verbindung zu schützen (Abbildung 1C). Setzen Sie die Anschlüsse in die vorgeformten subdermalen Taschen.
- Verankern Sie die Ports an drei Stellen um den Rand herum an der darunter liegenden Faszie mit 3-0 Polypropylennähten, um eine Portmigration zu verhindern. Nähern Sie sich dem Unterhautgewebe, der Dermis und der Haut in Schichten mit Polyglactin 910-Nähten wieder an. Bestätigen Sie erneut die Druckmesswerte durch perkutanen Zugriff auf die Ports. Spülen Sie den RVOT-Port mit 5 ml (1000 I.E./ml, 5000 Einheiten) Heparin-Natrium.
- Legen Sie einen 16-französischen Brustschlauch durch einen separaten Schnitt in die linke Pleurahöhle, befestigen Sie ihn an der Haut und verbinden Sie ihn dann mit einem Druck von -20 cm · H2O mit einer geschlossenen Thoraxdrainageeinheit. Legen Sie einen ungebundenen U-Stich um die Röhre, um den Verschluss nach der Entfernung des Brustschlauchs zu erleichtern.
- Verabreichen Sie eine Interkostalnervenblockade (0,5-1 mg/kg Bupivacain) zur postoperativen Analgesie.
- Schließen Sie die Thorakotomie mit Figur von acht, # 2 Polyglactin 910 Nähten. Schließen Sie die Pectoralis-Muskelschicht mit laufendem # 0 Polyglactin 910. Schließen Sie das Unterhautgewebe in Schichten von laufenden # 2-0 Polyglactin 910-Nähten und heften Sie die Haut.
- Positionieren Sie das Tier wieder in das dorsale Liegerad, entfernen Sie die orogaströse Sonde und setzen Sie dann Isofluran ab.
- Setzen Sie die mechanische Beatmung und unterstützende Pflege fort, bis der pH-Wert des arteriellen Blutes > 7,35 und der pCO2 -< 55 mmHg.
- Extubieren Sie, sobald das Tier spontan atmet, den Kopf hebt und auf dem Endotrachealtubus kaut. Entfernen Sie den Brustschlauch vor der vollständigen Wiederherstellung der Betäubung. Binden Sie den U-Stich fest, um den Brustschlauchschnitt zu schließen.
- Bringen Sie das Tier in seinen Käfig, während Sie die Wiederherstellung seiner Anästhesie überwachen. Stellen Sie sicher, dass zusätzlicher Sauerstoff (3-5 l/min durch Gesichtsmaske) jederzeit verfügbar ist, während das Schaf unbeweglich bleibt. Überwachen Sie die Vitalfunktionen stündlich für die ersten 4 Stunden, alle 8 Stunden für die nächsten 24 Stunden und einmal täglich danach.
5. Postoperative Genesung
- Überwachen Sie die Thorakotomie- und Portimplantationsstellen täglich auf Anzeichen einer Infektion. Lang wirkendes Antibiotikum (Ceftiofur, 5 mg/kg intramuskulär) innerhalb von 24 h nach dem Eingriff und danach alle 3-4 Tage für 1 Woche verabreichen.
- Setzen Sie das Fentanyl-Pflaster postoperativ für insgesamt 72 h fort. Danach eine zusätzliche Analgesie (z. B. Meloxicam, 1 mg/kg einmal täglich intramuskulär), wenn das Tier weiterhin Anzeichen von Schmerzen zeigt (z. B. Zähneknirschen, erhöhte Herzfrequenz).
- Entfernen Sie die äußeren Nähte und Hautklammern 10-14 Tage nach der Operation oder wie vom Tierärztlichen Personal empfohlen.
- Stellen Sie mit einem röhrenförmigen Verband sicher, dass das Tier die Hafenstandorte gegen umliegende Strukturen reibt oder abkratzt (Abbildung 2D).
6. Chronische PA-Streifenbildung (9 - 10 Wochen)
- Bringen Sie die Schafe in ein kleines Gehege. Scheren Sie die überschüssige Wolle um die implantierten Ports ab.
- Reinigen Sie die rasierten Bereiche mit 70% Isopropylalkohol. Wenden Sie topisches Lidocain-Spray zur Lokalanästhesie an.
- Bereiten Sie zwei Druckmessumformer zur Überwachung der RV- und Okkludermanschettendrücke vor (Abbildung 3A).
- Für beide Wandler: Verbinden Sie das weibliche Luer-Ende des Druckschlauchs (36 Zoll oder länger) mit dem männlichen Luer-Ende des Wandlers. Verbinden Sie das männliche Luer-Ende des Druckschlauchs mit einem der weiblichen Luer-Verbindungen an einem Drei-Wege-Absperrhahn. Verbinden Sie schließlich eine 22 G Huber-Nadel mit dem männlichen Luer-Ende dieses Drei-Wege-Absperrhahns.
- Für RV-Druckaufnehmer: Hängen Sie einen heparinisierten Kochsalzbeutel (2 IE / ml) auf, punktieren Sie den Beutel mit dem IV-Verabreichungsset und verbinden Sie den männlichen Luer-Anschluss des IV-Verabreichungssets mit dem weiblichen Luer-Anschluss des RV-Druckmessumformers. Setzen Sie dann den Salzbeutel (z. B. Druckbeutel) unter Druck.
- Für den Okkluderaufnehmer: Den Aufnehmer und den Druckschlauch vollständig vorbereiten. Setzen Sie eine männliche Luerkappe auf das weibliche Luer-Ende des Druckmessumformers, um zu verhindern, dass die Manschettenflüssigkeit zurück zum Schallkopf austritt.
- Verbinden Sie beide Aufnehmer mit einem geeigneten Kabel oder Adapter mit der Datenerfassungshardware.
- Kalibrieren Sie die Messumformer gemäß Ergänzungsdatei 1.
- Klicken Sie oben rechts im Softwarefenster auf Start , um die Aufzeichnung der Datenerfassungssoftware zur Erfassung von RV- und PA-Manschetten-Druckwellenformen bei 400 Hz zu starten.
- Lassen Sie einen Assistenten das Tier vor dem Hafenzugang leicht zurückhalten. Führen Sie die Huber-Nadel vom RV-Druckmessumformer in den RV-Anschluss ein. Befestigen Sie eine 10-ml-Spritze am Drei-Wege-Absperrhahn, und versuchen Sie, Blut aus dem Wohnmobilanschluss zurück in die Spritze zu ziehen (Abbildung 3B).
- Wenn es schwierig ist, die Spritze zurückzuziehen, injizieren Sie zuerst 5-10 ml Kochsalzlösung in den RV-Anschluss, um die Okklusionsquelle zu entfernen.
- Wenn die Verstopfung anhält, geben Sie 2 mg Gewebeplasminogenaktivator (tPA) als fibrinolytisches Mittel in den Port und lassen Sie es über Nacht stehen. Überprüfen Sie am nächsten Tag, um den tPA abzusaugen.
- Sobald die RV-Druckleitung hergestellt ist, schließen Sie die Huber-Nadel vom PA-Manschettenaufnehmer an.
- Erfassen Sie die Startwerte der RV- und PA-Manschettendrücke (Abbildung 3C). Beachten Sie alle drastischen Änderungen gegenüber früheren Messwerten.
- Wenn der PA-Manschetten- und/oder Wohnmobildruck gegenüber dem vorherigen Messwert erheblich gesunken ist, kann dies ein Zeichen dafür sein, dass die PA-Manschette undicht ist.
- Beobachten Sie ein weiteres offensichtliches Anzeichen für ein PA-Manschettenleck, indem Sie die PA-Manschettenwellenform untersuchen. Wenn der durchschnittliche PA-Manschettendruck mit einer erkennbaren Rate abfällt, besteht eine hohe Wahrscheinlichkeit, dass die Manschette undicht ist.
HINWEIS: Überprüfen Sie erneut, ob alle Luer-Verbindungen am Druckmessumformer, am Schlauch und am Absperrhahn festgezogen sind. Der stark unter Druck stehende Flüssigkeitsgehalt aus der PA-Manschette kann zurückfließen und aus losen Luerverbindungen austreten.- Wenn die PA-Manschette undicht ist, bestimmen Sie das Ausmaß der Leckage. Wenn die Leckagerate langsam ist, kann eine häufigere Banding-Strategie die Leckage überwinden, um das Krankheitsmodell immer noch wirksam zu machen.
- Injizieren Sie langsam 3% hypertone Kochsalzlösung in den Okkluderanschluss, während Sie auf den RV- und Manschettendruck achten.
- Passen Sie die Injektionsmenge basierend auf dem gewünschten Schweregrad der PH-Erkrankung und dem RV-Phänotyp an. Eine wöchentliche Erhöhung des Manschettendrucks um 100-150 mmHg ist ein vernünftiges Ziel, um einen adaptiven kompensierenden RV-Phänotyp zu entwickeln.
- Ein schnellerer Anstieg des Manschettendrucks (>250 mmHg pro Woche) führt wahrscheinlich zu einem dekompensierenden RV-Phänotyp.
- Sobald die PA-Manschette auf die gewünschte Menge aufgeblasen ist, entfernen Sie die Huber-Nadel aus dem Manschettenanschluss.
- Holen Sie sich eine Blutprobe aus dem RV-Port.
- 10 ml Blut steril aus dem RV-Port absaugen und beiseite stellen.
- Legen Sie eine neue Spritze anstelle der Aspirationsspritze und aspirieren Sie so viel Blut wie nötig, ohne die wöchentliche Blutentnahmegrenze von 7,5% des gesamten Blutvolumens zu überschreiten.
- Schließen Sie die Originalspritze wieder mit angesaugtem Blut an und führen Sie sie über den Wohnmobilanschluss zurück.
- Ziehen Sie am Ventilhebel des Druckmessumformers, um heparinisierte Kochsalzlösung aus dem Kochsalzbeutel in den RV-Anschluss zu spülen. Fahren Sie mit dem Spülen fort, bis die gesamte Linie klar und farblos wird.
- Spülen Sie den RV-Port mit 10 ml Kochsalzlösung. Dann spülen Sie den Port weiter mit 5 ml 1000 U / ml Heparin-Natrium.
- Wiederholen Sie die Schritte 6.1-6.12 alle 1-4 Tage für 9-10 Wochen.
Ergebnisse
Eine repräsentative Gruppe von 12 Schafen wird verwendet, um die Wirksamkeit dieses Modells für die Entwicklung unterschiedlicher Ph-RVF-Grade zu zeigen. Bei diesen Schafen stieg der mittlere PA-Manschettendruck von 32 ± 20 mmHg in Woche 1 auf 1002 ± 429 mmHg in Woche 9. Dies führte zu einer Erhöhung des RV-Mittelwerts und der systolischen Drücke von 28 ± 5 und 57 ± 7 mmHg in Woche 1 auf 44 ± 7 bzw. 93 ± 18 mmHg in Woche 9. Darüber hinaus wurde das PA-Manschettendruckprofil der gemischten venösen Sauerstoffsättigung (SvO2) überlagert, um die Wirksamkeit des Modells bei der Feinabstimmung des Krankheitsphänotyps zu demonstrieren (Abbildung 4). Insbesondere eine schnellere PA-Bandierung führte zu einem schnelleren Rückgang von SvO2. Im Vergleich dazu behielten diejenigen, die eine allmählichere PA-Banding-Strategie erlebten, einen physiologischen Bereich von SvO2 zwischen 70% und 80% bei. Ein repräsentatives transthorakales Echokardiogramm, das nach 9 Wochen progressiver PA-Streifenbildung aufgenommen wurde, zeigt RV-Dilatation und Septumbogen aufgrund von Drucküberlastung (Ergänzendes Video 1). In einem zuvor veröffentlichten Fallbericht10 kann das Modell auch verwendet werden, um ein RV-Versagen im Endstadium zu induzieren, das zu Pleuraergüssen und abdominalem Aszites führt.
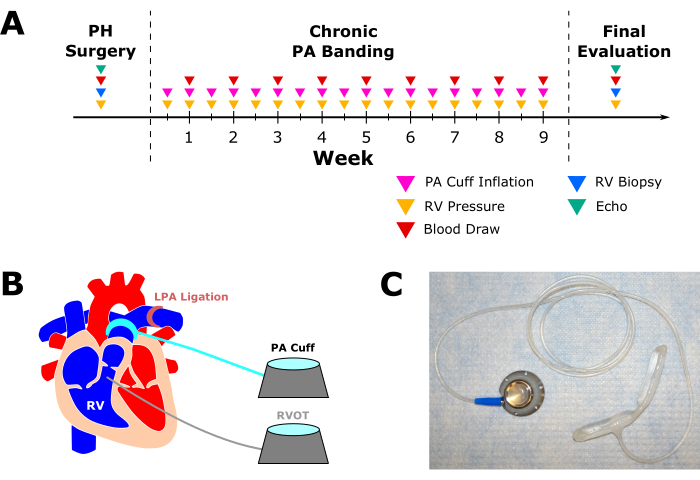
Abbildung 1: Überblick und Zeitplan für das Gesamtexperiment. (A) Experimenteller Zeitplan für das Modell des rechtsventrikulären Versagens (RVF) mit chronischer pulmonaler Hypertonie (PH) und die vorgeschlagene Datenerfassungsstrategie. (B) Das schematische Diagramm für die erste Überlebensoperation, um die Grundlage für das Modell des rechtsventrikulären Versagens (RVF) der chronischen pulmonalen Hypertonie (PH) zu schaffen. Der Hauptokkluder der Lungenarterie (PA) wird implantiert, die linke Lungenarterie (LPA) wird ligatiert und ein Druckschlauch wird im rechten ventrikulären Ausflusstrakt (RVOT) platziert. Schließlich sind sowohl RVOT- als auch PA-Manschettendruckleitungen mit ihren jeweiligen Ports verbunden, die beide subkutan für den wiederkehrenden Zugriff und die Überwachung implantiert werden. (C) Foto der PA-Manschette, des subkutanen Anschlusses und der Kunststoffarmatur zum Schutz ihrer Stachelverbindung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Fotografien der wichtigsten chirurgischen Schritte zur Etablierung des Modells der pulmonalen Hypertonie (PH) der Schafe. (A) Isolierung der Hauptpulmonalarterie (PA) und Implantation der PA-Manschette (Kreis). (B) Implantierte PA-Manschette (Kreis), Penrose-Schlauch (Stern) und rechtsventrikulärer Ausflusstrakt (RVOT) Druckschlauch (weißes Dreieck). (C) Subkutane Implantation von Ports für RVOT und PA-Manschette. (D) Schlauchverband und Schaumstoffpolsterung, die um den Schafkörper angebracht sind, um die implantierten Ports zu schützen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Experimenteller Ansatz für die Banderolierung der chronischen Lungenarterie (PA). (A) Schema für die Einrichtung von Druckmessumformern zur Messung und Einstellung rechtsventrikulärer (RV) und PA-Manschettendruckwerte. (B) Fotodarstellung des zufahrenden RV-Ausflusstrakts (RVOT) und der PA-Manschettenöffnungen. (C) Repräsentative Druckverfolgung von RV- und PA-Manschettendrücken. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Manschettendruck der Lungenarterie (PA) und entsprechende gemischte venöse Sauerstoffsättigung (SvO2). Longitudinale Trends zwischen dem Manschettendruck der Lungenarterie (PA) und der entsprechenden gemischtvenösen Sauerstoffsättigung (SvO2) zeigen eine Differenzierung des rechtsventrikulären Phänotyps basierend auf der PA-Banding-Strategie. Das Farbprofil variiert erheblich zwischen Probanden, die eine schnellere PA-Streifenstrategie erlebten, im Vergleich zu Probanden, die eine allmählichere Streifening-Strategie durchliefen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzendes Video 1: Repräsentative transthorakale Echokardiogramme zwischen gesundem Ausgangszustand und nach dem Krankheitsmodell für rechtsventrikuläres Versagen der pulmonalen Hypertonie (PH-RVF). Das PH-RVF-Modell rekapituliert die wichtigsten Merkmale der Krankheit, einschließlich RV-Dilatation und Hypertrophie sowie Septumbogen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzende Datei 1: Einrichtung der Datenerfassung und Kalibrierungsschritte. Bitte klicken Sie hier, um diese Datei herunterzuladen.
| Quelle | Edle Biowissenschaften, Woodbine, MD |
| Sex | Kastriertes Männchen oder Weibchen |
| Dehnung | Dorset-Kreuz |
| Gewicht | 55-70kg bei Erhalt |
| Diät | 3 Pfund Pellets jeden Tag. Timotheusheu im mitgelieferten Futterbeutel, bis zu zweimal täglich gefüllt |
| Lichtzyklus | Lichtzyklus 12/12 Stunden Hell/Dunkel-Perioden; Licht an um 6:00 Uhr, aus um 18:00 Uhr, sofern nicht anders angegeben |
| Zustand des Gehäuses | Schafe werden einzeln oder paarweise untergebracht. Gehäusegehäuse messen 6,3 W X 5,7 (35,4 Quadratfuß), sofern vom Facility Manager nicht anders angegeben. Mehrere Gehäuse können bei Bedarf für zusätzliche Stellfläche angeschlossen werden. Gummimatten werden allen Schafen nach Erhalt durch den Tierpflegetechniker zur Verfügung gestellt. Matten werden wöchentlich desinfiziert. |
Ergänzende Tabelle 1: Relevante Informationen zum Thema Tiere für diese Plattform.
| Fälle/Ereignisse | N (%) |
| Gesamt | 28 (100) |
| Keine Komplikationen | 22 (78) |
| Infektion, vorzeitiger Abbruch | 1 (4) |
| Kompromiss des implantierten Ports | 2 (7) |
| Kompromiss der implantierten Lungenarterienmanschette | 2 (7) |
| RV-Dekompensation am Ende des Modells | 1 (4) |
Ergänzende Tabelle 2: Komplikationen während des Modells der pulmonalen Hypertonie bei Schafen.
Diskussion
Das vorgestellte PH-RVF-Modell kann zuverlässig unterschiedliche Schweregrade der Erkrankung induzieren, um den Zielen der Untersuchung zu entsprechen. Zwei verschiedene Ansätze werden in Kombination verwendet, um dieses Krankheitsmodell zu induzieren. Erstens dient die LPA-Ligation dazu, den pulmonalen Gefäßwiderstand zu erhöhen und die PA-Kapazität zu verringern11,12, wodurch der Ausgangspunkt des chronischen Modells in einem bereits erhöhten RV-Afterload-Zustand festgelegt wird. Dann dient die Implantation der PA-Manschette und ihre fortschreitende Inflation dazu, einen gezielten Phänotyp von PH-RVF zu entwickeln. Die Kontrolle des PA-Manschettendrucks und seiner Änderungsrate kann differenziert zu kompensierenden oder dekompensierenden Wohnmobilen führen, was entweder durch die Aufrechterhaltung oder den Rückgang von SvO2 nachgewiesen wird (Abbildung 4). Durch die Erhöhung des Manschettendrucks um 250-300 mmHg pro Woche zeigen die Schafe nach etwa 5-6 Wochen frühe Anzeichen einer Dekompensation. Die Erhöhung des Manschettendrucks um 100-150 mmHg pro Woche ermöglicht dagegen ein anpassungsfähigeres Profil über die gesamte Dauer von 9 Wochen.
In der Literatur existieren nur wenige große Tiermodelle für chronische PH und RVF. Die Lungenarterienembolisation bei Schafen wurde am ausführlichsten berichtet und diskutiert4,5. Dieser Ansatz hat jedoch eine hohe Sterblichkeitsrate von mehr als 86%4, abhängig von der Dosierungshäufigkeit und den Perlengrößen, führt jedoch nur zu einer marginalen Änderung der RV-Hämodynamik und -funktion. Auf der anderen Seite kann das vorgestellte Modell eine viel größere Bandbreite an RV-Drucküberlastung mit minimalen verfahrensbedingten Todesfällen induzieren. Ein Tier, das aufgrund dieses PH-RVF-Modells starb, entwickelte mehrere Liter Pleuraerguss und Aszites10, was mit den klinischen und Forschungsergebnissen der Rechtsherzinsuffizienz bei Menschen13,14,15 und großen Tieren16 übereinstimmt. Diese Anzeichen wurden ohne Anzeichen einer Linksherzinsuffizienz beobachtet. Dieses Modell kann daher als klinisch übersetzbare Großtierplattform mit der Fähigkeit dienen, titrierbare Pathophysiologie zu produzieren.
Es gibt mehrere bemerkenswerte Herausforderungen bei der Ausführung dieses Modells. Erstens, während die Verwendung einer linken Mini-Thorakotomie eine zweckmäßige postoperative Genesung erleichtert, ist die gleichzeitige chirurgische Exposition sowohl der Haupt-PA als auch der LPA durch diesen minimal-invasiven Schnitt technisch anspruchsvoll. Die Auswahl des optimalen Interkostalraums ist unerlässlich und die Sonographie kann ein hilfreicher Leitfaden sein. Die PA-Bifurkation ist im Vergleich zur menschlichen Anatomie distaler und posteriorer, was die Ligatur der LPA zum schwierigsten Schritt dieses Verfahrens macht. Während die Ligatur als kritischer Schritt dient, um den pulmonalen Gefäßwiderstand zu erhöhen und die PA-Kapazität zu verringern, ist es möglich, dass das Haupt-PA-Banding allein einen ausreichend hohen RV-Druck erreichen kann.
Infektionen von Verweilhäfen und Wunddehiszenz an der Hafenstelle können schwierig zu behandeln sein und zu verheerenden Komplikationen führen. In diesem Modell der pulmonalen Hypertonie könnten Infektionen die akute metabolische Beleidigung sein, die kardiopulmonale Kompromittierung, Kollaps und frühe Mortalität auslöst. Hohe Standards für sterile Technik, sorgfältigen Hautverschluss und Hafenstandortschutz begrenzen die Häufigkeit und die Auswirkungen dieser Vorkommnisse erheblich.
Der Manschettenbruch ist ein spezifisches Problem mit dem Modell, das zu einem verringerten RV-Druck führen könnte. Obwohl ungewöhnlich, wurde dieses Problem bereits früher beobachtet. Es gibt ein paar vorbeugende und abhilfende Schritte für dieses Problem. Erstens sollte darauf geachtet werden, dass die Manschette nicht durchstochen wird, während sie mit Naht um die PA herum gesichert wird. Das Testen der Manschette vor dem Schließen der Brust gewährleistet ihre Integrität am Ende der ersten Operation. Als nächstes sollte die PA-Manschettengröße basierend auf der Hauptgröße des PA-Durchmessers ausgewählt werden. Wenn die Manschette undicht ist, ist es wichtig, das Ausmaß der Leckage zu beurteilen. Wenn eine häufigere Inflation des PA-Bandes die Leckagerate überwinden kann, kann das Modell immer noch eine moderate PH-RVF erreichen, obwohl es möglicherweise nicht mehr den gewünschten Schweregrad von PH-RVF induziert.
Nach unserer Erfahrung hat dieses Modell eine Gesamterfolgsrate von 78% (Ergänzende Tabelle 2), aber die meisten Komplikationen waren in der ersten Hälfte dieser Studien. Die neuere Kohorte von 13 Probanden hatte eine Erfolgsquote von 100%, was darauf hindeutet, dass dieses Modell mit genügend Erfahrung reproduzierbar und komplikationsfrei sein kann.
Schließlich besteht eine wichtige wissenschaftliche Einschränkung des vorgestellten Tiermodells darin, dass es ein Schlüsselmerkmal der pulmonalen arteriellen Hypertonie, nämlich den pulmonalen vaskulären Umbau, nicht vermittelt. Daher ist dieses Modell nicht die ideale Plattform, um Therapeutika zu entwickeln und zu testen, die sich ausschließlich auf das Lungengefäßsystem konzentrieren. Stattdessen ist es eine effektive Plattform, um RV-Dysfunktion und Versagen durch abnormale RV-Nachlast zu untersuchen. Die Patientenergebnisse bei PH werden weitgehend von der RV-Funktion bestimmt, und günstige Ergebnisse sind mit der Erhaltung dieser RV-Funktion verbunden17. Obwohl dieses Modell nicht alle Aspekte der PH erfasst, ist es ein wertvolles Modell für das Verständnis der molekularen Signalwege, die zu RVF führen, und für die Entwicklung von RV-zielgerichteten Therapeutika zur Verbesserung von RVF.
Das LPA-Ligations- und Haupt-INKREMENTELLE PA-Banding-Modell kann die komplexe Pathophysiologie von RVF sekundär zu PH erfolgreich rekapitulieren. Dieses Modell wird den Forschern eine experimentelle Plattform bieten, um neue diagnostische Biomarker zu entwickeln, die zwischen adaptiven und maladaptiven Reaktionen auf PH auf dem RV unterscheiden, kritische Reaktionswege in RVF aufklären und therapeutische Innovationen zur Behandlung von RVF ermöglichen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health R01HL140231 finanziert. Wir danken der Division of Animal Care für ihre Tierhaltung und tierärztliche Versorgung. Wir danken dem SR Light Laboratory und seinen Mitarbeitern, Jamie Adcock, Susan Fultz, Codi VanRooyen und José Diaz, für ihre engagierte technische Unterstützung bei großen Tieroperationen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Irrigation Pour Bottle by Baxter Healthcare, 1000 mL | Medline | BHL2F7124 | Surgical Disposable |
| 0.25% Bupivacaine | Hospira Inc | 0409-1160-18 | Medication, Intra-Operative |
| 0.9% Normal Saline, 1000 mL | Baxter Healthcare Corp | 0338-0049-04 | Medication, Intra-Operative |
| 0.9% Normal Saline, 500 mL | Baxter Healthcare Corp., | 0338-0049-03 | Medication, Chronic PH |
| 16 mm Heavy Duty Occluder with actuating tubing | Access Technologies | OC-16HD | Surgical Disposable |
| 3-mL Skin Prep Applicator | Medline | MDF260400 | Surgical Disposable |
| 70% isopropyl alcohol prep pads | Medline | MDS090670 | Disposable, Chronic PH |
| Adhesive bandage tape | Patterson Veterinary | 07-835-7776 | Disposable, Chronic PH |
| Adson forceps | V. Mueller | NL1400 | Surgical Instrument |
| Allis tissue forceps | V. Mueller | CH1560 | Surgical Instrument |
| Aortic clamp, straight (bainbridge forceps) | V. Mueller | SU6001 | Surgical Instrument |
| Backhaus towel forceps | V. Mueller | SU2900 | Surgical Instrument |
| Bags, Infusion: Nonsterile Novaplus Infusion Bag, 500 mL | Medline | TCV4005H | Disposable, Chronic PH |
| Berry sternal needle holder | V. Mueller | CH2540 | Surgical Instrument |
| Blades, Electrode: Electrode Blade, 6.5", with 0.24 cm Shaft | Medline | VALE15516 | Surgical Disposable |
| Blades: Stainless-Steel Sterile Surgical Blade, Size #10 | Medline | B-D371210 | Surgical Disposable |
| Blades: Stainless-Steel Sterile Surgical Blade, Size #11 | Medline | B-D371211 | Surgical Disposable |
| Blades: Stainless-Steel Sterile Surgical Blade, Size #15 | Medline | B-D371215 | Surgical Disposable |
| BNC Male to BNC Male Cable | Digi-Key | 415-0198-036 | Equipment |
| Castroviejo needle holder | V. Mueller | CH8589 | Surgical Instrument |
| Cefazolin | Apotex Corp | 60505-6142-0 | Medication, Intra-Operative |
| Ceftiofur Crystalline Free Acid | Zoetis Inc | 54771-5223-1 | Medication, Post-Operative |
| Chest Drain, with Dry Suction, Adult-Pediatric | Medline | DEKA6000LFH | Surgical Disposable |
| Chest tube passer | V. Mueller | CH04189 | Surgical Instrument |
| COnfidence Flowprobes for Research (PAU-Series) | Transonic | 24PAU | Equipment, Perivascular Flow Probe |
| Cooley tangential occlusion clamp | V. Mueller | CH6572 | Surgical Instrument |
| Data Acquisition Hardware | ADInstruments | PowerLab 16/30 | Equipment |
| DeBakey Aorta clamp | V. Mueller | CH7247 | Surgical Instrument |
| DeBakey multi-purpose clamp | V. Mueller | CH7276 | Surgical Instrument |
| Debakey tissue forceps, 12’’ | V. Mueller | CH5906 | Surgical Instrument |
| Debakey vascular tissue forceps 7 3/4’’ | V. Mueller | CH5902 | Surgical Instrument |
| Debakey vascular tissue forceps, 9’’ | V. Mueller | CH5904 | Surgical Instrument |
| Electrosurgical Generator | Covidien | Force FX-C | Equipment |
| Endotracheal Tube, 10mm | Patterson Veterinary | 07-882-9008 | Surgical Disposable |
| Enrofloxacin | Norbrook Laboratories Limited | 55529-152-05 | Medication, Intra-Operative |
| Fentanyl Transdermal Patch | Apotex Corp | 60505-7007-2 | Medication, Pre-Operative |
| Ferris smith tissue forceps | V. Mueller | SU2510 | Surgical Instrument |
| Finochietto rib spreaders, large | V. Mueller | CH1220-1 | Surgical Instrument |
| Finochietto rib spreaders, medium | V. Mueller | CH1215-1 | Surgical Instrument |
| Flexsteel ribbon retractor, 1” x 13” | V. Mueller | SU3340 | Surgical Instrument |
| Flexsteel ribbon retractor, 2” x 13” | V. Mueller | SU3346 | Surgical Instrument |
| Foerster sponge forceps, curved | V. Mueller | GL660 | Surgical Instrument |
| Gauze Sponges: Sterile X-ray Compatible Gauze Sponges, 16-Ply, 4" x 4" | Medline | PRM21430LFH | Surgical Disposable |
| Gerald-DeBakey forceps | V. Mueller | CH04242 | Surgical Instrument |
| Glassman Allis | V. Mueller | SU6152 | Surgical Instrument |
| Halsted mosquito forceps | V. Mueller | SU2702 | Surgical Instrument |
| Harken clamp | V. Mueller | CH6462 | Surgical Instrument |
| Heat Therapy Pump | Gaymar/Stryker | TP-400 | Equipment |
| Heparin | Fresenius Kabi, | 63323-540-31 | Medication, Chronic PH |
| Hospira Primary IV Sets, 80" | Patterson Veterinary | 07-835-0123 | Surgical Disposable |
| Hypertonic saline 3% | Baxter Healthcare Corp., | 0338-0054-03 | Medication, Chronic PH |
| Hypodermic Needle with Bevel and Regular Wall, 20 G x 1" | Medline | B-D305175Z | Disposable, Chronic PH |
| Interface Cable, Edwards LifeScience Transducer to ADInstruments Bridge Amplifier | Fogg System | 0395-2434 | Equipment |
| Intravenous Infusion Pump | Heska | Vet/IV 2.2 Infusion Pump | Equipment |
| Isoflurane | Patterson Veterinary | 14043-704-06 | Medication, Pre-Operative |
| Kantrowitz thoracic clamp, 9-1/2” | V. Mueller | CH1722 | Surgical Instrument |
| Kelly hemostats | V. Mueller | 88-0314 | Surgical Instrument |
| Lidocaine HCl, 2.46% | PRN Pharmacal, | 49427-434-04 | Medication, Chronic PH |
| Ligaclip Multiple-Clip Appliers by Ethicon | Medline | ETHMCS20 | Surgical Disposable |
| Loop, Vessel, Mini, Red, 2/pk, Sterile | Medline | DYNJVL12 | Surgical Disposable |
| Lorna non-perforating towel forceps | V. Mueller | SU2937 | Surgical Instrument |
| Mayo dissecting scissors, curved | V. Mueller | SU1826 | Surgical Instrument |
| Mayo dissecting scissors, straight | V. Mueller | SU1821 | Surgical Instrument |
| Medipore Dress-It Pre-Cut Dressing Covers by 3M | Medline | MMM2955Z | Surgical Disposable |
| Meloxicam | Patterson Veterinary | 14043-909-10 | Medication, Post-Operative |
| Mixter thoracic forceps, 9” | V. Mueller | CH1730-003 | Surgical Instrument |
| Mosquito hemostats | V. Mueller | 88-0301 | Surgical Instrument |
| Multi-Channel Research Consoles | Transonic | T402/T403 | Equipment, Perivascular Flow Meter |
| Multi-Lumen Central Venous Catheterization Kits | Medline | ARW45703XP1AH | Surgical Disposable |
| Multi-Parameter Vital Signs Monitor | Smiths Medical | SurgiVet Advisor 3 | Equipment |
| Needles: Hypodermic Needle with Regular Bevel, Sterile, 18 G x 1.5" | Medline | B-D305185Z | Surgical Disposable |
| No. 3 knife handle | V. Mueller | SU1403-001 | Surgical Instrument |
| No. 7 knife handle | V. Mueller | SU1407 | Surgical Instrument |
| Non-Vented Male Luer Cap | Qosina | 13614 | Disposable, Chronic PH |
| Octal Bridge Amplifier | ADInstruments | FE228 | Equipment |
| Ophthalmic Ointment | Akorn Animal Health | 59399-162-35 | Medication, Pre-Operative |
| Penrose Tubing, 6 mm x 46 cm, 11 mm Flat | Medline | SWD514604H | Surgical Disposable |
| Perma-Hand Black Braided Silk: 2-0 SH Taperpoint Needle, Control Release, 30" | Medline | ETHD8552 | Surgical Disposable |
| Perma-Hand Suture, Black Braided, Size 0, 6 x 30” | Medline | ETHA306H | Surgical Disposable |
| Perma-Hand Suture, Black Braided, Size 4-0, 12 x 30" | Medline | ETHA303H | Surgical Disposable |
| Phenylephrine | West-Ward | 0641-6142-25 | Medication, Intra-Operative |
| Polyhesive Cordless Patient Return Electrodes, Adult | Medline | SWDE7509 | Surgical Disposable |
| Port-A-Cath Huber Needle, Straight, 22 G x 1-1/2" | Medline | AAKM21200724 | Disposable, Chronic PH |
| PROLENE Monofilament Suture, Blue, Size 4-0, 36", Double Arm, RB-1 Needle | Medline | ETHD7143 | Surgical Disposable |
| PROLENE Polypropylene Monofilament Suture, Blue, Double-Armed, RB-1 Needle, Size 5-0, 24" | Medline | ETH8555H | Surgical Disposable |
| Regional Block Needles, 22-gauge | Medline | B-D408348Z | Surgical Disposable |
| Schnidt tonsil artery forceps | V. Mueller | M01700 | Surgical Instrument |
| Skin staple extractor | Medline | CND3031 | Disposable, Chronic PH |
| Skin stapler 35 wide, with counter | Medline | STAPLER35W | Surgical Disposable |
| Sphygmomanometer | Patterson Veterinary | 07-815-0464 | Equipment |
| Sponge bowl | V. Mueller | GE-75 | Surgical Instrument |
| Sponge, Lap: X-Ray Detectable Sterile Lap Sponge, 18" x 18", 5/Pack | Medline | MDS241518HH | Surgical Disposable |
| Sponge, Peanut: X-Ray Detectable Sterile Peanut Sponge, Small, 3/8" | Medline | MDS72038 | Surgical Disposable |
| Sterile Disposable Deluxe OR Towel, Blue, 17'' x 27'', 2/Pack | Medline | MDT2168202 | Surgical Disposable |
| Sterile Luer-Lock Syringe, 3 mL | Medline | SYR103010Z | Disposable, Chronic PH |
| Sterile Luer-Lock Syringe, 5 mL | Medline | SYR105010Z | Disposable, Chronic PH |
| Sterile Surgical Equipment Probe Covers | Medline | DYNJE5930 | Surgical Disposable |
| Stopcock: 3-Way Stopcock with Handle in OFF Position, Rotating Adaptor Male Collar Fitting, 45 PSI | Medline | DYNJSC301 | Surgical Disposable |
| Stopcock: 3-Way Stopcock with Handle in OFF Position, Rotating Adaptor Male Collar Fitting, 45 PSI | Medline | DYNJSC301 | Disposable, Chronic PH |
| Subcutaneous Port with 5-French Connector and Blue Boot | Access Technologies | CP2AC-5NC | Surgical Disposable |
| Super cut metzenbaum dissecting scissors | V. Mueller | CH2032-S | Surgical Instrument |
| Super cut nelson-metzenbaum dissecting scissors | V. Mueller | CH2025-S | Surgical Instrument |
| Syringes: Sterile Luer-Lock Syringe, 10 mL | Medline | SYR110010Z | Surgical Disposable |
| Thoracic Catheter, Straight, 28 Fr x 20" | Medline | SWD570549H | Surgical Disposable |
| Three-quarter surgical drape | Medline | DYNJP2414H | Surgical Disposable |
| Tiletamine + Zolazepam | Zoetis Inc | 54771-9050-1 | Medication, Pre-Operative |
| TourniKwik Tourniquet Set with Four 7.5" Bronze-Colored Tubes and 1 Snare, 12 French | Medline | CVR79013 | Surgical Disposable |
| Transducer clip | Edwards LifeScience | TCLIP05 | Equipment |
| Trigger Aneroid Gauge (Sphygmomanometer) | Patterson Veterinary | 07-815-0464 | Equipment |
| TruWave Disposable Pressure Transducer Kits by Edwards Lifesciences | Medline | VSYPX260 | Surgical Disposable and Chronic PH |
| TS420 Perivascular Flow Module | Transonic | TS420 | Equipment, Perivascular Flow Meter |
| Tubing, Suction: Sterile Universal Suction Tubing with Straight Ribbed Connectors, 1/4" x 12' | Medline | OR612 | Surgical Disposable |
| Tubing: Pressure Monitoring Tubing with Fixed Male Luer Lock and Female Fitting, Low Pressure, 72" L | Medline | DYNJPMTBG72MF | Surgical Disposable |
| Tubing: Pressure Monitoring Tubing with Fixed Male Luer Lock and Female Fitting, Low Pressure, 72" L | Medline | DYNJPMTBG72MF | Disposable, Chronic PH |
| Tubular Elastic Dressing Retainer | Medline | DERGL711 | Disposable, Chronic PH |
| Tuffier rib retractor | V. Mueller | CD1101 | Surgical Instrument |
| Tygon E-3603 Flexible Tubings | Fisher Scientific | 14-171-227 | Surgical Disposable |
| U.S.A retractor | V. Mueller | SU3660 | Surgical Instrument |
| Umbilical Tape, Cotton, 3-Strand, 1/8 x 36" | Medline | ETHU12TH | Surgical Disposable |
| Valleylab Button Switch Pencil | Medline | VALE2516H | Surgical Disposable |
| Vanderbilt deep vessel forceps | V. Mueller | CH1687 | Surgical Instrument |
| Veterinary Anesthesia Machine | Midmark | Matrx VMC | Equipment |
| Veterinary Anesthesia Ventilator | Hallowell EMC | Model 2000 | Equipment |
| Vicryl: Undyed Coated Vicryl 0 CT-1 36" Suture | Medline | ETHVCP946H | Surgical Disposable |
| Vicryl: Undyed Coated Vicryl 2 TP-1 Taper 54" Suture | Medline | ETHVCP880T | Surgical Disposable |
| Vicryl: Undyed Coated Vicryl 2-0 CT-1 18" Suture | Medline | ETHVCP739D | Surgical Disposable |
| Vital crile-wood needle holder, 10-3/8” | V. Mueller | CH2427 | Surgical Instrument |
| Vital mayo-hegar needle holder, 7-1/4” | V. Mueller | CH2417 | Surgical Instrument |
| Vital metzenbaum dissecting scissors, 14’’ | V. Mueller | CH2009 | Surgical Instrument |
| Vital metzenbaum dissecting scissors, 9” | V. Mueller | CH2006 | Surgical Instrument |
| Vital ryder needle holder, 9” | V. Mueller | CH2510 | Surgical Instrument |
| Yankauer, Bulb Tip: Sterile Rigid Yankauer with Bulb Tip, No Vent | Medline | DYND50130 | Surgical Disposable |
Referenzen
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. European Respiratory Journal. 38 (2), 359-367 (2011).
- Tonelli, A. R., et al. Causes and circumstances of death in pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 188 (3), 365-369 (2013).
- Urashima, T., et al. Molecular and physiological characterization of RV remodeling in a murine model of pulmonary stenosis. American Journal of Physiology- Heart and Circulatory Physiology. 295 (3), (2008).
- Sato, H., et al. Large animal model of chronic pulmonary hypertension. ASAIO Journal. 54 (4), 396-400 (2008).
- Pohlmann, J. R., et al. A low mortality model of chronic pulmonary hypertension in sheep. Journal of Surgical Research. 175 (1), 44-48 (2012).
- Noly, P. -E., Guihaire, J., Coblence, M., Dorfmuller, P., Fadel, E., Mercier, O. Chronic thromboembolic pulmonary hypertension and assessment of right ventricular function in the piglet. Journal of Visualized Experiments: JoVE. (105), e53133(2015).
- Pereda, D., et al. Swine model of chronic postcapillary pulmonary hypertension with right ventricular remodeling: Long-term characterization by cardiac catheterization, magnetic resonance, and pathology. Journal of Cardiovascular Translational Research. 7 (5), 494-506 (2014).
- Silva, K. A. S., Emter, C. A. Large animal models of heart failure: A translational bridge to clinical success. JACC: Basic to Translational Science. 5 (8), 840-856 (2020).
- Ukita, R., et al. Left pulmonary artery ligation and chronic pulmonary artery banding model for inducing right ventricular - pulmonary hypertension in sheep. ASAIO Journal (American Society for Artificial Internal Organs: 1992. 67 (1), 44-48 (2020).
- Ukita, R., et al. Progression toward decompensated right ventricular failure in the ovine pulmonary hypertension model. ASAIO Journal (American Society for Artificial Internal Organs: 1992. , (2021).
- Mercier, O., et al. Piglet model of chronic pulmonary hypertension. Pulmonary Circulation. 3 (4), 908-915 (2013).
- Guihaire, J., et al. Right ventricular plasticity in a porcine model of chronic pressure overload. Journal of Heart and Lung Transplantation. 33 (2), 194-202 (2014).
- Tang, K. J., Robbins, I. M., Light, R. W. Incidence of pleural effusions in idiopathic and familial pulmonary arterial hypertension patients. Chest. 136 (3), 688-693 (2009).
- Luo, Y. F., et al. Frequency of pleural effusions in patients with pulmonary arterial hypertension associated with connective tissue diseases. Chest. 140 (1), 42-47 (2011).
- Brixey, A. G., Light, R. W. Pleural effusions occurring with right heart failure. Current Opinion in Pulmonary Medicine. 17 (4), 226-231 (2011).
- Holt, T. N. Bovine High-mountain Disease. Merck and the Merck Veterinary Manual. , Available from: https://www.merckvetmanual.com/circulatory-system/bovine-high-mountain-disease/bovine-high-mountain-disease (2019).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. Journal of the American College of Cardiology. 58 (24), 2511-2519 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten