Method Article
Ein einfacher Ansatz zur Durchführung von TEER-Messungen mit einem selbst gefertigten Volt-Amperemeter mit programmierbarer Ausgangsfrequenz
In diesem Artikel
Zusammenfassung
Hier zeigen wir, wie man ein kostengünstiges Volt-Amperemeter mit programmierbarer Ausgangsfrequenz aufstellt, das mit handelsüblichen Essstäbchenelektroden für transepitheliale/endotheliale elektrische Widerstandsmessungen verwendet werden kann.
Zusammenfassung
Transepitheliale/endotheliale elektrische Beständigkeit (TEER) wird seit den 1980er Jahren verwendet, um die Konfluenz und Durchlässigkeit von In-vitro-Barrieremodellsystemen zu bestimmen. In den meisten Fällen werden Essstäbchenelektroden verwendet, um die elektrische Impedanz zwischen dem oberen und unteren Fach eines Zellkulturfiltereinsatzsystems zu bestimmen, das zelluläre Monolayer enthält. Die Filtermembran ermöglicht es den Zellen, durch den Bau enger Knoten zu haften, zu polarisieren und zu interagieren. Diese Technik wurde mit einer Vielzahl von verschiedenen Zelllinien beschrieben (z. B. Zellen der Blut-Hirn-Schranke, Blut-Zerebrospinal-Flüssigkeitsbarriere, oder Magen-Darm-und Lungentrakt). TEER Messgeräte können leicht von verschiedenen Laborgerätelieferanten bezogen werden. Es gibt jedoch kostengünstigere und anpassbare Lösungen, die sich vorstellen können, wenn ein geeignetes Voltammeter selbst montiert wird. Das übergeordnete Ziel dieser Publikation ist die Einrichtung eines zuverlässigen Gerätes mit programmierbarer Ausgangsfrequenz, das mit handelsüblichen Essstäbchenelektroden für die TEER-Messung verwendet werden kann.
Einleitung
Epithel- und Endothelzellen fungieren als zelluläre Grenzen, die die apikalen und basolateralen Seiten des Körpers trennen. Wenn sie durch enge Knoten verbunden sind, wird die passive Substanzdiffusion durch die parazellulären Räume eingeschränkt1, was zur Bildung einer selektiv durchlässigen Barriere führt. Mehrere künstliche Barrieresysteme wurden2 mit mikrovaskulären Endothelzellen (HBMEC, Blut-Hirn-Schranke3,4,5,6,7), Aderhautplexus entwickelt Epithelzellen (HIBCPP/PCPEC, Blut-Zerebrospinalflüssigkeitsbarriere8,9,10,11,12,13,14), kolorektalen Adenokarzinomzellen (Caco-2, Gastrointestinale Modelle15), oder Atemwegs-/Alveolarzelllinien (Lungenmodelle16,17). Diese Systeme bestehen in der Regel aus Zellen, die in einer Monoschicht auf durchlässigen Membranen (d. h. Filtereinsatzsystemen) angebaut werden, um den Zugang zu den apikalen und basolateralen Seiten zu ermöglichen. Es ist wichtig, dass die Integrität des Modellsystems den in vivo-Bedingungen entspricht. Daher wurden verschiedene Techniken entwickelt, um die Barrierefunktion zu analysieren, indem parazelluläre Diffusion von Tracerverbindungen über die Zellschicht gemessen wird. Zu diesen Stoffen gehören radioaktiv markierte Saccharose, farbstoffmarkiertes Albumin, FITC-markiertes Inulin oder mit Farbstoff gekennzeichnetes Dextrans2. Chemische Farbstoffe können jedoch Zellen für weitere Experimente unbrauchbar machen. Zur Nichtinvasiven Überwachung von Barrieresystemen kann die Messung des transepitheliaalen/transendotheliaalen elektrischen Widerstands (TEER) über eine zelluläre Monoschicht2,18,19verwendet werden. Da bipolare Elektrodensysteme durch die Elektrodenpolarisationsimpedanz an der Elektroden-Elektrolyt-Schnittstelle beeinflusst werden, werden tetrapolare Messungen in der Regel verwendet, um diese Einschränkung zu überwinden20. Die Unterlagetechnik ist eine vierterminale Sensorik (4T), die erstmals 1861 von William Thomson (Lord Kelvin)21beschrieben wurde. Kurz gesagt, wird der Strom durch ein Paar stromtragender Elektroden injiziert, während ein zweites Paar spannungsempfindlicher Elektroden verwendet wird, um den Spannungsabfall20zu messen. Heute bestehen sogenannte Essstäbchenelektroden aus einem Paar Doppelelektroden, die jeweils ein Silber/Silberchlorid-Pellet zur Spannungsmessung und eine Silberelektrode zum Passieren des Stroms2enthalten. Die elektrische Impedanz wird zwischen dem apikalen und dem basolateralen Fach mit der Zellschicht dazwischen gemessen (Abbildung 1). An den äußeren Elektroden wird ein Rechtecksignal mit einer Frequenz von typischerweise 12,5 Hz aufgebracht und der resultierende Wechselstrom (AC) gemessen. Zusätzlich wird der potenzielle Tropfen über die Zellschicht durch das zweite (innere) Elektrodenpaar gemessen. Die elektrische Impedanz wird dann nach Ohms Gesetz berechnet. TEER-Werte werden durch Multiplikation der Impedanz und der Zellschichtoberfläche normalisiert und werden in der Regel in der Zeit als cm2ausgedrückt.
Es gibt Systeme, in denen Zellen und Elektroden ausgefeilter angeordnet sind, aber auch auf dem 4T-Messprinzip basieren und mit den gleichen Messgeräten eingesetzt werden können. EndOhm-Systeme, bei denen der Filter eingesetzt wird, enthalten beispielsweise eine Kammer und eine Kappe mit einem Paar konzentrischer Elektroden mit der gleichen Struktur wie die Esssstiftelektrode. Die Form der Elektroden ermöglicht einen gleichmäßigeren Stromdichtefluss über die Membran, wodurch die Streuung zwischen den Messwerten reduziert wird. Noch komplexer (aber auch genauer) ist eine Ussing-Kammer, in der eine Zellschicht zwei Kammern trennt, die mit Ringers Lösung22gefüllt sind. Die Kammer selbst kann mit Sauerstoff,CO2oderN2vergast und gerührt oder mit Experimentellen Stoffen ergänzt werden. Wenn der Ionentransport über die Zellschicht erfolgt, kann ein potenzieller Unterschied durch zwei spannungsempfindliche Elektroden in der Nähe des Gewebes gemessen werden. Diese Spannung wird durch zwei stromführende Elektroden, die neben der Zellschicht platziert werden, aufgehoben. Der gemessene Strom gibt dann den Netzionentransport und der transepitheliale Widerstand, der die Barriereintegrität widerspiegelt, kann bestimmt werden22. TEER-Messungen können auch auf Body-on-a-Chip-Systeme angewendet werden, die Barrieregewebemodelle23,24darstellen. Diese Systeme imitieren in vivo Bedingungen der Zellen und bestehen oft aus mehreren Arten von Zellen, übereinander in Schichten gestapelt.
Im folgenden Protokoll wird erläutert, wie ein kostengünstiges und zuverlässiges Voltammeter mit programmierbarer Ausgangsfrequenz eingerichtet wird, das keine statistisch signifikanten Unterschiede in TEER im Vergleich zu handelsüblichen Messsystemen erzeugt.
Protokoll
1. Montage eines Grundvolt-Amperemeters zur TEER-Messung
- Bereiten Sie ein Standard-USB-Ladegerät als 5 V D.C. Netzteil, ein USB-Verlängerungskabel, ein Mikrocontroller, der als programmierbarer Rechteckgenerator verwendet werden, zwei Standard-Multimeter, die in der Lage sind, Wechselstrom und Spannung als Wurzel mittelförmiges Quadrat zu messen ( True-RMS), vier Kabel mit Bananensteckern, ein Telefonverlängerungskabel mit rJ14-Buchse mit sechs Pins mit den inneren vier verdrahteten (6P4C), zwei kurzen Kabeln, einer Glanzklemme, einem 120 k' Vorwiderstand, Drahtend-Ferrules und Lötschleim. Die erforderlichen Werkzeuge sind ein Isolationsabsabisz, ein Crimpwerkzeug und ein Lötkolben.
- Schließen Sie zunächst die USB-Erweiterung an die Mikrocontrollerplatine an.
- Entfernen Sie die Endisolierung von zwei kurzen Kabeln. Eine Seite pro Kabel entweder direkt an die Pins 0 und 2 des Mikrocontrollers oder an Lötschuhe löten, die wiederum an den jeweiligen Stiften abgeschnitten werden. Crimpen Sie die anderen Enden an das Drahtende ferrules und verbinden Sie sie mit einem Glanzterminal, wie in Abbildung 1dargestellt.
- Verknüpfen Sie die Bananenstecker mit den Multimetern. Entfernen und knirpern Sie das andere Ende jedes der vier Kabel.
- Schneiden Sie das Telefonverlängerungskabel in zwei Teile und zerlegen und knirschen Sie die Leiter der Seite, die den Buchsenstecker enthält. Überprüfen Sie die Kontinuität der Leiter und Stifte.
- Das erste Multimeter wird verwendet, um den Strom in A zu messen (beachten Sie, dass der AC-Modus explizit eingestellt werden muss). Verbinden Sie es in einer Serie mit einem 120 k' Vorwiderstand an die Pins fünf und sechs des RJ14-Steckers, entsprechend dem äußeren Elektrodenpaar der Esssstiftelektrode.
- Schließlich verbinden Sie das zweite Multimeter, mit dem der transepitheliale Spannungsabfall in mV gemessen wird, über die Glanzklemme mit den Pins drei und vier des RJ14-Steckers, entsprechend dem inneren Elektrodenpaar der Essstäbchenelektrode.
- Montieren Sie die Installation auf Wunsch in einem Gehäuse.
2. Programmierung des Mikrocontrollers
- Ändern Sie den bereitgestellten Quellcode (zusätzliche Codierungsdatei 1) nach Bedarf. In der gegebenen Form wechseln die Pins 0 und 2 zwischen Masse und +5 V mit 40 ms Halbzeit der Schwingung. So wird ein Rechtecksignal mit einer Amplitude von 5 V und einer Frequenz von ca. 12,5 Hz erzeugt. Die realen Werte können aufgrund der Ungenauigkeit des Zeitemitters des Mikrocontrollers abweichen.
- Schließen Sie den Mikrocontroller über einen USB-Anschluss an einen Desktop-Computer an und laden Sie den Quellcode mit der passenden Software25hoch.
3. Aufzeichnung von Spannungs-Oszillogrammen (optional)
- Bypass-Pins fünf und sechs des RJ14-Steckers mit einem 1 k" Testwiderstand und Anschluss an ein Oszilloskop.
- Überprüfen Sie die Frequenz, die Spitzenspannung und die Wellenform. Digitalisieren und exportieren Sie die Daten.
- Zeichnen Sie auf Wunsch Oszillogramme von einem Referenzgerät (EVOM) und dem selbstmontierten Voltammeter zum Vergleich auf.
HINWEIS: In diesem Fall wurden die Daten mit einem Digital Storage Scope HM 208 aufgezeichnet. Als sehr einfaches digitales Oszilloskop konnte das Bild intern digitalisiert (eingefroren) werden, musste aber mit einem analogen PM 8143 X-Y-Recorder geplottet werden. Das Bild wurde anschließend gescannt.
4. Zellkultivierung und TEER-Messung
- Samen Human Choroid Plexus Papilloma (HIBCPP) Zellen auf ZellkulturfilterEinsätze mit einer Porengröße von 3 m in DMEM/F12 (siehe Materialtabelle) mit 10% fetalem Kalbsserum9. Wachsen Sie die Zellen bei 37 °C in einer wassergesättigten Atmosphäre, die 5%CO2 enthält, wie von Dinner et al.9beschrieben.
- Wenn die Filter eine Impedanz von 70 x cm2erreichen, wechseln Sie zu serumfreiem DMEM/F12 und definieren Sie den Zeitpunkt als Tag 0.
- Schließen Sie die Elektrode an den RJ14-Anschluss des selbstmontierten Voltammeters an und schließen Sie das USB-Netzteil an. Stellen Sie die Multimeter auf AC-Spannungsmodus (mV) bzw. AC-Strommodus (A) ein.
- Alternativ können Sie die Elektrode an ein handelsübliches Referenzgerät anschließen und gemäß den Anweisungen des Herstellers einschalten.
- Sterilisieren Sie die Elektrode in 80% Ethanol für 10 min und gleichimisieren in dem entsprechenden Medium für weitere 10 min.
- Legen Sie die Elektrode in beide Fächer eines Zellkulturfiltereinsatzsystems (der längere Teil der Elektrode im unteren Fach und der kürzere Teil im oberen Fach), der eine HIBCPP-Zellschicht enthält, bis die Messwerte konstant bleiben.
- Beachten Sie bei einem Referenzgerät die Impedanz direkt oder berechnen Sie die Impedanz nach Ohms Gesetz (R = U/I) für das selbstmontierte Voltammeter. Beachten Sie, dass der Elektrodenwinkel die Messungen beeinflusst.
- Wiederholen Sie die TEER-Messung (Schritte 3 bis 6) von Tag 0 bis Tag 4.
Ergebnisse
Um den Betrieb eines selbstmontierten Voltammeters mit seinem handelsüblichen Pendant zu vergleichen, wurde ein Spannungs-Oszillatometer beider Geräte aufgezeichnet.
Wie in Abbildung 2Adargestellt, erzeugte das Referenzinstrument ein Rechtecksignal mit einer Amplitude von 80 mV und einer Schwingungszeit von 80 ms, was einer Frequenz von 12,5 Hz entspricht, wenn es mit einem 1 k-Testwiderstand lastig arbeitet.
Im Gegensatz dazu schaltete der Mikrocontroller des selbstmontierten Gerätes die Versorgungsspannung auf ein Rechtecksignal mit einer Amplitude von 5 V(Abbildung 2B) um, wenn kein Vorwiderstand eingestellt war. Es zeigte sich, dass der resultierende Strom jede Barrierefunktion zerstört und nicht für Zellkulturexperimente anwendbar ist (Daten nicht dargestellt). Ein weiteres Problem ist, dass in diesem Setup ein 1 k' Testwiderstand eine Überlastung mit einem daraus resultierenden Spannungsabfall verursachte (Abbildung 2B). Zusätzlich betrug die effektive Schwingungszeit des Mikrocontrollers 60 ms (Frequenz = 16,7 Hz) und unterschied sich dadurch aufgrund der Ungenauigkeit des Zeitemitters von der programmierten Verzögerungszeit. Wenn ein 120 k-K-Präwiderstand installiert wurde, verringerte sich die Amplitude auf einen Wert von 40 mV, der für die Zellkultur geeignet war (Abbildung 2C). Wie im Oszillogramm zu sehen, wurde das Signal-Rausch-Verhältnis erheblich beeinträchtigt (Abbildung 2C), aber die Messungen wurden nicht spürbar beeinflusst.
Beide Geräte wurden verwendet, um die Impedanz einer künstlichen Blut-Zerebrospinalflüssigkeitsbarriere zu bestimmen (vereinfachter Schaltplan in Abbildung 2D). HIBCPP-Zellen wurden auf Zellkulturfiltereinsätzen kultiviert und TEER wurde über 6 Tage gemessen: beginnend einen Tag, bevor die Zellen in serumfreie Bedingungen (Tag -1) und bis zu 4 Tage nach dem Wechsel des Mediums (Tag 4) verschoben wurden. Alle Messungen wurden in Vierbeinern mit vier HIBCPP-Filtern durchgeführt, die auf die gleiche Weise vorbereitet wurden. Ähnliche Werte wurden für das Referenzinstrument und das selbstmontierte Voltammeter ermittelt (Abbildung 3). Die Messungen waren reproduzierbar, und die Standardabweichungen lagen im gleichen Bereich. Die TEER-Werte reichten von 20 bis 550 x cm 2. Mit 0,33cm2 Filtern entspricht dies einer absoluten Impedanz von 83 x 1.660 °C.

Abbildung 1: Layoutdiagramm eines Basis-Volt-Amperemeters für teER-Messung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
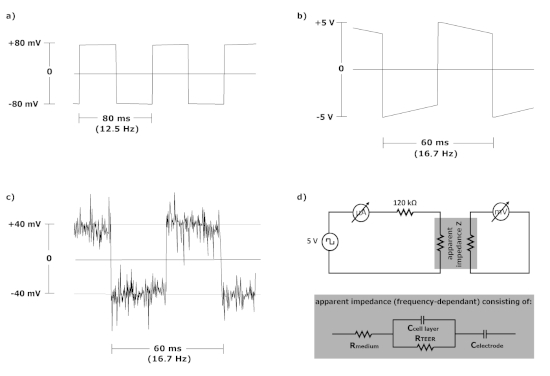
Abbildung 2: Oszillogramme und Messaufbau. (A) Kommerziell erhältliche EVOM. (B) Selbstmontiertes Voltammeter ohne Vorwiderstand. (C) Selbstmontiertes Voltammeter mit 120 k Vorwiderstand. (D) Schaltplan der Messeinrichtung. Beachten Sie, dass DieC-Elektrode nur in den elektrischen Schaltkreisen auftritt, wenn bipolare Systeme verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: TEER-Messungen von HIBCPP-Zellschichten auf Zellkulturfiltereinsätzen vor dem Wechsel zu einem serumfreien Kulturmedium (Tag -1), am Tag des Umschaltens (Tag 0) und bis zu 4 Tage danach (Tage 1-4). Fehlerbalken zeigen die Standardabweichung der vier HIBCPP-Filter an, die auf die gleiche Weise vorbereitet wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Codierungsdatei 1. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 2. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 3. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Bevor ein selbstgebautes Voltammeter in einer täglichen Routine verwendet werden kann, ist es wichtig, das Gerät auf die ordnungsgemäße Funktion zu überprüfen. In unserem Fall wurde eine Halbzeitschwingung von 40 ms (12,5 Hz) programmiert, aber die effektive Schwingungszeit betrug 60 ms (16,7 Hz). Diese Ungenauigkeit des Zeitemitters des Mikrocontrollers hatte keine nachweisbaren Auswirkungen auf TEER-Messungen. Es könnte am besten sein, die tatsächliche Frequenz mithilfe der Frequenzeinstellung eines der Multimeter zu bestimmen. Wenn eine Abweichung gefunden wird, kann der Quellcode entsprechend angepasst werden. Darüber hinaus wird dringend empfohlen zu prüfen, ob ein Testwiderstand oder andere definierte Setups korrekte und reproduzierbare Ergebnisse liefern. Wenn Sie mit künstlichen zellulären Barrieresystemen arbeiten, ist es vielleicht am besten, den Molekülfluss immer mit der Impedanzmessung zu korrelieren.
In diesem Fall wurde der aufgebrachte Strom mit einem 120 k- Vorwiderstand begrenzt. Unter der Annahme, dass die typischen TEER-Werte zwischen 100 und 2.000 ° liegen, kann der Spannungsabfall über die Zellschicht auf 4 bis 83 mV berechnet werden. Ein TEER von 1 k' wurde durch einen Testwiderstand simuliert und der resultierende potenzielle Tropfen wurde mit 40 mV bestätigt (Abbildung 2C).
Kommerziell erhältliche Geräte bieten oft einen Messbereich-Schalter, um den Vorwiderstand umzuschalten und so den Ausgangsstrom auf unterschiedliche Werte zu begrenzen. In diesem Fall ist es möglich, verschiedene Vorwiderstände zu installieren oder sogar den Widerstand durch ein Potentiometer zu ersetzen.
Das gezeigte Setup stellt eine kostengünstige Alternative zu handelsüblichen Instrumenten für die TEER-Messung dar. Werte, die mit dem selbstmontierten Voltammeter gemessen wurden, waren über einen weiten Bereich mit dem Referenzgerät vergleichbar. Dasselbe gilt für die Standardabweichungen. Das Rauschen im rechteckigen Wellensignal hatte keinen Einfluss auf die Messungen. Das Protokoll kann Wissenschaftler unterstützen, die durch begrenzte finanzielle Mittel eingeschränkt sind oder Vorexperimente zu niedrigen Kosten durchführen wollen.
Darüber hinaus kann der Mikrocontroller einfach auf verschiedene Ausgangsfrequenzen programmiert werden. Dies kann von Vorteil sein, da die scheinbare Impedanz ausR-Medium, RTEER, sowie der KapazitätC-Zellschicht26 besteht (Abbildung 2D). Zusätzlich trittC-Elektrode auf, wenn bipolare Systeme verwendet werden, während der Einfluss der Elektrodenpolarisationsimpedanz in tetrapolaren Systemen reduziert wird. Dies bedeutet, dass die gemessene Impedanz von RTEER bei niedrigen Frequenzen und, in bipolaren Systemen, von der Kapazität der Elektroden dominiert wird, während bei hohen Frequenzen die Gesamtimpedanz auf den Widerstand des Mediums26konvergiert. 27. Dazwischen wird die Impedanz durch dieC-Zellschichtbeeinflusst, die daher mittels elektrischer Impedanzspektroskopie28zugänglich ist.
Wir stellen zwei (ungetestete) Beispielcodes bereit, um eine Vorstellung davon zu geben, wie das Gerät für verschiedene Anwendungen optimiert oder neu programmiert werden könnte. Zunächst konnte eine sehr grundlegende Impedanzspektroskopie realisiert werden, indem die Ausgangsfrequenz in 20-Sekunden-Intervallen zwischen 12,5, 500 und 5000 Hz abwechselnd abwechselt (zusätzliche Codierungsdatei 2). In diesem Fall könnte eine tetrapolare20,28 oder bipolare27 Elektrode verwendet werden. Die angewandte Frequenz kann durch das eingebaute Multimeter (oder ein beliebiges Display oder eine LED, die mit dem Mikrocontroller verbunden ist) angezeigt werden. Zweitens könnte das Gerät verwendet werden, um die Leitfähigkeit von Puffern und Medien zu messen. Dies geschieht in der Regel mit tetrapolaren Elektroden mit hohen Frequenzen in einem Bereich von 1-110kHz. Der Code in der zusätzlichen Codierungsdatei 3 enthält keine Verzögerungszeit und erzeugte (mit unserem Gerät) eine Frequenz von ca. 70kHz.
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte.
Danksagungen
Die Autoren danken Herman Liggesmeyer und Marvin Bende für ihre fachkundige Beratung in Elektrotechnik und Informatik.
Materialien
| Name | Company | Catalog Number | Comments |
| 120 kOhm resistor | General (generic) equipment | ||
| Banana plug cables | General (generic) equipment | ||
| Cables | General (generic) equipment | ||
| Chopstick electrode | Merck Millicell | MERSSTX01 | |
| Chopstick electrode (alternative) | WPI World Precision Instruments | STX2 | |
| Crimping tool | General tool | ||
| Digispark / ATtiny85 | AZ-Delivery Vertriebs GmbH | Digispark Rev.3 Kickstarter | |
| DMEM:F12 | Gibco (Thermo Fisher) | 31330038 | |
| Fetal calf serum (FCS)/Fetal Bovine Serum (FBS) | Life Technologies | 10270106 | |
| Filter inserts 3µm translucent | Greiner Bioone | 662631 | |
| HIBCPP | Hiroshi Ishikawa / Horst Schroten | ||
| Insulation stripper | General tool | ||
| Luster terminal | General (generic) equipment | ||
| Oscilloscope | HAMEG | Digital Storage Scope HM 208 | |
| Plotter | PHILIPS | PM 8143 X-Y recorder | |
| Software Arduino | https://www.arduino.cc | Arduino 1.8.9 | |
| Soldering iron | General tool | ||
| Soldering lugs | General (generic) equipment | ||
| Telephone cable with RJ14 (6P4C) connector | General (generic) equipment | ||
| Test resistor | Merck Millicell | MERSSTX04 | |
| True-RMS multimeters | VOLTCRAFT | VC185 | |
| USB charger | General (generic) equipment | ||
| USB extension cord | General (generic) equipment | ||
| Voltohmmeter for TEER measurement | WPI World Precision Instruments | EVOM | |
| Voltohmmeter for TEER measurement (alternative) | Merck Millicell | ERS | |
| Wire end ferrules | General (generic) equipment |
Referenzen
- Matter, K., Balda, M. S. Functional analysis of tight junctions. Methods. 30, 228-234 (2003).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20, 107-126 (2015).
- Daniels, B. P., et al. Immortalized human cerebral microvascular endothelial cells maintain the properties of primary cells in an in vitro model of immune migration across the blood brain barrier. Journal of Neuroscience Methods. 212, 173-179 (2013).
- Weksler, B. B., et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. Federation of American Societies for Experimental Biology Journal. 19, 1872-1874 (2005).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Scientific Reports. 4, 4160 (2014).
- Stins, M. F., Badger, J., Sik Kim, K. Bacterial invasion and transcytosis in transfected human brain microvascular endothelial cells. Microbial Pathogenesis. 30, 19-28 (2001).
- Muruganandam, A., Herx, L. M., Monette, R., Durkin, J. P., Stanimirovic, D. B. Development of immortalized human cerebromicrovascular endothelial cell line as an in vitro model of the human blood-brain barrier. Federation of American Societies for Experimental Biology Journal. 11, 1187-1197 (1997).
- Ishiwata, I., et al. Establishment and characterization of a human malignant choroids plexus papilloma cell line (HIBCPP). Human Cell. 18, 67-72 (2005).
- Dinner, S., et al. A Choroid Plexus Epithelial Cell-based Model of the Human Blood-Cerebrospinal Fluid Barrier to Study Bacterial Infection from the Basolateral Side. Journal of Visualized Experiments. , (2016).
- Schwerk, C., et al. Polar invasion and translocation of Neisseria meningitidis and Streptococcus suis in a novel human model of the blood-cerebrospinal fluid barrier. PLoS One. 7, e30069 (2012).
- Tenenbaum, T., et al. Polar bacterial invasion and translocation of Streptococcus suis across the blood-cerebrospinal fluid barrier in vitro. Cellular Microbiology. 11, 323-336 (2009).
- Gath, U., Hakvoort, A., Wegener, J., Decker, S., Galla, H. J. Porcine choroid plexus cells in culture: expression of polarized phenotype, maintenance of barrier properties and apical secretion of CSF-components. European Journal of Cell Biology. 74, 68-78 (1997).
- Haselbach, M., Wegener, J., Decker, S., Engelbertz, C., Galla, H. J. Porcine Choroid plexus epithelial cells in culture: regulation of barrier properties and transport processes. Microscopy Research and Technique. 52, 137-152 (2001).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10, 1473-1491 (2013).
- Hilgendorf, C., et al. Caco-2 versus Caco-2/HT29-MTX co-cultured cell lines: permeabilities via diffusion, inside- and outside-directed carrier-mediated transport. Journal of Pharmaceutical Sciences. 89, 63-75 (2000).
- Mathia, N. R., et al. Permeability characteristics of calu-3 human bronchial epithelial cells: in vitro-in vivo correlation to predict lung absorption in rats. Journal of Drug Targeting. 10, 31-40 (2002).
- Fuchs, S., et al. Differentiation of human alveolar epithelial cells in primary culture: morphological characterization and synthesis of caveolin-1 and surfactant protein-C. Cell and Tissue Research. 311, 31-45 (2003).
- Furie, M. B., Cramer, E. B., Naprstek, B. L., Silverstein, S. C. Cultured endothelial cell monolayers that restrict the transendothelial passage of macromolecules and electrical current. The Journal of Cell Biology. 98, 1033-1041 (1984).
- Hidalgo, I. J., Raub, T. J., Borchardt, R. T. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability. Gastroenterology. 96, 736-749 (1989).
- Yeste, J., et al. Geometric correction factor for transepithelial electrical resistance measurements in Transwell and microfluidic cell cultures. Journal of Physics D Applied Physics. 49 (37), 3754 (2016).
- Northrup, E. VI: The Measurement of Low Resistance. Methods of Measuring Electrical Resistance. , 100-131 (1912).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3 (Suppl 2), 123-126 (2004).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15, 145-150 (2013).
- Esch, M. B., et al. On chip porous polymer membranes for integration of gastrointestinal tract epithelium with microfluidic 'body-on-a-chip' devices. Biomedical Microdevices. 14, 895-906 (2012).
- . Arduino Web Editor Available from: https://www.arduino.cc/en/Main/Software (2019)
- Benson, K., Cramer, S., Galla, H. J. Impedance-based cell monitoring: barrier properties and beyond. Fluids and Barriers of the CNS. 10, 5 (2013).
- Hufnagl, M. . Time Resolved Transepithelial Impedance Spectroscopy Of Caco 2 Monolayers Relying on Lithographically Patterned Basolateral Electrode Cell Arrays. , (2010).
- Guimerà, A., Gabriel, G., Parramon, D., Calderón, E., Villa, R., Dössel, O., Schlegel, W. C. Portable 4 Wire Bioimpedance Meter with Bluetooth Link. World Congress on Medical Physics and Biomedical Engineering. International Federation of Medical and Biological Engineering Proceedings. 25/7, (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten