Method Article
Hochdurchsatz-Messung der Darm Transitzeit mit Larven Zebrafisch
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, die Transitzeit von eindringmittel beschrifteten Nahrung durch den Darm Larven Zebrafisch auf hohen Durchsatz Weise messen.
Zusammenfassung
Zebrafisch dienen als alternative Modellorganismen für Drogentests Sicherheit. Gastrointestinaltrakt (GI) von Zebrafisch hat genetische, neuronale und pharmakologische Ähnlichkeiten zu den Säugetieren. GI-Intoleranz während der klinischen Prüfung von Wirkstoffkandidaten ist häufig und kann eine ernsthafte Bedrohung für die menschliche Gesundheit. Für GI-Toxizität bei Säugetieren präklinischen Modellen testen kann in Bezug auf Zeit, Testverbindung und Arbeit teuer sein. Die hier vorgestellte Hochdurchsatz-Methode kann verwendet werden, GI Sicherheitsfragen vorherzusagen. Im Vergleich zu Säugetieren Modelle, ermöglicht diese Methode für zweckmässiger Bewertung der zusammengesetzten GI Transit Test während der Verwendung von geringer Mengen der Substanz. Bei dieser Methode, larval Zebrafisch (7 Tage post Befruchtung) sind Lebensmittel, die eine fluoreszierende Label gefüttert. Nach der Fütterung, ist jeder Larven Fisch in einen Brunnen ein 96-konisch-Boden-Well-Platte gelegt und dosiert mit Testverbindung (in Wasser aufgelöst) oder das Fahrzeug. Wie tritt der Darm Transit, Fäkalien sammelt sich auf der Unterseite der Brunnen und die Rate, mit der dies geschieht, wird durch die Messung der Fluoreszenz von der Unterseite des Brunnens überwacht immer wieder im Laufe der Zeit mit einer Platte Spektralphotometer. Die Fluoreszenz von Larven in einer bestimmten Behandlungsgruppe werden gemittelt und diese Werte werden grafisch dargestellt zusammen mit Standard-Fehler für jede Messzeit nachgeben einer Kurve, durchschnittliche Durchfuhr von Lebensmitteln im Laufe der Zeit darstellt. Auswirkungen auf den Darm Transitzeit sind gekennzeichnet durch den Vergleich der Fläche unter der Kurve für jede Behandlungsgruppe mit derjenigen der Fahrzeug-behandelten Gruppe. Diese Methode Änderungen rechtzeitig erkannt Zebrafisch GI Transit durch Medikamente mit bekannten klinischen GI Effekte induziert; Es kann eingesetzt werden, um Dutzende von Behandlungen für GI Effekte pro Tag zu verhören. Als solche können sicherere Verbindungen schnell zu Testzwecken Säugetier-, priorisiert werden, die Entdeckung und kredenzt 3Rs Fortschritt beschleunigt.
Einleitung
Zebrafisch (Danio Rerio) dienen zum Modellieren vertebrate Biologie und Vorhersagen medikamententoxizität und/oder Wirksamkeit; neue Anwendungen in diesen Bereichen entstehen jedes Jahr. Die Vorteile von Zebrafisch gegenüber Säugetieren Modelle umfassen ihre Fruchtbarkeit, geringe Größe und Transparenz durch Organogenese. Zebrafisch werden zur Droge Kandidat akute Toxizität, sowie Vorhersagen, zusammengesetzte Auswirkungen auf die Organfunktion, z. B. Herz-, okular, Gastro-intestinale (GI)1,2. Zebrafisch Entwicklung und Physiologie sind ähnlich denen von Säugetieren in vielen Weisen3 und 80 % der Gene, die mit menschlichen Krankheit verbunden sind ein Zebrafisch Homolog4.
GI-Trakt Zebrafisch hat ähnliche Physiologie zu den Säugetieren GI-Trakt aber eine einfachere Architektur-5. Zebrafisch haben keinen Magen; die vordere Darm Lampe fungiert als ein Lebensmittel-Depot. Genexpression im Zebrafisch Darm hat viele Ähnlichkeiten mit derjenigen der Säugetier-5. Wie bei Säugetieren das Enterische Nervensystem des Zebrafisch steuert die Darm-Motilität und Darm Innervation Spiegel die von anderen Wirbeltieren6,7. Basierend auf diesen Ähnlichkeiten, sind Funktionsstörungen des menschlichen Darms im Zebrafisch, mit Methoden, die von Säugetieren Modelle8abgeleitet untersucht worden.
GI-Intoleranz während der klinischen Prüfung von Wirkstoffkandidaten ist häufig und kann eine ernsthafte Bedrohung für die menschliche Gesundheit. Eine Überprüfung der Programme in einem großen Pharmaunternehmen im Zeitraum 2005 – 2010 ergab GI Sicherheit als die Hauptursache für 9 % der klinischen Studie Kündigungen9. Tests für GI-Toxizität in präklinischen Modellen Säugetier kann teuer in Bezug auf Zeit, zusammengesetzte und arbeitsintensiv sein. Ein vorausschauender Hochdurchsatz-Assay für GI Transit kann bieten Flexibilität, Toxizitätstests compound und 3R Wirkung erzielen. Eine neuartige Methode bietet solch einen Test wird durch das Protokoll beschriebenen vorgestellt. Hochdurchsatz-Assays konnte schon früh in der Medikamentenentwicklung Kandidaten zu priorisieren, und tragen zur Reduzierung der GI Sicherheitstests in größeren Arten eingesetzt werden.
Protokoll
Alle hier beschriebene Methoden wurden von den institutionellen Animal Care genehmigt und Nutzung Committee (IACUC) des AbbVie.Abbvie betreibt unter der nationalen Institute der Gesundheit Führung zur Pflege und Verwendung von Labortieren in einer Einrichtung, die von der Association for akkreditiert die Bewertung und Anerkennung des Versuchstieres Pflege (AAALAC). Keine tierischen gesundheitlichen Bedenken wurden in diesen Studien beobachtet.
1. Erwachsene Zebrafisch züchten und Sammeln von Embryonen
- Haus und Rasse Erwachsenen Zebrafisch mit allgemeinen Haltung und Zuchtmethoden. Zum Beispiel, siehe Westerfield10.
- Bereiten Embryos Medium durch Auflösen dehydriert Meersalz (siehe Tabelle der Materialien) in entionisiertem Wasser in einer Konzentration von 60 mg/L.
- Sammeln befruchtete Eier aus der Erwachsenen Zucht Kammer, spülen Sie gut mit Embryo Medium und Haus Embryonen in etwa 50 mL Embryo Medium in 10 cm Petrischalen (50 Embryonen pro Schale) auf 28 ± 1 ° C auf einem 14:10 h hell: Dunkel-Zyklus.
- Entfernen Sie nicht überleben Embryonen nach 24 h und Ergänzung mit Embryonen zu überleben, so dass jedes Gericht 50 Embryonen pro Schale enthält.
2. trainieren Sie Larven ernähren, nicht gefärbte Lebensmittel
- Die 4th Tag nach Befruchtung (4 Dpf), ernähren sich die Larven in jede Petrischale 2 mg von pulverförmigen Larven Fischfutter (siehe Tabelle der Materialien) durch das streuen des Essen auf dem Wasser.
- Die Larven können 3 – 4 h zu füttern und dann übertragen Sie sie auf eine saubere (ohne Futter) Petrischale mit ca. 50 mL frischen Embryonen Medium.
- Zur Unterstützung bei der Übertragung als wenig Nahrung wie möglich spülen Sie jede Larve in einer Petrischale mit ca. 50 mL frischen Embryonen Medium vor dem endgültigen Übergang in die neue Schale.
- Wiederholen Sie die Fütterung und Spülen der Larven auf 5 Dpf und 6 Dpf.
3. bereiten Sie auf die 6 Dpf fluoreszierende Lebens- und Futtermittel, Larven auf 7 dpf
- Bereiten Sie Lebensmittel, die eine fluoreszierende Label (nachfolgend als fluoreszierende Essen, nach den Methoden der Bereich Et al. 3). kurz, mischen Sie 300 µL Leuchtstofflampen zu kennzeichnen (siehe Tabelle der Materialien), 100 µL deionisiertes Wasser und 200 mg Pulver Larven essen auf einem Uhrglas 10 cm.
- Die daraus resultierende Paste in einer dünnen Schicht auf das Uhrglas zu verbreiten. Lassen Sie die Paste zu trocken bei Raumtemperatur im Dunkeln für > 8 h.
- Kratzen Sie die getrocknete Mischung aus das Uhrglas, um Pulver, und bei Raumtemperatur im Dunkeln Lagern zu vernichten. Das fluoreszierende Essen ist jetzt bereit, an die Larven verfüttert werden.
- Auf 7 Dpf, füttern die fluoreszierende Nahrung für Larven in der gleichen Weise wie für frühere Fütterungen getan ist, 2 mg fluoreszierende Essen pro Schale bieten (siehe Schritte 2.1 – 2.2.1).
Hinweis: Stellen Sie sicher, dass das Essen fein zu einem Pulver gemahlen. Rieb fluoreszierende Nahrung, die in mit einem Gewicht von Papier zwischen Daumen und Zeigefinger gewickelt ist, ist eine nützliche Methode dafür fein Boden essen.
4. bereiten Sie konzentrierte Dosierung Lösungen der Testverbindungen
- Lösen Sie jede Testverbindung Embryo Mittel-und einer Konzentration, die 2 x die zieldosis ist. Prüfung von einem Dosisbereich gewünscht, bereiten Sie mehrere konzentrierte Dosierung Lösungen der entsprechenden Konzentrationen für die gewünschte Dosen.
- Bereiten Sie genug von jedem konzentrierte Dosierung Lösung, so dass 24 Larven behandelt werden können. Jede Larve benötigen 100 µL Dosierung Lösung (das Endvolumen pro Bohrloch ist 200 µL), so bei den allerwenigsten 2,4 mL Dosis Lösung benötigt für jede Behandlungsgruppe; 2,5 mL wäre eine angemessene Lautstärke.
- Wenn ein Lösungsmittel (z.B. Dimethyl Sulfoxid) für erste Gefäss-der Testverbindung verwendet wurde, bereiten die passende Fahrzeug-Kontrolle-Dosis (d. h. dieselbe Menge des Lösungsmittels als zusammengesetzte Behandlung aber ohne die Verbindung). Und wie für jede Verbindung-behandelten Gruppe bereiten genug Fahrzeuglösung, 24 Larven zu behandeln.
5. Übertragung Larven auf einer 96-Well-Platte und Behandlungen anwenden
- Nach Larven ernähren sich von fluoreszierenden Essen für 2 h gestattet wurde, verwenden einer transferpipette auf eine Spülung Gericht verschieben wie nach der Fütterung auf vorherige Tage der Fall war.
- Nachdem jeder Larve gespült wird, zusammen mit 100 µL Embryo Medium zurückzuziehen, und verschieben Sie es in einen Brunnen von einer 96-Well Polystyrol konischen Boden Multi-well-Platte (siehe Tabelle der Materialien), Verzicht auf volle 100 µL Embryo Medium in den Brunnen mit der Larve.
- Sobald die erforderliche Anzahl von Larven, die 96-Well-Platte übertragen wurden, fügen Sie 2 × 100 µL Dosierung Lösungen in jede Vertiefung konzentriert.
Hinweis: Die Verwendung von einer 12-Kanal Mehrkanal-Pipette ermöglicht schnelle Dosierung der Larven (12-in-a-Time). Um zu vermeiden, versehentlich die falsche Behandlung hinzufügen, verfolgen der enge von denen Larven haben dosiert worden, mit welcher Behandlung und achten Sie darauf, Pipettenspitzen zwischen den Behandlungen zu ändern.
6. Maßnahme aus- und anschließende Fluoreszenz aus jedem Brunnen
- Nach dem Hinzufügen der Dosis-Lösungen, setzen Sie 96-Well-Platte in eine Platte Spektralphotometer kann spannend und Erkennung von Emissionen aus dem fluoreszierende Label.
Hinweis: Für die gelb-grünen Etikett verwendet (siehe die Tabelle der Materialien), die entsprechenden Wellenlängen des Lichts sind spannend bei 505 nm und Erkennung bei 515 nm. - Lesen Sie die Fluoreszenz des 96-Well-Platte von unten 5 Mal in unmittelbarer Folge ohne Schütteln der Plattenrandes. Verwenden Sie den Mindestwert der 5 Lesungen aus jedem Brunnen als die erste Fluoreszenz aus dem Brunnen.
Hinweis: Die 5 Messung durchgeführt werden, wenn die Platte zu lesen ist deshalb, dass die Larven schwimmen manchmal auf dem Weg der das Anregungslicht und die Nahrung im Darm strahlt ein sehr großes Signal ist nicht repräsentativ für den freigegebenen Kot. Wobei das Minimum von 5 liest kann helfen, vermeiden die Verwendung von künstlich hoch Messungen aus der UN-transitierten Nahrung. - Lesen die Fluoreszenz des 96-Well-Platte (wie bei der ersten Lesung der Fall war) alle 20 min für die ersten 2 h nach Dosierung, alle 30 min. für 3 und 4 Stunden post-Dosierung und dann einmal jede Stunde für Stunden, 5, 6, 7 und 8 Post-Dosierung.
- Nehmen Sie vorsichtig, nicht zu stören (durch Schütteln der 96-Well-Platte) nieder Fäkalien zwischen liest und inkubieren Sie die Larven bei 28 ± 1 ° C zwischen mal gelesen.
- Inkubieren Sie die Larven über Nacht auf 28 ± 1 ° C und lesen Sie die Fluoreszenz von 96-Well-Platte am nächsten Morgen um die gleiche Zeit, die die Larven am Vortag dosiert waren. Verwenden Sie diese Messung als 24 h nach Dosis Fluoreszenz.
7. die Daten analysieren
Hinweis: Hier berechnen wir pro Bohrloch Akkumulation und Gruppe im Durchschnitt für jeden Zeitpunkt.
- Zur Berechnung der Akkumulation pro Well, mit nur minimalen Werte aus jeder der 5 lautet subtrahieren Sie den Anfangswert von jeden Zeitpunkt Wert. Führen Sie diese Berechnung für den Anfangswert sowie (Dies führt zu einer ersten Häufung von NULL für jedes gut).
- Wenn die Akkumulation in einen Brunnen an der 24 h-Zeitpunkt weniger als 150 relativen fluoreszierende Einheiten ist, schließen Sie aus, dass auch weitere Analysen; diese niedrigen Werte sind am ehesten durch niedrige oder keine Nahrungsaufnahme die fluoreszierenden durch die Larven während der Fütterung, und somit diese Larven sind nicht gute Themen für die Messung der Laufzeit.
- Berechnen Sie für jeden Zeitpunkt die durchschnittliche Ansammlung für Brunnen mit Co behandelten Larven sowie Standardfehler von diesen Durchschnittswerten.
- Die durchschnittliche Ansammlung auf der Y-Achse im Vergleich zu Zeit auf der X-Achse für jede Behandlungsgruppe des Grundstückes und die Flächen unter den Kurven (AUCs) zu vergleichen.
Hinweis: Behandlungen, die erheblich verlangsamen oder beschleunigen die Transitzeit haben AUCs deutlich kleiner oder größer, bzw. als der Fahrzeug-behandelten Gruppe.
Ergebnisse
Diese Methode, die Platte-basierte Spektralphotometrie verwendet, um GI Transit bewerten, einsetzbar als Ersatz für Hochdurchsatz-Fluoreszenz-Mikroskopie ist ein niedriger Durchsatz-Methode für die Bewertung der gleichen Funktion (Abbildung 1). Um die Daten in Abbildung 1zu erzeugen, wurden gleich behandelten Fische für GI-Transit mit Fluoreszenz-Mikroskopie (repräsentative Bilder gezeigt) oder Spektrophotometrie zu 4 Zeitpunkten analysiert 0, 4, 8 und 24 h nach dem dosieren; Vergleich der Daten aus diesen Experimenten gab hochkorrelierten Ergebnisse (lineare Regression von Daten R2 = 0,95). Die lineare Regression hat eine negative Steigung, da Mikroskopie die einbehaltenen Fluoreszenzsignal misst und Spektrophotometrie das übertragene Signal misst.
Die Auswirkungen der Verbindungen der unterschiedlichen Mechanismen, mit etablierten GI Aktivität beim Menschen können im Zebrafisch mit Spektralphotometrie Assay (Abbildung 2) erkannt werden. Im Vergleich zu Kontrollen Fahrzeug behandelt, Atropin (4,2 µM) und Amitriptylin (5 µM) verlangsamt GI Transit, während Tegaserod (3,3 µM) und Metoclopramid (33 µM) beschleunigte Transitzeit. Erythromycin (14 µM), erwartet, dass Transitzeit beschleunigt hatte keinen Effekt dieser Methode gemessen. Behandlung Gruppengrößen waren 24 bevor Entfernen von Daten aus Larven keine oder sehr Signal geringe. Die AUC für das durchschnittliche Signal pro Zeitpunkt wurde zwischen Verbindung-Fahrzeug-behandelt und Gruppen mit Tukey ehrlich signifikanter Unterschied für Typ-1-Fehlerkontrolle verglichen. Wirkungen wurden als bedeutende nur dann, wenn p ≤ 0,05. Die Konzentrationen verwendet für die oben genannten Behandlungen waren die maximale Dosen toleriert, in einem früheren Experiment bestimmt und definiert als die höchste Dosis ohne beobachtbare negative Auswirkungen durch grobe Beobachtung.
Die Spektralphotometrie Assay kann dosisabhängige Wirkungen Verbindungen messen. Abbildung 3 enthält Daten, die zeigen, dass Atropin GI Transit Dosis-Abhängigkeit im zebrafischlarven verlangsamt. Die niedrigste Dosis von Atropin getestet, 0.042 µM, hatte keinen signifikanten Effekt, während die beiden höheren Konzentrationen hatten erhebliche Auswirkungen, 0,42 µM mit weniger Einfluss als 4,2 µM.
Eine neue Probe durch positive und negative Kontrollen, das heißt, Verbindungen bekannt, aktive und inaktive bzw. im Zielsystem werden Tests beurteilt werden kann (in diesem Fall ist das Target-System der Säuger GI-Transit). Für die Spektralphotometrie Assay wurden 18 aktive (Positivkontrolle) und 6 inaktive (Negativkontrollen) getestet. Basierend auf diesen Experimenten, hat die Spektralphotometrie Assay hohe positive prädiktive Wert (90,9 %), aber geringe Empfindlichkeit (55,6 %) und negativen prädiktiven Wert (38,5 %). Diese Werte sind in Tabelle 1aufgeführten Daten abgeleitet. Sie reflektieren in der Praxis, dass wenn die Zebrafisch Transitzeit durch eine Behandlung beeinflusst wird, Säugetier-Transit betroffen sein dürfte. Wenn es keine Wirkung auf Zebrafisch Transitzeit, ist dies jedoch nicht prädiktiv für Säugetier-Effekt.
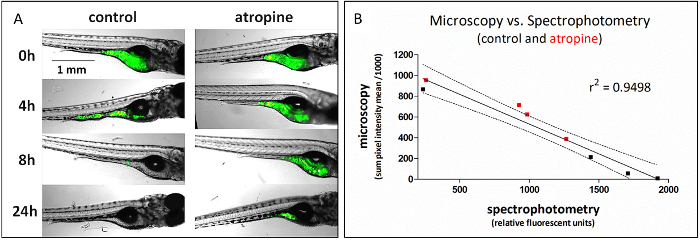
Abbildung 1: fluoreszierende Essen Transit vom Teller-basierte Spektralphotometrie als Verlust des Signals vom mikroskopische Bildgebung und eine entsprechende Verstärkung im Signal erkannt wird. (A) repräsentative mikroskopische Aufnahmen von der Analyse von Atropin (4,2 µM) Wirkung auf GI-Laufzeit. (B) durchschnittliche Signal von mikroskopischen Aufnahmen quantifiziert ist hoch (negativ) korreliert mit Signal von stornierten Fäkalien (Spektralphotometrie) aus identisch behandelten Fische. Daten von Atropin behandelt Fische sind rot. Diese Abbildung mit freundlicher Genehmigung von Cassar Et Al. kopiert 11. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Analyse Fluoreszenzsignal Akkumulation im Laufe der Zeit aus einem Multi-well-Platte ermöglicht die Identifizierung von Behandlungen, die GI-Transit-Rate ändern. Sternchen (*) zeigt deutlich unterschiedliche AUC als Fahrzeug-behandelten Fische. Fehlerbalken repräsentieren den Standardfehler des mittleren Signals für Larven in der Behandlungsgruppe pro Zeitpunkt. Diese Zahl wurde mit freundlicher Genehmigung von Cassar Et Al. wiederverwendet worden 11. Bitte klicken Sie hier für eine größere Version dieser Figur.
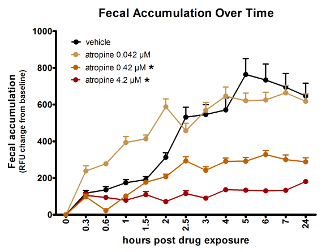
Abbildung 3 : Atropin Dosis-Abhängigkeit verlangsamt Zebrafisch Darm Transitzeit fluoreszierende Spektralphotometrie der fäkalen Akkumulation im Laufe der Zeit widerspiegelt. Sternchen (*) zeigt deutlich unterschiedliche AUC als Fahrzeug-behandelten Fische. Fehlerbalken repräsentieren den Standardfehler des mittleren Signals für Larven in der Behandlungsgruppe pro Zeitpunkt. Diese Zahl wird mit freundlicher Genehmigung von Cassar Et Al. wiederverwendet. 11. Bitte klicken Sie hier für eine größere Version dieser Figur.

Tabelle 1: GI Aktivität 24 Verbindungen in Säugetieren und Fischen. Diese Tabelle wird mit freundlicher Genehmigung von Cassar Et Al. wiederverwendet. 11.
Diskussion
Die neuartige Spektrophotometrie-Methode zur Messung der Zebrafisch Larven GI Transitzeit, das hier vorgestellte ist eine effiziente Assays, die behandlungseffekte auf Säugetier-GI-Funktion vorhersagen kann. Obwohl der Test geringen Empfindlichkeit hat, hat es hohe positive prädiktivität, annehmbar für erste Stufe-Assays für die Anzahl der Kandidaten Behandlungen basierend auf Toxizität12Gemüsemesser beschäftigt ist. Diese Methode ist einfacher ausgeführt, bietet einen höheren Durchsatz und verwendet weniger Tier Umgang mit Schritte als Fluoreszenz-Mikroskopie.
Innewohnt, diese Methode gibt es technische Herausforderungen. Fangen einzelne Larven, nach der Fütterung des fluoreszierenden Essen und deren Übertragung in einzelnen Vertiefungen ist zunächst eine Herausforderung. Jedoch kann ein Fachmann mit etwas Übung eine 96-Well-Platte in weniger als 15 min füllen. Wenn Sie zu einem bestimmten Zeitpunkt, wird die Platte versehentlich erschüttert und verunsichert die Fäkalien aus der Tiefe der Brunnen vor der Lesung, erscheint die Ansammlung zu verringern. Dies kann vermieden werden, durch Verschieben der Chicoréeblätter sorgfältig, ohne schütteln. Nach unserer Erfahrung störte normale Bewegung, einschließlich der von der Platte Spektralphotometer motorisierte Schublade, nicht den Test. Platte Leser mit einer Heizung ausgestattet (d. h., die Platte hat keinen Inkubator zwischen Messungen zurückgegeben werden), und befindet sich in der Nähe der Assay Labortisch für niedrigere Wahrscheinlichkeit der Störung optimieren könnte, aber dies war nicht notwendig in unserer Erfahrung.
Frühe Versuche die Methode enthalten Fütterung an den Tagen vor dem Test nicht. Ohne diese "Praxis" Fütterungen verbraucht niedrigere Anzahl von Larven, ausreichend fluoreszierende Nahrung während der Zeit vor der Behandlung Anwendung erlaubt. In jene Versuche Variation innerhalb Behandlungsgruppen war größer, und mehr Daten durch Low/No Signal Akkumulation im Laufe der Zeit unbrauchbar. Sogar mit der Praxis Fütterung, einige Larven nicht ausreichende Mengen an das fluoreszierende Essen konsumieren, Daten aus diesen Larven verringert Variation innerhalb von Gruppen und erhöht die Fähigkeit, behandlungseffekte zu identifizieren. Beginnend mit größeren Gruppengrößen (d. h. 24 gegenüber 12) ermöglicht eine ausreichende Anzahl von Larven, die nützliche Daten für die Analyse beitragen.
Die fluoreszente-Mikroskopie zeigt, dass Essen Transit fast vollständig von 24 h in Atropin behandelt Larven (nicht dargestellt), war jedoch die Mikrotestplatte Daten aus der letzten Zeitpunkt niedriger Schlusssignal der Atropin-Gruppe im Vergleich zur Fahrzeuggruppe widerspiegeln. Umgekehrt war höhere abschließende Mikrotestplatte Fluoreszenz mit Behandlungen, die Transitzeit, beschleunigt, obwohl die Fahrzeug behandelt Larven offenbar ihre GI-Trakt vor der endgültigen Zeitpunkt storniert haben. Basierend auf der zufälligen Zuordnung zu Behandlung von Larven gefüttert fluoreszierende Nahrung, übernehmen wir gleichwertige Verbrauch der fluoreszierenden Lebensmittel im Durchschnitt unter den Behandlungsgruppen. Angesichts dieser Tatsache, und anhand der oben beschriebenen Muster, Fluoreszenz von Fäkalien mit Zeitaufwand im Larvenstadium GI-Trakt abnimmt oder schneller Transit verleiht Fluoreszenz Kot irgendwie. Die eigentliche Ursache ist unbekannt und nicht verhört worden, aber immer noch der Test ist in der Lage, Messen und vergleichen Transitzeit zwischen den Gruppen.
Der Einsatz dieser Methode bei der Aufdeckung von toxischen Wirkungen der GI aus niedermolekularer Verbindungen ist eine Anwendung. Andere mögliche Anwendungen sind beispielsweise Krankheit Modellierung (z.B. Reizdarm-Syndrom) und neuartige Therapie Entdeckung für solche Krankheiten oder Pro-kinetischen Verbindungen zu entdecken. Darüber hinaus könnte in Verbindung mit transgenen Modellen, mit dieser Methode, die Rolle der Gene in normalen GI Transit sowie Transit Störungen, einschließlich Enterische Neuron-Mangel zu befragen. Der Zebrafisch-Larven bietet eine ganze Organismus Plattform auf einer Skala, die der Zelle Kultivierung nahe kommt, aber da gibt es mehrere Gewebe und unzähligen Zelltypen zusammen funktionieren in der Zebrafisch, Systeme Biologie Fragen erfragt werden und beantwortet mit diesem Modell.
Mit Zuführungen in der Technologie und neuen Anwendungen davon wird die Effizienz bei der Durchführung von Zebrafisch-Toxizitätstests weiterhin verbessern. Larval Zebrafisch Umgang mit Methoden und Tests sind weiterhin in Bezug auf die höheren Durchsatz13,14zu verbessern. Der Roman die hier vorgestellte Methode ist ein Beispiel für eine Verbesserung, die Zebrafisch Studien mehr wirkungsvoller machen kann.
Offenlegungen
Das Design, Studie Verhalten und finanzielle Unterstützung für diese Forschung wurden von AbbVie zur Verfügung gestellt. AbbVie beteiligte sich bei der Interpretation der Daten, Prüfung und Genehmigung des Manuskripts. S. Cassar, X. Huang und T. Cole sind Mitarbeiter von AbbVie und haben keine zusätzliche Interessenkonflikte offenlegen.
Danksagungen
Simon Cassar von carpetbones.com entworfen und erstellt die animierte Figur eingesetzt, um das Verfahren im Leben des GI Transit Assays zu demonstrieren.
Materialien
| Name | Company | Catalog Number | Comments |
| Wild type zebrafish breeding pair | Various sources - for example ZIRC (Zebrafish International Resource Center) | ZL-1 | Adult wild type zebrafish of AB lineage |
| 1.7 L Breeding Tank - Beach Style Design | Tecniplast | 1.7L SLOPED | Breeding tank |
| Instant Ocean sea salt | Intant Ocean | SS15-10 | Dehydrated sea salt |
| First Bites larval fish food | Hikari | 20095 | Powdered larval fish food |
| Yellow-green (505/515) Fluospheres | Invitrogen | F8827 | Fluorescent label |
| V-bottom 96-well polystyrene microplates | Thermo Fisher Scientific | 249570 | Multiwell microplate with V-shaped bottom in each well |
| Atropine | Sigma Aldrich | A0132 | |
| Amitriptyline | Sigma Aldrich | A8404 | |
| Tegaserod | Sigma Aldrich | SML1504 | |
| Metoclopramide | Sigma Aldrich | M0763 | |
| Erythromycin | Sigma Aldrich | E5389 | |
| Spectramax M2e microplate reader | Molecular Devices | Spectramax M2e | A multi-well plate spectrophotometer capable of fluorescent excitation and emission detection. |
| SoftMax Pro | Molecular Devices | SoftMax Pro | Software for spectrophotometer data acquisition |
Referenzen
- Berghmans, S., et al. Zebrafish based assays for the assessment of cardiac, visual, and gut function - Potential safety screens for early drug discovery. Journal of Pharmacological and Toxicological Methods. 58 (1), 59-68 (2008).
- Field, H. A., Kelley, K. A., Martell, L., Goldstein, A. M., Serluca, F. C. Analysis of gastrointestinal physiology using a novel intestinal transit assay in zebrafish. Neurogastroenterology and Motility. 21, 304-312 (2009).
- Kanungo, J., Cuevas, E., Ali, S., Paule, M. G. Zebrafish model in drug safety assessment. Current Pharmaceutical Design. 20 (34), 5416-5429 (2014).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Shepherd, I., Eisen, J. Development of the zebrafish enteric nervous system. Methods in Cell Biology. 101, 143-160 (2011).
- Holmberg, A., Olsson, C., Holmgren, S. The effects of endogenous and exogenous nitric oxide on gut motility in zebrafish Danio rerio embryos and larvae. The Journal of Experimental Biology. 209, 2472-2479 (2006).
- Olsson, C., Holmber, A., Holmgren, S. Development of enteric and vagal innervation of the zebrafish (Danio rerio) gut. The Journal of Comparative Neurology. 508, 756-770 (2008).
- Fleming, A., Jankowski, J., Goldsmith, P. In vivo analysis of gut function and disease changes in a zebrafish larvae model of inflammatory bowel disease: A feasibility study. Inflammatory Bowel Disease. 16 (7), 1162-1172 (2010).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five-dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , University of Oregon Press. Eugene, OR, USA. (2000).
- Cassar, S., Huang, X., Cole, T. A high-throughput method for predicting drug effects on gut transit time using larval zebrafish. Journal of Pharmacolical and Toxicological Methods. 76, 72-75 (2015).
- McKim, J. M. Building a tiered approach to in vitro predictive toxicity screening: A focus on assays with in vivo relevance. Combinatorial Chemistry and High Throughput Screening. 13 (2), 188-206 (2010).
- Bruni, G., Lakhani, P., Kokel, D. Discovering novel neuroactive drugs through high-throughput behavior-based chemical screening in the zebrafish. Frontiers in Pharmacology. 5, 153(2014).
- Mandrell, D., et al. Automated zebrafish chorion removal and single embryo placement: optimizing throughput of zebrafish developmental toxicity screens. Journal of Laboratory Automation. 17, 66-74 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten