Method Article
Ein Tandem-Flüssigchromatographie-Massenspektrometrie-basierter Ansatz zur Analyse von Metabolit
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll für die Extraktion von Metaboliten von Staphylococcus aureus und deren anschließenden Analyse mittels Flüssigchromatographie und Massenspektrometrie.
Zusammenfassung
In dem Bemühen, bakterielle Pathogene zu vereiteln, begrenzen Wirte oft die Verfügbarkeit von Nährstoffen an dem Ort der Infektion. Diese Einschränkung kann die Häufigkeit von Schlüsselmetaboliten ändern, auf die regulatorischen Faktoren reagieren, den Zellstoffwechsel einstellen. In den letzten Jahren sind eine Reihe von Proteinen und RNA als wichtige Regulatoren der Genexpression Virulenz entstanden. Beispielsweise reagiert das CodY Protein auf ein Niveau von verzweigtkettigen Aminosäuren und GTP und ist in niedrigen G + C Gram-positiven Bakterien weitgehend konserviert. Als globaler Regulator in Staphylococcus aureus, steuert CodY die Expression von Dutzenden von Virulenz und metabolischen Gene. Wir vermuten , dass S. aureus verwendet CodY, teilweise seinen metabolischen Zustand in dem Bemühen , zu verändern , um Nährstoff einschränkenden Bedingungen möglicherweise begegneten in der Host - Umgebung anzupassen. Diese Handschrift beschreibt ein Verfahren zur Extraktion und Analyse von Metaboliten aus S. aureus unter Verwendung von Flüssigchromatographie gekoppelt mit Massenspektrometry, ein Protokoll, das entwickelt wurde, um diese Hypothese zu testen. Das Verfahren zeigt auch Best Practices, die Strenge und Reproduzierbarkeit gewährleisten, wie biologischen eingeschwungenen Zustand und konstante Belüftung ohne die Verwendung von kontinuierlichen Chemostatkulturen beibehalten wird. Relativ zu dem USA200 Methicillin-empfindlicher S. aureus UAMS-1 parentalen Stamm zu isolieren, zeigte die isogene Mutante codY signifikante Anstiege in Aminosäuren aus Aspartat abgeleitet (zB Threonin und Isoleucin) und nimmt in ihren Vorläufern (zB Aspartat und O - Acetylhomoserin ). Diese Ergebnisse korrelieren gut mit Transkriptions Daten mit RNA-Seq - Analyse erhalten: Gene in diesen Bahnen hochreguliert zwischen 10- und 800-fach in der codY Nullmutante waren. Die Kopplung globale Analysen der Transkriptom und Metabolom kann zeigen, wie Bakterien ihren Stoffwechsel verändern, wenn sie mit Umwelt- oder Ernährungs Stress konfrontiert, potenziellen Einblicks in die phys Bereitstellungiologische Veränderungen im Zusammenhang mit Nährstoffverarmung während der Infektion erfahren. Solche Entdeckungen können den Weg für die Entwicklung neuartiger Antiinfektiva und Therapeutika ebnen.
Einleitung
Bakterielle Krankheitserreger müssen mit vielen Herausforderungen in der Host-Umgebung kämpfen. Neben dem direkten Angriff von Immunzellen, sondert der Wirt auch Nährstoffe wichtig für bakterielle Überleben und die Replikation zu erzeugen Ernährungs Immunität 1, 2. Um diese feindlichen Umgebungen zu überleben, zu implementieren bakteriellen Erregern Virulenzfaktoren. Einige dieser Faktoren lassen sich die Bakterien die Immunantwort zu entziehen; Andere Faktoren sind Verdauungsenzyme, wie Hyaluronidase, Thermonuklease und Lipase sezerniert wird , die die Bakterien ermöglichen, fehlende Nährstoffe nachzufüllen von Gewebe stammenden Bestandteile 3, 4, 5 raubend. Tatsächlich Bakterien Regulierungssysteme entwickelt haben, die den physiologischen Zustand der Zelle zur Produktion von Virulenz - Faktoren binden 6, 7, up class = "xref"> 8, 9, 10.
Eine wachsende Zahl von Hinweisen deutet auf CodY als entscheidender Regulator verbindet Stoffwechsel und Virulenz. Obwohl ersten 11 in Bacillus subtilis als Repressor des Dipeptids Permease (dpp) Gen entdeckt, wird CodY jetzt bekannt , um fast alle niedrigen G + C Gram-positive Bakterien , 12, 13 hergestellt werden und reguliert Dutzende von Genen in Kohlenstoff beteiligt und Stickstoffmetabolismus 14, 15, 16, 17, 18, 19. In pathogene Spezies, die Expression einiger der wichtigsten Virulenzgene 20, 21 CodY auch steuert,. ef "> 22, 23, 24, 25, 26, 27 CodY wird als ein DNA-bindendes Protein , das durch zwei Klassen von Liganden aktiviert: verzweigtkettigen Aminosäuren (BCAA, Isoleucin, Leucin und Valin [ILV]) und GTP . Wenn diese Nährstoffe reichlich vorhanden sind, reprimiert CodY (oder in einigen Fällen stimuliert) Transkription. Da diese Nährstoffe begrenzt werden, so wird CodY Aktivität progressiv verringert wird, in einer abgestuften Transkriptionsreaktion führt, daß erneut Routen durch verschiedene Stoffwechselwege Vorläufern zentralen Stoffwechsel verbunden 28, 29, 30.
Tandem - Flüssigkeitschromatographie gekoppelt mit Massenspektrometrie (LC-MS) ist ein leistungsfähiges Verfahren , das genau identifizieren und quantifizieren , kann kleinmolekulare intrazelluläre Stoffwechselprodukte 31. Wenn mit umschrift gepaartriptome Analyse (zB RNA-Seq), dieser analytische Workflow kann Einblick in die physiologischen Veränderungen liefern , die in Reaktion auf Umwelt- oder Ernährungs Stress auftreten. Hier stellen wir ein Verfahren zur Extraktion von Metaboliten Staphylococcus aureus - Zellen und die anschließende Analyse mittels LC-MS. Dieser Ansatz wird verwendet, um die pleiotropen Wirkungen von CodY auf S. aureus Physiologie zu demonstrieren.
Protokoll
1. Herstellung von Pufferlösungen
- Bereiten phosphatgepufferter Salzlösung (PBS; pH 7,4) durch eine Stammlösung von 10 × PBS auf eine Endkonzentration von 1x mit Reinstwasser verdünnt wird (destilliertem und entionisiertem) Wasser.
- Bereiten Abschrecken Lösung durch Kombination von 2 ml Acetonitril, 2 ml Methanol, 1 ml ultrareinem H 2 O und 19 ul (0,1 mM Endkonzentration) Ameisensäure.
- Bereiten LC-MS Lösungsmittel A durch Zugabe von Ameisensäure (0,2% [v / v] Endkonzentration) zu Reinstwasser.
- Bereiten LC-MS Lösungsmittel B durch Zugabe von Ameisensäure (0,2% [v / v] Endkonzentration) zu Acetonitril.
HINWEIS: Alle Lösungen sollten mit den höchsten reinen Reagenzien zur Verfügung (in der Regel HOCHLEISTUNGSFLÜSSIGKEITSCHROMATOGRAPHIE grade) hergestellt werden. Die Lösungen sollten vor jedem Experiment frisch hergestellt werden und auf Eis gelagert vor der Verwendung.
2. Etablierung von Steady-state S. aureus Wachstum
- Streak S. aureus Stämme von Interesse für die Isolierung auf tryptischen Soja - Agar (TSA) aus einem gefrorenen Glycerolstammlösung. Inkubieren bei 37 ° C für 16-24 h.
- Beimpfen von 4 ml tryptischer Sojabrühe (TSB) oder ein anderes geeignetes Medium in sterilen Glas Inkubationsröhrchen mit einzelnen Kolonien jedes Stammes. Inkubieren geneigt (~ 70 ° Winkel) mit einer Drehung bei 60 Umdrehungen pro Minute (rpm) bei 37 ° C für 16-20 h.
HINWEIS: Über Nacht Kulturen sind anfällig für Sauerstoff-Gradienten, wenn Standardverfahren, einschließlich der in Schritt 2.2 beschrieben, die zelluläre Physiologie beeinflussen. So beschäftigen wir eine Mehrfachstrategie zurück-Verdünnung biologischen eingeschwungenen Zustand (siehe Schritte 2,4-3,2, unten) zu gewährleisten. - Verwenden eines Spektrophotometers die optische Dichte der Kulturen aus dem Schritt 2.2 bei 600 nm (OD 600) zu messen. Verwenden steriles Medium als optische Referenz (leer). Man verdünnt diese Zellen zu einer OD 600 von 0,05 in 50 ml sterilen TSB - Medium (vorgewärmt auf 37 ° C) in separaten, 250 mL DeLong Flaschen.
- IncuBeize der Kulturen bei 37 ° C in einem Wasserbad bei 280 Umdrehungen pro Minute unter Schütteln.
- Alle 30 min, nehmen OD 600 Messungen; wie die optischen Dichten zu erhöhen, kann es notwendig werden, die Kulturen mit TSB zu verdünnen, so dass sie innerhalb des linearen Absorptionsbereich des Spektrometers bleiben.
- Wenn Kulturen aus Schritt 2.5 eine OD 600 von ~ 0,8-1,0 erreichen, Subkultur sie in 50 ml 37 ° C auf TSB einen OD600 von 0,01-0,05 und wiederholen Sie die Schritte 2.4 und 2.5.
3. Probenentnahme-Setup
- Bereiten Sie die ein Bett aus zerkleinerten Trockeneis in einem geeigneten Gefäß (zB Glasschale, Eisbehälter oder Kühler).
- Da die optischen Dichten der Kulturen die gewünschte Erntepunkt nähern, 1 ml der für ≥5 min Lösung auf eine 35 mm Petrischale und unbehandeltem Vorkühl- auf Trockeneis abgeschreckt.
HINWEIS: Der „gewünschte Erntepunkt“ wird in Abhängigkeit von experimentellen Zielen variiert. Zum Beispiel war, wenn man m untersuchenetabolites während der aeroben Wachstums Kennzahlen dieses Zustands umfassen Acetat Ausscheidung und Wieder Assimilation des Acetats in der post-exponentiellen Wachstumsphase 32, 33. Im allgemeinen sollte dieser Punkt in einem bestimmten Wachstumsstadium (zB exponentielle Phase). Die spezifischen OD 600 Werte mit dieser Stufe verbunden ist, kann zwischen verschiedenen Bakterienstämme und Wachstumsmedien variieren. - Legen Sie eine Edelstahlfilter Fritte (vorgekühlte bis -20 ° C) in einem Gummi-Stopper und legt es auf einem Vakuumkolben mit einem Hausvakuum oder eine Vakuumpumpe befestigt.
- Anwenden des Vakuums und legen eine gemischte Celluloseester-Membran (0,22 um Porengrße) oben.
HINWEIS: Es ist wichtig, einen Filter mit einem Durchmesser gleich demjenigen der Fritte zu verwenden und richtig, diese Filter zu zentrieren, um sicherzustellen, dass die Probe durch die Filter gezogen wird und nicht über den Rand. Benetzen der Membran mit eiskaltem, sterilen H 2 O kann helfenmit der Membran zu positionieren.
4. Probenernte
- Bei einer OD 600 von ~ 0,4-0,5, verwenden eine serologische Pipette 13 ml der Kultur aus dem Kolben zu entfernen und die Probe auf die Filter anzuwenden.
- Nachdem die gesamte Probe gefiltert wurde sofort abwaschen den Filter mit ≥5 mL eiskaltem PBS-Medium-assoziierte Metaboliten abzuwaschen.
- Trennen des Vakuums und mit einem Paar von sterilen Pinzette den Filter von der Fritte zu entfernen. Invertieren des Filters (Zellseite nach unten) in den vorgekühlten Quenchlösung.
HINWEIS: Es ist wichtig , die obigen Schritte schnell (dh innerhalb von Sekunden) und so schnell auszuführen , wie die Flüssigkeit der schnelle Abschreckung der Zellen zu gewährleisten , wurde entfernt, verhaften metabolische Aktivität. - Inkubieren Sie die Filter in dem Quench-Lösung auf Trockeneis für ≥20 min.
- Unter Verwendung einer sterilen Pinzette, invertieren die Filter (Zellseite nach oben) in die Petrischale und einer Mikropipette verwenden, um die Zellen zum Abspülen von ter Membran in die Quench-Lösung.
- die Zellen in Quenchlösung erneut suspendiert und dann überträgt die Zellsuspension auf ein sterilen 2 ml schlagfesten Röhrchen mit ~ 100 & mgr; L von 0,1 mm Siliciumdioxidperlen. Speicher dieses auf Trockeneis oder bei -80 ° C.
5. Metabolit Extraction
- Auftau-Proben auf nasses Eis und die Zellen in einem Homogenisator mit vier Bursts 30 s bei 6.000 Umdrehungen pro Minute, wobei 2 min Kühlperioden auf Trockeneis zwischen den Zyklen stören.
- Klärung die Lysate 15 Minuten in einer vorgekühlten, gekühlten Mikrozentrifuge bei maximaler Geschwindigkeit (dh 18.213 xg bei ≤4 ° C).
- Übertragen Sie den Überstand in ein sauberes Reaktionsgefäß.
- Unter Verwendung einer Mikropipette, übertragen einen kleinen Teil der Probe auf ein Mikrozentrifugenröhrchen für die Quantifizierung von Restpeptidgehalt in Schritt 6; Speichern der Rest bei -80 ° C.
HINWEIS: Das Volumen der reservierten Probe variiert, abhängig von dem BCA-Assay in Schritt 6.1. DiesProbe sollte auf nassem Eis für die sofortige Analyse oder gefroren bei -80 ° C gelagert werden.
6. Bicinchoninsäure (BCA) Assay
- Durchführen eine BCA-Assay, wie durch den Hersteller empfohlen Kit, unter Verwendung von Proben aus dem Schritt 5.4 die Restpeptidkonzentration für jede Probe zu bestimmen.
7. LC-MS
- Mischen Sie 75 & mgr; l von S. aureus - Extrakt mit 75 & mgr; L LC-MS Lösungsmittel B, hergestellt in Schritt 1.4.
- Vortex zu mischen und Spin bei 13.000 × g für 5 min.
- Man gibt 100 & mgr; l Überstand in eine Flüssigchromatographie (LC) und die Kappe Phiole es. Stellen Sie sicher, dass keine Luftblasen in der Probe eingefangen werden.
- Legen Sie die LC - Fläschchen auf die LC-MS - Autosampler und bearbeiten Sie die laufende Liste in der Software „Offline - Worklist - Editor.“
- Füllen Sie den "Sample Namen" (zB Wildtyp-1), "Sample Position" (zB P1-A1), "Method" (zB Formic Acid-negativ Methode) und "Data File" (zB Wildtyp-1) Spalten. Klicken Sie auf die Schaltfläche „Speichern Vorrat“ -Taste. Öffnen Sie die „Mass Spectrometry Data Acquisition Workstation“ Software und geben Sie den zuvor gespeicherten Arbeitsliste. Klicken Sie auf den „Start Vorrat Run“, um die kontinuierliche LC-MS-Messung zu starten.
- Trennen Sie die Proben auf einer Säule, verknüpfen Sie die Spalte mit einer Flugzeit (TOF) Spektrometer und koppelt den TOF-Spektrometer mit dem LC-System. Verwenden einer mobilen Phase Gradient wie folgt: 0-2 min, 85% Lösungsmittel B; 3-5 min, 80% Lösungsmittel B; 6-7 min, 75% Lösungsmittel B; 8-9 min, 70% Lösungsmittel B; 10-11.1 min, 50% Lösungsmittel B; 11,1-14 min, 20% Lösungsmittel B; und 14,1 bis 24 min, 5% Lösungsmittel B; am Ende mit einem 10 min Wieder Äquilibrierungsperiode mit 85% Lösungsmittel B und einer Fließgeschwindigkeit von 0,4 ml min -1.
- Unter Verwendung einer isokratischen Pumpe infundieren eine Referenzmasse Lösung mit dem Durchlauf für den gleichzeitigen Massenachse Kalibrierung zu ermöglichen.
HINWEIS: Dieser Schrittbasiert auf dem Standard-Handbuch TOF-Spektrometer.- Verwenden, um die Mischung aus Essigsäure D4 und Hexakis (1H, 1H, 3H-Tetrafluorpropoxy) Phosphazin als Referenzmasse Lösung auszuführen, um die Echtzeit-Kalibrierung. Verwenden Sie die isokratische Pumpe mit einer Fließgeschwindigkeit von 2,5 ml min -1 für die Infusion.
8. Batch-Korrektur von Ion Counts
- Bezeichnen jede Probe als Referenzprobe für die Chargenkorrektur zu dienen (zB Wildtyp, replizieren 1).
- Berechnen Sie die Summe der Ionenzählungen für alle Metaboliten innerhalb der Referenzprobe. Wiederholen Sie diese Berechnung für alle Proben.
- Unterteilen der Gesamtionenzahl jeder Probe durch die Gesamtionenzahl der Referenzprobe ein Verhältnis zu erzeugen.
- Unterteile die Ionenzahl für jeden Metaboliten in einer Probe durch das Proben- / Bezugsverhältnis eine chargen korrigierten Ionenzahl für jeden Metaboliten zu erhalten.
9. Peptid Normalisierungs
- Divide chargen korrigierte Ionen Zählwerte für jede in Schritt 8 durch die Peptidkonzentration mit dem BCA-Assay in Schritt 6 erhaltenen Probe bestimmt einen normalisierten Wert für jeden Metaboliten zu ergeben.
HINWEIS: Die normalisiert, batch-batch korrigierten Ionenzählungen für jeden Metaboliten in Schritt 9.1 kann direkt zwischen Stämmen und einem statistischen Analyse (zB einem Mann-Whitney U - Test) verglichen werden. Alternativ bekannt, dass ein Metabolit unverändert entweder durch die Behandlung oder genetischen Hintergrund sein kann als Normalisierungseinrichtung verwendet werden, um Veränderungen zu erkennen, durch Zersetzung Metaboliten. Die Aufnahme einer bekannte Menge an L-Norvalin oder gluraric Säure in dem Extraktionspuffer kann verwendet werden für den Verlust während der Probenverarbeitung 34 zu korrigieren.
Ergebnisse
Wir haben während der in - vitro - Wachstum in einem reichen komplexen Medium intrazellulären Stoffwechselprodukt- Pools in S. aureus analysiert. Als Beweis für das Prinzip, verglichen wir Metabolitprofilen zwischen dem Methicillin-empfindlicher S. aureus Osteomyelitis isoliert UAMS-1 (Wildtyp [WT]) und einen isogenen Stamm , der den global Transkriptionsregulator CodY (Δ codY) 26 fehlt. Steady-state, exponentielle Kulturen der WT und codY Stämme wurden in TSB - Medium etabliert, wie in Schritt 2 des Protokolls beschrieben. Das Wachstumsverhalten der Wildtyp und Mutante codY - Null - Kulturen waren ähnlich, mit nur leichten Unterschiede in Wachstumsausbeute und Rate (Abbildung 1). Verwendung von RNA-Seq und Microarray - Technologie, offenbarten , dass wir und andere mehr Gene , die für die an der Biosynthese von Aminosäuren aus Aspartat abgeleitet beteiligten Enzymen wurden in dem mutierten c - Null codY de-reprimiertompared zu WT - Zellen während der in - vitro - Wachstum in TSB (Figur 2) 25, 27, 30. Außerdem, 30, 35 und brnQ1 brnQ2, die für Verzweigtkettige Aminosäuren Permeasen, sind in der codY- Nullmutante überexprimiert.
Um festzustellen, inwieweit die steady-state intrazellulärem Abundanzen von Metaboliten mit diesem Weg verbunden sind, in der Nullmutante verändert, führen wir LC-MS-basierten Metabolit Profilierung. WT und codY- null mutierten Zellen wurden auf biologische eingeschwungenen Zustand wachsen gelassen und wurden , wie in Schritt 4 des Protokolls beschrieben abgetastet. Wir stellten fest, Metabolit Abundanz durch die Peakfläche Ionenintensität für jeden chromatographisch aufgelöst Metaboliten Integration eines analytischen Software-Paket (siehe Materialliste) verwendet wird. Wir korrigiert für differenzen in Biomasse durch Metabolit Abundanzen der Restpeptidkonzentration jeder Probe normalisiert. Wir korrigierten ferner diese Werte für mögliche chargenWirkungen zwischen den Proben von in jeder Probe für alle Metaboliten, die die durchschnittliche Ionenzahl zu berechnen und um die Wildtyp-Probe als Referenzwert verwendet wird. Dieser Ansatz zwischen den Stichproben Vergleiche von Metaboliten Abundanzen über Bedingungen aktiviert. Inter-Metabolit Vergleiche innerhalb einer gegebenen Probe können auf ähnliche Weise, indem zuerst normalisiert Metaboliten Abundanzen von Ionen-Zählungen erreicht werden, um das Verfahren der Standardaddition Molmengen verwendet.
Wir haben das Niveau der Schlüsselzwischenprodukte bei der Aspartat - Weg in UAMS-1 verglichen und seine codY- Nullmutante. Wie in 3 zu sehen ist , werden die Endprodukte dieses Weges (zB Threonin und (iso) -leucin) sind reichlich vorhanden in codY - Null - Mutanten - Zellen, während Vorstufen (zBAspartat und o acetyl Homoserin) sind reichlich vorhanden in WT - Zellen. Die kombinierte Hochregulation von BrnQ Permeasen 36 und der ILV Biosyntheseweg führt wahrscheinlich zu einem Anstieg in Isoleucin und Leucin 30. Obwohl die Unterschiede relativ klein sind (<4-fach), LC-MS-basierte Quantifizierung und Batch-Korrektur zeigen robust und statistisch signifikante Veränderungen, die durch CodY vermittelte mit Transkriptions Veränderungen konsistent sind.
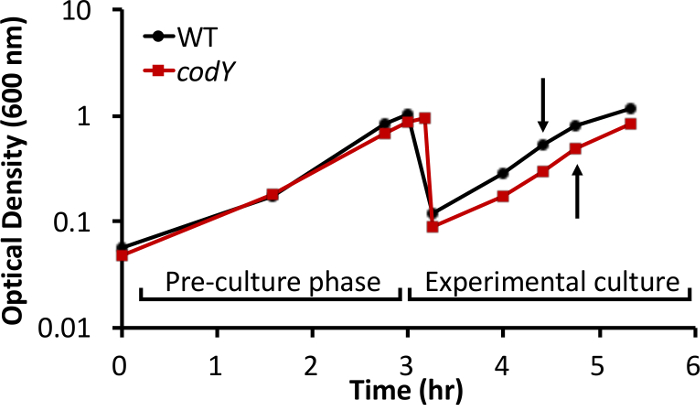
Abbildung 1: Wachstumsverhalten von S. aureus UAMS-1 und ein isogenen codY - Null - Mutante in TSB. Zu verlängern waren die Zeit , die aufgewendet Zellen im steady-state exponentiellen Wachstum, Kulturen rückverdünnter zu einer optischen Dichte von 0,05 in frischem Medium , nachdem die Vorkulturen eine OD 600 von ~ 1 gelöst. Die Proben für die LC-MS-Analyse wurden gesammelt Metabolitaus experimentellen Kulturen bei einer optischen Dichte von ~ 0,5 (Pfeile). Die gezeigten Daten sind repräsentativ für drei biologische nachbildet.

Abbildung 2: Schematische Darstellung von ausgewählten Metaboliten aus Aspartat abgeleitet. Genen und Operons, deren Produkte katalysieren die Synthese von Aspartat-Familie Aminosäuren in Kursivschrift angegeben sind; die Erhöhung der Transkript Fülle in einem codY - Null - Mutante zum Wildtyp verglichen, wie 29 von RNA-Seq - Analyse bestimmt, ist auch anzumerken. DHP, 2,6-diaminoheptanedioate (2,6-Diaminopimelat).

Abbildung 3: Häufigkeiten von Metaboliten in der Aspartat - Familie wird in einem codY Mutante verändert. Die log 2 -fach Änderungen ausgewählter Metaboliten in dercodY- Nullmutante im Vergleich zu UAMS-1 (WT) gezeigt. Die Änderung wurde durch Division die durchschnittliche Häufigkeit von drei Replikaten der biologischen codY- null Dehnung durch die durchschnittliche Abundanz von drei biologischen Replikaten des WT - Stammes bestimmt. Der Standardfehler zwischen biologischen Replikaten für jeden Metaboliten betrug <35%. Die gestrichelten Linien zeigen ein Protokoll 2 1,5-fache Veränderung, die Cutoff in diesem Experiment verwendet.
Diskussion
Alle kleinen Molekül-Metaboliten werden in zentralen Stoffwechselwege miteinander über ihren gemeinsamen Ursprung verbunden. Während des exponentiellen Wachstums sind Bakterienzellen in biologischen und metabolischen eingeschwungenen Zustand eine Momentaufnahme des physiologischen Zustands unter spezifischen Bedingungen bereitzustellen. CodY überwacht Nährstoff Hinlänglichkeit durch zu ILV und GTP reagieren. Als ILV und GTP - Pools Tropfen, wahrscheinlich CodY Aktivität progressiv verringert, um die Expression von Zielgenen seiner Einstellung zur Erhöhung der Nährstoffverarmung 30 anzupassen. Ein CodY-defizienter Stamm verhält , als ob ILV GTP und aus der Umgebung aufgebraucht sind , sondern nur weist einen sehr milden Unterschied in Wachstumsverhalten relativ zu der CodY-bewandert Stamm (Abbildung 1). Somit liefert der Vergleich der Steady-State-Pool von Metaboliten in diesen Stämmen uns eine einzigartige Gelegenheit, um das Ausmaß zu offenbaren, zu dem Stoffwechsel neu konfiguriert wird, wenn Nährstoffe knapp sind. Es ist zu beachten, dass our Experimente untersuchen Metaboliten Abundanzen wenn CodY Aktivität maximiert wird (ILV und GTP sind am häufigsten in der exponentiellen Phase). Jedoch können auch andere Fragen in anderen Phasen des Wachstums angegangen werden. Zum Beispiel in der exponentiellen Phase ist Tricarbonsäure (TCA) -Zyklus Aktivität sehr niedrig; in post-exponentiellen Phase wird der TCA - Zyklus 36 aktiviert. Eine Anzahl von Phänotypen, einschließlich Metaboliten Abundanzen, sind auf diese Aktivierung abhängig ist. Zusätzlich wird das agr Quorum sensing - System ist während des Übergangs von exponentiellem Wachstum bis zur stationären Phase 37. Sammeln von Proben in post-exponentiellen oder stationären Phase kann mehr relevant für Studien, die diese Themen Adressierung sein. Unabhängig davon , wann die Proben geerntet werden, ist es wichtig , zu sammeln, waschen und zu übertragen , die Proben in den Extraktionspuffer so schnell wie möglich (dh innerhalb s) , um den Stoffwechselumsatz zu minimieren , das auftritt , wenn stationärer Zustand gestörter.
Das chromatographische hier beschriebenen Verfahren sind besonders geeignet zur Analyse von polaren und unpolaren Aminosäuren und zentrale Kohlenstoffmetabolismus Verbindungen. Allerdings kann weiteres klassenspezifische Verfahren verwendet werden, um spezifische Verbindungen von Interesse zu quantifizieren nicht chromatographisch durch dieses Verfahren gelöst. Zum Beispiel kann die Änderung der pH - Wert der mobilen Phase durch chromatographische Ameisensäure mit Essigsäure ersetzt als Additiv wurde berichtet , 38 , um die Auflösung von Isoleucin und Leucin zu ermöglichen. Das Extraktionsverfahren modifizieren kann in ähnlicher Weise die Wiederherstellung und die Quantifizierung von labilen Metaboliten ermöglichen, die hier verwendet, um das Extraktionsverfahren empfindlich sind. Zum Beispiel können Verbindungen, wie Cystein , das zur Bildung von Disulfidbrücken neigen können potenziell mit Ellman-Reagenz 39 folgende Derivatisierung zurückgewonnen werden. Anschwänzen Extraktionspuffer mit Stickstoffgas kann NAD + NADH erhalten undVerhältnisse, so dass für eine Bewertung des zellulären Redox - Zustandes 40. Nukleosidtriphosphate können in Grund- oder ungepufferte Lösungen zersetzen; die Extraktionslösung Ansäuern kann die Rückgewinnung dieser Moleküle 41 verbessern.
In einer exponentiell wachsenden Bakterienkultur, die Depletion von einem oder mehreren Nährstoffen führt zu dem Übergang zu den post-exponentiellen und stationären Phasen des Wachstums. Diese Wachstumsphasen sind durch unterschiedliche Stoffwechselzustände 42 gekennzeichnet. Chemostat-basierte Kulturen erzeugen eine nahezu kontinuierliche biologischen eingeschwungenen Zustand ideal für die Genexpression und physiologischen Untersuchungen. Jedoch erfordert das Verfahren spezielle Ausrüstung, ist technisch anspruchsvoll und erfordert, dass eine Nährstoffbegrenzung eine stabile Population von Zellen unter Strömung aufrechtzuerhalten aufgezwungen werden. Die letztgenannte Anforderung verursacht Transkriptions und physiologische Störungen durch andere Faktoren als die Variable oder Wiedergulator analysiert. Um sicherzustellen, dass unsere Kolben-basierten Ergebnisse sind repräsentativ für Zellen exponentiell im stationären Zustand wachsen und nicht von einem Übergang zwischen zwei Phasen, beschäftigen wir eine doppelte Rückverdünnungsstrategie mit einem einheitlichen Kolben: Volumenverhältnis (geringe Veränderungen des Sauerstoffgehalt kann dazu führen, veränderter Metabolismus 36, 42). Nach einer anfänglichen Verdünnung der Übernachtkulturen werden diese Zellen auf einen OD 600 von ~ 1,0, rück verdünnt auf einen OD 600 von ~ 0,05, gezüchtet und geerntet , wenn sie eine OD 600 von ~ 0,5 erreicht. Ein solches Verfahren auch verdünnt zytoplasmatischen Molekülen, einschließlich stabiler RNAs während dem Wachstum über Nacht ansammelt. Tatsächlich RNAIII, der Effektor des agr Quorum sensing - System, ist eine solche RNA und reguliert die Expression von einigen der gleichen Gens Targets wie CodY 25, 43, 44. Kumulierte RNAIII kann maskieren CodY-dependent Regulierung, was zu einer Unterschätzung der Stärke der Repression oder Stimulation durch CodY (Sharma und Brinsmade, nicht veröffentlichte Ergebnisse).
Eine Einschränkung dieser Analyse ist, dass sie einen momentanen Einblick in Stoffwechselprodukt Abundanzen innerhalb der Zelle zur Verfügung stellen; keine Schlussfolgerungen können aus den Ergebnissen in Bezug auf Veränderungen im Fluss durch einen bestimmten Weg gezogen werden. Zum Beispiel können die Abundanzen von Lysin und Methionin zwischen den beiden untersuchten Stämmen ändern sich nicht, trotz Derepression der biosynthetischen Enzyme in der codY- null Dehnung (2 und 3). Der codY - Null - Stamm kann in der Tat mehr Lysin und Methionin zu erzeugen, aber sie können sie schnell in andere Verbindungen umgewandelt werden; damit diese Moleküle nicht ansammeln. Mit 13 C- oder 15 N-markiertem Kohlenstoff oder Stickstoffquellen würden uns erlauben , Kohlenstoff und Stickstoff Skeletten durch metabolische Hauptgänge 45 zu folgen , 46.
Wir haben die beschriebenen Verfahren zu erläutern Veränderungen Metabolit pools in S. aureus, B. subtilis 29, Mycobacterium tuberculosis 47 und Enterococcus faecium 48, jedoch ist das Verfahren auf andere Gram-positive und Gram-negative Bakterien können angewendet werden, einschließlich anderer menschliche Krankheitserreger leicht im Labor kultiviert. Tatsächlich kann unerwartete Verbindungen zwischen Stoffwechsel und Virulenz zeigen metabolomic und transkriptomischen Integration von Informationen, die sich auf neue Strategien führen könnten Infektionen zu behandeln.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde teilweise durch einen NIH Pathway to Independence Award (gewähren GM 099.893) und Fakultät Startfonds SRB, sowie ein Forschungsprojekt Grant (gewähren GM 042219) gefördert. Die Geldgeber hatten keine Rolle in Studiendesign, Datenerfassung und Interpretation, oder die Entscheidung, die Arbeit zur Publikation einzureichen.
Materialien
| Name | Company | Catalog Number | Comments |
| Material/Equipmenta | |||
| DeLong Culture Flask (250 mL) | Belco | 2510-00250 | |
| Sidearm Flask, 500 mL | Pyrex | 5340 | |
| 3-hole Rubber Stopper, #7 | Fisher | 14-131E | |
| Stainless Steel Filter holder/frit | VWR | 89428-936 | |
| Petri Dish, 35 mm | Corning | 430588 | Not tissue culture treated |
| Mixed cellulose ester membrane, 0.22 μm pore size | Millipore | GSWP02500 | |
| Impact-resistant tubes, 2 mL | USA Scientific | 1420-9600 | |
| Silica Beads, 0.1 mm | Biospec Products Inc | 11079101Z | |
| Precellys 24 homogenizer | Bertin Instruments | EQ03119-200-RD000.0 | |
| Micro BCA Protein Assay Kit | Pierce (Thermo Scientific) | 23235 | |
| Cogent Diamond hydride type C column | Agilent | 70000-15P-2 | |
| Accurate-Mass Time-of-Flight (TOF) LC-MS, 6200 Series | Agilent | G6230B | |
| Quat Pump, 1290 Series | Agilent | G4204A | |
| Bin Pump, 1290 Series | Agilent | G4220A | |
| Valve Drive, 1290 Series | Agilent | G1107A | |
| Isocratic Pump, 1290 Series | Agilent | G1310B | |
| TCC, 1290 Series | Agilent | G1316C | |
| Sampler, 1290 Series | Agilent | G4226A | |
| Thermostat, 1290 Series | Agilent | G1330B | |
| Chemical | |||
| Tryptic Soy Broth | Becton Dickinson | 211825 | |
| Difco Agar, Granulated | Becton Dickinson | 214530 | Solid media contains 1.5% [w/v] agar |
| Phosphate-buffered saline (pH 7.4) 10x | Ambion | AM9624 | Dilute fresh to 1x with ultra-pure water |
| Acetonitrile | Fisher Scientific | A955-500 | Optima LC-MS |
| Methanol | Fisher Scientific | A456-500 | Optima LC-MS; toxic |
| Formic Acid | Sigma Aldrich | 94318 | For mass spectrometry, 98% |
| Software | |||
| MassHunter | Agilent | G3337AA | |
| Bacterial Strain | Species | Strain | Genotype |
| SRB 337 | Staphylococcus aureus | USA200 MSSA UAMS-1 | wild type |
| SRB 372 | Staphylococcus aureus | USA200 MSSA UAMS-1 | ΔcodY::erm |
| aChemicals and materials listed are specific to the method described and do not include standard laboratory chemicals or supplies. | |||
Referenzen
- Hood, M. I., Skaar, E. P. Nutritional immunity: transition metals at the pathogen-host interface. Nat. Rev. Microbiol. 10 (8), 525-537 (2012).
- Weinberg, E. D. Clinical enhancement of nutritional immunity. Comp. Ther. 1 (5), 38-40 (1975).
- Ibberson, C. B., et al. Staphylococcus aureus hyaluronidase is a CodY-regulated virulence factor. Infect. Immun. 82 (10), 4253-4264 (2014).
- Lee, C. Y., Iandolo, J. J. Mechanism of bacteriophage conversion of lipase activity in Staphylococcus aureus. J. Bacteriol. 164 (1), 288-293 (1985).
- Olson, M. E., et al. Staphylococcus aureus nuclease is an SaeRS-dependent virulence factor. Infect. Immun. 81 (4), 1316-1324 (2013).
- Somerville, G. A., Proctor, R. A. At the crossroads of bacterial metabolism and virulence factor synthesis in Staphylococci. Microbiol. Mol. Biol. Rev. 73 (2), 233-248 (2009).
- Seidl, K., et al. Staphylococcus aureus CcpA affects virulence determinant production and antibiotic resistance. Antimicrob. Agents Chemother. 50 (4), 1183-1194 (2006).
- Richardson, A. R., Somerville, G. A., Sonenshein, A. L. Regulating the intersection of metabolism and pathogenesis in Gram-positive bacteria. Microbiol. Spectr. 3 (3), 1-27 (2015).
- Geiger, T., et al. Role of the (p)ppGpp synthase RSH, a RelA/SpoT homolog, in stringent response and virulence of Staphylococcus aureus. Infect. Immun. 78 (5), 1873-1883 (2010).
- Gaupp, R., et al. RpiRc is a pleiotropic effector of virulence determinant synthesis and attenuates pathogenicity in Staphylococcus aureus. Infect. Immun. 84 (7), 2031-2041 (2016).
- Serror, P., Sonenshein, A. L. Interaction of CodY, a novel Bacillus subtilis DNA-binding protein, with the dpp promoter region. Mol. Microbiol. 20 (4), 843-852 (1996).
- Sonenshein, A. L. CodY, a global regulator of stationary phase and virulence in Gram-positive bacteria. Curr. Opin. Microbiol. 8 (2), 203-207 (2005).
- Brinsmade, S. R. CodY, a master integrator of metabolism and virulence in Gram-positive bacteria. Curr. Genet. , (2016).
- Molle, V., et al. Additional targets of the Bacillus subtilis global regulator CodY identified by chromatin immunoprecipitation and genome-wide transcript analysis. J. Bacteriol. 185 (6), 1911-1922 (2003).
- Moses, S., et al. Proline utilization by Bacillus subtilis: Uptake and catabolism. J. Bacteriol. 194 (4), 745-758 (2012).
- Lobel, L., Herskovits, A. A. Systems level analyses reveal multiple regulatory activities of CodY controlling metabolism, motility, and virulence in Listeria monocytogenes. PLoS Genet. 12 (2), 1-27 (2016).
- Belitsky, B. R., Sonenshein, A. L. CodY-mediated regulation of guanosine uptake in Bacillus subtilis. J. Bacteriol. 193 (22), 6276-6287 (2011).
- den Hengst, C. D., Buist, G., Nauta, A., Van Sinderen, D., Kuipers, O. P., Kok, J. Probing direct interactions between CodY and the oppD promoter of Lactococcus lactis. Microbiol. 187 (2), 512-521 (2005).
- Fisher, S. H. Regulation of nitrogen metabolism in Bacillus subtilis: vive la différence. Mol. Microbiol. 32 (2), 223-232 (1999).
- Dineen, S. S., McBride, S. M., Sonenshein, A. L. Integration of metabolism and virulence by Clostridium difficile CodY. J. Bacteriol. 192 (20), 5350-5362 (2010).
- Dineen, S. S., Villapakkam, A. C., Nordman, J. T., Sonenshein, A. L. Repression of Clostridium difficile toxin gene expression by CodY. Mol. Microbiol. 66 (1), 206-219 (2007).
- Hendriksen, W. T., et al. CodY of Streptococcus pneumoniae: Link between nutritional gene regulation and colonization. J. Bacteriol. 190 (2), 590-601 (2008).
- Bennett, H. J., et al. Characterization of relA and codY mutants of Listeria monocytogenes: Identification of the CodY regulon and its role in virulence. Mol. Microbiol. 63 (5), 1453-1467 (2007).
- Stenz, L., Francois, P., Whiteson, K., Wolz, C., Linder, P., Schrenzel, J. The CodY pleiotropic repressor controls virulence in Gram-positive pathogens. FEMS Immunol. and Med. Microbiol. 62 (2), 123-139 (2011).
- Majerczyk, C. D., et al. Direct targets of CodY in Staphylococcus aureus. J. Bacteriol. 192 (11), 2861-2877 (2010).
- Majerczyk, C. D., Sadykov, M. R., Luong, T. T., Lee, C., Somerville, G. A., Sonenshein, A. L. Staphylococcus aureus CodY negatively regulates virulence gene expression. J. Bacteriol. 190 (7), 2257-2265 (2008).
- Pohl, K., et al. CodY in Staphylococcus aureus: A regulatory link between metabolism and virulence gene expression. J. Bacteriol. 191 (9), 2953-2963 (2009).
- Sonenshein, A. L. Control of key metabolic intersections in Bacillus subtilis. Nat. Rev. Microbiol. 5 (12), 917-927 (2007).
- Brinsmade, S. R., et al. Hierarchical expression of genes controlled by the Bacillus subtilis global regulatory protein CodY. Proc. Nat. Acad. Sci. U.S.A. 111 (22), 2-7 (2014).
- Waters, N. R., et al. A spectrum of CodY activities drives metabolic reorganization and virulence gene expression in Staphylococcus aureus. Mol. Microbiol. 101 (3), 495-514 (2016).
- Zhou, B., Xiao, J. F., Tuli, L., Ressom, H. W. LC-MS-based metabolomics. Mol. Biosyst. 8 (2), 470-481 (2012).
- Somerville, G. A., et al. Staphylococcus aureus aconitase inactivation unexpectedly inhibits post-exponential-phase growth and enhances stationary-phase survival. Infect. Immun. 70 (11), 6373-6382 (2002).
- Somerville, G. A., Said-Salim, B., Wickman, J. M., Raffel, S. J., Kreiswirth, B. N., Musser, J. M. Correlation of acetate catabolism and growth yield in Staphylococcus aureus: Implications for host-pathogen interactions. Infect. Immun. 71 (8), 4724-4732 (2003).
- Brinsmade, S. R., Kleijn, R. J., Sauer, U., Sonenshein, A. L. Regulation of CodY activity through modulation of intracellular branched-chain amino acid pools. J. Bacteriol. 192 (24), 6357-6368 (2010).
- Kaiser, J. C., Omer, S., Sheldon, J. R., Welch, I., Heinrichs, D. E. Role of BrnQ1 and BrnQ2 in branched-chain amino acid transport and virulence in Staphylococcus aureus. Infect. Immun. 83 (3), 1019-1029 (2015).
- Ledala, N., Zhang, B., Seravalli, J., Powers, R., Somerville, G. A. Influence of iron and aeration on Staphylococcus aureus growth, metabolism, and transcription. J. Bacteriol. 196 (12), 2178-2189 (2014).
- Novick, R. P. Autoinduction and signal transduction in the regulation of staphylococcal virulence. Mol. Micorbiol. 48 (6), 1429-1449 (2003).
- Pesek, J. J., Matyska, M. T., Fischer, S. M., Sana, T. R. Analysis of hydrophilic metabolites by high-performance liquid chromatography-mass spectrometry using a silica hydride-based stationary phase. J. Chromatog. A. 1204 (1), 48-55 (2008).
- Guan, X., Hoffman, B., Dwivedi, C., Matthees, D. P. A simultaneous liquid chromatography/mass spectrometric assay of glutathione, cysteine, homocysteine and their disulfides in biological samples. J. Pharm. Biomed. Anal. 31 (2), 251-261 (2003).
- Sporty, J. L., Kabir, M. M., Turteltaub, K. W., Ognibene, T., Lin, S. J., Bench, G. Single sample extraction protocol for the quantification of NAD and NADH redox states in Saccharomyces cerevisiae. J. Sep. Sci. 31 (18), 3202-3211 (2008).
- Rabinowitz, J. D., Kimball, E. Acidic acetonitrile for cellular metabolome extraction from Escherichia coli. Anal. Chem. 79 (16), 6167-6173 (2007).
- Somerville, G. A., Powers, R. Growth and preparation of Staphylococcus epidermidis for NMR metabolomic analysis. Methods Mol. Biol. 1106, 71-91 (2014).
- Roux, A., Todd, D. A., Velazquez, J. V., Cech, N. B., Sonenshein, A. L. CodY-Mediated regulation of the Staphylococcus aureus Agr system integrates nutritional and population density signals. J. Bacteriol. 196 (6), 1184-1196 (2014).
- Guillet, J., Hallier, M., Felden, B. Emerging functions for the Staphylococcus aureus RNome. PLoS Pathog. 9 (12), 1003767 (2013).
- Sauer, U., et al. Metabolic flux ratio analysis of genetic and environmental modulations of Escherichia coli central carbon metabolism. J. Bacteriol. 181 (21), 6679-6688 (1999).
- Niittylae, T., Chaudhuri, B., Sauer, U., Frommer, W. B. Comparison of Quantitative Metabolite Imaging Tools and Carbon-13 Techniques for Fluxomics. Methods Mol. Biol. 553 (1), 355-372 (2009).
- de Carvalho, L. P. S., Fischer, S. M., Marrero, J., Nathan, C., Ehrt, S., Rhee, K. Y. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17 (10), 1122-1131 (2010).
- Weisenberg, S. A., Butterfield, T. R., Fischer, S. M., Rhee, K. Y. Suitability of silica hydride stationary phase, aqueous normal phase chromatography for untargeted metabolomic profiling of Enterococcus faecium and Staphylococcus aureus. J. Sep. Sci. 32 (13), 2262-2265 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten