Method Article
Ein vereinfachtes System zur Bewertung der Zell Mechanosensing und Durotaxis
In diesem Artikel
Zusammenfassung
Many mammalian cells preferentially migrate towards a more rigid matrix or substrate through durotaxis. The goal of this protocol is to provide a simple in vitro system that can be used to study and manipulate cell durotaxis behaviors by incorporating polydimethylsiloxane (PDMS) substrates of defined rigidity, interfacing with glass coverslips.
Zusammenfassung
Die Zusammensetzung und die mechanischen Eigenschaften der extrazellulären Matrix sind sehr variabel zwischen Gewebetypen. Diese Bindegewebsstroma Vielfalt großen Einfluss auf das Zellverhalten normalen und pathologischen Prozessen, einschließlich der Zellproliferation, Differenzierung, Adhäsion Signalisierung und gerichtete Migration zu regulieren. In dieser Hinsicht ist die angeborene Fähigkeit von bestimmten Zelltypen, auf eine steifere oder weniger nachgiebig Matrixsubstrat wird als durotaxis bezeichnet migrieren. Dieses Phänomen spielt eine wichtige Rolle in der Embryonalentwicklung, Wundheilung und Invasion von Krebszellen. Hier beschreiben wir einen einfachen Test zur durotaxis studieren, in vitro, mit Polydimethylsiloxan (PDMS) Substraten. Herstellung der beschriebenen durotaxis Kammern schafft eine Steifigkeit Schnittstelle zwischen dem relativ weichen PDMS-Gel und einem starren Deckglas. Im vorliegenden Beispiel haben wir diese durotaxis Kammern verwendet, um eine Rolle des cdc42 demonstrieren / Rac1 GTPase aktivierende Protein, cdGAP, in mechanosensing und durotaxis Regulierung im menschlichen U2OS Osteosarkom-Zellen. Dieser Test ist leicht an andere Zelltypen und / oder Zuschlags anderer Proteine von Interesse, ihre jeweiligen Rollen in mechanosignaling und durotaxis erkunden.
Einleitung
Die extrazelluläre Matrix (ECM) besteht aus einer komplexen Reihe von strukturellen und Vernetzungsproteinen einschließlich Kollagen, Fibronectin und Laminin besteht. Es ist zwar bekannt, dass die ECM liefert wichtige strukturelle Unterstützung für Zellgewebe gibt es zunehmend Hinweise darauf, daß Zellen, aktiv auf physikalische Veränderungen zu reagieren in der ECM-Umgebung zu unterschiedlichen zellulären Prozessen, einschließlich der Zellüberlebens, der Differenzierung und der Zellmigration regulieren. Beispielsweise können Unterschiede in der Steifigkeit der ECM mesenchymalen Stammzellen gegenüber verschiedenen Linien fahren, mit weicher Substrate (~ 1 kPa) Förderung neurogene Linien während steife (~ 25 kPa) Substrate fördern osteogene Differenzierung 1. Ähnlich kann eine Erhöhung der Steifigkeit Stromamatrix wurde gezeigt, dass Brust Epithelzelle Tumorigenese und Invasion in das umliegende Gewebe 2,3 fördern.
Ein besonders interessanter Aspekt dieser mechanosignaling Aktivität resultiert in einem Verfahren, wie durotaxis, bei dem Zellen wandern bevorzugt in Richtung eines starren Substrats 4,5 bekannt. Zellen ständig erfassen die physikalischen Eigenschaften ihrer extrazellulären Umgebung durch Integrin-Rezeptor-Bindung an den ECM. Dies wiederum fördert die Ansammlung von zahlreichen strukturellen und Signalproteinen, ihre zytoplasmatischen Domänen, die Bildung von Klebstoff fokalen Adhäsionen oder fokalen Kontakten 6,7 bekannten Strukturen zu fahren. Da Integrine haben keine inhärente enzymatische Aktivität werden Signale von der ECM durch diese Hilfsproteine übertragen, um die Antwort der Zelle auf ihre sich verändernden Umwelt 8 koordinieren. Dementsprechend ist die Identifizierung und Charakterisierung der Schlüsselproteinen regulieren mechanosignaling und durotaxis involviert ein wichtiges Forschungsgebiet.
Verschiedene Modellsysteme entwickelt worden, um zu studieren durotaxis in vitro, aber die meisten habenverwendet kollagenbeschichteten Polyacrylamid Substrate 4. Jedoch kann die Vorbereitung der Polyacrylamid Substrate technisch anspruchsvoll sein und das Kollagen in diesen Assays verwendet werden, müssen chemisch vernetzt mit dem Substrat 9 ist. Polydimethylsiloxan (PDMS) Substrate wurde gezeigt, dass vergleichbare mechanische Eigenschaften wie die Polyacrylamid Substrate 10 aufweisen. Jedoch PDMS Substraten durch einfaches Mischen ein Verhältnis der Base zu Vernetzer hergestellt, und diese Substrate können mit ECM-Proteine ohne die Notwendigkeit für eine chemische Vernetzung beschichtet werden, wodurch eine einfachere PDMS Werkzeug, um die Wirkungen der Steifheit auf das Zellverhalten zu untersuchen. Hier beschreiben wir, wie eine einfache durotaxis Kammer, in der ein weiches PDMS-Substrat mit einem starren Deckglas integriert vorzubereiten.
Der Test, wie unten beschrieben, bietet eine schnelle und einfache Methode, um durotaxis studieren. Für diese Studie menschlichen U2OS Osteosarkom-Zellen in Kombination mit siRNA-vermittelten verwendeten wirKnockdown von cdGAP, um die Rolle dieser focal adhesion protein in durotaxis 11 zu studieren. Wichtiger ist, daß dieses Protokoll leicht den individuellen Bedürfnissen angepasst werden. Andere Zelltypen können für die U2OS-Zellen ersetzt werden und jedes Protein kann abgerissen oder überexprimiert wird, um die Auswirkungen auf das Zellverhalten während durotaxis bestimmen. Weiterhin kann das Protokoll angepasst ist, um fluoreszent markierte Proteine enthalten, um ihre Dynamik und das Verhalten mit FRAP oder FRET Ansätze analysiert werden.
Protokoll
1. Herstellung von Durotaxis Chambers
- Einem 6-Loch-Gewebekulturplatte herzustellen, tarieren Sie die Waage mit einem 50-ml konischen Röhrchen. Man wiegt etwa 10 g des PDMS-Grundlösung in der 50-ml-Tube (die Lösung ist ziemlich viskos).
- Für ein 90: 1 Substrat (Einhaltung von ~ 1 kPa), unterteilen das gemessene Gewicht des PDMS-Grundlösung in der Röhre um 90, um die richtige Menge an Vernetzer-Lösung benötigt bestimmen. Die berechnete Menge des PDMS-Vernetzer-Lösung auf die gleiche Röhre.
Beispiel: 10 g / 90 = 0,11 g. In 0,11 g des PDMS-Vernetzer-Lösung auf den PDMS-Basislösung.
HINWEIS: Die Basis und Vernetzungslösungen werden sowohl in der PDMS-Kit zur Verfügung gestellt. - Kräftig mischen die PDMS-base / Vernetzer-Mischung für 5 min bei RT mit einem kleinen Spachtel. In diesem Stadium wird die Mischung einer großen Anzahl von Luftblasen enthält.
- Zentrifugieren Sie die PDMS-Substrat in einer Tischzentrifuge 5 min bei 50 × g bei RT, die bub entfernenbles. Wenn es noch Blasen nach 5 min, Zentrifuge erneut.
- Pipette 1 ml 90: 1 PDMS Substrat in jede Vertiefung der Gewebekultur behandelten Platte mit 6 Vertiefungen. Eventuell verbleibende Luft in den PDMS vorhanden Blasen können in dieser Phase durch knallen sie mit einer 21 G-Nadel beseitigt werden. Ermöglichen, dass die PDMS für 30 min in der gut verteilen.
- Boil 12 mm Glas # 1 Deckgläser in destilliertem Wasser für 5 min. Wiederholen Sie zweimal, und speichern Sie die Deckgläser in destilliertem Wasser.
- Legen Sie ein, getrocknet Deckglas in jede Vertiefung der Gewebekulturplatte durch leichtes Berühren einer Seite des Deckglases in die PDMS-Lösung fallen dann das Deckglas auf die PDMS. Als das Deckglas gelegt hat, wird die PDMS beginnen, um die Kanten des Deckglases über eingreifen, aber nicht vollständig abdecken. Dies wird eine Schnittstelle zwischen den PDMS und Glas nach dem Härten erzeugen (siehe 1A, B).
- Die Platte bei 70 ° C in einem Ofen für 16 Stunden, um zu heilen (verhärten) die PDMS. Setzen Sie den plate in einer Zellkultur Kapuze und UV Sterilisation für 10 Minuten.
HINWEIS: Am besten ist es, um die Platten innerhalb von ein paar Tagen der Anwendung zu machen. Jedoch können die Platten in Parafilm ohne Puffer eingewickelt und bei 4 ° C für bis zu 2 Wochen ohne nennenswerten Qualitätsminderung gelagert werden.
2. Zell Plating
HINWEIS: Wenn die Untersuchung der Wirkung von siRNA-vermittelten Knockdown, führen Sie die Zuschlags mit den Anweisungen des Herstellers oder des optimierten Protokoll für den Zelltyp der Wahl.
- Mantel jeweils durotaxis Kammer mit 1 ml von 10 ug / ml Fibronektin in PBS ohne Calcium und Magnesium für 1 h bei 37 ° C. Alternativ kann das Fibronektin kann den Tag vor der Analyse durch Inkubation der PDMS mit 10 ug / ml Fibronektin in PBS für 16 Stunden bei 4 ° C angewendet werden. Sicherzustellen, dass die gesamte Oberfläche der Fibronektin in PBS-Lösung eingetaucht.
- Bereiten hitzedenaturierte 1% BSA. Wiege 0,5 g BSA und löst ihn in 50 ml PBS.Filter sterilisiert die Lösung durch ein 0,22 um Filter und Hitze bei 80 ° C für 12 min.
Hinweis: Diese Lösung ist der Tag vor dem Beschichten und bei 4 ° C Zelle. - Saugen Sie das Fibronektin-Lösung und wäscht 3 mal mit PBS. 1 ml der hitzedenaturierten BSA in PBS in jede Vertiefung und Inkubation für 30 min bei RT.
- Trypsinize und zählen Zellen der Wahl, während die durotaxis Kammern sind mit der Hitze denaturiert BSA blockiert.
- Platte 1 x 10 5 Zellen in einem Volumen von 2 ml in jede Vertiefung der durotaxis Kammer mit dem für den jeweiligen Zelltyp der Wahl erforderlichen Medien. Damit sich die Zellen anhaften und verteilt auf dem Substrat für 4 Stunden in einem befeuchteten Inkubator bei 37ºC mit 5% CO 2.
HINWEIS: U2OS-Zellen werden routinemäßig in DMEM mit 10% FBS, 2 mM L-Glutamin, 1 mM Natriumpyruvat und 10 IU / ml Penicillin, 10 ug / ml Streptomycin ergänzt.
HINWEIS: Die Zellzahl in diesem Beispiel verwendet wird, für eine optimierteU2OS-Zellen. Optimierung für andere Zelltypen erforderlich sein können. Diese Dichte verleiht den Zellen genügend Platz, um ohne signifikante Wechselwirkungen mit anderen Zellen wandern.
3. Bildgebung lebender Zellen
- Führen Sie Live Cell Imaging auf einem inversen Mikroskop mit Phasenkontrast mit einer 10X-Objektiv. Das Mikroskop ist mit einem geschlossenen ökologischen, feuchten Kammer eingebaut werden und ermöglicht die Steuerung der Temperatur bei 37 ° C und 5% CO 2 während einer Langzeitbildgebung.
- Nachdem die Zellen für ca. 3,5 Stunden verteilt, montieren Sie die Platte in das Mikroskop Kammer. Die Probe (n) in die Kammer für 30 Minuten äquilibrieren.
- Up automatisierte Multi-Point-Besuch auf dem Mikroskop falls vorhanden eingestellt. Konzentrieren Sie sich auf der Schnittstelle zwischen den 90: 1 PDMS und dem Deckglas, und wählen Sie Punkte für Bild in der ganzen Oberfläche mit durchschnittlich 40 Punkte pro durotaxis Kammer. Bild die Zellen alle 10 min bis zu 16 h.
HINWEIS: Die WiederRegion von Interesse wird als zwei Zeilen angezeigt wird, mit der Außenleitung, die dem Rand des Deckglases und der Innenleitung entsprechend der tatsächlichen Grenzfläche zwischen den PDMS und dem Deckglas. Siehe Abbildung 1B.
4. Datenanalyse
- Erzeugen Sie eine Tabelle wie in Tabelle 1.
- Zählen die Anzahl der Durchgangsereignisse aus den PDMS auf der Glasoberfläche und umgekehrt von jedem Film erzeugt. Notieren Sie die Anzahl der Durchgangsereignisse in der entsprechenden Spalte in der Excel-Tabelle.
HINWEIS: Ein Durchgangsereignis wird als der Zellkern, der über die Grenze zwischen dem PDMS und Glas in jede Richtung definiert. - Um mehrere Übergänge zu quantifizieren, zu zählen, wie oft die Zelle überquerte die Schnittstelle. Diese Nummer in dem Excel-Spalte entsprechend dem Substrat, auf dem die Zelle an dem Ende des Films angeordnet sind, aufgenommen werden. Wiederholen Sie die Analyse für jede Zelle, die die Schnittstelle in t durchquerter Film. Zellen, die während der Bilderzeugung aus dem Sichtfeld zu migrieren auszuschließen.
Anmerkung: Es ist auch wichtig, um zu verifizieren, die durch Zellzählung zu Beginn des Experiments, dass die Zellen der Lage sind, auch für die fibronektinbeschichtete PDMS und Deckglas Oberflächen haften. - Wird der Prozentsatz an Zellen, die aus PDMS auf der Glasoberfläche (dh unterzog durotaxis) migriert. Hinzufügen der Anzahl der Durchgangsereignisse von weich bis hart und den mehreren Durchgangsereignisse, die auf harte und Dividieren durch die Gesamtzahl der Durchgangsereignisse beendet.
- Berechnung des Prozentsatzes der mehrfachen Durchgänge durch Teilen der Anzahl von Mehrfachdurchgängen durch die Gesamtzahl von Übergängen.
Ergebnisse
Ein Schema des durotaxis Kammer ist in 1A gezeigt. Weichen PDMS-Substrat (eine 90: 1 Mischung von PDMS Basis Lösungen Vernetzer) in einer 6 Well-Platte verteilt und ein Deckglas wird oben auf den PDMS, die dann teilweise die obere Oberfläche des Deckglases abdeckt angeordnet, wodurch eine Schnittstelle schaffen zwischen den beiden Substraten unterschiedlicher Compliance. Die Steifigkeit des weichen PDMS Substrat ~ 1 kPa, vergleichbar mit der typischen Einhaltung des Hirngewebes ist, während die Steifigkeit von Glas ist etwa 1-2 GPa 1. Ein Phasenkontrastbild der Schnittstelle zwischen dem PDMS und Glas ist durch die weißen Pfeile in 1B gezeigt. Die Sternchen bezeichnen zwei Steuer RNAi Zellen migrieren in Richtung der härteren Substrat. Die Fransen, die zu sehen sind (schwarzer Pfeil) entspricht bis an den Rand des Deckglases.
Um die Daten zu quantifizieren, sollte ein Microsoft Excel-Tabelle, wie in Tabelle 1 erzeugt werden </ strong>. Sollte die Anzahl der Durchgangsereignisse gezählt und in der entsprechenden Spalte organisiert werden. Einige der erzeugten Filme können nicht zur Quantifizierung verwendet werden. Ein Film kann aus Quantifizierung weggelassen werden, wenn es eine Luftblase in den PDMS, das mit einem Zellen Fortschritt stört oder wenn die Zellen zu dicht gepackt, was zu Kollisionen, die Zell Direktionalität drastisch beeinflussen. Zellteilung sollte auch überwacht werden, da dies ebenfalls offen Zellbewegung zu beeinflussen.
In der Regel werden die meisten adhärenten Zelltypen bevorzugt wandern in Richtung einer steiferen Substrat 2,4,12. Zu beginnen, um die molekularen Mechanismen, durch die Zellen auf mechanische Signale in ihrer Umgebung zu verstehen, können spezifische Proteine unten mit siRNA stoßen werden. In unserem Beispiel etwa 70% der Kontroll-siRNA-behandelten Zellen zeigten durotaxis 2A. Im krassen Gegensatz dazu, wenn cdGAP wurde abgerissen mit RNAi hatten die Zellen keine Präferenzdarüber, ob sie auf die harte oder weiche Substrat 2A migriert. Darüber hinaus überquerte die cdGAP Zuschlagszellen die Grenze mehrmals, während Steuer siRNA behandelten Zellen in der Regel nur die Grenze einmal, 2B gekreuzt. Repräsentative Spuren der Kontroll-siRNA-Zellen zeigen, dass die Zellen wandern in der Regel über die Grenze einmal und bevorzugt blieb auf der steifere Oberfläche im Vergleich zu cdGAP siRNA behandelten Zellen, die nicht über eine Präferenz für entweder Steifigkeit nicht nachweisen, und die Grenze mehrmals 2C gekreuzt.
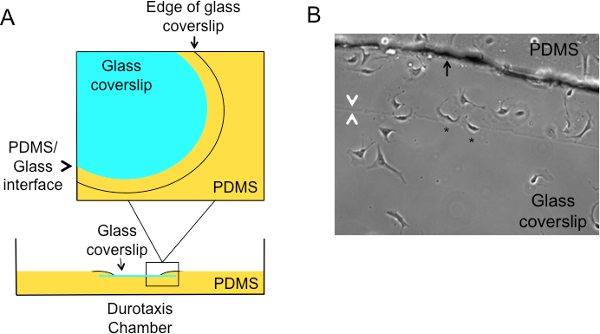
Abbildung 1. Schematische Darstellung des Durotaxis Kammer einzurichten. (A) Weiche PDMS wird in jede Vertiefung einer 6-Well-Platte verteilt und ein Deckglas auf der Oberseite des PDMS platziert. PDMS wird über die Seiten der Oberseite des Deckglases eingreifen, befErz härtet, um eine Schnittstelle zwischen den zwei Substraten zu bilden. Durotaxis wird, indem man die Richtungsabhängigkeit der Zellen über den PDMS / Glas-Grenzfläche bestimmt. (B) Repräsentative Phasenkontrastbild, das die Schnittstelle zwischen den weichen PDMS und starre Glassubstrat. Die Sternchen zeigen Steuer RNAi behandelten U2OS-Zellen unterzogen durotaxis. Die weißen Pfeile bezeichnen die Schnittstelle zwischen den PDMS und Deckglas und der Pfeil zeigt die Kante des Deckglas unter den PDMS. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

. Tabelle 1 Schematische Darstellung der Microsoft Excel-Tabelle einzurichten Spalten werden gegründet, um den Film Nummer, siRNA verwendet, die Anzahl der Zellen, die von den weichen PDMS migriertstarre Glassubstrat oder umgekehrt, sowie die Gesamtzahl der Zellen analysiert. Spalten werden auch für die Zellen, die die Schnittstelle mehrmals überqueren und am Ende entweder auf den weichen PDMS oder dem Glassubstrat gesetzt. Wenn eine Zelle über die Grenze mehrmals wandert, wird die Anzahl der Mehrfachdurchgangsereignisse dieser Zellen in der Spalte des Substrats, auf dem die Zelle an dem Ende des Films angeordnet sind, aufgenommen.

Abbildung 2. Knockdown von cdGAP in U2OS-Zellen führt zu einem Verlust der durotaxis. (A) Kontroll-siRNA behandelten Zellen wandern bevorzugt auf die starre Glassubstrat, während cdGAP siRNA behandelten Zellen fanden keine Vorlieben aufweisen. (B) Steuer siRNA behandelten Zellen überquerte die Grenze zwischen den PDMS und Glas einmal. Allerdings wanderten cdGAP RNAi behandelten Zellen hin und her über die boundary mehrmals. (C) Tracks von repräsentativen Zellen entweder mit Kontrolle behandelt oder cdGAP siRNA wurden unter Verwendung des Hand Tracking Plugin in ImageJ generiert. Die p-Werte wurden unter Verwendung eines Studenten t-Test bestimmt und Fehler Balken stellen die 95% Konfidenzintervall. Mit freundlicher Genehmigung von Wormer et al. 2014 11 wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Hier beschreiben wir eine einfache Test um durotaxis in migrierenden Zellen zu studieren. Eine große Stärke dieses Tests ist die Leichtigkeit der Herstellung der durotaxis Kammern mit PDMS. Die Steifigkeit der Substrate können leicht durch Ändern des Verhältnisses der PDMS-Basislösung zu Vernetzer, das Studium der verschiedenen Steifigkeiten im Assay ermöglicht manipuliert werden. Allerdings ist eine potenzielle Beschränkung des Systems, dass die Zellen nur auf eine einzige Änderung in der Steifigkeit Substrat ausgesetzt, im Gegensatz zu erleben eine Steifigkeit Gradienten, die durch ausgefeiltere Systeme 4 vorgesehen ist. Wichtig ist, dass im Gegensatz zu Polyacrylamid-Substrate sind die ECM-Komponenten müssen nicht chemisch vernetzt sein, um PDMS ist. Tatsächlich ist die Fibronectinbeschichtung ungefähr äquivalent sowohl auf dem PDMS und den Glasoberflächen, wie durch Anfärben mit einem für Fibronektin 11-Antikörper bestimmt. Da frühere Studien haben gezeigt, dass Zellen verhalten sich gleich auf beiden PDMS oder Polyacrylamid Substraten die Verwendung of PDMS Substraten bietet eine viel einfachere Modell, mit dem Mechanotransduktion in Zellen 10,12 studieren.
Der wichtigste Schritt in der Herstellung der PDMS Substraten ist es, sicherzustellen, dass die Basis und die Vernetzungsmittel-Lösungen werden gründlich gemischt. Wenn sie nicht gut genug vermischt, dann werden die Substrate nicht vollständig härten bei Wärmebehandlung. Dies wird in das Deck Sinken zu weit in die PDMS oder das Deck Driften in den PDMS während der Bilderzeugung führen. Wenn die Zentrifugationskraft zu hoch ist, können die Basis und Vernetzers Lösungen in der Röhre zu trennen. Dies kann durch Verringern der Geschwindigkeit der Zentrifugation oder durch Entgasen der Mischung für 30 min unter Verwendung einer Vakuumkammer beseitigt werden. Schließlich ist die Zelldichte kritisch, da zu viele Zellen ihre Fähigkeit zur vollständigen ausbreiten und durch den Kontakt mit benachbarten Zellen durotax ungehindert beeinflussen. Die Dichte hier berichtet wurde U2OS-Zellen optimiert. Wenn jedoch andere Zelltypen verwendet werden, eine optimale cell Zahlen müssen empirisch bestimmt werden.
Wir haben vor kurzem diesen Assay verwendet werden, um zu untersuchen, wie die focal adhesion Signalprotein cdGAP regelt mechanosensing und durotaxis 11. Offensichtlich gibt es zahlreiche zelluläre Komponenten zusätzlich zu fokalen Adhäsionen wie Zytoskelettelementen Proteintransport Komponenten und Ionenkanäle, die in mechanische Signalübertragung beteiligt sind, und somit kann auch die Regulierung der durotaxis 13 bei - 15. Jede dieser Komponenten kann ohne weiteres in unserem System unter Verwendung ähnlicher RNAi Ansätzen ausgewertet werden. Zusätzlich ist dieser Test sehr offen für die Einführung von verschiedenen pharmakologischen Aktivatoren oder Inhibitoren. Der Test kann auch so angepasst, um kompliziertere Formen der Analyse, wie beispielsweise den Einbau von fluoreszenzmarkierten Proteinen, in Kombination mit FRET oder FRAP Ansätze erlauben, um die Proteindynamik und räumlich-zeitlichen Aktivierung zu untersuchen.
Offenlegungen
The authors have no conflicts to disclose.
Danksagungen
Diese Arbeit wird durch NIH R01 GM47607, CA163296 und NSF 1.334.493 um CET unterstützt. Wir danken Mitglieder der Turner-Labor für die kritische Durchsicht des Manuskripts. Alle in diesem Bericht angegebenen Daten wurden durch die Erlaubnis von Wormer et al. 2014 11 wiedergegeben.
Materialien
| Name | Company | Catalog Number | Comments |
| Polydimethylsiloxane (PDMS) | Dow Corning | 3097358-1004 | Sylgard 184 Silicone Elastomer Kit |
| #1 Cover glass 12 mm | Fisher Scientific | 12-545-82 | |
| 6-well plate | Celltreat | 229106 | |
| DMEM | Cellgro | 15-017-CM | |
| L-Glutamine | Cellgro | 25-005-CI | |
| Sodium Pyruvate | Fisher Scientific | BP356-100 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| Fibronectin | BD Biosciences | 610077 | |
| PBS | Invitrogen | 21600-044 | |
| Falcon tubes | Celltreat | 229456 | |
| Fetal Bovine Serum | Atlanta Biologicals | S11150 | |
| Bovine Serum Albumin | Sigma | A7906 | |
| U2OS cells | ATCC | HTB-96 |
Referenzen
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Lo, C. M., Wang, H. B., Dembo, M., Wang, Y. L. Cell movement is guided by the rigidity of the substrate. Biophysical Journal. 79 (1), 144-152 (2000).
- Plotnikov, S. V., Waterman, C. M. Guiding cell migration by tugging. Current Opinion in Cell Biology. 25 (5), 619-626 (2013).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin-cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Balaban, N. Q., et al. Force and focal adhesion assembly: a close relationship studied using elastic micropatterned substrates. Nature Cell Biology. 3 (5), 466-472 (2001).
- Provenzano, P. P., Keely, P. J. Mechanical signaling through the cytoskeleton regulates cell proliferation by coordinated focal adhesion and Rho GTPase signaling. Journal of Cell Science. 124 (8), 1195-1205 (2011).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Prager-Khoutorsky, M., et al. Fibroblast polarization is a matrix-rigidity-dependent process controlled by focal adhesion mechanosensing. Nature Cell Biology. 13 (12), 1457-1465 (2011).
- Wormer, D. B., Davis, K. A., Henderson, J. H., Turner, C. E. The focal adhesion-localized CdGAP regulates matrix rigidity sensing and durotaxis. PloS ONE. 9 (3), e91815(2014).
- Trichet, L., et al. Evidence of a large-scale mechanosensing mechanism for cellular adaptation to substrate stiffness. Proceedings of the National Academy of Sciences. 109 (18), 6933-6938 (2012).
- Eyckmans, J., Boudou, T., Yu, X., Chen, C. S. A hitchhiker’s guide to mechanobiology. Developmental Cell. 21 (1), 35-47 (2011).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Jafar-Nejad, H., et al. Sec15, a component of the exocyst, promotes notch signaling during the asymmetric division of Drosophila sensory organ precursors. Developmental Cell. 9 (3), 351-363 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten