Method Article
吲哚菁绿荧光在复杂腹腔镜胆囊切除术导航中的作用
摘要
该方案概述了荧光引导下腹腔镜胆囊切除术的步骤,并阐明了荧光导航在各种手术场景中的作用。
摘要
腹腔镜胆囊切除术 (LC) 是治疗胆石症和胆囊炎的金标准。在严重炎症和粘连的困难病例中,胆管损伤 (BDI) 的风险明显更高。精确识别解剖胆道结构对于防止此类损伤至关重要。传统的术中可视化技术 (IVT) 由于其复杂性、增加的创伤和高错误率而受到临床应用的限制。利用吲哚菁绿 (ICG) 作为荧光染料的近红外荧光 (NIRF) 成像已成为一种创新的 IVT 技术。它越来越被认为是一种可行、安全和有效的 LC 方法。然而,NIRF 在困难的 LC 程序中的疗效仍不清楚,ICG 给药的最佳时间和剂量尚未确定。本文概述了对急性坏疽性胆囊炎患者进行荧光引导下困难 LC 的主要步骤,并评估了 NIRF 在各种情况下的成像效果。患者仰卧位,放置了四个套管针。切换到荧光模式后,很容易识别荧光标记的胆管。在荧光引导下,仔细解剖 Calot 三角形。在提取胆囊之前,分别识别和夹住胆囊管 (CD) 和囊动脉 (CA)。最后,以荧光模式检查手术区域以检测胆漏。凭借令人满意的 ICG 成像和顺利的手术,患者的术后恢复顺利。NIRF 是一种安全有效的技术,在未来的临床应用中显示出巨大的前景。
引言
全世界大约 20% 的成年人受到胆结石的影响,这可能导致急性胆囊炎——一种痛苦、进展迅速且可能危及生命的疾病1。胆囊炎患者必须及时手术干预。腹腔镜胆囊切除术 (LC) 已被广泛接受为这种情况的标准治疗方法。
然而,传统的手术方法在复杂病例中可能会带来重大挑战。严重的炎症或粘连会使胆道模糊不清,从而增加胆管或动脉意外受伤的风险2。胆管损伤 (BDI) 是这些复杂 LC 程序中最严重和最常见的并发症之一。它通常会导致不可逆转的终生后果,严重时会导致致命后果3。精确识别关键的胆道结构,例如 Calot 三角形,对于促进外科手术和最大限度地减少潜在损伤至关重要4。
传统的术中可视化技术 (IVT) 集成了胆管造影、超声和胆总管镜检查,可实现胆道的实时监测。然而,诸如辐射暴露、显着的误差幅度5 和繁琐的程序等问题阻碍了 IVT 的广泛采用。
近红外荧光 (NIRF) 是一种尖端技术,可通过单个腹腔镜在荧光和白光模式之间轻松切换,从而在手术过程中实现胆道的实时可视化。该技术具有高灵敏度、特异性和组织渗透能力6。NIRF 可有效预防腹腔镜胆囊切除术 (LC) 期间的胆管损伤 (BDI),尤其是在涉及严重炎症或粘连的复杂病例中7。
与传统 IVT 相比,NIRF 更易于实施,提供更清晰的胆道可视化,并且不会造成额外的创伤 8,9,10。其荧光染料吲哚菁绿 (ICG) 已被美国食品药品监督管理局 (Food and Drug Administration) 证明对人类使用是安全的11。ICG 通常在手术前静脉注射;然而,ICG 注射的时间和剂量仍不确定12,13。这些因素是高质量荧光成像的关键决定因素。最佳 ICG 性能可在胆管中实现强荧光信号,同时最大限度地减少肝组织的背景荧光14。
通过广泛的探索,我们确定了 ICG 注射的最佳时间和剂量为术前 45 分钟给药 0.25 mg。本研究旨在证明这种时间和剂量在各种复杂手术场景中的成像效果。
研究方案
本研究是按照中山大学附属第五医院人类研究伦理委员会的指导方针进行的。获得患者参与本研究的书面知情同意书。复杂腹腔镜胆囊切除术 (LC) 的标准包括: 胆囊壁水肿伴增厚 ≥4 mm;坏疽性胆囊炎伴或不伴穿孔;上腹部手术史;胆囊颈嵌塞结石;Mirizzi 综合征或肝外胆管变异;和需要经囊胆总管探查的病例。 材料表中提供了所用试剂和设备的详细信息。
1. 荧光成像准备和患者定位
- 手术前 45 分钟 通过 外周静脉注射给予 0.25 mg ICG。
注:将 1 小瓶 ICG (25 mg) 溶于 10 mL 生理盐水中。将 1 mL 溶液注入 100 mL 生理盐水中进行稀释。手术前 10 分钟 通过 静脉注射给予 45 mL 稀释溶液。 - 设置 DPM-I 荧光系统,一种双通道图像引导设备,可在白光 (380-665 nm) 和近红外 (810-1200 nm) 光谱中运行。
- 将患者置于仰卧位。在诱导全身麻醉(遵循机构批准的方案)并完成所有安全程序(头罩、无菌手套和无菌擦洗)后,创建一个无菌区域。使用四端口方法15 进行套管针插入。
2. 胆道结构的荧光引导可视化和识别
- 切换到荧光模式以定位胆管。
注意:在荧光模式下,染色的胆管结构可以直接可见或在简单分离包囊脂肪组织后显现(图 1A)。 - 按照荧光导航,使用烧灼钩仔细解剖和分离胆囊管 (CD) 和囊动脉 (CA),以实现关键的安全视图,也称为卡洛三角。
注:在荧光模式下,CD 显示荧光信号,而 CA 不显示任何荧光信号。 - 在识别和区分胆管后,将 Hem-O-lock 夹套在 CD 和 CA 上。将两个剪辑放在 CD 的近端和一个远端。将一个夹子放在 CA 的近端和一个远端夹子。
注意:仔细识别 CD 胆总管 (CBD) 连接处,以防止对 CBD 造成意外伤害。
3. 切除胆囊
- 从颅窝中解剖胆囊,用剪刀将胆囊管 (CD) 和囊动脉 (CA) 在夹子之间分开,然后将胆囊放入提取袋中。
- 采用白光模式检测任何出血,并在胆囊切除术完成后切换到荧光模式以确认没有胆漏。
- 从腹腔中取出胆囊,在胆囊窝放置引流管,并使用 4-0 聚乳糖素闭合腹部。用 3-0 不可吸收缝合线缝合皮肤。
注意:只有在确认有一条导管进入胆囊后才能切割 CD,尤其是在胆道解剖结构发生变化的情况下,例如右侧副肝管。
4. 术后监测和管理
- 术后回顾炎症标志物。
- 当引流管清澈且每天少于 50 mL 时,取下腹部引流管。
- 根据患者的临床状况和外科医生的建议,根据需要给予预防性抗生素。
- 监测患者是否有感染迹象,包括手术部位发热、发红或肿胀。
- 在 7-10 天内安排一次随访咨询,以评估恢复情况。
结果
按照方案中概述的外科手术(图 2),在 3 名困难胆囊患者中成功进行了荧光引导下腹腔镜胆囊切除术 (LC)。手术过程中没有转为开放手术,也没有发生胆管损伤 (BDI)。在荧光模式下未观察到胆汁渗漏,如随附的视频所示。术中和术后结果总结见 表 1。
2024 年 4 月至 8 月期间,共记录了 70 例荧光引导 LC 病例,人口统计数据见 表 2。其中,91% (64/70) 表现出令人满意的荧光成像,所有胆管清晰可见,胆道荧光信号强,肝脏背景干扰最小。3 例未显示肝外胆管的荧光成像。这归因于肝总管梗阻。此外,3 例荧光成像效果不佳: 2 例归因于早期注射吲哚菁绿 (ICG),1 例归因于囊性管 (CD) 梗阻。
通过引流观察证实,没有转为开放手术,手术过程中没有胆管损伤,也没有术后胆漏。与传统的白光 LC 相比,ICG 荧光成像具有以下优势:(1) 胆管实时导航,增强外科医生的信心;(2) 早期发现变异胆管;(3) 准确识别 CD-胆总管 (CBD) 交界处,降低 BDI 的发生率;(4) 区分 CD 和囊动脉 (CA),防止 CA 损伤;(5) 及时识别胆汁渗漏。总之,ICG 荧光导航使 LC 更快、更安全、更精确。
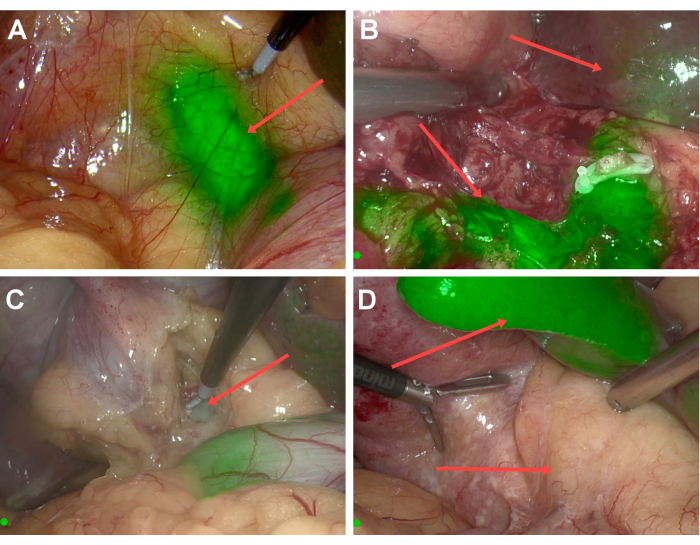
图 1:荧光成像。 (A) 在荧光模式下,直接观察到染色的胆管。(B) 适当的 ICG 给药:胆道荧光信号强,对比鲜明,而背景肝脏荧光较弱。(C) 早期注射 ICG:胆管的荧光强度不足以识别解剖结构。(D) 晚期注射 ICG:肝脏显示高荧光,但胆管中含有的 ICG 不足,无法获得足够的可见度。 请单击此处查看此图的较大版本。

图 2:手术程序。 (A) 手术前静脉注射 ICG。(B) 向上拉胆囊,露出 Calot 三角形。(C) 切换到荧光模式可以观察胆管。(D) 跟随荧光导航剖析 Calot 三角形。(E) 清洁 Calot 三角的脂肪组织揭示了 CHD 和 CBD 的清晰可视化。CD 和胆囊不可见,表明 CD 开口处有结石梗阻。(F) 将阻生结石推向胆囊后,CD 变得可见。(G) 夹紧 CD。(H) 切除胆囊后,切换到荧光模式可检测任何胆汁渗漏。 请单击此处查看此图的较大版本。
| 变量 | 结果 | ||
| 病人 | 第一 | 第二 | 第三 |
| 手术时间(分钟) | 65 | 65 | 45 |
| 转换为 open | 不 | 不 | 不 |
| 失血量 (mL) | 20 | 20 | 10 |
| BDI | 不 | 不 | 不 |
| CA 损伤 | 不 | 不 | 不 |
| 术后住院时间(天) | 4 | 4 | 3 |
| 引流持续时间(天) | 4 | 3 | 2 |
| 并发症 | |||
| 胆汁泄漏 | 不 | 不 | 不 |
| 腹痛 | 不 | 不 | 不 |
| 感染 | 不 | 不 | 不 |
| 转移到 ICU | 不 | 不 | 不 |
| 病理诊断 | 慢性胆囊炎急性加重 | 急性坏疽性胆囊炎 | 急性胆囊炎 |
表 1:手术结果。
| 人口 | 病人 |
| ICG 引导的 LC (n = 70) | |
| 平均年龄 (岁) | 55.9 ± 14.1 |
| 性 | |
| 雄 | 32 |
| 女性 | 38 |
| 平均 BMI (kg/m2 ) | 25.2 ± 4 |
| 上腹部手术史 | 5 |
| 合并症 | 28 |
| 高血压 | 18 |
| 糖尿病 | 13 |
| 心脏病 | 13 |
| 肝炎 | 3 |
表 2:患者的人口统计数据。
讨论
腹腔镜胆囊切除术 (LC) 长期以来一直被认为是治疗胆石症和胆囊炎的金标准。然而,在涉及急性炎症、坏疽、穿孔和解剖变异(统称为困难胆囊)的病例中,传统的手术方法通常会带来重大挑战16。这些具有挑战性的情况显着增加了胆管损伤 (BDI) 和囊动脉 (CA) 损伤的风险。
BDI 是与 LC 相关的最严重的并发症之一,通常是由于胆囊管 (CD) 和胆总管 (CBD) 的错误识别引起的17。预防 BDI 的关键在于精确识别 CD-CBD 连接,这使得胆道的可视化变得至关重要。传统的术中可视化技术 (IVT),例如胆管造影、超声和胆总管镜检查,最初就是为此目的而开发的。然而,由于对辐射暴露的担忧、显着的误差幅度和繁琐的程序,它们的采用受到了阻碍 5,18。
近红外荧光 (NIRF) 是一种新开发的术中可视化技术 (IVT),在广泛的肝胆手术中具有许多优势。这些包括检测原发性肝癌中的病变19、识别肝转移20、协助肝移植手术21、可视化胆道22、检测胆漏23 以及在儿科和机器人手术中的应用24。吲哚菁绿 (ICG) 通过胆道排泄,在肝胆手术中具有天然优势。
在腹腔镜胆囊切除术 (LC) 期间,NIRF 提供清晰、实时的胆管可视化,有效防止对胆道结构造成不必要的伤害。最重要的是,NIRF 易于实施和作。NIRF 引导的 LC 是对传统 LC 程序的直接增强,只需要术前静脉注射 ICG 作为附加步骤。该技术不会影响整个手术过程,不会造成额外的创伤,并允许在白光和荧光模式之间无缝切换。
术中荧光成像的疗效受多种因素影响。首先,ICG 注射的给药途径起着至关重要的作用。ICG 可通过术前静脉注射或术中直接胆囊注射给药。虽然直接胆囊注射很麻烦、有创,并且不能提供肝外胆管(例如肝总管)的完全可视化,但术前静脉给药是目前首选的方法25,26。其次,ICG 注射的时间和剂量是荧光成像质量的关键决定因素,因为它们会影响胆管可视化的强度和肝脏背景干扰12,27。理想的成像结果可确保以最小的肝脏背景荧光清晰地显示胆管(图 1B)。第三,ICG 给药后太晚进行荧光成像可能导致胆管荧光强度不足,阻碍解剖结构的识别(图 1C)。最后,过晚的注射会导致肝脏荧光高和胆管荧光不足,从而限制了其在紧急液相色谱情况下的适用性(图 1D)。
吲哚菁绿 (ICG) 注射的最佳时间和剂量仍在研究中 12,28,29,30,31。经过广泛的研究,术前 30-45 分钟的时间和 0.25 mg 的剂量已被确定为实现令人满意的荧光可视化的最佳时间。值得注意的是,这些结果是使用我们中心使用的荧光设备(DPM-I 荧光系统)获得的。ICG 的最佳时间和剂量可能因所使用的特定荧光系统而异。这种缩短的注射时间有可能使 ICG 在紧急腹腔镜胆囊切除术 (LC) 手术中得到有效使用。当胆管壁和上覆脂肪层的厚度超过 1 cm 时,荧光信号明显减弱甚至可能消失。为了改善荧光成像,可以去除表面脂肪组织,并拉伸胆管以减薄其壁。胆管梗阻对荧光成像的影响因梗阻位置而异。肝门梗阻可能在肝脏背景中引起强烈的荧光信号,但在肝外胆管中完全缺乏成像。相反,胆囊管 (CD) 或胆总管 (CBD) 阻塞可能导致梗阻的胆管段无法成像。本文提供了我们中心进行荧光引导困难液相色谱分析的详细步骤,并总结了影响荧光成像的因素。荧光导航技术已在我们的中心常规使用,成功率达到 91%,成像结果令人满意。
荧光导航使用 ICG 作为其荧光染料。当以低于 2.0 mg/kg 的浓度使用时,ICG 没有毒副作用或过敏反应,表明术中荧光导航所需的剂量 (0.25 mg) 完全在安全范围内。总之,荧光导航是一种安全有效的技术,为识别和区分手术过程中的关键结构提供了至关重要的帮助。在困难的液相色谱程序中,荧光导航可显著提高精密度并降低医源性损伤的风险。它对未来的临床应用前景广阔。
披露声明
作者声明他们没有需要披露的利益冲突。
致谢
这项工作得到了中国国家自然科学基金(资助号 82272105)、广东省基础与应用基础研究基金(资助号 2022A1515011244、2023A1515011521、2023A1515010475)、中国广东省医学科学研究基金(A2017421、2016116212141586)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3-0 MERSILK | JOHNSON MEDICAL (CHINA) LTD. | SA84G | The Suture Material |
| 4-0 Coated VICRYL | ETHICON | VCP310 | The Suture Material |
| Endoscopic Fluorescence Imaging System | ZHUHAI DI PU MEDICAL TECHNOLOGY CO., LTD. | H380022041YF | Fluorescence Laparoscope Equipment |
| Hem-O-lock Clips | SINOLINKS MEDICAL INNOVOATION, INC. | B240714 | Hem-O-lock Clips |
| Indocyanine Green for Injection | DANDONG YICHUANG PHARMACEUTICAL CO., LTD. | H20055881 | Fluorescence Dye |
参考文献
- Lammert, F., et al. Gallstones. Nat Rev Dis Primers. 2, 16024 (2016).
- Georgiades, C. P., et al. Is inflammation a significant predictor of bile duct injury during laparoscopic cholecystectomy. Surg Endosc. 22 (9), 1959-1964 (2008).
- Flum, D. R., Cheadle, A., Prela, C., Dellinger, E. P., Chan, L. Bile duct injury during cholecystectomy and survival in medicare beneficiaries. JAMA. 290 (16), 2168-2173 (2003).
- Ortenzi, M., et al. Safety of laparoscopic cholecystectomy performed by trainee surgeons with different cholangiographic techniques (SCOTCH): A prospective non-randomized trial on the impact of fluorescent cholangiography during laparoscopic cholecystectomy performed by trainees. Surg Endosc. 38 (2), 1045-1058 (2024).
- Araki, K., Conrad, C., Ogiso, S., Kuwano, H., Gayet, B. Intraoperative ultrasonography of laparoscopic hepatectomy: Key technique for safe liver transection. J Am Coll Surg. 218 (2), e37-e41 (2014).
- Nguyen, Q. T., Tsien, R. Y. Fluorescence-guided surgery with live molecular navigation-A new cutting edge. Nat Rev Cancer. 13 (9), 653-662 (2013).
- Manasseh, M., Davis, H., Bowling, K. Evaluating the Role of Indocyanine Green Fluorescence Imaging in Enhancing Safety and Efficacy During Laparoscopic Cholecystectomy: A Systematic Review. Cureus. 16 (11), e73388 (2024).
- Zhou, H., He, Y., Chang, L. Comparative study of Indocyanine Green fluorescence imaging versus conventional fiber-optic imaging in laparoscopic choledochotomy for stone extraction and immediate biliary incision suturing. Updates Surg. 76 (6), 2247-2254 (2024).
- Quaresima, S., et al. Routine near infra-red indocyanine green fluorescent cholangiography versus intraoperative cholangiography during laparoscopic cholecystectomy: A case-matched comparison. Surg Endosc. 34 (5), 1959-1967 (2020).
- Lim, S. H., Tan, H. T. A., Shelat, V. G. Comparison of indocyanine green dye fluorescent cholangiography with intra-operative cholangiography in laparoscopic cholecystectomy: a meta-analysis. Surg Endosc. 35 (4), 1511-1520 (2021).
- Benya, R., Quintana, J., Brundage, B. Adverse reactions to indocyanine green: a case report and a review of the literature. Cathet Cardiovasc Diagn. 17 (4), 231-233 (1989).
- Pardo Aranda, F., et al. Indocyanine green (ICG) fluorescent cholangiography in laparoscopic cholecystectomy: Simplifying time and dose. Dig Liver Dis. 55 (2), 249-253 (2023).
- Dip, F., et al. Use of fluorescence imaging and indocyanine green during laparoscopic cholecystectomy: Results of an international Delphi survey. Surgery. 172 (6S), S21-S28 (2022).
- Chen, Q., et al. Extrahepatic biliary tract visualization using near-infrared fluorescence imaging with indocyanine green: Optimization of dose and dosing time. Surg Endosc. 35 (10), 5573-5582 (2021).
- Hori, T., et al. Protocol for laparoscopic cholecystectomy: Is it rocket science. World J Gastroenterol. 22 (47), 10287-10303 (2016).
- Elshaer, M., et al. Subtotal cholecystectomy for "difficult gallbladders": Systematic review and meta-analysis. JAMA Surg. 150 (2), 159-168 (2015).
- Fletcher, D. R., et al. Complications of cholecystectomy: Risks of the laparoscopic approach and protective effects of operative cholangiography: A population-based study. Ann Surg. 229 (4), 449-457 (1999).
- Flum, D. R., Dellinger, E. P., Cheadle, A., Chan, L., Koepsell, T. Intraoperative cholangiography and risk of common bile duct injury during cholecystectomy. JAMA. 289 (13), 1639-1644 (2003).
- Wang, B., et al. NIR-II fluorescence-guided liver cancer surgery by a small molecular HDAC6 targeting probe. EBioMedicine. 98, 104880 (2023).
- Hu, Z., et al. First-in-human liver-tumour surgery guided by multispectral fluorescence imaging in the visible and near-infrared-I/II windows. Nat Biomed Eng. 4 (3), 259-271 (2020).
- Lau, N. S., et al. Current and potential applications for indocyanine green in liver transplantation. Transplantation. 106 (7), 1339-1350 (2022).
- van den Bos, J., et al. Near-infrared fluorescence cholangiography assisted laparoscopic cholecystectomy (FALCON): An international multicentre randomized controlled trial. Surg Endosc. 37 (6), 4574-4584 (2023).
- Wang, X. N., et al. The role of fluorescent cholangiography in preventing biliary tract injury and finding bile leakage. Zhonghua Yi Xue Za Zhi. 103 (16), 1242-1244 (2023).
- Esposito, C., et al. Image-guided pediatric surgery using indocyanine green (ICG) fluorescence in laparoscopic and robotic surgery. Front Pediatr. 8, 314 (2020).
- Cardenas, G., Fornaguera, I., Diaz Del Gobbo, R., Ginesta, C. Direct gallbladder indocyanine green injection technique to achieve critical view of safety in laparoscopic cholecystectomy. Cir Esp (Engl Ed). 99 (9), 678-682 (2021).
- Castagneto-Gissey, L., et al. Intracholecystic versus intravenous indocyanine green (ICG) injection for biliary anatomy evaluation by fluorescent cholangiography during laparoscopic cholecystectomy: a case-control study. J Clin Med. 11 (12), 3508 (2022).
- Esposito, C., et al. Indocyanine green (ICG) fluorescent cholangiography during laparoscopic cholecystectomy using RUBINA technology: Preliminary experience in two pediatric surgery centers. Surg Endosc. 35 (11), 6366-6373 (2021).
- Liu, H., et al. Investigation of the optimal indocyanine green dose in real-time fluorescent cholangiography during laparoscopic cholecystectomy with an ultra-high-definition 4K fluorescent system: A randomized controlled trial. Updates Surg. 75 (7), 1903-1910 (2023).
- Huang, Y., et al. Real-time fluorescent cholangiography with indocyanine green in laparoscopic cholecystectomy: a randomized controlled trial to establish the optimal indocyanine green dose within 30 min preoperatively. Surg Today. 53 (2), 223-231 (2023).
- Lopez-Sanchez, J., et al. Dose and administration time of indocyanine green in near-infrared fluorescence cholangiography during laparoscopic cholecystectomy (DOTIG): Study protocol for a randomised clinical trial. BMJ Open. 13 (3), e067794 (2023).
- Esposito, C., et al. Clinical application and technical standardization of indocyanine green (ICG) fluorescence imaging in pediatric minimally invasive surgery. Pediatr Surg Int. 35 (10), 1043-1050 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。