Method Article
在斑马鱼胃中使用双光子显微镜进行深度和空间控制的体积消融
摘要
胚胎发育需要细胞运动的大规模协调。双光子激发介导的激光烧蚀允许对大群深层细胞进行空间控制的三维烧蚀。此外,该技术可以探测 体内 集体迁移细胞对其机械环境中的扰动的反应。
摘要
形态发生涉及许多细胞运动,以将细胞组织成组织和器官。为了适当的发展,所有这些运动都需要紧密协调,积累的证据表明,这至少部分是通过机械相互作用实现的。在胚胎中测试这一点需要直接的身体扰动。激光烧蚀是一种日益常用的选择,可以缓解机械约束或物理隔离两个细胞群。然而,许多烧蚀都是用紫外线(UV)激光进行的,其提供的轴向分辨率和组织穿透有限。这里描述了一种使用双光子显微镜消融深度,显着和空间上明确定义的体积的方法。消融在表达轴向中端肠胚层中绿色荧光蛋白的转基因斑马鱼品系中表现出来,并用于切断轴向中胚层,而不影响上覆的外胚层或下面的卵黄细胞。在消融之前和之后通过实时成像监测细胞行为。消融方案可用于不同的发育阶段,任何细胞类型或组织,规模从几微米到超过一百微米不等。
引言
细胞 - 细胞相互作用在发育中起着至关重要的作用。细胞提供信号,它们的直接邻居或更远的细胞可以感知,从而影响它们的命运和/或行为。其中许多信号本质上是化学性质的。例如,在表征良好的诱导事件中,一个细胞群产生可扩散的分子,影响另一个细胞群的命运1。然而,其他信号是机械的。细胞对邻居施加力和约束,邻居感知并做出反应2。
研究这些细胞 - 细胞 相互作用在体内 的重要性的一种方法是消除一些细胞并观察随后的发展。不幸的是,去除或破坏细胞的可用技术是有限的。细胞可以通过手术切除3,4,使用针头或小线,但这种治疗是侵入性的,不是很精确,通常在立体显微镜下进行,阻止在显微镜下立即成像。此外,靶向深层细胞意味着在覆盖的组织中刺穿一个洞,从而产生不必要的扰动。基因编码的光敏剂,如KillerRed,已被用于通过光照诱导细胞死亡5。光敏剂是在光照射下产生活性氧的发色团。它们的主要局限性是它们需要长光照明(约15分钟),如果细胞移动,这可能很难实现,并且它们通过细胞凋亡诱导细胞死亡,这不是立即的。
最后,激光烧蚀在过去15年中得到了发展和广泛的应用6,7,8,9,10,11,12。激光束聚焦在目标细胞/组织上。它通过加热,光消融或血浆诱导的消融诱导其消融;所涉及的过程取决于功率密度和曝光时间13。大多数烧蚀方案使用紫外激光器来实现其高能量。然而,紫外线既被生物组织吸收又被散射。因此,靶向深层细胞需要高激光功率,然后在更浅表的,平面外的组织中诱导损伤。这限制了紫外激光器在浅表结构上的使用,并解释了它们相对较低的轴向分辨率。非线性光学(所谓的双光子显微镜)使用光的非线性特性来激发荧光团,荧光团在红外域中具有大约一半能量的两个光子。当应用于消融术时,这有三个主要优点。首先,与紫外光相比,红外光的散射更少,被生物组织吸收更少14,从而可以在不增加所需激光功率的情况下到达更深的结构。其次,使用飞秒脉冲激光器可提供非常高的功率密度,通过等离子体感应产生烧蚀,这与加热相反,不会在空间上扩散15。第三,诱导等离子体形成的功率密度仅在焦点处达到。由于这些特性,双光子激光烧蚀可用于精确靶向深层细胞,而不会影响周围的组织环境。
集体迁移是发育过程的一个很好的例子,其中细胞 - 细胞相互作用是根本的。集体迁移被定义为相邻细胞影响一个细胞行为的细胞迁移16。这些相互作用的性质(化学或机械)以及它们如何影响细胞迁移可能会有很大差异,并且通常不完全理解。移除细胞并观察其如何影响其他细胞的能力对于进一步解开这些集体过程至关重要。几年前,我们使用手术方法确定,斑马鱼原肠胚形成过程中的洄游是集体迁徙17。Polster是一组细胞,构成胚胎背侧的第一个内化细胞18。这些细胞在 Tg(gsc:GFP) 转基因系中以绿色标记,位于胚胎深处,在几层外胚层细胞的下方。在原肠胚形成过程中,该组导致轴向中胚层的延伸,从胚胎组织者迁移到动物极19,20,21,22,23 (图1A)。我们确定细胞需要与邻居接触,以将其迁徙定位在动物极点的方向上。然而,更好地了解这种集体迁移的细胞和分子基础涉及去除一些细胞,看看这如何影响其余的细胞。因此,我们使用双光子显微镜设置开发了大而深体积的烧蚀。在这里,我们演示了使用该协议来切断中间的polster,并通过跟踪用Histone2B-mCherry标记的细胞核来观察对细胞迁移的影响。
研究方案
所有动物工作均由伦理委员会N 59和国家教育部批准,文件编号为APAFIS#15859-2018051710341011v3。下面描述的一些步骤特定于我们的设备和软件,但可以很容易地适应不同的设备。
1. 注射准备
- 在胚胎培养基(EM)中制备75毫升1%琼脂糖溶液。
- 将注射模具放入90毫米培养皿中,倒入约50毫升琼脂糖,足以让模具漂浮。让琼脂糖凝固并除去注射模具。
- 通过将1 mL琼脂糖倒入30毫米培养皿中来制备琼脂糖包衣的培养皿。
- 将储备溶液稀释在不含RNase的水中,制备4μL 30ng / μL组蛋白2B-mCherry mRNA溶液并保持在冰上。
注意:在操作mRNA时要小心戴上手套,以避免RNase介导的降解。 - 使用微量移液管拉拔器从毛细管中拉出注射针。
2. 胚胎制备
- 一旦鱼产卵,在EM的90毫米培养皿中收集,冲洗和收获。将胚胎置于28.5°C培养箱中。
- 等待 20 分钟,让第一个单元格变为可见。
- 将30个胚胎转移到充满EM的注射板中。使用略钝的镊子将胚胎挤压在凹槽中,并用动物杆向上定向。
- 使用微量加载器尖端,用2μLmRNA溶液填充注射针。将针头插入毛细管支架中,置于与聚四氟乙烯(PTFE)管连接到空气喷射器的微型机械手中。
- 在立体显微镜下,小心地打破针尖。
- 通过将针头插入细胞中,将mRNA溶液注射到1细胞期胚胎中。
注意:注射的体积约为细胞体积的三分之一。 - 将注射的胚胎放回28.5°C培养箱中。
3. 双光子显微镜的制备
注:本协议使用两个激光器。一个用于成像GFP(在920nm处)并进行烧蚀(在820nm处)。它将被称为绿光/烧蚀激光。另一个用于在1160nm处对mCherry进行成像。它将被称为红色激光。
- 将绿色/烧蚀激光设置为 820 nm(烧蚀波长),将红色激光设置为 1160 nm(mCherry 激发)。
- 在光路上使用可移动的反射镜,在扫描头的入口和出口处对齐绿色/烧蚀和红色激光束。
注:这增加了激光束焦点,并最大限度地减少了激发和烧蚀的焦散量。 - 测量物镜下820nm处绿光/烧蚀激光器的最大功率。为此,请将功率计放在物镜下方,关闭黑色腔室,将绿色/烧蚀激光功率设置为100%,然后打开百叶窗。计算达到 300 mW 所需的激光功率百分比。
- 将绿光/烧蚀激光器回设为920 nm(GFP激发),并将激光功率设置为7%。将红色激光功率设置为 15%。
- 激活外延光电倍增管(PMT)探测器,用于绿线和红线;将绿线和红线 PMT 灵敏度设置为 65。
- 将视场设置为 400 x 400 μm,将图像分辨率设置为 512 x 512 像素,将扫描频率设置为 800 Hz。
- 选择 "3D 延时成像" 模式。然后,创建一个文件夹,并在每次采集后激活 自动保存 数据。
- 组装加热室并将其设置为28°C。 等待至少10分钟,使腔室和物镜变暖。
4. 安装胚胎
- 在荧光立体显微镜下,以70%的外延率鉴定表达GFP的胚胎。
注意:选择轴向中胚层中具有明亮信号且无背景荧光的胚胎,以获得更好的成像质量。 - 使用塑料巴斯德移液管在琼脂糖涂层皿(步骤1.3)中转移三到四个选定的胚胎,并使用细镊子小心地将其去脉。
注意:去鞘胚胎非常脆弱,与空气或塑料接触时会破裂。 - 将 1 mL 0.2% 琼脂糖倒入 1x 青霉素-链霉素 EM 中,放入一个小玻璃瓶中。将小瓶置于预热的42°C干块加热器中。
注意:必须快速执行以下步骤,以便在琼脂糖凝固之前允许胚胎定向。 - 使用火抛光玻璃移液器将去壳的胚胎转移到0.2%琼脂糖玻璃小瓶中。注意不要在琼脂糖中添加过多的EM,以避免稀释它。从移液器中丢弃剩余的EM,并在胚胎从移液器中脱落之前,将胚胎与足够的琼脂糖一起吸回以覆盖玻璃底培养皿的载玻片。
- 将琼脂糖和胚胎吹在盘子的载玻片上。注意不要让胚胎接触空气或盘子的塑料面。接下来,用琼脂糖填充载玻片周围的腔室。
- 使用睫毛定向胚胎,使目标区域位于顶部(图1B)。
注意:在定向胚胎时,请注意仅触摸胚泡,而不是非常脆弱的蛋黄。琼脂糖将在1分钟左右凝固,具体取决于室温。 - 等待约5分钟,琼脂糖完全凝固,然后加入几滴青霉素 - 链霉素EM。
5. 定位胚胎和消融前成像
- 将玻璃底盘放在加热室中物镜下方。将物镜浸入青霉素 - 链霉素EM中并关闭加热室。
- 移动滑块以设置目镜的光路。然后,使用目镜,荧光灯和载物台控制,找到一个胚胎并将焦点设置为胚胎表面。
- 关闭荧光灯,将光路设置为PMT,然后关闭黑色腔室。
注:小心关闭黑色腔室中的所有光源,因为它可能会损坏PMT。 - 开始实时成像并定位轴向中胚层。调整绿色/烧蚀和红色激光功率以获得良好的信号(即,对于GFP表示区域,每像素1,000至20,000光子)。使用红色通道将阶段移动到胚胎的最顶部,并将此位置设置为Z = 0。
- 选择 1 分钟的时间步长和 2 μm 的 Z 步长。110 μm的Z形程足以覆盖整个埾星,并且在这些设置下不到1分钟即可获得。将第一片片设置在轴向中胚层上方15μm处(在更浅的外胚层中)。
注:堇子沿曲线移动,因此Z层的底部应设置为比堇子最深位置深30μm,以适应其在延时成像期间的运动(图1E)。 - 录制10-15分钟的消融前电影。

图1:激光消融术的成功结果(A)背侧70%外延的胃泌尿胚胎方案;pAM:后轴中胚层;黑色箭头标记了樁匐迁移的方向;黑色方块表示极点中烧蚀的典型视场。(B)用于切断的胚胎安装方案。侧视图。胚胎的安装使得燎星的平面垂直于光轴。(C)受精后24小时对照和烧蚀胚胎的存活和形态。比例尺为300μm.(E)在表达Histone2B-mCherry的Tg(gsc:GFP)胚胎的polster中激光烧蚀的时间序列。仅带有绿色通道的视图是最大投影。特写镜头显示了含有细胞碎片的烧蚀区域。具有绿色和红色(显示为洋红色)通道的视图是烧蚀前后的 XY 和 XZ 切片(绿色闪电表示烧蚀)。XZ切片显示,上覆组织(没有GFP表达的洋红色细胞核)没有受到底层结构消融的影响。黄色虚线框对应于为激光烧蚀处理选择的ROI。比例尺在大视图中为50 μm,在特写镜头中为25 μm。请点击此处查看此图的放大版本。
6. 目标定位和激光烧蚀
- 在实时成像上定位光栅轮廓,并使用电光调制器感兴趣区域 (EOM ROI) 工具绘制一个跨越光栅宽度的 20 像素 (15 μm) 大矩形。将此矩形放在 polster 的中间(图 1E)。
- 请注意包含 polster 像元的最高平面和最低平面的轴向位置。在这两个平面之间每10μm将进行烧蚀。请注意,ROI 不会与任何这些平面上的蛋黄单元格重叠。
- 将载物台放置在间隔的最低 Z 位置。烧蚀必须自下而上地进行,因为碎屑会吸收光线。
- 将绿色/烧蚀激光波长设置为820 nm,并设置 功率百分比 以获得300 mW的退出功率(步骤3.3)。
- 将 成像频率 设置为 200 Hz。
- 将绿色/烧蚀激光成像 EOM 设置为 0,然后选择 ROI 处理 模式。
- 打开 EOM 并将处理设置为立即开始(在 0 帧之后)。
- 将 "成像模式" 设置为"延时摄影",然后停用 "自动保存"。
- 将 "时间步长" 设置为"快速"模式。
- 将 处理帧数 和 帧数 设置为与目标深度对应的值(表 1)。
| 深度(微米) | 治疗框架 |
| -30 | 1 |
| -35 | 1-2 |
| -40 | 1-2 |
| -45 | 2 |
| -50 | 2-3 |
| -55 | 3 |
| -60 | 3-4 |
| -65 | 4 |
| -70 | 4 |
| -75 | 4-5 |
| -80 | 4-5 |
| -85 | 5 |
| -90 | 5 |
| -95 | 5-6 |
| -100 | 6 |
| -105 | 6 |
表1:建议的激光治疗框架数量作为胚胎中靶细胞深度的函数(0是胚胎表面)。
- 开始成像。采集是黑色的,因为在EOM处理期间PMT的快门关闭。
- 将舞台上移到列表的下一个 Z 位置(步骤 6.2)。
- 重复步骤 6.10 到 6.12,直到到达 polster 的顶部。
7. 烧蚀后验证和成像
- 将绿光/烧蚀激光器设置为920 nm和5%功率。将绿色/烧蚀激光成像EOM设置为100,然后选择 全场 模式。
- 将 "成像频率" 设置为 800 Hz。关闭 EOM。
- 在实时模式下浏览整个堆栈,以检查每个平面是否已被烧蚀。如果不是这种情况,请返回步骤 6.2。
注意:消融有时会引起相邻组织的垂直移动,因此可能必须重新定义Z层。 - 将 "成像模式" 设置为"3D 延时摄影",然后重新激活 "自动保存"。记录40-60分钟的消融后电影。
- 在消融后的电影中,检查靶细胞是否被有效消融。荧光回收或靶细胞占据空间并阻止跟随细胞通过,表明靶细胞仅被光漂白而没有消融(图1E和图2A)。
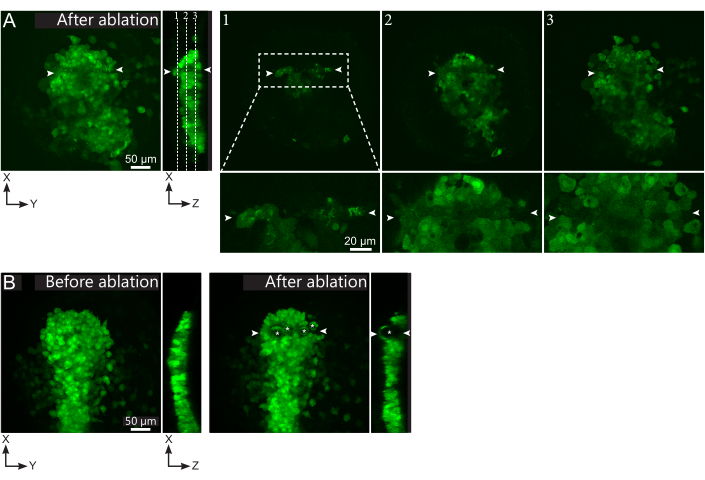
图2:激光烧蚀的阴性结果。 (A)激光烧蚀中潜在故障的典型示例。大型 XY 视图是最大投影,XZ 视图是重建剖面。激光处理区域位于两个白色箭头之间。三个焦平面在重建部分中突出显示,并显示在右侧。它们对应于三种不同类型的故障。平面1显示,栉体上方的细胞已被烧蚀。这可以通过在栉星上方的焦平面上存在自发荧光碎片(见特写)来识别(参见重建部分上平面1的位置)。这可能是由于对要消融的区域的定义不正确造成的。平面2显示了已经漂白但未消融的细胞。它们可以被识别为低荧光信号仍然显示完整的细胞轮廓(见特写)。平面3显示了完整的细胞,这些细胞几乎没有通过激光处理漂白。这可能是由于对要消融的区域的定义不正确或处理不当造成的。在平面2和3中描述的情况下,可以将消融处理重新应用于未消融的靶细胞。比例尺在大视图中为50 μm,在特写镜头中为20 μm。(B)由于激光处理过强而由空化形成的气泡(用白色星号标记)的典型例子。这种气泡不仅限于Z平面,有时甚至跨越了污染物的整个高度,使相邻组织变形。比例尺为50μm, 请点击此处查看此图的放大版本。
8. 数据分析
- 使用图像分析软件打开延时系列,并设置正确的像素大小。
- 在 Spot 函数中,将 "物体大小" 设置为 10 μm,因为这是原肠胚形成过程中的平均原子核大小。然后,运行 Spot 函数以检测和跟踪原子核。
注意:通过考虑较低的轴向分辨率,沿Z轴拟合12μm长的椭圆体形状,可以略微改善检测。 - 使用筛选器删除误报。在 Tg(Gsc:GFP) 系中,来自胚胎轴的细胞和一些内胚层细胞被标记为绿色。因此,对绿色强度进行滤波可以快速选择这些电池(图3A)。
- 将连续点之间的最大距离设置为与像元速度兼容的值。
注意:请仔细考虑两帧之间的时间间隔。Polster细胞以2.8±0.8μm/min迁移。因此,允许4μm的最大位移持续1分钟的时间步长可以去除大多数伪影轨迹。 - 允许在一个或两个时间点上出现间隙可提供更长的连续跟踪,但可能会引入跟踪错误。如果在一次性点未正确检测到原子核,请考虑使用不同的参数/过滤器重新运行斑点检测。
- 目视检查曲目,并在必要时进行更正。
- 将结果导出为.xlsx文件。使用已发布的电子表格例程24 (图 3B)和数据分析软件上的自定义例程(可根据要求提供)处理文件。
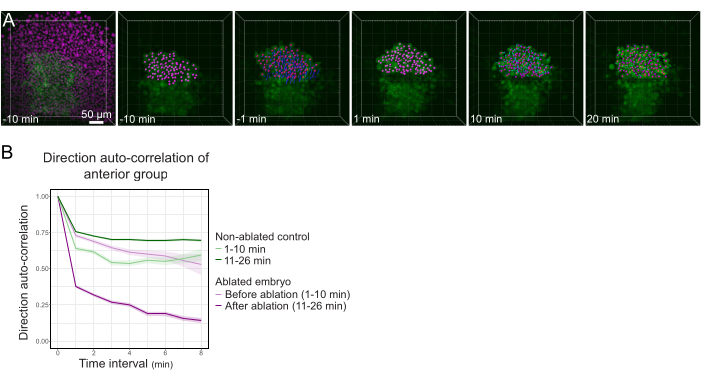
图3:分离出的桔梗前半部分会影响细胞的方向性。 (A)在激光消融切断中间的栉水之前和之后,3D重建表达Histone2B-mCherry的 Tg(gsc:GFP) 胚胎(以洋红色显示)。属于燎星前半部分的细胞核用洋红色点标记,并在消融前后随时间跟踪(见 电影S1)。(B)作为迁移持久性的量度,在消融之前和之后属于Polster前部的细胞的方向自相关。细胞在消融前显示连续运动,消融后急剧减少,表明集体导向迁移的损失。作为对照,还在形成非消融胚胎前半部分的细胞上测量方向自相关。图形包络线指示标准误差。 请点击此处查看此图的放大版本。
结果
为了切断中间的污染物,注射了Histone2B-mCherry mRNA的 Tg(gsc:GFP) 胚胎在70%的表观阶段安装,如步骤4所述。通过GFP表达鉴定出极点,并且将胚胎安装,以使极点的平面垂直于光轴(图1B)。将胚胎倾斜远离这个位置将使程序复杂化。光必须穿过更多的组织才能到达消融平面,并且消融平面将相对于胚胎轴倾斜。在验证了所有细胞核都正确标记后,记录了10分钟的消融前延时,以捕获消融前的细胞运动(图1E 和 图3A, 电影S1)。
在形态学上鉴定了堰星,并且位于其中间的15μm x 200μm的矩形区域在五个焦平面上被烧蚀,以确保在噼星的整个深度上切断(图1E,Movie S1)。消融后立即重新启动成像,并用于监测手术效率。如果成功,消融将消除所有细胞结构以及GFP和mCherry荧光,因此消融体积应显示为无信号体积。但是,可能会产生一些碎片。这种碎屑在绿色和红色通道中都是自发荧光的,并且通常显示平行于烧蚀方向的不规则细长形状(图1E)。过于强烈的处理会形成大量的碎片,这些碎片可能成为障碍物并扰乱细胞行为。更强的处理甚至会诱发空化,其标志是在组织中形成气泡(图2B)。空化与在组织中传播的机械冲击波有关,并可能引起目标体积的损伤13,15。应丢弃带有空化气泡的胚胎,并且应通过减少处理框架来调整处理。
相反,太少的处理可能会使光漂白荧光团而不诱导血浆形成,因此不会烧蚀(图2A)。不完全的光漂白很容易通过具有特征细胞形状的微弱荧光的存在来发现(图2A)。这样的胚胎应该被丢弃或再次处理,进行更多的治疗框架。完全光漂白与成功烧蚀的区别更具挑战性,因为两者都会导致无信号体积。然而,光漂白可以回顾性地识别,因为荧光将在消融后成像过程中逐渐恢复。然而,这意味着对未消融的胚胎进行至少半小时的成像,这非常耗时。因此,我们建议调整治疗强度(通过增加治疗次数)以诱导形成少量可见碎片,这不会影响细胞行为,但立即确认有效的消融。最后,应在消融后的第一张图像上检查消融体积周围细胞中是否存在损伤(图2A)。当激光治疗正确调整(形成少量碎片)时,相邻组织的损伤不太可能由消融的空间扩散引起,这在空间上定义得非常好,而是由于要消融的区域选择不准确和/或目标选择和消融之间时间的组织运动造成的。具有受影响邻近组织的胚胎应丢弃。
成功消融后,每分钟捕获Z-堆栈40分钟,记录GFP细胞质信号和mCherry核信号。然后跟踪细胞核,并将它们的运动用作细胞运动的代理。在较强的GFP信号上鉴定出与栉星细胞相对应的轨迹(图3A,Movie S1)。通过计算细胞方向自动相关来测量细胞运动的持久性24。聚焦于位于桔星前半部分的墕星细胞,发现切断中间的桫花,从而将这些细胞与桫桫的后部分离,降低了它们的方向自相关(图3B),表明栉星细胞的适当迁移需要整个桔体的完整性,与其所证明的集体迁移一致17。
在获得消融后薄膜后,胚胎可以展开,使用精细的镊子小心地从琼脂糖中提取它们,并在28.5°C下孵育直到它们达到受精后24小时。同样,胚胎应该存活下来,不应该出现任何明显的形态缺陷(图1C,D)。
电影S1:成功的激光烧蚀。 在表达Histone2B-mCherry的 Tg(gsc:GFP) 胚胎的Polster中间进行激光烧蚀。来自栎星前部的原子核被跟踪,并带有洋红色点。磁道采用时间颜色编码(图 3)。空框架对应于激光烧蚀。 请按此下载短片。
讨论
在这里,我们描述了一种协议,该协议使用非线性光学来执行深度和空间上定义良好的体积烧蚀。该协议最关键的一步是找到提供足够能量以允许消融的处理条件,但不能过多的能量,以避免过多的碎片或空化。目标部位传递的能量主要取决于:(1)激光退出功率,(2)激光对准的质量,(3)光通过到达烧蚀平面的组织的性质,(4)烧蚀平面的深度。因此,在每次实验之前,测量激光退出功率,将其调整到参考值(在我们的协议中,820nm时为300 mW)并确保正确的激光对准至关重要。在这些假设下,治疗条件应该从一个实验日到另一个实验日是可重复的。我们建议进行广泛的测试,以定义特定样品类型的最佳参数(激光功率和处理框架数量)。然后,这些参数可用于所有类似的实验。在这里描述的示例(在原肠胚形成过程中切断polster)中,例如,我们已经建立了胚胎内不同深度的消融治疗条件(表1),现在在进行实验时依赖于此图表。值得注意的是,在我们的系统上选择了820nm波长,该波长提供了最高的峰值能量(由于激光和光学特性)。根据系统属性,可以使用更短或更长的波长6,11,12。目标组织的深度是一个关键参数,胚胎安装也是一个关键步骤,因为不正确的安装可能会增加光必须通过才能达到目标体积的组织厚度。
所描述的协议的原始特征之一是通过在不同的焦平面上执行连续消融来消融整个体积。由于烧蚀会产生吸收光的碎片,因此我们发现在最深的平面上开始烧蚀并从最深的平面到最浅的平面依次消融至关重要。
该协议描述了深部和大体积的消融,以及消融后几分钟内到一个多小时的邻近组织反应的记录。该协议的潜在限制之一是执行消融和重新启动成像所需的时间。有两个因素限制了这种延迟。第一个是在多个焦平面上进行消融所需的时间。在我们的系统上,经过培训的用户在2-3分钟内执行polster的切断。这可以通过优化软件以在不同平面上自动烧蚀来减少。尽管如此,总烧蚀时间将等于扫描目标区域所需的时间,乘以每个焦平面上的重复次数,乘以焦平面的数量,在我们的条件下,大约是1分钟。考虑到细胞迁移速度,这意味着一些细胞在消融过程中可能会进入或退出目标区域。在我们的案例中,这并没有被证明是一个问题,但如果需要细胞靶向的绝对精度,这可能是一个问题。第二个限制因素是使用相同的激光器进行烧蚀(在820nm处)和激发绿色荧光团(在920nm处)。因此,最后一次烧蚀和开始记录之间的延迟由将激光从820 nm调谐到920 nm所需的时间定义,范围从30秒到1分钟。
在某些情况下,特别是对于较小的消融(单细胞消融,细胞骨架元件等亚细胞成分的消融),记录细胞/组织的即时反应对于推断其机械状态可能至关重要25,26,27。在这种情况下,可以通过用另一种激光成像(例如,在这里,仅使用1160 nm激光或使用第三激光线记录红色信号)或在820 nm处对绿色荧光团进行成像来规避限制。这不是成像的最佳波长(荧光团的激发有限,强烈的光毒性作用),但可以在短时间内用于记录即时组织反应。
很少有技术可用于消除细胞并观察这如何影响胚胎的其余部分。两个主要选择是物理去除细胞或破坏它们,如激光消融。与物理去除相比,细胞破坏可能会释放细胞质含量,从而影响邻近细胞。威廉·鲁克斯(Wilhelm Roux)和汉斯·德里施(Hans Driesch)就青蛙和海胆胚胎的马赛克或调节发育获得的争议和分歧结果在历史上突出了这一点28。最近,在伤口愈合测定中观察到差异,这取决于伤口是由划痕(破坏某些细胞)还是移除插入物产生的29。然而,物理去除细胞而不损害其他组织仅适用于胚胎表面的细胞和不太粘附于其邻居的细胞,从而限制了这种方法的范围。因此,已经开发了不同的策略来破坏细胞,激光烧蚀是最常用的。紫外激光消融已经并越来越多地使用,特别是用于进行小的,浅表的消融,并观察即时的组织反应。
我们在这里描述了使用红外光来执行更深层次和空间上定义明确的烧蚀。该协议的主要限制是需要红外脉冲激光器和双光子成像设置。然而,这种设备在成像平台上变得越来越频繁。此外,这里用于选择性地消融图像中一个区域的EOM可以被光漂白后的荧光恢复(FRAP)模块所取代。虽然不太方便,但即使只需放大目标区域10,甚至可以在没有EOM或FRAP模块的情况下执行协议。与大多数经典的烧蚀方案相比,使用脉冲红外激光器具有两个主要优点。首先,由于红外光在活组织中的有效穿透,可以使用激光功率到达深焦平面,而不会引起失焦损伤。这使我们能够靶向深达120μm的细胞,这是单光子激发方案无法企及的。其次,使用非线性光学元件可确保出色的轴向分辨率,即使在组织深度,也可以精确控制3D烧蚀。结合这两个优点,可以烧蚀特定定义的,深的,最终是大体积的。
我们描述了使用双光子显微镜切断极点,这是我们和其他人最近进行的实验30。然而,只需很少的调整,拟议的方案可以适应许多不同的样品。例如,我们已经成功地使用它来执行Polster的完全消融,在原肠胚形成期间在外侧中胚层内进行消融,或者在单个Schwan细胞在其相关轴突上迁移期间进行消融,而不影响轴突。因此,我们认为该协议是一种有价值且通用的工具,在许多实验系统中应该有助于分析某些细胞/组织对邻近结构的行为和发育的影响。
披露声明
作者声明没有竞争利益。
致谢
我们感谢Emilie Menant的鱼类护理,Polytechnique Bioimaging Facility,特别是Pierre Mahou,感谢在法兰西岛地区(interDIM)和国家研究机构(ANR-11-EQPX-0029 Morphoscope2,ANR-10-INBS-04 France BioImaging)部分支持的设备上提供实时成像。这项工作得到了ANR拨款15-CE13-0016-1,18-CE13-0024,20-CE13-0016以及欧盟地平线2020研究和创新计划的支持,该计划根据Marie Skłodowska-Curie赠款协议No 840201,高级和研究部和国家科学研究中心。
材料
| Name | Company | Catalog Number | Comments |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | |
| Agarose | PanReac AppliChem | A8963,0500 | |
| Data analysis software : Matlab | Math Works | ||
| Electro-optic modulator (EOM) | ConOptics | 350-80LA | |
| Embryo Medium (EM) solution | Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio), 5th Edition. University of Oregon Press, Eugene (Book). (2000). | ||
| Environmental chamber chamber | Okolab | H201-T-UNIT-BL | |
| EOM driver | ConOptics | 302RM | |
| Fluorescence source | Lumencor | SOLA | |
| Glass bottom dishes | MatTek | P35G-0-10-C | |
| Glass capillaries | Harvard Apparatus | 300085 | Outside diameter 1.0 mm, inside diameter 0.58 mm |
| Glass pipettes | Volac | D810 | Tip should be fire polished |
| Green/ablation laser | Spectra Physics | Mai Tai HP DeepSee | |
| Histone2B-mCherry mRNA | Synthesized from pCS2-H2B-mCherry plasmid (Dumortier& al. 2012) | ||
| Image analysis software: IMARIS | Bitplane | ||
| ImSpector software | Abberior Instruments Development Team | ||
| Injection mold | Adapative Science Tools | I-34 | |
| Microloader tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-151 | |
| Micropipette puller | Sutter | P-1000 | |
| mMESSAGE mMACHINE SP6 Transcription Kit | Invitrogen | AM1340 | |
| Penicillin-Streptomycin | Thermofisher | 15140-122 | 10 000 units penicillin and 10 mgstreptomycin per ml |
| Photomultiplier tube (PMT) | Hammamatsu | H7422-40 | |
| PicoPump (Air injector) | World Precision Instrument | PV820 | |
| Red laser | Spectra Physics | OPO/Insight DeepSee | |
| RNAse free water for injection | Sigma | W3500 | |
| Spreadsheet software: Excel | Microsoft | ||
| Stereomicroscope | Nikon | SMZ18 | |
| Tg(gsc:GFP) zebrafish line | Doitsidou, M. et al. Guidance of primordial germ cell migration by the chemokine SDF-1. Cell. 111 (5), 647–59, doi: doi.org/10.1016/S0092-8674(02)01135-2 (2002). | ||
| TriM Scope II microscope | La Vision Biotech |
参考文献
- Slack, J. M. W. Embryonic induction. Mechanisms of Development. 41 (2-3), 91-107 (1993).
- Fernandez-Sanchez, M. -. E., Brunet, T., Röper, J. -. C., Farge, E. Mechanotransduction's impact on animal development, evolution, and tumorigenesis. Annual Review of Cell and Developmental Biology. 31, 373-397 (2015).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Selleck, M. A. J. Culture and microsurgical manipulation of the early avian embryo. Methods in Cell Biology. 51 (51), 1-21 (1996).
- Bulina, M. E., et al. A genetically encoded photosensitizer. Nature Biotechnology. 24 (1), 95-99 (2006).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Colombelli, J., Grill, S. W., Stelzer, E. H. K. Ultraviolet diffraction limited nanosurgery of live biological tissues. Review of Scientific Instruments. 75 (2), 472-478 (2004).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods in Molecular Biology. 1189, 219-235 (2015).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. Journal of Visualized Experiments: JoVE. (159), (2020).
- Bonnet, I., et al. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface. 9 (75), 2614-2623 (2012).
- Rauzi, M., Lenne, P. F., Lecuit, T. Planar polarized actomyosin contractile flows control epithelial junction remodelling. Nature. 468 (7327), 1110-1115 (2010).
- Niemz, M. H. . Laser-Tissue Interactions. Encyclopedia of Biomaterials and Biomedical Engineering, Second Edition - Four Volume Set. , (2019).
- Smith, A. M., Mancini, M. C., Nie, S. Bioimaging: second window for in vivo imaging. Nature Nanotechnology. 4 (11), 710-711 (2009).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current Topics in Developmental Biology. 95, 93-144 (2011).
- Theveneau, E., David, N. B. Migrations cellulaires collectives. Medecine/Sciences. 30 (8-9), 751-757 (2014).
- Dumortier, J. G., Martin, S., Meyer, D., Rosa, F. M., David, N. B. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 16945-16950 (2012).
- Solnica-Krezel, L., Stemple, D. L., Driever, W. Transparent things: cell fates and cell movements during early embryogenesis of zebrafish. BioEssays. 17 (11), 931-939 (1995).
- Montero, J. -. A., Kilian, B., Chan, J., Bayliss, P. E., Heisenberg, C. -. P. Phosphoinositide 3-kinase is required for process outgrowth and cell polarization of gastrulating mesendodermal cells. Current Biology. 13 (15), 1279-1289 (2003).
- Ulrich, F., et al. Slb/Wnt11 controls hypoblast cell migration and morphogenesis at the onset of zebrafish gastrulation. Development. 130 (22), 5375-5384 (2003).
- Kai, M., Heisenberg, C. -. P., Tada, M. Sphingosine-1-phosphate receptors regulate individual cell behaviours underlying the directed migration of prechordal plate progenitor cells during zebrafish gastrulation. Development. 135 (18), 3043-3051 (2008).
- Smutny, M., et al. Friction forces position the neural anlage. Nature Cell Biology. 19 (4), 306-317 (2017).
- Johansson, M., Giger, F. A., Fielding, T., Houart, C. Dkk1 controls cell-cell interaction through regulation of non-nuclear β-Catenin pools. Developmental Cell. 51 (6), 775-786 (2019).
- Gorelik, R., Gautreau, A. Quantitative and unbiased analysis of directional persistence in cell migration. Nature Protocols. 9 (8), 1931-1943 (2014).
- Grill, S. W., Howard, J., Schäffer, E., Stelzer, E. H. K., Hyman, A. A. The distribution of active force generators controls mitotic spindle position. Science. 301 (5632), 518-521 (2003).
- Desprat, N., Supatto, W., Pouille, P. -. A. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell. 15 (3), 470-477 (2008).
- Farhadifar, R., Röper, J. -. C., Aigouy, B., Eaton, S., Jülicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Willier, B. H., Oppenheimer, J. M. . Foundations of Experimental Embryology. , (1964).
- Ashby, W. J., Zijlstra, A. Established and novel methods of interrogating two-dimensional cell migration. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (11), 1338-1350 (2012).
- Bosze, B., et al. Pcdh18a regulates endocytosis of E-cadherin during axial mesoderm development in zebrafish. Histochemistry and Cell Biology. 154 (5), 463-480 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。