Method Article
عمليات الاستئصال العميقة والتحكم المكانية في الحجم باستخدام مجهر فوتونين في زيبرافيش غاسترولا
In This Article
Summary
يتطلب التطور الجنيني تنسيقا واسع النطاق لحركة الخلية. يسمح الإثارة ثنائية الفوتونيز بالاجتثاث بالليزر بوساطة الاستئصال ثلاثي الأبعاد الذي يتم التحكم فيه مكانيا لمجموعات كبيرة من الخلايا العميقة. بالإضافة إلى ذلك ، يمكن لهذه التقنية التحقيق في رد فعل الخلايا المهاجرة بشكل جماعي في الجسم الحي للاضطرابات في بيئتها الميكانيكية.
Abstract
مورفوجينيسيس ينطوي على العديد من حركات الخلايا لتنظيم الخلايا في الأنسجة والأعضاء. ومن أجل التنمية السليمة، يجب تنسيق جميع هذه الحركات بإحكام، وتشير الأدلة المتراكمة إلى أن ذلك يتحقق، على الأقل جزئيا، من خلال التفاعلات الميكانيكية. اختبار هذا في الجنين يتطلب الاضطرابات الجسدية المباشرة. الاستئصال بالليزر هي خيار يستخدم بشكل متزايد الذي يسمح بتخفيف القيود الميكانيكية أو عزل جسديا اثنين من مجموعات الخلايا من بعضها البعض. ومع ذلك ، يتم إجراء العديد من عمليات الاستئصال باستخدام ليزر الأشعة فوق البنفسجية (UV) ، والذي يوفر دقة محورية محدودة واختراق الأنسجة. يتم وصف طريقة هنا ل ablate عميقة، كبيرة، وأحجام محددة بشكل جيد مكانيا باستخدام المجهر اثنين الفوتون. يتم عرض الاستئصالات في خط حمار وحشي معدل وراثيا يعبر عن البروتين الفلوري الأخضر في mesendoderm المحوري ويستخدم لقطع mesendoderm المحوري دون التأثير على ectoderm المفرط أو خلية الصفار الأساسية. يتم مراقبة سلوك الخلية عن طريق التصوير الحي قبل وبعد الاستئصال. يمكن استخدام بروتوكول الاستئصال في مراحل نمو مختلفة، على أي نوع من الخلايا أو الأنسجة، على نطاقات تتراوح بين بضعة ميكرونات إلى أكثر من مائة ميكرون.
Introduction
تلعب التفاعلات بين الخلية والخلية أدوارا حيوية في التنمية. توفر الخلايا إشارات يمكن لجيرانها المباشرين، أو الخلايا البعيدة، إدراكها، وبالتالي التأثير على مصيرهم و/أو سلوكهم. العديد من هذه الإشارات هي كيميائية في طبيعتها. على سبيل المثال، في أحداث التعريفية ذات الخصائص الجيدة، تنتج مجموعة خلايا واحدة جزيئات قابلة للنشر تؤثر على مصير مجموعة خلايا أخرى1. غير أن الإشارات الأخرى ميكانيكية؛ الخلايا تمارس القوات والقيود على جيرانهم، والتي يرى الجيران والرد على2.
إحدى الطرق لدراسة أهمية هذه التفاعلات بين الخلية والخلية في الجسم الحي هي القضاء على بعض الخلايا ومراقبة التطور اللاحق. لسوء الحظ، التقنيات المتاحة لإزالة أو تدمير الخلايا محدودة. يمكن إزالة الخلايا جراحيا3,4، باستخدام الإبر أو الأسلاك الصغيرة، ولكن هذه العلاجات الغازية، ليست دقيقة جدا، وعادة ما يتم تنفيذها تحت منظار مجسم، ومنع التصوير الفوري تحت المجهر. وعلاوة على ذلك، فإن استهداف الخلايا العميقة يعني ثقب ثقب في الأنسجة المفرطة، وخلق الاضطرابات غير المرغوب فيها. وقد استخدمت الحساسات الضوئية المشفرة وراثيا، مثل KillerRed، للحث على موت الخلايا عن طريق الإضاءة الخفيفة5. الحساسات الضوئية هي الكروموفوريس التي تولد أنواع الأكسجين التفاعلية عند تشعيع الضوء. الحد الرئيسي هو أنها تتطلب إضاءات ضوئية طويلة (حوالي 15 دقيقة) ، والتي قد يكون من الصعب تحقيقها إذا كانت الخلايا تتحرك ، وأنها تحفز موت الخلايا من خلال موت الخلايا المبرمج ، وهو أمر غير فوري.
وأخيرا، تم تطوير عمليات الاستئصال بالليزر واستخدامها على نطاق واسع في السنوات ال 15 الماضية6,7,8,9,10,11,12. ويركز شعاع الليزر على الخلية المستهدفة / الأنسجة. فإنه يحفز الاستئصال من خلال التدفئة, الاجتثاث الضوئي, أو الاستئصال الناجم عن البلازما; تعتمد العملية المعنية على كثافة الطاقة ووقت التعرض13. معظم بروتوكولات الاستئصال استخدام أشعة الليزر للأشعة فوق البنفسجية لطاقتها العالية. ومع ذلك، يتم امتصاص ضوء الأشعة فوق البنفسجية على حد سواء وتناثرها من قبل الأنسجة البيولوجية. وبالتالي ، فإن استهداف الخلايا العميقة يتطلب طاقة ليزر عالية ، مما يؤدي بعد ذلك إلى أضرار في أنسجة أكثر سطحية وخارج الطائرة. وهذا يحد من استخدام أشعة الليزر فوق البنفسجية إلى هياكل سطحية ويفسر دقة المحورية منخفضة نسبيا. البصريات غير الخطية (ما يسمى المجهر اثنين فوتون) يستخدم خصائص غير خطية للضوء لإثارة الفلوروفور مع اثنين من فوتونات من نصف الطاقة تقريبا في مجال الأشعة تحت الحمراء. عند تطبيقها على الاستئصال ، وهذا له ثلاث مزايا رئيسية. أولا، ضوء الأشعة تحت الحمراء أقل تشتتا وأقل امتصاصا من الأشعة فوق البنفسجية بواسطة الأنسجة البيولوجية14، مما يسمح بالوصول إلى هياكل أعمق دون زيادة قوة الليزر المطلوبة. ثانيا، استخدام ليزر نبضي femtosecond يوفر كثافات طاقة عالية جدا، وخلق الاستئصال من خلال التعريفي البلازما، والتي، خلافا للتدفئة، لا تنتشر مكانيا15. ثالثا، يتم الوصول إلى كثافة الطاقة التي تحفز تكوين البلازما في نقطة الاتصال فقط. وبفضل هذه الخصائص، يمكن استخدام استئصال الليزر ثنائي الفوتون لاستهداف الخلايا العميقة بدقة دون التأثير على بيئة الأنسجة المحيطة.
الهجرات الجماعية هي مثال ممتاز على العمليات التنموية التي تكون فيها التفاعلات بين الخلية والخلية أساسية. يتم تعريف الهجرات الجماعية على أنها هجرات الخلايا التي تؤثر فيها الخلايا المجاورة على سلوك الخلية الواحدة16. ويمكن أن تختلف طبيعة هذه التفاعلات (الكيميائية أو الميكانيكية) وكيفية تأثيرها على هجرة الخلايا اختلافا كبيرا وغالبا ما لا تكون مفهومة تماما. القدرة على إزالة الخلايا ومراقبة كيفية تأثير ذلك على الآخرين أمر بالغ الأهمية في زيادة كشف هذه العمليات الجماعية. قبل بضع سنوات، أثبتنا - باستخدام النهج الجراحية - أن هجرة البولستر أثناء تخثر سمك الحمار الوحشي هي هجرة جماعية17. بولستر هو مجموعة من الخلايا التي تشكل أول خلايا استيعاب على الجانب الظهري من الجنين18. هذه الخلايا، وصفت باللون الأخضر في خط Tg(gsc:GFP) المعدلة وراثيا، وتقع في عمق الجنين، تحت عدة طبقات من الخلايا epiblast. أثناء الاختراق ، تقود هذه المجموعة تمديد المحور المحوري ، والهجرة من المنظم الجنيني إلى القطب الحيواني19،20،21،22،23 (الشكل 1A). لقد أثبتنا أن الخلايا تتطلب الاتصال مع جيرانها لتوجيه هجرتهم في اتجاه القطب الحيواني. ومع ذلك، فإن فهم الأسس الخلوية والجزيئية لهذه الهجرة الجماعية بشكل أفضل ينطوي على إزالة بعض الخلايا لمعرفة كيف يؤثر ذلك على الخلايا المتبقية. لذلك ، قمنا بتطوير عمليات استئصال من كميات كبيرة وعميقة باستخدام إعداد مجهري ثنائي الفوتون. هنا، نحن نظهر استخدام هذا البروتوكول لقطع بولستر في وسطه ومراقبة العواقب على هجرة الخلايا عن طريق تتبع نواة المسمى مع Histone2B-mCherry.
Protocol
تمت الموافقة على جميع الأعمال الحيوانية من قبل اللجنة الأخلاقية N 59 وMinistère de l'Education Nationale، دي L'Enseignement Supérieur et la Recherche تحت رقم الملف APAFIS#15859-2018051710341011v3. بعض الخطوات المذكورة أدناه محددة لمعداتنا وبرامجنا ولكن يمكن تكييفها بسهولة مع المعدات المختلفة.
1. إعداد الحقن
- إعداد 75 مل من محلول الآغاروز 1٪ في الجنين المتوسط (EM).
- وضع قالب حقن في طبق بيتري 90 ملم وتصب ما يقرب من 50 مل من الآجروز، وهو ما يكفي لقالب لتعويم. دع الآغاروز يترسخ ويزيل قالب الحقن.
- إعداد طبق مغلفة agarose عن طريق صب 1 مل من الآغاروز في طبق بيتري 30 ملم.
- إعداد 4 ميكرولتر من 30 نانوغرام / μL Histone2B-mCherry مرنا الحل عن طريق تمييع محلول المخزون في المياه الخالية من RNase والحفاظ على الجليد.
ملاحظة: الحرص على ارتداء قفازات أثناء التلاعب مرنا لتجنب تدهور RNase بوساطة. - سحب إبرة حقن من الشعيرات الدموية باستخدام سحب micropipette.
2. إعداد الجنين
- مرة واحدة وقد وضعت الأسماك البيض، وجمع، وشطف، والحصاد في طبق بيتري 90 ملم في EM. ضع الأجنة في حاضنة 28.5 درجة مئوية.
- انتظر 20 دقيقة حتى تصبح الخلية الأولى مرئية.
- نقل 30 جنينا إلى لوحة الحقن مليئة EM. ضغط الأجنة في الأخاد باستخدام ملقط حادة قليلا وتوجيهها مع القطب الحيوان حتى.
- باستخدام طرف محمل صغير، املأ إبرة الحقن بمحلول 2 ميكرولتر من الحمض النووي الريبي. أدخل الإبرة في حامل الشعرية الموضوع في متلاعب صغير متصل بأنابيب البوليتيترافلوروإيثيلين (PTFE) إلى حاقن الهواء.
- تحت المنظار المجسم، كسر بعناية غيض من الإبرة.
- حقن محلول مرنا في الأجنة مرحلة 1 خلية عن طريق إدخال الإبرة في الخلية.
ملاحظة: وحدة التخزين حقن حوالي ثلث وحدة تخزين الخلية. - ضع الأجنة المحقونة مرة أخرى في حاضنة 28.5 درجة مئوية.
3. إعداد مجهر فوتونين
ملاحظة: يتم استخدام اثنين من أشعة الليزر في هذا البروتوكول. واحد يستخدم لتصوير GFP (في 920 نانومتر) وإجراء عمليات الاستئصال (في 820 نانومتر). وسوف يشار إليها باسم الليزر الأخضر / الاستئصال. ويستخدم الآخر في 1160 نانومتر لتصوير mCherry. وسوف يشار إليها باسم الليزر الأحمر.
- تعيين الليزر الأخضر / الاستئصال إلى 820 نانومتر (الطول الموجي الاستئصال) والليزر الأحمر إلى 1160 نانومتر (mCherry الإثارة).
- باستخدام المرايا المنقولة على المسار البصري، قم بمحاذاة أشعة الليزر الخضراء/الاجتثاث والأحمر عند دخول رئيس المسح الضوئي وخروجه.
ملاحظة: هذا يزيد من تركيز شعاع الليزر ويقلل من حجم البؤرة للإثارة والاجتثاث. - قياس القوة القصوى لليزر الأخضر / الاستئصال في 820 نانومتر تحت الهدف. للقيام بذلك، ضع عداد الطاقة تحت الهدف، أغلق الغرفة السوداء، تعيين طاقة الليزر الخضراء / الاستئصال إلى 100٪، وفتح مصاريع. حساب النسبة المئوية لطاقة الليزر اللازمة للوصول إلى 300 كيلوواط.
- أعد الليزر الأخضر/الاجتثاث إلى 920 نانومتر (إثارة GFP) وحدد طاقة الليزر إلى 7٪. تعيين طاقة الليزر الحمراء إلى 15٪.
- تنشيط epi-PhotoMultiplier أنابيب (PMT) كاشفات للخطوط الخضراء والحمراء; تعيين حساسية PMT الخط الأخضر والأحمر إلى 65.
- تعيين مجال الرؤية إلى 400 × 400 ميكرومتر ، ودقة الصورة إلى 512 × 512 بكسل ، وتردد المسح الضوئي إلى 800 هرتز.
- حدد وضع التصوير الفاصل الزمني ثلاثي الأبعاد . ثم قم بإنشاء مجلد وتنشيط الحفظ التلقائي للبيانات بعد كل عملية اقتناء.
- تجميع غرفة التدفئة وتعيينها إلى 28 درجة مئوية. انتظر ما لا يقل عن 10 دقيقة للغرفة والهدف من ذلك إلى الحارة.
4. تركيب الجنين
- تحت منظار مجسم مفلور، حدد الأجنة بنسبة 70٪ من البشرة التي تعبر عن GFP.
ملاحظة: حدد الأجنة ذات الإشارة الساطعة في مؤشر الميوديرم المحوري وبدون مضان الخلفية للحصول على جودة تصوير أفضل. - نقل ثلاثة إلى أربعة أجنة مختارة في طبق المغلفة agarose (الخطوة 1.3) باستخدام ماصة باستور البلاستيك و dechorionate بعناية لهم باستخدام ملقط ناعم.
ملاحظة: الأجنة dechorionated حساسة جدا وسوف تنفجر عند ملامسة الهواء أو البلاستيك. - صب 1 مل من 0.2٪ agarose في 1x البنسلين-streptomycin EM في قارورة زجاجية صغيرة. ضع القارورة في سخان كتلة جافة مسخن 42 درجة مئوية.
ملاحظة: يجب تنفيذ الخطوات التالية بسرعة للسماح اتجاه الجنين قبل مجموعات agarose. - نقل جنين dechorionated في قارورة الزجاج agarose 0.2٪ باستخدام ماصة زجاجية مصقول النار. الحرص على عدم إضافة الكثير من EM في agarose لتجنب تمييعه. تجاهل EM المتبقية من ماصة و يستنشق الجنين مرة أخرى جنبا إلى جنب مع ما يكفي من agarose لتغطية الشريحة من طبق أسفل الزجاج قبل أن يسقط الجنين من المصصة.
- ضربة agarose والجنين على الشريحة الزجاجية للطبق. الحرص على عدم السماح للجنين لمس الهواء أو الجانب البلاستيكي من الطبق. بعد ذلك، ملء الغرفة حول الشريحة الزجاجية مع agarose.
- استخدم رمش لتوجيه الجنين بحيث تكون المنطقة المستهدفة في الأعلى (الشكل 1B).
ملاحظة: عند توجيه الأجنة، والحرص على لمس blastoderm فقط، وليس صفار هشة جدا. سوف Agarose تعيين في حوالي 1 دقيقة، اعتمادا على درجة حرارة الغرفة. - الانتظار ~ 5 دقائق لgarose لتعيين تماما، ومن ثم إضافة بضع قطرات من البنسلين-streptomycin EM.
5. تحديد مكان الجنين والتصوير قبل الاستئصال
- ضع طبق القاع الزجاجي تحت الهدف في الغرفة الساخنة. تزج الهدف في البنسلين-streptomycin EM وإغلاق غرفة ساخنة.
- حرك شريط التمرير لتعيين مسار الضوء إلى العينين. ثم، وذلك باستخدام العين، ومصابيح الفلورسنت، والسيطرة على المرحلة، والعثور على الجنين وتعيين التركيز على سطح الجنين.
- قم بإيقاف تشغيل المصباح الفلوري، وحدد مسار الضوء إلى PMTs، واغلق الغرفة السوداء.
ملاحظة: كن حذرا لإيقاف تشغيل كافة مصادر الضوء في الغرفة السوداء كما قد تلحق الضرر PMTs. - بدء التصوير الحي وتحديد موقع mesoderm المحورية. ضبط القوى الليزر الأخضر / الاستئصال والأحمر أن يكون لها إشارة جيدة (أي بين 1000 و 20000 الفوتونات لكل بكسل للمناطق التعبير عن GFP). استخدم القناة الحمراء لنقل المرحلة إلى أعلى الجنين وقم بتعيين هذا الموضع على أنه Z = 0.
- اختر خطوة زمنية من 1 دقيقة وخطوة Z من 2 ميكرومتر. دورة Z من 110 ميكرومتر كافية لتشمل بولستر كله ويتم الحصول عليها في أقل من 1 دقيقة مع هذه الإعدادات. تعيين الشريحة الأولى 15 ميكرومتر فوق mesoderm المحورية (في ectoderm أكثر سطحية).
ملاحظة: يتحرك بولستر على طول خط منحني بحيث يجب تعيين الشريحة السفلية من المكدس Z 30 ميكرومتر أعمق من موضع أعمق بولستر لاستيعاب حركتها أثناء التصوير الفاصل الزمني (الشكل 1E). - سجل 10-15 دقيقة من فيلم ما قبل الاستئصال.

الشكل 1: النتيجة الناجحة للاجتثاث بالليزر. (أ) مخطط الجنين الغازي بنسبة 70٪ في المنظر الظهري؛ (ب) مخطط الجنين المتخثر بنسبة 70٪ في المنظر الظهري؛ (ج) مخطط للجنين المتخثر بنسبة 70٪ في المنظر الظهري؛ (ج) مخطط للجنين المتخثر بنسبة 70٪ في المنظر الظهري؛ (ج) مخطط للجنين المتخثر بنسبة 70٪ في المنظر الظهري؛ (ج) مخطط للجنين المتخثر pAM: الميوديرم المحوري الخلفي; السهم الأسود علامات اتجاه الهجرة بولستر; مربع أسود يشير إلى حقل نموذجي من وجهة نظر لاجتثاث في بولستر. (ب) مخطط تصاعد الجنين لقطع بولستر. عرض الجانبي. يتم تركيب الجنين بحيث يكون مستوى البولستر عموديا على المحور البصري. (ج) البقاء على قيد الحياة و(د) مورفولوجيا السيطرة والأجنة الاجتثاث في 24 ساعة بعد الإخصاب. شريط المقياس هو 300 ميكرومتر (E) تسلسل زمني من الاستئصال بالليزر في بولستر جنين Tg (gsc:GFP) يعبر عن Histone2B-mCherry. المشاهدات مع القناة الخضراء هي فقط الحد الأقصى للتوقعات. تعرض الصحيفة المقربة المنطقة المائلة التي تحتوي على حطام الخلية. طرق العرض مع قنوات الأخضر والأحمر (المعروضة كما أرجواني) هي شرائح XY و XZ قبل وبعد الاستئصال (الصاعقة الخضراء تمثل الاستئصال). تظهر شرائح XZ أن الأنسجة المغالاة (نواة أرجوانية بدون تعبير GFP) لم تتأثر باجتثاث الهياكل الأساسية. يتوافق المربع الأصفر المتقطع مع عائد الاستثمار المحدد لعلاج الاستئصال بالليزر. يبلغ حجم شريط القياس 50 ميكرومترا في الإطلالات الكبيرة و25 ميكرومترا في القرب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. الهدف الموقع والاجتثاث بالليزر
- حدد موقع كفاف بولستر على التصوير الحي، وباستخدام أداة منطقة الاهتمام للمعامل الكهربائي البصري (EOM ROI)، ارسم مستطيلا كبيرا بحجم 20 بكسل (15 ميكرومترا) يمتد بعرض البولستر. ضع هذا المستطيل في منتصف بولستر (الشكل 1E).
- لاحظ الموضع المحوري للمستويات الأعلى والأدنى التي تحتوي على خلايا بولستر. سيتم إجراء عمليات الاستئصال كل 10 ميكرومتر بين هاتين الطائرتين. الحرص على أن ROI لا تتداخل الخلية صفار على أي من هذه الطائرات.
- ضع المرحلة في الموضع Z الأدنى للفاصل الزمني. يجب إجراء عمليات الاستئصال من أسفل إلى أعلى حيث يمتص الحطام الضوء.
- تعيين الطول الموجي ليزر الأخضر / الاستئصال إلى 820 نانومتر وتعيين نسبة الطاقة للحصول على قوة الخروج من 300 كيلوواط (الخطوة 3.3).
- تعيين تردد التصوير إلى 200 هرتز.
- تعيين الأخضر / الاستئصال التصوير بالليزر EOM إلى 0 وحدد ROI-علاج الوضع.
- قم بتشغيل EOM وتعيين العلاج لبدء فورا (بعد 0 الإطار).
- تعيين وضع التصوير إلى الفاصل الزمني وإزالة تنشيط الحفظ التلقائي.
- تعيين وضع خطوة الوقت إلى سريع.
- تعيين عدد إطارات المعالجة وعدد الإطارات إلى القيمة المطابقة للعمق المستهدف (الجدول 1).
| العمق (ميكرومتر) | إطارات العلاج |
| -30 | 1 |
| -35 | 1-2 |
| -40 | 1-2 |
| -45 | 2 |
| -50 | 2-3 |
| -55 | 3 |
| -60 | 3-4 |
| -65 | 4 |
| -70 | 4 |
| -75 | 4-5 |
| -80 | 4-5 |
| -85 | 5 |
| -90 | 5 |
| -95 | 5-6 |
| -100 | 6 |
| -105 | 6 |
الجدول 1: العدد المقترح لإطارات المعالجة بالليزر كدالة لعمق الخلية المستهدف في الجنين (0 هو سطح الجنين).
- بدء التصوير. الاستحواذ أسود مع إغلاق الغالق إلى PMT أثناء علاج EOM.
- الانتقال إلى أعلى المرحلة إلى الموضع Z التالي من القائمة (الخطوة 6.2).
- كرر الخطوات من 6.10 إلى 6.12 حتى يتم الوصول إلى أعلى بولستر.
7. التحقق والتصوير بعد الاجتثاث
- تعيين ليزر الخضراء / الاستئصال إلى 920 نانومتر و 5٪ السلطة. تعيين التصوير بالليزر الأخضر /الاستئصال EOM إلى 100 وحدد وضع Fullfield .
- تعيين تردد التصوير إلى 800 هرتز.
- الذهاب من خلال كومة كاملة في وضع العيش للتحقق مما إذا كان قد تم ablated كل طائرة. إذا لم يكن هذا هو الحال، العودة إلى الخطوة 6.2.
ملاحظة: الاستئصال أحيانا يؤدي إلى تحول عمودي من الأنسجة المجاورة بحيث قد يكون Z-كومة لإعادة تعريف. - تعيين وضع التصوير إلى الفاصل الزمني ثلاثي الأبعاد وإعادة تنشيط الحفظ التلقائي. سجل 40-60 دقيقة من فيلم ما بعد الاستئصال.
- تحقق، في فيلم ما بعد الاستئصال، ما إذا كانت الخلايا المستهدفة قد تم استئصالها بشكل فعال. ويشير استرداد الفلورسينس، أو الخلايا المستهدفة التي تشغل حيزا وتمنع خلايا المتابعين من التحرك، إلى أن الخلايا المستهدفة كانت مضروبة ضوئيا فقط وليست مشوهة (الشكل 1E والشكل 2 ألف).
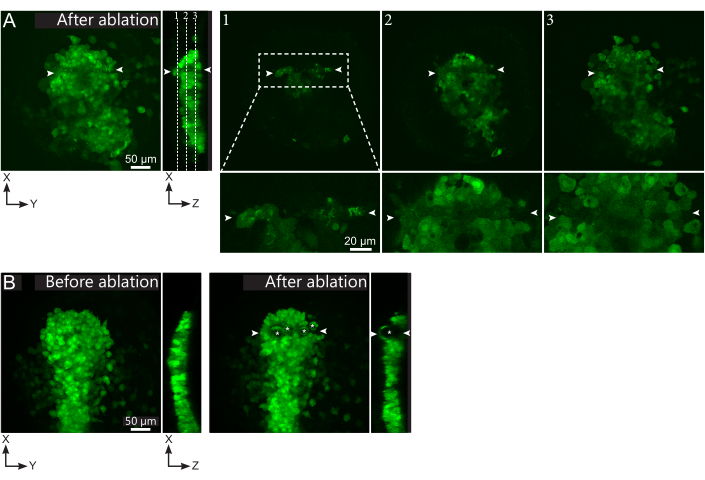
الشكل 2: النتائج السلبية لاجتثاث الليزر. (أ) أمثلة نموذجية للإخفاقات المحتملة في استئصال الليزر. طرق العرض XY كبيرة هي أقصى التوقعات، XZ عرض هو قسم أعيد بناؤها. منطقة المعالجة بالليزر تقع بين رأسي السهم الأبيض. يتم تمييز ثلاث طائرات محورية في القسم المعاد بناؤه وعرضها على اليمين. وهي تتوافق مع ثلاثة أنواع مختلفة من الإخفاقات. الطائرة 1 تظهر أن الخلايا فوق البولستر قد تم اجتثاثها. ويمكن تحديد ذلك من خلال وجود حطام تلقائي على هذا المستوى البؤري (انظر عن قرب) فوق ال polster (انظر موقع الطائرة 1 في القسم المعاد بناؤه). وهذا ينتج على الأرجح من تعريف غير صحيح للمنطقة إلى أن يتم اجتثاث. تظهر الطائرة 2 الخلايا التي تم تبييضها ولكن لم يتم اجتثاثها. ويمكن تحديدها على أنها إشارة مضان منخفضة لا تزال تكشف عن ملامح الخلايا سليمة (انظر عن قرب). تعرض الطائرة 3 خلايا سليمة، والتي بالكاد تم تبييضها عن طريق العلاج بالليزر. وقد ينتج ذلك عن تعريف غير صحيح للمنطقة يمكن استئصاله أو سوء المعاملة. في الحالات التي تم تصويرها في الطائرتين 2 و 3 ، من الممكن إعادة تطبيق علاج الاستئصال على الخلايا المستهدفة غير الاجتثاث. يبلغ حجم شريط القياس 50 ميكرومترا في الإطلالات الكبيرة و20 ميكرومترا في القرب. (ب) مثال نموذجي للفقاعات (التي تتميز النجمة البيضاء) التي شكلتها التجويف بسبب العلاج بالليزر مكثفة جدا. لا تقتصر هذه الفقاعات على طائرة Z ، بل وتمتد في بعض الأحيان على الارتفاع الكامل للبولستر ، وتشوه الأنسجة المجاورة. شريط المقياس هو 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
8. تحليل البيانات
- افتح سلسلة الفاصل الزمني مع برنامج تحليل الصور وحدد حجم البكسل الصحيح.
- في الدالة Spot ، قم بتعيين حجم الكائن إلى 10 ميكرومتر، حيث أن هذا هو متوسط حجم النواة أثناء الاختراق. ثم قم بتشغيل الدالة Spot للكشف عن النوى وتعقبها.
ملاحظة: قد يكون الكشف عن تحسن طفيف بالنظر إلى انخفاض دقة المحورية، وتركيب شكل بيضاوي طويل 12 ميكرومتر على طول المحور Z. - استخدم عوامل التصفية لإزالة الإيجابيات الخاطئة. في خط Tg (Gsc:GFP) ، يتم تسمية الخلايا من المحور الجنيني وبعض خلايا الجلد باللون الأخضر. وبالتالي، تصفية على كثافة خضراء يسمح اختيار سريع من هذه الخلايا (الشكل 3A).
- تعيين المسافة القصوى بين النقاط المتتالية إلى قيمة متوافقة مع سرعة الخلايا.
ملاحظة: يجب مراعاة الفاصل الزمني بين إطارين. تهاجر خلايا بولستر عند 2.8 ± 0.8 ميكرومتر/دقيقة. وبالتالي، فإن السماح ب 4 ميكرومتر من الحد الأقصى للإزاحة لخطوة زمنية تبلغ 1 دقيقة يزيل معظم المسارات اليدوية. - السماح للثغرات على نقطة واحدة أو نقطتين الوقت يوفر مسارات أطول مستمرة ولكن قد يعرض أخطاء التتبع. إذا لم يتم الكشف عن نواة بشكل صحيح عند نقطة واحدة، ففكر في إعادة تشغيل الكشف الموضعي باستخدام معلمات/عوامل تصفية مختلفة.
- تحقق بصريا المسارات، وإذا لزم الأمر، تصحيحها.
- تصدير النتائج كملف .xlsx. معالجة الملف باستخدام إجراءات جدول البيانات المنشورة24 (الشكل 3B) والروتينات المخصصة على برامج تحليل البيانات (متوفرة عند الطلب).
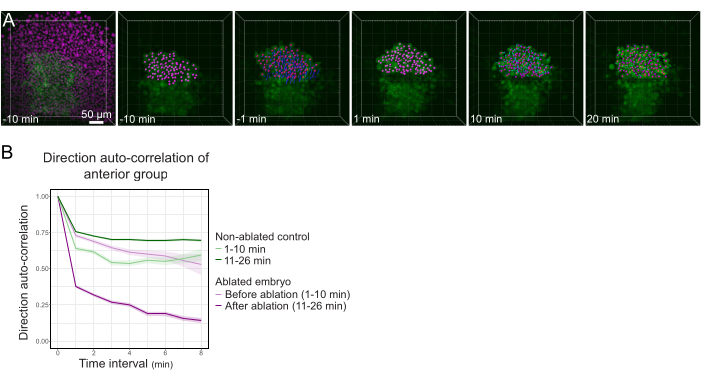
الشكل 3: عزل النصف الأمامي من بولستر يؤثر على اتجاه الخلية. (أ) إعادة بناء 3D جنين TG (gsc:GFP) يعبر عن Histone2B-mCherry (معروض باللون الأرجواني) ، قبل وبعد استئصال الليزر الذي يقطع الشستر في منتصفه. نوي تنتمي إلى النصف الأمامي من بولستر يتم وضع علامة مع نقطة أرجواني وتتبع مع مرور الوقت قبل وبعد الاستئصال (انظر الفيلم S1). شريط المقياس هو 50 ميكرومتر (ب) كمقياس لاستمرار الهجرة، اتجاه الارتباط التلقائي للخلايا التي تنتمي إلى الجزء الأمامي من بولستر قبل وبعد الاستئصال. تعرض الخلايا حركة مستمرة قبل الاستئصال ، والتي تنخفض بشكل كبير بعد الاستئصال ، مما يشير إلى فقدان الهجرة الجماعية المنحى. كما تم قياس الاتجاه التلقائي الارتباط على الخلايا التي تشكل النصف الأمامي من بولستر من الجنين غير الاجتثاث، كعنصر تحكم. تشير مغلفات الرسم البياني إلى خطأ قياسي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لقطع بولستر في وسطه، تم تركيب جنين Tg (gsc:GFP)، الذي تم حقنه مع الهستون2B-mCherry mRNAs في مرحلة epiboly 70٪، كما هو موضح في الخطوة 4. تم التعرف على بولستر بواسطة التعبير GFP، وتم تركيب الجنين بحيث يكون مستوى بولستر عموديا على المحور البصري (الشكل 1B). إن إمالة الجنين بعيدا عن هذا الوضع سوف تعقد الإجراء. يجب أن يمر الضوء عبر المزيد من الأنسجة للوصول إلى طائرات الاستئصال ، وسيتم إمالة طائرات الاستئصال بالنسبة إلى الفؤوس الجنينية. بعد التحقق من أن جميع نواة الخلية وصفت بشكل صحيح، تم تسجيل 10 دقيقة قبل الاستئصال الفاصل الزمني لالتقاط حركات الخلية قبل الاستئصال (الشكل 1E والشكل 3A، فيلم S1).
تم تحديد بولستر بشكل شكلي، وتم استئصال منطقة مستطيلة من 15 ميكرومتر × 200 ميكرومتر، تقع في وسطها، على خمس طائرات محورية لضمان قطع على عمق كامل من بولستر (الشكل 1E، فيلم S1). تم إعادة تشغيل التصوير مباشرة بعد الاستئصال واستخدم لرصد كفاءة الإجراء. إذا نجحت، فإن الاستئصال قد قضت على جميع الهياكل الخلوية وGFP و mCherry مضان بحيث يجب أن تظهر وحدة التخزين المزيلة كحجم خالية من الإشارات. ومع ذلك، قد تنشأ بعض الحطام. هذا الحطام هو autofluorescent، سواء في القنوات الخضراء والحمراء، وعادة ما يعرض الأشكال ممدود غير النظامية موازية لاتجاه الاستئصال (الشكل 1E). وهناك علاج مكثف جدا تشكل كمية كبيرة من الحطام التي قد تكون بمثابة عقبة وسلوك الخلية المضطربة. العلاجات أقوى سوف تحفز حتى التجويف، تميزت بتشكيل فقاعات في الأنسجة (الشكل 2B). ويرتبط التجويف مع موجة صدمة الميكانيكية تنتشر في الأنسجة، ويمكن أن تؤدي إلى أضرار من حجم المستهدف13,15. يجب التخلص من الأجنة ذات فقاعات التجويف ، وينبغي ضبط العلاج عن طريق تنفيذ إطارات علاج أقل.
وعلى العكس من ذلك، فإن القليل جدا من العلاج قد يفلوروفلوراش photobleach دون تحفيز تشكيل البلازما، وبالتالي دون ablating (الشكل 2A). يمكن بسهولة رصد الbleaching غير مكتملة من خلال وجود مضان خافت مع شكل خلوي مميز (الشكل 2A). وينبغي التخلص من هذه الأجنة أو علاجها مرة أخرى أداء المزيد من أطر العلاج. يعد التعتيم الضوئي الكامل أكثر صعوبة للتمييز عن الاستئصال الناجح ، حيث سيؤدي كلاهما إلى حجم خال من الإشارات. ومع ذلك ، يمكن تحديد Photobleaching بأثر رجعي ، حيث سيتعافى الفلورسينس تدريجيا أثناء التصوير بعد الاجتثاث. ومع ذلك، فإن هذا يعني أن الأجنة غير المستأسد يتم تصويرها لمدة نصف ساعة على الأقل، وهو أمر يستغرق وقتا طويلا. لذلك نقترح تعديل كثافة العلاج (عن طريق زيادة عدد العلاجات) للحث على تكوين عدد قليل من الحطام المرئي ، والذي لن يؤثر على سلوك الخلية ولكنه يؤكد على الفور الاستئصال الفعال. وأخيرا، ينبغي التحقق من عدم وجود ضرر في الخلايا المحيطة بحجم الاستئصال على الصور الأولى بعد الاجتثاث (الشكل 2A). عندما يتم ضبطها بشكل صحيح العلاج بالليزر (تشكيل الحطام قليلة)، والأضرار في الأنسجة المجاورة من غير المرجح أن تنتج عن الانتشار المكاني للاجتثاث، الذي هو جيد جدا تعريف مكانيا، ولكن بدلا من ذلك نتيجة لاختيار غير دقيقة من المنطقة إلى أن يتم اجتثاث و / أو حركات الأنسجة في الوقت بين اختيار الهدف والاجتثاث. يجب التخلص من الأجنة ذات الأنسجة المجاورة المصابة.
بعد الاستئصال الناجح ، تم التقاط مداخن Z كل دقيقة لمدة 40 دقيقة ، وتسجيل كل من إشارة السيتوبلازمية GFP والإشارة النووية mCherry. ثم تم تعقب النوى، واستخدمت حركتهم كوكيل لحركة الخلية. تم تحديد المسارات المقابلة لخلايا بولستر على إشارة GFP القوية (الشكل 3A ، الفيلم S1). تم قياس استمرار حركة الخلية من خلال حساب اتجاه الخلية التلقائي الارتباط24. التركيز على خلايا بولستر الموجودة في النصف الأمامي من بولستر كشفت أن قطع بولستر في وسطه، وبالتالي فصل هذه الخلايا من الجزء الخلفي من بولستر، انخفض اتجاهها autocorrelation (الشكل 3B)، مما يدل على أن الهجرة السليمة للخلايا بولستر يتطلب سلامة بولستر كله، تمشيا مع الهجرة الجماعية أظهرت 17.
بعد الحصول على فيلم ما بعد الاستئصال ، يمكن إزالة الأجنة ، واستخراجها بعناية من الآغروز باستخدام ملقط ناعم ، واحتضانها عند 28.5 درجة مئوية حتى تصل إلى 24 ساعة بعد الإخصاب. مرة أخرى، يجب أن تبقى الأجنة على قيد الحياة ولا ينبغي أن تقدم أي عيب مورفولوجي واضح (الشكل 1C، D).
فيلم S1: استئصال الليزر الناجح. الاستئصال بالليزر في منتصف بولستر من جنين TG (gsc:GFP) التعبير عن Histone2B-mCherry. يتم تعقب النوى من الجزء الأمامي من بولستر مع مرور الوقت وتتميز النقاط أرجواني. المسارات هي الوقت مرمزة بالألوان (الشكل 3). تتوافق الإطارات الفارغة مع استئصال الليزر. الرجاء الضغط هنا لتحميل هذا الفيلم.
Discussion
هنا، نقوم بوصف بروتوكول يستخدم البصريات غير الخطية لإجراء عمليات استئصال حجم عميقة ومحددة مكانيا. الخطوة الأكثر أهمية في البروتوكول هي العثور على ظروف العلاج التي توفر الطاقة الكافية للسماح بالاجتثاث ، ولكن ليس الكثير من الطاقة ، لتجنب الحطام المفرط أو التجويف. تعتمد كمية الطاقة المسلمة في الموقع المستهدف بشكل رئيسي على: (1) قوة مخرج الليزر ، (2) جودة محاذاة الليزر ، (3) طبيعة الأنسجة التي يمر من خلالها الضوء للوصول إلى مستوى الاستئصال ، (4) عمق مستوى الاستئصال. لذلك، قبل كل تجربة، من المهم قياس قوة الخروج بالليزر، وضبطها على قيمة مرجعية (300 كيلوواط عند 820 نانومتر في بروتوكولنا)، وضمان محاذاة الليزر المناسبة. وبموجب هذه الافتراضات، ينبغي أن تكون ظروف العلاج قابلة للتكرار من يوم تجريبي إلى آخر. نوصي بإجراء اختبارات شاملة لتحديد المعلمات المثلى (طاقة الليزر وعدد إطارات المعالجة) لنوع عينة محدد. ويمكن بعد ذلك استخدام هذه المعلمات في جميع التجارب المماثلة. في المثال الموصوف هنا (قطع البولستر أثناء التخثر) ، قمنا ، على سبيل المثال ، بإنشاء ظروف علاج للاجتثاث في أعماق مختلفة داخل الجنين (الجدول 1) ونعتمد الآن على هذا المخطط عند إجراء التجارب. وتجدر الإشارة إلى أنه تم اختيار الطول الموجي 820 نانومتر كما هو، على نظامنا، الطول الموجي توفير أعلى الطاقات الذروة (بسبب خصائص الليزر والبصريات). ويمكن استخدام أطوال موجية أقصر أو أطول تبعا لخصائص النظام 6,11,12. عمق الأنسجة المستهدفة كونها معلمة حاسمة، تصاعد الجنين هو أيضا خطوة حاسمة، كما تصاعد غير صحيح قد تزيد من سمك الأنسجة التي يجب أن تمر الضوء من خلال للوصول إلى حجم الهدف.
واحدة من السمات الأصلية للبروتوكول الموصوف هو تخفيف حجم كامل من خلال إجراء عمليات الاستئصال المتعاقبة على طائرات محورية مختلفة. وبما أن الاستئصالات ستولد حطاما يمتص الضوء، فقد حددنا أنه من الأهمية بمكان البدء في الاستئصال على أعمق مستوى والإزالة بالتتابع من أعمق الطائرات إلى أكثرها سطحية.
يصف هذا البروتوكول استئصال الكميات العميقة والكبيرة وتسجيل استجابة الأنسجة المجاورة في غضون دقائق بعد الاستئصال لأكثر من ساعة. أحد القيود المحتملة للبروتوكول هو الوقت المطلوب لإجراء الاستئصال وإعادة تشغيل التصوير. وهناك عاملان يحدان من هذا التأخير. الأول هو الوقت اللازم لإجراء عمليات الاستئصال على طائرات محورية متعددة. على نظامنا ، يتم تنفيذ قطع بولستر من قبل مستخدم مدرب في 2-3 دقيقة. ويمكن تخفيض هذا عن طريق تحسين البرنامج لأتمتة الاستئصال على طائرات مختلفة. ومع ذلك، فإن إجمالي وقت الاستئصال يساوي الوقت اللازم لمسح المنطقة المستهدفة، ويعادل عدد التكرارات على كل طائرة محورية، أضعاف عدد الطائرات المحورية، التي تبلغ في ظروفنا حوالي دقيقة واحدة. بالنظر إلى سرعة ترحيل الخلية، فهذا يعني أن بعض الخلايا قد تدخل المنطقة المستهدفة أو تخرج منها أثناء إجراء الاجتثاث. في حالتنا، لم يثبت أن هذه مشكلة ولكن يمكن أن يكون إذا كان هناك حاجة إلى دقة مطلقة في استهداف الخلايا. العامل الحد الثاني هو أن يتم استخدام نفس الليزر لإجراء الاستئصال (في 820 نانومتر) وإثارة الفلوروفور الأخضر (في 920 نانومتر). وبالتالي يتم تعريف التأخير بين الاستئصال الأخير وبداية التسجيل من خلال الوقت اللازم لضبط الليزر من 820 نانومتر إلى 920 نانومتر ، تتراوح بين 30 s إلى 1 min.
في بعض الحالات، على وجه الخصوص، بالنسبة للاجتثاثات الأصغر (استئصال الخلية الواحدة، واجتثاث المكونات دون الخلوية مثل عناصر الهيكل الخلوي)، قد يكون تسجيل الاستجابة الفورية للخلية/الأنسجة أمرا حاسما للاستدلال على حالته الميكانيكية25,26,27. في مثل هذه الحالات، يمكن التحايل على القيد، إما عن طريق التصوير بالليزر آخر (هنا، على سبيل المثال، تسجيل إشارات حمراء فقط مع ليزر 1160 نانومتر أو باستخدام خط ليزر ثالث) أو تصوير الفلوروفور الأخضر في 820 نانومتر. هذا ليس الطول الموجي الأمثل للتصوير (الإثارة المحدودة للفلوروفوريس ، والآثار القوية السامة للصور) ولكن يمكن استخدامها على مدى فترات قصيرة لتسجيل استجابة الأنسجة الفورية.
تتوفر تقنيات قليلة للقضاء على الخلايا ومعرفة كيف يؤثر ذلك على بقية الجنين. الخياران الرئيسيان هما إزالة الخلايا جسديا أو تدميرها ، كما هو الحال في عمليات الاستئصال بالليزر. بالمقارنة مع الإزالة المادية، قد يؤدي تدمير الخلايا إلى إطلاق محتوى السيتوبلازمي، الذي يمكن أن يؤثر على الخلايا المجاورة. وقد تم تسليط الضوء على ذلك تاريخيا من خلال الجدل والنتائج المتباينة التي حصل عليها فيلهلم رو وهانز دريسك فيما يتعلق بالفسيفساء أو التطور التنظيمي للضفدع وجنين قنفذ البحر28. في الآونة الأخيرة ، لوحظت اختلافات في فحوصات التئام الجروح ، اعتمادا على ما إذا كان الجرح يتم إنشاؤه عن طريق الصفر (الذي يدمر بعض الخلايا) أو إزالة insert29. ومع ذلك ، فإن إزالة الخلايا جسديا دون إتلاف الأنسجة الأخرى ممكن فقط للخلايا على سطح الجنين والخلايا التي لا ترتبط كثيرا بجيرانها ، مما يحد من نطاق هذه النهج. ونتيجة لذلك، تم تطوير استراتيجيات مختلفة لتدمير الخلايا، والاجتثاث بالليزر هو الأكثر توظيفا. وقد تم استخدام عمليات الاستئصال بالليزر بالأشعة فوق البنفسجية وتستخدم بشكل متزايد ، على وجه الخصوص ، لإجراء عمليات استئصال سطحية صغيرة ، ومراقبة استجابة الأنسجة الفورية.
وصفنا هنا استخدام ضوء الأشعة تحت الحمراء لإجراء عمليات استئصال أعمق ومحددة مكانيا. القيد الرئيسي لهذا البروتوكول هو شرط ليزر نبضي بالأشعة تحت الحمراء وإعداد التصوير اثنين فوتون. ومع ذلك ، فإن هذه المعدات أصبحت أكثر وأكثر تواترا على منصات التصوير. بالإضافة إلى ذلك ، يمكن استبدال EOM المستخدمة هنا لثني منطقة واحدة في الصورة بشكل انتقائي بوحدة استرداد الفلورية بعد الbleaching الضوئي (FRAP). على الرغم من أنه أقل ملاءمة ، إلا أنه يمكن حتى تنفيذ البروتوكول بدون وحدات EOM أو FRAP ببساطة عن طريق التكبير على المنطقة المستهدفة10. باستخدام الليزر بالأشعة تحت الحمراء نبضي يجلب اثنين من المزايا الرئيسية مقارنة مع معظم بروتوكولات الاستئصال الكلاسيكية. أولا، بفضل الاختراق الفعال للأشعة تحت الحمراء في الأنسجة الحية، يمكن الوصول إلى الطائرات المحورية العميقة مع قوى الليزر التي لا تحفز الأضرار خارج التركيز. سمح لنا هذا باستهداف خلايا بعمق يصل إلى 120 ميكرومتر ، بعيدا عن متناول اليد مع بروتوكولات إثارة الفوتون الواحد. ثانيا، يضمن استخدام البصريات غير الخطية دقة محورية ممتازة، مما يسمح بالاجتثاث ثلاثي الأبعاد الذي يتم التحكم فيه بدقة، حتى في العمق في الأنسجة. الجمع بين هاتين الميزةين يسمح الاستئصال من أحجام محددة على وجه التحديد ، عميقة ، وكبيرة في نهاية المطاف.
نحن نصف استخدام مجهر فوتونين لقطع بولستر، وهي تجربة قمنا نحن وآخرون مؤخرا بتنفيذها30. ومع ذلك، ومع إدخال تعديلات قليلة، يمكن تكييف البروتوكول المقترح مع العديد من العينات المختلفة. لقد استخدمناها بنجاح، على سبيل المثال، لإجراء استئصال كامل للبولستر، أو استئصال داخل الميسودرم الجانبي أثناء التخثر، أو استئصال خلايا شوان الفردية أثناء هجرتها على محورها المحوري المرتبط بها، دون التأثير على المحور. لذلك، نعتقد أن هذا البروتوكول هو أداة قيمة ومتعددة الاستخدامات، والتي ينبغي أن تكون مفيدة في العديد من النظم التجريبية لتحليل تأثير بعض الخلايا / الأنسجة على سلوك وتطوير الهياكل المجاورة.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود مصالح متنافسة.
Acknowledgements
نشكر إيميلي مينانت على رعاية الأسماك، ومرفق التصوير الحيوي للفنون التطبيقية، ولا سيما بيير ماهو، للمساعدة في التصوير الحي على معداتهم بدعم جزئي من ريجيون إيل دو فرانس (interDIM) ووكالة الأنباء الوطنية دي لا ريشرش (ANR-11-EQPX-0029 Morphoscope2، ANR-10-INBS-04 France BioImaging). وقد تم دعم هذا العمل من خلال منح ANR 15-CE13-0016-1، 18-CE13-0024، 20-CE13-0016، وبرنامج الاتحاد الأوروبي لأفق 2020 للبحث والابتكار بموجب اتفاق منحة ماري سكلودوسكا كوري رقم 840201، ومينيستير دي L'Enseignement Supérieur et de la Recherche والمركز الوطني للبحوث العلمية.
Materials
| Name | Company | Catalog Number | Comments |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | |
| Agarose | PanReac AppliChem | A8963,0500 | |
| Data analysis software : Matlab | Math Works | ||
| Electro-optic modulator (EOM) | ConOptics | 350-80LA | |
| Embryo Medium (EM) solution | Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio), 5th Edition. University of Oregon Press, Eugene (Book). (2000). | ||
| Environmental chamber chamber | Okolab | H201-T-UNIT-BL | |
| EOM driver | ConOptics | 302RM | |
| Fluorescence source | Lumencor | SOLA | |
| Glass bottom dishes | MatTek | P35G-0-10-C | |
| Glass capillaries | Harvard Apparatus | 300085 | Outside diameter 1.0 mm, inside diameter 0.58 mm |
| Glass pipettes | Volac | D810 | Tip should be fire polished |
| Green/ablation laser | Spectra Physics | Mai Tai HP DeepSee | |
| Histone2B-mCherry mRNA | Synthesized from pCS2-H2B-mCherry plasmid (Dumortier& al. 2012) | ||
| Image analysis software: IMARIS | Bitplane | ||
| ImSpector software | Abberior Instruments Development Team | ||
| Injection mold | Adapative Science Tools | I-34 | |
| Microloader tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-151 | |
| Micropipette puller | Sutter | P-1000 | |
| mMESSAGE mMACHINE SP6 Transcription Kit | Invitrogen | AM1340 | |
| Penicillin-Streptomycin | Thermofisher | 15140-122 | 10 000 units penicillin and 10 mgstreptomycin per ml |
| Photomultiplier tube (PMT) | Hammamatsu | H7422-40 | |
| PicoPump (Air injector) | World Precision Instrument | PV820 | |
| Red laser | Spectra Physics | OPO/Insight DeepSee | |
| RNAse free water for injection | Sigma | W3500 | |
| Spreadsheet software: Excel | Microsoft | ||
| Stereomicroscope | Nikon | SMZ18 | |
| Tg(gsc:GFP) zebrafish line | Doitsidou, M. et al. Guidance of primordial germ cell migration by the chemokine SDF-1. Cell. 111 (5), 647–59, doi: doi.org/10.1016/S0092-8674(02)01135-2 (2002). | ||
| TriM Scope II microscope | La Vision Biotech |
References
- Slack, J. M. W. Embryonic induction. Mechanisms of Development. 41 (2-3), 91-107 (1993).
- Fernandez-Sanchez, M. -E., Brunet, T., Röper, J. -C., Farge, E. Mechanotransduction's impact on animal development, evolution, and tumorigenesis. Annual Review of Cell and Developmental Biology. 31, 373-397 (2015).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Selleck, M. A. J. Culture and microsurgical manipulation of the early avian embryo. Methods in Cell Biology. 51 (51), 1-21 (1996).
- Bulina, M. E., et al. A genetically encoded photosensitizer. Nature Biotechnology. 24 (1), 95-99 (2006).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Colombelli, J., Grill, S. W., Stelzer, E. H. K. Ultraviolet diffraction limited nanosurgery of live biological tissues. Review of Scientific Instruments. 75 (2), 472-478 (2004).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods in Molecular Biology. 1189, Clifton, N.J. 219-235 (2015).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. Journal of Visualized Experiments: JoVE. (159), (2020).
- Bonnet, I., et al. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface. 9 (75), 2614-2623 (2012).
- Rauzi, M., Lenne, P. F., Lecuit, T. Planar polarized actomyosin contractile flows control epithelial junction remodelling. Nature. 468 (7327), 1110-1115 (2010).
- Niemz, M. H. Laser-Tissue Interactions. Encyclopedia of Biomaterials and Biomedical Engineering, Second Edition - Four Volume Set. , Springer International Publishing. Cham. (2019).
- Smith, A. M., Mancini, M. C., Nie, S. Bioimaging: second window for in vivo imaging. Nature Nanotechnology. 4 (11), 710-711 (2009).
- Rauzi, M., Lenne, P. -F. Cortical forces in cell shape changes and tissue morphogenesis. Current Topics in Developmental Biology. 95, 93-144 (2011).
- Theveneau, E., David, N. B. Migrations cellulaires collectives. Medecine/Sciences. 30 (8-9), 751-757 (2014).
- Dumortier, J. G., Martin, S., Meyer, D., Rosa, F. M., David, N. B. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 16945-16950 (2012).
- Solnica-Krezel, L., Stemple, D. L., Driever, W. Transparent things: cell fates and cell movements during early embryogenesis of zebrafish. BioEssays. 17 (11), 931-939 (1995).
- Montero, J. -A., Kilian, B., Chan, J., Bayliss, P. E., Heisenberg, C. -P. Phosphoinositide 3-kinase is required for process outgrowth and cell polarization of gastrulating mesendodermal cells. Current Biology. 13 (15), 1279-1289 (2003).
- Ulrich, F., et al. Slb/Wnt11 controls hypoblast cell migration and morphogenesis at the onset of zebrafish gastrulation. Development. 130 (22), 5375-5384 (2003).
- Kai, M., Heisenberg, C. -P., Tada, M. Sphingosine-1-phosphate receptors regulate individual cell behaviours underlying the directed migration of prechordal plate progenitor cells during zebrafish gastrulation. Development. 135 (18), 3043-3051 (2008).
- Smutny, M., et al. Friction forces position the neural anlage. Nature Cell Biology. 19 (4), 306-317 (2017).
- Johansson, M., Giger, F. A., Fielding, T., Houart, C. Dkk1 controls cell-cell interaction through regulation of non-nuclear β-Catenin pools. Developmental Cell. 51 (6), 775-786 (2019).
- Gorelik, R., Gautreau, A. Quantitative and unbiased analysis of directional persistence in cell migration. Nature Protocols. 9 (8), 1931-1943 (2014).
- Grill, S. W., Howard, J., Schäffer, E., Stelzer, E. H. K., Hyman, A. A. The distribution of active force generators controls mitotic spindle position. Science. 301 (5632), New York, N.Y. 518-521 (2003).
- Desprat, N., Supatto, W., Pouille, P. -A. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell. 15 (3), 470-477 (2008).
- Farhadifar, R., Röper, J. -C., Aigouy, B., Eaton, S., Jülicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Willier, B. H., Oppenheimer, J. M. Foundations of Experimental Embryology. , Prentice-Hall. Englewood Cliffs. (1964).
- Ashby, W. J., Zijlstra, A. Established and novel methods of interrogating two-dimensional cell migration. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (11), 1338-1350 (2012).
- Bosze, B., et al. Pcdh18a regulates endocytosis of E-cadherin during axial mesoderm development in zebrafish. Histochemistry and Cell Biology. 154 (5), 463-480 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ISSN 2578-2746
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.
