Method Article
从真核细胞蛋白质复合体串联亲和纯化
摘要
We describe here a novel, robust, and efficient tandem affinity purification (TAP) method for the expression, isolation, and characterization of protein complexes from eukaryotic cells. This protocol could be utilized for the biochemical characterization of discrete complexes as well as the identification of novel interactors and post-translational modifications that regulate their function.
摘要
活性的蛋白质-蛋白质和蛋白质-核酸复合物的纯化是用于酶活性和新颖性亚基和翻译后修饰的从头鉴定表征至关重要。细菌系统中允许的各种单个的多肽和蛋白复合物的表达和纯化。然而,该系统不使能包含翻译后修饰( 例如 ,磷酸化和乙酰化)的蛋白质亚基的纯化,和新颖的调节亚基是只存在/在真核系统中表达的鉴定。在这里,我们提供一种新的,健壮的,并使用STREP-有效串联亲和纯化(TAP)方法和FLAG标签的蛋白质,有利于蛋白质复合物的纯化与来自真核细胞中瞬时或稳定表达表位标记的蛋白质的详细描述。此协议可应用到表征PROTEIN复杂的功能,以发现复杂亚基的翻译后修饰,并通过质谱分析法来识别新调节复杂的组件。值得注意的是,此TAP方法可用于研究真核或病原(病毒和细菌)组分形成蛋白复合物,从而产生一宽的下游实验机会阵列。我们建议,研究人员的蛋白质复合物的工作可以利用许多不同的方法这种方法。
引言
蛋白质-蛋白质相互作用(质子泵抑制剂)是用于生物过程1,并在这些质子泵抑制剂进一步研究的精确调节临界可以告知他们的功能2。几种方法已被设计用于质子泵抑制剂的研究和表征以及用于新的调控蛋白组分的从头鉴定。 1989年,斯坦利领域和同事报道酵母双杂交(Y2H)检测3。这种方法允许在酿酒酵母作用因子(猎物)的定义的兴趣(诱饵)蛋白的公正和全面的鉴定。除了其用于发现质子泵抑制剂显着的效用,在Y2H测定可用于在酵母细胞中表征蛋白质对,限定最小相互作用域,以及识别废除这种相互作用的突变。通过修改Y2H测定中,质子泵抑制剂,也可在哺乳动物细胞中研究了类="外部参照"> 4。在Y2H测定( 如酵母三杂交系统)的变型也可以用于研究蛋白质的RNA,并在细胞中的蛋白质,小的有机配体的相互作用。
另一种常用的工具来研究质子泵抑制剂以同源系统是共免疫沉淀(共-IP)测定5。通过使用抗体免疫沉淀目的蛋白质,共同的IP测定使研究人员能够监测细胞对各种环境条件和实验条件质子泵抑制剂。使用表位标记的蛋白( 例如 ,FLAG,Myc基因,STREP和HA,等等)在亲和纯化(AP)的方法,促进了从复合蛋白质混合物为几个下游测定法,包括免疫印迹蛋白质的分离,银染色的和酶分析。然而,这些以前的方法使能大量的蛋白质复合物的用于进一步表征,包括在体外在隔离ssays,通过质谱法,和翻译后修饰的识别调节亚基的发现。该AP方法的改进版本被称为串联的AP(TAP),这是通过创建与通过两个连续的AP 6,7纯化两个表位的融合蛋白研究质子泵抑制剂的纯化技术。在这篇文章中,我们提出了净化蛋白复合物,其中两个亚单位的标签与不同的表位,然后通过两个连续的AP(STREP AP随后FLAG IP)纯化TAP方法的变型。我们首先提供的TAP的一个简约概述( 图1),然后所有的试验步骤的详细描述( 图2),使得研究人员可以将它们应用到他们感兴趣的蛋白复合物。
为了证明在TAP方法的适用性,我们选择了一个良好表征细胞周期CDK络合物(简称PTEFB激酶),它是由所述调节亚基细胞周期蛋白T1(CycT1)和激酶(CDK9)的,并且是由RNA聚合酶II(RNA聚合酶II)8,9,10参与转录的调节。 P-TEFB磷酸聚合酶II和其相关联的消极延伸因子,这在启动子减轻转录暂停的C-末端结构域,并由此促进转录延伸11,12,13。考虑到这一众所周知的互动,STREP标记CycT1和FLAG标记CDK9均超过在HEK293T细胞中表达。互惠TAP实验与STREP标记CDK9和FLAG标记CycT1进行进一步验证该蛋白质相互作用是独立使用的表位。收集细胞并裂解48小时后转染。 (AP STREP之后FLAG的可溶性裂解液纯化TAPIP)。输入和纯化蛋白通过Western印迹和银染色( 图3)分析。
研究方案
1.电镀细胞
- 转染前一天,板3.5×10 6个 HEK293T细胞于10ml Dulbecco改良的Eagle培养基(DMEM)中的补充有10%(体积/体积)胎牛血清(FBS)和1%(体积/体积)青霉素/链霉素(10,000 U / ml的股票)每100毫米的菜。板3 - 5 100个实验/条件毫米的菜肴,以保证足够的蛋白质回收。
注:板的数量为每个实验/条件,这将依赖于感兴趣的蛋白质复合物的表达水平和溶解性来确定。可替代地,如果需要更大规模的纯化,细胞系可以适于在悬浮于生长在旋转烧瓶2中 ,但这种方法不会对瞬时转染工作。
2.转染细胞或诱使稳定细胞系
- 第二天,检查在显微镜下细胞。细胞必须是70 - PROCE前80%汇合eding。
- 转染的细胞以每100mm培养皿转染试剂的质粒DNA的7微克和21微升总混合物。转染细胞的载体表达GFP( 表1)作为转染效率的对照。
注意:如果使用诱导响应于多西环素14,15的两个或更多个复杂亚基表达的HEK293-T-REX或类似的稳定细胞系,该诱导剂将必须加入到细胞中,并培养48小时。同样地,也将需要验证目的诱导的GFP在加入诱导剂的表达的稳定细胞系。继续执行步骤2.7。 - 准备每100mm培养皿转染混合物。在1.5ml微量离心管中,总质粒DNA(对应于两个或更多的质粒)的7微克混合500μl的未补充的DMEM。在一个单独的离心管中,混合500微升未补充的DMEM的Wi日21微升的转染试剂。重复每个转反应。
- 吸取转染试剂溶液到质粒DNA溶液(不混合以相反的顺序解)。吹打至少4次混合。
- 孵育该混合物在室温下进行10 - 15分钟,但超过15分钟不再。
- 倾斜板创建介质贮存器和小心逐滴吸取转染混合物到板的内部侧而不会干扰细胞。返回菜到原来的平面位置和漩涡轻轻分配混合物。
- 孵育在37℃下将细胞在5%的CO 2的潮湿的细胞培养箱中(该条件在下文中称为"组织培养孵化")。更换介质5小时转染后(可选)。
3.检查转染或诱导效率
- 在24小时后转染,可视化流感下细胞orescent显微镜检查转染效率(或表达GFP控制HEK293T-REX稳定细胞系的诱导)。孵育另外24小时。
4. STREP亲和纯化(STREP AP)
- 收集的细胞
- 在48小时后转染,删除媒体并加入8毫升冷1X磷酸盐缓冲液(PBS)的。吸管上下从板脱落的细胞。
- 收集和细胞悬液转移到15毫升管中,在4℃旋转细胞向下以800 xg离心4分钟。
- 删除PBS上清。重复降速(800×g离心在4℃下1分钟),以消除任何残留的PBS中。保存细胞沉淀在-80℃以备将来使用或按照以下步骤继续蛋白纯化。
- 裂解细胞
- 悬浮用5×细胞沉淀体积被动裂解缓冲液的细胞沉淀(每个板250微升)(PLB:20mM的Tris-盐酸pH为7.5,150 mM氯化钠,1.5mM的MgCl 2的,1毫摩尔DTT,蛋白酶抑制剂混合物片剂,5%体积/体积的甘油,和1.0%的NP-40)和细胞悬浮液转移到一个1.5 ml离心管。
- 在4℃短暂涡旋悬挂和章动30分钟。
- 降速细胞悬浮液以10,000×g离心10分钟,在4℃下。
- 转移可溶性裂解物进入一个新的1.5 ml离心管并弃去细胞沉淀。可节省10%的可溶性裂解物作为最终体积的"STREP AP输入"。保存在4℃。
- 平衡的STREP珠
注:使用STREP珠第一个AP一步!配合拉下来STREP珠复苏比那些FLAG珠拉下显著更多的蛋白质。- 取出(正×40微升)+ n中的50%的STREP珠浆液微升(N =样品数量),并在4℃降速在1500 xg离心2分钟。
注:使用广泛米outhed提示,吸管珠。 - 除去上清液,加入500μlPLB到珠。章动珠子混合物在4℃5分钟。降速在1500 XG为2分钟,4℃。
- 重复总共3次洗涤。重悬在PLB珠粒到n的终体积×40微升。
- 添加40微升50%的STREP珠浆液对每个细胞裂解物样品和章动2小时,在4℃。
- 取出(正×40微升)+ n中的50%的STREP珠浆液微升(N =样品数量),并在4℃降速在1500 xg离心2分钟。
- STREP AP
- 降速的解决方案在1500 XG为2分钟,在4℃。
- 在4℃去除上清,店作为"STREP AP流通型(FT)"。
- 加入500μlSTREP AP洗涤缓冲液I(20mM的Tris-盐酸pH值7.5,250mM的氯化钠,1.5mM的MgCl 2的,1毫摩尔DTT,5%甘油和0.2%的NP-40)的小珠的。章动珠子混合物在4℃,5分钟,离心以1500 xg离心在4℃下2分钟。弃去上清液。
- 重复,共4次洗涤。
注:第四洗涤之前,将珠粒溶液转移至新的1.5 ml离心管,以减少蛋白质背景。这一步是必要的。
- 重复,共4次洗涤。
- 加入500μl洗涤缓冲液II(100mM的Tris-盐酸pH值8.0,150mM的NaCl和1mM EDTA)中并通过反相管平衡的珠子。降速在1500 xg离心2分钟,在4℃,弃上清。
- 洗脱目的蛋白质用50μlSTREP洗脱缓冲液(100毫摩尔Tris-盐酸pH为8.0,150 mM氯化钠,1mM EDTA中,和2.5mM脱硫生物素)的。涡流在800rpm,在4℃下15分钟。
- 降速珠粒在1500 xg离心1分钟,在4℃下。收集上清液。该级分对应于"STREP AP洗脱"样品。
- 保存在4℃的珠粒级分用于第二洗脱,这可能会产生高达与第一洗脱获得的蛋白质的量的一半。在STREP AP洗脱分装10%的银染色和/或免疫印迹16。
- 平衡的FLAG珠
- 取出(NX 16微升)+ N的FLAG珠溶液微升(N =样品数量),并在4℃降速在1500 xg离心2分钟。
注:使用广口提示,吸管珠。 - 除去上清液,并添加FLAG洗涤缓冲液500微升(100毫摩尔Tris-盐酸pH为8.0,150 mM氯化钠,1mM的EDTA和0.1%NP-40)至珠。降速在1500 XG为2分钟,4℃。重复总共3次洗涤。
- 重悬在FLAG洗涤缓冲液珠粒于nx 16微升的最终体积。
- 在4℃加入16微升的FLAG珠浆剩余的STREP AP洗脱和章动过夜。
- 取出(NX 16微升)+ N的FLAG珠溶液微升(N =样品数量),并在4℃降速在1500 xg离心2分钟。
5. FLAG IP
- 降速FLAG珠悬浮在1500 XG为2分钟,4℃。在4℃下保存上清液和存储为"FLAG IP流过"式(FT)。
- 加50081; FLAG洗涤缓冲液将溶液的湖章动,在4℃下在4℃下5分钟,然后离心以1500 xg离心2分钟。重复,共4次洗涤和每次洗涤后除去上清液。
注:第四洗涤之前,蛋白质 - 小珠溶液转移至新的1.5 ml离心管,以减少背景。这一步是必要的。 - 从最后的旋转除去上清液,并添加含FLAG肽的200毫微克/微升到珠粒FLAG洗涤缓冲液的30微升。涡流在800rpm,在4℃下2小时。
- 降速悬浮液在1500×g离心2分钟,在4℃。收获在4℃将上清液和存储为"FLAG IP洗脱"。
注:洗脱样品可以通过银染色和/或免疫印迹使用标准协议16进行确认,并准备进一步蛋白分析。在建立免疫印迹,运行所有下面的示例:(1)STREP AP输入,(2)STREP AP FT,(3)STREP AP Eluti上,(4)FLAG IP FT,和(5)FLAG的IP洗脱。装卷将具有用于每个实验加以确定。所有收集的样品和珠子可以储存在4℃短期贮存,并在-80℃下长期贮存。 TAP样品可以通过质谱法进行分析,以核实它们的组件的身份,以确定新的翻译后后修饰,和/或到发现用纯化复杂2,17中的任何新的蛋白质相互作用。为了这个目的,在运行考马斯凝胶或银染色后,频带可使用干净的手术刀凝胶切。几个优秀条评论讨论质谱方法进行了先前公布的18,19。
结果
在这篇文章中,我们展示了TAP方法充分表征CycT1-CDK9复合物(也被称为P-TEFB激酶)的适用性。
和CDK9-FLAG(CDK9:F),或CDK9-STREP(CDK9:S)和细胞周期蛋白T1-FLAG(CycT1:F):编码细胞周期蛋白T1-STREP(S CycT1)质粒( 表1),转染入HEK293T细胞。阴性对照包括用空载体和CDK9转染:F或CycT1:F质粒( 图3A和B,分别地)。将蛋白质表达48小时收集细胞之前。细胞的多块板每实验中使用(被用于在图3中呈现的数据每个采样五大板块),以增加蛋白质的生产和回收。将细胞在单独的离心管中裂解后,在同一样品的细胞裂解物合并成一个microcentrif之前加入STREP珠粒UGE管。与珠一部分结合蛋白质样品增加了最终蛋白质浓度,从而可以提高从难以表达的蛋白质的蛋白质回收率。在初始洗脱,第二洗脱可以以增加的总蛋白质输入的FLAG的IP来完成。它保存为每个纯化步骤的输入添加珠粒为将来的故障排除( 表2),如果需要的话之前是重要的。
图3A的数据显示为CycT1的TAP方法的结果:S和CDK9:F,Western blot检测。 CDK9:F共洗脱CycT1:■所述STREP珠,但不是在缺乏CycT1阴性对照的AP:S,这表明CDK9:F和CycT1:S型的蛋白质 - 蛋白质复合物。果然,在FLAG洗脱,这进一步证实了复合物形成检测这两种蛋白。 图3B示出了地区环境部门一道(:S和CycT1:CDK9 F)的倒数TAP方法,其中两种蛋白的抗原决定簇标记被交换的LTS和Western blot检测。
图3C和3D分别显示了银染色分析了TAP和TAP互惠的结果。 图3C泳道2表明CDK9:F共洗脱CycT1:•关闭的STREP珠子,而不是从控制的AP(泳道1),因此表明CDK9:F和CycT1:•形成的蛋白质-蛋白质复合物。在随后的FLAG洗脱,如图泳道4,CycT1:S CO-洗脱CDK9:F关闭的FLAG珠。类似地, 图3D表明CycT1:F共洗脱CDK9:•关闭的STREP珠子,而不是从控制的AP,并且该蛋白质-蛋白质复合物的第二标志的IP步骤后有效地回收。无论是西方的印迹和银染证实,TAP协议有效就职于purificatio N,隔离和感兴趣的蛋白质复合物的表征。

图1:TAP 纯化策略概述。一个简单的方案描述TAP的步骤。编码与任STREP或FLAG表位标签感兴趣的蛋白的质粒共转染到哺乳动物细胞。 48小时诱导后,将细胞收集并裂解。含有感兴趣与其它蛋白质沿蛋白可溶性细胞裂解物装载到STREP珠STREP的AP。然后蛋白质,要么包含STREP标记或结合到附着到小珠的Strep-标记的蛋白进行洗脱。然后将FLAG珠加入到STREP洗脱。然后是蛋白质,要么包含FLAG标签或必然要附加到珠FLAG标签蛋白被洗脱。洗脱可以通过所指示的方法进行分析。TTP://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/55236/55236fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。
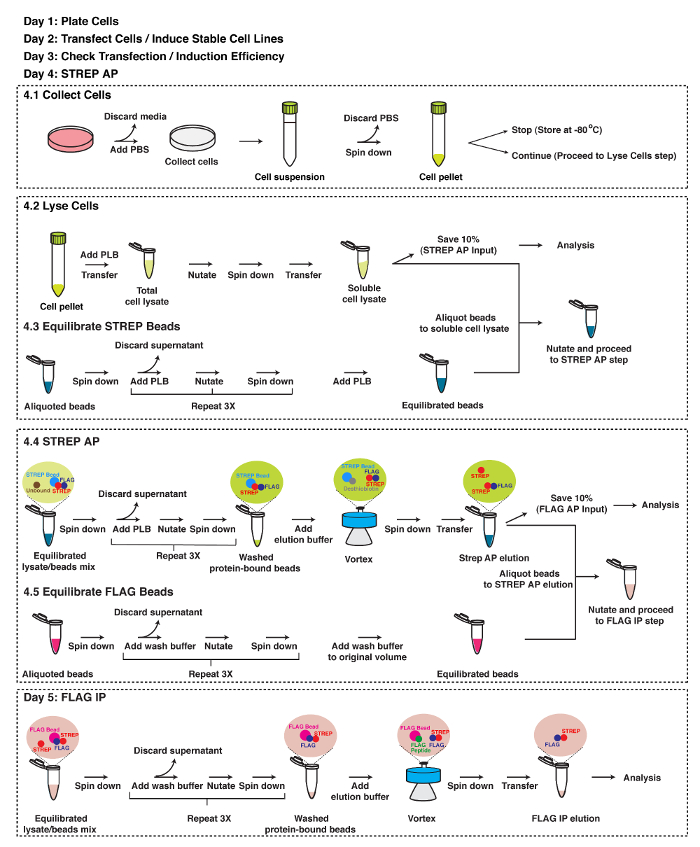
图2:TAP战略的示意图。 TAP的详细协议。详情请参阅文本。 请点击此处查看该图的放大版本。
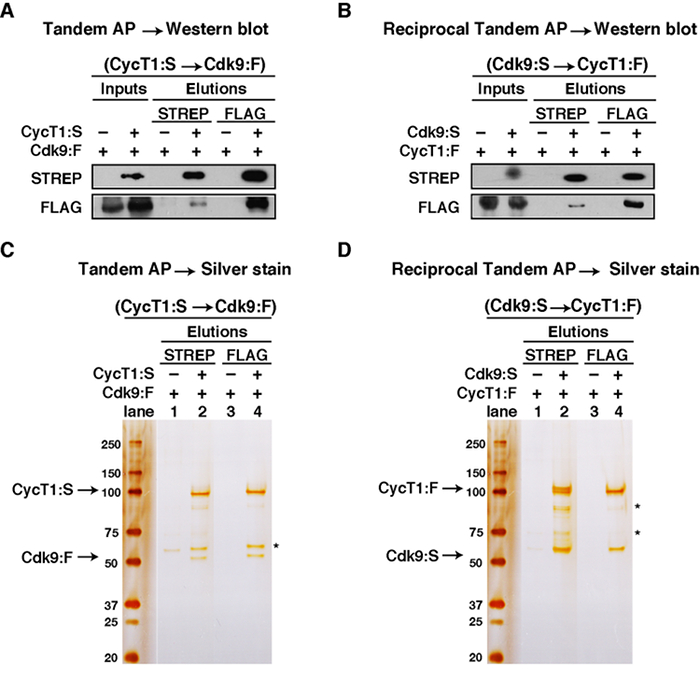
图3:TAP 纯化步骤一步的分析为例。 (A)TAP的Western blot分析(CycT1:S和CDK9:F)。 (B)相互TAP的Western blot分析(CDK9:S和CycT1:F)。 FROM 1 ml完整细胞裂解物,5微升(0.2%)的加载为"STREP AP输入"。 975微升其余全细胞裂解物加入到STREP珠子STREP AP和"STREP AP洗脱"的100微升收集。从此,5微升(2%)为加载。 80微升的"STREP AP洗脱"加入到FLAG珠FLAG IP和"FLAG IP洗脱"的30微升收集。从"FLAG IP洗脱"的30微升,7微升(23.3%)被加载。 (C)TAP的银染分析(CycT1:S和CDK9:F)。 (:S和CycT1:CDK9 F)倒数TAP( 四 )银染分析。 5微升(2%)"STREP AP洗脱"和"FLAG IP洗脱"7微升(23.3%)被加载。星号表示共洗脱的杂质。 请点击此处查看该图的放大版本。
| 蛋白 | 残留 | 向量 | 标签 | 克隆网站 | 参考 |
| CycT1 | 1-708 | 的pcDNA / 4要 | STREP | HindIII位- EcoRI位 | 麦克纳马拉等。 2013年10 |
| CycT1 | 1-708 | 的pcDNA / 4要 | 旗 | HindIII位- EcoRI位 | 本文 |
| CDK9 | 1-372 | 的pcDNA / 4要 | STREP | HindIII位-的XhoⅠ | 本文 |
| CDK9 | 1-372 | 的pcDNA / 4要 | FLAG | HindIII位-的XhoⅠ | 麦克纳马拉等人,2013 10 |
| GFP | 1-238 | 的pcDNA / 4要 | STREP-FLAG | BamHI位- XhoI位 | 本文 |
表1:本研究中使用的质粒。 CycT1和CDK9被连接入的pcDNA / 4要-STREP和的pcDNA / 4要-FLAG质粒载体。这些构建体转化到DH5α感受态细胞中并接种于LB-氨苄青霉素平板上。被选定的殖民地,种植和筛选。成功连接克隆通过桑格测序和限制性消化和琼脂糖凝胶电泳的组合验证。为CycT1我们使用了较短的版本(1 - 708),而不是全长(1 - 726),因为最后的18个残基包含一个PEST序列(肽序列富含脯氨酸,谷氨酸,丝氨酸和苏氨酸),这充当蛋白质降解20的信号肽。 CDK9是全长。串联STREP标签的顺序如下:GGGGWSHPQFEKGGGSGGGSGGGSWSHPQFEK。串联FLAG标签的顺序如下:GGGGDYKDHDGDYKDHDIDYKDDDDK。
表2:故障排除表。故障排除开始之前,仔细检查,以确保每一个关键步骤已经接踵而至。在这个协议中的某些步骤需要比别人更多的优化,实现了预期的结果。 请点击这里下载此文件。
讨论
此处所描述的表达和从真核细胞中的蛋白质复合物的分离的协议不限于这样的分子组件的生化特性,但也可用于新的交互件和翻译后修饰,可以调节它们的功能的识别。亲和标签的使用并不限于是什么在这个协议中提到;但我们的经验表明,使用STREP作为第一个AP步骤显著增强了最终蛋白质 - 蛋白质复合物的产率。都与其它表位标签( 例如 ,FLAG)相比,距离STREP珠的结合和洗脱步骤是非常有效的。此外,在理论上,TAP可以应用于其它蛋白质或结构域以一些较小的优化,如缓冲液条件,每实验板数(用于瞬时和稳定表达系统) 等 。此外,在TAP方法也可以应用ŧo其他细胞系是否存在特定的蛋白质复合物需要它们的功能和其独特的因素相互作用的特殊系统。为了便于排除故障,强烈建议在输入和FT样本都被保存( 表2)。当预期的蛋白条带不能在洗脱被可视化,对FT样品可以用于排除实验,以确定样本是否已结合于和/或洗脱掉的珠子。
一个成功的TAP是严格依赖于高水平的蛋白质表达和恢复。因此,研究人员将必须优化对逐案基础起始材料的量。如果瞬时转染来表达蛋白质成分,转染效率,应在TAP的第二步骤之前是至少70%。倒数的TAP方法(其中的表位在两个诱饵之间交换),通常有助于确定哪些实验策略应使用以达到最佳的纯度和产率。再次,这将根据具体情况逐案进行调查。重要的是,执行相互TAP也证实了PPI是独立的亲和标签。
本文中所呈现的TAP方法的一些方面有局限性。例如,过度表达FLAG-和STREP标记的蛋白质可能产生的异位表达蛋白本身或者其干扰作用的文物。不同表位标签可能影响蛋白的表达水平,蛋白构象,和/或亚细胞定位。除细胞系和转染效率限制,复合物的大小要纯化可能是一个问题。此TAP方法适用于多亚基蛋白复合物。 (数据未显示)从我们的经验,四组分可通过银染色进行检测。然而,使用两个标记的组件时,其它交互件可能不共纯化在相同化学计量的水平。因此,对于这个特定的目标,是表示,诱导复杂的组件的表达水平较低的使用细胞系。另一个限制将是PPI的强度。如果相互作用是不够稳定,可以在纯化步骤(特别是在最后的FLAG的IP步骤)会丢失某些组件。
该TAP方法,前面所述的几个不同的表位标签进行了测试,验证和比较6。但是,这篇文章中提出的TAP方法新颖,并提供了一种简单,高效,严谨,和替代战略研究的生产者价格指数,复杂的装配,并推断网络的蛋白质组成和功能。与以往的TAP方法相比,该STREP-FLAG的TAP策略允许对复合物用于进一步表征的快速纯化而不复杂的组合物,活性或功能的先验知识;并且无需蛋白酶切割( 例如 ,TEV)用于蛋白质洗脱(WHICH可以显著降低蛋白质产量)。因为增加的蛋白质复合物回收,所述STREP-FLAG的TAP方法也允许为,随着通过串联质谱分析10,15中的细胞感兴趣的蛋白质复合物关联的蛋白质的鲁棒辨识。随后,其他方法,如共焦显微镜,大小排阻层析,和共同的IP测定法,也可使用以验证质子泵抑制剂。最后,我们建议TAP协议的替代版本,可以适应净化和研究离散蛋白质的RNA复合物,这将大大有助于研究人员在RNA生物学领域的组装。
总之,我们提出以纯化并在哺乳动物细胞系的特征质子泵抑制剂的方法。我们建议,这种方法可为未来的表征和许多新的蛋白质复合体的功能分析的基础。
披露声明
The authors have nothing to disclose.
致谢
Research reported in this publication was supported by the National Institute of Allergy and Infectious Diseases (NIAID) of the NIH under award number R01AI114362 and Welch Foundation grant I-1782 to Iván D'Orso.
材料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium (DMEM) | GE Healthcare Life Sciences/Hyclone | SH3002.2FS | |
| Fetal bovine serum | GE Healthcare Life Sciences/Hyclone | SH30071 | |
| Penicillin/Streptomycin | MP Biomedicals | MP091670049 | |
| PolyJet | SignaGen Laboratories | SL100688 | |
| Protease inhibitor cocktail | Roche | 11836153001 | |
| STREP-Tactin Superflow | IBA Lifesciences | 2-1208-010 | |
| STREP-tag elution buffer | IBA Lifesciences | 2-1000-025 | |
| EZview Red ANTI-FLAG M2 Affinity Gel | Sigma-Aldrich | F2426 | |
| Corning 100 mm × 20 mm style dish cell culture treated nonpyrogenic polystyrene 20/sleeve | Corning | 430167 | |
| Protein Lo-Bind Eppendorf | Eppendorf | 022431081 | |
| Digital Vortex Mixer | Fisher Scientific | 02-215-370 | |
| 48 hole micro tube foam rack | Fisher Scientific | 02-215-386 | |
| Labquake shaker rotisserie | Thermo | 415110 |
参考文献
- Sharan, R., Ulitsky, I., Shamir, R. Network-based prediction of protein function. Mol Syst Biol. 3, 88-99 (2007).
- Jager, S., et al. Global landscape of HIV-human protein complexes. Nature. 481, 365-370 (2012).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Luo, Y., Batalao, A., Zhou, H., Zhu, L. Mammalian two-hybrid system: a complementary approach to the yeast two-hybrid system. Biotechniques. 22, 350-352 (1997).
- Lee, C. Coimmunoprecipitation assay. Methods Mol Biol. 362, 401-406 (2007).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Jager, S., et al. Purification and characterization of HIV-human protein complexes. Methods. 53, 13-19 (2011).
- Price, D. H. P-TEFb, a cyclin-dependent kinase controlling elongation by RNA polymerase II. Mol Cell Biol. 20, 2629-2634 (2000).
- Peterlin, B. M., Price, D. H. Controlling the elongation phase of transcription with P-TEFb. Mol Cell. 23, 297-305 (2006).
- McNamara, R. P., McCann, J. L., Gudipaty, S. A., D'Orso, I. Transcription factors mediate the enzymatic disassembly of promoter-bound 7SK snRNP to locally recruit P-TEFb for transcription elongation. Cell Rep. 5, 1256-1268 (2013).
- Adelman, K., Lis, J. T. Promoter-proximal pausing of RNA polymerase II: emerging roles in metazoans. Nat Rev Genet. 13, 720-731 (2012).
- D'Orso, I. 7SKiing on chromatin: move globally, act locally. RNA Biol. 13, 545-553 (2016).
- McNamara, R. P., Bacon, C. W., D'Orso, I. Transcription Elongation Control by the 7SK snRNP Complex: Releasing the Pause. Cell Cycle. 15, 2115-2123 (2016).
- Yao, F., Svensjo, T., Winkler, T., Lu, M., Eriksson, C., Eriksson, E. Tetracycline repressor, tetR, rather than the tetR-mammalian cell transcription factor fusion derivatives, regulates inducible gene expression in mammalian cells. Hum Gene Ther. 9, 1939-1950 (1998).
- McNamara, R. P., et al. KAP1 Recruitment of the 7SK snRNP Complex to Promoters Enables Transcription Elongation by RNA Polymerase II. Mol Cell. 61, 39-53 (2016).
- Ausubel, F. M., et al. Current Protocols in Molecular Biology. , Greene Publishing Associates and Wiley-Interscience. New York. (1994).
- Trudgian, D. C., et al. Comparative evaluation of label-free SINQ normalized spectral index quantitation in the central proteomics facilities pipeline. Proteomics. 11, 2790-2797 (2011).
- Choudhary, C., Mann, M. Decoding signalling networks by mass spectrometry-based proteomics. Nat Rev Mol Cell Biol. 11, 427-439 (2010).
- Bensimon, A., Heck, A. J., Aebersold, R. Mass spectrometry-based proteomics and network biology. Annu Rev Biochem. 81, 379-405 (2012).
- Rogers, S., Wells, R., Rechsteiner, M. Amino acid sequences common to rapidly degraded proteins: the PEST hypothesis. Science. 234, 364-368 (1986).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。