Method Article
对链球菌-Tactin树脂交联的双(磺基)辛二酸酯(BS3)双链球菌标记蛋白及其复合物的一步纯化
摘要
的方法被描述为在链亲和素修饰的双链球菌标记的融合蛋白和它们的特定配合物的净化效率(链球菌-Tactin)树脂共价交联的双(硫代琥珀酰亚胺基)辛二酸酯(BS3)。该方法具有速度快,良好的靶蛋白回收率和纯度高的优点,并且与随后的分析通过质谱兼容。
摘要
链球菌标记的融合蛋白对携带一个精心设计的链亲和素(链霉素-Tactin)树脂亲和纯化已成为生理条件下广泛使用的方法为蛋白质复合物的分离。含有两个拷贝Strep-标签II的指定双Strep-标签或SIII-标签,融合蛋白具有对链球菌-Tactin相比,那些仅含有一个单一的Strep-标签更高亲和力的优点,因而允许更有效的纯化。然而,这一优点是通过一个事实,即双链球菌标记的蛋白与生物素的洗脱可能不完整,导致低蛋白恢复抵消。回收可以通过使用变性洗脱剂十二烷基硫酸钠(SDS)得到显着改善,但是这会导致样品污染链球菌-Tactin从树脂上释放,使得与下游蛋白质组分析测定不相容。为了克服这种限制,我们已经开发出一种方法,其中树脂耦合链球菌-Tactin的四聚体首先,通过共价交联与双(硫代琥珀酰亚胺基)辛二酸酯(BS3),将所得的交联树脂,然后用纯化靶蛋白复合物在单一批次纯化步骤稳定化。高效洗脱SDS确保了良好的蛋白质回收,而没有污染链球菌-Tactin允许通过质谱下游蛋白分析。作为概念验证,我们在这里描述的协议为SIII标记病毒蛋白VPG-PRO从病毒感染N的核提纯使用链球菌-Tactin聚甲基丙烯酸酯树脂的交联与BS3 本塞姆氏烟草植物。相同的协议,可用于净化任何感兴趣的双链球菌标记的蛋白质和其生理结合配偶体进行表征。
引言
近年来,Strep-标签技术已成为广泛使用的生物医学研究中的许多领域,包括蛋白质组学和结构生物学。这种蛋白质纯化技术,这依赖于重组蛋白的融合到一个短的Strep-标签肽,已经成熟账面链球菌-Tactin,链霉的具有改进的肽结合的能力的基因工程变体亲和基质的到来。1,2含有两个拷贝Strep-标签II的指定双Strep-标签或SIII-标签,表现出对链球菌-Tactin基质比那些仅含有一个单一的Strep-标签,确保了重组蛋白质的更有效的纯化具有更高的亲和力和融合蛋白其相关的具有约束力的合作伙伴。然而,双链球菌标签蛋白对链球菌-Tactin较高的亲和力也有其不利的一面。这种蛋白质与过量的生物素的竞争性洗脱可能不完整,导致减少靶蛋白的产量。 A M矿石有效的替代方案是洗脱SDS,但它会导致与链球菌-Tactin不需要的样品污染从树脂上释放,使得用蛋白质组学分析测定不相容。本文提出了一种技术,通过第一稳定链球菌-Tactin的通过化学交联的树脂偶联的四聚体,然后用SDS洗脱从所得的交联树脂的双链球菌标记的蛋白质和其相关的复合物来克服这种限制。因此,足够的蛋白质产量可在不与链球菌-Tactin样品污染来实现,从而允许通过质谱法进一步分析。
该方法适用于任何重组融合蛋白的纯化与表面暴露SIII-标签3或双-Strep-标签(氨基酸序列WSHPQFEK(GGGS)3 WSHPQFEK和SAWSHPQFEK(GGGS)2 GGSAWSHPQFEK,分别)。该蛋白质可以是动物,植物或细菌来源的,可以从任一总细胞中分离裂解物或富集的细胞器部分。作为一个例子,我们在这里描述一个SIII标签蛋白VPG-Pro的马铃薯A病毒(PVA)4从PVA-感染的烟草本塞姆氏烟草植物的细胞核部分的纯化。如前所述5,具有以下修饰的核成分进 行分离:细胞没有用甲醛处理,丁酸钠代替在所有的缓冲区用5mM氟化钠,完全蛋白酶抑制剂被置换为PMSF,加入Triton X-100的浓度在萃取缓冲器#2降低到0.3%(体积/体积),并通过蔗糖垫离心得到(提取缓冲液#3)的核沉淀再悬浮于1.45毫升预冷的结合缓冲液中并旋转1.5小时,在4℃下根据下面描述(见第2部分)的协议包含SIII标签的诱饵蛋白和相关的复合物(诱饵蛋白样品)所得的核提取物进行了处理。
研究方案
1,交联链球菌-Tactin聚甲基丙烯酸酯树脂与双(磺基琥珀酰亚胺)的辛二酸(BS3)
- 平衡含有2mg BS3交联剂的室温1密封微管中。注意:BS3是一种有害物质。戴防护手套和护目镜。
- 重悬链球菌-Tactin聚甲基丙烯酸酯树脂(在100毫米的Tris-HCl,pH 8.0的50%悬浮液,1 mM的EDTA,150 mM氯化钠)进行了简短的剧烈震荡,并立即用枪头与600微升悬浮液转移到离心柱结束切断。
- 离心机在1500×g离心30秒,在室温下进行。弃去流通,并添加450微升磷酸盐缓冲盐水(PBS)中的列。
- 重复前面的步骤2次以上,以完全代替Tris缓冲液,用PBS和离开该树脂在430微升PBS的最后离心后调节pH值至8.0。
- 穿刺微管的铝箔与BS3与含有100的移液管尖1;升超纯水。通过轻轻地上下吹打溶解BS3粉末在水中,并立即加入20微升的溶液中,以旋转柱。 BS3在交联反应中的终浓度为〜1.2毫米。
- 旋转30分钟,在室温下的列。检查该树脂与BS3溶液适当混合。
- 以淬灭反应,加入6微升3M的Tris-HCl,pH值7.5和旋转另一个15分钟,在室温下的列。
- 离心机在1500×g离心30秒,在室温下进行。弃去流通和重悬的交联树脂在450微升的Tris缓冲盐水与吐温20(TBST)。重复离心和洗涤步骤两次以上。在最后一步中,重悬树脂在450微升TBS的。
- 用枪头末端的树脂悬液转移至新管切断。重悬在左与另一个450微升TBS的列中的树脂和传送到同一管中。重复次e最近步骤一次以上,以确保该树脂从柱的最大传送到管内。
- 让管静置10分钟,在室温下和通过除去过量的TBS将音量调节到600微升。该树脂可立即使用(推荐),也可以保存在4°C,无冻结。
在双链球菌标签的诱饵蛋白及相关配合物的2。绑定到交联链球菌-Tactin聚甲基丙烯酸酯树脂
- 离心机1毫升在结合缓冲液以17,000×g离心10分钟,在4℃下,将上清液转移到新管中的诱饵蛋白的样品。
- 为了最大限度地减少内源性生物素化的蛋白的链球菌-Tactin树脂的结合中,添加抗生物素蛋白为100μg/ ml的终浓度,并在4℃下旋转15分钟
- 如果从步骤1.10的交联树脂已被存储为在延长的时间期间内,在4℃,离心,在400×g离心收集FO树脂在4℃下,R 1分钟,弃去上清液并用1ml的TBST洗涤树脂。重复离心和洗涤步骤2次以上,第一次用TBST,然后用TBS。离心管中,在400×g离心1分钟,在4℃,以除去过量的TBS调整到原来的体积。
- 通过涡旋重新悬浮交联链球菌-Tactin树脂。立即加入50微升树脂悬浮液的使用切割枪头含有诱饵蛋白质样品的管中,在4℃下旋转,另外的30分钟
- 在等待时,恒温设定为55℃,预热500微升的洗脱缓冲液对在步骤3.1中使用。
- 离心机在400×g离心1分钟,在4℃下弃去上清液,并在4℃下用1ml预冷的洗涤缓冲液#1的洗涤树脂在旋转器上5分钟。重复离心和洗涤步骤3次。在最后一步中,重悬在树脂中加入250μl的洗涤缓冲液#2。
- 风帆 ansfer树脂悬浮于新鲜的自旋柱。重悬残留在管中的另一个250微升的洗涤缓冲液#2的树脂和传送到同一列中。
- 离心机在400×g离心3分钟,在4℃,弃去流通和柱转移到新鲜海豚机头2毫升管。立即进行下面的洗脱步骤。
具体蛋白复合物3。洗脱
- 从步骤2.4加入150μl预热的洗脱缓冲液中,以旋转柱。
- 在孵育恒温5分钟,55℃,摇在1400转每分钟。
- 离心机在1500×g下在室温下放置1分钟。
- 丢弃的列和存储纯化的目的蛋白在≤-20℃。
| 磷酸盐缓冲盐水(PBS)中 | |
| 的Na 2 HPO 4 | 10毫米 |
| KH 2 PO 4 | 2mM的 |
| 氯化钠 | 137毫 |
| 氯化钾 | 2.7毫米 |
| 将pH调节至7.4,除非另有说明(pH值8.0 1.4节) | |
| Tris缓冲盐水(TBS) | |
| 的Tris-HCl,pH 7.4的 | 50毫米 |
| GHT =“20”的风格=“高度:20像素,宽度:299px;”>氯化钠 | 150毫 |
| 三缓冲盐水与吐温20(TBST)的 | |
| 的Tris-HCl,pH 7.4的 | 50毫米 |
| 氯化钠 | 150毫 |
| 吐温20 | 0.1%(体积/体积) |
| 结合缓冲液 | |
| 的Tris-HCl,pH 8.0的 | 25毫米 |
| 氯化钠 | |
| 氟化钠 | 5毫米 |
| EDTA | 0.5毫米 |
| 甘油 | 10%(V / V) |
| PMSF | 0.1毫米 |
| 洗涤缓冲液#1 | |
| 的Tris-HCl,pH 8.0的 | 25毫米 |
| 氯化钠 | 500毫米 |
| 氟化钠 TD> | 5毫米 |
| EDTA | 0.4毫米 |
| IGEPAL CA-630 | 0.2%(体积/体积) |
| 甘油 | 5%(体积/体积) |
| PMSF | 0.1毫米 |
| 洗涤缓冲液#2 | |
| 的Tris-HCl,pH 8.0的 | 25毫米 |
| 氯化钠 | 150毫 |
| 的Tris-HCl,pH 8.0的 | 25毫米 |
| SDS | 1%(重量/体积) |
表1在本研究中使用的缓冲器。
结果
纯化过程在图1中示意性地示出,以与其他现有的纯化方法相关联的问题的表示一起。
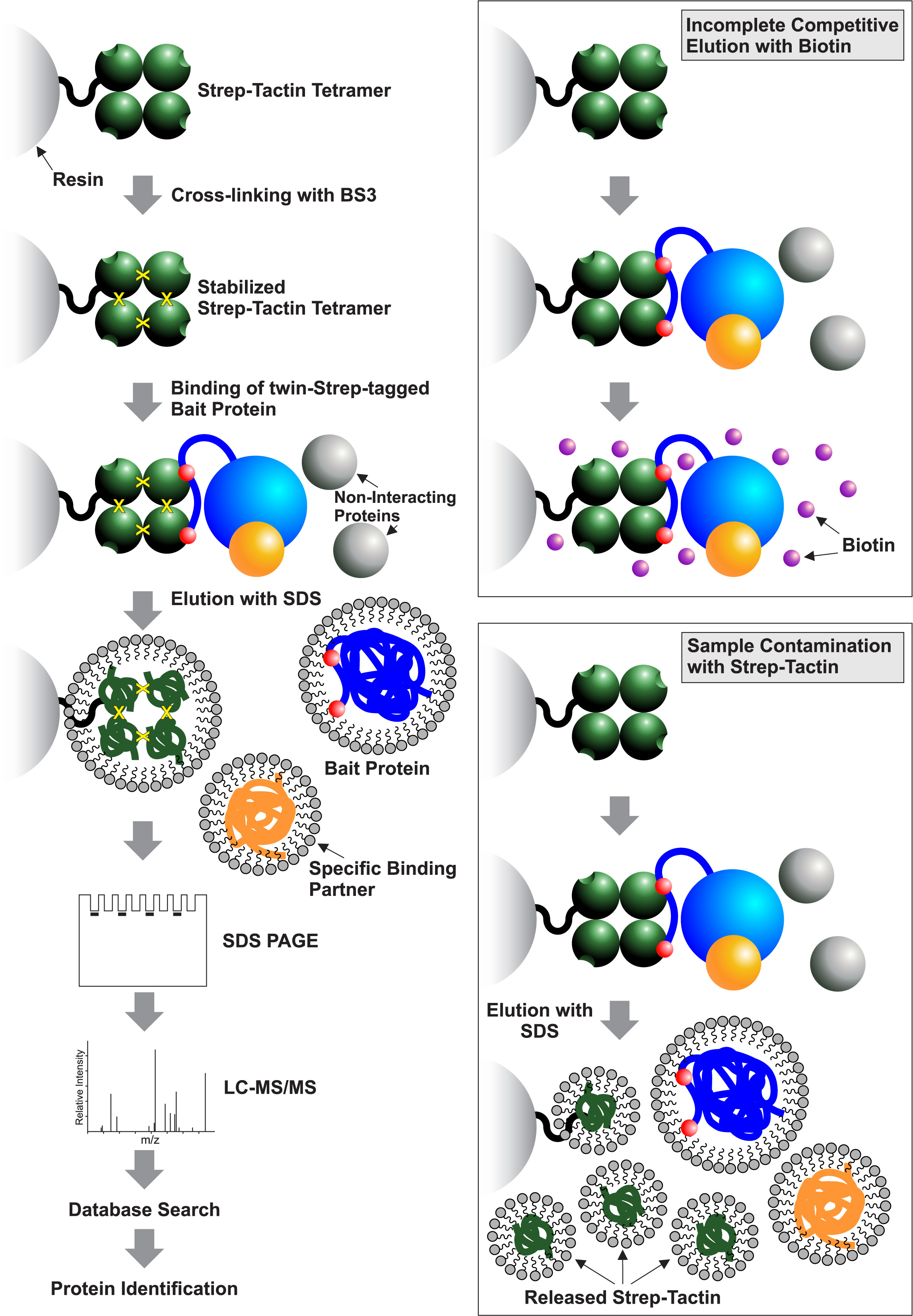
图1的纯化过程的示意图。的工作流程包括通过共价交联与BS3,双-链霉素标记的诱饵蛋白和相关的复合物结合到交联的树脂的树脂偶联链球菌-Tactin四聚体稳定化,洗去未结合的蛋白质,变性的特异性结合的蛋白质复合物,用1%SDS和通过液相色谱 - 串联质谱(LC-MS/MS)分析它们的洗脱。两个红球的诱饵蛋白表示双Strep标签。其他纯化方法的局限性都显示在插图盒子上的权利。它们包括靶蛋白的洗脱不完全用生物素和样品污染链球菌-Tactin以下变性洗脱,用1%SDS。
使用BS3-交联链球菌-Tactin聚甲基丙烯酸酯树脂和变性洗脱,用1%SDS的SIII-标记的蛋白质纯化的典型结果示于图2。含有离心柱洗脱物的10%(15微升)纯化SIII标记PVA VPG-Pro和相关蛋白,通过SDS-PAGE后银染色进行分析。由于没有对应的PVA VPG-Pro的阴性对照泳道的52 kDa带的证实下拉的特异性。将40μl的剩余旋转柱的洗脱液被施加到角蛋白的游离的SDS凝胶和相应的泳道中切出和所包含的蛋白质用胰蛋白酶消化,并通过液相色谱 - 串联质谱(LC-MS/MS)进行分析。质谱分析鉴定病毒RNA-DEPEndent RNA聚合酶(复制酶)NIB作为VPG-Pro的相互作用的合作伙伴。对应于笔尖多个胰蛋白酶肽的亲和纯化,并没有在四个控制表达VPG-Pro的无SIII-标签,确认相互作用的特异性的所有4次生物学重复进行检测。因为NIB(59 kDa的)的分子量接近SIII标记VPG-PRO(52 kDa的)的,这两种蛋白出现一个双波段中SDS-PAGE分析( 图2,箭头)。综上所述,上述结果提供了实验证据,链球菌-Tactin树脂共价交联的BS3该亲和纯化可成功地用于分离双链球菌标记的蛋白质和通过质谱法鉴定其生理结合伴侣。

图2。纯化SIII-标记的PVA VPG-Pro和其结合配偶体的PVA笔尖上链球菌-Tactin聚甲基丙烯酸酯树脂交联的BS3。该图显示洗脱液从交联的银染色的SDS-聚丙烯酰胺凝胶珠。笔尖被鉴定通过质谱法作为VPG-Pro的使用相同的样品的等分试样的结合伙伴。 SIII标记PVA VPG-PRO(预测分子量:52 kDa的)和笔尖(预测分子量:59 kDa的)迁移的双带,用箭头表示。阴性对照组(中央车道)从细胞感染病毒表达VPG-Pro的无SIII标签对应的净化。
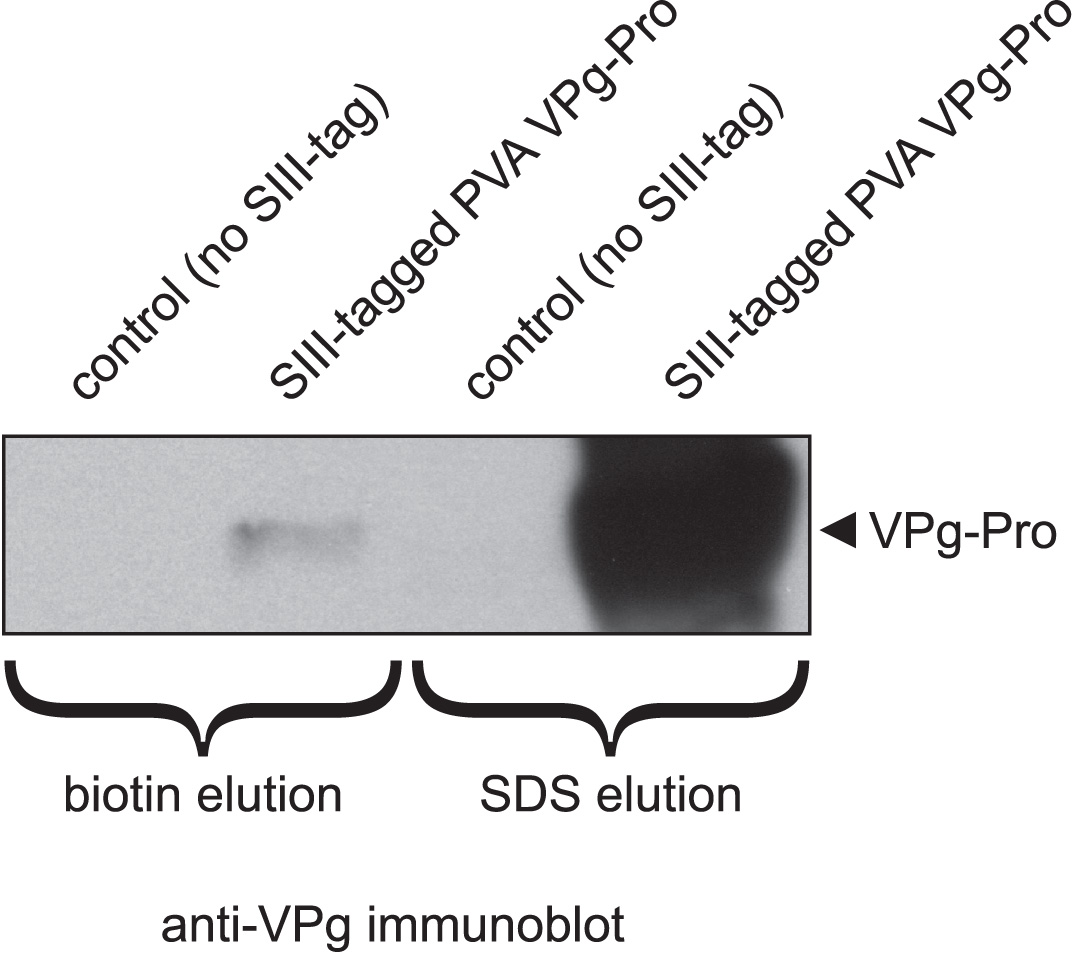
图3。生物素洗脱SIII-标记的PVA VPG-Pro的从链球菌-Tactin聚甲基丙烯酸酯树脂不完整的相比洗脱,用1%SDS中。该图显示了由链球菌-Tactin磁珠洗脱物的抗VPG免疫印迹。将珠洗脱无论是与15mM的生物素或与1%SDS。在信号强度的差异,反映与两个洗脱技术获得不同的蛋白质的产量。阴性对照对应于纯化从感染的细胞表达VPG-Pro的无SIII-标记的病毒。

图4的共价交联与BS3防止链球菌-Tactin的从树脂中的SDS洗脱的释放。该图显示了从非交联的(左泳道)的SDS洗脱物的银染色的凝胶和BS3-交联(右线),链球菌-Tactin聚甲基丙烯酸酯树脂。注意:发布链球菌-Tactin在左车道的存在,但其在右车道缺席。

图5双(硫代琥珀酰亚胺基)辛二酸酯(BS3)及其与赖氨酸残基的链球菌-Tactin的ε氨基的交联反应的化学结构。

图6。纯化,双链球菌标记的绿色荧光蛋白(GFP)的非交联和BS3交联链球菌-Tactin聚甲基丙烯酸酯树脂。人胚肾293细胞中表达的双链球菌标记的GFP的两个相等的量裂解和使用上述协议,不同的是在一种情况下,树脂已被交联的BS3和在其他BS3已经是同样的处理烯中的交联反应被取代了水。该图显示了银染色的SDS-聚丙烯酰胺凝胶和纯化蛋白的抗GFP免疫印迹。请注意,在蛋白质产量有些下降是固有的,涉及化学交联的纯化方法,但是这是由高纯度的样品由于没有释放链球菌-Tactin的补偿。
讨论
上述协议可用于纯化目的和其相关的复合物中的任何合适的缓冲液不含有生物素或强变性剂的任何双链球菌标签的诱饵蛋白。在该协议的当前版本中,结合和洗涤都相对严格的条件下在高盐和非离子型去污剂的存在下进行。尽管这会导致更少的背景,脆弱的蛋白质复合物可以解离这些条件下。为了保持这种低亲和力复合物,盐的浓度可被降低和非离子型洗涤剂,可减少或省略的结合和洗涤缓冲液。
在双Strep-标签系统的主要优点是小的(3kDa)串联标记链霉亲和改造(链球菌-Tactin)1,2,允许甚至在批次靶蛋白及其复合物的高效一步纯化的高亲和力模式。因为双Strep-标签的强绑定到链球菌-Tactin,该树脂可在适度严格的条件下,如高的洗涤剂和/或盐的浓度,这将导致较高的靶蛋白的纯度下进行洗涤。然而,这种强大的约束力也有其缺点。甚至在蛋白质与单个Strep-标签II(氨基酸序列WSHPQFEK)的情况下,从树脂中竞争性洗脱有时可能是困难的。例如,链球菌(Ⅱ)标记的蛋白激酶,NtCDPK2,从链球菌-Tactin聚甲基丙烯酸酯树脂用10mM洗脱脱硫生物素被证明是不成功的,因此需要变性洗脱SDS样品缓冲液6。问题得到解决后才脱硫生物素被替换为更强的竞争生物素(10毫米),并进行洗脱5分钟,在剧烈振摇7。在双Strep-标签,这对链球菌-Tactin更高的亲和力的情况下,靶蛋白的洗脱可能不完整,即使在生物素浓度高达15毫米。 如图3,SIII-标记的PVA VPG-Pro的仅一小部分能够从链球菌-Tactin树脂进行纯化,用15mM的生物素相比,用含1%SDS的量。要注意的是竞争性洗脱的效率可能也依赖于洗脱的蛋白或蛋白复合物的性质是很重要的。更大和更疏水蛋白可以在空间上阻碍了在链球菌-Tactin的生物素结合口袋的可访问性,从而使得竞争性洗脱效率较低。上述缺陷是通过使用洗脱SDS避免,但这样的洗脱有它自己的问题,主要是围绕着,即暴露于去污剂导致树脂偶联链球菌-Tactin四聚体和样品污染与释放链球菌-Tactin 8的离解的事实。这表现在图4(左线),这说明链球菌-Tactin树脂中含有1%SDS洗脱缓冲液孵育后释放了大量链球菌-Tactin的。这种污染是不能接受的,如果样品需要通过LC-MS/MS进一步分析。
一种有效的解决上述污染问题是树脂耦合链球菌-Tactin四聚体9通过共价交联的稳定化。为了这个目的,我们采用了一种水溶性的,非可裂解的,同双功能胺反应性交联剂BS3与稳定蛋白结构63-82成功使用的历史记录, 图5示出了BS3的化学式和其交联与赖氨酸在链球菌-Tactin免费的ε氨基基团反应。当树脂耦合链球菌-Tactin四聚体稳定后通过交联与BS3,样品污染与释放链球菌-Tactin问题得到基本消除( 图4,右车道)。因为交联与BS3不会引起广泛的蛋白聚集14,它不降低生物素的链霉亲和结合袋的可及性,使得交联的树脂适于链球菌标记的融合蛋白的纯化。应当指出,然而,化学交联具有生物活性(抗体等)的蛋白质的稳定激活和未激活的蛋白的构象,导致一些活性损失。例如,相比于用非交联的抗体15中得到使用BS3-交联的抗体的成熟的免疫沉淀法产生一个较低的目标蛋白产率。然而,生物活性的丧失一些被认为是可接受的折衷为提高样品的纯度。我们已经观察到类似的结果与BS3-交联链球菌-Tactin树脂。与交联的树脂得到的稍低蛋白产率是超过了极大的提高样品的纯度( 图6)的补偿。
该方法的另一个潜在应用是在链球菌标签膜蛋白的纯化solubiliz编带洗涤剂。洗涤剂是用于保持这样的疏水蛋白及其相关的复合物在溶液中必不可少的,但它们的存在可能会导致与链球菌-Tactin样品污染从亲和树脂释放。这方面的一个很好的例子是链球菌(II)的标记膜蛋白在 NTT1对链球菌-Tactin磁珠的纯化蛋白质结晶8的目的。洗涤剂laurylamidodimethylpropylaminoxide(拉庞)中的洗脱缓冲液中的存在导致链球菌-Tactin的从珠和不期望的链球菌-Tactin晶体8的后续生长的释放。树脂耦合链球菌-Tactin四聚体通过共价交联的稳定化可提供克服该问题的有效手段。
总之,化学交联已经成功地用于克服与来自链球菌-Tactin树脂变性洗脱相关联的限制。这种方法有助于取得良好的靶蛋白重covery没有引入样品污染。所提出的方法因此可以用于识别双链球菌标签的诱饵蛋白通过质谱法的特异性结合配偶体。此外,该方法可以适用于分离和表征核蛋白复合物,包括那些可逆交联的甲醛,以及溶解有洗涤剂的膜蛋白。最后,化学交联不显著改变链球菌-Tactin树脂的物理性能,使得交联的树脂可能适合于高通量应用。
披露声明
没有利益冲突的声明。
致谢
我们非常感谢技术支持四逆Miettinen,明娜Pöllänen和塔如Rautavesi的。我们感谢赫尔卡Nurkkala提供的HEK 293细胞中表达的双链球菌标记的GFP和佩卡Evijärvi提供录音设备。这项工作是由芬兰科学院,授权号码138329,134684和258978。
材料
| Name | Company | Catalog Number | Comments |
| Bis(sulfosuccinimidyl) suberate (BS3), No-Weigh format, 8 x 2 mg | Pierce/Thermo Scientific | 21585 | www.fishersci.com CAUTION: Hazardous substance. Causes serious respiratory, skin and eye irritation. Wear protective gloves and eye protection. |
| Strep-Tactin MacroPrep resin (50% suspension) | IBA | 2-1505 | www.iba-lifesciences.com |
| Spin-X centrifuge tube filter, cellulose acetate membrane, pore size 0.45 μm, non-sterile | Costar (Corning) | 8163 | www.corning.com/lifesciences/ |
| Dolphin-nose tubes | Costar (Corning) | 3213 | www.corning.com/lifesciences/ |
| Avidin | IBA | 2-0204 | www.iba-lifesciences.com |
参考文献
- Voss, S., Skerra, A. Mutagenesis of a flexible loop in streptavidin leads to higher affinity for the Strep-tag II peptide and improved performance in recombinant protein purification. Protein Eng. 10 (8), 975-982 (1997).
- Schmidt, T. G., Skerra, A. The Strep-tag system for one-step purification and high-affinity detection or capturing of proteins. Nat. Protoc. 2 (6), 1528-1535 (2007).
- Junttila, M. R., Saarinen, S., Schmidt, T., Kast, J., Westermarck, J. Single-step Strep-tag purification for the isolation and identification of protein complexes from mammalian cells. Proteomics. 5 (5), 1199-1203 (2005).
- Hafren, A., Hofius, D., Ronnholm, G., Sonnewald, U., Makinen, K. HSP70 and its cochaperone CPIP promote potyvirus infection in Nicotiana benthamiana by regulating viral coat protein functions. Plant Cell. 22 (2), 523-535 (2010).
- Jaskiewicz, M., Peterhansel, C., Conrath, U. Detection of histone modifications in plant leaves. J. Vis. Exp. (55), (2011).
- Witte, C. P., Noel, L. D., Gielbert, J., Parker, J. E., Romeis, T. Rapid one-step protein purification from plant material using the eight-amino acid StrepII epitope. Plant Mol. Biol. 55 (1), 135-147 (2004).
- Werner, A. K., Sparkes, I. A., Romeis, T., Witte, C. P. Identification, biochemical characterization, and subcellular localization of allantoate amidohydrolases from Arabidopsis and soybean. Plant Physiol. 146 (2), 418-430 (2008).
- Panwar, P., Deniaud, A., Pebay-Peyroula, E. Contamination from an affinity column: an encounter with a new villain in the world of membrane-protein crystallization. Acta Crystallogr. D. Biol. Crystallogr. 68 (10), 1272-1277 (2012).
- Hendrickson, W. A., et al. Crystal structure of core streptavidin determined from multiwavelength anomalous diffraction of synchrotron radiation. Proc. Natl. Acad. Sci. U. S. A. 86 (7), 2190-2194 (1989).
- Bernot, K. M., Lee, C. H., Coulombe, P. A. A small surface hydrophobic stripe in the coiled-coil domain of type I keratins mediates tetramer stability. J. Cell Biol. 168 (6), 965-974 (2005).
- Singh, I., et al. Solution structure of human von Willebrand factor studied using small angle neutron scattering. J. Biol. Chem. 281 (50), 38266-38275 (2006).
- Weldon, W. C., et al. Enhanced immunogenicity of stabilized trimeric soluble influenza hemagglutinin. PLoS One. 5 (9), (2010).
- Wang, W., Barger, S. W. Roles of quaternary structure and cysteine residues in the activity of human serine racemase. BMC Biochem. 12, 63 (2011).
- Rappsilber, J. The beginning of a beautiful friendship: cross-linking/mass spectrometry and modelling of proteins and multi-protein complexes. J. Struct. Biol. 173 (3), 530-540 (2011).
- Sousa, M. M., Steen, K. W., Hagen, L., Slupphaug, G. Antibody cross-linking and target elution protocols used for immunoprecipitation significantly modulate signal-to noise ratio in downstream 2D-PAGE analysis. Proteome Sci. 9, 45 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。