Method Article
遗传操纵
摘要
在这里,我们报道了一种采用I型和II型Δku80弓形虫高效的生成有针对性的基因缺失和基因替换为功能基因组学分析。
摘要
针对性的遗传操作使用同源重组的方法的选择功能基因组学分析,以获得基因的功能和表型(次)的详细视图。与靶基因缺失,有针对性的突变,传统的基因的功能,和/或标签的基因的突变株的发展提供了强有力的战略,以处理基因的功能,尤其是当这些基因操作可以有效地针对感兴趣的使用整合介导的基因位点,通过双击跨越同源重组。
由于非同源重组,功能基因组学分析弓形虫率非常高的情况下有效的方法,针对特定基因位点的基因缺失和基因替换先前已限制。最近,我们取消了非同源重组的主要途径,在I型和II型菌株T.弓形虫删除基因encodin克的KU80蛋白质1,2。 Δku80株正常工作过程中速殖子(急性)和bradyzoite(慢性) 在体外和体内的阶段,并表现出基本上是一个100%的同源重组频率。 ΔKu80的菌株进行功能基因组学研究可行的单一基因,以及基因组规模1-4。
在这里,我们报告的方法使用类型I型和IIΔku80Δhxgprt株推进T中的基因打靶方法弓形虫 。我们概述了用于产生对象的次黄嘌呤-黄嘌呤-鸟嘌呤磷酸核糖转移酶(HXGPRT)可选择标记的插入或缺失的基因缺失,基因置换和标记基因的有效方法。所描述的基因打靶协议可以用在多种方式推进Δku80株寄生虫基因组功能分析和开发单一菌株进行多个有针对性的遗传操作。这种遗传方法的应用和随后的表型分析将揭示T.生物学方面的基础和独特的弓形虫和相关重大人类病原体引起的疟疾( 恶性 )。和隐孢子虫病( 隐孢子虫 )。
引言
弓形虫病是一种常见的专性细胞内原生动物寄生虫,经常和慢性感染动物和人类的广泛的5。据估计,目前超过1亿人是慢性感染这种病菌。除了T所引起的疾病的重要性弓形虫感染的实验工具,强大的基因组学资源,提高可用性,易用性在体外生长和优良的小鼠模型T.弓形虫广泛的研究真核细胞病原体和其他重大apicomplexan寄生虫引起严重的疾病,如疟疾( 恶性 )。和隐孢子虫( 隐孢子虫 )5,7领先的模型系统。 à重大限制弓形虫作为模式生物的后代进行有针对性的遗传操作一直是低效恢复。这的proble基因打靶米是由于同源重组频率低,相对于非同源重组的频率非常高,在野生型菌株T.广泛的DNA同源性弓形虫即使目标DNA分子遗传学研究2。
最近,我们的基因类型的非同源重组的主要途径受阻I型和II株弓形虫通过删除编码的KU80蛋白质1,2基因。由此产生的类型I和II型ΔKu80的菌株表现出正常的生长速率, 在体外和在体内过程中速殖子和bradyzoite阶段的体外和体内的大小和行为,但是,这些菌株表现出基本上是100%的同源重组频率,这表型的可能性增加迅速隔离所需的后代有针对性的遗传操作由几百到几寿美国和倍1,2,4。最近社会广泛使用的类型,I型和IIΔKu80的菌株有显着提升的步伐,品种,以及T中有针对性的遗传方法的成功率弓形虫1-4,8-13。在这里,我们描述了一个全面的协议,有针对性的基因缺失,基因置换,基因标记ΔKU80株T.弓形虫 。我们演示了如何设计和可靠的目标遗传操作特定的基因或基因位点在ΔKU80株弓形虫。
研究方案
1。基因打靶删除感兴趣的基因
这种协议被设计为有效地产生具有上面定义的基因位点的靶基因缺失的突变株。先前所描述的T。霉酚酸和黄嘌呤(MPA + X)14-16选择后, 刚地弓形虫次黄嘌呤-黄嘌呤-鸟嘌呤磷酸核糖转移酶(HXGPRT)可选择的标记,在这个协议中使用的安全和可靠的标志插入。该协议使用经过验证的和具有成本效益的方法构建基于酵母重组克隆17,18 DNA靶向分子。几种可供选择的协议是市售的用于构建重组靶向分子,通过使用细菌的重组克隆的方法, 在体外重组克隆的方法,或融合PCR。下面描述的协议,提供最高的整体效率和可靠性,恢复克隆段ITES具备有针对性的基因缺失ΔKU80株T.弓形虫 。
1.1瞄准DNA的制备
- 访问ToxoDB 6( http://www.toxodb.org )获得感兴趣的基因(GOI)的基因组序列。
注意:应获得的基因组序列,从I型,II或III的基因组序列中的的数据库ToxoDB,最近的被操纵的应变。例如:GT1为RH和ME49 PRU。
- 设计中的具体重叠的引物,扩增的5'和3'的基因组的目标侧翼的感兴趣的基因(GOI),结合了33 bp的重叠与酵母穿梭载体pRS416(或者pRS426),并纳入了33 bp的重叠与可选择的标记( HXGPRT)( 图1A-B)。各引物中添加了独特的限制性内切酶位点两端的5'一ND 3'基因组靶向大桶,放在33基点之间的重叠和T.刚地弓形虫特异的引物序列(次)( 图1A-B)。
注:大于30 bp的重叠是需要高效的酵母重组克隆。的5'和3'的基因组的目标侧翼设计用于扩增特定的DNA片段之间的800和1400 bp的定义有针对性的删除。要知道,较短的侧翼靶向效率将大大降低在ΔKu80的的Δhxgprt背景的的2。
- PCR扩增用引物F1和R1的5'目标侧翼,PCR扩增靶的3'侧翼引物F2和R2( 图1A-C)从基因组DNA的3。另外,PCR扩增〜2 kbp的HXPGRT的包括相关的5'和3'侧翼区的HXGPRT cDNA pminiHXGPRT的盒14使用引物HXF和硬X射线的dhfr基因( 图1B-C)。
注意:使用待转染的亲本株的基因组DNA的扩增目标侧翼。
注意:放置在前进方向相对于5'和3'的DNA定位侧翼,以方便后续有效的遗传操作,如从被破坏的基因座有针对性地去除HXGPRT的HXGPRT标记。
- 通过琼脂糖凝胶电泳验证正确的PCR产物长度和估计的DNA片段的浓度,使用琼脂糖凝胶电泳标准或另一种方法,用于确定DNA浓度。
- 生成主管酵母等分试样中所描述的Gietz和Schiestly 17。
- 结合50ng的5'基因组的定位后刀面,50ng的3'基因组的定位后刀面,100毫微克的HXGPRT选择标记,用无菌H 2 O的线性化的穿梭载体,以达到最终体积为10和50 ng -20微升。三个PCR产物和酵母, 大肠杆菌,酵母转化感受大肠杆菌穿梭载体重组克隆使用协议由Gietz和Schiestly 17。铠转化的酵母减去尿嘧啶的基本培养基中琼脂平板上,在30℃下孵育2 - 3天。
注意:该有序组件的质粒,5'靶侧翼,的HXGPRT标记,和3'靶侧翼是促进了设计33 bp的DNA片段( 图1A-B)之间的重叠,并通过同源重组介导的酵母。
- 收获的酵母,加入2毫升的2倍YPAD尿嘧啶负板轻轻刮撞出不中断琼脂菌落。以5000×g的5分钟,弃上清,离心的酵母溶液。
- 酵母沉淀重悬在250微升含有核糖核酸酶A的重悬缓冲液中,并加入50 - 100μl的永恒,全到该溶液中清洗的玻璃珠。涡流粉碎酵母细胞以最快的速度为5分钟。
- 允许的玻璃珠来解决在试管底部,将上清转移至2毫升的Eppendorf管中。
- 隔离酵母使用少量的DNA分离试剂盒的DNA,再悬浮在最终体积为〜100微升。
- 混合2微升的DH10B电称职E. 40微升的的酵母DNA(〜50毫微克) 大肠杆菌保存在冰中。
- 将溶液转移到冷冻2毫米的间隙电试管和2.4千伏和129Ω的细菌细胞电穿孔。
- 救援细胞的每个试管中加入0.8毫升SOC肉汤14毫升SNAP-帽猎鹰管和传输解决方案。 40 - 60分钟转鼓上,在37℃下孵育细胞。
- 板块E.大肠杆菌在2XYT +氨苄青霉素(AMP)板和孵化板在37°C过夜。
- 选择〜6 - 8个单菌落3毫升2XYT + AMP和成长在37°C〜16小时
- 每个E.准备了30%的甘油冷冻股票大肠杆菌克隆。
- 分离质粒pΔGOI的从E.使用小量制备试剂盒的大肠杆菌克隆,重悬在终体积〜100微升。
- 验证用限制性内切酶消化pΔGOI来衡量DNA质粒大小和验证预期pΔGOIDNA带型。
- 最后确定验证pΔGOI的DNA序列的5'和3'的基因组的目标侧翼验证100%的DNA序列的基因组序列数据的基础上在http://www.ToxoDB.org 。
注意:近乎完美的序列同源性是必不可少的基因打靶效率3,因为每个碱基对的差异构成完美的同源性的长度相应的切最大化。
注意:II型Δku80应变的基础上保诚亲本圣的基因组序列的雨是不是在这个时候。这项工作使用II型ME49基因组序列基因组II型ΔKu80的应变作为替代。在数量的遗传位点的序列数据的基础上,据估计,ME49基因组的和保诚基因组的〜1每10,000个碱基,或更小的频率表现出单核苷酸多态性。
- 生成> 200微克的pΔGOI股票从验证E.接种了〜250毫升2XYT + AMP过夜培养与甘油股大肠杆菌小量克隆。
- 隔离pΔGOI从大量培养,使用maxiprep DNA分离试剂盒,重悬在终体积为1,000〜微升质粒DNA。
- 重复的限制性内切酶消化,或DNA的pΔGOImaxiprep DNA测序,以验证正确的目标DNA分子在转染前。
- 〜15微克pΔGOI的线性化的5'末端,使用独特的限制性内切酶X(RE.X)摘要现场建造的5'目标侧翼( 图1B)。
注:基因打靶T.刚地弓形虫要求至少约10微克的目标DNA,以获得一个有效的频率针对感兴趣的基因位点2的事件。
- 确认pΔGOI线性化,并通过琼脂糖凝胶电泳或一种替代方法,确定DNA浓度。
注意:如果限制性内切酶消化的5'侧翼不会产生线性化的完整的,所设计的3'独特的RE.Y摘要站点可以用来作为一种替代线性化pΔGOI的站点。
注:一个完全线性化的目标DNA分子成功的基因靶向ΔKu80的菌株的同源重组是必不可少的。
- 中和限制性内切酶由incubat在68°C为15 - 20分钟。
- 准备在100μl的无菌H 2 O 中的至少15微克线性化的质粒商店的线性pΔGOI在-20°C,直到转染时。
1.2 T.弓形虫的寄生虫,转染,选择,亚克隆,验证,存档和维护基因操纵株
培养的一般方法和操纵T。弓形虫在人包皮成纤维细胞(HFF)19-21。该ΔKu80的 Δ的hxgprt菌株正常复制在寄生虫感染培养基(老鹰最低必需培养基(EMEM)生长培养基补充有1%牛胎儿血清(FBS)和1%的抗真菌抗生素的稀释100倍的股票)1,2。 弓形虫所有工作必须使用生物安全2级程序执行。 T.弓形虫RHΔKU80 2削NTAL菌株产生,从RHΔhxgprt应变从鲁斯实验室14。从PruΔhxgprt(的保诚 gniaud菌株BSG-4 22),其中包含稳定地整合CAT可选择的标记和绿色荧光蛋白(GFP)的控制下的bradyzoite阶段的特异性启动子LDH2记者PruΔku801亲本菌株产生。
- 接种25cm 2的烧瓶中汇合的的HFF细胞与1×10 6活的I型RHΔKu80的Δhxgprt寄生虫,或接种两个25cm 2的烧瓶中,用2×10 6可行的类型II Prugniaud(PRU)ΔΔhxgprt Ku80的寄生虫。
注:存活的寄生虫被定义为外寄生虫,新鲜裂解。
注意事项: 此规模提供了足够数量的三个转染实验的活寄生虫的。
- 检查ΔKu80的的 Δ感染hxgprt的文化〜68 - 72小时后感染。验证是否存在活寄生虫〜90 - 95%的HFF细胞裂解,计划精确定时转染。
注:隔离新鲜egressed的寄生虫本协议的成功是至关重要的,因为寄生虫生存能力低的,将取消基因靶向效率。
- 到溶液中,搅动可行的寄生虫,关闭插件的密封盖子上的25cm 2的烧瓶中,并剧烈摇晃烧瓶中来回搅拌寄生虫的生长表面的无液体飞溅到在盖的内侧或烧瓶颈部。
注:寄生虫收获不需要为I型或注射器针头释放协议键入IIΔKU80株。
- 寄生虫溶液转移到一个10毫升注射器连接到含有3微米的膜过滤器固定器和一个开放的15毫升带螺旋帽的管放置在过滤器单元的顶部。注射器过滤到15毫升的螺丝帽筒寄生虫。
注意:通过膜过滤寄生虫删除受感染的细胞和细胞碎片。
- 确定的寄生虫浓度(每毫升速殖子的形式)使用血球。
注:可选:使用的寄生虫解决方案,设立斑块形成单位(PFU)检测21将读取7 - 8天后,以确定转染寄生虫足够的生存能力(PFU速殖子比≥0.2)。
- 在1400 XG 7分钟,吸上清液0.4毫升不扰乱寄生虫颗粒颗粒寄生虫。附带2分钟1,400 XG和抽吸剩余上清〜0.01毫升,而不会干扰寄生虫沉淀。
- 的寄生虫沉淀重悬弹管的底部,立即加入23 cytomix缓冲液(1.33倍浓度)的寄生虫沉淀,得到寄生虫浓度为4 - 5×10 7寄生虫/毫升cytomix的。
注意:省略加入ATP和还原型谷胱甘肽cytomix以来,这些新增的不提高基因打靶效率。
- 解冻100μl等分线性pΔGOI的协议1.1(步骤26)。
- 0.3毫升的寄生虫cytomix的溶液(〜1.3 - 1.6×10 7寄生虫)协议1.1(步骤26),100微升线性pΔGOI从传输,并立即传送整个0.4毫升寄生虫+pΔGOI混合冷冻2毫米的间隙电比色皿。
- 电穿孔寄生虫1.4千伏和24Ω。
- 住宅吨〜5分钟然后将其转移到150厘米2烧瓶中汇合HFF细胞感染培养基用30ml的转染的比色皿中的全部内容,并过夜孵育感染培养的转染,在室温下的比色皿。
- 开始选择霉酚酸+黄嘌呤(MPA + X)〜20小时后的转染( 图2A)通过更换感染培养基MPA + X的选择培养基(MPA(25微克/毫升)和黄嘌呤(50微克/毫升)在感染介质)。
注:请勿打扰的孵化的MPA + X选择烧瓶。
- 估计通过目视检查单层的MPA + X选择烧瓶〜8日发表的文章转染个PFU的总数。验证通过光学显微镜发展PFUS健康感染区的存在。
注:如果斑块是不可见的第8天,感染的迹象保持选择和显示器自突变菌株的离子可能具有减小的复制率。
注意:该ΔΔhxgprt Ku80的寄生虫株有一个非常低的背景的不需要的非定标事件,它可以成功地分离出相当严重的突变株的,但不是致命的生长缺陷。如果一个基因是必不可少的,它不能被删除,的主转染,或随后通过寄生虫种群,可能会揭示寄生虫不再复制随着人口解析对象击倒在选择的表型。
- 在步骤3中,摇动烧瓶中撞出的单层细胞外寄生虫[可见的噬菌斑后,已经开发],以产生一种寄生虫的解决方案。接送〜0.5毫升的寄生虫的解决方案,从MPA + X选择烧瓶25厘米2 MPA + X选择烧瓶中汇合的HFF细胞(指定文化通1A)。
- 打跑寄生虫在原来的150厘米2 MPA + X选择烧瓶〜3天后和转让〜0.5毫升寄生虫解决的第二个25厘米2 MPA + X选择烧瓶中汇合HFF细胞(候这种文化通1B)。
- 允许感染区的发展传球1A和/或通过1B瓶〜5天。直观地验证光镜,通1A和1B瓶的包含健康感染区25个可行个PFU最低。
- 选择合格1A或1B通的烧瓶继续通过MPA + X选择培养基,在25厘米2瓶。 MPA + X选择下保持通道。
注意:必须培养足够数量的后代删除从人口的非集成的持续存在的附加 体亚克隆前寄生虫。不要进行亚克隆转染后的前20天为I型RH Ku80的ΔΔhxgprt,或转染后25天前II型PRUΔKu80的Δhxgprt寄生虫,以便有足够的时间来稀释非集成的附加 体1,2。
- 96托盘MPA + X选择培养基含有汇合HFF细胞的亚克隆寄生虫。准备一个塔盘1寄生虫/孔和第二托盘在2个寄生虫/孔的浓度的浓度。
注意:最近溶解(约90 - 95%的HFF细胞在25cm 2的烧瓶中),以确保寄生虫具有高可行性的亚克隆寄生虫。
注意:用于亚克隆的最佳时间帧转染后通过测量迅速成功对象的寄生虫产生在一个较高的频率在选定的人口1成立。
- 继续通过转MPA + X选择培养基使用每周通过时间表感染寄生虫的主要人口25厘米2 HFF的烧瓶中用寄生虫溶液10μl的。
注意:如果没有获得克隆进行有针对性的基因缺失(击倒)从第一亚克隆,resubclone继续保持人口的寄生虫在步骤18〜10 - 12周后转染。
注意:不能得到基因缺失的原因之一来自一些pΔGOI质粒的游离基因的持久性。游离基因的持久性是由所含的序列的5'和3'的基因组的目标侧翼,并没有出现出现从HXGPRT的遗传元件。约5 - 10%的目标质粒表现出显着的附加体的持久性,必须稍后的时间的寄生虫种群的亚克隆,以允许有足够数目的世代时间稀释持续存在的附加体和解决人口主要是稳定的整合体。
- 分数的96孔的托盘6 - 7天后的亚克隆(I型寄生虫)或7 - 8日发表的文章亚克隆(类型II寄生虫)的样品中的一个单一的PFU作为一个单一的感染区,确定在光学显微镜40X或60X的力量。标记一个小点上的96孔的纸盒盖PFU以及指定位置。
- 混合每口井的内容设置在50微升(200微升尖)用吸管通过引导流体流过的PFU驱散寄生虫以及含有一个单一的PFU。
注:混合以及加速裂解HFF单层寄生虫。类型我将RH株裂解〜II型混合后第4天,保诚寄生虫以及裂解〜5天混合后。
- 选择一打裂解井(克隆)和耐擦伤在底部的每个这些溶解的井的使用0.5 - 10微升的移液管尖,同时绘制6微升寄生虫溶液。反传输6微升寄生虫装有汇合HFF细胞在1毫升MPA + X选择培养基中,在24孔到一个良好的解决方案。
注意:这是必不可少的划伤井底保持不断接触寄生虫居住在井底的移液管尖的开口孔。
- 监测24孔托盘HFF细胞裂解。
注:键入我RH寄生虫通常会裂解井24井格式〜4天。 II型PRU寄生虫通常会裂解井〜5天。
- 将2微升可行的的寄生虫的解决方案,从每口井的底部,在24孔格式划伤+ X选择培养基,每孔含有汇合HFF细胞和1毫升MPA的一个新的24孔托盘对应得很好。
注:所有寄生虫克隆和线可以连续主在这24孔托盘格式通过可行的寄生虫溶液2微升,每7天禀。
- 验证寄生虫被成功地转移到一个新的24孔托盘〜18小时后通过光镜目视检查。
- 收获寄生虫裂解井24孔托盘从步骤23 - 24使用1毫升或10毫升吸管和转移的Eppendorf管中的寄生虫的解决方案。
- 颗粒的寄生虫在1,400×g,7分钟,冲洗一次在1毫升磷酸缓冲盐水(PBS),沉淀再次在1,400×g,3分钟。
- 从颗粒吸液PBS,再加入200μl的PBS至沉淀中,悬浮寄生虫。在-80℃冻结的寄生虫的解决方案,直到DNA隔离。
- 隔离寄生虫DNA从每个克隆使用组织DNA隔离MINIKIT。
- 验证目标基因缺失(基因敲除)通过PCR验证引物( 图2A-C)。测试感兴趣的基因的编码区的功能和使用的CxF上游和下游CXR的基因组DNA的引物( 图2A-B)试验的PCR产物的存在下,跨越基因组的目标的侧面和HXGPRT证明正确的5'和3没有'对象的HXGPRT基因整合到已删除的基因位点。
注意:验证的引物必须是唯一的感兴趣的基因或假阳性结果可以得到。引物设计可以上http://www.toxodb.org验证,爆破引物序列的基因组(次),以验证引物是唯一的。
- 按每周计划的通道寄生虫的无性系中所描述的步骤24。针对性的缺失已验证后,继续选择的MPA + X是可选的。
- 存档的寄生虫克隆,准备冷冻个股。颗粒外寄生虫HFF细胞的裂解,在一个25厘米2培养瓶中,删除媒体和寄生虫轻轻悬浮颗粒在细胞培养的冷冻介质的寄生虫浓度> 4×10每毫升7寄生虫。等分试样转移到离心管中并储存寄生虫无限期地在液氮中,或在-80℃下
2。删除HXGPRT的
该协议设计用于除去从的HXGPRT标记的基因操作的ΔKu80的菌株在基因组中的整合位点。除去HXGPRT允许标记回收和与多个遗传操作使用唯一的选择的基础上HXGPRT 1-3代的菌株。虽然下文详述的协议描述的方法来重新定位的轨迹删除HXGPRT的 ,应该指出的是除去上面的感兴趣的基因位点的HXGPRT也允许同时重新整合的野生型基因(三omplementation),重新整合的突变基因,以及重新整合了一个标记基因(N-或C-末端的绿色荧光蛋白,HA标记等),允许用于各种遗传操作。 24行动的机制和目标使用6黄嘌呤选择的协议已先前描述1-3,15。
2.1 HXGPRT删除
- 海关HXGPRT的可选择的标志从pΔGOI,消化与RE.Z断独特的限制性酶切位点侧翼的HXGPRT( 图1B)。
- 验证完全消化的DNA通过琼脂糖凝胶电泳。隔离从琼脂糖凝胶上的两个频带中的较大者。
注意:两个频带中的较大的包含质粒的5'和3'DNA靶侧翼,但不的HXGPRT基因。
- 将琼脂糖部分含有较大的DNA带离心柱上篮克凝胶平放在膜。在13000×g下 4分钟,在RT中的自旋列。添加无菌H 2 O流过,使体积为100μl。
注:其他商业方法可从琼脂糖分离DNA。
- 通过乙醇沉淀浓缩DNA,最终体积为18微升无菌H 2 O中的DNA,再悬浮
- 浓缩DNA混合1微升与7毫升H 2 O,1μl的10倍连接缓冲液和1μlT4 DNA连接酶(5单位),并将反应在4℃下保温过夜,以产生pΔGOIc(pΔGOIclean)( 图3A)。
注:在这一步的DNA片段与含有DNA末端的RE.Z可以被设计和包括创建质粒适合野生型基因(互补),有针对性地重新整合的突变基因进行有针对性的重新整合,以及有针对性的标记基因的重新整合(N-或C-端HA标签,GFP,等)。
- 稀释前用无菌H 2 O反应2X电。
- 变换pΔGOIc到E.在协议1.1 大肠杆菌的克隆,分离,并验证目标质粒。然后线性pΔGOIc的准备转染(见步骤1.1.11到1.1.26)。
- 重复的寄生虫转协议,在协议1.2概述(步骤1至11)。
请注意:在此之前进行的步骤1至8,验证对象除去HXGPRT的突变株中是可行的。感染150厘米2烧瓶中汇合HFF细胞与1×10 6速殖子的突变株,使用6 -硫代黄嘌呤(6TX)的选择培养基(200μg/ ml的感染培养基6TX),并放置在烧瓶中的PFU检测。检查烧瓶8天后,以确认没有(或很少的; <10)PFU是可见的,这是必不可少的建立,潜在TiAl基的基因打靶的效率将超过任何潜在的自发逆转突变株的表型与的减少HXGPRT表达(6TX耐药表型)。
注:约5 - 10%的HXGPRT整合位点表现出显著自发频率6TX阻力,即使HXGPRT标记仍然集成在目标站点(见代表结果部分解释)。
- 开始6TX选择〜20小时后转染150厘米2烧瓶中的培养基中,通过改变到6TX选择培养基。
注:请勿打扰〜10天转染后的烧瓶。
- 检查烧瓶为PFU形成10天- 12转染后(I型寄生虫)或10天- 16转染后(类型II寄生虫)。
注:Parasi的TES被删除HXGPRT针对不会开始生长基因和mRNA HXGPRT下选择6TX,直到被删除,的残留HXGPRT蛋白失活。
- 摇动选择烧瓶中,以创建一种寄生虫的解决方案,和转让0.5 - 1.0毫升到新的25cm 2的烧瓶中汇合HFF细胞和5毫升6TX的选择培养基中的寄生虫的溶液。重复从主150厘米2的转移到新的25cm 2的烧瓶中两个天,每天一次。
注:多重采样增加的机会即已经失去了HXGPRT的基因捕捉可行的针对性寄生虫。
- 检查25厘米2瓶〜5天,感染后发展区健康复制寄生虫的PFU就能来验证是否存在。挑选一个或两个瓶中含有感染区。
注意事项: 删除寄生虫的HXGPRT基因复制,在一个正常的增长速度在6TX选择。
- 继续流逝的寄生虫在6TX选择培养基。
- 亚克隆寄生虫人口后25 - 30天的选择。设置一个96〜1 /寄生虫和其他〜2 /寄生虫以及托盘。
- 准备寄生虫DNA分离的克隆,并保持在24孔格式文化的克隆根据协议1.2(19至29步)。
- 通过PCR使用在图3A-B中概述的战略确认HXGPRT删除。
3。 C-末端标记的蛋白质
此协议是专为C-末端标记的蛋白质通过同源重组双十字针对一体化的标记,基因位点的基因MPA + X选择2,4。此协议有效运作,因为5'DHFR序列 HXGPRT标记是一个充分验证功能的3'非翻译区的其他基因2,4。
3.1直接C-末端标记的蛋白质内源性基因位点
- 创建定向pΔGOItag质粒构建酵母重组克隆( 图4)和协议1.1中描述的方法。的5'基因组的定位后刀面包含了最后的800〜1200 bp的编码区(或基因组DNA)的GOI,除了终止密码子被移动到的位置选择的标签(HA标签,His标签,Myc基因标记3'等)
- 建立上面的内源性基因的蛋白质编码基因的C-末端标记的目标插入,通过以下协议1.1和1.2中的步骤,使用概述的策略( 图4)。
- 验证使用PCR策略上面的内源基因位点的C-末端标记插入。
- 方案1方案2中描述的方法,使用步骤d"重新定位的基因位点ELETE的HXGPRT选择标记创建了一个精确调节内源性基因标记的蛋白的基因表达。此协议还恢复HXGPRT的的可选择的标记,可以再次使用的目标在标签的菌株(见方案1)的另一个轨迹。
结果
提供的模板的详细构造一个目标质粒删除的基因,包括限制性酶切位点的位置和生成,促进基因定位和基因打靶技术的验证,以及为随后删除HXGPRT,在质粒构建的引物单步的过程( 图1A-C,图2A,图3A)。作出有针对性的基因缺失( 图2A),用来验证的淘汰赛删除的引物对,例如,I型rop18( 图2B),以及具有代表性的PCR验证结果的一般原理图 ( 图2C)。此代表性的结果示出为说明结果的范围内,可以得到在基因位点是比较困难的目标。成功的目标的基因的缺失将导致在没有的基因,在感兴趣的PCR产物(PCR 1),3'的基因组的目标侧翼(PCR2)的存在下,以及存在的HXGPRT适当整合的可选择的标记之间的5'和3'的基因组的目标侧翼定义的删除(PCR3及PCR4) 。验证克隆3,4,5,6,8,9,和11有针对性的基因缺失(击倒)HXGPRT已经取代了印度政府( 图2C)。
表示不包含基因缺失的克隆,可以由各种不同的条带模式。通常情况下,没有基因缺失的克隆将镜像亲本株(亲柄)与PCR1和PCR2的观察到的波段,但不为PCR3或PCR4看到的克隆1和2( 图2C)。这种"家长模式"源于一些潜在的机制。有时候,MPA抗寄生虫进行非集成坚持附加体pΔGOI目标质粒,我们注意到,继续选择常常迫使这些附加体集成。我们也观察到一些罕见的背景不同IΔKu80的菌株由于集成的pΔGOI意外定位质粒其中包含一个的HXGPRT cDNA的通过表达DHFR的 5'和3'的启动子元件,到DHFR基因座或到部分删除的HXGPRT的轨迹14。虽然这种罕见的事件是有针对性的整合,它不是旨在整合和作为一个关键点要记住在设计任何基因替换策略。质粒DNA同源性进行您的pΔGOI针对大于120个基点可能会提供一个替代网站重组在ΔKU80株2,可以给一个不受欢迎的背景中。在这样的背景下,减少或不存在的相比,I型II型保诚ΔKu80的菌株因为是基于I型序列核苷酸多态性时相比,II型DNA的HXGPRT可选择标记大大降低了这一难得的背景在实验中使用II型PRUΔKU80应变1。如果一个基因位点是必不可少的(不能删除),或有一个极低的基因靶向频率轨迹,或如果坚持[]附加体都是不容易消除了通过增长和选择非集成,这种父母的格局将主宰观察MPA的图案抗性克隆。另外,有时可观察到靶向DNA分子只在5'或3'的基因组的目标侧翼和一个带观察为PCR3或PCR4(但不是两者)看到随着PCR1和PCR2在克隆10(5集成集成)和克隆7(3'整合)( 图2C)。这些模式表明单个交叉的不经常发生的,在上面的轨迹,集成的HXGPRT,但此对象的集成不删除感兴趣的基因为目标的质粒整合。这种模式(泳道7&10 图2C)EM强调说需要报告PCR数据验证,定点整合的发生,而不是一个单一的同源跨越的目标分子的第二非同源整合。在极少数情况下,我们观察到基因的克隆12( 图2C),表示父母图案和有针对性的删除模式表示的混合物。这种模式最有可能产生有时从两个克隆以及在同一地点存在的寄生虫基因型。
示出的一般原理用于去除的HXGPRT来自Δku80Δgoi的:: HXGPRT删除HXGPRT的应变( 图3A)。的引物对用于验证从ΔKu80的ΔGRA2 :: HXGPRT( 图3B)的去除HXGPRT PCR5的一个独特〜1.2 kbp的带放大看到克隆4,第7,第9,第11和12( 图3C)。如果不从HXGPRT的轨迹,3〜。4 KBP波段(克隆1,2,3,6,8,10,和父母控制)。几种机制的作用,使去除HXGPRT(6TX选择)更具挑战性和一体化的HXGPRT(MPA + X选择)的效率比。 MPA的选择是简单更有效率大于6TX选择14,16。此外,更高的水平的HXGPRT表达需要为的挑选6TX比MPA选择16,24。因此,可能减少HXGPRT的酶活性或基因突变或表观遗传学变化,减少在一个基因的基因表达水平的HXGPRT的突变,有可能取消的有效性选择6TX。即使有了这些挑战6TX选择的的挑选6TX在ΔKu80的菌株,成功率大于90%1-3在第一次尝试。
直接的C-末端标记的蛋白编码基因的一般方案( 图4)所示。这计划采用直接集成通过3 HXGPRT'的标记基因同源重组的双重跨越,也采用类似上述的验证策略。当一个基因被怀疑是一个不可缺少的基因,这可以使用第二个独立隔离的目标DNA质粒转染验证。替代的方法,如计划调控基因的表达,可用于进一步核实是必不可少的,如果一个基因25。
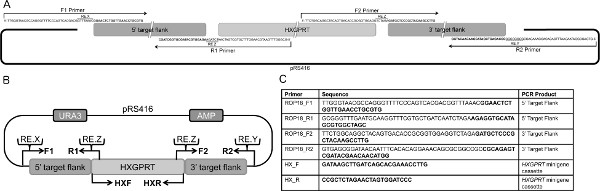
图1。靶向DNA质粒的设计概述。 。设计示意图重叠引物PCR扩增5'和3'目标侧翼的pRS416穿梭载体和HXGPRT的小基因盒的33 bp的重叠。在原理图中所示的引物为用于产生的5'和3'靶的侧翼pΔROP1810 B.设计目标DNA分子的整体策略。骨干pΔGOIpRS416穿梭载体含尿嘧啶(市建局)和氨苄青霉素(AMP)可选择的标记。 pRS416插入的是一个1〜的KBP 5的DNA扩增基因组DNA的HXGPRT小基因盒和pRS416使用F1和R1引物重叠的目标侧翼,1〜3 KBP'从基因组DNA扩增目标DNA侧翼重叠HXGPRT小基因盒pRS416使用F2和R2引物和HXGPRT的小基因盒。以下独特的限制性内切酶消化站点被添加到引物:RE.X中的F1引物(限制性内切酶的X剪切站点)切割质粒在目标DNA的5'侧翼的5'末端,在R2 RE.Y切割的质粒的引物中的R1和F2的引物在3'端的3'的目标DNA侧翼和RE.Z切除HXGPRT分钟盒式igene C.引物序列,用于生成靶向构建体删除rop18。 黑体区域对应到T。刚地弓形虫基因组序列,以及的nonbold区域对应的限制酶位点重叠与pRS416在HXGPRT小基因盒的序列。 HX_F和HX_R底漆对放大HXGPRT的小基因盒14。读取的引物从5'至3'。表改编从芬特雷斯等[10]。 点击这里查看大图 。

图2。概述删除使用HXGPRT基因的协议。 Disruptio。n的双交叉同源重组事件使用〜的KBP 5 DNA目标侧翼〜1 KBP 3'目标DNA侧翼质粒pΔGOI的的GOI的Δku80Δhxgprt株。 PCR1的PCR策略,PCR2,PCR3,PCR4(不按比例),使基因型验证,验证克隆有针对性地整合HXGPRT印尼政府轨迹和删除。B.代表底漆对设计验证删除rop18 。ROP18_DF ROP18_DR放大PCR1,ROP18_ExF ROP18_CxR的扩增PCR2,ROP18_CxF DHFR_CxR的放大PCR3 DHFR_CxF的和ROP18_CxR放大PCR4( 见图2A)。读取的引物从5'至3'。表改编从芬特雷斯等:10 C.代表结果验证靶基因的缺失(rop18)使用HXGPRT的。以下转染质粒pΔROP18的成Δku80Δhxgprt和选择在MPA +X,MPA +所述抗性克隆父母应变控制删减rop18。PCR 1(400个基点)和PCR(〜650 bp)的产品是积极的和消极(〜1200 bp的PCR 3)和PCR检测4(约1,300 bp)的产品。 GOI淘汰赛是有针对性积极为PCR2,PCR3 PCR4的产品和为负的PCR 1产品( 见图2A)。 PCR1和PCR2( 上图 )的结果,代表面板PCR3( 中图 ),和PCR4( 底部面板)所示。克隆3,4,5,6,8,9和11表现出正确的带型的PCR 1,PCR2,PCR3和PCR4定义有针对性的基因缺失事件在克隆。克隆1,2,7,10和12是没有基因缺失,对应于其他潜在的有代表性的结果。 (C =家长控制应变Δku80Δhxgprt,M =大小标记) 点击此处查看大图 。

图3。的协议重新定位感兴趣的基因删除HXGPRT的概述。 A.战略的HXGPRT去除选择标记的双交换同源重组事件在应变Δku80Δgoi的:: HXGPRT使用〜的KBP 5 DNA目标侧翼和一个1〜的KBP 3的DNA目标侧翼质粒pΔGOIc的的。 PCR基因型验证策略描绘的检测用引物对的PCR产物(PCR5)跨越删除(不按比例)。B.甲代表性的设计的引物对从GRA2验证去除可选择标记HXGPRT轨迹应变Δku80Δgra2中:: HXGPRT引物GRA2 _CLF GRA2_CxR扩增PCR5。引物读取从5'至3'。C.代表面板,可以得到下面的转染与Δku80Δgoi:: HXGPRT和选择6TX质粒pΔGOIc到的耐6TX克隆。无性系4,第7,第9,第11和12表现出正确的带型的PCR5对应的对象删除的HXGPRT标记(〜1.2 kbp的产品,跨越的3'与5'侧翼和以外的3'侧翼有轻微的重叠侧翼)。克隆1,2,3,6,8和10(该频带光)代表预期的条带图案的周围〜3.4 kbp的亲本克隆基因型对应,即使这些克隆表现出一定程度的阻力,容许6TX他们的选择(此型可偶尔油然而生关机的HXGPRT表达( 见附注协议2.1(第8步)和代表性的成果部分)(C =家长控制应变Δku80Δgoi:: HXGPRT的 ,M =大小标记)。w.jove.com/files/ftp_upload/50598/50598fig3large.jpg"目标="_blank">点击这里查看大图。

图4。设计的一个目标标记的蛋白质的C-末端的DNA分子。策略是基于的能力的HXGPRT标记,也可作为3'下游的调节区。的骨干pΔGOItag的pRS416穿梭载体含有尿嘧啶(市建局)及氨苄青霉素(AMP)选择标记。 〜1 5 KBP'目标DNA扩增基因组DNA的侧翼重叠HXGPRT小基因盒和pRS416使用Fgoi引物RTAG,重叠了〜1 KBP 3'从基因组DNA扩增目标DNA侧翼插入pRS416 HXGPRT小基因盒和pRS416使用F2和R2引物和在HXGPRT小基因盒。的5'DNA靶侧翼带有标签(HA,Myc基因,他等),然后由一个替换的终止密码子,终止密码子替换。 MPA + X选择集成的C-末端的标签和的下游HXGPRT,和移动的3'端非编码区的位置后HXGPRT标记。以下独特的限制性内切酶消化网站已加入引物:RE.X在Fgoi引物(限制性内切酶的X剪切站点)切割质粒在目标DNA的5'侧翼的5'末端,并在RE.Y的R2引物切割质粒的3'末端的3'DNA靶侧翼,在rtag命令和F2引物和RE.Z切除HXGPRT的的小基因盒用于质粒构建重新定位标记的基因位点删除HXGPRT标记将恢复安置的3'UTR。
讨论
在这里,我们提供了一个协议,用于有效的基因定位在ΔKu80的寄生虫株基因操纵拥有对象的基因缺失,基因置换和/或标签的基因的后代,以使有效地回收。的顺序执行这些方法提供了可靠的包含单个或多个目标的遗传操作1-3的寄生虫突变体的分离方法。有针对性的删除而产生取决于多种因素,ΔKu80的应变与所提出的策略和协议的使用极大地提高了工作效率和易于精确定义的突变株T.功能基因组研究中的弓形虫 。
基因组的T。弓形虫在无性阶段的单倍体。因此,考虑规划时删除基因,该基因不得在体外至关重要的。然而,效率的圆盾鼎基因敲除在ΔKU80株是非常高,这使隔离显著受损的复制率的突变株。如果有针对性的基因是必不可少的,寄生虫往往在选择过程中停止复制。针对性的基因操纵的另一个关键因素是必须取得至少620 bp的基因组靶向侧翼检测到有针对性的集成,完美的同源性。较长的同源性区域产生更高的效率目标和使用目标约1,000 bp的DNA侧翼是一个可靠和有效的方法1-4。出于这个原因,重要的是产生T的同一菌株的基因组的目标侧翼刚地弓形虫 (RH,保诚)作为操纵基因的菌株。缺乏足够的同源性,经常导致在1个基因组的定位后刀面的靶向整合,但没有其他。不完全整合或未能取得淘汰赛MAŸ也可以由于游离持久。转染后,立即所有的靶向分子的非集成的附加体,有时靶向分子,可以持续许多世代的附加体。 〜1 KBP使用目标DNA侧翼,并继续通过寄生虫在选择之前,再亚克隆经常解决与游离的持久性有关的问题。
一旦淘汰赛进行验证,并除去的HXGPRT标记,基因打靶策略可以重复1-3在一个单一的寄生虫株产生多个基因缺失的第二GOI。缺失,替换,或标记基因的产生,也可以通过使用不同的可选择的标记物( 博莱霉素,CAT,乙胺嘧啶抗性DHFR等)。 CAT可选择标记虽然目前存在于不同IIΔKu80的保诚基因组1,此标记可以使用HXGPRT除去选择这里描述的协议。在我们的手中,HXGPRT选择是最安全和最有效的靶向效率最高的单拷贝针对性插入标记是足够强大的选择在MPA + X介质。HXGPRT还提供了目前唯一有用的方法,有针对性地删除一个可选择的标记( 图3)使用6 -硫代黄嘌呤(6TX)选择2,3。因此,该协议提供了目前唯一的方法定义的突变株与一些有针对性的遗传操作。
ΔKu80的弓形虫株进行有针对性的遗传操作,该协议提供了一个有价值的和有效的方法,和适用于一个单一的基因,基因家族,或功能基因组的全基因组研究的分析。 ΔKu80的菌株1,2之前,可用的,这些方法尚未得到广泛应用,由于到该INE这些方法fficiency。因此,该协议是广泛适用于有针对性的遗传操作弓形虫和所有感兴趣在寄生虫宿主反应,生物学,功能基因组学的问题上解决一系列调查访问。
披露声明
作者宣称,他们有没有竞争经济利益。
致谢
这项工作得到补助从NIH DJB(AI041930,AI073142,AI075931,AI091461)。
材料
| Name | Company | Catalog Number | Comments |
| Name of Reagent/Material | Company | Catalog Number | Comments |
| Overlap Primers | Integrated DNA Technologies | 4 nmole Ultramer DNA oligos | |
| Validation Primers | Integrated DNA Technologies | 100 nmole DNA Oligo | |
| Yeast Strain #90845 | ATCC | Designation FY834 | |
| Shuttle Vector pRS416 | ATCC | 87521 | |
| DH10B E. coli | Invitrogen | 12033-015 | SOC broth in kit with E. coli |
| Resuspension Buffer | Qiagen | Buffer P1 in QIAprep Spin Miniprep Kit | |
| Miniprep Kit | Qiagen | 27104 | QIAprep Spin Miniprep Kit |
| Glass Beads | Scientific Industries | SI-BG05 | 0.5 mm acid-washed |
| Qiacube Automated Robotic Work Station | Qiagen | ||
| Electroporation Cuvette | USA Scientific | 9104-5050 | 2 mm-gap |
| BTX600 electroporator | BTX | ||
| Maxiprep Kit | Qiagen | 12662 | QIAprep Spin Maxiprep Kit |
| 25 cm2 Canted neck plug seal flask | Corning | 430168 | |
| 150 cm2 Canted Neck plug seal flask | Corning | 430823 | |
| Human Foreskin Fibroblasts (HFF) cells | ATCC | SCRC1041 | |
| Swin-lok Filter Holder | Whatman | 420200 | 25-mm-diameter |
| Membrane | Whatman | 110612 | Nucleopore Track-etched Membrane 3 mm pore size, 25-mm-diameter |
| Mycophenolic acid (MPA) | Sigma | ||
| Xanthine (X) | Sigma | ||
| 96-well Tissue Culture Tray | Corning Costar | ||
| 24-well Tissue Culture Tray | Corning Costar | ||
| MEM Eagle Media | Lonza Biowhittaker | 12-611F | |
| Fetal Bovine Serum | Gibco | 26140-111 | |
| Antibiotic-Antimycotic (Anti-Anti) | Gibco | 15240-062 | |
| Spin Column | Primm Labs | PAE-100 | Easy Clean DNA Extraction Spin Kit |
| T4 DNA Ligase | New England Biolabs | ||
| 6-thioxanthine | Acros Organics | ||
| Tissue DNA Minikit | Qiagen | 51104 | QIAamp DNA Blood Mini Kit |
| Cell Culture Freeze/Recovery Media | Gibco | 126-48-010 | |
| Phosphate Buffered Saline | Hyclone | SH30028.02 | minus calcium, minus magensium |
参考文献
- Fox, B. A., et al. Type II Toxoplasma gondii KU80 knockout strains enable functional analysis of genes required for cyst development and latent infection. Eukaryot. Cell. 10, 1193-1206 (2011).
- Fox, B. A., Ristuccia, J. G., Gigley, J. P., Bzik, D. J. Efficient gene replacements in Toxoplasma gondii strains deficient for nonhomologous end joining. Eukaryotic Cell. 8, 520-529 (2009).
- Fox, B. A., Bzik, D. J. Avirulent uracil auxotrophs based on disruption of orotidine-5'-monophosphate decarboxylase elicit protective immunity to Toxoplasma gondii. Infection and Immunity. 78, 3744-3752 (2010).
- Hortua Triana, M. A., et al. Biochemical and molecular characterization of the pyrimidine biosynthetic enzyme dihydroorotate dehydrogenase from Toxoplasma gondii. Molecular and Biochemical Parasitology. 184, 71-81 (2012).
- Kim, K., Weiss, L. M. Toxoplasma gondii: the model apicomplexan. Int. J. Parasitol. 34, 423-432 (2004).
- Gajria, B., et al. ToxoDB: an integrated Toxoplasma gondii database resource. Nucleic Acids research. 36, 553-556 (2008).
- Kim, K., Weiss, L. M. Toxoplasma: the next 100 years. Microbes and infection / Institut Pasteur. 10, 978-984 (2008).
- Butcher, B. A., et al. Toxoplasma gondii rhoptry kinase ROP16 activates STAT3 and STAT6 resulting in cytokine inhibition and arginase-1-dependent growth control. PLoS pathogens. 7, e1002236 (2011).
- Daher, W., Klages, N., Carlier, M. F., Soldati-Favre, D. Molecular characterization of Toxoplasma gondii formin 3, an actin nucleator dispensable for tachyzoite growth and motility. Eukaryot. Cell. 11, 343-352 (2012).
- Fentress, S. J., et al. Phosphorylation of immunity-related GTPases by a Toxoplasma gondii-secreted kinase promotes macrophage survival and virulence. Cell Host Microbe. 8, 484-495 (2010).
- Musiyenko, A., Majumdar, T., Andrews, J., Adams, B., Barik, S. PRMT1 methylates the single Argonaute of Toxoplasma gondii and is important for the recruitment of Tudor nuclease for target RNA cleavage by antisense guide RNA. Cellular microbiology. 14, 882-901 (2012).
- Straub, K. W., Peng, E. D., Hajagos, B. E., Tyler, J. S., Bradley, P. J. The moving junction protein RON8 facilitates firm attachment and host cell invasion in Toxoplasma gondii. PLos Pathog. 7, e1002007 (2011).
- Szatanek, T., et al. Cactin is essential for G1 progression in Toxoplasma gondii. Molecular Microbiology. 84, 566-577 (2012).
- Donald, R. G., Carter, D., Ullman, B., Roos, D. S. Insertional tagging, cloning, and expression of the Toxoplasma gondii hypoxanthine-xanthine-guanine phosphoribosyltransferase gene. Use as a selectable marker for stable transformation. J. Biol. Chem. 271, 14010-14019 (1996).
- Donald, R. G., Roos, D. S. Gene knock-outs and allelic replacements in Toxoplasma gondii: HXGPRT as a selectable marker for hit-and-run mutagenesis. Molecular and Biochemical Parasitology. 91, 295-305 (1998).
- Pfefferkorn, E. R., Borotz, S. E. Toxoplasma gondii: characterization of a mutant resistant to 6-thioxanthine. Exp. Parasitol. 79, 374-382 (1994).
- Gietz, R. D., Schiestl, R. H. Frozen competent yeast cells that can be transformed with high efficiency using the LiAc/SS carrier DNA/PEG method. Nature Protocols. 2, 1-4 (2007).
- Oldenburg, K. R., Vo, K. T., Michaelis, S., Paddon, C. Recombination-mediated PCR-directed plasmid construction in vivo in yeast. Nucleic Acids Res. 25, 451-452 (1997).
- Fox, B. A., Gigley, J. P., Bzik, D. J. Toxoplasma gondii lacks the enzymes required for de novo arginine biosynthesis and arginine starvation triggers cyst formation. Int. J. Parasitol. 34, 323-331 (2004).
- Roos, D. S. Molecular genetic tools for the identification and analysis of drug targets in Toxoplasma gondii. Curr. Top. Microbiol. Immunol. 219, 247-259 (1996).
- Roos, D. S., Donald, R. G., Morrissette, N. S., Moulton, A. L. Molecular tools for genetic dissection of the protozoan parasite Toxoplasma gondii. Methods in Cell Biology. 45, 27-63 (1994).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Molecular Microbiology. 44, 721-733 (2002).
- vanden Hoff, M. J., Moorman, A. F., Lamers, W. H. Electroporation in 'intracellular' buffer increases cell survival. Nucleic Acids Research. 20, 2902 (1992).
- Pfefferkorn, E. R., Bzik, D. J., Honsinger, C. P. Toxoplasma gondii: mechanism of the parasitostatic action of 6-thioxanthine. Exp. Parasitol. 99, 235-243 (2001).
- Mital, J., Meissner, M., Soldati, D., Ward, G. E. Conditional expression of Toxoplasma gondii apical membrane antigen-1 (TgAMA1) demonstrates that TgAMA1 plays a critical role in host cell invasion. Mol. Biol. Cell. 16, 4341-4349 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。