Method Article
استخراج الحمض النووي القائم على المصفوفة لتسلسل الجيل التالي المستهدف على عينات البلغم الملوثة
* These authors contributed equally
In This Article
Summary
نقدم طريقة محسنة لاستخراج الحمض النووي من البلغم الملوث باستخدام طريقة استخراج قائمة على المصفوفة جنبا إلى جنب مع تنقية الخرزة المغناطيسية لتسلسل الجيل التالي المستهدف من المتفطرة السلية.
Abstract
يعرف الآن تسلسل الجيل التالي (NGS) كأداة قوية لتشخيص السل المقاوم للأدوية في الوقت المناسب وبدقة. تقدم NGS المستهدفة (tNGS) نهجا مبسطا من خلال التركيز على جينات محددة مرتبطة بمقاومة الأدوية ، متجاوزة الحاجة إلى الأساليب التقليدية القائمة على الثقافة مع أوقات استجابة تتراوح من أسابيع إلى أشهر. أوصت منظمة الصحة العالمية ب tNGS كاستراتيجية قيمة لتحسين تشخيص السل لتوجيه العلاج وتحسين نتائج العلاج، لا سيما في البيئات المحدودة الموارد. من بين فحوصات tNGS الموصى بها من قبل منظمة الصحة العالمية ، اخترنا طريقة توفر اختبارا سريعا وشاملا لحساسية الدواء ، وتحديد النسب ، وتصنيف السلالة. في حين أن طرق استخراج الحمض النووي الموحدة متوفرة ، إلا أنها قد تستغرق وقتا طويلا وتتطلب عمالة مكثفة. لمواجهة هذا التحدي ، قمنا بتحسين بروتوكول استخراج الحمض النووي المبسط القائم على المصفوفة جنبا إلى جنب مع تنقية الخرزة المغناطيسية. تقدم هذه الطريقة نهجا سريعا وفعالا لاستخراج الحمض النووي مباشرة من رواسب البلغم الملوثة ، مما يتيح التحليل السريع ل tNGS في اتجاه مجرى النهر. ومن خلال تبسيط عملية استخراج الحمض النووي من رواسب البلغم، يمكن لهذا البروتوكول أن يسهل اعتماد tNGS على نطاق أوسع في البيئات السريرية الروتينية، مما يساهم في نهاية المطاف في تحسين نتائج المرضى والاستفادة من جهود مكافحة السل العالمية.
Introduction
وتشير التقديرات إلى أن 3.7 مليون شخص مصابين بالسل لم يتم تشخيصهم أو علاجهم على مستوى العالم في عام 2023، مما يسلط الضوء على التهديد الكبير الذي يشكله السل على الصحةالعالمية1. تقدر منظمة الصحة العالمية أن ما يقرب من 400,000 شخص أصيبوا بالسل المقاوم للريفامبيسين (RR-TB) أو السل المقاوم للأدوية المتعددة (MDR-TB) في عام 20231. يعد تشخيص السل والسل المقاوم للأدوية وعلاجهما بسرعة أمرا ضروريا لتحقيق المعالم والأهداف المتمثلة في الحد من الإصابة بالسل والوفياتالناجمة عنه.
يؤدي الاعتماد على طرق الاستزراع التقليدية واختبار الحساسية للأدوية (pDST) إلى تأخير تحديد ملف مقاومة العزلات السريرية والعلاج ، مع أوقات استجابة تتراوح من 6 إلى 8 أسابيع ، ويتطلب بنية تحتية معقدة للاحتواء الحيوي. ويمكن للاختبارات التشخيصية الروتينية، بالاقتران مع الاختبارات التشخيصية المزمنة للسل المقاوم للأدوية، أن توفر مزايا شاملة لمقاومة الأدوية وتحسن إضفاء الطابع الشخصي على نظم السل المقاوم للأدوية المتعددة، مع تقليص الوقت اللازم للعلاج الفعال من أسابيع أو شهور إلى أيام2 و3 و4.
وفي عامي 2023 و2024، أوصت منظمة الصحة العالمية باستخدام الترفنات المضادة للسل كفئة جديدة من التشخيص لتحديد القابلية للإصابة بالأدوية المضادة للسل من الخطين الأول والثانيبسرعة. وهذا يجعلها أداة قيمة لتوجيه قرارات العلاج دون الحاجة إلى استزراع المتفطرة السلية في مختبرات السلامة البيولوجية من المستوى 3 (BSL-3). نهج tNGS هو شكل مكثف من التسلسل يستخدم تفاعل البوليميراز المتسلسل (PCR) لتضخيم الأهداف الجينية التي تمنح مقاومة الأدوية قبل التسلسل. ومن بين اختبارات tNGS التي أوصت بها منظمة الصحة العالمية، اخترنا مقايسة Deeplex Myc-TB، التي أبلغ عن استيفائها للمعايير القائمة على الفصل للكشف عن مقاومة الريفامبيسين، والإيزونيازيد، والإيثامبوتول، والبيرازيناميد، والفلوروكينولون، والأميكاسين، والستربتومايسين، واللينزوليد، والبيداكويلين، وكلوفازيمين. نستخدم هذا الاختبار لتقييم مدى ملاءمة الحمض النووي المستخرج باستخدام هذا البروتوكول ل tNGS في اتجاه مصب.
بالإضافة إلى ذلك ، نشرت منظمة الصحةالعالمية الطبعة الثانية من كتالوج الطفرات المرتبطة بمقاومة الأدوية في MTB ، مما يوفر خارطة طريق لاستخدام تسلسل الجينوم الكامل (WGS) و tNGS للتنبؤ بقابلية الأدوية وتوجيه العلاج6. أظهرت مراجعة منهجية حديثة وتحليل تلوي أن tNGS كان لديه حساسية وخصوصية بنسبة 94.1٪ و 98.1٪ على التوالي ، للكشف عن مقاومة الأدوية ، بناء على 23 هدفا في مناطق مختلفة تمنح المقاومة في جينوم MTB ، مقارنة ب pDST7.
ومع ذلك ، لا يزال تنفيذ هذه الأساليب صعبا بسبب التعقيد والتكاليف المرتبطة على وجه التحديد بسير العمل والبنية التحتية والمعدات المطلوبة. يتمثل التحدي الحاسم في عزل الحمض النووي للبكتيريا الفطرية عالية الجودة مباشرة من رواسب البلغم النظيف ، وهي خطوة حاسمة لتطبيقات tNGS في اتجاه المصب. لمعالجة هذا الأمر ، نقدم طريقة سريعة وبسيطة لاستخراج الحمض النووي مصممة خصيصا ل tNGS.
تتضمن طريقة استخراج الحمض النووي الموحدة لمقايسة MTB tNGS المحددة دليلا داخليا وبروتوكولاآليا 8. نصف هنا بروتوكول استخراج الحمض النووي المبسط القائم على المصفوفة (الشكل 1). تستخدم الطريقة مصفوفة InstaGene (IGM) ، التي تربط المعادن والبروتينات مما يسمح باستخراج الحمض النووي عالي الجودة مباشرة من رواسب البلغم الملوثة. يوفر هذا البديل وقتا أسرع للاستجابة وإنتاجا كافيا للحمض النووي ل tNGS في اتجاه المصب. يتغلب هذا البروتوكول على تعقيدات الطرق اليدوية والآلية مع ضمان جودة tNGS للتشخيص السريع للمتغيرات التي تمنح مقاومة في MTB. مع الاهتمام المتزايد باستخدام tNGS في مجال علم الفطريات ، يمكن لهذا البروتوكول أن يسهل اعتماده في تدفقات عمل التشخيص الروتينية.

الشكل 1: تمثيل تخطيطي لطرق استخراج الحمض النووي للبكتيريا الفطرية من عينات رواسب البلغم المطهرة باستخدام تعليق مصفوفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
تمت الموافقة على هذا البحث من قبل لجنة أخلاقيات البحث: السلامة البيولوجية والبيئية (REC: BES) في جامعة ستيلينبوش: BES-2024-25384 ولجنة أخلاقيات البحث البشري: N21 / 09/093 و N09 / 11/296.
1. تحضير عينة رواسب البلغم
ملاحظة: يجب تنفيذ الخطوات التالية في مختبر السلامة الحيوية من المستوى الثالث (BSL3) قبل استخراج الحمض النووي.
- قم بإعداد حصة من عينة رواسب البلغم التي تم تطهيرها مسبقا باستخدام N-acetyl-L-cysteine (NALC) وهيدروكسيد الصوديوم (NaLC / NaOH) عن طريق نقل 500 ميكرولتر -2 مل إلى أنبوب منخفض الارتباط سعة 1.5 مل أو 2 مل.
- ضع الأنابيب التي تحتوي على عينات رواسب البلغم في وضع مستقيم في رف أنبوبي وضع العينات في فرن على حرارة 80 درجة مئوية واحتضانها لمدة ساعة واحدة لتعطيل البكتيريا الفطرية من خلال المعالجة الحرارية.
- بعد 1 ساعة ، قم بإزالة رف الأنبوب مع العينات ، وامسح أسطح الأنبوب ، وضعها في حاوية مناسبة لنقلها إلى مختبر السلامة الحيوية من المستوى الثاني (BSL2).
ملاحظة: اترك العينات تبرد إلى درجة حرارة الغرفة قبل التعامل معها أو تخزينها مرة أخرى.
2. استخراج الحمض النووي باستخدام تعليق المصفوفة والخالط عالي السرعة (الشكل 2)
- قبل البدء ، أضف ثلاث حبات زجاجية بقطر 2 مم إلى أنابيب غطاء لولبي سعة 1.5 أو 2 مل ، مغطاة بشكل فضفاض ، وأوتوكلاف (من الناحية المثالية قبل يوم واحد على الأقل من استخراج الحمض النووي).
- قم بإزالة تعليق المصفوفة من الثلاجة وضعه على محرك مغناطيسي (يتم تضمين مغناطيس في زجاجة الكاشف) لإحضار الكاشف إلى درجة حرارة الغرفة والبدء في خلط الكاشف.
- قم بتشغيل كتلة التسخين وقم بالتسخين المسبق إلى 56 درجة مئوية (في حالة توفر كتلتين للتسخين ، قم بتسخين الثانية مسبقا إلى 100 درجة مئوية.
ملاحظة: يمكن تنفيذ الخطوات التالية على مقعد مختبر في منشأة BSL2: - جهاز الطرد المركزي عينة رواسب البلغم المعطلة بالحرارة عند 16,800 × جم (أو السرعة الكاملة) لمدة 15 دقيقة. باستخدام ماصة 20-200 ميكرولتر، قم بشفط المادة الطافية برفق والتخلص منها، مما يضمن بقاء الحبيبات دون إزعاج.
- امزج تعليق المصفوفة عن طريق الرج اللطيف (لا تقم بالدوامة) ، وأضف 200 ميكرولتر من المصفوفة المختلطة جيدا لإعادة تعليق الحبيبات.
- ماصة الحجم الكامل في أنبوب غطاء لولبي سعة 1.5 مل يحتوي على ثلاث حبات زجاجية معقمة مسبقا بقطر 2 مم.
- ضع العينات في كتلة تسخين واحتضانها عند 56 درجة مئوية لمدة 15 دقيقة.
ملاحظة: مباشرة بعد إزالة العينة من كتلة التسخين ، اضبط كتلة التسخين على 100 درجة مئوية بعد الخطوة 2.7 ، إذا كانت كتلة تسخين واحدة فقط متاحة. - تجانس العينات باستخدام دوامة لمدة 10 ثوان لتفريق الخلايا.
- ضع العينات في كتلة تسخين واحتضانها عند 100 درجة مئوية لمدة 10 دقائق.
- تجانس العينات باستخدام الخالط عالي السرعة مع المعلمات التالية: دورة واحدة مدتها 60 ثانية بسرعة 4.0 م / ث.
- جهاز طرد مركزي عند 12,000 × جم لمدة 5 دقائق. نقل 130 ميكرولتر من المادة الطافية المحتوية على الحمض النووي إلى أنبوب جديد منخفض الارتباط سعة 1.5 مل دون إزعاج الحبيبات (مصفوفة مع حطام الخلية). تخلص من الأنبوب الأول الذي يحتوي على المصفوفة وحطام الخلية.
ملاحظة: نقطة توقف آمنة. في حالة التوقف ، قم بتجميد العينات عند -20 درجة مئوية حتى تصبح جاهزة لمواصلة تنقية الحمض النووي. - المضي قدما في تنقية الحمض النووي باستخدام الخرز المغناطيسي.

الشكل 2: طريقة استخراج الحمض النووي القائمة على المصفوفة إلى جانب الخالط عالي السرعة. اختصار: HSH = الخالط عالي السرعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تنقية الحمض النووي باستخدام الخرز المغناطيسي (الشكل 3)
ملاحظة: قبل الشروع في تنقية الحمض النووي ، قم بتنفيذ الخطوتين 3.1 و 3.2.
- أخرج الخرزات المغناطيسية من الثلاجة وضع الحاوية في درجة حرارة الغرفة لمدة 30 دقيقة حتى تتوازن. بدلا من ذلك ، قم بتدوير زجاجة مخزون الخرزة المغناطيسية لإعادة تعليق جميع الخرزات واستنشاق 1،280 ميكرولتر في أنبوب جديد (لتنقية 21 عينة) وضعها في درجة حرارة الغرفة للتوازن.
- قم بإعداد دفعة 9 مل من 80٪ إيثانول عن طريق إضافة 7.2 مل من الكحول الإيثيلي النقي إلى 1.8 مل من الماء المصفى والمعقم.
ملاحظة: يمكن تنفيذ الخطوات التالية على مقعد المختبر في منشأة BSL2. - قم بتدوير زجاجة مخزون الخرزة المغناطيسية أو الكمية المحضرة جيدا لضمان تعليق الخرزات قبل الاستخدام. كرر الدوامة بعد كل 10 عينات لضمان تعليق متجانس.
- أضف حجم 1.2x (156 ميكرولتر) من الخرز المغناطيسي إلى الحمض النووي المستخرج (130 ميكرولتر).
ملاحظة: بالنسبة للعينات التي تحتوي على كميات أكبر من الحمض النووي (المزرعة) ، يمكن معالجة كمية أصغر من العينة (على سبيل المثال ، 50 ميكرولتر) وتنقيتها بحجم 1.2x من الخرز المغناطيسي. - امزج العينات عن طريق سحب العينة 10x. احتضان العينات لمدة 5 دقائق في درجة حرارة الغرفة.
- ضع العينات على الرف المغناطيسي الأنبوبي سعة 1.5 مل لمدة 3 دقائق أو حتى يصبح السائل صافيا. استنشق بعناية وتخلص من المادة الطافية دون إزعاج الخرز.
- مع وجود الأنابيب الموجودة على المغناطيس ، أضف 200 ميكرولتر من 80٪ من الإيثانول ، مما يضمن بقاء الخرزات دون إزعاج والسماح لها بالحضانة لمدة 30 ثانية.
- استنشق الإيثانول بعناية وتخلص منه دون إزعاج الخرز.
- كرر الخطوة 3.7 لغسلتين.
- بعد الغسيل الثاني ، قم بإزالة الإيثانول والتخلص منه. قم بإزالة أي إيثانول متبقي باستخدام ماصة 1-10 ميكرولتر.
- اترك الأنابيب مفتوحة لتجفيف الخرزات في الهواء لمدة 10 دقائق ، أو حتى يصبح للخرز مظهر غير لامع.
ملاحظة: لا تدع الخرزات تجف أكثر من اللازم وتتشقق. - بمجرد أن يكون للحبات مظهر غير لامع ، قم بإزالة الأنابيب على الفور من المغناطيس وأضف 50 ميكرولتر من الماء الخالي من النوكلياز (NFW) مباشرة على الخرزات في كل عينة. بعد إضافة NFW إلى جميع الأنابيب، امزج كل عينة على حدة عن طريق سحب العينة 10x. افحص الأنبوب بحثا عن أي حبات عالقة داخل الأنبوب وكرر خطوة الخلط إذا لزم الأمر. احتضان العينات لمدة 5 دقائق في درجة حرارة الغرفة.
ملاحظة: يمكن زيادة الحضانة من 5 دقائق إلى 10 دقائق ، ولكن لا تقلل من وقت الحضانة إلى أقل من 5 دقائق. - ضع الأنابيب مرة أخرى على الرف المغناطيسي لمدة 3 دقائق أو حتى يصبح السائل صافيا. مع وجود الأنابيب الموجودة على الرف المغناطيسي ، انقل المادة الطافية المحتوية على الحمض النووي إلى أنبوب معقم ومنخفض الارتباط محدد بوضوح. تأكد من عدم نقل الخرزات إلى المادة الطافية.
ملاحظة: إذا كانت الخرزات مرئية في طرف الماصة أثناء النقل، فقم بإعادة الماصة إلى الأنبوب الموجود على الحامل المغناطيسي لفصلها لمدة 3 دقائق إضافية. لا تنقل الخرز إلى الأنبوب الجديد.
نقطة توقف آمنة. في حالة التوقف ، قم بتجميد العينات عند -20 درجة مئوية حتى تصبح جاهزة لمواصلة القياس الكمي باستخدام طريقة مناسبة ل NGS وتضخيم تفاعل البوليميراز المتسلسل اللاحق باستخدام مقايسة MTB tNGS.
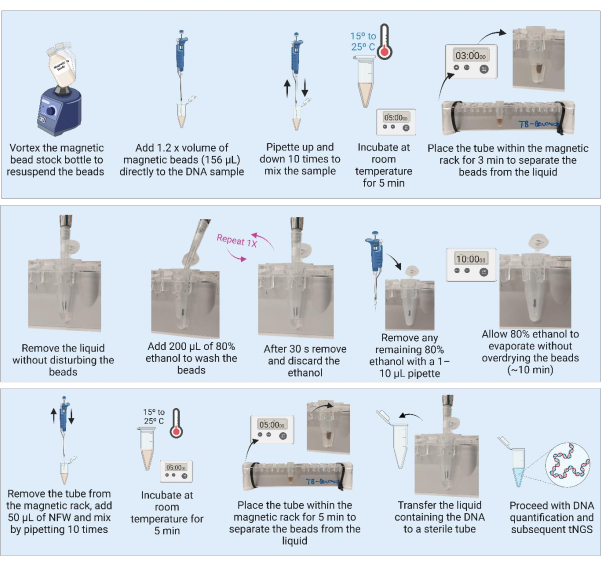
الشكل 3: تنقية الحمض النووي وتركيزه باستخدام الخرز المغناطيسي. الاختصارات: NFW = ماء خال من النوكلياز. tNGS = تسلسل مستهدف من الجيل التالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
وصف العينة
تم جمع ومعالجة ما مجموعه 165 عينة من رواسب البلغم ، إيجابية للعصيات الحمضية السريعة (AFB) في الفحص المجهري مع حمل بكتيري لا يقل عن 1+ ، ومعالجتها بشكل روتيني من قبل خدمات المختبرات الصحية الوطنية (NHLS) جرين بوينت ، كيب تاون ، جنوب إفريقيا. تم استخراج الحمض النووي من عينات رواسب البلغم باستخدام مجلدين مختلفين [حوالي 2 مل (ن = 102) و 500 ميكرولتر (ن = 63)]. أجريت هذه المقارنة لتقييم ما إذا كان حجم عينة الرواسب الأصغر يمكن أن ينتج حمضا واحدا كافيا ل tNGS في اتجاه مجرى النهر.
يوضح الشكل 4 مقارنة مربعة لتركيز الحمض النووي الكلي (نانوغرام / ميكرولتر) عبر درجات مختلفة من مسحة البلغم (1+ ، 2+ ، و 3+) وأحجام رواسب البلغم (2 مل و 500 ميكرولتر). ينخفض محصول الحمض النووي بشكل عام بشكل عام عند استخدام 500 ميكرولتر من الرواسب للاستخراج ، مع تباين عبر درجات اللطاخة. وبالتالي ، فإن متوسط تركيزات الحمض النووي المستخرج من عينات الرواسب التي لا يقل حجمها عن 2 مل كان في المتوسط أعلى من تركيز الحمض النووي المستخرج من رواسب 500 ميكرولتر ، مقسمة طبقيا بواسطة AFB للعينة.

الشكل 4: تأثير حجم رواسب البلغم على إنتاجية الحمض النووي عبر درجات اللطاخة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
يوضح الشكل 5 مخططات صندوقية توضح متوسط عدد قراءات التسلسل (متوسط عمق التغطية) لجميع أهداف عينات رواسب البلغم بدرجات مسحة متفاوتة (1+ و 2+ و 3+) تمت معالجتها من حجمي إدخال مختلفين (2 مل و 500 ميكرولتر). يتم تمثيل القيم المتطرفة بنقاط فردية ، ويتم عرض المحور y على مقياس لوغاريتمي لاستيعاب التباين في التغطية. يشير النطاق الربيعي العالي ل 3+ عينات مستخرجة من رواسب 500 ميكرولتر إلى تباين أكبر مع الأحمال البكتيرية الأعلى.

الشكل 5: مقارنة متوسط عدد قراءات التسلسل (عمق التغطية) لجميع الأهداف عبر درجات التشويه وأحجام إدخال العينات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يصور الشكل 6 تقييم مقبولية نتائج التسلسل باستخدام خط أنابيب المعلوماتية الحيوية لتطبيق الويب المرتبط. يتم تصنيف درجات جودة التسلسل على أنها +++ (مقبولة للغاية) و ++ (مقبولة) و + (مقبولة بشكل هامشي) و - (غير مقبولة) و ND (غير محددة). يشير عدم وجود شريط في الرسم البياني إلى أنه لم يتم الحصول على نتائج لتلك الفئة المحددة. تظهر درجة اللطاخة 1+ نسبة أعلى من النتائج غير المقبولة والنتائج المحايدة مقارنة بدرجات اللطاخة 2+ و 3+ لمجموعة عينة حجم الإدخال 500 ميكرولتر. كان متوسط عمق تغطية التسلسل للعينات المستخرجة من 500 ميكرولتر من رواسب البلغم 4,316 مقارنة ب 4,810 للعينات المستخرجة من رواسب البلغم 2 مل. يشير هذا إلى أن الحمض النووي المستخرج من رواسب البلغم كان كافيا لأداء tNGS في اتجاه مجرى النهر ، بغض النظر عن حجم المدخلات.
بناء على توزيع مقبولية نتيجة التسلسل ، حققت العينات ذات درجة اللطاخة 3+ أعلى معدل نجاح حيث تم تسجيل معظم تسلسلات العينات على أنها ++ و +++ مقارنة بعينات درجة اللطاخة 1+ و 2+. بالنسبة لعينات الإدخال 500 ميكرولتر ، تكون نسبة العينات في الفئتين - و + أعلى نسبيا عبر جميع درجات اللطاخة مقارنة بعينات الإدخال 2 مل. يشير هذا إلى أن المزيد من العينات تندرج في الفئات الأقل جودة والأقل قبولا لمدخلات 500 ميكرولتر. بالنسبة لعينات الإدخال 2 مل ، هناك نسبة أعلى من العينات في فئات الجودة العالية ، ++ و +++ ، خاصة بالنسبة للمسحة من الدرجة 3+. يشير هذا إلى أن العينات التي تحتوي على مدخلات 2 مل من المرجح أن تنتج درجات جودة تسلسل أفضل مقارنة بتلك التي تحتوي على مدخلات 500 ميكرولتر.

الشكل 6: توزيع درجات الجودة حسب درجة التشويه وأحجام إدخال العينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم نشر الجمع بين طريقة الاستخراج القائمة على المصفوفة إلى جانب الخالط عالي السرعة في الأصل بواسطة Shea et al.9. تم تطوير هذه الطريقة وتحسينها ل WGS للحمض النووي المستخرج من مزارع MTBC9،10. لقد قمنا بتحسين هذه الطريقة للاستخدام مع مقايسة MTB tNGS. كان لاستخراج الحمض النووي وتنقية 21 عينة وقت استجابة مشترك يبلغ 4 ساعات و 40 دقيقة ، بما في ذلك خطوات الحضانة والطرد المركزي. يتم توضيح موثوقية البروتوكول الموصوف إلى جانب تنظيف الخرزة لاستخراج الحمض النووي من عينات ذات درجات مسحة تتراوح من 1+ إلى 3+ بناء على متوسط العائد (الشكل 4) ، والعمق الكلي لتغطية جميع الأهداف مجتمعة (الشكل 5) ، ودرجة قبول نتيجة التسلسل كما هو محدد بواسطة تطبيق الويب المرتبط (الشكل 6).
وجدت دراسة حديثة عدم وجود علاقة متسقة بين درجة اللطاخة وتركيز الحمض النووي أو عمق قراءة التسلسل. اقترح المؤلفون أن التباين في معالجة العينات وخطوات التنظيف قد يؤثر على الأداء في العينات عالية الدرجة اللطاخة ، خاصة عندما لا تتم إزالة الملوثات بكفاءة. بالإضافة إلى ذلك ، لا يزال التسلسل من رواسب البلغم يمثل تحديا بسبب تعقيد تجمع الحمض النووي ، حيث يمكن للحمض النووي غير المستهدف أن يتنافس مع MTB DNA11. على الرغم من أننا لم نلاحظ أي علاقة واضحة بين تركيز الحمض النووي المدخل وعمق التسلسل ، فمن المهم ملاحظة أن إدخال الحمض النووي قبل تفاعل البوليميراز المتسلسل المستهدف يجب ألا يتجاوز 100 نانوغرام ، وفقا لتعليمات الشركة المصنعة ، لأن هذا قد يؤدي إلى تثبيط تفاعل البوليميراز المتسلسل (PCR). بالإضافة إلى ذلك ، يمكن أن تحتوي عينات رواسب البلغم ذات الحمل البكتيري العالي ، 2+ و 3+ ، على المزيد من الملوثات ، مثل الحمض النووي البشري ، وحطام الخلايا ، والمثبطات الأخرى ، والتي يمكن أن تتداخل مع تضخيم تفاعل البوليميراز المتسلسل وإعداد المكتبة.
تعمل خطوة التنقية أيضا كخطوة تركيز ، مما يعزز إنتاجية الحمض النووي للبكتيريا الفطرية قبل tNGS. هذه الطريقة فعالة في معالجة العينات ذات الحمل البكتيري المنخفض وقد أظهرت أداء موثوقا به بأحجام صغيرة تصل إلى 500 ميكرولتر ، مما يجعلها مناسبة للإعدادات الروتينية حيث يتوفر حجم عينة محدود. يمكن أن يقلل تطبيقه من الحاجة إلى زيارات المتابعة للعيادات ، وبالتالي تقليل مخاطر فقدان المريض للمتابعة. بالإضافة إلى ذلك ، فإن الطريقة بسيطة ولا تتطلب خبرة معملية متقدمة ، مما يدعم إدماجها في البيئات المحدودة الموارد.
ومع ذلك ، تجدر الإشارة إلى بعض النقاط حول البروتوكول. لا ينبغي تجميد العينات أو تبريدها مباشرة بعد الحضانة عند 80 درجة مئوية. يمكن أن يتسبب التبريد السريع مباشرة بعد المعالجة الحرارية في تكوين تكاثف على الأسطح الداخلية للأنبوب ، مما يؤدي إلى تخفيف العينة ويحتمل أن يؤثر على استخراج الحمض النووي في اتجاه مجرى النهر. بالإضافة إلى ذلك ، قد يزيد التبريد المفاجئ من خطر تدهور العينة عن طريق تعزيز تجزئة الحمض النووي أو النشاط الأنزيمي الذي ربما لم يتم تعطيله تماما أثناء المعالجة الحرارية. هذه الاعتبارات ذات صلة خاصة عند معالجة عينات البلغم للكشف عن MTB. وفقا لتوصيات منظمة الصحة العالمية بشأن تلطيخ Ziehl-Neelsen ، فإن درجة التشويه 1+ تتوافق مع 10-99 AFB لكل 100 حقل غمر بالزيت ، و 2+ تشير إلى 1-10 AFB لكل حقل في 50 حقلا على الأقل ، و 3+ تمثل أكثر من 10 AFB لكل حقل في 20 حقلا على الأقل12.
يتمثل أحد قيود هذه الطريقة في افتقارها إلى الأتمتة بسبب متطلبات التجانس اليدوي باستخدام الخالط عالي السرعة أو جهاز ضرب الخرز. لمعالجة هذا الأمر ، تركز الجهود المستمرة على تحسين البروتوكول من خلال اختبار أوقات حضانة أقصر ، ودرجات حرارة حضانة أقل ، وطرق بديلة للتجانس عالي السرعة.
وبالتالي ، فإن طريقة استخراج الحمض النووي القائمة على المصفوفة ، جنبا إلى جنب مع الخالط عالي السرعة ، هي تقنية سريعة لاستخراج الحمض النووي تستخدم الحرارة وضرب الخرز لإطلاق الحمض النووي الجيني مع إزالة مثبطات تفاعل البوليميراز المتسلسل في نفس الوقت ، مثل المعادن والبروتينات.
Disclosures
يتلقى المؤلف T.R. دعما تمويليا من FIND من خلال عقد خدمة مع جامعة كاليفورنيا في سان دييغو. تلقى المؤلف T. R. تمويلا من المعاهد الوطنية للصحة لتطوير وتقييم حل tNGS للسل المقاوم للأدوية (R01AI176401). المؤلف T. R. هو مؤسس مشارك وعضو مجلس إدارة ومساهم غير مدفوع الأجر في Verus Diagnostics Inc.
Acknowledgements
يود المؤلفون أن يشكروا فريق مختبر السل في NHLS - غرين بوينت ، جنوب إفريقيا على تقديم المساعدة التقنية. تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (NIH) ومؤسسة التشخيص الجديد المبتكر (FIND) ، معرف منحة مشروع TS ELiOT: R01AI153213 ، معرف منحة Unitaid: 2019-32-FIND MDR. تم إنشاء الأرقام باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Alternative: Benchmark BeadBlaster 24 | Benchmark Scientific | D2400 | |
| AMPure XP Bead-Based Reagent | Beckman Coulter | A63881 | |
| Autoclaved or sterile glass beads (2 mm) | Sigma-Aldrich | Z273627-1EA | |
| Ethyl alcohol, Pure | Sigma-Aldrich | E7023-500ML | |
| Filter pipette tips (10 µL) | Bio-Smart Scientific | FT-10-R | |
| Filter pipette tips (1000 µL) | Bio-Smart Scientific | FT1000-R | |
| Filter pipette tips (20 µl) | Bio-Smart Scientific | FT20-R | |
| Filter pipette tips (200 µL) | Bio-Smart Scientific | FT200-R | |
| Heating-block ranging from 37 °C to 100 °C | Eppendorf | 5382000031 | |
| High-speed homogenizer (HSM) as FastPrep-24 | MP Biomedicals | 116005500 | |
| Incubator 80 °C | Lasec Group | IBLPDHG-9030A | |
| InstaGene Matrix | Bio-Rad Laboratories Inc. | BBRD7326030 | |
| Low-binding microtubes (1.5 mL or 2 mL) | Eppendorf | EP0030108051-250EA | |
| Magnetic rack for 1.5 – 2 mL tubes | Thermo Fisher Scientific Inc. | 12321D | |
| Magnetic stirrer | Merck | Z671886 | |
| Microcentrifuge | Eppendorf | 5406000046 | |
| Milli-Q IX 7015 Pure Water Purification System | Merck | ZIX7015T0C | |
| Nuclease-free water (NFW), molecular grade | Thermo Fisher Scientific Inc. | AM9937 | |
| Pipettes (P10, P20, P200, and P1000) | Eppendorf | EP3123000918-1EA | |
| Qubit Assay Tubes | Thermo Fisher Scientific Inc. | Q32856 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific Inc. | Q33231 | |
| Qubit fluorometer instrument | Thermo Fisher Scientific Inc. | Q33226 | |
| Screw cap tubes (1.5 mL) | Scientific Specialties Inc. | P2TUB056C-0001.5ST | |
| Vortex | Lasec Group | WMBB0L0E0216 |
References
- Global Tuberculosis Report 2024. Geneva: WHO. , World Health Organization. https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2024 (2024).
- De Araujo, L., et al. Implementation of targeted next-generation sequencing for the diagnosis of drug-resistant tuberculosis in low-resource settings: a programmatic model, challenges, and initial outcomes. Front Public Health. 11, 1204064(2023).
- Murphy, S. G., et al. Direct detection of drug-resistant Mycobacterium tuberculosis using targeted next generation sequencing. Front Public Health. 11, 1206056(2023).
- Kambli, P., et al. Targeted next generation sequencing directly from sputum for comprehensive genetic information on drug resistant Mycobacterium tuberculosis. Tuberculosis. 127, 102051(2021).
- WHO Consolidated Guidelines on Tuberculosis.Module 3: Diagnosis. Rapid diagnostics for tuberculosis detection. Third edition. , World Health Organization. https://iris.who.int/bitstream/handle/10665/376221/9789240089488-eng.pdf?sequence=1 (2024).
- Catalogue of mutations in Mycobacterium tuberculosis. complex and their association with drug resistance. Second edition. , World Health Organization. https://iris.who.int/bitstream/handle/10665/374061/9789240082410-eng.pdf?sequence=1 (2023).
- Schwab, T. C., et al. Targeted next-generation sequencing to diagnose drug-resistant tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis. 24 (10), 1162-1176 (2024).
- Deeplex Myc-TB manual version 5. , GenoScreen. https://acrobat.adobe.com/link/track?uri=urn%3Aaaid%3Ascds%3AUS%3A67c2b53f-c91d-3a73-a6ea-4769e7c8fe57 (2023).
- Shea, J., et al. Comprehensive whole-genome sequencing and reporting of drug resistance profiles on clinical cases of Mycobacterium tuberculosis in New York State. J Clin Microbiol. 55 (6), 1871-1882 (2017).
- Conceição, E. C., et al. Mycobacterium tuberculosis. DNA extraction using InstaGene Matrix and high-speed homogenizer from clinical primary culture. , https://www.protocols.io/view/mycobacterium-tuberculosis-dna-extraction-using-in-dhvs366e (2024).
- Nilgiriwala, K., et al. Genomic sequencing from sputum for tuberculosis disease diagnosis, lineage determination, and drug susceptibility prediction. J Clin Microbiol. 61 (3), e0157822(2023).
- Laboratory Services in Tuberculosis Control Part II: Microscopy. Geneva: WHO. , World Health Organization. https://iris.who.int/bitstream/handle/10665/65942/WHO_TB_98.258_(part2).pdf?sequence=2 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved