Method Article
نموذج الفئران لتضخم البطين الأيمن الناجم عن الضغط الزائد والفشل عن طريق ربط الجذع الرئوي
In This Article
Summary
نصف نموذج الفئران للضغط البطيني الأيمن الناجم عن زيادة الضغط الرئوي. يتم تضمين بروتوكولات مفصلة للتنبيب والجراحة والتنميط الظاهري عن طريق تخطيط صدى القلب في الورقة. تستخدم الأدوات المصنوعة حسب الطلب للتنبيب والجراحة ، مما يسمح باستنساخ سريع وغير مكلف للنموذج.
Abstract
يرتبط فشل البطين الأيمن (RV) الناجم عن الحمل الزائد للضغط ارتباطا وثيقا بالمراضة والوفيات في عدد من أمراض القلب والأوعية الدموية والرئة. التسبب في فشل عربة سكن متنقلة معقد ولا يزال غير مفهوم بشكل كاف. لتحديد استراتيجيات علاجية جديدة لعلاج فشل RV ، تعد النماذج الحيوانية القوية والقابلة للتكرار ضرورية. اكتسبت نماذج ربط الجذع الرئوي (PTB) شعبية ، حيث يمكن تقييم وظيفة RV بشكل مستقل عن التغيرات في الأوعية الدموية الرئوية.
في هذه الورقة ، نقدم نموذجا للفأر من الحمل الزائد لضغط RV الناجم عن PTB في الفئران البالغة من العمر 5 أسابيع. يمكن استخدام النموذج للحث على درجات مختلفة من أمراض RV ، بدءا من تضخم RV الخفيف إلى فشل RV اللا تعويضي. يتم تضمين بروتوكولات مفصلة للتنبيب وجراحة PTB والتنميط الظاهري عن طريق تخطيط صدى القلب في الورقة. علاوة على ذلك ، يتم إعطاء تعليمات لتخصيص الأدوات للتنبيب وجراحة PTB ، مما يتيح استنساخ سريع وغير مكلف لنموذج PTB.
تم استخدام مشابك ربط التيتانيوم لتضييق الجذع الرئوي ، مما يضمن درجة عالية من انقباض الجذع الرئوي قابلة للتكرار ومستقلة عن المشغل. تم تصنيف شدة PTB باستخدام أقطار مشبك ربط داخلية مختلفة (خفيفة: 450 ميكرومتر وشديدة: 250 ميكرومتر). أدى ذلك إلى أمراض RV تتراوح من تضخم مع وظيفة RV المحفوظة إلى فشل RV اللا تعويضي مع انخفاض النتاج القلبي والمظاهر خارج القلب. تم تقييم وظيفة RV عن طريق تخطيط صدى القلب في 1 أسبوع و 3 أسابيع بعد الجراحة. يتم عرض أمثلة على صور تخطيط صدى القلب والنتائج هنا. علاوة على ذلك ، يتم عرض نتائج قسطرة القلب اليمنى والتحليلات النسيجية لأنسجة القلب.
Introduction
فشل البطين الأيمن (RV) هو متلازمة سريرية مع أعراض قصور القلب وعلامات الاحتقان الجهازي الناتج عن خلل RV1. يرتبط خلل RV بقوة بالمراضة والوفيات في عدد من أمراض القلب والأوعية الدمويةوالرئة 2. مسببات خلل RV معقدة ، ولا تزال مسارات الإشارات الأساسية وتنظيمها غير موضحة بشكل كاف.
تظهر الملاحظات من العلاجات الحالية أن وظيفة RV المحسنة ترتبط ارتباطا وثيقا بتقليل الحمل اللاحق ، مما يشير إلى أن الأوعية الدموية الرئوية هي هدف العلاجالأساسي 3. يشير هذا إلى أن العلاجات الحالية لها تأثير مباشر ضئيل فقط على وظيفة RV ، والتي يمكن أن تتدهور حتى بعد تحسين مقاومة الأوعية الدموية الرئوية3. وبالتالي ، هناك حاجة ماسة إلى مزيد من البحث في تحسين وظيفة RV بشكل مستقل عن تقليل الحمل اللاحق.
النماذج الحيوانية القوية والقابلة للتكرار ضرورية في البحث عن عوامل علاجية جديدة. في معظم نماذج فشل RV المزمن ، يكون السبب الكامن وراء ارتفاع ضغط الدم الرئوي الناجم عن التغيير الهيكلي للأوعية الدمويةالرئوية 4،5،6. تشمل النماذج المميزة جيدا نموذج نقص الأكسجة المزمن 7,8 ، ونموذج Sugen-hypoxia 9,10,11 ، ونموذج monocrotaline12,13. نظرا لأن فشل عربة سكن متنقلة ثانوي لارتفاع ضغط الدم الرئوي في هذه النماذج ، فمن المستحيل التمييز بين آثار التدخلات على الأوعية الدموية الرئوية والتأثيرات المباشرة على RV6.
لدراسة عربة سكن متنقلة بشكل مستقل عن الأوعية الدموية الرئوية ، اكتسب نموذج ربط الجذع الرئوي (PTB) شعبية وتم وصفه في العديد من الأنواع الحيوانية ، بما في ذلك الفئران والجرذان والأرانب والأغنام والخنازير6،14،15،16،17،18،19،20،21،22،23 ، 24,25,26,27. في نماذج PTB ، يتم تحقيق انقباض الجذع الرئوي جراحيا ، مما يؤدي إلى زيادة ضغط RV6. توجد طرق مختلفة لتطبيق PTB ، بما في ذلك انقباض الوعاء برباط أو بمشبك ربط معدني18,28. في النماذج التي تستخدم الأحرف المركبة ، يتم ربط الجذع الرئوي بإبرة ، ويتم سحب الإبرة ، تاركا الرباط في مكانه. ينتج عن هذا انقباض الوعاء الذي يعتمد على حجم الإبرة وتوتر العقدة18,29. في النماذج التي تستخدم مشابك ربط معدنية ، قد تكون درجة انقباض الجذع الرئوي أكثر قابلية للتكرار. يتم استخدام أدوات تطبيق مشبك الربط المعدلة لإغلاق مقاطع الربط بقطر محدد مسبقا وثابت. هذا يجعل الطريقة مستقلة عن المشغل ويقلل من التباين المرتبط ب PTB في النمط الظاهري للمرض15،27،28.
لقد ثبت أن نماذج Murine PTB تحفز تضخم RV والفشل18,28. يتمثل أحد التحديات الرئيسية عند استخدام نموذج PTB في اختيار قطر PTB المناسب لتحقيق الدرجة المطلوبة من أمراض RV. هذا يمثل تحديا خاصا عند محاولة نمذجة فشل عربة سكن متنقلة لا تعويضية. لهذا ، يجب أن يكون الانقباض ضيقا بدرجة كافية للحث على فشل RV المزمن دون أن يؤدي إلى فشل RV الحاد والموت بعد فترة وجيزةمن الجراحة 6. تتمثل إحدى طرق حل هذا التحدي في استخدام الفطام أو اليافعة 6,15. تم استخدام نموذج PTB بنجاح لدراسة مراحل مختلفة من فشل عربة سكن متنقلة باستخدام فطام الفئران Wistar15,30. لتحقيق ذلك ، خضعت الفئران اليافعة ذات إمكانات النمو المتبقية لجراحة PTB مع تطبيق مقاطع ربط التيتانيوم. عندما نمت الفئران ، أصبح التضيق الرئوي تدريجيا أكثر حدة وأدى إلى تضخم RV أو فشل RV المزمن ، اعتمادا على شدة PTB15,30. مستوحاة من هذا النموذج ، افترضنا أنه يمكن إنتاج مراحل مختلفة من أمراض RV في نموذج PTB الفئران باستخدام الفئران اليافعة. قد تساعد دراسة مجموعة واسعة من أمراض RV من مرض خفيف إلى شديد في توضيح فهمنا لتطور المرض والانتقال من تضخم RV إلى فشل RV.
هنا ، نقدم نموذجا للفأر للحمل الزائد لضغط RV الناجم عن PTB في الفئران اليافعة. باستخدام هذا النموذج ، يمكن إنتاج درجات مختلفة من أمراض RV ، بدءا من تضخم RV إلى فشل RV اللا تعويضي. تتضمن هذه الدراسة بروتوكولات مفصلة للتنبيب وجراحة PTB والتنميط الظاهري عن طريق تخطيط صدى القلب.
Protocol
تمت الموافقة على الدراسة من قبل مفتشية التجارب الحيوانية الدنماركية (رقم الترخيص: 2021-15-0201-00928) وتم إجراؤها وفقا للتشريعات الوطنية لحيوانات المختبر. استخدمت هذه الدراسة ذكور الفئران C57BL / 6N البالغة من العمر 5 أسابيع.
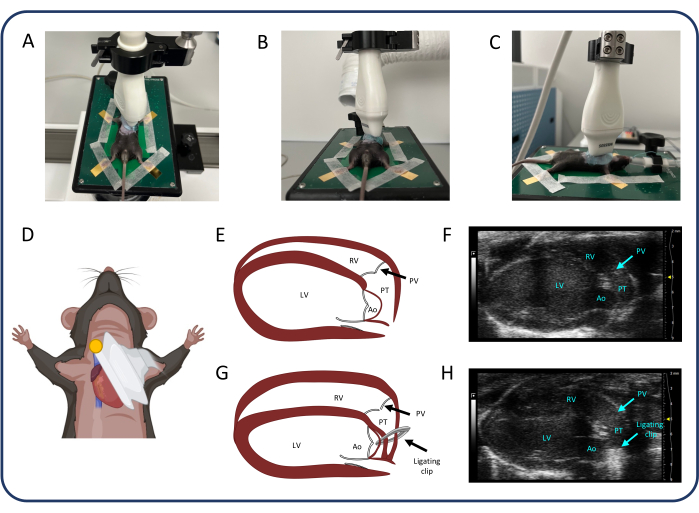
1. تخصيص أدوات التنبيب والجراحة (الشكل 1)
ملاحظة: يفصل هذا القسم أهم الخطوات في إعداد الأدوات المخصصة للتنبيب وجراحة PTB من مواد غير مكلفة ومتاحة بسهولة.
- تحضير الأنبوب الرغامي (الشكل 1 أ).
يمكن استخدام القسطرة الوريدية الشائعة (IV) للتنبيب وتهوية الفئران.- اختر الحجم المناسب للقسطرة داخل الأوعية المقابلة لحجم الفئران. يوصى باستخدام قسطرة 22G للفئران البالغة من العمر 5 أسابيع (17-20 جم) وقسطرة 23G للفئران الأكبر حجما (>20 جم).
- اسحب الإبرة وافصل آلية القفل. أدخل الإبرة مرة أخرى في القسطرة واقطع طرف الإبرة بزاوية 45 درجة ، حوالي 2 مم من طرف القسطرة.
- استخدم ورق الصنفرة لإضعاف الطرف لمنع إصابة الحبال الصوتية للفئران.
- اقطع جناحا واحدا من القسطرة للحصول على رؤية أفضل أثناء التنبيب.
- تحضير المبعثر الصدري (الشكل 1 ب).
- استخدم حامل إبرة لثني قطعة من الأسلاك المعدنية المرنة بطول 10 سم تقريبا في المنتصف بزاوية 30 درجة.
- استخدم حامل الإبرة لإنشاء خطافات غير مؤلمة بعرض 5 مم بعناية على طرفي السلك.
- تحضير حامل التنبيب (الشكل 1C).
ملاحظة: يتيح استخدام حامل التنبيب التوصيل المستمر للتخدير عبر أنبوب الأنف أثناء التنبيب. يسمح ذلك بالتنبيب الخاضع للرقابة والآمن تحت التوجيه البصري ، مما يقلل من خطر إصابة الحبال الصوتية والقصبة الهوائية بالإضافة إلى خطر وضع الأنبوب في غير مكانه في المريء. يمكن استخدام أي إطار معدني أو بلاستيكي كإطار لحامل التنبيب. تم استخدام حامل دور مطبخ منحني قليلا في هذه الدراسة.- قطع قطعة 3 سم من الأنابيب المطاطية التي تناسب خطم الماوس وتوصيلها بصمام قسطرة وريدي. يمكن توصيل التخدير المستنشق عبر الصمام قبل التنبيب.
- اصنع حلقة باستخدام خياطة مضفرة 1-0 على بعد حوالي 5 مم من فتحة الأنبوب. سيتم استخدام هذا لتأمين خطم الفئران في الأنبوب.
- اقطع حفرة بالقرب من الجزء العلوي من ورقة بلاستيكية مرنة وضع الأنبوب في الحفرة. يتم استخدام الورقة لدعم الماوس في حامل التنبيب.
- استخدم الشريط لتثبيت الأجزاء الفردية معا كما هو موضح في الشكل 1C.
- تحضير قنية التوجيه (الشكل 1D ، E).
- اسحب خياطة أحادية الشعيرات 6-0 من خلال قنية حادة 27G واربط عقدة على الخرزة. استخدم هذه العقدة لاحقا لفهم الخيط أثناء جراحة PTB.
- استخدم حامل إبرة لثني طرف القنية بزاوية 80 درجة.
- قم بإعداد تطبيق مشبك الربط.
ملاحظة: يتم تعديل مشبك الربط مع الفكين بزاوية مع آلية توقف قابلة للتعديل (الشكل 1F) ، والتي توقف ضغط مشبك الربط عندما يكون الفكين على مسافة محددة مسبقا من بعضها البعض. يتم استخدام مشبك الربط المعدل لتطبيق مشابك ربط التيتانيوم على الجذع الرئوي.- ثبت قطعة نحاسية مقطوعة حسب الطلب على مقابض مشبك الربط بمسمارين. قم بتركيب برغي قابل للتعديل في المنتصف (الشكل 1F ، سهم أبيض) يحدد المسافة الدقيقة بين المقابض المضغوطة لمشبك الربط ، والتي تتوافق مع مسافة دقيقة بين الفكين.

الشكل 1: أدوات التنبيب وجراحة PTB. أ: أنبوب داخل القصبة الهوائية مصنوع من قسطرة وريدية. ب: المبعدة الصدري. ج: حامل التنبيب والفأر الموضوعان في حامل التنبيب لتلقيهما التخدير على أنبوب أنفي. (د) الأدوات الجراحية ومشبك الربط المعدل المستخدم في جراحة PTB. ه: قنية التوجيه. (و) آلية إيقاف قابلة للتعديل حسب الطلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تعديل تطبيق مشبك الربط
- اختر القطر الداخلي لمشبك الربط بناء على الشدة المطلوبة لفشل عربة سكن متنقلة. بالنسبة للفئران C57BL / 6N البالغة من العمر 5 أسابيع (17-20 جم) ، استخدم قطر مشبك يبلغ 250 ميكرومتر للضغط الشديد و 450 ميكرومتر للحمل الزائد لضغط RV الخفيف. استخدم أقطار مشبك وسيطة للحث على الضغط الزائد المعتدل.
- استخدم الأسلاك المعدنية أو الإبر لضبط مشبك الربط Applier. تأكد من أن قطر السلك يتوافق مع قطر المشبك المطلوب.
- قم بتحميل تطبيق المشبك بمشبك ربط وضع سلك الضبط في وسط مشبك الربط. أثناء ضغط مشبك التطبيق ، أدر المسمار حتى يتم وضع فكي المشبك بإحكام حول السلك. تأكد من بقاء المشبك في مكانه على سلك الضبط بمجرد تحرير أداة تطبيق المشبك.
- مع ضبط مشبك التطبيق ، ضع مشبك ربط آخر على سلك الضبط للتحقق من صحة القطر المحدد.
3. الاستعدادات للجراحة
- تحفيز التخدير في غرفة الحث باستخدام 7٪ سيفوفلوران في 0.6 لتر / دقيقة 100٪ أكسجين. تأكد من التخدير الكافي عن طريق قرصة إصبع القدم قبل التنبيب.
ملاحظة: يمكن أيضا استخدام إيزوفلوران. كن على علم بأنه يجب استخدام تركيزات مختلفة. - تنبيب الماوس باستخدام قسطرة 22G IV. إجراء التنبيب تحت التوجيه البصري ، باستخدام المجهر الجراحي وحامل التنبيب ، مما يسمح بالمحاذاة المناسبة لتصور الحبال الصوتية والتسليم المستمر للتخدير المستنشق على أنبوب الأنف (الشكل 1C).
- تهوية الماوس عند 175 ضربة / دقيقة وحجم المد والجزر 300 ميكرولتر / السكتة الدماغية.
ملاحظة: يوصى أيضا بأحجام المد والجزر من 8-10 ميكرولتر / جم ، ويعتمد حجم المد والجزر المثالي على التسرب المحتمل والمساحة الميتة في نظام التهوية. - ضع الماوس الأنبوبي على وسادة تدفئة مغطاة (37 درجة مئوية) وضع مرهم مرطب على عيون الفأر.
- يجب الحفاظ على التخدير (سيفوفلوران 3.5٪ في 0.6 لتر/دقيقة أكسجين 100٪) وتطبيق 0.1 ملغ/كغ من البوبرينورفين و5 ملغ/كغ من كاربروفين تحت الجلد في حالة التسكين في الفترة المحيطة بالجراحة. إزالة كل الشعر من الصدر باستخدام كريم مزيل الشعر وتطهير الجلد مع مناديل مطهرة.
4. جراحة PTB
- قم بعمل شق 10 مم في الجلد فوق الفضاء الوربي الثاني من الزاوية القصية إلى الخط الإبطي الأمامي الأيسر. تقسيم العضلات الصدرية الرئيسية والثانوية عن طريق تشريح حادة.
- قطع العضلات الوربية في الفضاء الوربي الثاني وتشريح الغدة الصعترية بصراحة لفضح القلب والجذع الرئوي والشريان الأورطي. ضع ضامنا صدريا في الفضاء الوربي للحفاظ على إمكانية الوصول إلى مجال التشغيل.
ملاحظة: يجب توخي الحذر الشديد عند قطع العضلات الوربية ، حيث يمتد الشريان الثديي الداخلي الأيسر على بعد 1-2 مم فقط من القص. قد تؤدي إصابة هذا الشريان إلى فقدان الدم بشكل كبير. - افصل الجذع الرئوي عن الشريان الأورطي الصاعد عن طريق إزالة النسيج الضام بصراحة بين الأوعية باستخدام ملقط مجهري. تحسين تعرض الجذع الرئوي بشكل أكبر عن طريق تدوير الجزء السفلي من جسم الماوس (الساق اليسرى على الساق اليمنى).
- مرر قنية التوجيه عبر الجيب التأموري المستعرض الخلفي للجذع الرئوي. استخدم الملقط للإمساك بالعقدة الموجودة على طرف قنية التوجيه وسحب الخيط من خلال قنية التوجيه. قم بإزالة قنية التوجيه بعناية بينما يبقى الخيط في مكانه حول الجذع الرئوي.
- قم بتحميل مشبك الربط واستخدم الخيط لتوجيه الجذع الرئوي إلى فكي مشبك الربط وضغط المشبك. حرر الخيط مباشرة بعد وضع المقطع ولاحظ ملء الجذع الرئوي.
ملاحظة: يمكن ملاحظة بطء القلب في الثواني القليلة الأولى بعد تطبيق مشبك الربط. - ضع خياطة قابلة للامتصاص 6-0 حيدة حول السترة الثانية والثالثة وأغلق المساحة الوربية. قم بإخلاء أكبر قدر ممكن من الهواء من التجويف الصدري عن طريق الضغط اللطيف على الصدر أثناء شد الخرزة.
- أخيرا ، قم بخياطة الجلد بخياطة قابلة للامتصاص 6-0 خيوط أحادية.
- نفذ نفس الإجراء ، باستثناء وضع مشبك الربط (الخطوة 4.5) ، أثناء الجراحة الوهمية.
5. تخطيط صدى القلب
- بعد تحريض التخدير في غرفة الحث (1-2 دقيقة ، 6٪ سيفوفلوران في أكسجين 100٪) ، حافظ على التخدير باستخدام أنبوب الأنف (3.5٪ سيفوفلوران في أكسجين 100٪). قم بإزالة كل الشعر من الصدر والبطن باستخدام كريم مزيل الشعر وضع الماوس على وسادة التدفئة. ضع مرهما مرطبا على العينين وجل الموجات فوق الصوتية على صدر الماوس.
ملاحظة: اضبط كسب 2D وعمق التركيز وعمق الصورة لتحسين جودة الصورة في جميع قياسات تخطيط صدى القلب. - اضبط المسبار بالموجات فوق الصوتية للعثور على عرض المحور الطويل شبه القصي (PLAX) (الشكل 2). في PLAX ، قم بقياس القطر الداخلي للجذع الرئوي وتكامل وقت السرعة (VTI) في الجذع الرئوي.
- حدد الوضع B وحرك وسادة التسخين بعناية في المحور x و y و z لتحديد الجذع الرئوي في وسط الصورة. استخدم اللون لتحديد أكبر قطر للجذع الرئوي. استخدم مخزن سينمائي لالتقاط تسلسل لقياس قطر الجذع الرئوي.
- حدد دوبلر اللون وموجة النبض (PW) وضع المؤشر في وسط الجذع الرئوي. اضبط زاوية PW حتى تصبح الخطوط المنقطة موازية لتدفق الدم في الوعاء.
- اضغط على متجر سينمائي لقياس VTI. ضع المؤشر بالقرب من كلا جداري الجذع الرئوي واضغط على مخزن السينما مرة أخرى للحصول على تدفق بالقرب من جدار الوعاء الدموي.
ملاحظة: يمكن أيضا تقييم القطر الداخلي للبطين الأيمن (RV) وسمك الجدار الخالي من RV في عرض PLAX.
- ابحث عن عرض المحور القصير شبه القصي (PSAX) (الشكل 3) لقياس الأقطار الداخلية للبطين الأيسر (LV) ، والتي يمكن استخدامها لتقييم انتفاخ الحاجز (التكوين D).
- حدد الوضع B وقم بتدوير المسبار 90 درجة عكس اتجاه عقارب الساعة. قم بزاوية المسبار 20-30 درجة بشكل جانبي لتجنب تظليل عربة سكن متنقلة بواسطة القص ، وقم بإمالة المسبار 20-30 درجة في الجمجمة حتى يصبح البطين الأيسر مستديرا قدر الإمكان. بعد ذلك ، حرك المسبار في الاتجاه القحفي الذيلي لتحديد مستوى العضلات الحليمية ذات الأقطار البطينية الأكبر واضغط على مخزن السينما.
ملاحظة: يمكن أيضا استخدام PSAX على المستوى الحليمي المتوسط لتقييم تغير المنطقة الكسرية RV. يمكن استخدام PSAX على مستوى الصمام الأبهري لقياس تقصير RV الجزئي أو سمك الجدار الخالي من RV.
- حدد الوضع B وقم بتدوير المسبار 90 درجة عكس اتجاه عقارب الساعة. قم بزاوية المسبار 20-30 درجة بشكل جانبي لتجنب تظليل عربة سكن متنقلة بواسطة القص ، وقم بإمالة المسبار 20-30 درجة في الجمجمة حتى يصبح البطين الأيسر مستديرا قدر الإمكان. بعد ذلك ، حرك المسبار في الاتجاه القحفي الذيلي لتحديد مستوى العضلات الحليمية ذات الأقطار البطينية الأكبر واضغط على مخزن السينما.
- استخدم طريقة العرض القمية المكونة من 4 غرف (A4CH) (الشكل 4) لقياس الرحلة الانقباضية الحلقية ثلاثية الشرف (TAPSE) وتقييم القلس ثلاثي الشرف.
- ضع المسبار كما هو موضح في الشكل 4. بمجرد تحديد القلب ، قم بإجراء تعديلات صغيرة على المسبار باستخدام الرسغ والأصابع فقط لتحديد جميع غرف القلب الأربع والصمام ثلاثي الشرف.
- يعد تحديد طريقة عرض A4CH جيدة والحفاظ عليها أمرا صعبا. اترك يد تشغيل المسبار تستقر على وسادة التدفئة لتحقيق الثبات. حرك المسبار وقم بإمالته وتدويره قليلا حتى يتم العثور على الصورة المناسبة.
- حرك المسبار في بعد واحد فقط في كل مرة: على سبيل المثال ، حرك القحف الذيلي للعثور على القلب ، ثم قم بإمالة المسبار لتحديد جميع الغرف الأربع وأخيرا أدر المسبار حتى تصبح جميع الغرف الأربع والصمام ثلاثي الشرف في الإطار. إذا لزم الأمر ، كرر الخطوات الثلاث عدة مرات قبل الحصول على الصورة المثالية.
- بمجرد تحديد الصمام ثلاثي الشرف ، حدد الوضع M وضع الخط المنقط في الحلقة ثلاثية الشرف للجدار الحر. اضغط على متجر سينمائي لحفظ القياسات.
- حدد اللون لتقييم الصمام ثلاثي الشرف للقلس. في حالة وجود قلس ، ستظهر نفاثة من التدفق الرجعي من عربة سكن متنقلة إلى الأذين الأيمن (RA) في الانقباض (الشكل 5).
ملاحظة: في عرض A4CH ، يمكن أيضا قياس دوبلر الأنسجة في الجدار الخالي من RV وسرعة تدفق RV.
- ضع المسبار كما هو موضح في الشكل 4. بمجرد تحديد القلب ، قم بإجراء تعديلات صغيرة على المسبار باستخدام الرسغ والأصابع فقط لتحديد جميع غرف القلب الأربع والصمام ثلاثي الشرف.
الشكل 2: عرض المحور الطويل شبه القصي (PLAX). (A-D) تحديد موضع المسبار بالموجات فوق الصوتية. (ه، و) قلب الفئران الطبيعي في PLAX. (ز ، ح) توسيع RV وتضخم بعد PTB. الاختصارات: LV: البطين الأيسر ، RV: البطين الأيمن ، PV: الصمام الرئوي ، PT: الجذع الرئوي ، Ao: الشريان الأورطي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: عرض المحور القصير شبه القصي (PSAX). (A-D) تحديد موضع المسبار بالموجات فوق الصوتية. (ه، واو) قلب الفئران الطبيعي في PSAX. (ز ، ح) PSAX بعد PTB. الاختصارات: LV: البطين الأيسر ، RV: البطين الأيمن ، PM: العضلات الحليمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
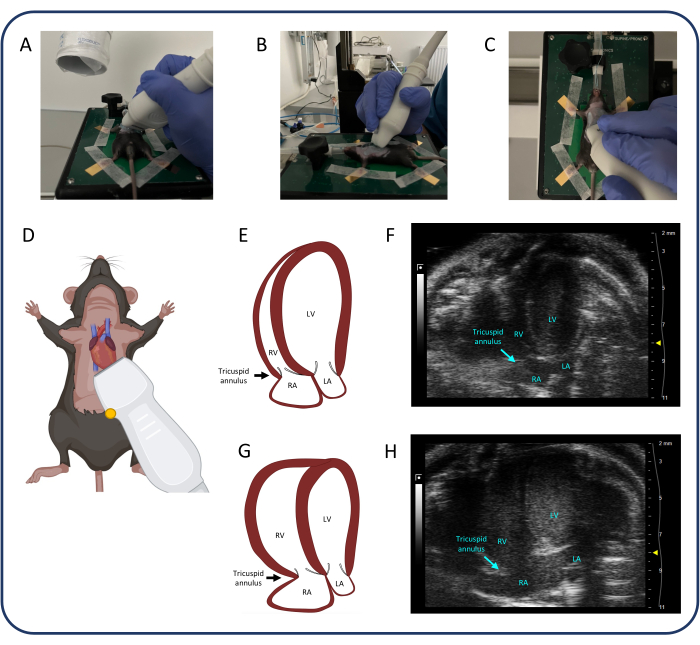
الشكل 4: منظر قمي مكون من 4 غرف (A4CH). (A-D) تحديد موضع المسبار بالموجات فوق الصوتية. (ه، و) قلب الفئران الطبيعي في عرض A4CH. (ز ، ح) RV و RA التوسع بعد PTB. الاختصارات: LV: البطين الأيسر ، RV: البطين الأيمن ، RA: الأذين الأيمن ، LA: الأذين الأيسر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: قلس ثلاثي الشرف مرئي بواسطة دوبلر ملون في عرض A4CH. (أ) في الانبساط ، لوحظ التدفق من RA إلى RV (السهم). (ب) أثناء الانقباض ، تكون نفاثة رقيقة من التدفق من RV إلى RA مرئية (سهم). الاختصارات: LV: البطين الأيسر ، RV: البطين الأيمن ، RA: الأذين الأيمن ، LA: الأذين الأيسر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تحليل البيانات
- قم بقياس قطر الجذع الرئوي في ثلاث دورات قلبية في PLAX واستخدم متوسط قطر الجذع الرئوي لمزيد من تحليلات البيانات. قياس VTI في ثلاث دورات قلبية في PLAX لكل من الحلقات السينمائية الثلاثة المخزنة (في وسط الجذع الرئوي وبالقرب من جدران الوعاء). استخدم متوسط VTI لجميع قياسات VTI لمزيد من التحليل. استخدم الصيغة التالية لحساب ثاني أكسيد الكربون:
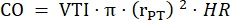
 نصف قطر الجذع الرئوي ، HR: معدل ضربات القلب:
نصف قطر الجذع الرئوي ، HR: معدل ضربات القلب: - قياس LVEI في PSAX على مستوى منتصف حليمي. استخدم أداة قياس لقياس أكبر قطر داخلي منخفض الجهد (LVid1) من منتصف الحاجز إلى الجدار الحر. بعد ذلك ، قم بقياس القطر الداخلي LV المتعامد مع القياس الأول (LVid2). كرر هذه القياسات في ثلاث دورات قلبية واحسب LVEI باستخدام متوسط الأقطار الداخلية LV والصيغة التالية:
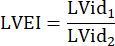
- قم بقياس TAPSE في ثلاث دورات قلبية في عرض A4CH واستخدم TAPSE المتوسط لمزيد من تحليلات البيانات.
7. قسطرة القلب الأيمن
- قم بقياس ضغط البطين الأيمن (RV) وحجمه عن طريق قسطرة القلب اليمنى باستخدام قسطرة 1.4F ذات طرف دقيق بعد 3 أسابيع من جراحة PTB.
- تخدير الماوس وتنبيبه كما هو موضح في الخطوات 3.1-3.4. ضع الماوس على وسادة تدفئة مغطاة (37 درجة مئوية) وحافظ على التخدير (3.5٪ سيفوفلوران في 0.6 لتر / دقيقة 100٪ أكسجين).
- تطبيق 2000 وحدة دولية من الهيبارين (العضلي [i.m.]) و0.5 مل من كلوريد الصوديوم (تحت الجلد [s.c.]).
- باستخدام المقص الجراحي ، قم بقطع جدار البطن بشكل ذيلي لعملية الخنجري والوصول إلى التجويف الصدري عن طريق قطع الحجاب الحاجز بعناية على طول شقه في جدار الصدر. قطع الحجاب الحاجز و costae حتى يتم الحصول على وصول كاف إلى القلب.
- ضع رباطا حول الوريد الأجوف السفلي. استخدم هذا لإغلاق الوعاء لتقليل التحميل المسبق لتسجيل قياسات حجم الضغط لاحقا في البروتوكول.
- استخدم إبرة 26G لإحداث ثقب صغير بعناية في عربة سكن متنقلة. تأكد من أن هذا قريب من القمة قدر الإمكان وأن الإبرة لا تخترق البطين تماما ولكنها تعمل فقط كدليل لإدخال قسطرة التوصيل. في حالة حدوث نزيف ، اضغط برفق باستخدام قطعة قطن صغيرة لتقليل فقدان الدم.
- تحديد الثقب الصغير في جدار البطين وإدخال القسطرة عن طريق اختراق الأنسجة.
ملاحظة: عند إدخال القسطرة ، احرص على عدم إتلاف جدار البطين الداخلي. - غالبا ما يتم ملاحظة التغيرات في ضغط البطين الأيمن (RVP) لعدة دقائق بعد إدخال القسطرة. انتظر حتى يستقر RVP للحصول على قياسات الحالة المستقرة التمثيلية.
- للحصول على حلقات حجم الضغط ، استخدم الرباط الذي تم وضعه مسبقا حول الوريد الأجوف السفلي. اسحب الرباط بعناية لإغلاق الوعاء ، وبالتالي تقليل التحميل المسبق تدريجيا.
- بمجرد تسجيل حلقات حجم الضغط التمثيلية ، قم باستخراج القسطرة ، والقتل الرحيم للفأر عن طريق استئصال القلب. في هذا الوقت ، اجمع عينات الدم والأنسجة لمزيد من التحليل.
النتائج
تم اختيار الفئران C57BL / 6N (ذكور ، عمرها 5 أسابيع ، 17-20 جم) بشكل عشوائي إما إلى PTB شديد (sPTB ، 250 ميكرومتر ، n = 12) ، PTB خفيف (mPTB ، 450 ميكرومتر ، ن = 9) ، أو جراحة وهمية (وهمية ، ن = 15). تم إجراء تقييم وظيفة القلب عن طريق تخطيط صدى القلب 1 أسبوع و 3 أسابيع بعد الجراحة. تم إجراء قسطرة القلب اليمنى مع القتل الرحيم اللاحق بعد 3 أسابيع من الجراحة. تم وزن الأعضاء ، وتم إعداد أنسجة القلب للتحليلات النسيجية.
كشف تخطيط صدى القلب بعد 1 أسبوع من الجراحة عن علامات ارتفاع ضغط RV وخلل RV في sPTB مقارنة بمجموعات mPTB والمجموعات الوهمية. كان خلل RV واضحا من خلال انخفاض النتاج القلبي (CO) و TAPSE (الشكل 6A ، B). أشار انخفاض مؤشر انحراف البطين الأيسر (LVEI) إلى زيادة ضغط RV (الشكل 6C). لذلك ، يمكن التحقيق في التدخلات العكسية بالفعل بعد 1 أسبوع في نماذج PTB الشديدة. أظهرت مجموعة mPTB علامات تخطيط صدى القلب لارتفاع ضغط RV مقارنة مع الوهمية (انخفاض LVEI) بعد 1 أسبوع ولكن لا توجد علامات على خلل RV كما تم تقييمه بواسطة تخطيط صدى القلب (الشكل 6).
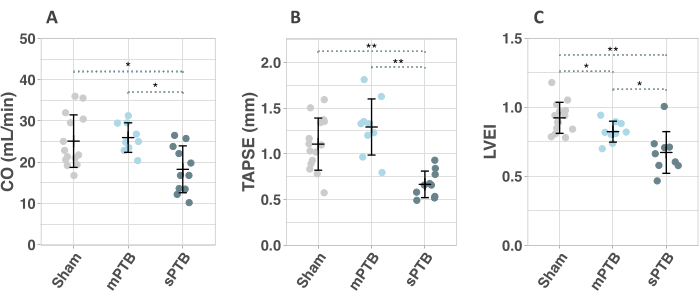
الشكل 6: قياسات تخطيط صدى القلب 1 أسبوع بعد الجراحة. أ: النتاج القلبي. (ب) رحلة انقباضية حلقية ثلاثية الشرف (TAPSE). (ج) مؤشر انحراف مركز البطين الأيسر (LVEI). الاختصارات: mPTB: ربط الجذع الرئوي الخفيف (PTB) ؛ sPTB: PTB شديد. يتم تقديم البيانات بواسطة مخططات مبعثرة بوسائل ± SD. * p < 0.05 ، ** p < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد 3 أسابيع ، تم إبراز آثار جراحة PTB في sPTB مع مزيد من الانخفاض في النتاج القلبي وانخفاض ثابت في TAPSE مقارنة بالوهمية (الشكل 7 أ ، ب). لم يلاحظ أي فرق في معلمات تخطيط صدى القلب بين mPTB والمجموعات الوهمية بعد 3 أسابيع (الشكل 7 أ ، ب).
كشفت قسطرة القلب اليمنى عن زيادة الضغط الانقباضي RV (RVSP) في كلتا مجموعتي PTB مقارنة بالوهمية بعد 3 أسابيع من الجراحة (الشكل 7C). تأثرت وظيفة الانبساطي RV في مجموعة sPTB ، المشار إليها بزيادة في المرونة الانبساطية في نهاية RV (Eed) ، وهو مقياس مستقل عن الحمل لصلابة RV (الشكل 7D). كما تم زيادة انقباض عربة سكن متنقلة ، كما تم تقييمها بواسطة المرونة الانقباضية النهائية (Ees) ، في مجموعة sPTB مقارنة بالوهمية ، بينما أظهرت مجموعة mPTB زيادة غير مهمة (الشكل 7E).
كشفت القياسات التشريحية عن زيادة تضخم RV مع زيادة شدة PTB التي يتم التعبير عنها من خلال الزيادة التدريجية في نسبة وزن RV إلى وزن الجسم (RV / BW) (الشكل 7F). كان RVSP متناسبا خطيا مع درجة تضخم RV (الشكل 7G). أكدت منطقة المقطع العرضي لخلايا عضلة القلب RV (CSA) زيادة بنسبة 40٪ في تضخم RV في sPTB مقارنة بالوهمية ، بينما كانت هناك زيادة غير كبيرة في mPTB مقارنة بالوهمية (الشكل 8A-D). كانت درجة التليف في عربة سكن متنقلة والأذين الأيمن (RA) أعلى بسبعة أضعاف في sPTB مقارنة بالوهم. لم يلاحظ أي زيادة في تليف RV في mPTB (الشكل 8E-H).
لوحظ قلس ثلاثي الشرف (TR) في 64٪ في مجموعة sPTB بعد أسبوع واحد وفي 91٪ في 3 أسابيع ، في حين لم يتم العثور على TR في مجموعات sham و mPTB (البيانات غير معروضة). شوهدت درجات متفاوتة من تلون الكبد ، وهي علامة على المعاوضة خارج القلب ، في مجموعة sPTB (الشكل 9). لم يلاحظ أي تغير في اللون في مجموعات mPTB والصور.
باختصار ، نظهر وجود علاقة بين قطر النطاقات وشدة المرض. تحاكي مجموعة mPTB مرحلة المرض المبكرة مع تضخم RV خفيف دون خلل RV ، بينما تظهر مجموعة sPTB علامات خلل وفشل RV.
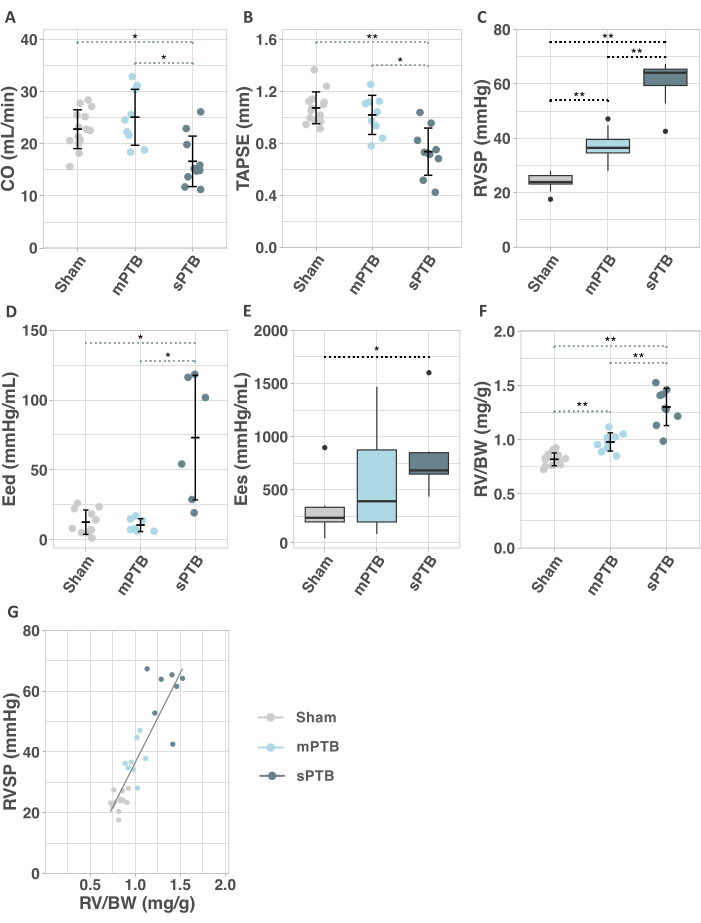
الشكل 7: تخطيط صدى القلب ، وحجم الضغط الغازي ، والقياسات التشريحية بعد 3 أسابيع من الجراحة. أ: النتاج القلبي. (ب) رحلة انقباضية حلقية ثلاثية الشرف (TAPSE). ج: الضغط الانقباضي البطيني الأيمن (RVSP). د: المرونة الانبساطية في نهاية الانبساطي. (ه) المرونة الانقباضية النهائية (Ees). (و) نسبة وزن البطين الأيمن ووزن الجسم (RV / BW). (ز) العلاقة بين الضغط الانقباضي البطيني الأيمن (RVSP) ووزن RV / BW في 3 أسابيع بعد الجراحة. تم إجراء تحليل الانحدار الخطي ويتم تقديمه في المؤامرة. المعدل R2 = 0.75 ، ص < 0.001. الاختصارات: mPTB: ربط الجذع الرئوي الخفيف (PTB) ؛ sPTB: PTB شديد. يتم تقديم البيانات الموزعة عادة بواسطة مخططات مبعثرة بوسائل ± SD. يتم تقديم البيانات الموزعة بشكل غير طبيعي بواسطة مخططات صندوقية مع متوسطات مع IQR وشعيرات تمثل قيما ضمن 1.5 × IQR من Q1 و Q3 ، على التوالي * p < 0.05 ، ** p < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: التحليلات النسيجية لأنسجة RV. (أ) منطقة المقطع العرضي RV. (ب-د) HE أنسجة RV ملطخة من (B) وهمية ، (C) mPTB ، و (D) sPTB. (ه) النسبة المئوية للتليف الخلالي بالنسبة للأنسجة السليمة في RV. (F-H) أنسجة RV الملطخة Picrosirius من (F) sham و (G) mPTB و (H) sPTB. قضبان المقاييس: (B-D) = 50 ميكرومتر ، (F-H) = 250 ميكرومتر. يتم تقديم البيانات بواسطة مخططات صندوقية مع المتوسطات و IQR والشعيرات التي تمثل قيما ضمن 1.5 × IQR من Q1 و Q3 ، على التوالي. * ص < 0.05 ، ** ع < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
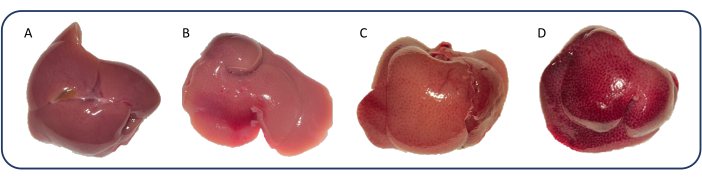
الشكل 9: درجات مختلفة من تغير لون الكبد. تم تصنيف تغير اللون 0-3. استند التصنيف إلى درجة المظهر المرقط ولون أنسجة الكبد. تم التقاط الصور من خلال المجهر ، مما يجعل الأنسجة تبدو أخف وزنا من الإضاءة المحيطة. أ: 0: الكبد الطبيعي. (ب) 1: بقع ضوئية بدون تغير في اللون. (ج) 2: بقع معتدلة وتغير لون خفيف. (د) 3: بقع شديدة وتغير اللون (كبد جوزة الطيب). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه الورقة ، نقدم نموذجا للفأر لتضخم وفشل عربة سكن متنقلة ناتجة عن الضغط الزائد. نثبت أن: (i) PTB في الفئران اليافعة يمكن أن يحفز درجات متفاوتة من أمراض RV ، بدءا من تضخم RV الخفيف إلى فشل RV مع علامات خارج القلب من المعاوضة وتليف RV المؤكد نسيجيا. (ii) يمكن ملاحظة علامات خلل RV وقياسها عن طريق تخطيط صدى القلب في 1 و 3 أسابيع بعد جراحة PTB. (iii) تتناسب درجة تضخم RV مع شدة PTB والزيادة الناتجة في ضغط RV. قد يساعد هذا النموذج في توضيح التسبب في فشل RV الثانوي للحمل الزائد لضغط RV ، حيث نظهر أن نموذج PTB مناسب لدراسة المراحل المختلفة لأمراض RV.
لضمان نجاح وتكرار نموذج PTB الفئران ، ينبغي إيلاء اهتمام كبير للخطوات التالية. (ط) اختيار قطر مشبك الربط المناسب. يعتمد قطر المشبك الأيمن على عدة عوامل ، مثل الدرجة المطلوبة من الحمل الزائد لضغط RV ووقت المتابعة. عمر ووزن الجسم من الفئران هي أيضا عوامل مهمة يجب مراعاتها. وفقا لذلك ، يمكن تعديل البروتوكول اعتمادا على السؤال العلمي الحالي. لهذا السبب ، نوصي بإجراء العمليات الجراحية التجريبية وتخطيط صدى القلب في النقاط الزمنية ذات الصلة بعد الجراحة لتقييم مدى ملاءمة أقطار المشبك المحددة. (ii) يعد الضبط الدقيق لأداة تطبيق المشبك أمرا ضروريا لضمان علم الأمراض القابل للتكرار. نوصي باستخدام الأسلاك المعدنية أو القنية ذات القطر الخارجي المحدد جيدا كدليل لضبط مشبك الربط Applier. (iii) كان فقدان الدم أكثر المضاعفات الشديدة شيوعا أثناء جراحة PTB والسبب الأكثر شيوعا للوفيات في الفترة المحيطة بالعملية الجراحية وبعدها. للحد من فقدان الدم ، استخدم أدوات جراحية مجهرية حادة وتشريح حاد كلما أمكن ذلك. استخدم المقص الجراحي فقط عندما يشار إليه في البروتوكول. (iv) سبب آخر للوفيات المحيطة بالجراحة هو arrythmias القلبية. يمكن أن تحدث نوبات قصيرة من بطء القلب أثناء تشريح الجذع الرئوي وتطبيق مقطع الربط. للحد من خطر السكتة القلبية ، يجب أن يكون وقت التلاعب في الجذع الرئوي محدودا. عند ملاحظة بطء القلب ، توقف مؤقتا عن التلاعب بالجذع الرئوي حتى يصبح معدل ضربات القلب طبيعيا. (ت) يمكن أن يكون تقييم تخطيط صدى القلب القابل للتكرار أمرا صعبا ويتطلب التدريب قبل تحقيق النتائج القابلة للتكرار. نظرا لصغر حجم عربة سكن متنقلة ، من الصعب بشكل خاص تحقيق تصور جيد للعربة الترفيهية في الفئران التي تعمل بشكل زائف في عرض PLAX و A4CH. (vi) قد يختلف معدل ضربات القلب بشكل كبير أثناء تقييم تخطيط صدى القلب. لتقليل التباين ، راقب معدل ضربات القلب عن كثب واستخدم جرعات منخفضة من التخدير مع ضمان التخدير الكافي.
يتمثل أحد قيود نموذج PTB للفئران في الحاجة إلى المعدات الجراحية والتدريب. يجب دائما إجراء العمليات الجراحية التجريبية للتدريب ، ويجب تعديل الأساليب وفقا للمعدات المتاحة محليا. استخدمنا مقاطع ربط التيتانيوم ، والتي وجد أنها طريقة قابلة للتكرار بدرجة كبيرة لتحريض الحمل الزائد لضغط RV15. بالإضافة إلى ذلك ، فقد ثبت أن استخدام مشابك الربط يؤدي إلى انخفاض معدل الوفيات في الفترة المحيطة بالجراحة وتحسين التعافي بعد الجراحة مقارنة بالأربطةالجراحية 31.
تخطيط صدى القلب لتقييم وظيفة RV له بعض القيود ، لأنه يعتمد على المشغل ، وقد يؤثر التباين بين المشغل وداخله على نتائج تخطيط صدى القلب. في هذه الدراسة ، تم إجراء تخطيط صدى القلب من قبل اثنين من المشغلين. لتجنب التحيز من الاختلاف بين المراقبين ، أجرى كلا المشغلين تخطيط صدى القلب على عدد متساو من الفئران من جميع المجموعات. علاوة على ذلك ، فإن تخطيط صدى القلب في الفئران له تحدياته. هذا صحيح بشكل خاص في الفئران الصغيرة والسليمة نسبيا ، كما يتضح من اختلاف قياسات CO و TAPSE الأكبر في أسبوع 1 (الشكل 5) مقارنة ب 3 أسابيع (الشكل 6). لتحقيق قياس أكثر دقة لثاني أكسيد الكربون ، تم قياس VTI في الجذع الرئوي في ثلاث دورات قلبية في ثلاثة مواقع مختلفة (في وسط الجذع الرئوي وبالقرب من جدران الوعاء). علاوة على ذلك ، فقد ثبت أن تخطيط صدى القلب يبالغ في تقدير أول أكسيد الكربون مقارنة بالتصوير بالرنين المغناطيسي في الفئران المعرضة ل PTB32. التصوير بالرنين المغناطيسي هو المعيار الذهبي لقياس أول أكسيد الكربون في الفئران ، وبالتالي يمكن النظر فيه عند استخدام النموذج الحالي32. التحدي الآخر في الفئران ذات الارتفاع الضئيل أو المنعدم لضغط RV ، هو صغر حجم عربة سكن متنقلة ، مما يعقد رؤية A4CH جيدة للقياس ، على سبيل المثال ، TAPSE. قد يؤدي هذا إلى التقليل من تقدير TAPSE في بعض الفئران في مجموعات sham و mPTB. على الرغم من هذه التحديات ، تم تحقيق نتائج ذات دلالة إحصائية ل CO و TAPSE في sPTB مقارنة مع sham و mPTB. هذا يدل على أن CO و TAPSE هي علامات مفيدة لوظيفة RV في النموذج الحالي ، ولكنها تسلط الضوء أيضا على الحاجة إلى تدريب مكثف للمحققين قبل تقييم تخطيط صدى القلب للفئران.
أحد القيود المتأصلة في جميع النماذج الحيوانية هو أنه لا يمكن استقراء النتائج مباشرة للبشر بسبب الاختلافات الجينية والفسيولوجية.
على حد علمنا ، هذا هو نموذج PTB الوحيد في الفئران اليافعة. تم استخدام هذا النهج في الفئران ، حيث تتطور الزيادة التدريجية والبطيئة في الحمل اللاحق مع نمو الفئران. هذا التحريض البطيء للمرض يحاكي بشكل أفضل تطور فشل RV المزمن15.
يتضمن البروتوكول الحالي مجموعتين متميزتين من الفئران بدرجات مختلفة من خلل RV. على حد علمنا ، لا تتضمن أي نماذج PTB أخرى منشورة من الفئران مجموعة تعاني فقط من تضخم RV الخفيف دون علامات خلل في RV أو ضعف الدورة الدموية أو التليف. وبالتالي يتم التغاضي عن هذه المرحلة المبكرة من المرض إلى حد كبير. قد تؤدي دراسة هذه المرحلة المبكرة من تطور المرض إلى زيادة فهمنا للتقدم التدريجي من تضخم RV إلى فشل RV الذي يظهر في المرضى الذين يعانون من PAH17 المزمن.
في هذا النموذج ، تتطور أمراض فشل RV المزمن في غضون 3 أسابيع بعد الجراحة ، مما يجعلها واحدة من أكثر النماذج فعالية من حيث الوقت لفشل RV المزمن6. تشير نماذج PTB الأخرى إلى فترات دراسة من 1 إلى 8 أسابيع17،18،33،34،35. لاحظنا علامات اختلال RV بالفعل 1 أسبوع بعد الجراحة في sPTB. ومع ذلك ، فإن هذا النهج الفعال من حيث الوقت مع متابعة لمدة 3 أسابيع يأتي مع قيود. لا تنمو الفئران بشكل كامل في 8 أسابيع وقد تؤدي المتابعة الأطول إلى تضيق الجذع الرئوي الشديد بشكل متزايد وفشل RV أكثر حدة.
الفئران المعدلة وراثيا متاحة بسهولة ، ويمكن إنتاج سلالات جديدة معدلة وراثيا في الفئران بسرعة نسبية وكفاءة من حيث الوقت36. وهذا يشكل ميزة رئيسية لنماذج PTB الفئران على عكس النماذج التي تستخدم الفئران أو الثدييات الكبيرة.
في الختام ، نقدم نموذجا للفأر القابل للتكرار لتضخم RV الناجم عن الضغط الزائد والفشل في الفئران اليافعة. يتم تضمين بروتوكولات مفصلة للتنبيب والجراحة والتنميط الظاهري عن طريق تخطيط صدى القلب في الورقة. تستخدم الأدوات المصنوعة حسب الطلب للتنبيب والجراحة ، مما يسمح باستنساخ سريع وغير مكلف للنموذج. يمكن استخدام النموذج لتحديد الآليات التي تحكم تكيف عربة سكن متنقلة مع الحمل الزائد للضغط ، بالإضافة إلى العمليات الكامنة وراء أمراض المركبات الترفيهية التي تؤدي في النهاية إلى فشل عربة سكن متنقلة. أخيرا ، يمكن استخدام النموذج لاختبار أهداف علاجية جديدة لعلاج فشل عربة سكن متنقلة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل Snedkermester Sophus Jacobsen og Hustru Astrid Jacobsens Fond و Helge Peetz og Verner Peetz og hustru Vilma Peetz Legat و Grosserer A.V. Lykfeldt og Hustrus Legat. علاوة على ذلك ، يود المؤلفون أن يشكروا موظفي مرافق في قسم الطب السريري بجامعة آرهوس على دعمهم أثناء تنفيذ العمل التجريبي.
Materials
| Name | Company | Catalog Number | Comments |
| Biosyn 6-0, monofilament, absorbable suture | Covidien | UM-986 | |
| Blunt cannula, 27G 0.4x0.25, | Sterican | 292832 | |
| Bupaq Multidose vet 0,3 mg/ml (Buprenorphinum) | Salfarm Danmark | VNR 472318 | |
| C57BL/6NTac mice | Taconic Biosciences | C57BL/6NTac | |
| Dagrofil 1, braided, non-absorbable suture | B Braun | C0842273 | |
| Depilatory cream | Veet | 3132000 | |
| Disinfection Swabs (82% Ethanol + 0.5% Chlorhexidine) | Mediq | 3340122 | |
| Disposable scalpels, size 11 | Swann-Morton | 11708353 | |
| Dräger Vapor 2000 Sevoflurane | Dräger | M35054 | |
| Eye oinment neutral, "Ophta" | Actavis | MTnr.: 07586 Vnr: 53 96 68 | |
| Horizon ligating clips | Teleflex Medical | 5200 (IPN914931) | |
| Horizon Open Ligating Clips applier, curved, 6" (15 cm) | Teleflex Medical | 537061 | |
| Kitchen roll holder | n.a. | n.a. | |
| Metal wire of different thickness | n.a. | n.a. | |
| Microsurgical instruments set | Thompson | n.a. | |
| MiniVent Ventilator | Hugo Sachs | Type 845 | |
| MS505S transducer | Visual sonics | n.a. | |
| Rimadyl Bovis vet. 50 mg/ml (Carprofen) | Zoetis | MTnr: 34547, Vnr: 10 27 99, | |
| Sevoflurane Baxter 100 % | Baxter Medical | MTnr: 35015 | |
| Silicone tubing | n.a. | n.a. | |
| Soft plastic sheet | n.a. | n.a. | |
| Stereomicroscope, "Opmi Pico" | Carl Zeiss Surgicals GmbH | n.a. | |
| Ultrasonic probe holder/rail | Visual Sonics | 11277 | |
| Varming plate | Visual sonics | 11437 | |
| Venflon ProSafety, 22G, 0,9 x 25mm | Becton Dickinson | 393222 |
References
- Voelkel, N. F., et al. Right ventricular function and failure: Report of a national heart, lung, and blood institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
- Haddad, F., Doyle, R., Murphy, D. J., Hunt, S. A. Right ventricular function in cardiovascular disease, part ii: Pathophysiology, clinical importance, and management of right ventricular failure. Circulation. 117 (13), 1717-1731 (2008).
- Van De Veerdonk, M. C., et al. Progressive right ventricular dysfunction in patients with pulmonary arterial hypertension responding to therapy. J Am Coll Cardiol. 58 (24), 2511-2519 (2011).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: Problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: The evolution of animal models in pulmonary hypertension research; are we there yet. Pulm Circ. 3 (4), 739-756 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Voelkel, N. F., Tuder, R. M. Hypoxia-induced pulmonary vascular remodeling: A model for what human disease. J Clin Invest. 106 (6), 733-738 (2000).
- Rabinovitch, M., Gamble, W., Nadas, A. S., Miettinen, O. S., Reid, L. Rat pulmonary circulation after chronic hypoxia: Hemodynamic and structural features. Am J Physiol. 236 (6), H818-H827 (1979).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. Faseb j. 15 (2), 427-438 (2001).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. Am J Respir Crit Care Med. 184 (10), 1171-1182 (2011).
- Nicolls, M. R., et al. New models of pulmonary hypertension based on VEGF receptor blockade-induced endothelial cell apoptosis. Pulm Circ. 2 (4), 434-442 (2012).
- Hessel, M. H., Steendijk, P., Den Adel, B., Schutte, C. I., Van Der Laarse, A. Characterization of right ventricular function after monocrotaline-induced pulmonary hypertension in the intact rat. Am J Physiol Heart Circ Physiol. 291 (5), H2424-H2430 (2006).
- Gomez-Arroyo, J. G., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Janssen, W., et al. 5-ht2b receptor antagonists inhibit fibrosis and protect from RV heart failure. Biomed Res Int. 2015, 438403 (2015).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Axelsen, J. B., et al. Effects of 6-mercaptopurine in pressure overload induced right heart failure. PLoS One. 14 (11), e0225122 (2019).
- Egemnazarov, B., et al. Pressure overload creates right ventricular diastolic dysfunction in a mouse model: Assessment by echocardiography. J Am Soc Echocardiogr. 28 (7), 828-843 (2015).
- Wang, Q., et al. Induction of right ventricular failure by pulmonary artery constriction and evaluation of right ventricular function in mice. J Vis Exp. (147), e59431 (2019).
- Kojonazarov, B., et al. The peroxisome proliferator-activated receptor β/δ agonist gw0742 has direct protective effects on right heart hypertrophy. Pulm Circ. 3 (4), 926-935 (2013).
- Kojonazarov, B., et al. P38 MAPK inhibition improves heart function in pressure-loaded right ventricular hypertrophy. Am J Respir Cell Mol Biol. 57 (5), 603-614 (2017).
- Rai, N., et al. Effect of Riociguat and Sildenafil on right heart remodeling and function in pressure overload induced model of pulmonary arterial banding. Biomed Res Int. 2018, 3293584 (2018).
- Sydykov, A., et al. Genetic deficiency and pharmacological stabilization of mast cells ameliorate pressure overload-induced maladaptive right ventricular remodeling in mice. Int J Mol Sci. 21 (23), 9099 (2020).
- Andersen, S., et al. Effects of combined angiotensin ii receptor antagonism and neprilysin inhibition in experimental pulmonary hypertension and right ventricular failure. Int J Cardiol. 293, 203-210 (2019).
- Andersen, S., et al. Pressure overload induced right ventricular remodeling is not attenuated by the anti-fibrotic agent pirfenidone. Pulm Circ. 9 (2), 2045894019848659 (2019).
- Labazi, H., et al. Sex-dependent changes in right ventricular gene expression in response to pressure overload in a rat model of pulmonary trunk banding. Biomedicines. 8 (10), 430 (2020).
- Sun, X. Q., et al. Increased mao-a activity promotes progression of pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 64 (3), 331-343 (2021).
- Axelsen, J. S., et al. Effects of Empagliflozin on right ventricular adaptation to pressure overload. Front Cardiovasc Med. 10, 1302265 (2023).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Boehm, M., et al. Delineating the molecular and histological events that govern right ventricular recovery using a novel mouse model of pulmonary artery de-banding. Cardiovasc Res. 116 (10), 1700-1709 (2020).
- Andersen, S., et al. Effects of bisoprolol and losartan treatment in the hypertrophic and failing right heart. J Card Fail. 20 (11), 864-873 (2014).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Vildbrad, M. D., et al. Limitations and pitfalls in measurements of right ventricular stroke volume in an animal model of right heart failure. Physiol Meas. 36 (5), 925-937 (2015).
- Boehm, M., et al. Maintained right ventricular pressure overload induces ventricular-arterial decoupling in mice. Exp Physiol. 102 (2), 180-189 (2017).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Luitel, H., et al. Pressure overload leads to an increased accumulation and activity of mast cells in the right ventricle. Physiol Rep. 5 (6), e13146 (2017).
- Mamazhakypov, A., et al. Novel therapeutic targets for the treatment of right ventricular remodeling: Insights from the pulmonary artery banding model. Int J Environ Res Public Health. 18 (16), 8297 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved