Method Article
التحفيز المغناطيسي المتكرر عبر الجمجمة جنبا إلى جنب مع التدريب على مراقبة العمل لدى الأطفال المصابين بالشلل الدماغي التشنجي
In This Article
Summary
يعاني الأطفال المصابون بالشلل الدماغي التشنجي (SCP) من تشنج الأطراف واضطرابات الحركة ووضعية غير طبيعية بسبب إصابة منطقة القشرة الدماغية الحركية ، مما يؤدي إلى عدم القدرة على الوقوف والمشي بشكل طبيعي. لذلك ، أصبح تخفيف التشنج في الأطراف وتعزيز الوظيفة الحركية الإجمالية لدى الأطفال المصابين ب SCP أهدافا علاجية مهمة.
Abstract
تقدم هذه الدراسة نتائج تجربة معشاة ذات شواهد باستخدام تصميم عامل 2 × 2 ، مقارنة آثار التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) وطرق التدخل في التدريب على مراقبة العمل (AOT) على التشنج ووظيفة التوازن والوظيفة الحركية لدى الأطفال المصابين بالشلل الدماغي التشنجي (SCP). تهدف الدراسة إلى التحقق مما إذا كان الجمع بين التدخلين ينتج عنه تحسن أكبر من العلاج وحده أو العلاج التقليدي.
تم تقسيم الأطفال الخاضعين في هذه الدراسة ، وفقا لجدول الأرقام العشوائي ، عشوائيا إلى أربع مجموعات: المجموعة التقليدية ، ومجموعة rTMS ، ومجموعة AOT ، ومجموعة التدخل المشترك. تلقى جميع الأطفال في المجموعات الأربع علاجا تقليديا لإعادة التأهيل ، على أساسه تم إعطاؤهم برامج علاجية مختلفة لتدابير إعادة التأهيل. لم يكن لدى المجموعة التقليدية أي علاج آخر بينما تلقت مجموعة rTMS rTMS ، وتلقت مجموعة AOT AOT وأعطيت مجموعة التدخل المشترك تدخلا مشتركا من rTMS و AOT. تم تدريبهم خمسة أيام في الأسبوع لمدة 12 أسبوعا. تم تقييم التغييرات في درجات التشنج ، ووظيفة التوازن ، والقدرة على المشي ، والوظيفة الحركية الإجمالية في بداية البرنامج التدريبي وعند الانتهاء من 12 أسبوعا من العلاج.
أكمل ما مجموعه 64 طفلا مع SCP الدراسة ، وتم تحليل نتائجهم. كانت الكفاءة الإجمالية للوظيفة الحركية البالغة 87.50٪ في المجموعة التجريبية أعلى بكثير من 25.00٪ في المجموعة التقليدية ، و 62.50٪ في مجموعة rTMS ، و 68.75٪ في مجموعة AOT. أظهرت النتائج الأولية أن التدخل المشترك ل rTMS و AOT يمكن أن يحسن بشكل فعال وظيفة التوازن والوظيفة الحركية للأطفال ، وكان التأثير العلاجي للتدخل المشترك أفضل من العلاج التقليدي ، rTMS أو AOT وحده. وأخيرا، تم توضيح الفعالية السريرية ومعايير العلاج المثلى للتدخل المشترك لتوفير أساس سريري للمعالجين لإجراء إعادة تأهيل وظائف الأطراف السفلية للأطفال الذين يعانون من SCP.
Introduction
الشلل الدماغي1 (CP) هو أحد أكثر اضطرابات الإعاقة شيوعا عند الأطفال وهو مجموعة من المتلازمات المستمرة الناجمة عن تلف الدماغ غير التدريجي في الأجنة والرضع النامين ، بما في ذلك خلل الحركة المركزي ، والموقف غير الطبيعي ، ومحدودية الحركة. حاليا ، هناك ما يقرب من 17 مليون طفل في جميع أنحاء العالم مصابون بالشلل الدماغي2 ، مع أكثر من 5 ملايين حالة في الصين. من بين الأشكال المختلفة للشلل الدماغي، يمثل الشلل الدماغي التشنجي (SCP) حوالي 80٪3. يعاني الأطفال المصابون ب SCP من تلف في الدماغ يؤدي إلى تشنجات عضلية ، وتقلص الوظيفة الحسية ، وضعف التنسيق العضلي ، وانخفاض قدرات التوازن ، وكلها تعيق المشي المستقل والأنشطة اليومية. تشمل تدابير إعادة التأهيل الحالية لتعزيز الوظيفة الحركية الإجمالية لدى الأطفال المصابين ب SCP أنشطة مثل تدريب الاستقرار الأساسي4 ، والتدريب الموجه نحو المهام5 ، والعلاج بالحركة الناجم عن القيود6 ، وعلاج التغذية المرتدة البصريةالمرآة 7. يمكن لهذه التدابير تحسين الأعراض السريرية للأطفال من خلال تنظيم وإعادة تشكيل الجهاز العصبي المركزي من أسفل إلى أعلى من خلال تحسين وظائف الأعضاء الطرفية.
التحفيز المغناطيسي عبر الجمجمة (TMS)8,9 هو طريقة علاجية غير مؤلمة وغير جراحية وآمنة. يشير rTMS إلى الإطلاق المستمر للمنبهات على فترات متساوية بعد أمر واحد ، وهو أحد أنماط التحفيز المتكررة المنتظمة. استنادا إلى مبدأ الحث الكهرومغناطيسي والتحويل الكهرومغناطيسي ، فإنه يطبق التيارات العابرة من خلال ملفات التحفيز لتشكيل مجال مغناطيسي نابض لاختراق الجمجمة ، وتوليد تيار تحريضي لتحفيز الخلايا العصبية وإطلاق سلسلة من الاستجابات الفسيولوجية والكيميائية الحيوية. تم تطبيق rTMS على مراقبة وتقييم وعلاج الأمراض العصبية ، مما يوفر نهجا جديدا لاستكشاف بنية ووظيفة الدماغ10. أظهرت الدراسات الحالية11،12 أن rTMS له تأثيرات علاجية متفاوتة على تشنجات الأطراف والوظيفة الحركية لدى الأطفال المصابين بالشلل الدماغي. علاوة على ذلك ، فإن تأثير علاج rTMS جنبا إلى جنب مع تقنيات إعادة التأهيل الأخرى أكثر وضوحا.
AOT هي طريقة إعادة تأهيل تستخدم نظام الخلايا العصبية المرآة (MNS) لإنشاء التعلم الحركي والذاكرة13,14. يتمثل جوهر AOT في جعل المراقب يراقب بعناية الإجراءات في الفيديو ثم يبذل قصارى جهده لتقليد ما لاحظه. قد تؤدي عملية المراقبة إلى التنشيط في الشبكة العصبية المعروفة باسم MNS ، على غرار التنشيط الذي يحدث عندما يشارك المرء شخصيا في تنفيذ تلك الإجراءات15 ، والتي توفر أساسا فسيولوجيا عصبية ل AOT. أظهرت AOT نجاحا في تحسين المهارات الحركية لدى المرضى الذين يعانون من اضطرابات الحركة ، مما أدى إلى نتائج إيجابية في التعافي من السكتة الدماغية وإعادة تأهيل الوظيفة الحركية للطرف العلوي لدى مرضى الشلل الدماغي16,17.
وجدت دراساتنا السابقة أن AOT القائم على نظام الخلايا العصبية المرآتية يمكن أن يحسن بشكل فعال التوازن والقدرة على المشي للأطفال المصابين بالشلل الدماغي18. بالإضافة إلى ذلك، أظهرتالدراسات 19 أن التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) يمكن أن يحسن التشنج العضلي والحركة والمشي لدى الأطفال المصابين بالشلل الدماغي، ولكن معايير علاج التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) المطبقة على الأطفال المصابين بالشلل الدماغي لم يتم توحيدها، ومن المشاكل الملحة استكشاف تأثير المعلمات المختلفة للتحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) على الأطفال المصابين بالشلل الدماغي، لتوفير معيار علاج شخصي ودقيق. نعتقد أن الجمع بين rTMS و AOT لديه القدرة على التطور إلى استراتيجية علاج طبيعي قيمة لإعادة التأهيل العصبي للشلل الدماغي. حفز كل من rTMS و AOT القشرة الدماغية لدى الأطفال المصابين ب SCP20 ، مما ساعد على تطوير الوظيفة الحركية الإجمالية. تهدف هذه الدراسة إلى معرفة ما إذا كان الجمع بين rTMS و AOT يمكن أن يحقق تأثيرا تآزريا أكبر من العلاج التقليدي أو rTMS أو AOT وحده.
Protocol
تم إجراء هذه الدراسة بما يتفق بدقة مع المعايير الوطنية للتجارب البشرية ، وتمت الموافقة على الدراسة السريرية من قبل جمعية الأخلاقيات في مستشفى Xiangya Boai لإعادة التأهيل (رقم الموافقة على الأخلاقيات: 20211223). وافق أولياء أمور الأطفال على المشاركة في هذا البرنامج التدريبي ووقعوا على استمارات الموافقة المستنيرة. تم تجنيد الأطفال المصابين ب SCP في مستشفى Xiangya Boai لإعادة التأهيل ومستشفى Xiangya بجامعة سنترال ساوث من فبراير 2022 إلى ديسمبر 2022.
1. التحضير قبل التجربة
- لضمان دقة نتائج الدراسة ، قم بتوفير التدريب المناسب لمعالجي إعادة التأهيل وتقييم مهاراتهم مسبقا للتأكد من قدرتهم على توجيه الأطفال في التدريب.
ملاحظة: يجب تدريب فنيي التحفيز المغناطيسي المتكرر عبر الجمجمة وتأهيلهم لضمان سلامة الأطفال. - قم بإجراء فحص سلامة التحفيز المغناطيسي المتكرر عبر الجمجمة مع أولياء الأمور قبل التجربة، بما في ذلك استجوابهم حول أدلة النوبات والأدوية التي يتم تناولها.
ملاحظة: يمكن للأدوية أن تخفض عتبة النوبة.
2. التوظيف
- تجنيد الأطفال المصابين ب SCP الذين يفي تشخيصهم وتصنيفهم السريري بمعايير إرشادات علاج إعادة تأهيل الشلل الدماغي الصيني (2022) 21.
- تأكد من أن الأطفال تتراوح أعمارهم بين 3 و 6 سنوات.
- تأكد من أن الأطفال لديهم مقياس جيزيل للتشخيص التنموي (GDDS) حاصل تنمية المنطقة السلوكية التكيفية (DQ) > 55 حتى يتمكنوا من المشاركة بنشاط في التدريب.
- تأكد من أن الأطفال لديهم تصنيف الوظيفة الحركية الإجمالية (GMFCS) I-III.
- تأكد من أن الأطفال يمكنهم المشي أكثر من 10 أمتار بشكل مستقل أو باستخدام مشاية.
- استبعاد ما يلي: الأطفال الذين يعانون من أنواع أخرى من الشلل الدماغي ؛ الأطفال المقرر إعادة تأهيلهم طبيا أو جراحة خلال فترة الدراسة ؛ الأطفال الذين يعانون من الصرع أو الإعاقة الذهنية الشديدة أو ضعف البصر أو نقص الانتباه ؛ الأطفال الذين خضعوا لزراعة قوقعة الأذن أو الغرسات داخل الجمجمة.
- قبل التدريب ، احصل على نماذج موافقة مستنيرة من أولياء أمور الأطفال للمشاركة الطوعية في هذا البرنامج التدريبي 1x في اليوم ، 5 أيام في الأسبوع لمدة 12 أسبوعا.
3. تقييم ما قبل المعالجة
- تحليل البيانات الأساسية التي تم جمعها من الأطفال المجندين المصابين ب SCP ، بما في ذلك الاسم والجنس والعمر ونوع التشنج الشلل الدماغي و GMFCS والمستوى المعرفي وارتداء مقوام القدم في الكاحل والعلاج الطبي السابق أو الحالي والتاريخ الجراحي.
- تقييم إعادة التأهيل
ملاحظة: أظهرت الدراسات أن مقياس التشنج الشامل (CSS) المستخدم لتقييم درجة تشنج الأطراف السفلية لدى الأطفال المصابين ب SCP يتمتع بموثوقية وصلاحية جيدة22.- تحديد درجة التشنج عن طريق فحص منعكس وتر العرقوب للطرف السفلي ، وتوتر العضلات في مجموعة ثني الكاحل الأخمصي ، ورمع الكاحل. استخدم معايير التقييم التالية: لا تشنج ، <7 ؛ تشنج خفيف ، 7-9 ؛ تشنج معتدل ، 10-12 ؛ وتشنج شديد ، 13-16.
- قم بتقييم وظيفة التوازن وفقا لمقياس توازن الأطفال (PBS)23 ، والذي يتضمن 14 عنصرا تم اختبارها. ينقسم كل عنصر إلى خمسة مستويات مع 0-4 نقاط لكل عنصر و 56 نقطة في المجموع. كلما ارتفعت النتيجة ، كانت وظيفة التوازن أفضل.
ملاحظة: يعتمد برنامج PBS على مراجعة BBS للأطفال ، حيث يقوم بشكل أساسي بضبط ترتيب العناصر التي تم اختبارها ، وتقصير الوقت للحفاظ على الموقف ، وتوضيح تعليمات الاختبار. - قم بتقييم قدرة الأطفال على المشي بناء على سرعة المشي 10 أمتار (10 ميجاوات ثانية)24.
- اطلب من الأطفال المشي بأسرع ما يمكن على مدرج بمواصفات العرض × الطول = 20 سم × 15 م ، بشكل مستقل أو ارتداء تقويم العظام في الكاحل أو القدم أو استخدام أداة مساعدة على المشي للأطفال الذين يعانون من GMFCS من الدرجة الثالثة.
- اطلب من الأطفال البدء في المشي عند علامة 15 مترا ؛ ابدأ التوقيت عند 12 مترا ، وتوقف عند 2 مترا لقياس الوقت المستغرق لمنتصف 10 أمتار. اطلب من الأطفال إجراء ثلاثة اختبارات متتالية 10MWT وحساب سرعة المشي (م / ث).
ملاحظة: تم تصنيف المستوى الوظيفي للأطفال من الأول إلى الثالث وفقا ل GMFCS ، مما يعني أن لديهم قدرة معينة على الوقوف والمشي. - قم بتقييم مستوى الوظيفة الحركية الإجمالية للأطفال عن طريق اختيار وضع الوقوف في المنطقة D (13 عنصرا) والمشي والجري والقفز في المنطقة E (24 عنصرا) في مقياس الوظيفة الحركية الإجمالية (GMFM). احسب النتيجة وفقا لدرجة إكمال كل عنصر (0-3 نقاط) واحصل على النتيجة الإجمالية للمنطقتين D و E. كلما ارتفعت الدرجة ، كانت الوظيفة الحركية الإجمالية أفضل.
- احسب معدل الفعالية باستخدام المعادلتين (1) و (2) وتقييم الفعالية السريرية لتدخلات الوظائف الحركية الإجمالية عن طريق قياس الفرق في الدرجات من قسم GMFM-88E قبل وبعد العلاج.
معدل الفعالية (٪) =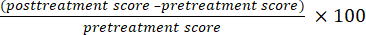 (1)
(1)
معدل الفعالية = معدل فعال كبير + معدل فعال (2)- اعتبر النتيجة فعالة بشكل كبير إذا كان معدل الفعالية >50٪.
- اعتبر النتيجة فعالة إذا كان معدل الفعالية بين 20٪ و 50٪.
- اعتبر أن النتيجة غير فعالة إذا كان معدل الفعالية <20٪.
4. الطريقة العلاجية
ملاحظة: شرح مبادئ وأهداف البرنامج التدريبي ، وكذلك الآثار الضارة المحتملة وقضايا السلامة أثناء عملية التدريب ، لأولياء أمور الأطفال.
- قسم الأطفال الذين يعانون من SCP عشوائيا إلى أربع مجموعات مختلفة: مجموعة تقليدية ، ومجموعة rTMS ، ومجموعة AOT ، ومجموعة تدخل مركب وفقا لطريقة الجدول العددي (16 حالة في كل مجموعة في هذه الدراسة).
- ضمان حصول جميع الأطفال على علاج إعادة التأهيل التقليدي ، والذي سيتم على أساسه إعطاؤهم تدابير علاجية مختلفة لإعادة التأهيل. لا تتلقى المجموعة التقليدية أي علاج آخر لإعادة التأهيل. تتلقى مجموعة rTMS rTMS ؛ تتلقى مجموعة AOT AOT ؛ وتتلقى لجنة الدراسات نظام rTMS جنبا إلى جنب مع AOT.
- اشرح بالتفصيل لعائلات الأطفال المشاركين إمكانيات مشاركتهم في برامج التدريب لإعادة التأهيل التقليدية ، rTMS ، AOT ، والتدخلات المشتركة. التأكد من أن الباحثين أعمى عن تخصيص الموضوعات وعدم مشاركتهم في التقييم.
- وفقا لترتيب قبول هؤلاء الأطفال ، قم بإنشاء قائمة رقمية كجدول بيانات. التوزيع العشوائي في مجموعات على النحو التالي: الأرقام 1 ، 5 ، 9 ... للمجموعة العادية ؛ الأرقام 2 ، 6 ، 10 ... لمجموعة rTMS ؛ الأرقام 3 ، 7 ، 11 ... لمجموعة AOT ؛ والأرقام 4 ، 8 ، 12 ... لمجموعة التدخل المشترك. لضمان الخصوصية ، استخدم ستارة لتزويد كل طفل بمساحة منفصلة خلال كل جلسة علاج.
- إعادة التأهيل التقليدية
- ممارسة العلاج
- اشرح مبدأ العلاج بالتمرين والغرض منه لأولياء أمور الأطفال وإخطارهم بأن مدة العلاج 30 دقيقة.
- وفقا لتصنيف قوة عضلاتهم ، اطلب من الأطفال أداء تمارين قوة العضلات لتدريب عضلات الورك الخاطفة ، والعضلات الباسطة الخلفية للورك ، والعضلات الباسطة الظهرية للكاحل ، 10x لكل مجموعة وثلاث مجموعات في اليوم.
- وفقا لمستوى وظيفة التوازن لديهم ، اطلب من الأطفال إجراء تدريب على التوازن مثل الوقوف بدون دعم ، والوقوف مع القدمين معا ، والوقوف على ساق واحدة ، لمدة 10 دقائق في كل مرة.
- وفقا لقدرتهم على المشي ، اطلب من الأطفال إجراء تدريب على المشي مثل الإمساك باليد والمشي المستقل وعبور العقبات ، لمدة 10 دقائق في كل مرة.
- المعالجه المائيه
- اشرح مبدأ العلاج المائي وعمليته والغرض منه لأولياء أمور الأطفال وإخطارهم بأن مدة العلاج 20 دقيقة.
- عند استخدام آلة العلاج المائي الخاصة للأطفال ، اضبط درجة حرارة الماء على درجة حرارة مناسبة من 37-38 درجة مئوية.
- اطلب من الآباء مساعدة أطفالهم على خلع ملابسهم ، وارتداء سروال سباحة مقاوم للماء وأطواق العلاج المائي ، ثم إدخالهم في آلة العلاج المائي.
- انقر على زر حمام الفقاعات لبدء العلاج واطلب من الأطفال الوقوف والالتفاف واتخاذ خطوات بالتناوب مع وضع كلتا القدمين في الماء.
- العلاج بالتدليك
- قم بتشخيص الأطفال أولا.
- شرح آثار العلاج بالتدليك لأولياء أمور الأطفال وإخطارهم بأن مدة العلاج 30 دقيقة.
- ضع الأطفال في وضعية الانبطاح وطبق تقنيات القرص والدفع بالتناوب 5-10x على جانبي الشريان التاجي وخط الطول المثانة.
- ضع الأطفال في وضعية الانبطاح واضغط ، باستخدام نهاية الإبهام ، على نقاط الوخز بالإبر في Futu و Liangqiu و Zusanli و Jiexi و Huantiao و Chengfu و Wuizhong من أعلى إلى أسفل.
- ضع الأطفال في وضع الاستلقاء أو الانبطاح وقم بتطبيق الرفع الإيقاعي والقرص 10-20x بالإبهام والأصابع الأربعة الأخرى بالتناوب على عضلات الفخذ وأوتار الركبة وعضلة ثلاثية الرؤوس في ربلة الساق في نفس الوقت.
- ممارسة العلاج
- rTMS
ملاحظة: شارك المعالج الفيزيائي المشارك في أداء التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) أولا في التدريب الذي نظمته الشركة المصنعة. من أجل سلامة المشاركين، يجب على المعالج أو غيره من المهنيين الطبيين المدربين الإشراف على عملية العلاج بأكملها وإبلاغ الأوصياء مقدما بأن النبض الناتج عن التحفيز المغناطيسي المتكرر عبر الجمجمة قد يسبب ألما مؤقتا وخفيفا وارتعاشا طفيفا في الوجه والأطراف عندما يضرب فروة الرأس.- تحضير المريض بالتحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS)
- في الزيارة الأولى ، أخبر المعالج الفيزيائي بالمعلومات الأساسية والتاريخ الطبي للأطفال الخاضعين.
- اشرح عملية علاج التحفيز المغناطيسي المتكرر عبر الجمجمة والاستجابات المحتملة لأولياء أمور الأطفال وأبلغهم بأن مدة العلاج حوالي 30 دقيقة.
- ضع الأطفال في وضع الاستلقاء أو الجلوس ، وقم بتقليل أيديهم بالكحول الطبي ، واختر غطاء وضع مناسب لكل منهم وفقا لمحيط رأسهم. ضع الخط الأنفي القذالي على غطاء تحديد المواقع على الخط المتوسط للأطفال المشاركين ، ونقطة عبور الخط الأنفي القذالي والخط الصدغي الجداري عند منتصف الخط الفاصل بين الحاجب والجثة الخلفية القذالية.
ملاحظة: يجب اختيار الحجم المناسب وفقا لمحيط الرأس. - قم بتثبيت قطب التسجيل على عضلة البطن للخاطف pollicis brevis للأطفال المشاركين ، والقطب المرجعي لوتر الخاطف pollicis brevis ، والقطب السفلي على الرسغ.
- إعداد عملية rTMS
- ابدأ تطبيق الكمبيوتر على جهاز rTMS ، وأدخل المعلومات الأساسية والتشخيصات للأطفال المشاركين ، وحدد خطة العلاج.
- ملف التحفيز عبارة عن ملف دائري مبرد بالهواء ، يتزامن مركزه مع منطقة M1 المقابلة المقابلة للخاطف الذي تم تحديده. ضع الملف عند 45 درجة على فروة الرأس.
ملاحظة: تم تصميم غطاء تحديد المواقع وفقا لنظام ترتيب القطب الكهربائي لتخطيط كهربية الدماغ (EEG) 10-20 ، والذي يمكنه تحديد موقع منطقة M1 بسرعة. - حدد شدة تحفيز بنسبة 30٪ وتحفيز منطقة M1 المقابلة لعضلة الخاطف المقابلة pollicis brevis بواسطة نبضة أحادية يدوية.
ملاحظة: أثناء العلاج ، يجب أن يحتفظ الأطفال المشاركون بموقفهم لتجنب انحراف هدف التحفيز. - راقب الرسم البياني لواجهة الجهود الحركية المستثارة وقلل شدة التحفيز تدريجيا. حدد RMT على أنه الحد الأدنى من شدة التحفيز التي ستثير هذه الاستجابة إذا كان ما لا يقل عن 5 من أصل 10 محفزات متتالية للقشرة الحركية الأولية للطفل (M1) تحفز قوة جهد حركية تزيد عن 50 مللي فولت في عضلة الهلوسة الخاطفة المقابلة (الشكل 1 أ).
- انقر فوق زر التأكيد ، واحفظ سجل RMT ، ثم أدخل صفحة إعداد معلمة العلاج .
- علاج rTMS
- استخدم الإعدادات التالية لإجراء تحفيز منخفض التردد على منطقة M1 من القشرة الدماغية غير التالفة: تردد التحفيز 1 هرتز ، شدة التحفيز 80٪ RMT ، رقم التحفيز 10 ، وقت التحفيز 10 ثوان ، عدد التكرار 80 ، والعدد الإجمالي للنبضات 80025,26 (انظر الشكل 1B).
- استخدم الإعدادات التالية لإجراء تحفيز عالي التردد لمنطقة M1 من القشرة الدماغية التالفة: تردد التحفيز 5 هرتز ، شدة التحفيز 100٪ RMT ، رقم التحفيز 15 ، وقت التحفيز 3 ثوان ، مرات التكرار 80 ، والعدد الإجمالي للنبضات 120010 (انظر الشكل 1C).
- راقب ردود الأطفال المشاركين. على سبيل المثال ، إذا بدأ الأطفال في البكاء بسبب ضرب فروة الرأس ، أو كان لديهم ارتعاش مفرط في الوجه ، أو أظهروا علامات نوبة وردود فعل سلبية أخرى ، فتوقف عن العلاج على الفور.
ملاحظة: بالنسبة للأطفال المصابين بالشلل التشنجي / الرباعي ، تم إجراء تحفيز عالي التردد لمنطقة M1 من القشرة الدماغية التالفة بالتناوب على جانبي الدماغ التالف. بالنسبة لأولئك الذين يعانون من شلل نصفي تشنجي ، تم تحفيز منطقة M1 من القشرة الدماغية غير التالفة بتردد منخفض ، في حين تم تحفيز القشرة الدماغية التالفة في منطقة M1 بتردد عال.
- تحضير المريض بالتحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS)
- أوت
ملاحظة: تطلب AOT من المعالجين الفيزيائيين تصوير حركات جسم الأشخاص بالفيديو مسبقا والإشراف على دقة السلامة والتدريب لعملية العلاج بأكملها.- اشرح مبدأ AOT وإجراءاتها واحتياطاتها لأولياء أمور الأطفال، وأبلغهم بأن المدة 30 دقيقة.
- اطلب من اثنين من أخصائيي العلاج الطبيعي المحترفين تصوير مقاطع فيديو لحركات الجسم من ثلاث زوايا مختلفة: الأمام والجانب والخلف ، وتصميم ست حركات للجسم لغرض تحسين توازن الأطراف السفلية ووظيفة المشي.
- تنتقل الحركة الأولى من الجلوس إلى الوقوف: حرك الجسم للأمام من وضع الجلوس المستقيم عن طريق رفع الحوض وتمديد مفصل الركبة ، والتحول تدريجيا إلى وضع الوقوف ، ثم الجلوس. قم بإجراء هذا 3x على التوالي (الشكل 2 أ).
- الحركة الثانية هي تمرين الوقوف: حرك وزن الجسم إلى اليسار أو اليمين قدر الإمكان ثم عد إلى الوضع المحايد. قم بتنفيذها 3x بدوره (الشكل 2 ب).
- الحركة الثالثة هي أيضا تمرين ثابت: حرك وزن الجسم للأمام أو للخلف قدر الإمكان ثم عد إلى الوضع المحايد. قم بتنفيذها 3x بدوره (الشكل 2C).
- الحركة الرابعة هي أيضا تمرين دائم: قم بتدوير الجسم إلى اليسار أو اليمين قدر الإمكان ثم العودة إلى الوضع المحايد. قم بتنفيذها 3x بدوره (الشكل 2D).
- الحركة الخامسة هي تمرين الوقوف: المشي جانبيا إلى اليسار أو اليمين ثم العودة إلى الوضع المحايد. قم بتنفيذها 3x بدوره (الشكل 2E).
- الحركة السادسة هي تمرين واقف: بالتناوب خطوة لأعلى أو لأسفل بارتفاع 10 سم بالقدمين اليسرى واليمنى. قم بتنفيذها 3x بدوره (الشكل 2F).
- اجعل الأطفال مجتمعين في غرفة هادئة ويجلسون على بعد 5 أمتار من تلفزيون 86 بوصة في أوضاع مريحة.
- اطلب من أخصائي العلاج الطبيعي شرح حركات الجسم أولا حتى يتمكن الأطفال بعد ذلك من التركيز على مشاهدة الفيديو.
- بعد مشاهدة الفيديو ، اطلب من الأطفال تقليد هذه الحركات.
5. تقييم ما بعد العلاج
ملاحظة: سيتم إكمال العلاج المسبق وتقييم ما بعد العلاج لمدة 12 أسبوعا لكل مريض من قبل نفس طبيب إعادة تأهيل الأطفال.
- بعد 12 أسبوعا من تدابير إعادة التأهيل المختلفة للمجموعات الأربع من الأطفال ، اطلب من طبيب إعادة تأهيل الأطفال نفسه إعادة تقييم الفعالية السريرية ل CSS و PBS و 10 MWS و GMFM والوظيفة الحركية الإجمالية.
- تسجيل رضا أولياء الأمور وملاحظاتهم على خطة العلاج ، بما في ذلك درجة الاستمتاع بالعلاج وتحسين الوعي الذاتي ، وكذلك رغباتهم واقتراحاتهم لمواصلة العلاج.
6. التحليل الإحصائي
- أدخل التركيبة السكانية ، CSS ، PBS ، سرعة المشي 10 أمتار (10MWS) ، GMFM ، وبيانات تقييم المعدل الفعال (٪) في البرنامج للتحليل الإحصائي.
- تحليل بيانات العد باستخدام اختبار χ2 أو طريقة فيشر الدقة الاحتمالية.
- تحديد ما إذا كانت البيانات تتوافق مع التوزيع الطبيعي وتعبر عن البيانات الموزعة بشكل طبيعي كمتوسط ± SD.
- استخدم تحليل انحراف القياس المتكرر للمقارنة بين المجموعات الأربع وقم بإجراء تحليل المقاييس المتكررة للتباين في ظل النموذج المختلط للتحقق مما إذا كانت النتائج ودرجات التباين لكل مجموعة متسقة مع التوزيع الطبيعي تقريبا.
- اعتبر الوقت عاملا داخل المجموعة والتدخل عاملا بين المجموعات. إذا كان هناك أي تفاعل بين هذين العاملين ، فاختبر الفرق بين المجموعات في كل نقطة زمنية عند a = 0.05. إذا لم يكن هناك تأثير تفاعل ، فاختبر التأثير الرئيسي. ضع في اعتبارك أن الفروق ذات دلالة إحصائية عند P < 0.05.
النتائج
تعرض هذه الورقة نتائج 64 طفلا يعانون من SCP (الجدول التكميلي S1 والملف التكميلي 1) ، الذين تم تقسيمهم عشوائيا إلى أربع مجموعات وفقا لطريقة الجدول العددي وأعطيت تدابير إعادة تأهيل مختلفة لمدة 12 أسبوعا. خلال العملية بأكملها ، لم يكن لدى الأطفال المشاركين أي ردود فعل سلبية مثل الصداع والدوخة والنوبات.
ويبين الجدول 1 البيانات الديمغرافية لمجموعات الأطفال الأربع. قبل العلاج ، لم تكن هناك فروق ذات دلالة إحصائية في نسبة الجنس ، والعمر ، والفئة التشنجية للشلل الدماغي ، و GMFCS ، وحاصل النمو GDDS (GDDS DQ) ، واستخدام الأجهزة المساعدة (مقوام القدم في الكاحل أو المشاية) (جميعها P > 0.05).
تمت مقارنة درجات CSS للمجموعات الأربع من الأطفال قبل وبعد العلاج لمدة 12 أسبوعا في الجدول 2. بعد 12 أسبوعا من التدريب ، انخفضت درجات CCS لجميع المجموعات الأربع بشكل ملحوظ ، حيث أظهرت مجموعة التدخل المركب تغييرات أكبر بكثير من المجموعات الثلاث الأخرى. كان تأثير الوقت وتأثير التفاعل بين المجموعات والوقت معنويا (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05).
يتم عرض درجات PBS و 10MWS و GMFM قبل وبعد التدريب لمدة 12 أسبوعا للمجموعات الأربع في الجدول 3 والجدول 4 والجدول 5. مقارنة بدرجات ما قبل التدريب ، زادت درجات PBS و 10MWS و GMFM لجميع المجموعات الأربع بشكل ملحوظ بعد العلاج ، مع تحسن درجات مجموعة التدخل المركب أكثر من غيرها. كان تأثير الوقت وتأثير التفاعل بين المجموعات والوقت معنويا (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05).
يتم تمثيل التأثيرات السريرية على الوظيفة الحركية الإجمالية في جميع المجموعات الأربع من الأطفال في الجدول 6. كان معدل الفعالية الكلي للوظيفة الحركية الإجمالية في مجموعة التدخل المركب 87.50٪ ، وهو أعلى بكثير من المجموعات الثلاث المتبقية (مجموعة rTMS 62.50٪ ، مجموعة AOT 68.75٪ ، المجموعة التقليدية 25.00٪) (χ2 = 13.850 ، P = 0.003).
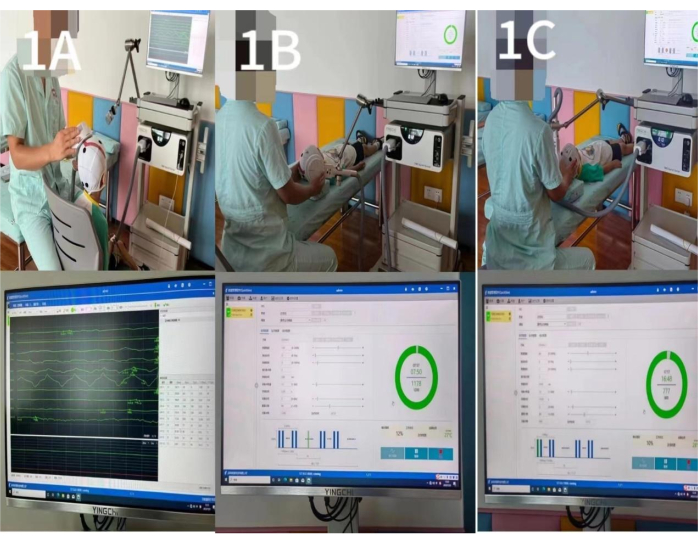
الشكل 1: تحفيز منطقة M1. (أ) تحديد العتبة: تم قياس قيمة RMT عندما كانت المنطقة M1 المقابلة المقابلة للعضلة الخاطف ، والتي تم تحفيزها بنبضة واحدة لتوليد جهد مستثار للحركة. (ب) التحفيز منخفض التردد في منطقة M1 من القشرة الدماغية غير التالفة: كان تردد التحفيز 1 هرتز ، وشدة التحفيز 80٪ RMT ، وكان عدد التحفيز 10 ، واستمر وقت التحفيز لمدة 10 ثوان ، وكان عدد التكرار 80 مرة ، وكان إجمالي عدد النبضات 800. (ج) التحفيز عالي التردد لمنطقة M1 من القشرة الدماغية التالفة: كان تردد التحفيز 5 هرتز ، وكانت شدة التحفيز 100٪ RMT ، وكان عدد التحفيز 15 ، واستمر وقت التحفيز لمدة 3 ثوان ، وكانت أوقات التكرار 80 مرة ، وكان العدد الإجمالي للنبضات 1200. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التدريب على مراقبة العمل. (أ) الحركة الأولى: تحويل الجلوس إلى التوقف. (ب) الحركة الثانية: تحريك وزن الجسم إلى الأيسر. (ج) الحركة الثالثة: تحريك وزن الجسم ذهابا وإيابا. (د) الحركة الرابعة: دوران الجسم الأيسر/الأيمن. (ه) الحركة الخامسة: المشي لليسار/لليمين. (و) الحركة السادسة: الصعود / النزول بالتناوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| (ن = 64 ، س ±) | |||||||||
| بند | المجموعة التقليدية | مجموعة rTMS | مجموعة AOT | مجموعة التدخل المركب | χ2 / F | P | |||
| رقم (ن) | 16 | 16 | 16 | 16 | |||||
| نسبة الجنس (ذكور / إناث) | 10/6 | 10/6 | 13/3 | 9/7 | 2.494 | 0.476 | |||
| العمر (سنة) | 4.44±0.80 | 4.74±0.68 | 4.71±0.54 | 4.63±0.68 | 0.654 | 0.683 | |||
| تصنيف الشلل الدماغي التشنجي (ليجيا التشنجي / الشلل التشنجي التشنجي) | 02-07-2007 | 5/10/1 | 6/9/1 | 5/10/1 | 2.105 | 0.945 | |||
| GMFCS (ن) (المستوى الأول / الثاني / الثالث) | 7/3/6 | 6/5/5 | 8/5/3 | 8/5/3 | 2.750 | 0.868 | |||
| جي دي دي اس دي كيو | 70.06±10.25 | 70.13±9.44 | 71.56±12.58 | 69.25±6.89 | 0.148 | 0.931 | |||
| استخدام الأجهزة المساعدة (ن) نعم / لا | 5/11 | 3/13 | 3/13 | 4/12 | 1.780 | 0.699 | |||
الجدول 1: مقارنة المعلومات الأساسية لمجموعات الأطفال الأربع (ن = 64 ، × ± ثانية). * تحليل التباين أحادي الاتجاه. قبل التدريب ، لم تكن هناك فروق ذات دلالة إحصائية في نسبة الجنس ، والعمر ، والفئة التشنجية للشلل الدماغي ، و GMFCS ، وحاصل نمو GDDS (GDDS DQ) ، واستخدام الأجهزة المساعدة (مقوام القدم في الكاحل أو المشاية) ، مما يشير إلى قابلية المقارنة. الاختصارات: GMFCS = تصنيف الوظيفة الحركية الإجمالية. GDDS DQ = جدول التشخيص التنموي Gesell حاصل النمو.
| مجموعة | رقم (ن) | قبل | بعد | F | P | ||
| المجموعة التقليدية | 16 | 10.63±1.67 | 10.19±1.76 | ||||
| مجموعة rTMS | 16 | 10.88±1.41 | 9.75±1.13 | ||||
| مجموعة AOT | 16 | 10.75±1.13 | 9.75±1.00 | ||||
| مجموعة التدخل المركب | 16 | 10.69±1.01 | 8.88±1.02 | ||||
| عامل المجموعة | 0.774 | 0.513 | |||||
| عامل الوقت | 228.261 | <0.001 | |||||
| عامل المجموعة * عامل الوقت | 15.217 | <0.001 | |||||
الجدول 2: مقارنة درجات CSS في المجموعات الأربع من الأطفال (ن = 64 ، × ± ثانية). بعد العلاج ، أظهرت نتائج ANOVA ذات المقاييس المتكررة أن تأثير الوقت وتأثير التفاعل بين المجموعات والوقت كانا معنويين (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05). الاختصارات: CSS = مقياس التشنج الشامل ؛ rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة ؛ AOT = التدريب على مراقبة العمل.
| مجموعة | رقم (ن) | قبل | بعد | F | P | ||
| المجموعة التقليدية | 16 | 28.25±9.38 | 31.13±9.22 | ||||
| مجموعة rTMS | 16 | 29.44±10.05 | 35.56±9.82 | ||||
| مجموعة AOT | 16 | 29.25±9.84 | 35.94±8.62 | ||||
| مجموعة التدخل المركب | 16 | 29.81±11.59 | 41.88±8.03 | ||||
| عامل المجموعة | 1.12 | 0.348 | |||||
| عامل الوقت | 371.208 | <0.001 | |||||
| عامل المجموعة * عامل الوقت | 27.954 | <0.001 | |||||
الجدول 3: مقارنة درجات PBS في المجموعات الأربع من الأطفال (ن = 64 ، × ± ثانية). بعد العلاج ، أظهرت نتائج ANOVA ذات المقاييس المتكررة أن تأثير الوقت وتأثير التفاعل بين المجموعات والوقت كانا معنويين (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05). الاختصارات: PBS = مقياس توازن الأطفال. rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة ؛ AOT = التدريب على مراقبة العمل.
| مجموعة | رقم (ن) | قبل | بعد | F | P | ||
| مجموعة كونتينشايدنا | 16 | 1.02±0.14 | 1.10±0.16 | ||||
| مجموعة rTMS | 16 | 0.98±0.18 | 1.15±0.16 | ||||
| مجموعة AOT | 16 | 0.99±0.12 | 1.15±0.09 | ||||
| مجموعة التدخل المركب | 16 | 1.02±0.15 | 1.24±0.11 | ||||
| عامل المجموعة | 0.946 | 0.424 | |||||
| عامل الوقت | 501.551 | <0.001 | |||||
| عامل المجموعة * عامل الوقت | 19.275 | <0.001 | |||||
الجدول 4: مقارنة درجات 10MWS في المجموعات الأربع من الأطفال (ن = 64 ، × ± ثانية). بعد العلاج ، أظهرت نتائج ANOVA ذات المقاييس المتكررة أن تأثير الوقت وتأثير التفاعل بين المجموعات والوقت كانا معنويين (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05). الاختصارات: 10MWS = 10 م سرعة المشي ؛ rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة ؛ AOT = التدريب على مراقبة العمل.
| مجموعة | رقم (ن) | قبل | بعد | F | P | ||
| مجموعة كونتينشايدنا | 16 | 46.63±20.05 | 54.00±22.19 | ||||
| مجموعة rTMS | 16 | 48.94±19.96 | 61.94±20.61 | ||||
| مجموعة AOT | 16 | 50.25±15.25 | 63.63±16.40 | ||||
| مجموعة التدخل المركب | 16 | 50.94±18.43 | 75.69±17.86 | ||||
| عامل المجموعة | 1.300 | 0.283 | |||||
| عامل الوقت | 502.502 | <0.001 | |||||
| عامل المجموعة * عامل الوقت | 31.184 | <0.001 | |||||
الجدول 5: مقارنة درجات GMFM في المجموعات الأربع من الأطفال (ن = 64 ، × ± ثانية). بعد العلاج ، أظهرت نتائج ANOVA ذات المقاييس المتكررة أن نتائج ANOVA ذات المقاييس المتكررة أظهرت أن تأثير الوقت وتأثير التفاعل بين المجموعات والوقت كانا معنويين (P < 0.05) ، بينما لم يكن التأثير بين المجموعات معنويا (P > 0.05). الاختصارات: GMFM = مقياس الوظيفة الحركية الإجمالية ؛ rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة ؛ AOT = التدريب على مراقبة العمل.
| مجموعة | رقم | فعالة واضحة | فعال | فعاله | المعدل الفعلي | ||
| المجموعة التقليدية | 16 | 1 | 3 | 12 | 25.00% | ||
| مجموعة rTMS | 16 | 3 | 7 | 6 | 62.50% | ||
| مجموعة AOT | 16 | 2 | 9 | 5 | 68.75% | ||
| مجموعة التدخل المركب | 16 | 7 | 7 | 2 | 87.50% | ||
| χ2 | 13.850 | ||||||
| P | 0.003 | ||||||
| الاختصارات: rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة. AOT = التدريب على مراقبة العمل. | |||||||
الجدول 6: مقارنة الوظيفة الحركية الإجمالية لجميع المجموعات الأربع من الأطفال (ن [٪]). الاختصارات: rTMS = التحفيز المغناطيسي المتكرر عبر الجمجمة. AOT = التدريب على مراقبة العمل.
الملف التكميلي 1: معلومات حالة المريض. تم علاج المريض باستخدام rTMS جنبا إلى جنب مع AOT. بعد 12 أسبوعا من العلاج ، تمت مقارنة بيانات مؤشرات التقييم المختلفة قبل وبعد العلاج لتحديد التأثير السريري للتدخل المشترك على الوظيفة الحركية الإجمالية للمريض. الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي S1: بيانات المريض. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
بالنسبة للأطفال الذين يعانون من SCP ، تؤدي زيادة نشاط الخلايا العصبية γ و α إلى تثبيط مدخلات الجهاز القشري الشوكي ، مما يؤدي إلى زيادة توتر العضلات المعروف باسم التشنج. نظرا لأن تشنجات الأطراف تؤثر بشكل كبير على تطور الوظيفة الحركية للأطراف السفلية للأطفال المصابين ب SCP ، فإن أحد أهداف التدريب الحاسمة هو تقليل التشنج. حاليا ، يتم استخدام استراتيجيات العلاج التدريجي للتخفيف من التشنج ، بما في ذلك تمريض إعادة التأهيل ، والعلاج الطبيعي ، وتطبيق دعامة العظام ، وحقن توكسين البوتولينوم27 ، والعلاجات الدوائية ، والتدخلات الجراحية28. في هذه الدراسة ، تم استخدام تقنيات إعادة التأهيل مثل العلاج بالتمارين الرياضية والعلاج المائي والعلاج بالتدليك و rTMS لتخفيف التشنجات لدى الأطفال المصابين بالتكثيف المستدام للتكنولوجيا. ويبين الجدول 2 أن درجات التحفيز المغناطيسي المتكرر عبر الجمجمة في مجموعة التدخل المركب أظهرت تحسنا أكبر من المجموعات الثلاث الأخرى، مما يشير إلى أن التدخل المشترك ل rTMS وAOT أكثر فعالية في تخفيف التشنج لدى الأطفال المصابين بالتكثيف المستدام للأفراد. اقترح Rajak et al.12 أن زيادة وتيرة علاج rTMS يمكن أن يساعد في تقليل التشنجات العضلية لدى أطفال الشلل الدماغي وتسهيل تطوير الوظيفة الحركية. عالج Gupta et al.29 20 حالة من مرضى الشلل الدماغي الذين يعانون من rTMS عند 5 هرتز و 10 هرتز لمدة 20 يوما ، مما حفز القشرة الحركية للدماغ ، وأظهرت النتائج أن توتر العضلات في علاج rTMS كان أقل بكثير من المجموعة التقليدية. كانت هذه النتيجة متسقة مع نتيجة الدراسة الحالية التي كانت فيها درجات CSS للمجموعة التجريبية أفضل بكثير من تلك الخاصة بالمجموعات الثلاث الأخرى من الأطفال.
قبل قبول علاج التحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS)، كان من الضروري قياس العتبة الحركية للأطفال أولا لتحديد شدة علاجهم. بالنسبة للأطفال المصابين بالشلل النصفي التشنجي ، تم تقييم الجانب الصحي أولا ، ثم الجانب المصاب. تم استخدام العتبة الحركية للجانب الصحي لتحديد شدة العلاج. أثناء علاج rTMS ، يجب ارتداء أغطية تحديد المواقع بشكل صحيح ، ويجب أن يتزامن مركز تحفيز الملف مع النقطة الثابتة التي يحددها الملف ، ويجب وضع الملف عند 45 درجة مع فروة الرأس. في هذه الدراسة ، تم اختيار منطقة M1 كموقع تحفيز لتحسين اضطرابات حركة الأطراف السفلية. يمكن أن يقلل التحفيز منخفض التردد بتردد 1 هرتز من تدفق الدم الدماغي واستثارة جانب التحفيز ويزيد من استثارة الجانب المقابل. يمكن أن يؤدي التحفيز عالي التردد بتردد 5 هرتز إلى تحسين استثارة القشرة للجانب المحفز بشكل مباشر. الهدف هو تحقيق تثبيط أفضل بين نصف الكرة الأرضية ، والتناوب بين التحفيز منخفض وعالي التردد يفضي إلى استعادة الوظيفة الحركية.
تمثل AOT نهجا واعدا لتدخل الشلل الدماغي ، واستعادة شبكات الدماغ التالفة لإعادة تأسيس الوظيفة الحركية كعامل مساعد للعلاج الطبيعي15,30. وفقا لهذه الآلية ، استكشف العلماء تآزر AOT مع العلاج الناجم عن القيود6 ، والتدريب على اهتزاز الجسم بالكامل31 ، وأنظمة واجهة الدماغ الحاسوبية32 في إعادة تأهيل الشلل الدماغي. يجب أن تقدم AOT إجراءات ذات مغزى للمراقبين وتتطلب من الأطفال أن يكون لديهم قدرة معرفية معينة لتقليد الإجراءات في الفيديو. كانت النقطة الرئيسية في AOT هي الملاحظة وليس تنفيذ الإجراءات. نظرا لأن اضطرابات التوازن يمكن أن تؤثر على المشي المستقل والأنشطة اليومية للأطفال الذين يعانون من SCP ، فإن تعزيز قدرتهم على التحكم في التوازن كان مهما بشكل خاص. تضمنت هذه الدراسة برامج AOT التي تتضمن حركات وظيفية لتعزيز توازن الأطراف السفلية وقدرات المشي. شاهد الأطفال الفيديو باهتمام ، وأبلغهم المعالجون الفيزيائيون بمزيد من التفاصيل حول الإجراءات المعروضة في الفيديو وأرشدوا الأطفال وأشرفوا عليهم لأداء الإجراءات بشكل صحيح. أثناء التدريب ، يحتاج أخصائيو العلاج الطبيعي إلى توضيح تفاصيل الحركة للأطفال واعتماد حوافز لضمان المشاركة التلقائية. حققت AOT تأثيرات علاجية جيدة في بيئات إعادة التأهيل عن بعد للأطفال المصابين بالشلل الدماغي بسبب تشغيلهاالبسيط 33. لذلك ، يتم تشجيع الآباء على تنفيذ تدريب منزلي مكثف لتعزيز فعالية التدريب. وفي الوقت نفسه ، ترتبط فعالية التدريب ارتباطا وثيقا بالبرنامج التدريبي الذي يلتزم به المرضى أثناء مراقبة و / أو تنفيذ الحركات. سيتم إنتاج نتائج مختلفة للتعلم والأداء بناء على مستويات الانتباه المختلفة التي يتم دفعها لمراقبة موارد التدريب34. لم يجد Kim et al.35 أي فرق جوهري عند مقارنة نتائج تدخلات AOT قصيرة وطويلة الأجل.
في هذه الدراسة، وعلى أساس إعادة التأهيل التقليدية، تم إعطاء آثار أربع طرق مختلفة للتدخل، وهي تدابير إعادة التأهيل التقليدية وحدها، و rTMS، و AOT، والتدخل المشترك ل rTMS و AOT، على الوظيفة الحركية الإجمالية للأطفال الذين يعانون من SCP على التوالي لاستكشاف ما إذا كان التدخل المشترك له تأثير تآزري. يوضح الجدول 3 والجدول 4 والجدول 5 أنه بعد 12 أسبوعا من العلاج ، تحسنت درجات PBS و 10MWS و GMFM لجميع المجموعات. ومع ذلك ، أظهرت مجموعة التدخل المشترك أكبر تحسن في درجات PBS و 10MWS و GMFM مقارنة بالمجموعات التقليدية و rTMS و AOT. علاوة على ذلك ، كان المعدل الفعال للوظيفة الحركية الإجمالية أعلى بكثير أيضا. يوضح الجدول 6 أن المعدل الفعال للوظيفة الحركية الإجمالية في مجموعة التدخل المشترك كان 87.50٪ ، متجاوزا المجموعة التقليدية (25.00٪) ، ومجموعة rTMS (62.50٪) ، ومجموعة AOT (68.75٪) (χ2 = 13.850 ، P = 0.003) ، مما يشير إلى أن التدخل المشترك ل rTMS و AOT أكثر فعالية في تحسين الوظيفة الحركية للأطفال المصابين بالتكثيف المستدام للتكنولوجيا. قد تكون آليات التنظيم: أولا ، موقع rTMS هو منطقة M1 في المنطقة الحركية للأطراف السفلية للقشرة الدماغية ، وهي قريبة من المنطقة التي تنشط فيها AOT MNS. تعمل مراقبة الحركة وتنفيذها على تقوية الاتصال بين القشرة الحركية ومنطقة M1 من خلال MNS36. ثانيا ، أكد Sun et al.37أن rTMS ينظم استثارة القشرة الدماغية المستهدفة عن طريق تطبيق مجال مغناطيسي على المنطقة الدماغية المستهدفة لتوليد تيار حثي ، والذي يمكن أن ينتشر على طول المسالك القشرية الشوكية والأعصاب الحركية الطرفية ، مما يؤدي إلى استجابات العضلات التي تعزز استعادة الوظيفة الحركية للأطراف. يمكن أن تزود AOT الأطفال بالخبرة المتوقعة والتحضير للعمل من خلال مراقبة الفيديو أولا ، وتعزيز نشاط الشبكة العصبية المعتمد على المهمة عند أداء نفس المهمة38. ثالثا ، يحفز تحفيز rTMS للمناطق القشرية الحركية الجانبية التنشيط عبر المشبكي للدوائر تحت القشرية عبر التيارات المستحثة ، مما ينتج عنه نشاط تشنجي حركي وعضلي منخفض لإنشاء أنماط حركة صحيحة39. يمكن ملاحظة مقاطع الفيديو الإجرائية لبرنامج AOT بشكل متكرر وفي وقت واحد لتعزيز الذاكرة الحركية وتعزيز إعادة تشكيل القشرة الدماغية من خلال التنفيذ المتكرر للبرنامج40. يمكن للتدخل المشترك أن ينظم النشاط القشري بشكل تآزري ، ويزيد من استثارة القشرة الحركية وتوظيف الوحدات الحركية ، ويقلل من التشنج وفرط المنعكسات العضلية ، ويعزز تأثير التفاعل المتبادل. لهذه الأسباب، قد يكون للتحفيز المغناطيسي المتكرر عبر الجمجمة (rTMS) مع AOT تأثير تآزري لتحسين التغيرات العصبية وتحسين استعادة الوظيفة الحركية.
يظهر الجمع بين rTMS و AOT كاستراتيجية فعالة لإعادة التأهيل الفردي لخلل وظيفي في الأطراف السفلية لدى الأطفال المصابين بالتكثيف المستدام للسرطان ، مما يحسن التوازن والوظيفة الحركية. هناك أيضا أوجه قصور في هذه الدراسة: قد تكون تأثيرات الدواء الوهمي موجودة ل rTMS حيث لم يتم استخدام حالة rTMS الوهمية. كانت معظم طرق التقييم المستخدمة في الدراسة عبارة عن مقاييس تقييم إعادة التأهيل ، ولم يتم تطبيق أي تقييم موضوعي بالتصوير مثل الفيزيولوجيا العصبية أو تخطيط كهربية الدماغ أو التصوير بالرنين المغناطيسي الوظيفي. إلى جانب ذلك، هناك حاجة إلى دراسات سريرية واسعة النطاق وطويلة الأجل وتجارب معشاة ذات شواهد مع تقييم فسيولوجي عصبي أو تصويري موضوعي للحصول على معلمات علاج موحدة للعلاج ب rTMS و AOT أو لتحديد التأثير العلاجي.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذه الدراسة بتمويل من مستشفى Xiangya Boai لإعادة التأهيل.
Materials
| Name | Company | Catalog Number | Comments |
| K6 multimedia scene interactive training system | Hunan Le Jiekang technology Co., LTD | Program implementation | |
| KLW-SLL type spa machine for children | Nanjing Kanglongwei Technology Industrial Co., LTD | Conventional therapy | |
| Pulse magnetic field stimulator model YRD CCY-II | Shenzhen Yingzhi technology Co., LTD | Program implementation | |
| SPSS26 software | IBM | Statistic analysis |
References
- Sadowska, M., Sarecka-Hujar, B., Kopyta, I. Cerebral palsy: current opinions on definition, epidemiology, risk factors, classification and treatment options. Neuropsychiatric Dis Treat. 16, 1505-1518 (2020).
- Alpay, S. Z., Kim, S. K., Oh, K. J., Graham, S. F. Advances in cerebral palsy biomarkers. Adv Clin Chem. 100, 139-169 (2016).
- Paul, S., Nahar, A., Bhagawati, M., Kunwar, A. J. A review on recent advances of cerebral palsy. Oxid Med Cell Longev. 2022, 2622310 (2022).
- Huang, C., et al. Efficacy and safety of core stability training on gait of children with cerebral palsy: A protocol for a systematic review and meta-analysis. Medicine. 99 (2), e18609 (2020).
- Kwon, H. Y., Ahn, S. Y. Effect of task-oriented training and high-variability practice on gross motor performance and activities of daily living in children with spastic diplegia. J Phys Ther Sci. 28 (10), 2843-2848 (2016).
- Jamali, A. R., Amini, M. The effects of constraint-induced movement therapy on functions of cerebral palsy children. Iran J Child Neurol. 12 (4), 16-27 (2018).
- Park, E. J., Baek, S. H., Park, S. Systematic review of the effects of mirror therapy in children with cerebral palsy. J Phys Ther Sci. 28 (11), 3227-3231 (2016).
- Fan, J., et al. The effectiveness and safety of repetitive transcranial magnetic stimulation on spasticity after upper motor neuron injury: A systematic review and meta-analysis. Front Neural Circuits. 16, 973561 (2022).
- Zewdie, E., et al. Safety and tolerability of transcranial magnetic and direct current stimulation in children: Prospective single center evidence from 3.5 million stimulations. Brain Stimul. 13 (3), 565-575 (2020).
- Dadashi, F., et al. The effects of repetitive transcranial magnetic stimulation (rTMS) on balance control in children with cerebral palsy. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 5241-5244 (2019).
- Feng, J. Y., et al. Effect of infra-low-frequency transcranial magnetic stimulation on motor function in children with spastic cerebral palsy. Chinese Journal of Contemporary Pediatrics. 15 (3), 187-191 (2013).
- Rajak, B. L., Gupta, M., Bhatia, D., Mukherjee, A. Increasing number of therapy sessions of repetitive transcranial magnetic stimulation improves motor development by reducing muscle spasticity in cerebral palsy children. Ann Indian Acad Neurol. 22 (3), 302-307 (2019).
- Novak, I., et al. State of the evidence traffic lights 2019: systematic review of interventions for preventing and treating children with cerebral palsy. Curr Neurol Neurosci Rep. 20 (2), 3 (2020).
- Buchignani, B., et al. Action observation training for rehabilitation in brain injuries: a systematic review and meta-analysis. BMC Neurol. 19 (1), 344 (2019).
- Buccino, G. Action observation treatment: a novel tool in neurorehabilitation. Philos Trans R Soc Lond B Biol Sci. 369 (1644), 20130185 (2014).
- Lee, H. J., Kim, Y. M., Lee, D. K. The effects of action observation training and mirror therapy on gait and balance in stroke patients. J Phys Ther Sci. 29 (3), 523-526 (2017).
- Peng, T. H., et al. Action observation therapy for improving arm function, walking ability, and daily activity performance after stroke: a systematic review and meta-analysis. Clin Rehabil. 33 (8), 1277-1285 (2019).
- Fan, T. L., et al. Effects of action observation therapy based on mirror neuron theoryon the balance and walking ability of children with cerebral palsy. Chin J Child Health Care. 31 (2), 220-224 (2023).
- Noh, J. S., Lim, J. H., Choi, T. W., Jang, S. G., Pyun, S. B. Effects and safety of combined rTMS and action observation for recovery of function in the upper extremities in stroke patients: A randomized controlled trial. Restor Neurol Neurosci. 37 (3), 219-230 (2019).
- Parvin, S., et al. Therapeutic effects of repetitive transcranial magnetic stimulation on corticospinal tract activities and neuromuscular properties in children with cerebral palsy. Annu Int Conf IEEE Eng Med Biol Soc. 2018, 2218-2221 (2018).
- Children Rehabilitation Committee of China Rehabilitation Medical Association, China Rehabilitation Association for Disabled Children Cerebral Palsy Rehabilitation Committee, Chinese medical doctor association pediatric rehabilitation committee. & Chinese rehabilitation Guidelines for Cerebral Palsy (2022) Editorial board. Chinese Rehabilitation Guidelines for Cerebral Palsy (2022) Chapter 1: Generality. Chin J Appl Clin Pediatr. 37 (12), 887-892 (2022).
- Subspecialty Group of Rehabilitation, t. S. o. P.C. M. A. Rehabilitation strategy and recommendation for motor dysfunction in children with cerebral palsy. Zhonghua Er Ke Za Zhi. 58 (2), 91-95 (2020).
- Alimi, L., Kalantari, M., Nazeri, A. R., Akbarzade, B. A. Test-retest & inter-rater reliability of Persian version of Pediatric Balance Scale in children with spastic cerebral palsy. Iran J Child Neurol. 13 (4), 163-171 (2019).
- Thompson, P., et al. Test-retest reliability of the 10-metre fast walk test and 6-minute walk test in ambulatory school-aged children with cerebral palsy. Dev Med Child Neurol. 50 (5), 370-376 (2008).
- Yang, Z., Qiao, L., He, J., Zhao, X., Zhang, M. Effects of repetitive transcranial magnetic stimulation combined with functional electrical stimulation on hand function of stroke: A randomized controlled trial. NeuroRehabilitation. 51 (2), 283-289 (2022).
- Li, X., et al. Effect of virtual reality combined with repetitive transcranial magnetic stimulation on musculoskeletal pain and motor development in children with spastic cerebral palsy: a protocol for a randomized controlled clinical trial. BMC Neurology. 23 (1), 339 (2023).
- Multani, I., Manji, J., Hastings-Ison, T., Khot, A., Graham, K. Botulinum toxin in the management of children with cerebral palsy. Paediatr Drugs. 21 (4), 261-281 (2019).
- Volpon Santos, M., Carneiro, V. M., Oliveira, P., Caldas, C. A. T., Machado, H. R. Surgical results of selective dorsal rhizotomy for the treatment of spastic cerebral palsy. J Pediatr Neurosci. 16 (1), 24-29 (2021).
- Gupta, M., Rajak, B. L., Bhatia, D., Mukherjee, A. Neuromodulatory effect of repetitive transcranial magnetic stimulation pulses on functional motor performances of spastic cerebral palsy children. J Med Eng Technol. 42 (5), 352-358 (2018).
- Abdelhaleem, N., et al. Effect of action observation therapy on motor function in children with cerebral palsy: a systematic review of randomized controlled trials with meta-analysis. Clin Rehabil. 35 (1), 51-63 (2021).
- Jung, Y., Chung, E. J., Chun, H. L., Lee, B. H. Effects of whole-body vibration combined with action observation on gross motor function, balance, and gait in children with spastic cerebral palsy: a preliminary study. J Exerc Rehabil. 16 (3), 249-257 (2020).
- Rossi, F., et al. Combining action observation treatment with a brain-computer interface system: perspectives on neurorehabilitation. Sensors (Basel). 21 (24), 8504 (2021).
- Beani, E., Menici, V., Ferrari, A., Cioni, G., Sgandurra, G. Feasibility of a home-based action observation training for children with unilateral cerebral palsy: an explorative atudy. Front Neurol. 11, 16 (2020).
- Carson, H. J., Collins, D. J. Commentary: Motor imagery during action observation: a brief review of evidence, theory and future research opportunities. Front Hum Neurosci. 11, 25 (2017).
- Kim, D. H., An, D. H., Yoo, W. G. Effects of live and video form action observation training on upper limb function in children with hemiparetic cerebral palsy. Technol Health Care. 26 (3), 437-443 (2018).
- Qi, F., Nitsche, M. A., Ren, X., Wang, D., Wang, L. Top-down and bottom-up stimulation techniques combined with action observation treatment in stroke rehabilitation: a perspective. Front Neurol. 14, 1156987 (2023).
- Sun, Y. Y., et al. Effects of repetitive transcranial magnetic stimulation on motor function and language ability in cerebral palsy: A systematic review and meta-analysis. Front Pediatr. 11, 835472 (2023).
- Jeong, Y. A., Lee, B. H. Effect of action observation training on spasticity, gross motor function, and balance in children with diplegia cerebral palsy. Children (Basel). 7 (6), 64 (2020).
- Gupta, M., Lal Rajak, B., Bhatia, D., Mukherjee, A. Effect of r-TMS over standard therapy in decreasing muscle tone of spastic cerebral palsy patients. J Med Eng Technol. 40 (4), 210-216 (2016).
- Ryan, D., et al. Effect of action observation therapy in the rehabilitation of neurologic and musculoskeletal conditions: a systematic review. Arch Rehabil Res Clin Transl. 3 (1), 100106 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved