Method Article
Erişkin Sıçanlarda Oküler Terapötik Uygulama ve İleri Doku Alımı
Bu Makalede
Özet
Bu çalışma, terapötiklerin yetişkin sıçanın retina ve optik sinirlerine verilmesi için bir metodoloji sunmaktadır. Ek olarak, yetişkin bir sıçanda optik sinir ve retinanın yukarıdan aşağıya blok koleksiyonu için benzersiz bir doku elde etme yöntemi tanıtılmıştır.
Özet
Retina ve optik sinir de dahil olmak üzere gözün arka segmentine terapötik uygulama, kan-beyin ve kan-retina bariyerlerinin varlığı ile karmaşıklaşır. Sıçanlar gibi küçük hayvan modelleri, çeşitli oküler patolojileri incelemek için kullanılır. Arka göze terapötik uygulama zor olsa da, bunu başarmak, birçoğu translasyonel alaka düzeyi için küçük hayvan modellerinde doğrulama gerektiren oküler bozuklukların tedavisi için çok önemlidir. Bu nedenle, iki posterior terapötik uygulama tekniği sunulmaktadır: yetişkin sıçanlarda kullanım için intravitreal enjeksiyon (IVI) ve retrobulbar enjeksiyon (RBI). Ek olarak, çeşitli histolojik ve moleküler analiz teknikleri için gözlerin ve optik sinirlerin en blok çıkarılması için bir yöntem tanıtılmıştır. Diseksiyon protokolü, retina ve optik sinir dokularında ölüm sonrası yaralanmayı en aza indirirken nöro-görsel sistemin tam olarak gözlemlenmesini sağlar. Terapötik siklosporinin retina ve optik sinire başarılı bir şekilde verilmesi, hem IVI hem de RBI kullanılarak enjeksiyondan yirmi dört saat sonra gözlenen saptanabilir konsantrasyonlarla elde edildi. Ayrıca, en blok retina ve sinir örnekleri, tam göz histolojik doku analizi için başarıyla çıkarıldı, bu da retinanın ve daha geniş nöro-görsel sistemin kapsamlı bir şekilde gözlemlenmesini kolaylaştırdı.
Giriş
Gözünkarmaşık anatomisi 1,2, özellikle kan-retina bariyerinin (BRB) varlığı nedeniyle retina ve optik sinire terapötik iletmek inanılmaz derecede zordur3,4,5. BRB, retinayı sistemik dolaşım istilasından korumaya hizmet eder, ancak sistemik terapötik dolaşım genellikle BRB6,7 tarafından bloke edildiğinden, terapötik uygulamaya karşı zorlu bir rakiptir. Küçük lipofilik moleküller BRB'den kolayca yayılabilir, ancak daha büyük ve hidrofilik moleküllerin retinaya erişmesi daha zordur6. İntravitreal (IVI) ve retrobulbar (RBI) enjeksiyonlar, ilaçların oküler dokulara verilmesini sağlayarak BRB'nin getirdiği sınırlamaların üstesinden gelir. IVI, terapötiklerin gözün iç ortamına uygulanmasıyla umut verici bir uzlaşma görevi görür 8,9. Bu yöntem, ilacın vitreustan geçmesini, böylece BRB'yi atlamasını ve optik sinire7 ulaşmak için retina ve koroidden yayılmasını gerektirir. RBI, gözün arkasından retrobulbar boşluğuna10 iletilir. Terapötikler, retrobulbar boşluktaki dokular ve bezler yoluyla difüzyon yoluyla verilebilir ve doğrudan retinaya girmeden optik siniri ve çevresindeki yapıları etkiler, bu da BRB'nin bütünlüğünü korur. İlaçları doğrudan veya dolaylı olarak göze vererek, hem intravitreal hem de retrobulbar enjeksiyonlar, terapötik ilacın daha yüksek lokal konsantrasyonlarını elde edebilir ve bu da topikal veya sistemik uygulamaya (oral veya intravenöz) kıyasla etkinliğini artırır2. Bu, birçok oküler hastalıkta görüldüğü gibi hızlı etki veya yüksek etki gerektiren tedaviler için özellikle önemlidir. Hedefe yönelik uygulama aynı zamanda vücudun geri kalanının ilaca maruz kalmasını sınırlar, bu da hedef dışı etki riskini azaltır ve ilaçlar topikal, oral veya intravenöz olarak uygulandığında ortaya çıkabilecek olası olumsuz etkilerin en aza indirilmesine yardımcı olur11.
Subkonjonktival, posterior subtenon ve subretinal gibi diğer perioküler enjeksiyonların kendi yararları ve sınırlamaları vardır 2,5. Posterior subtenon enjeksiyonlarının oküler dokulara yüksek ilaç konsantrasyonları sağladığı gözlenmiştir; Bununla birlikte, subtenon enjeksiyonu skleral'e orbital vaskülartürdendaha yakındır 5,12. Buna karşılık, RBI, terapötiği optik sinire posterior subtenon veya subkonjonktival13'ten daha yakın yerleştirir. Bu, optik sinir patolojilerinin RBI ile verilen terapötikleri diğer perioküler enjeksiyon tiplerine göre tercih ettiği anlamına gelebilir. Posterior subtenon enjeksiyonlarının şaşılık, hifema ve yüksek göz içi basıncı gibi ilişkili riskleri vardır5. Yüksek göz içi basıncı ayrıca IVI, subkonjonktival ve subretinal enjeksiyonlarda bildirilen bir risk faktörüdür2. Bu enjeksiyon tipleri, istenen terapötik etkiyi elde etmek için genellikle tekrarlayan dozlama gerektirir2. Subretinal enjeksiyonlar, subkonjonktival enjeksiyonlar ve IVI ile ilişkili diğer risk faktörleri arasında katarakt oluşumu, retina kanaması, retina dekolmanı ve iltihaplanmabulunur 2. Bu IVI, subretinal enjeksiyonlar ve subkonjonktival enjeksiyonlar, RBI enjeksiyonlarından daha invazivdir, çünkü bu enjeksiyonlar göz içi2'dir. RBI, iğneyi doğrudan göz küresine girmeden terapötiği retrobulbar boşluğa yerleştirdiği için daha az invaziv olarak kabul edilebilir. Topikal uygulama gibi diğer daha az invaziv terapötik uygulama stratejileri, ilacın %5'inden daha azı oküler yüzeyde tutularak yeterli ilaç dağıtımının gerisinde kalmaktadır 2,5.
IVI, terapötik ajanları doğrudan gözün arka segmentine verme yeteneği nedeniyle kullanılan klinik öncesi modellerde öne çıkan bir tekniktir. IVI, ilacı doğrudan vitreus mizahına iletir ve bu da onu lokalize tedavi için tercih edilen bir uygulama tekniği haline getirir14. IVI tekniği, terapötik kişinin, ilacın retinaya nüfuz etmesinin önünde yaygın bir engel olan kan-retina bariyerini atlamasına izin verir14. IVI, inflamasyon ve oküler yapılara zarar verme fırsatı sunar, bu nedenle prosedüre titiz bir şekilde uyulmalıdır14. Retina dekolmanı ve katarakt oluşumunu en aza indirmek için Chiu ve ark. lens, retina, oküler kas ve damarlardan kaçınarak par plana seviyesinde 45 derecelik bir eğim yerleştirme ve enjeksiyonu vurgulayan bir IVI yaklaşımını tanımlamaktadır15. Bu teknikte, terapötik uygulama için nazal skleraya 30 G'lik bir iğne yerleştirilir15. IVI, invaziv doğası nedeniyle hala risklerle ilişkilidir. Potansiyel riskler arasında retina dekolmanı, katarakt oluşumu, endoftalmi veya kanamabulunur 16. IVI tekniklerinin invaziv doğası, Ikjong Park ve ark.16 tarafından domuz gözleri üzerinde yapılan bir deneyde gösterildiği gibi göz içi basıncını da arttırır. Çalışma, iğne yerleştirme ve sıvı enjeksiyonunun farklı aşamaları sırasında göz içi basıncındaki değişiklikleri göstermektedir. İşlem sırasında göz içi basıncında önemli farklılıklar olduğunu bildirirler16.
RBI'ler, önceki çalışmalarda kemirgenlere terapötik bir uygulama aracı olarak başarıyla kullanılmıştır. Böyle bir çalışma, RBI17 aracılığıyla verilen çeşitli prostaglandin analoglarının etkilerini karşılaştırdı. Albino sıçanlara, inferior forniksin lateral alanından 45 derecelik bir açıyla yerleştirilen 26 G'lik bir iğne 0.1 mL enjekte edilmiş bir RBI verildi17. Bu çalışmada kullanılan protokol, sıçanların intraperitoneal (IP) kloralhidrat18 enjeksiyonu yoluyla uyuşturulduğu daha önce tarif edilen bir yöntemden uyarlanmıştır. Sıçanlar üzerinde yapılan bir başka çalışmada, topikal damlalar ile retrobulbar enjeksiyonları karşılaştırılmıştır19. Sıçanlar, bir IP ketamin / ksilazin enjeksiyonu ile uyuşturuldu ve RBI, 30 G'lik bir iğneile verildi 19. Daha önce tartışılan sedasyon yöntemlerinin aksine, RBI'nin orbital yağ üzerindeki etkilerini gözlemleyen bir çalışma, RBI20'den önce sıçanları sakinleştirmek için inhalasyonel izofluran kullandı. Bu çalışmalar, hangi anesteziklerin ve iğne özelliklerinin başarılı olabileceğine dair fikir verirken, prosedür sırasında hayvanların konumlandırılması ve ele alınması tartışılmamıştır.
Farelerde yapılan çeşitli çalışmalar, terapötik uygulama yöntemleri için RBI'leri de yürütür. Bir çalışma, nefrotik sendromu başarılı bir şekilde indüklemek için RBI'yi lateral kuyruk ven enjeksiyonu ile karşılaştırdı21. İkinci bir çalışmada, kardiyak görüntüleme için kontrast madde uygulanmasında aynı iki enjeksiyon tekniği de karşılaştırılmıştır22. Fareler inhalasyon izofluran ile uyuşturuldu ve gözün medial tarafınaenjekte edildi 22. Her iki çalışma da RBI yöntemini daha önce yazılmış bir protokolden uyarladı. Bu protokolün enjeksiyonlarını retro-orbital olarak adlandırdığını, ancak enjeksiyon yerini gözün arkasındaki retrobulbar boşluk olarak tanımladığını belirtmek önemlidir. Bu protokolün yazarları, farelerin hızlı aktivasyon ve iyileşme süresine dikkat çekerek, tercih edilen bir sedasyon yöntemi olarak inhalasyonel izofluranı kullandılar23. Bir RBI için, göz çevresindeki cilde baskı uygulanarak göz kısmen yuvadan dışarı çıkmıştı23. Daha sonra iğne medial kantus eğim tarafı aşağı bakacak şekilde 30 derecelik bir açıyla sokuldu ve göz tabanınaulaşana kadar sokuldu 23. Kazara kan akışı tıkanması veya trakeal çökme meydana gelebileceğinden, hayvana baskı uygularken dikkatli olunmalıdır23. Enjektör ayrıca yerleştirildiğinde iğne ucuna karşı kördür ve bu nedenle göze zarar vermek ilişkili bir risktir. 23 Terapötik uygulama sırasında göze zarar vermek bu deneyde kritik bir risktir, çünkü ek yaralanmalara neden olmak çalışmanın sonuçlarını doğrudan zayıflatır. Ayrıca, daha önce tarif edilen konumlandırma ve taşıma tekniğinin fareler üzerinde gerçekleştirildiği ve sıçanlara uygulanabilirlik hakkında yorumlar içermediği de belirtilmelidir.
Optik sinir ve retinanın çıkarılmasının denendiği birçok yol vardır. Böyle bir yöntem, sağlam bir optik kiazmayı koruyarak optik sinirlerin ve gözlerin blok halinde çıkarılmasını araştırdı24. Bu yöntem, mevcut çalışma ile en karşılaştırılabilir olanıdır, çünkü tek tek gözler ve optik sinirler de en blok çıkarılması için korunur; Bununla birlikte, optik kiazma ayrılır. Bu prosedürde dikkatli olmak, prosedürün karmaşıklığı nedeniyle son derece önemli olacaktır. Mevcut yöntemde diseksiyona kaudal kafatası üzerinden başlıyoruz ve optik sinirlere verilen hasarı sınırlayacak ve tüm sinirin sağlam kalmasına izin verecek şekilde erişim sağlamak için rostral olarak çalışıyoruz. Ayrıca, sinirin sağlam ve göze bağlı tutulması, gömme işlemi için çok önemlidir, çünkü sinirin her bir parçasındaki hasar farklı bir patolojik gözleme karşılık gelebilir24. Optik sinirin oryantasyonu, nasıl gömüldüğünün histolojik analiz için önemli olabilecek farklı kesitlere izin vermesi nedeniyle dikkate alınması önemlidir.
Küçük hayvan laboratuvarı oftalmik ameliyat masası (SALOOT, bir oftalmik cerrahi platformu) olarak bilinen özel yapım bir cihaz, anestezi sağlamak ve hayvanı oküler terapötik enjeksiyonlar için sabit bir pozisyonda tutmak için bir dizi 3D baskılı malzemeden oluşur. SALOOT tasarımı, oftalmik prosedürler için baş ve oküler yapıların stabilitesine izin verir, bu da operasyonların hızını ve tekrarlanabilirliğini artırırken, gaz anestezisi verilmesine ve ekshalasyon partiküllerinin atılmasına izin verir. SALOOT, sıçan gövdesini tutmak için içbükey bir redüksiyon içeren üç boyutlu bir baskılı bloktur ve hayvanın başını bir izofluran girişli bir burun konisine tutmak için ön tarafta daha dar bir bölge bulunur. Burun konisinin altında küçük bir rezervuar ve egzoz çıkışı bulunur. Terapötik oküler uygulama ve hassas oküler doku alımı için aşağıdaki yöntemler geliştirilmiştir; Oküler travma sonrası dokuları incelemek için tasarlanmıştır, bu nedenle bulguların karışık yorumlanmasını önlemek için travma, enjeksiyon, tedavi ve diseksiyonun etkilerini tanımlamak çok önemlidir.
Bu makalede, erişkin sıçanlarda kullanılmak üzere intravitreal ve retrobulbar enjeksiyonlar olmak üzere iki oküler terapötik enjeksiyon yöntemi sunulmaktadır. Ek olarak, erişkin bir sıçandan sağlam optik sinirin ve retinanın en blok olarak çıkarılması için bir doku elde etme yöntemi sunulmaktadır. Bu teknikler, indüklenmiş patolojinin oküler ve peri-oküler etkilerinin araştırılmasını ve tedavisini sağlar.
Protokol
Tüm deneyler, Oftalmik ve Görsel Araştırmalarda Hayvanların Kullanımı için ARVO Bildirimine uygun olarak yürütüldü ve Ohio Eyalet Üniversitesi'ndeki kurumsal hayvan bakımı ve kullanımı komitesi tarafından onaylandı. Bu çalışma için ~ 200 g ağırlığında ve yaklaşık 2 aylık erkek Sprague Dawley sıçanları kullanıldı25. Reaktiflerin ve kullanılan ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. İntravitreal enjeksiyon (IVI)
- İzofluran ve atık uçlarını SALOOT bağlantı portlarına takın. Oftalmik ve Görsel Araştırmalarda Hayvanların Kullanımına İlişkin ARVO Beyanı ve onaylanmış IACUC protokolünü izleyerek standart izofluran prosedürlerini kullanarak hayvanı uyuşturun.
NOT: Alternatif olarak, hayvan zaten başka bir oftalmik test seansından anestezi altındaysa (ör., ketamin / ksilazin karışımı; 90 mg / kg ketamin ve 10 mg / kg ksilazin), hayvanı oftalmik cerrahi platformuna aktarın ve yeterli anestezi derinliğinin korunmasını sağlamak için anesteziyi izofluran (3 oksijen: 3 izofluran oranı) ile titre edin. - Anestezi uygulanmış hayvanla birlikte oftalmik cerrahi platformunu canlı bir ameliyat mikroskobu altına yerleştirin. Pedal çekme refleksi ile anestezik derinliği değerlendirin.
- Ameliyat edilen göze veya gözlere bir ila iki damla% 0.5 tetrakain hidroklorür oftalmik solüsyon yerleştirin. Herhangi bir manipülasyon yapılmayacaksa karşı göze %0.3 hipromelloz gibi kayganlaştırıcı topikal oftalmik merhem uygulayın.
- Ardından, oküler yüzeye bir ila iki damla% 5 povidon-iyot kullanın ve pamuklu bir bez kullanarak göz çevresindeki cilde povidon-iyot uygulayın.
- 10 mm uzunluğunda ve 15 derecelik açıyla stil 4 uçlu 33 G iğneli 10 μL'lik bir şırınga kullanın ve% 0.9 bakteriyostatik sodyum klorür çekin. İğneyi sıcak boncuk sterilizatörüne daldırmadan önce şırıngayı ve iğneyi tuzlu su ile yıkayın.
- Devam etmeden önce soğumasını bekleyin. İğne soğuduktan sonra, ilgilenilen terapötiği istenen miktara (4 μL) kadar çizin.
NOT: Kavram kanıtlama çalışmaları için, seyreltik olmayan dövme mürekkebi ve fosfat tamponlu salin (PBS) içinde Evan'ın Mavi boyası kullanılmıştır. Evan'ın Mavi tozu, opak olana kadar PBS ile karıştırıldı. Terapötik kavram kanıtı çalışmaları için aşağıdaki konsantrasyonlar kullanıldı: 1 mg / mL'de ibudilast, tauroursodeoksikolik asit (TUDCA) 5 mg / mL, siklosporin enjeksiyonu, 250 mg / mL ve anakinra 100 mg / 0.67 mL. Terapötik tozlar% 0.9 bakteriyostatik salin içinde seyreltildi.
- Devam etmeden önce soğumasını bekleyin. İğne soğuduktan sonra, ilgilenilen terapötiği istenen miktara (4 μL) kadar çizin.
- Dişlerle ince oftalmik forseps kullanarak, stabilize etmek için limbustaki skleral dokuyu nazikçe kavrayın. İrisin etrafında soluk kırmızı bir halka olacaktır. Bu halkayı bir dönüm noktası olarak kullanın, iğneyi eğimli tarafı aşağı gelecek şekilde yerleştirin ve arka göze enjekte edin.
NOT: İğneyi retinaya doğru açılı tuttuğunuzdan emin olun ve iğneyi sadece 2/3 oranında yerleştirin (Şekil 1). Katarakt oluşumuna yol açacağından iğnenin lensi çizmediğinden emin olun. - Terapötik enjekte edildikten sonra iğneyi yavaşça çıkarın. Tuzlu su ile yıkamadan önce gözü kapatın ve en az 10-15 saniye basınç tutun.
- Hayvanı izoflurandan ayırın ve oftalmik cerrahi platformundan çıkarın. Her göze %0.3'lük bir damla hipromelloz damlatın ve ardından hayvanın bir ısıtma yastığı üzerinde iyileşmesine izin verin.
2. Retrobulbar enjeksiyonu (RBI)
- İzofluran ve atık uçlarını SALOOT bağlantı portlarına takın. Standart izofluran prosedürlerini kullanarak hayvanı uyuşturun.
NOT: Alternatif olarak, hayvan zaten başka bir oftalmik test seansından anestezi altındaysa (ör., ketamin / ksilazin karışımı; 90 mg / kg ketamin ve 10 mg / kg ksilazin), hayvanı oftalmik cerrahi platformuna aktarın ve yeterli anestezi derinliğinin korunmasını sağlamak için anesteziyi izofluran (3 oksijen: 3 izofluran oranı) ile titre edin. - Anestezi uygulanmış hayvanla birlikte oftalmik cerrahi platformunu canlı bir ameliyat mikroskobu altına yerleştirin. Pedal çekme refleksi ile anestezik derinliği değerlendirin.
- Ameliyat edilen göze veya gözlere bir ila iki damla% 0.5 tetrakain hidroklorür oftalmik solüsyon yerleştirin. Herhangi bir manipülasyon yapılmayacaksa karşı göze kayganlaştırıcı topikal oftalmik merhem (% 0.3 hipromelloz) uygulayın.
- Daha sonra, oküler yüzeye bir ila iki damla% 5 povidon-iyot kullanın ve bir göz mızrağı kullanarak, gözü çevreleyen cilde povidon-iyot uygulayın.
- 28 G iğne ile 0,5 mL'lik bir insülin şırıngası alın. İlgilenilen terapötiği istenen miktara (100 μL) hazırlayın.
NOT: Kavram kanıtlama çalışmaları için, seyreltik olmayan dövme mürekkebi ve fosfat tamponlu salin (PBS) içinde Evan'ın Mavi boyası kullanılmıştır. Evan'ın Mavi tozu, opak olana kadar PBS ile karıştırıldı. Terapötik kavram kanıtı çalışmaları için aşağıdaki konsantrasyonlar kullanılmıştır: 10 mg / mL'de ibudilast, 50 mg / mL'de TUDCA, 250 mg / mL'de siklosporin enjeksiyonu ve 100 mg / 0.67 mL'de anakinra. Terapötik tozlar% 0.9 bakteriyostatik salin içinde seyreltildi. - Dişlerle ince oftalmik forseps kullanarak, stabilize etmek için alt göz kapağını nazikçe kavrayın. İğneyi, eğimli tarafı aşağı bakacak şekilde, oküler soketin arkası hissedilene kadar alt yörünge kenarı boyunca saat 6 ile 7 arasında bir açıyla sokun. İğneyi hafifçe geri çekin ve ardından terapötik maddeyi yavaşça enjekte edin (Şekil 2).
- İğneyi nazikçe ve yavaşça çıkarın. Ardından, tuzlu su ile yıkamadan önce gözü kapatın ve en az 10-15 saniye basınç altında tutun.
- Hayvanı izoflurandan ayırın ve oftalmik cerrahi platformundan çıkarın. Her göze %0.3'lük bir damla hipromelloz damlatın ve ardından hayvanın bir ısıtma yastığı üzerinde iyileşmesine izin verin.
3. Oküler doku izolasyon diseksiyonu
- Hayvana CO2 asfiksiasyonu yoluyla ötenazi yapıldıktan sonra veya onaylanmış IACUC Protokolünde aksi belirtilmediği gibi, hayvanı sternal yaslanma pozisyonuna getirin. Sırt boynu üzerinde, kulak kepçesi seviyesine kadar uzanan enine bir cilt kesisi kullanın.
- Atlanto-oksipital eklemi ortaya çıkarmak için dorsal kas sistemini inceleyin. Başı vücuttan ayırarak atlanto-oksipital eklemi kesmek için mayonez makası kullanın (Şekil 3). Künt diseksiyon kullanarak, cildi dorsal kafatasından burun seviyesinden dorsal boynuna kadar nazikçe çıkarın ve her iki gözün etrafındaki cildi sağlam bırakın.
- Kafatasının tabanındaki foramen magnuma bir çift orta düz kanama durdurucu veya iğne sürücüsü yerleştirin. Foramen magnumdan her iki taraftaki temporal bölgeye uzanan lateral kafatasını nazikçe kırmak için hemostatları kullanın (Şekil 3).
- Kafatasının üst kısmını çıkarırken, kanama durdurucuları beynin dorsal tarafına paralel tutun. Bu, beynin sağlam kalmasını ve kemik çıkarma işleminde çentiklenmemesini sağlayacaktır.
- Düz bir spatula kullanarak, optik sinirleri açığa çıkarmak için beyni rostrally olarak nazikçe yansıtın. Optik sinirlere beynin ağırlığından kaynaklanan gerginliğin uygulanmamasına dikkat edilmelidir.
- Sinirler açıktayken, bir çift orta boy mikromakas alın ve optik kiazma boyunca küçük bir kesi yapın ve her iki siniri de beyinden ayırın. Bu noktada beyin, histolojik değerlendirme için 4 ° C'de 24 saat boyunca PBS'de (% 4 PFA) atılabilir veya paraformaldehit içine yerleştirilebilir.
- Bir çift küçük iris makası ve bir çift dişli oftalmik mikro forseps kullanarak, göz çevresindeki fazla dokuyu (yani göz kapakları, bağ dokusu vb.) dikkatlice çıkarın. Tamamlandıktan sonra, göz oküler yuvaya yerleştirilmelidir, ancak sadece göz dışı kas ve bezler hala mevcut olmalıdır.
- Kanama durdurucuları küçük iris makası ile birlikte kullanarak, optik kanaldan geçerken optik siniri kesmemeye büyük özen göstererek oküler orbitadan kesin. Oküler soketin arkasındaki kemiği kanama durdurucularla dikkatlice ayırın ve daha hassas kontrol için küçük diseksiyon makasını kullanın.
- Kemik çıkarıldıktan sonra, yağ yastıkçıklarını, bezleri ve göz dışı kasları çıkarmak için bir çift mikromakas ve ince forseps ile oküler orbitanın etrafını hassas bir şekilde kesin. Bu işlem sırasında optik sinirlere dikkat ettiğinizden emin olun.
- Göz, kafatasının iç kısmına doğru kaudal olarak nazikçe yansıtılabilmelidir. Bu noktada küçük mikromakas ve ince forseps kullanarak alt kafatası sırtındaki siniri çevreleyen bağ dokusunu çıkarın.
- Bu doku çıkarıldıktan sonra, göz ve tam optik sinir kafatasından blok halinde kaldırılabilmelidir. Kontralateral göz ve sinir için bu adımları tekrarlayın.
- Ayrıca, optik siniri ve gözü dural kılıf gibi fazla dokudan temizleyin. Dokuların histolojik analiz için korunması gerekmiyorsa, -80 °C'de saklanmadan önce kuru buz veya sıvı nitrojen kullanarak hızlı dondurma yapın.
- Kütle spektrometresi için retinanın dünyanın iç bölgesinden izole edilmesi ve optik sinirin izole edilmesi gerekir. Optik siniri en yakın dış noktada dünyadan ayırın. Siniri -80 °C'ye aktarılmadan önce buz üzerindeki bir kriyotüpe yerleştirin.
- Göz küresini ameliyat mikroskobu altında bir Petri kabına yerleştirin. Bir çift küçük mikromakasla limbusta bir kesi yapmadan önce gözü sabit tutmak için bir çift kavisli forseps kullanın.
- Kesimi dünyanın tüm çevresini kapsayacak şekilde uzatın. Küre ikiye bölünmeli ve ön kısım atılabilir.
- Arka bölümü iç tarafı yukarı gelecek şekilde yerleştirin ve bir çift ince oftalmik cımbız kullanarak ince krem renkli dokuyu çıkarın. Optik diske yapışmış gibi görünebilir. Böyle bir durumda, retinayı diskten ayırmak için mikro makası kullanın.
NOT: Retina dokusu daha sonra -80 °C'ye aktarılmadan önce buz üzerinde bir kriyotüpe yerleştirilebilir. Dokular daha sonra değerlendirme için kütle spektrometresi tesisine aktarılabilir.
- Kısmi perfüzyon kullanarak immünohistolojik boyama için, sağlam gözü bir Petri kabına yerleştirin. 28 G'lik bir iğne ile bir insülin şırıngası almadan ve iğne retinaya doğru açılı olacak şekilde limbusa yerleştirmeden önce gözü sabit tutmak için bir çift kavisli forseps kullanın. Bu adımı limbus boyunca diğer iki noktada tekrarlayın. Dünyanın delinmesi, yeterli perfüzyonun sağlanmasına yardımcı olur ve uygun fiksasyona yardımcı olur.
NOT: Küre, bir çalkalayıcıya geçmeden ve sıvı hareketini kolaylaştırmak için 40 dakika daha düşük hızda çalkalamadan önce en az 20 dakika boyunca %20 PFA'da sabitlenmelidir. - Sabitleme adımı tamamlandıktan sonra, PFA'yı çıkarın ve PBS ile değiştirin. Şişeleri 15 dakika boyunca hafifçe çalkalayın ve ardından ikinci bir 15 dakikalık PBS durulaması için bu adımı tekrarlayın.
- Son PBS durulama döngüsünden sonra, PBS'yi aspire edin ve PBS'de% 30 sükroz çözeltisi ile değiştirin ve ardından 24 saat buzdolabında saklayın. Sükroz inkübasyon adımını takiben, histolojik değerlendirme için OCT'ye doku gömün26.
Sonuçlar
Hem RBI hem de IVI için iğnenin yerleşimini ve boyutunu optimize etmek için enjeksiyon boyası (Evans Blue boyası) ve dövme mürekkebi (Şekil 2B) kullanılarak kadavra hayvanları üzerinde ön pilot deneyler yapıldı. Dövme mürekkebi seyreltilmedi ve daha sonra Evans Blue tozu, sıvı opak hale gelene kadar PBS'de karıştırıldı. İdeal RBI'nin, oküler soketin arkası hissedilene kadar alt orbital kenar boyunca saat 6 ile 7 arasında bir açıyla yerleştirilmiş 28 G'lik bir iğneye sahip olduğu sonucuna vardık. Bu, boyaları optik siniri delmeden yörüngenin arkasına, sinire yakın bir yere iletti. Benzer şekilde, bu pilot kadavra boya denemesi IVI enjeksiyonu ile takip edildi, ancak dövme mürekkebi 33 G iğne ile birlikte çok viskoz olduğu için sadece Evans Blue boyası kullanıldı. Enjeksiyon protokolleri belirlendikten sonra, kavramın kanıtı in vivo 200 g'da erkek pigmentli Long-Evans sıçanları kullanılarak terapötik çalışmalar yapıldı (n = 18). Ek olarak, RBI güvenliğini belirlemek için erkek Long-Evans sıçanları (n = 2) kullanılarak ışığa uyarlanmış flaş görsel uyarılmış potansiyeller (fVEP'ler) gerçekleştirildi. Başlangıç fVEP değerleri kaydedildi ve daha sonra sağ göze (OD) salin enjeksiyonundan (100 μL) 7 gün sonra fVEP'ler bir kez daha yapıldı. Sol gözlere (OS) enjeksiyon yapılmadı. fVEP'ler, sinyallerin beyaz bir flaş (200 cd.s/m2) ve 1000 ms26'lık bir uyaran aralığı kullanılarak 30 cd/m2'lik bir arka plana karşı elde edildiği önceden var olan protokollere göre gerçekleştirildi. fVEP amplitüdleri, gözler veya zaman noktaları arasında önemli bir değişiklik göstermedi (Şekil 4). İstatistiksel analiz, %95 güven aralığına sahip iki dalgalı bir ANOVA kullanılarak yapıldı. Grup etkileşimlerini belirlemek için Tukey'in çoklu karşılaştırma testleri GraphPad Prism'de yapılmıştır26.
Oküler terapötik uygulamanın etkinliğini belirlemek için, aşağıdaki nöroprotektif terapötikler elde edildi: 10 mg / mL (RBI) ve 1 mg / mL (IVI) ibudilast, tauroursodeoksikolik asit (TUDCA) 50 mg / mL (RBI) ve 5 mg / mL (IVI), siklosporin enjeksiyonu, 250 mg / mL, siklosporin topikal,% 0.05 ve anakinra 100 mg / 0.67 mL. Siklosporin, RBI (n = 2), IVI (n = 2) ve topikal olarak (n = 3) uygulandı . Anakinra, ibudilast ve TUDCA, RBI (n = 2) ve IVI (n = 2) yoluyla uygulandı. İlaçlar, travmatik optik nöropatinin sıçan modelinde kullanılmak üzere nöroprotektif terapötikler olarak potansiyelleri açısından seçildi. Siklosporin, özellikle oldukça viskoz olduğu ve bu nedenle diğer terapötiklere göre enjekte edilmesi zor olduğu için kullanıldı. Dokular, daha önce belirtilen yöntem izlenerek enjeksiyondan 24 saat sonra elde edildi. Dokular kütle spektrometresi (TUDCA, ibudilast ve siklosporin) veya proteomik analiz (anakinra) (OSU'nun Farmakoanalitik Paylaşılan Kaynak CORE'u) yoluyla analiz edildi. Kontrol retinaları ve sinirleri toplandı ve Kütle Spektrometresi ve proteomik analiz ile değerlendirildi. Terapötik olarak tedavi edilen örnekler daha sonra değerlendirildi ve ilgilenilen dokuların her birinde bulunan nispi ilaç seviyelerini belirlemek için kontrollerle karşılaştırıldı. Anakinra RBI örnekleri, derin anestezi altında bile enjeksiyon sırasında hayvan ürkme tepkisi nedeniyle analizden çıkarıldı. Bu ağrı yanıtı nedeniyle, RBI Anakinra uygulaması optimal bir terapötik yaklaşım olmayabilir.
Siklosporin, her iki enjeksiyon mekanizması yoluyla 24 saat sonra hem retinada hem de optik sinirde tespit edildi; Bununla birlikte, her iki doku tipinde de topikal doğum tespit edilmedi. IV enjeksiyon grubunda, retina 383 ppb konsantrasyona sahipti ve optik sinir <5 ppb'ye sahipti. RB enjeksiyon yolu retinada 16 ppb ve optik sinirde 49 ppb olarak gözlendi (Tablo 1). Her iki enjeksiyon yolu için de enjeksiyondan 24 saat sonra retina veya optik sinirde TUDCA tespit edilmedi. RB enjeksiyonundan sonra sadece bir hayvanın optik sinir dokusunda ibudilast tespit edildi (<5 ppb). Terapötik pilot enjeksiyon çalışması, her iki enjeksiyon yönteminden sonra her iki doku tipinde siklosporinin varlığı ile kanıtlandığı gibi, her iki enjeksiyon protokolünün de retina ve optik sinire ilaç verme yeteneğine sahip olduğunu göstermiştir. Bu çalışma aynı zamanda siklosporinin ilgilenilen hedef dokularda yüksek konsantrasyonlar verdiğini göstermektedir. Bir hipotez, ibudilast ve TUDCA'nın retina ve optik sinire ulaşmış olabileceğidir, ancak oküler ortamdaki yarı ömürleri, enjeksiyondan 24 saat sonra tespit edilemeyecek kadar kısa olabilir. İlaçların şu anda nöroprotektif bir etkisi olabilir; bununla birlikte, bu ilaçların hem iç (IVI) hem de göz dışı (RBI) bölgelerde farmakokinetiğini doğrulamak için daha fazla çalışmaya ihtiyaç duyulacaktır.
Bu pilot çalışma aynı zamanda tam optik sinirin ve gözlerin başarılı bir şekilde çıkarılması yoluyla oküler doku izolasyonu protokolünü de destekledi. Terapötik uygulama pilot çalışmasında analiz için retinalar ve optik sinirler başarıyla elde edildi (Tablo 1). Ayrıca bu oküler doku izolasyon diseksiyonu ile gözler ve optik sinirler blok halinde immünohistokimya için toplanabilmiştir (Şekil 5). En-blok örnekleri, yukarıda belirtildiği gibi iki erkek Sprague Dawley sıçanından toplandı. Numuneler OCT'ye gömüldü ve 10 μm kalınlığında bir kriyostat üzerinde uzunlamasına kesitlere ayrıldı. Örnekler, OCT'yi çıkarmak için PBS'de inkübe edildi ve daha sonra PBS artı Triton-X-100 (PBT) içinde 1:20 normal eşek serumunda oda sıcaklığında 2 saat inkübe edildi. Kesitler daha sonra aşağıdaki antikorlarla inkübe edildi: anti-β-tubulin (1:1000; MAB5564; Millipore, Burlington, MA) ve anti-glial fibriler asidik protein (GFAP; 1:50; Z0334; DAKO, Santa Clara, CA) gece boyunca 4 ° C'de PBT'de, PBS ile durulanır ve eşek anti-fare Alexa 488 ve eşek anti-tavşan Alexa 594 (1:200) içinde gece boyunca 4 ° C'de PBT'de inkübe edilir. Bölümler durulandı ve bir montaj ortamına artı DAPI'ye monte edildi. Örnekler, tutarlı ayarlar26 kullanılarak geniş alanlı bir floresan mikroskobu veya konfokal mikroskop üzerinde görüntülendi. Sağlam optik sinir başı görüntülenebildi (Şekil 5A, B) ve aşağıdaki ilgilenilen belirteçler için başarılı bir şekilde boyandı: β-tubulin (yeşil), glial fibriler asidik protein (GFAP; kırmızı) ve nükleer belirteç DAPI (mavi). Bu diseksiyon yöntemi, Şekil 5C'de görüldüğü gibi tam optik sinir örneklerinin elde edilmesine izin verdi.

Şekil 1: İntravitreal (IV) enjeksiyon tekniğinin şeması. 33 G iğneli, 10 mm uzunluğunda ve 15 derecelik açıyla 10 μL'lik bir şırınga, limbusta gözün 2/3'ü kadar bir şekilde yerleştirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Retrobulbar (RB) enjeksiyon tekniğinin şematik ve temsili görüntüsü. (A) RB enjeksiyonunun şematik görüntüsü. 28 G iğneli 0,5 mL'lik bir insülin şırıngası, alt orbital kenar boyunca saat 6 ile 7 arasında bir açıyla yerleştirilir. İğne, oküler yuvanın arkası hissedilene kadar ilerletilir ve daha sonra enjeksiyondan önce hafifçe geri çekilir. (B) Pilot denemeler sırasında siyah dövme mürekkebi ile aynı iğneyi kullanan RB enjeksiyon tekniğinin temsili görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Oküler doku izolasyonu sırasında ana diseksiyon noktalarının şeması. Noktalı çizgiler kesi noktalarını gösterir. (A) Sıçan, atlanto-oksipital eklem işaretli olarak dorsal olarak görüntülenir. (B) Sıçan kafatası, önemli kesi izleri ile dorsal olarak görüntülendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
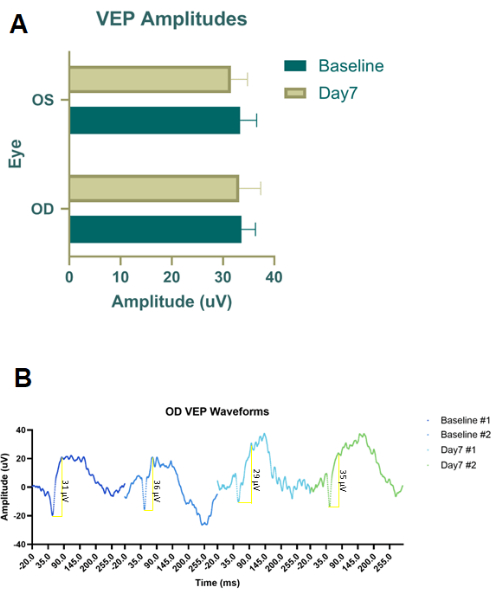
Şekil 4: RBI salin ile tedavi edilen kohortların flaş görsel uyarılmış potansiyelleri (fVEP'ler). (A) Salin RBI ile tedavi edilen sağ gözlerden (OD) ve kontrol/tedavi edilmeyen sol gözlerden (OS) ortalama fVEP genlikleri. Gruplar arasında veya gözler arasında fVEP dalga formlarının amplitüdünde anlamlı bir fark tespit edilmedi. (B) Sağ gözler (OD) salin RBI ile tedavi edilen gözlerin fVEP dalga biçimleri başlangıçta ve daha sonra enjeksiyondan yedi gün sonra (n = 2 hayvan örneği). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Oküler Doku İzolasyon Diseksiyonu sonrası toplanan optik sinir başının (A,B) epifloresan mikrografları ve kemirgenlerin en blok göz örneği (C). (A,B) Hayvanlardan sağlam optik sinir başları toplandı ve 20x büyütmede β-tubulin (yeşil), glial fibriler asidik protein (GFAP; kırmızı) ve nükleer belirteç DAPI (mavi) belirteçleri ile boyandı. (C) Sağlam küreyi ve tam optik siniri gösteren en blok göz örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Aracı | Rota | Retina | Optik Sinir |
| Siklosporin | IVI (Türkçe) | 383 | <5 |
| Siklosporin | RBI | 16 | 49 |
| Siklosporin | Topikal | ND | ND |
| TUDCA (Türkçe) | IVI (Türkçe) | ND | ND |
| TUDCA (Türkçe) | RBI | ND | ND |
| İbudilast | IVI (Türkçe) | ND | ND |
| İbudilast | RBI | ND | <5 |
| Anakinra Belediyesi | IVI (Türkçe) | D | ND |
| Anakinra Belediyesi | RBI | NA | NA |
| ND: Algılanmadı | |||
| D: Tespit edildi ancak miktarı belirlenemedi | |||
| NA: Mevcut değil | |||
Tablo 1: Terapötik pilot enjeksiyonları. Aşağıdaki terapötik ajanlar, uygulamadan 24 saat sonra retina ve optik sinirdeki varlıkları açısından araştırıldı: siklosporin (topikal, IVI, RB), TUDCA (RB ve IVI), ibudilast (RB ve IVI) ve Anakinra (RB ve IVI). Her iki enjeksiyon yolundan sonra hem retinada hem de optik sinirde siklosporin tespit edildi, bu da RB ve IV enjeksiyon protokollerimizin retina ve optik sinire oküler ilaç verme yeteneğine sahip olduğunu gösteriyor.
Tartışmalar
Esas olarak BRB'nin oluşturduğu geçirimsiz bariyer nedeniyle, retina ve optik sinire terapötiklerin verilmesiyle ilgili karmaşık zorluklar, bu çalışmanın önemini vurgulamaktadır 3,4. IVI ve RBI tekniklerinin araştırılması, yalnızca bu engellerin üstesinden gelmek için yenilikçi yaklaşımları vurgulamakla kalmaz, aynı zamanda oküler bakım ve terapötik gelişim için daha geniş etkileri de vurgular. Bu bulgular, hem IVI hem de RBI'nin, terapötiklerin doğrudan etkilenen oküler dokulara hedefli olarak verilmesini kolaylaştırabileceğini göstermektedir. Bu hedefe yönelik yaklaşım, sistemik veya topikal uygulama yolları 2,11 ile genellikle elde edilemeyen terapötik konsantrasyonlara ulaşmak ve böylece çeşitli oküler hastalıklar için tedavilerin etkinliğini artırmak için hayati önem taşır.
Bu enjeksiyon tekniklerinin karşılaştırmalı analizi, benzersiz faydalarını ortaya koymaktadır: IVI, vitreus ve iç retina katmanlarına27 doğrudan erişim sağlarken, RBI, BRB'nin bütünlüğünden ödün vermeden optik sinire difüzyona izin verir28. Bu içgörüler, spesifik terapötik ajanların en iyi nasıl sunulacağına dair daha incelikli bir anlayışa katkıda bulunur ve sonuçta oküler hastalıklardan muzdarip hastalar için tedavi sonuçlarını iyileştirir. Burada açıklanan IVI ve RBI uygulama yöntemleri, siklosporin gibi terapötikleri kritik dokulara başarıyla ileterek etkili oküler tedaviler geliştirme potansiyelini vurguladı.
Ayrıca, bu terapötik yöntem geliştirme süreci sayesinde, hem aktivasyon hem de iyileşmede hızlı etkili olduğu için bu RBI ve IVI protokolü için sedasyon yöntemi olarak inhalasyonel izofluran seçilmiştir. SALOOT, kemirgen için çok önemli destek ve stabilizasyon sağlarken, tek tip bir solunan anestezik oranına izin verir. Daha önce tartışıldığı gibi, RBI ile ilişkili bazı riskler, kör iğne yerleştirilmesi nedeniyle gözde olası hasarın yanı sıra, fareler23 için retrobulbar enjeksiyon protokolünde belirtilen basınç tekniğine bağlı kan akışı tıkanması veya trakeal çökmeyi içerir. Bu riskleri azaltmaya yardımcı olmak için, bu protokol stabilizasyon için hayvanın alt kapağını kavramak için oftalmik forseps kullanır, bu nedenle basınç tekniğinden vazgeçilir ve kan akışı tıkanıklığının veya trakeal kollapsın meydana gelmesini ortadan kaldırır. Bu teknik aynı zamanda iğne batırılırken hayvan üzerinde daha iyi kontrol sağlar. Canlı ameliyat mikroskobunun kullanımıyla birlikte forseps kullanımı, kör yerleştirme riskini en aza indirmeye yardımcı olur ve operatöre iğne konumunu daha iyi görselleştirme sağlar. Ek olarak, ameliyat platformu, iğnenin yerleştirilmesi sırasında kafatasının hareket etmesini önleyen çok önemli baş desteği sağlar. Ameliyat platformu aynı zamanda başın vücudun geri kalanına göre yükselmesini sağlar, bu da başın daha düz bir pozisyonda olmasını sağlar ve platform izofluran ve oksijen bağlantılarına sahip olduğundan, konumlandırma sırasında anestezi seviyesinden asla ödün verilmez. IVI tekniği, terapötikleri doğrudan vitreus mizahına enjekte ederek BRB'yi atlama konusundaki benzersiz yeteneği nedeniyle benimsenmiştir. Teknik, invaziv doğası nedeniyle oküler hasar için fırsat yaratır, ancak iğnenin lensi çizmemesini dikkatli bir şekilde sağlayarak, iğneyi yavaşça çıkararak ve enjeksiyondan sonra 10-15 saniye boyunca göze basınç uygulayarak risk en aza indirilir.
En blok retina ve optik sinir örneklerinin başarılı bir şekilde çıkarılması ve analiz edilmesi bu benzersiz doku elde etme yöntemi ile mümkün olmuştur. Göz ve sinir bloğunun izolasyonu sağlandı, bu da optik sinir başı ve tam göz immünofloresan boyaması ile kanıtlandığı gibi tam görme sistemini değerlendirebilmeye yardımcı oldu (Şekil 5). Bu yöntem, beynin, optik sinirlerin ve kürelerin yukarıdan aşağıya görüntülenmesine izin verir, bu da dokularımızın genel yapısının ve bütünlüğünün daha kolay korunmasını sağlar.
Bu çalışma, yalnızca bir hayvan cinsiyetinin kullanılması ve nispeten küçük bir örneklem büyüklüğü dahil olmak üzere potansiyel sınırlamalara sahiptir. RB enjeksiyonları ayrıca terapötik sızıntının doğal sınırlaması ile de ilişkilidir. RB enjeksiyonundan sonra, terapötikler retrobulbar boşluktan dünyanın önüne geçebilir. Bu teknik, yerleştirme açısını değiştirerek ve iğneyi yörüngenin arkasına mümkün olduğunca yakın tutarak bu doğal sınırlamayı en aza indirmeyi amaçladı. Ek olarak, terapötik uygulamadan sonra 10-15 saniye boyunca hafif basıncın korunmasının, terapötiklerin retrobulbar boşluktan dışarı çıkmasını önlemeye yardımcı olduğu belirlendi.
Bu yöntemler, küçük bir hayvan travmatik oküler yaralanma modelinde terapötik müdahale için gelecekteki çalışmalarda kullanılacaktır. IVI yöntemleri, civcivlerde ve farelerde kullanım için genişletilmiştir; Bununla birlikte, iğne boyutu ve terapötik hacimler ayarlanmalıdır. Civcivler için 28-29 G insülin iğnesi ve 20 μL terapötik hacim optimal bulundu29, ancak farelerde 31 G iğne ve 2 μL terapötik hacmin ideal olduğu belirlendi. IVI tekniği, diğer hayvanlara çeviri ile minimal düzeyde değişti. RBI'nin diğer türlere çevrilmesi için, iğne boyutunun ve hacminin uyarlanması gerekecektir, ancak türler arasındaki doğal anatomik farklılıklar göz önüne alındığında, genel teknik çevrilebilir kalmalıdır.
Küçük hayvan modellerinden elde edilen içgörüler, ilaç dağıtım mekanizmalarının anlaşılmasını ilerletmek ve tedavi protokollerini optimize etmek için paha biçilmezdir. Sonuç olarak, bu araştırma, optik bakımın kalitesini önemli ölçüde artırabilecek, görmeyi korumaya ve klinik uygulamada sonuçları iyileştirmeye yönelik adımlar atabilecek daha etkili tedaviler için zemin hazırlamaktadır.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yapıldığını beyan ederler.
Teşekkürler
Bu çalışma kısmen ABD Savunma Bakanlığı Vizyon Araştırma Programı Ödülleri W81XWH-15-1-0074 ve W81XWH-22-1-0989 tarafından finanse edilmiştir. Burada yer alan görüşler veya iddialar yazarların özel görüşleridir ve resmi olarak veya Ordu Bakanlığı veya Savunma Bakanlığı'nın görüşlerini yansıttığı şeklinde yorumlanmamalıdır. Bu araştırma hibesi, kısmen Ohio Körlüğü Önleme Üyesi Genç Araştırmacı Öğrenci Bursu Görme Araştırmalarında Kadın Akademisyenler için Ödül tarafından desteklenmiştir. Ross Vakfı'nın desteğini minnetle kabul ediyoruz. Hizmetler, P30EY032857 kapsamında OSU Vizyon Bilimleri Araştırma Çekirdek Programı'nda gerçekleştirildi. Ohio Eyalet Üniversitesi Laboratuvarı ve Hayvan Kaynakları'na (ULAR) teşekkür ederiz. Ayrıca, Reilly lisans laboratuvarı üyeleri Michelle Mosko, Emma Lally, Sam Duckworth ve Eve Howard'a teşekkür ederiz. SALOOT tasarımına katkıda bulunan Bongsu Kim'e, Elizabeth Urbanski ve Ryan Webb'e de teşekkür ederiz. Şekil 1, Şekil 2A ve Şekil 3 BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
Referanslar
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır