Method Article
Глазная терапевтическая доставка и расширенное извлечение тканей у взрослых крыс
В этой статье
Резюме
В этом исследовании представлена методология доставки терапевтических препаратов в сетчатку и зрительные нервы взрослой крысы. Кроме того, представлен уникальный метод забора тканей для нисходящего сбора зрительного нерва и сетчатки у взрослой крысы.
Аннотация
Терапевтическая доставка в задний сегмент глаза, включая сетчатку и зрительный нерв, осложняется наличием гематоэнцефалических и гематоэнальных барьеров. Модели мелких животных, таких как крысы, используются для изучения различных глазных патологий. В то время как терапевтическая доставка в задний глаз является сложной задачей, ее достижение имеет важное значение для лечения глазных заболеваний, многие из которых требуют валидации на моделях мелких животных для трансляционной релевантности. Таким образом, представлены две задние терапевтические методики доставки: интравитреальная инъекция (ВВИ) и ретробульбарная инъекция (RBI) для использования у взрослых крыс. Кроме того, для различных методов гистологического и молекулярного анализа вводится метод удаления глаз и зрительных нервов. Протокол диссекции позволяет полностью наблюдать за нервно-зрительной системой, сводя к минимуму посмертное повреждение тканей сетчатки и зрительного нерва. Была достигнута успешная доставка терапевтического циклоспорина к сетчатке и зрительному нерву, при этом обнаруживаемые концентрации наблюдались через 24 часа после инъекции с использованием как IVI, так и RBI. Кроме того, были успешно извлечены образцы сетчатки и нервов en bloc для полного гистологического анализа глазной ткани, что способствует всестороннему наблюдению за сетчаткой и более широкой нейрозрительной системой.
Введение
Доставка терапевтических препаратов к сетчатке и зрительному нерву невероятно сложна из-за сложной анатомии глаза1,2, в частности, из-за наличия гематематического барьера (BRB)3,4,5. BRB служит для защиты сетчатки от инвазии системного кровообращения, но является сложным противником терапевтического введения, поскольку системное терапевтическое кровообращение часто блокируется BRB 6,7. Небольшие липофильные молекулы могут легко диффундировать через BRB, но более крупным и гидрофильным молекулам труднее получить доступ к сетчатке. Интравитреальные (IVI) и ретробульбарные (RBI) инъекции позволяют доставлять лекарства в ткани глаза, преодолевая ограничения, налагаемые BRB. ИВН служит многообещающим компромиссом путем введения терапевтических средств во внутреннюю среду глаза 8,9. Этот метод требует, чтобы препарат проникал через стекловидное тело, таким образом, обходя BRB, и диффундировал через сетчатку и сосудистую оболочку, чтобы достичь зрительного нерва7. RBI выводится за глаз в ретробульбарное пространство10. Терапевтические препараты могут доставляться путем диффузии через ткани и железы в ретробульбарном пространстве, воздействуя на зрительный нерв и окружающие структуры, не попадая непосредственно в сетчатку, которая поддерживает целостность BRB. Доставляя лекарственные препараты прямо или косвенно в глаз, как интравитреальные, так и ретробульбарные инъекции позволяют достичь более высоких местных концентраций терапевтического препарата, что повышает его эффективность по сравнению с местным или системным введением (пероральным или внутривенным)2. Это особенно важно для лечения, требующего быстрых действий или высокой потенции, как это наблюдается при многих глазных заболеваниях. Адресная доставка также ограничивает воздействие препарата на остальную часть организма, что снижает риск побочных эффектов и помогает свести к минимуму потенциальные побочные эффекты, которые могут возникнуть при местном введении лекарственных препаратов местно, перорально иливнутривенно.
Другие периокулярные инъекции, такие как субконъюнктивальная, задняя субтенонная и субретинальная, имеют свои преимущества и ограничения 2,5. Было замечено, что задние субтенонные инъекции доставляют высокие концентрации препарата в ткани глаза; Однако субтенонная инъекция находится ближе к склеральной, чем к орбитальной сосудистой 5,12. В отличие от этого, RBI помещает терапевтическое вещество ближе к зрительному нерву, чем к заднему субтенону или субконъюнктивальному13. Это может означать, что патологии зрительного нерва отдают предпочтение терапии, доставляемой RBI, по сравнению с другими типами периокулярных инъекций. Инъекции задних субтенонов сопряжены с рисками, включая косоглазие, гифему и повышенное внутриглазное давление5. Повышенное внутриглазное давление также является зарегистрированным фактором риска при внутривенных инъекциях, субконъюнктивальных и субретинальных инъекциях2. Эти типы инъекций часто требуют повторного дозирования для достижения желаемого терапевтического эффекта2. Другие факторы риска, связанные с субретинальными инъекциями, субконъюнктивальными инъекциями и внутривенными инъекциями, включают образование катаракты, кровоизлияние в сетчатку, отслоение сетчатки и воспаление2. Эти внутривенные инъекции, субретинальные инъекции и субконъюнктивальные инъекции являются более инвазивными, чем инъекции RBI, поскольку эти инъекции являются внутриглазными2. RBI можно считать менее инвазивным, поскольку он помещает терапевтическое вещество в ретробульбарное пространство, не вводя иглу непосредственно в глазную область. Другие, менее инвазивные терапевтические стратегии доставки, такие как местное введение, не обеспечивают достаточной доставки лекарства, при этом менее 5% препарата задерживается на поверхности глаза.
IVI является важным методом в доклинических моделях, который используется из-за его способности доставлять терапевтические агенты непосредственно в задний сегмент глаза. IVI доставляет препарат непосредственно в стекловидное тело, что делает его предпочтительным методом доставки для локализованного лечения14. Методика IVI позволяет терапевтически обходить гемато-ретинальный барьер, который является распространенным препятствием для проникновения препарата в сетчатку14. IVI создает возможность воспаления и повреждения глазных структур, поэтомунеобходимо тщательно соблюдать процедуру. Чтобы свести к минимуму отслойку сетчатки и образование катаракты, Chiu et al. описывают подход IVI, который подчеркивает введение и инъекцию скоса под углом 45 градусов на уровне par plana, избегая хрусталика, сетчатки, глазных мышц и сосудов15. В этой технике игла 30 G вводится в склеру носа для терапевтической доставки15. IVI по-прежнему связан с рисками из-за его инвазивного характера. Потенциальные риски включают отслойку сетчатки, образование катаракты, эндофтальмит или кровоизлияние16. Инвазивный характер методов ВВИ также повышает внутриглазное давление, как было показано в эксперименте на свиных глазах, проведенном Ikjong Park et al.16. Исследование показывает изменения внутриглазного давления на разных этапах введения иглы и введения жидкости. Они сообщают о существенных изменениях внутриглазного давления во время процедуры16.
RBI были успешно использованы в предыдущих исследованиях в качестве средства терапевтической доставки грызунам. В одном из таких исследований сравнивались эффекты различных аналогов простагландинов, вводимых через RBI17. Крысам-альбиносам вводили RBI с вводом иглы 26 G 0,1 мл инъекции, вводимой через латеральную область нижнего свода под углом 45 градусов17. Протокол, использованный в этом исследовании, был адаптирован из ранее описанного метода, в котором крысам вводили анестезию с помощью внутрибрюшинной инъекции хлоралгидра18. В другом исследовании, проведенном на крысах, сравнивали капли местного действия с инъекциями ретробульбара19. Крысам вводили анестезию с помощью инъекции кетамина/ксилазина, а RBI вводили через иглу 30G19. В отличие от ранее обсуждавшихся методов седации, в одном исследовании, в котором изучалось влияние RBI на орбитальный жир, использовался ингаляционный изофлуран для успокоения крыс до RBI20. В то время как эти исследования дают представление о том, какие анестетики и спецификации игл могут быть успешными, позиционирование и обращение с животными во время процедуры не обсуждаются.
В различных исследованиях на мышах также проводятся ИРБ для терапевтических методов доставки. В одном исследовании сравнивали RBI с инъекцией в боковую хвостовую вену для успешного индуцирования нефротического синдрома21. Во втором исследовании также сравнивались те же две техники инъекций при введении контрастного веществадля визуализации сердца. Мышам вводили анестезию ингаляционным изофлураном и вводили в медиальную сторону глаза22. Оба исследования адаптировали свой метод RBI из ранее составленного протокола. Важно отметить, что этот протокол называл их инъекцию ретроорбитальной, а место инъекции описывалось как ретробульбарное пространство за глазом. Авторы этого протокола использовали ингаляционный изофлуран в качестве предпочтительного метода седации, отметив быструю активацию и время восстановлениямышей. При RBI глаз частично выступал из глазницы путем давления на кожу вокруг глаза23. Затем иглу вводили в медиальную кантус скосом вниз под углом 30 градусов и вводили до тех пор, пока она не достигала основания глаза23. Необходимо соблюдать осторожность при оказании давления на животное, так как может произойти случайная блокировка кровотока или коллапс трахеи23. Инъектор также слеп к кончику иглы при введении, поэтому повреждение глаза является связанным с этим риском. Повреждение глаза при терапевтическом введении является критическим риском в этом эксперименте, так как причинение дополнительной травмы напрямую подрывает результаты исследования. Следует также отметить, что ранее описанная техника позиционирования и обработки проводилась на мышах и не включала замечаний о применимости к крысам.
Существует множество способов удаления зрительного нерва и сетчатки. Один из таких методов исследовал удаление зрительных нервов и глаз целиком, сохраняя неповрежденный зрительный хиазма24. Этот метод наиболее сопоставим с текущим исследованием, поскольку отдельные глаза и зрительные нервы также сохраняются для удаления en bloc; Тем не менее, зрительный хиазма отделяется. Проявление осторожности в этой процедуре будет иметь первостепенное значение из-за сложности процедуры. В текущем методе мы начинаем рассечение через хвостовой череп и работаем рострально, чтобы обеспечить доступ таким образом, чтобы ограничить повреждение зрительных нервов и позволить всему нерву остаться неповрежденным. Кроме того, сохранение нерва неповрежденным и прикрепленным к глазу имеет решающее значение для процесса внедрения, поскольку повреждение каждой части нерва может соответствовать различным патологическим наблюдениям. Ориентация зрительного нерва важна для рассмотрения, так как способ его залегания позволяет получить различные поперечные сечения, которые могут быть важны для гистологического анализа.
Изготовленное на заказ устройство, известное как офтальмологический операционный стол лаборатории для малых животных (SALOOT, платформа офтальмологической хирургии), состоит из серии напечатанных на 3D-принтере материалов для обеспечения анестезии и удержания животного в стабильном положении для глазных терапевтических инъекций. Конструкция SALOOT обеспечивает стабильность головы и глазных структур при офтальмологических процедурах, что повышает скорость и воспроизводимость операций, а также позволяет проводить газовую анестезию и удалять частицы на выдохе. SALOOT представляет собой трехмерный печатный блок с вогнутой редукцией для удержания тела крысы и более узкой областью спереди для удержания головы животного в носовом конусе с входом изофлурана. Под носовым обтекателем находится небольшой резервуар и выпускное отверстие. Для терапевтической доставки глаз и точного забора глазной ткани были разработаны следующие методы: Они были разработаны для изучения тканей после глазной травмы, поэтому крайне важно очертить последствия травмы, инъекции, лечения и вскрытия, чтобы избежать путаной интерпретации полученных результатов.
В данной статье представлены два метода глазных терапевтических инъекций, интравитреальная и ретробульбарная инъекции, для применения у взрослых крыс. Кроме того, представлен метод забора тканей для полного удаления интактного зрительного нерва и сетчатки у взрослой крысы. Эти методы позволяют исследовать глазные и периокулярные эффекты индуцированной патологии и проводить их лечение.
протокол
Все эксперименты проводились в соответствии с Заявлением ARVO об использовании животных в офтальмологических и визуальных исследованиях и одобрены институциональным комитетом по уходу за животными и их использованию в Университете штата Огайо. Для исследования были использованы самцы крыс Sprague Dawley весом ~200 г и возрастом около 2 месяцев25. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Интравитреальные инъекции (ВВИ)
- Присоедините изофлуран и отработанные провода к портам крепления SALOOT. Обезболите животное с использованием стандартных процедур изофлурана в соответствии с Заявлением ARVO об использовании животных в офтальмологических и визуальных исследованиях и утвержденным протоколом IACUC.
Примечание: В качестве альтернативы, если животное уже находилось под анестезией после другого сеанса офтальмологического тестирования (т.е. смеси кетамина/ксилазина; 90 мг/кг кетамина и 10 мг/кг ксилазина), переведите животное на платформу офтальмологической хирургии и титруйте анестезию изофлураном (соотношение 3 кислорода: 3 изофлурана) для обеспечения достаточной глубины анестезии. - Поместите платформу для офтальмологической хирургии с животным, находящимся под наркозом, под живым операционным микроскопом. Оцените глубину анестезии с помощью рефлекса отмены педали.
- Введите одну-две капли 0,5% офтальмологического раствора тетракаина гидрохлорида в глаз или глаза, на которых проводится операция. Нанесите смазывающую местную офтальмологическую мазь, такую как гипромеллоза 0,3%, на контралатеральный глаз, если манипуляция не проводится.
- Затем нанесите одну-две капли 5% повидон-йода на поверхность глаза, и с помощью ватного тампона нанесите повидон-йод на кожу вокруг глаза.
- С помощью шприца объемом 10 мкл с иглой 33 G с наконечником типа 4 при длине 10 мм и угле 15 градусов наберите 0,9% бактериостатического натрия хлорида. Промойте шприц и иглу физиологическим раствором, прежде чем погрузить иглу в стерилизатор с горячими шариками.
- Дайте ему остыть, прежде чем продолжить. После того как игла остынет, наберите интересующее лечебное средство до нужного количества (4 μл).
ПРИМЕЧАНИЕ: Для подтверждения концепции были использованы неразбавленные чернила для татуировок и краситель Evan's Blue в фосфатно-солевом буфере (PBS). Порошок Evan's Blue смешивали с PBS до непрозрачности. Для терапевтических исследований были использованы следующие концентрации: ибудиласт в дозе 1 мг/мл, таурурсодезоксихолевая кислота (TUDCA) 5 мг/мл, циклоспорин для инъекций, 250 мг/мл и анакинра в дозе 100 мг/0,67 мл. Лечебные порошки разводили в 0,9% бактериостатическом растворе.
- Дайте ему остыть, прежде чем продолжить. После того как игла остынет, наберите интересующее лечебное средство до нужного количества (4 μл).
- С помощью тонких офтальмологических щипцов с зубами аккуратно захватите склеральную ткань в области лимба для стабилизации. Вокруг радужной оболочки будет слабое красное кольцо. Используйте это кольцо в качестве ориентира, вставьте иглу скошенной стороной вниз и введите ее в задний глаз.
ПРИМЕЧАНИЕ: Убедитесь, что игла наклонена к сетчатке и вводите иглу только на 2/3 пути (Рисунок 1). Следите за тем, чтобы игла не поцарапала хрусталик, так как это приведет к образованию катаракты. - После того, как терапевтическое средство было введено, медленно извлеките иглу. Закройте глаз и удерживайте давление не менее 10-15 с перед промыванием физиологическим раствором.
- Прекратите прием изофлурана с животного и снимите его с платформы офтальмологической хирургии. Поместите каплю гипромеллозы 0,3% в каждый глаз, а затем дайте животному восстановиться на грелке.
2. Ретробульбарная инъекция (RBI)
- Присоедините изофлуран и отработанные провода к портам крепления SALOOT. Обезболивайте животное с помощью стандартных процедур с изофлураном.
Примечание: В качестве альтернативы, если животное уже находилось под анестезией после другого сеанса офтальмологического тестирования (т.е. смеси кетамина/ксилазина; 90 мг/кг кетамина и 10 мг/кг ксилазина), переведите животное на платформу офтальмологической хирургии и титруйте анестезию изофлураном (соотношение 3 кислорода: 3 изофлурана) для обеспечения достаточной глубины анестезии. - Поместите платформу для офтальмологической хирургии с животным, находящимся под наркозом, под живым операционным микроскопом. Оцените глубину анестезии с помощью рефлекса отмены педали.
- Введите одну-две капли 0,5% офтальмологического раствора тетракаина гидрохлорида в глаз или глаза, на которых проводится операция. Нанесите смазывающую местную офтальмологическую мазь (гипромеллоза 0,3%) на контралатеральный глаз, если манипуляция не проводится.
- Затем нанесите одну-две капли 5% повидон-йода на поверхность глаза и с помощью глазного копья нанесите повидон-йод на кожу вокруг глаза.
- Приобретите инсулиновый шприц объемом 0,5 мл с иглой 28 G. Составьте интересующее терапевтическое средство в нужном количестве (100 μл).
ПРИМЕЧАНИЕ: Для подтверждения концепции были использованы неразбавленные чернила для татуировок и краситель Evan's Blue в фосфатно-солевом буфере (PBS). Порошок Evan's Blue смешивали с PBS до непрозрачности. Для терапевтического обоснования концепций использовали следующие концентрации: ибудиласт в дозе 10 мг/мл, TUDCA в дозе 50 мг/мл, циклоспорин для инъекций в дозе 250 мг/мл и анакинра в дозе 100 мг/0,67 мл. Лечебные порошки разводили в 0,9% бактериостатическом растворе. - С помощью тонких офтальмологических щипцов с зубьями аккуратно захватите нижнее веко для стабилизации. Введите иглу скошенной стороной вниз под углом между 6 и 7 часами вдоль нижнего орбитального края до тех пор, пока не прощупается задняя часть глазной впадины. Слегка отведите иглу назад и медленно введите терапевтическое средство (рисунок 2).
- Аккуратно и медленно извлеките иглу. Затем закройте глаз и удерживайте давление не менее 10-15 с, прежде чем смыть солевым раствором.
- Прекратите прием изофлурана с животного и снимите его с платформы офтальмологической хирургии. Поместите каплю гипромеллозы 0,3% в каждый глаз, а затем дайте животному восстановиться на грелке.
3. Изолирующая диссекция глазной ткани
- После того, как животное было усыплено с помощью асфиксии CO2 или иным образом, указанным в утвержденном протоколе IACUC, поместите животное в лежачее положение за грудиной. Используйте поперечный разрез кожи над спинной частью шеи, доходящий до уровня ушной раковины.
- Рассеките тыловую мускулатуру, чтобы обнажить атланто-затылочный сустав. С помощью ножниц майонеза сделайте надрез через атланто-затылочный сустав, отделяя голову от тела (рисунок 3). Используя тупое рассечение, аккуратно удалите кожу от дорсального черепа от уровня носа до спинной шеи, оставив кожу вокруг обоих глаз нетронутой.
- Вставьте пару средних прямых гемостатиков или игольчатых драйверов в большое затылочное отверстие у основания черепа. С помощью гемостатиков аккуратно прорвите боковой череп, простирающийся от большого затылочного отверстия до височной области с обеих сторон (Рисунок 3).
- При удалении верхней части черепа держите гемостатики параллельно дорсальной стороне мозга. Это гарантирует, что мозг останется неповрежденным и не будет поврежден в процессе удаления кости.
- С помощью плоского шпателя аккуратно отразите мозг рострально, чтобы обнажить зрительные нервы. Необходимо следить за тем, чтобы напряжение от веса мозга не оказывалось на зрительные нервы.
- Обнажив нервы, возьмите микроножницы среднего размера и сделайте небольшой разрез поперек зрительного нерва, отрезав оба нерва от мозга. На этом этапе мозг может быть отброшен или помещен в параформальдегид в PBS (4% PFA) на 24 ч при 4 °C для гистологической оценки.
- С помощью маленьких ножниц для радужной оболочки глаза и пары зубчатых офтальмологических микрощипцов осторожно удалите излишки ткани (т. е. век, соединительной ткани и т. д.) вокруг глаза. После завершения глаз должен быть расположен в глазной впадине, но при этом должны присутствовать только экстраокулярные мышцы и железы.
- Используя гемостатики в сочетании с маленькими ножницами по радужной оболочке, разрежьте глазную орбиту, соблюдая большую осторожность, чтобы не перерезать зрительный нерв при его прохождении через зрительный канал. Осторожно оторвите кость в задней части глазной впадины с помощью гемостатика, а для более точного контроля используйте небольшие ножницы для рассечения.
- После того, как кость будет удалена, аккуратно разрежьте вокруг глазной орбиты с помощью микроножниц и тонких щипцов, чтобы удалить жировые пакеты, железы и экстраокулярные мышцы. Убедитесь, что во время этого процесса вы внимательно следите за зрительными нервами.
- Глаз должен иметь возможность мягко отражаться каудально по направлению к внутренней части черепа. На этом этапе с помощью небольших микроножниц и тонких щипцов удалите соединительную ткань, окружающую нерв на нижнем гребне черепа.
- После удаления этой ткани глаз и весь зрительный нерв должны быть отделены от черепа целиком. Повторите эти действия для контралатерального глаза и нерва.
- Кроме того, очистите зрительный нерв и глаз от лишней ткани, такой как твердая мозговая оболочка. Если ткани не нуждаются в консервации для гистологического анализа, то перед хранением при температуре -80 °C проводят мгновенную заморозку с использованием сухого льда или жидкого азота.
- Для масс-спектрометрии сетчатка должна быть изолирована от внутренней области глазного яблока, а зрительный нерв должен быть изолирован. Отделите зрительный нерв от глазного яблока в ближайшей наружной точке. Поместите нерв в криопробирку на льду перед переносом на -80 °C.
- Поместите глазной шар на чашку Петри под операционный микроскоп. Используйте пару изогнутых щипцов, чтобы удерживать глаз неподвижно, прежде чем делать разрез в лимбе с помощью маленьких микроножниц.
- Удлинейте разрез так, чтобы охватить всю окружность земного шара. Глобус должен быть разделен пополам, а передняя часть может быть отброшена.
- Поместите заднюю часть внутренней стороной вверх и с помощью тонкого офтальмологического пинцета удалите тонкую ткань кремового цвета. Может показаться, что он прилипает к диску зрительного нерва. В этом случае с помощью микроножниц отрежьте сетчатку от диска.
ПРИМЕЧАНИЕ: Затем ткань сетчатки может быть помещена в криопробирку на льду перед переносом до -80 °C. Затем ткани могут быть переданы в масс-спектрометрическую установку для оценки.
- Для иммуногистологического окрашивания с использованием частичной перфузии поместите неповрежденный глаз на чашку Петри. Используйте пару изогнутых щипцов, чтобы удерживать глаз в устойчивом положении, прежде чем взять инсулиновый шприц с иглой 28 G и ввести его в лимб под углом к сетчатке. Повторите этот шаг еще в двух точках вдоль лимба. Пункция глазного яблока помогает обеспечить адекватную перфузию и способствует правильной фиксации.
ПРИМЕЧАНИЕ: Шар должен быть зафиксирован в 4% PFA не менее чем на 40 минут перед переходом в шейкер и перемешиванием на низкой скорости в течение дополнительных 20 минут для облегчения движения жидкости. - После завершения этапа фиксации извлеките PFA и замените его на PBS. Поместите флаконы на легкую встряхивание на 15 минут, а затем повторите этот шаг в течение второго 15-минутного полоскания PBS.
- После заключительного цикла промывки PBS отсадите PBS и замените его 30% раствором сахарозы в PBS, а затем поставьте в холодильник на 24 часа. После этапа инкубации сахарозы встроить ткань в ОКТ для гистологической оценки26.
Результаты
Предварительные пилотные эксперименты были проведены на трупных животных с использованием инъекционного красителя (краситель Evans Blue) и чернил для татуировок (рис. 2B) для оптимизации размещения и размера иглы как для RBI, так и для IVI. Чернила для татуировки были неразбавленными, а затем порошок Evans Blue смешивали с PBS до тех пор, пока жидкость не становилась непрозрачной. Мы пришли к выводу, что идеальный RBI представляет собой иглу 28 G, вставленную под углом между 6 и 7 часами вдоль нижнего орбитального края до тех пор, пока не будет прощупана задняя часть глазной впадины. Это доставляло красители к задней части глазницы, ближе к нерву, не прокалывая зрительный нерв. Аналогичным образом, за этим пилотным испытанием трупного красителя последовала инъекция IVI, но использовался только краситель Evans Blue, так как чернила для татуировки были слишком вязкими в сочетании с иглой 33 G. После того, как были определены протоколы инъекций, были проведены терапевтические исследования in vivo с использованием самцов пигментированных крыс Лонг-Эванса в дозе 200 г (n = 18). Кроме того, с использованием самцов крыс Лонг-Эванса (n = 2) были проведены адаптированные к свету визуальные вызванные потенциалы вспышки (fVEP) с использованием самцов крыс Лонг-Эванса (n = 2) для определения безопасности RBI. Регистрировались исходные значения fVEP, а затем через 7 дней после введения физиологического раствора (100 μL) в правый глаз (OD) снова проводились fVEP. Левый глаз (ОВ) инъекции не получали. fVEP проводили по ранее существовавшим протоколам, в которых сигналы получали на фоне 30 кд/м2 с использованием белой вспышки (200 кд.с/м2) и интервала между стимулами 1000мс26. Амплитуды fVEP не показали существенных изменений между глазами или временными точками (рис. 4). Статистический анализ проводили с использованием двухволнового ANOVA с 95% доверительным интервалом. Множественные сравнительные тесты Тьюки были проведены в GraphPad Prism для определения групповых взаимодействий26.
Для определения эффективности глазного терапевтического введения были получены следующие представляющие интерес нейропротекторные препараты: ибудиласт в дозах 10 мг/мл (РБИ) и 1 мг/мл (ВВИ), таурурсодезоксихолевая кислота (TUDCA) 50 мг/мл (РБИ) и 5 мг/мл (ВВИ), циклоспорин для инъекций, 250 мг/мл, циклоспорин местно, 0,05%, анакинра 100 мг/0,67 мл. Циклоспорин вводили через RBI (n = 2), IVI (n = 2) и местно (n = 3). Анакинра, ибудиласт и TUDCA вводили через RBI (n = 2) и IVI (n = 2). Препараты были выбраны с учетом их потенциала в качестве нейропротекторных терапевтических средств для использования в модели травматической оптической нейропатии на крысах. В частности, использовался циклоспорин, поскольку он был очень вязким и, следовательно, трудным для инъекций по сравнению с другими терапевтическими средствами. Ткани получали через 24 ч после инъекции по ранее указанному методу. Ткани анализировали с помощью масс-спектрометрии (TUDCA, ибудиласт и циклоспорин) или протеомного анализа (анакинра) (OSU's Pharmacoanaytic Shared Resource CORE). Контрольные сетчатки и нервы были собраны и оценены с помощью масс-спектрометрии и протеомного анализа. Затем были оценены обработанные терапевтическими препаратами образцы и сравнены с контрольной группой, чтобы определить относительные уровни препарата, обнаруженного в каждой из представляющих интерес тканей. Образцы Anakinra RBI были исключены из анализа из-за реакции животного на вздрагивание во время инъекции, даже под глубокой анестезией. Из-за этой болевой реакции введение RBI Anakinra может не быть оптимальным терапевтическим подходом.
Циклоспорин был обнаружен как в сетчатке, так и в зрительном нерве через 24 ч с помощью обоих механизмов инъекции; Тем не менее, местное введение не было обнаружено ни в одном из типов тканей. В группе внутривенных инъекций концентрация в сетчатке составляла 383 ppb, а в зрительном нерве — <5 ppb. При введении RB наблюдалось 16 ppb в сетчатке и 49 ppb в зрительном нерве (Таблица 1). TUDCA не была обнаружена ни в сетчатке, ни в зрительном нерве через 24 ч после инъекции ни при одном из путей инъекции. Ибудиласт был обнаружен в ткани зрительного нерва только одного животного после введения RB (<5 ppb). Терапевтическое пилотное инъекционное исследование показало, что оба протокола инъекций способны доставлять лекарство к сетчатке и зрительному нерву, о чем свидетельствует присутствие циклоспорина в обоих типах тканей после обоих методов инъекции. Это исследование также показывает, что циклоспорин дает высокие концентрации в тканях-мишенях, представляющих интерес. Одна из гипотез заключается в том, что ибудиласт и TUDCA могли достичь сетчатки и зрительного нерва, но их период полураспада в глазной среде мог быть слишком коротким, чтобы его можно было обнаружить через 24 часа после инъекции. Возможно, что в это время препараты оказывают нейропротекторное действие; тем не менее, необходимы дальнейшие исследования для подтверждения фармакокинетики этих препаратов как во внутренней (IVI), так и в экстраокулярной (RBI) областях.
Это пилотное исследование также поддержало протокол изоляции глазной ткани путем успешного удаления полного зрительного нерва и глаз. Сетчатка и зрительные нервы были успешно получены для анализа в пилотном исследовании терапевтической доставки (Таблица 1). Кроме того, с помощью этого изолирующего диссекции глазной ткани удалось собрать глаза и зрительные нервы в едином блоке для иммуногистохимии (рис. 5). Образцы en-bloc были собраны у двух самцов крыс Sprague Dawley, как описано выше. Образцы погружали в ОКТ и продольно разрезали на криостате толщиной 10 мкм. Образцы инкубировали в PBS для удаления ОКТ, а затем инкубировали в обычной ослиной сыворотке 1:20 в PBS плюс Triton-X-100 (PBT) при комнатной температуре в течение 2 ч. Затем срезы инкубировали со следующими антителами: анти-β-тубулин (1:1000; MAB5564; Millipore, Burlington, MA) и антиглиальный фибриллярный кислый белок (GFAP; 1:50; Z0334; DAKO, Санта-Клара, Калифорния) в PBT в течение ночи при 4°C, промытые PBS, и инкубированные в Donkey Anti-mouse Alexa 488 и Donkey Anti-rabbit Alexa 594 (1:200) в PBT в течение ночи при 4 °C. Секции были промыты и смонтированы в монтажный носитель плюс DAPI. Образцы визуализировали на широкопольном флуоресцентном микроскопе или конфокальном микроскопе с постоянными настройками26. Интактный диск зрительного нерва удалось визуализировать (рис. 5A, B) и успешно окрашивать по следующим интересующим его маркерам: β-тубулин (зеленый), глиальный фибриллярный кислый белок (GFAP; красный) и ядерный маркер DAPI (синий). Этот метод диссекции позволил получить полные образцы зрительного нерва, как показано на рисунке 5C.

Рисунок 1: Схема техники интравитреального (внутривенного) введения. Шприц объемом 10 мкл с иглой 33 G, длиной 10 мм и углом 15 градусов вводится на 2/3 пути в глаз в области лимба. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Схематическое и репрезентативное изображение техники ретробульбарной (RB) инъекции. (A) Схематическое изображение RB-инъекции. Инсулиновый шприц объемом 0,5 мл с иглой 28 G вводится вдоль нижнего обода орбиты под углом от 6 до 7 часов. Иглу продвигают до тех пор, пока не прощупается задняя часть глазной впадины, а затем немного оттягивают назад перед инъекцией. (B) Репрезентативное изображение техники инъекции RB с использованием той же иглы с черными чернилами для татуировки во время пилотных испытаний. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Схема основных точек расслоения во время изоляции глазной ткани. Пунктирными линиями обозначены точки надрезов. (А) Крыса расположена дорсально с помеченным атланто-затылочным суставом. (B) Череп крысы показан дорсально с заметными следами от разрезов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
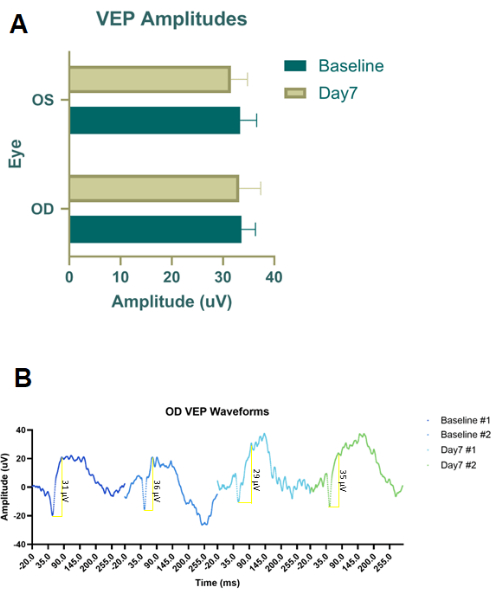
Рисунок 4: Флэш-визуальные вызванные потенциалы (fVEP) когорт, получавших RBI, получавших физиологический раствор. (A) Усредненные амплитуды fVEP из правого глаза (OD), обработанного физиологическим раствором RBI, и контрольного/необработанного левого глаза (OS). Не было выявлено существенных различий в амплитуде форм волн fVEP между группами или между глазами. (B) Формы волны fVEP солевого раствора RBI на правом глазу (OD) лечили на исходном уровне, а затем через семь дней после инъекции (n = 2 образца на животных). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Эпифлуоресцентные микрофотографии диска зрительного нерва (A,B) и образца глаза (C) грызунов, собранные после вскрытия глазной ткани. (А,Б) У животных были собраны интактные нервные головки зрительного нерва, которые были окрашены маркерами β-тубулина (зеленого цвета), глиального фибриллярного кислого белка (GFAP; красный) и ядерного маркера DAPI (синий) при 20-кратном увеличении. (C) Образец глаза, показывающий неповрежденный глазный яблоко и полный зрительный нерв. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Агент | Маршрут | Сетчатка | Зрительный нерв |
| Циклоспорин | IVI | 383 | <5 |
| Циклоспорин | РБИ | 16 | 49 |
| Циклоспорин | Тематический | НД | НД |
| TUDCA | IVI | НД | НД |
| TUDCA | РБИ | НД | НД |
| Ибудиласт | IVI | НД | НД |
| Ибудиласт | РБИ | НД | <5 |
| Анакинра | IVI | D | НД |
| Анакинра | РБИ | NA | NA |
| ND: не обнаружено | |||
| D: Обнаружено, но не может быть количественно определено | |||
| NA: Нет в наличии | |||
Таблица 1: Терапевтические пилотные инъекции. Следующие терапевтические агенты были исследованы на предмет их присутствия в сетчатке и зрительном нерве через 24 ч после введения: циклоспорин (местное, IVI, RB), TUDCA (RB и IVI), ибудиласт (RB и IVI) и анакинра (RB и IVI). Циклоспорин был обнаружен как в сетчатке, так и в зрительном нерве после обоих путей инъекции, что указывает на то, что наши протоколы RB и внутривенных инъекций способны доставлять глазные препараты к сетчатке и зрительному нерву.
Обсуждение
Сложные проблемы, связанные с доставкой терапевтических препаратов к сетчатке и зрительному нерву, в первую очередь из-за непроницаемого барьера, создаваемого BRB, подчеркивают важность данного исследования 3,4. Изучение методов IVI и RBI не только подчеркивает инновационные подходы к преодолению этих препятствий, но и подчеркивает более широкие последствия для офтальмологической помощи и терапевтических разработок. Эти результаты показывают, что как IVI, так и RBI могут способствовать адресной доставке терапевтических средств непосредственно в пораженные ткани глаза. Этот целенаправленный подход жизненно важен для достижения терапевтических концентраций, которые часто недостижимы при системном или местном введении 2,11, тем самым повышая эффективность лечения различных глазных заболеваний.
Сравнительный анализ этих инъекционных техник выявляет их уникальные преимущества: IVI обеспечивает прямой доступ к стекловидному телу и внутренним слоям сетчатки27, в то время как RBI обеспечивает диффузию к зрительному нерву без нарушения целостности BRB28. Эти выводы способствуют более детальному пониманию того, как лучше всего доставлять конкретные терапевтические агенты, что в конечном итоге улучшает результаты лечения пациентов с заболеваниями глаз. Описанные здесь методы доставки IVI и RBI успешно доставляли терапевтические препараты, такие как циклоспорин, в критические ткани, что подчеркивает потенциал для разработки эффективных глазных терапий.
Кроме того, в процессе разработки этого терапевтического метода, ингаляционный изофлуран был выбран в качестве метода седации для данного протокола RBI и IVI, поскольку он быстро действует как в активации, так и в восстановлении. SALOOT обеспечивает жизненно важную поддержку и стабилизацию для грызуна, обеспечивая при этом равномерное количество ингаляционного анестетика. Как обсуждалось ранее, некоторые риски, связанные с RBI, включают возможное повреждение глаза из-за слепого введения иглы, а также блокировку кровотока или коллапс трахеи из-за техники давления, описанной в протоколе ретробульбарной инъекции для мышей23. Чтобы помочь снизить эти риски, в этом протоколе используются офтальмологические щипцы для захвата нижнего века животного для стабилизации, тем самым отказываясь от техники давления и устраняя блокировку кровотока или коллапс трахеи. Эта техника также дает лучший контроль над животным во время введения иглы. Использование щипцов в сочетании с использованием живого операционного микроскопа помогает свести к минимуму риск слепого введения, давая оператору лучшую визуализацию местоположения иглы. Кроме того, операционная платформа обеспечивает важнейшую поддержку головы, которая предотвращает смещение черепа во время введения иглы. Операционная платформа также обеспечивает подъем головы по отношению к остальной части тела, что позволяет голове находиться в более ровном положении, а поскольку платформа имеет соединения изофлурана и кислорода, уровень анестезии никогда не нарушается во время позиционирования. Метод IVI был принят из-за его уникальной способности обходить BRB путем введения терапевтических препаратов непосредственно в стекловидное тело. Этот метод создает возможность повреждения глаз из-за его инвазивного характера, но риск сводится к минимуму, если тщательно следить за тем, чтобы игла не поцарапала хрусталик, медленно извлекать иглу и оказывать давление на глаз в течение 10-15 секунд после инъекции.
Успешное извлечение и анализ образцов сетчатки и зрительного нерва en bloc стало возможным благодаря этому уникальному методу забора тканей. Была достигнута изоляция глаза и нерва en bloc, что помогает оценить всю зрительную систему, о чем свидетельствует окрашивание диска зрительного нерва и полное иммунофлуоресцентное окрашивание глаза (Рисунок 5). Этот метод позволяет визуализировать мозг, зрительные нервы и глобусы сверху вниз, что позволяет легче сохранить общую структуру и целостность наших тканей.
Это исследование имеет потенциальные ограничения, в том числе использование только одного пола животных и относительно небольшой размер выборки. Инъекции RB также связаны с присущим ограничением терапевтической утечки. После инъекции RB терапевтические препараты могут мигрировать из ретробульбарного пространства в переднюю часть глазного яблока. Этот метод был направлен на минимизацию этого врожденного ограничения за счет изменения угла введения и удержания иглы как можно ближе к задней части орбиты. Кроме того, было установлено, что поддержание светового давления после терапевтического введения в течение 10-15 с помогло предотвратить миграцию терапевтических средств из ретробульбарного пространства.
Эти методы будут использоваться в будущей работе по терапевтическому вмешательству на модели травматического повреждения глаза мелких животных. Методы IVI были расширены для использования на цыплятах и мышах; Тем не менее, размер иглы и терапевтические объемы должны быть скорректированы. Для цыплят оптимальными были признаны инсулиновая игла 28-29 г и 20 мкл терапевтического объема29, но для мышей было определено, что игла 31 г и 2 мкл терапевтического объема были идеальными. Методика IVI минимально изменилась с трансляцией на других животных. Для переноса RBI на другие виды необходимо адаптировать размер и объем иглы, но общая техника должна оставаться переводимой до тех пор, пока учитываются внутренние анатомические различия между видами.
Знания, полученные на моделях мелких животных, бесценны для углубления понимания механизмов доставки лекарств и оптимизации протоколов лечения. В конечном счете, это исследование закладывает основу для более эффективных методов лечения, которые могут значительно повысить качество оптической помощи, добиваясь успехов в сохранении зрения и улучшении результатов в клинической практике.
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была частично профинансирована Программой исследований зрения Министерства обороны США W81XWH-15-1-0074 и W81XWH-22-1-0989. Мнения или утверждения, содержащиеся в настоящем документе, являются частными взглядами авторов и не должны толковаться как официальные или отражающие точку зрения Министерства армии или Министерства обороны. Этот исследовательский грант был частично поддержан премией Ohio Affiliate of Prevent Blindness Young Investigator Young Investigator Student Fellowship Award для женщин-ученых в области исследований зрения. Мы с благодарностью признательны за поддержку со стороны Фонда Росса. Услуги были выполнены в рамках Исследовательской программы OSU Vision Sciences в рамках P30EY032857. Мы хотели бы поблагодарить Лабораторию и животные ресурсы Университета штата Огайо (ULAR). Кроме того, мы хотели бы поблагодарить студентов лаборатории Рейли Мишель Моско, Эмму Лалли, Сэма Дакворта и Еву Ховард. Мы также хотели бы поблагодарить Бонгсу Кима за вклад в разработку SALOOT, а также Элизабет Урбански и Райана Уэбба. Рисунок 1, рисунок 2A и рисунок 3 были созданы с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Anakinra 100 mg/0.67 mL | Sobi | NDC: 66658-0234-07 | |
| Antipamezole hydrochloride (Antisedan) 5.0 mg/mL | Zoetis | NADA #141-033 | 107204-8 | |
| Bacteriostatic sodium chloride (0.9%) | Hospira Inc. | NDC: 0409-1966-02 | |
| Cryotube | VWR | 76417-258 | https://us.vwr.com/store/product?keyword=76417-258 |
| Curved forceps | Fischer Scientific | 08-953F | |
| cyclosporine injection 250 mg/mL | Perrigo | NDC: 00574-0866-10 | |
| cyclosporine topical, 0.05% (Restasis) | AbbVie (Vizient) | NDC: 00023-9163-30 | |
| Cyotube Cap | Thermo Scientific | 3471BLK | https://www.fishersci.com/shop/products/screw-cap-microcentrifuge-tube-caps/14755237?searchHijack=true&searchTerm= screw-cap-microcentrifuge-tube-caps&searchType=Rapid& matchedCatNo=14755237 |
| Evans Blue | Sigma-Aldrich | E2129-10G | |
| Eye Spears | Fischer Scientific | NC0972725 | https://www.fishersci.com/shop/products/ultracell-pva-eye-spears-100-p/NC0972725 |
| Fine forceps | Fischer Scientific | 08-953E | https://www.fishersci.com/shop/products/fisherbrand-dissecting-jewelers-microforceps-2/08953E?gclid=Cj0KCQiAkJO8BhCGARIsAM kswyiER9Kanmi3ZMgoXTr82Zg3 g44m1Q6WLftkYfb36hC7pbkwR hVAy3MaAqkLEALw_wcB&ef_id =Cj0KCQiAkJO8BhCGARIsAMks wyiER9Kanmi3ZMgoXTr82Zg3g4 4m1Q6WLftkYfb36hC7pbkwRhV Ay3MaAqkLEALw_wcB:G:s&ppc _id=PLA_goog_2086145680_81 843405274_08953E__38624700 1354_6556597232892883360& ev_chn=shop&s_kwcid=AL!4428 !3!386247001354!!!g!827721591 040!&gad_source=1 |
| Fine ophthalmic forceps with teeth | Fisher Scientific | 50-253-8287 | https://www.fishersci.com/shop/products/bonn-suturing-forceps-7-5-cm/502538287 |
| Flat spatula | Fischer Scientific | 14-375-100 | https://www.fishersci.com/shop/products/fisherbrand-spoonula-lab-spoon/1437510#?keyword= |
| Hot bead Sterilizer | Fine Science Tools | 18000-45 | https://www.finescience.com/en-US/Products/Instrument-Care-Accessories/Sterilization/Hot-Bead-Sterilizers |
| Hypromellose 0.3% (GenTeal Tears Severe Dry Eye Gel) | Alcon Laboratories Inc. | https://www.amazon.com/GenTeal-Tears-Lubricant-Ointment-Night-Time/dp/B01IN5G1L0/ref=sr_1_4?dib=eyJ2IjoiMSJ9.DxYpqjIIBNO TVuPo7jln5xeGazA_YFg0cbt3 kCyC-0ouZARw5qIHYvCM7vB R_vO30OWUEXDZhQmQfLQ9 ySld4mujpzrWjxbsEXLBs5JPhjZ eUPgPY0sHoJA46f9EYULdxiTu BQy5fVA2OB20RV09mbdW8hX 6j8-bXIYTZljPGMo5_GMq9jnJo8 3iR35c1THxEiEH2FsvSx7VXup- QK9uCkWwAYrw2v3tyLUCq2JT APPF34nsYqGnSASMgOARU_ 2lVz-kIy-QUEYHGOoIimIWwBY htz33RkFrq7YjtnC2uDbImNiudG zWJv-uUhmJngYjbBGbeWE0VX 7CGPkEokUZrCQ8AI2HeXjSMph gPhMbK88RcHJ63AyH0TiBtS2k1 Xceh-CD26_prJSNxF6Mv5-jgGf9 iLmXvVtKkkSwc-5uYLk7gZHaFC Yj73F_imbmeHYr.4vfu7h4m4Jlfy- qiqmgeAnDHlJTGYV22HJ2w_xD ir0k&dib_tag=se&keywords=Gent eal+gel&qid=1736793609&sr=8-4 | |
| ibudilast | Millipore Sigma | I0157-10MG | |
| insulin syringe 0.5 mL with a 28 gauge Micro-Fine IV Needle | Becton, Dickinson and Company (BD) | 14-826-79 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| Ketamine | Covetrus | NDC: 11695-0703-1 | |
| Long Evans Rat | Charles River Laboratories International, Inc. | https://www.criver.com/products-services/find-model/long-evans-rat?region=3611 | |
| Mayo Scissors | Electron Microscopy Sciences | 72968-03 | |
| Medium microscissors | Amazon | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation | |
| Medium straight hemostats or needle drivers | Sigma-Aldrich | Z168866-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z168866#product-documentation |
| Needle 33 G with a style 4 tip at a length of 10 mm and angle of 15 degrees | Hamilton | 7803-05 | |
| paraformaldehyde 4 in phosphate-buffered saline (PBS) (4% PFA) | Thermo Fischer | J61899.AK | |
| Petri dish | Millipore Sigma | P5606-400EA | https://www.sigmaaldrich.com/US/en/product/sigma/p5606?utm_source=google&utm_medium= cpc&utm_campaign=8674694095 &utm_content=105162454052& gad_source=1&gclid=Cj0KCQiA kJO8BhCGARIsAMkswygXXfgY ABr7EfLtf4tvuLS0E8A4SxX4XM NJQDaI80Yi4FO-iahCsPcaAp9E EALw_wcB |
| phosphate-buffered saline (PBS) | Sigma-Aldrich | P3813-10PAK | https://www.sigmaaldrich.com/US/en/product/sigma/p3813 |
| Povidone-Iodine (Betadine) 5% | Alcon Laboratories Inc. | NDC: 0065-0411-30 | |
| Shaker Model 3500 | VWR | 89032-092 | |
| Small iris scissors | Sigma-Aldrich | Z265977-1EA | https://www.sigmaaldrich.com/US/en/product/aldrich/z265977& |
| small microscissors | Fisher Scientific | 17-456-004 | https://www.fishersci.com/shop/products/self-opening-scissors-2/17456004?keyword=true |
| Sprague Dawley Rat | Charles River Laboratories International, Inc. | SAS 400 | https://emodels.criver.com/product/400 |
| Sucrose | Millipore Sigma | 57-50-1 | https://www.sigmaaldrich.com/US/en/substance/sucrose3423057501 |
| syringe 10 µL (Model 701 RN) | Hamilton | 80330 | |
| Tattoo Ink (Intenze Tattoo Ink True Black 1 oz) | Amazon | https://www.amazon.com/Intenze-Tattoo-Ink-True-Black/dp/B01GW747L2 | |
| tauroursodeoxycholic acid (TUDCA) | Milipore Sigma | 580549-1GM | |
| Tetracaine Hydrochloride Ophthalmic Solution 0.5% | Bausch & Lomb Inc. | NDC: 68682-920-64 | |
| Xylazine (Rompun) 100 mg/mL | Dechra | NADA #047-956 | |
Ссылки
- Nguyen, D. D., Lai, J. -Y. Advancing the stimuli response of polymer-based drug delivery systems for ocular disease treatment. Polym Chem. 11 (44), 6988-7008 (2020).
- Tsai, C. -H., et al. Ocular drug delivery: Role of degradable polymeric nanocarriers for ophthalmic application. Int J Mol Sci. 19 (9), ijms19092830(2018).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: A key modulator in neurodegenerative diseases. Molecules (Basel, Switzerland). 24 (8), 24081583(2019).
- Ryan, A. K., Rich, W., Reilly, M. A. Oxidative stress in the brain and retina after traumatic injury. Front Neurosci. 17, 1021152(2023).
- De Matteis, V., Rizzello, L. Noble metals and soft bio-inspired nanoparticles in retinal diseases treatment: A perspective. Cells. 9 (3), 679(2020).
- O'Leary, F., Campbell, M. The blood-retina barrier in health and disease. FEBS J. 290 (4), 878-891 (2023).
- del Amo, E. M., et al. Pharmacokinetic aspects of retinal drug delivery. Prog Retin Eye Res. 57, 134-185 (2017).
- Nguyen, D. D., Luo, L. -J., Yang, C. -J., Lai, J. -Y. Highly retina-permeating and long-acting resveratrol/metformin nanotherapeutics for enhanced treatment of macular degeneration. ACS Nano. 17 (1), 168-183 (2023).
- Luo, L. -J., et al. Targeting nanocomposites with anti-oxidative/inflammatory/angiogenic activities for synergistically alleviating macular degeneration. App Mat Today. 24, 101156(2021).
- Naik, S., et al. Small interfering RNAs (siRNAs) based gene silencing strategies for the treatment of glaucoma: Recent advancements and future perspectives. Life Sci. 264, 118712(2021).
- Luo, L. -J., Nguyen, D. D., Lai, J. -Y. Dually functional hollow ceria nanoparticle platform for intraocular drug delivery: A push beyond the limits of static and dynamic ocular barriers toward glaucoma therapy. Biomat. 243, 119961(2020).
- Ghate, D., Brooks, W., McCarey, B. E., Edelhauser, H. F. Pharmacokinetics of intraocular drug delivery by periocular injections using ocular fluorophotometry. Invest Ophthalmol Vis Sci. 48 (5), 2230-2237 (2007).
- Soni, V., Pandey, V., Tiwari, R., Asati, S., Tekade, R. K. Chapter 13 - Design and evaluation of ophthalmic delivery formulations. Basic Fund Drug Deliv. , 473-538 (2019).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 313(2020).
- Chiu, K., Chang, R. C. -C., So, K. -F. Intravitreous injection for establishing ocular diseases model. J Vis Exp. (8), e313(2007).
- Park, I., Park, H. S., Kim, H. K., Chung, W. K., Kim, K. Real-time measurement of intraocular pressure variation during automatic intravitreal injections: An ex-vivo experimental study using porcine eyes. PLOS One. 16 (8), e0256344(2021).
- Cosan, S., et al. Effect of retrobulbar prostaglandin analog injection on orbital fat in rats. Int Ophthal. 43 (12), 4985-4990 (2023).
- Levy, Y., Kremer, I., Shavit, S., Korczyn, A. D. The pupillary effects of retrobulbar injection of botulinum toxin A (oculinum) in albino rats. Invest Ophthalmol Vis Sci. 32 (1), 122-125 (1991).
- Jbara, D., Eiger-Moscovich, M., Didkovsky, E., Keshet, Y., Avisar, I. In vivo effects of prostaglandin analogs application by topical drops or retrobulbar injections on the orbital fat of a rat model. Ocular Imm Inflamm. 31, 1-6 (2022).
- Eftekhari, K., et al. Histologic evidence of orbital inflammation from retrobulbar alcohol and chlorpromazine injection: A clinicopathologic study in human and rat orbits. Ophthal Plastic and Reconstr Surg. 32 (4), 302-304 (2016).
- Bohnert, B. N., et al. Retrobulbar sinus injection of doxorubicin is more efficient than lateral tail vein injection at inducing experimental nephrotic syndrome in mice: A pilot study. Lab Animals. 53 (6), 564-576 (2019).
- Socher, M., Kuntz, J., Sawall, S., Bartling, S., Kachelrieß, M. The retrobulbar sinus is superior to the lateral tail vein for the injection of contrast media in small animal cardiac imaging. Lab Animals. 48 (2), 105-113 (2014).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animals. 40 (5), 155-160 (2011).
- Pozyuchenko, K., et al. Investigating animal models of optic neuropathy: An accurate method for optic nerve and chiasm dissection in mice. J Neurosci Methods. 331, 108527(2020).
- Sengupta, P. The laboratory rat: Relating its age with human's. Int J Prevent Med. 4 (6), 624-630 (2013).
- Ryan, A. K., et al. Torsion-Induced Traumatic Optic Neuropathy (TITON): A physiologically relevant animal model of traumatic optic neuropathy. PLOS One. 20 (1), e0312220(2025).
- Bora, K., et al. Assessment of Inner blood-retinal barrier: Animal models and methods. Cells. 12 (20), 2443(2023).
- Vinores, S. A. Breakdown of the blood-retinal barrier. Encyc Eye. , 216-222 (2010).
- Heisler-Taylor, T., et al. Multimodal imaging and functional analysis of the chick NMDA retinal damage model. PLOS One. 16 (9), e0257148(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены