Method Article
Elektroensefalogram ve Elektrokardiyogram Telemetri Cihazlarının Yenidoğan Tavşan Kitlerine İmplantasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Epilepside ani beklenmedik ölüm mekanizmaları (SUDEP) tam olarak anlaşılamamıştır ve mevcut modellerden tercüme edilmesi zordur. Transgenik tavşanlar bu mekanizmalar hakkında fikir verebilir. Ölümle sonuçlanabilecek ciddi olayları değerlendirmek için transgenik tavşan kitlerinde uzun süreli, sürekli elektroensefalografi ve elektrokardiyografi kayıtları için bir yöntem tarif ediyoruz.
Özet
İyon kanalı genlerindeki patojenik varyantlar, epilepside (SUDEP) yüksek oranda ani beklenmedik ölüm ile ilişkilidir. SUDEP'in mekanizmaları tam olarak anlaşılamamıştır ancak nöbetlere ek olarak otonomik disfonksiyon ve kardiyak aritmileri de içerebilir. Bazı iyon kanalı genleri hem beyinde hem de kalpte eksprese edilir ve epilepsi ve kardiyak aritmilerle ilişkili iyon kanalopatileri olan hastalarda SUDEP riskini potansiyel olarak artırır. Epilepsi varyantlarını eksprese eden transgenik tavşanlar, SUDEP'in karmaşık fizyolojisini incelemek için bütün bir organizma sağlar. Daha da önemlisi, tavşanlar insan kalp fizyolojisini fare modellerinden daha yakından kopyalar. Bununla birlikte, tavşan modellerinin, invaziv izleme prosedürlerinden geçerken ek sağlık ve anestezi hususları vardır. Yenidoğan tavşan kitlerinde uzun süreli eşzamanlı elektroensefalogram (EEG) ve elektrokardiyogram (EKG) izlemesi için bir telemetri cihazını cerrahi olarak implante etmek için yeni bir yöntem geliştirdik. Burada, P14 (ağırlık aralığı 175-250 g) kitlerine bir telemetri cihazı yerleştirmek için cerrahi yaklaşım, uygun anestezi ve monitörizasyon ve ameliyat sonrası bakım ile ilgili ayrıntılı dikkat gösterilerek düşük komplikasyon oranı elde edilen cerrahi yöntemler gösterilmektedir. Bu yöntem, genetik veya edinilmiş epilepsilerin tavşan modellerinde kardiyak aritmiler, nöbetler ve potansiyel SUDEP gelişimindeki kritik noktalarda nöral ve kardiyak elektrofizyolojinin sürekli izlenmesine izin verir.
Giriş
Epilepside ani beklenmedik ölüm (SUDEP), epilepsili hastalarda önde gelen bir ölüm nedenidir. SUDEP'in mekanizmaları tam olarak anlaşılamamıştır, ancak potansiyel olarak nöbetlere ek olarak otonomik disfonksiyon, apne ve kardiyak aritmileri içerir 1,2,3,4,5,6,7. Lokanalopatiye bağlı genetik epilepsileri olan hastalar en yüksek SUDEP oranlarına sahiptir. Örneğin, SUDEP, yaşamın ilk yılında başlayan genetik bir epilepsi olan Dravet sendromundan sorumlu gen olan voltaj kapılı sodyum kanal geni SCN1A8'de varyantları olan hastaların% 20'sinde görülür. Epilepsiye bağlı birçok iyon kanalı geni hem beyinde hem de kalpte eksprese edilir, laboratuvar ve klinik veriler, kanalopatiye bağlı genetik epilepsileri olan hastalarda kardiyak aritmilerin mevcut olabileceğini düşündürmektedir7, 9,10,11,12 ve potansiyel olarak nöbet kaynaklı ölümcül kardiyak aritmi veya aynı anda nöbet ve aritmi oluşumu nedeniyle SUDEP riskini artırır. SUDEP'in laboratuvar ortamında değerlendirilmesi çok sayıda zorluğu beraberinde getirmektedir. Kardiyak bir bakış açısına göre, farelerdeki kardiyak aksiyon potansiyelleri insanlardakinden çok farklıdır13 ve insan iPSC-kardiyak miyosit modelleri14 tüm organizmanın karmaşıklıklarını çoğaltamaz. Genetik epilepsilerin transgenik tavşan modelleri, tavşan kardiyak fizyolojisi insan13,15'inkini daha yakından kopyaladığından, karmaşık patofizyolojiyi incelemek için bütün bir organizma sağlarken, SUDEP'i incelemek için ideal bir sistem sağlar. SUDEP ilk nöbet kadar erken ortaya çıkabileceğinden, bu hayvan modellerini erken bir zaman noktasından değerlendirmek, hem nöbetlerin hem de kardiyak aritmilerin başlangıcını anlamak için esastır. Yenidoğan döneminde video kaydı zordur, çünkü tavşan kitleri genellikle hala yuvadadır. Geleneksel bir kablolu sistemle sürekli elektroensefalogram (EEG) veya elektrokardiyogram (EKG) kaydı, kitler barajdayken mümkün değildir. Aralıklı kaydın SUDEP ile ilişkili nadir, terminal olayları yakalaması olası değildir. Bu nedenle, tavşan kitlerinde uzun süreli, sürekli, eş zamanlı EEG ve EKG kaydı sağlamak için kablosuz implante edilebilir telemetri izlemeye yöneldik.
Bu protokolde başarının anahtarı, bu hassas hayvanlar için uygun anestezi ve postoperatif destektir. Tavşanlar, benzersiz anatomik ve fizyolojik özellikler nedeniyle köpek ve kedilere (%0.17-%0.24) kıyasla anestezik ölüm riski (%1.39-%4.8) çok daha yüksektir16,17. Bu artmış anestezik riske ana katkıda bulunanlar arasında optimal olmayan hava yolu yönetimi ve akut postoperatif komplikasyonlar yer alır. Geniş dilli uzun, dar bir ağız, ağız ile gırtlak arasında keskin bir açı, epiglotun dorsal yer değiştirmesi, laringeal travmaya karşı artan duyarlılık ve laringospazm eğiliminin artması dahil olmak üzere birçok faktör tavşanlarda entübasyon zorluğuna katkıda bulunur 18,19,20. Anında anestezik ataktan sonra, tavşanlar hayatı tehdit eden gastrointestinal staz sendromu geliştirme riski altındadır. Bu karmaşık, çok faktörlü bir problemdir ve anestezinin, herhangi bir nedenle (rahatlamayan ağrı, mide bulantısı, vb.) prosedür sonrası mide motilitesini ve/veya sekonder anoreksiyi inhibe eden doğrudan ilaç etkileri yoluyla katkıda bulunduğu varsayılmaktadır.21.
Tavşan yenidoğanların ve bebeklerin benzersiz fizyolojisi, anestezi ve cerrahi ile ilgili zorlukları daha da kötüleştirir. Tavşanlar, fizyolojik homeostaz ve özel anatomik hususlar için az gelişmiş mekanizmalarla doğan altricial gençlere sahiptir. Çoğu ticari ürün, Hollanda kemerli ve Yeni Zelanda Beyaz çapraz tavşan kitlerinin küçük vasküler boyutu, yüksek dinlenme kalp atış hızı ve pigmentli cildi için optimize edilmediğinden, intravenöz erişim ve izleme zordur. Yenidoğanlarda22 kardiyak debi esas olarak kalp atış hızına bağlı olduğundan ve genel olarak böbrek veya karaciğer yolu ile ilaç klerensi yetişkinlere23 kıyasla azaldığından, uygun ilaç seçimi ve dozu ile ilgili hususlar kritiktir. Tavşanlarda anestezik ölümün birincil nedeninin solunum depresyonu ve apneye ikincil olduğu düşünülmektedir. Tüm tavşanlar için daha önce tartışılan hava yolu yönetimi sorunlarına ek olarak, yenidoğanların hipoksemi ve hiperkapni karşısında depresif bir solunum dürtüsü vardır ve bu da anestezinin zaten zorlu olan bu yönünü daha riskli hale getirir24.
Bu protokolde, epilepsi hastasının neonatal tavşan modelinde cerrahi ve anestezik sağkalım oranı yüksek olan EEG ve EKG telemetri implantı için başarılı bir yöntem tanımlanmıştır (Şekil 1). Bu bilgi, diğer araştırmacıların epilepsi, kardiyak aritmi ve ilgili nörogelişimsel bozukluklarla ilgili araştırmaları ilerletmek için zorlu yenidoğan tavşan modellerinin üstesinden gelmelerini sağlayacaktır.
Protokol
Açıklanan tüm çalışmalar, onaylanmış bir hayvan kullanım protokolünün bir parçası olarak Michigan Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından gözden geçirilmiş ve onaylanmıştır ve USDA Hayvan Refahı Yasası ve NIH Halk Sağlığı Hizmeti Politikası dahil olmak üzere ilgili federal yasalar ve yönergelerle uyumludur. Michigan Üniversitesi, AAALACi tarafından akredite edilmiş bir kurumdur.
1. Hayvan hazırlama
- İşlemden 1-2 gün önce cerrahi tıraş kitleri (yaş P14-P19, ağırlık >175 g) ve ameliyat günü makas kullanarak anestezi süresini en aza indirin.
- Prosedüre hazırlanırken tüm cerrahi alet ve malzemeleri (mümkün olduğunca) otoklav veya gazla sterilize edin.
- Ketamin (10 mg / kg IM), buprenorfin HCl (0.01 mg / kg IM) 0.3 mg / mL'ye seyreltilmiş 0.3 mg / mL ve yeniden solumayan bir devre kullanarak maske anestezisi yoluyla sevofluran ve oksijen ile anesteziyi indükleyin.
- Auriküler ven (tercih edilen) veya sefalik ven içine 26 G 3/4" intravenöz (IV) kateter yerleştirin ve heparinize salin 10 birim / mL ile yıkayın.
- # 40 veya # 50 bıçak kullanarak karın, göğüs, sırt, boyn ve başı cilde mümkün olduğunca yakın tıraş edin.
- Kornea ülserasyonunu önlemek için ilaçsız kayganlaştırıcı oftalmik merhem uygulayın.
- Analjezikler (carprofen 4 mg / kg SQ - 25 mg / mL'ye seyreltilmiş) ve perioperatif antibiyotik (sefazolin 20 mg / kg IV, 50 mg / mL'ye seyreltilmiş) uygulayın. Cerrahi sürenin her 90-180 dakikasında bir antibiyotikleri yeniden uygulayın.
2. Cerrahi hazırlık (Şekil 2)
- Anestezi kitini ameliyat masasına aktarın ve rektal termometre ile kontrol edilen kızılötesi bir ısıtma yastığına sırtüstü yatırın.
- Burnu ve ağzı, yeniden nefes almayan bir Jackson-Rees devresine (0,5 L torba) döner bir konektörle bağlı özel bir 3D baskılı yüz maskesine yerleştirin ve 2 L / dk'da oksijen akışıyla sevofluran anestezisine (etki için% 1,5 -% 7) devam edin.
- Sevofluran ile anesteziyi koruyun ve anestezi derinliğini kulak veya pençe üzerinde bir nabız oksimetresi ve / veya femoral arter üzerinde veya doğrudan kalp üzerinde bir Doppler ile izleyin.
- Kalp atış hızını (HR) 180-260, oksijen satürasyonunu %>85) ve solunum hızını dakikada 10-50 nefes arasında tutmak için prosedür boyunca anesteziyi ayarlayın (gezilerin doğrudan görselleştirilmesi veya yeniden solunum torbasının hareketi).
NOT: Acil durum ilaçları bulundurun (glikopirrolat, epinefrin, doksapram). - Ön uzuvları maskeye nazikçe bantlayarak kiti yüz maskesine sabitleyin.
- Sol arka bacağını ameliyat masasına gevşek bir şekilde sabitleyerek kiti hafif sağ yanal bir konuma getirin.
- Tüm karnı ısıtılmış bir cerrahi ovma, alternatif betadin ve steril salin ile hazırlayın.
NOT: İstenirse fırçalamayı bitirmek için ek bir cerrahi solüsyon kullanılabilir. Özel önlükler, saç boneleri ve galoşlar giyen cerrah, prosedürü steril koşullar altında gerçekleştirmek için aseptik olarak fırçalayacak ve steril önlük ve eldiven giyecektir. - Kitin her iki tarafına yapışkanlı cerrahi havlular yerleştirin ve üzerini büyük bir cerrahi örtü ile örtün. Karın ve göğsü ortaya çıkarmak için uygun büyüklükte bir delik açın.
- İmplantı cerrahi alana açın ve implant ankraj deliklerinin her birine emilmeyen ankraj dikişleri yerleştirin. Sütürü 5-6 cm'lik bir kuyrukla bağlı bırakın (Şekil 3A). İmplantı ısıtılmış steril tuzlu su dolu bir kaseye yerleştirin.
3. İmplantın karın içine yerleştirilmesi
- Yeterli anesteziyi sağladıktan sonra, bir neşter ile linea alba boyunca deriden 3 cm'lik bir kesi yapın.
- Periton boşluğunu açmak için kas boyunca dikkatli bir kesi yapın.
- İmplantı karın boşluğunun kraniyal kısmına yerleştirin ve insizyonun soluna yerleştirin.
- Negatif EKG telini periton boşluğundan ve cildi insizyonun yaklaşık 2 cm sağında tünellemek için bir trokar kullanın. İmplantın periton boşluğu içinde rahat bir şekilde oturmasını sağlamak için kalan 3 teli insizyonun 3-4 cm soluna tünelleyin.
- İmplantı ankraj dikişleri ile periton boşluğunun ventral duvarına sabitleyin ve bağırsak sıkışması olmadığından emin olun (Şekil 3B).
- Karın duvarını sürekli bir düzende emilebilir bir sütür ile kapatın.
- Cilt kesisini kesikli bir şekilde emilmeyen bir sütürle kapatın.
4. EKG uçlarının yerleştirilmesi
- Negatif EKG ucunu deri altından ilk kaburga seviyesinde sağ üst göğse tünelleyin.
- Yaklaşık 10 cm'lik teli gevşek bir şekilde sarmak için deri altı bir cebi kör bir şekilde inceleyin.
NOT: Deri altındaki sıkı bobinler cilt erozyonuna ve tel maruziyetine neden olabilir. - Fazla teli kesin ve ucunu emilemeyen bir dikiş ile yalıtılmış tele bağlayarak açıkta kalan tel ile bir halka oluşturun.
- İlmeği 2 adet emilmeyen sütürle kasın üzerine sabitleyin.
- Telin etrafında sağdaki periton kasını 1-2 adet emilebilir sütür ile kesikli bir şekilde kapatın.
- Sağ üst göğüs ve sağ karın bölgesindeki cildi 2-3 adet emilmeyen sütürle kesintili bir şekilde kapatın.
- Pozitif EKG kablosunu sol alt kaburgaya tünelleyin ve kaslara sabitlemek ve insizyonu kapatmak için yukarıdaki adımları tekrarlayın.
- Tünel: EEG, cerrahi alanda mümkün olduğunca deri altından sol lateral tarafa yönlendirir.
- Çıkan tellerin etrafında solda bulunan periton kasına 1 adet emilebilir sütür ekleyin. Cildi emilemeyen sütür ile kesikli bir şekilde kapatın.
- Açıkta kalan EEG tellerini steril alüminyum folyo ile sarın.
5. Sırt yüzeyinin hazırlanması
- Steril olmayan bir asistan daha sonra steril örtüyü ve bacak bağını çıkaracaktır.
- Yüz maskesi ile devre arasındaki döner konektörü kullanarak döndürerek yüz maskesinin güvenli bir şekilde yerinde kalmasını sağlarken kiti yüzüstü konuma getirin (Şekil 2B). Sürekli anestezik izlemeyi sağlamak için nabız öküz ve/veya doppler monitörlerini gerektiği gibi ayarlayın.
- Cerrahi alanı, sol taraftaki çıkan tellerin bulunduğu bölgeyi fırçalamak için dikkatli bir şekilde baş, boyun ve tüm sırtı içerecek şekilde bir betadin ovma ile hazırlayın.
- Cerrah daha sonra sol tarafın altına steril bir yapışkan havlu yerleştirirken, alüminyum folyo tel paketi steril olmayan bir asistan tarafından tutulur.
- Kabloları steril ve nazikçe alüminyum paketten çıkarın ve steril alana yerleştirin. Örtüyü steril havlularla bitirin.
- Steril bir örtü ile örtün ve tüm steril alanı açığa çıkaracak kadar büyük bir pencere kesin.
6. EEG derivasyonlarının yerleştirilmesi
- Kafatasını ortaya çıkarmak için orta hatta kafa derisinden 3 cm'lik bir kesi yapın.
- EEG kablolarını sol taraftan kafatasına deri altından tünellemek için bir trokar kullanın.
- Bir neşter kullanarak açıkta kalan parietal kemiklerden periosteuumu temizleyin ve kazıyın.
- Steril bir ultrason kapağına el tipi bir matkap yerleştirin. Matkaba 1.0 mm'lik bir matkap çapağı yerleştirin.
- Parietal kemiklere, lambdanın yaklaşık 0,5 cm önünde ve sagital sütürün 0,5 cm yanında bilateral çapak delikleri açın.
NOT: Ventral hava yolunu tıkayabileceğinden, dorsal kafatasına uygulanan basınç miktarına dikkat edin, bu nedenle prosedürün bu noktasında solunum izleme çok önemlidir. Kalp atış hızındaki sabit veya önemli bir düşüş, solunum tıkanıklığını (apneye sekonder bradikardi) gösterebilir ve derhal değerlendirme ve harekete geçilmelidir. - Çapak deliğine bir vida yerleştirmek için ince forseps kullanın. Yaklaşık yarıya kadar sokmak için tornavidayı kullanın (Şekil 3C).
- Yaklaşık 10 cm'lik teli gevşek bir şekilde sarmak için boynun arkası boyunca deri altı bir cebi kör bir şekilde inceleyin.
- Fazla kabloyu kesin. İzolasyonu uçtan soyun ve teli gerin.
- Açıkta kalan telin sonunda bir düğüm atarak, küçük bir ilmek tutarak bir ilmek oluşturun. Halkayı vidanın üzerine yerleştirin ve telin vidaya temas ettiğinden emin olarak vidayı kafatasına sıkın. Topraklama kablosunu sola ve kayıt kablosunu sağa yerleştirin.
- Tüm kablolar yerleştirildikten sonra analiz yazılımındaki telemetri sinyallerini aslına uygunluk açısından değerlendirin. Kit sakinleştirilirken EEG sinyali düşük bir genlikte görünecektir.
- Vidaları ve telleri diş akrilik ile kafatasına sabitleyin ve tamamen sertleşmesine izin verin.
- Baş ve sol yanda emilmeyen bir dikiş ile cildi kapatın.
- Her insizyonda deri altından bupivakain (maksimum doz 2 mg / kg 5 mg / mL, 2.5 mg / mL'ye seyreltilmiş) enjekte edin. Her kesiği bir tüberkülin şırıngası kullanılarak uygulanan az miktarda cilt yapıştırıcısı ile örtün.
7. Anestezi iyileşmesi
- Sevofluran anestezisini kapatın ve kalan bandı, örtüyü ve anestezik izlemeyi çıkarırken en az 5 dakika boyunca sadece oksijen sağlayın.
- Bir glükometre kullanarak kan şekeri seviyelerini kontrol edin ve ısıtılmış deri altı sıvılarını vücut ağırlığının% 10'unda (kg) uygulayın.
- Hayvan ağrılı bir uyarana (ayak parmağı çimdikleme) tepki verdiğinde, 37-38 °C'ye ayarlanmış bir kurtarma inkübatörüne geçin.
NOT: Çoğu zaman, bu aktarım sırasında kitin sıcaklığı önemli ölçüde düşecektir. Kiti biofeedback kızılötesi ısıtma yastığına geri döndürmek veya ek ek ısı sağlamak faydalı olabilir. - Görsel olarak sürekli izleyin ve her 10-15 dakikada bir rektal sıcaklığı, nabız oksimetresi okumalarını, kalp atış hızını ve solunum hızını kaydedin.
- Hayvan sürekli olarak ayaktan ve uyanık olduğunda, intravenöz kateteri çıkarın ve kanama durana kadar bölgeye baskı uygulayın.
8. Ameliyat sonrası bakım ve izleme
- Kiti baraja ve çöp arkadaşlarına iade edin. Termoregülasyon ve toparlanmaya yardımcı olmak için kafeste yuvalama materyali ve ek beslenmenin (Malzeme Tablosu) bulunduğundan emin olun.
- Ameliyatı takip eden 7-10 gün boyunca kiti günlük olarak kontrol edin, günlük tartı yapın ve kafes içinde ek beslenme sağlayın.
- İyileşmeden sonraki ilk 2 gün (D1 ve D2), her 24 saatte bir ek analjezikler (carprofen 4 mg / kg SQ - 5 mg / mL'ye seyreltilmiş) ve deri altı sıvıları (5-7 mL) verin.
- İyileşmeden sonraki ilk 3 gün (D1, D2 ve D3) kiti günde iki kez kontrol edin ve ağrı, ambulasyon, insizyonel görünüm ve hidrasyon kanıtlarını değerlendirin. Bu süre zarfında günde bir kez, enfeksiyon kanıtı olmadığından ve uygun termoregülasyondan emin olmak için kitin sıcaklığını ölçün.
- Kesiler 7-10 gün içinde uygun şekilde iyileşirse dikişleri çıkarın.
Sonuçlar
Bu projenin başarılı bir şekilde sonuçlanması, implant prosedüründe ve kayıt protokolünde birden fazla parametrenin geliştirilmesini gerektirdi. İmplant cerrahisi 16 tavşan kiti üzerinde denendi veya gerçekleştirildi ve 14'ü prosedürden başarıyla kurtuldu. Bunlardan 12'si deneysel son noktaya kadar hayatta kaldı. İntraoperatif veya postoperatif ölüm nedenleri, deneysel son noktaya ulaşmada gelecekteki başarıya izin veren prosedür değişiklikleri ile birlikte Tablo 1'de vurgulanmaktadır. En sık görülen operatif komplikasyon, hipoksi ve bradikardiye yol açan solunum depresyonu idi. Protokol, 2 nabız oksimetresi ve bir Doppler monitörü dahil olmak üzere çoklu izleme modalitelerini içerecek şekilde değiştirildi. Bu, cerrahi prosedür sırasında bir monitörün arızalanması veya gevşemesi durumunda yedeklemenin izlenmesine olanak tanır. Ek olarak, tavşanlardaki deri pigmentleri, nabız oksimetresini daha az güvenilir hale getirebilir ve vücudun birden fazla noktasından izlemeyi gerektirebilir. İndüksiyon ve iyileşme genellikle anestezinin en riskli dönemleri olarak kabul edilirken, prosedür boyunca diğer noktalarda bradikardiye yol açan solunum depresyonu gözlemledik ve bu da her zaman uyanık yaşamsal belirtilerin izlenmesi ihtiyacını vurguladı. Bu komplikasyona yönelik bir müdahale olarak, hayvanların ilk iki cerrahi kohortunda (hayvanlar 1-4) anestezik komplikasyonlar gözlendikten sonra protokole ek izleme ve doxapram eklendi. 12 ve 13 numaralı hayvanlar aynı kohortta idi ve zayıf solunum dürtüsü nedeniyle doxapram (2-5 mg / kg, IV veya dil altı) uygulandı. Her ikisi de intraoperatif olarak solunum depresyonu ve apneden başarılı bir şekilde resüsitasyon edildi.
Telemetri kayıtları, kitler ev kafeslerine geri döndükten hemen sonra yapılabilir ve genellikle kit anesteziden tamamen iyileşene kadar nispeten düşük genlikli EEG sinyalleri gösterir (Şekil 4). EKG sinyal morfolojisi, kaydın ilk birkaç gününde yara izi oluştukça biraz değişebilir ve EKG telinin konumu daha da sağlamlaştırılır (Şekil 4B). EEG ve EKG sinyal kalitesi, sinyalde bozulma olmadan zamanla sağlamdır, yeterli miktarda aşırı tel, büyümeye izin vermek için deri altından sarmal olarak bırakılır. İmplant, EEG ve EKG'ye ek olarak sıcaklık, hızlanma ve sinyal kalitesi dahil olmak üzere çeşitli biyopotansiyelleri izleyebildiğinden, telemetri kayıtları çalışmanın bireysel ihtiyaçlarına göre özelleştirilebilir (Şekil 5). Veri analizi Emka ECGAuto yazılımı ile offline olarak gerçekleştirilmektedir. 500 Hz'de EEG ve EKG veri toplama ile implant pilleri yaklaşık 55 gün dayanır. Bu zaman aralığı, veri toplama parametreleri değiştirilerek veya aralıklı örnekleme ile uzatılabilir. EKGAuto'da nöbet tespitine yardımcı olmak için yazılım programlaması yapılabilir (Şekil 5). İmplante edilen tavşanlar, enfeksiyon için en yüksek riskli dönem olduğundan, ameliyattan sonraki ilk 7 gün boyunca cilt eritemi, ağırlık ve sıcaklık açısından izlenir. Ameliyat sonrası, tavşan kitleri işlemden 1-3 gün sonra kilo alımı göstermeye başlar ve bu da işlemden minimum sıkıntı olduğunu gösterir. Veteriner personeli, ameliyat sonrası ilk hafta 2-3 kez kapsamlı muayeneler yapar ve iyileşme sırasında endişeler ortaya çıkarsa daha düzenli aralıklarla muayene eder. Deneyimlerimize göre, kitler yuvaya geri döndükten sonra geyik dikiş bölgelerini önemli ölçüde rahatsız etmez, bu nedenle yara iyileşmesi mükemmel olmuştur. Birkaç kitte kraniyal insizyonda benign seromlar gelişti (Tablo 1), bunun için 3 gün daha carprofen verildi ve bu da daha fazla komplikasyon olmadan seroma rezolüsyonu ile sonuçlandı. Uzun süreli, tavşanlar laboratuvar personeli veya hayvancılık personeli tarafından sıkıntı belirtileri açısından günlük olarak gözlemlenir. Veteriner personeli, herhangi bir endişe ortaya çıkarsa tavşanları muayene etmek ve tedavi etmek için hazırdır. Telemetre sinyal kalitesi, pil bitene kadar cihaz veya kablo arızası için günlük olarak kontrol edilir.
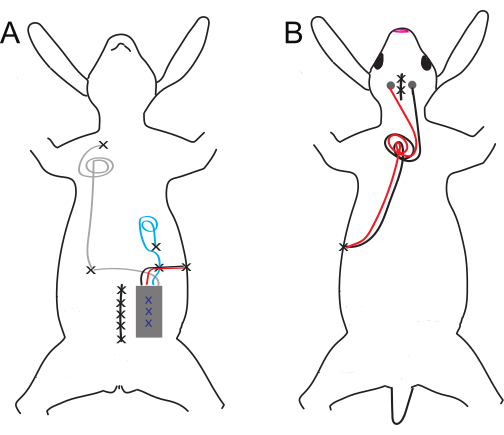
Şekil 1: Ventral ve dorsal implant şeması ve elektrot yerleşimi. (A) Ventral ve (B) dorsal implantlar. Sütür bölgeleri siyah X'ler ile gösterilirken, mavi X'ler abdominal implantın iç yapışma dikişlerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
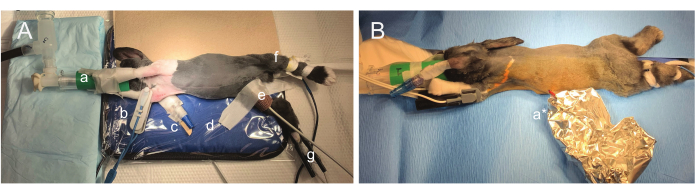
Şekil 2: Cerrahi konumlandırma fotoğrafları. (A) Hayvan, abdominal implanta, torasik EKG elektrovütünün yerleştirilmesine ve aynı cerrahi pozisyonda tellerin dorsuma kısmi tünellenmesine izin vermek için kısmen döndürülür. Burun, özel bir 3D baskılı yüz maskesine (a) rahatça yerleştirilmiştir ve ön uzuvlara gevşek bir şekilde bantlanmıştır. SpO2 izlemesi aralıklı olabilir, bu nedenle birden fazla prob kullanılır (sağ önkol (b) ve sağ arka bacak (g)). Sağ kulağa intravenöz bir kateter yerleştirilir (c). Gösterilen diğer anestezik monitörizasyon, biofeedback kızılötesi sıcaklık monitörizasyonu (d) ve sağ femoral arteri (e) kullanan Doppler monitörizasyonunu içerir. Solunum, hayvanın veya yeniden solunum torbasının gözlemlenmesiyle görsel olarak izlenir. (B) İmplant ve EKG ucu yerleştirildikten sonra steril alan kırılır ve tavşan yüzüstü pozisyona döndürülür. Sırt yüzeyi EEG kurşun yerleştirme için hazırlandığı için teller bir folyo torba (a*) içinde steril kalır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Cerrahi prosedürdeki temel adımlar. (A) Cilt kesisinden önce implanta üç dikiş atılır. (B) İmplantı periton boşluğunun ventral duvarına sabitlemek için uzun bir kuyruk kalır. (C) Kafatasına vidalanırken kafatası vidaları ince forseps ile tutulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
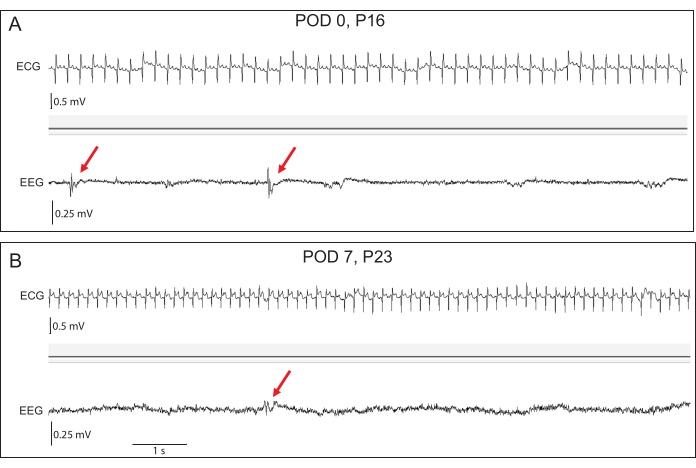
Şekil 4: Temsili erken EEG ve EKG kayıtları. (A) Postoperatif gün (POD) 0'da, başlangıç EEG amplitüdleri düşüktür, ancak transgenik tavşanlarda interiktal epileptiform deşarjlar (kırmızı oklar) görülebilir. (B) POD 7 ile EEG amplitüdleri artmıştır. Epileptiform akıntılar belirgin kalır. EKG sinyal doğruluğu her iki zaman noktasında da mükemmeldir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Bir P66 transgenik tavşan kitinde tonik-klonik nöbet sırasında temsili ham izlemeler. Önceden işlenmiş telemetre verileri, çevrimdışı analiz için (A) EEG, (B) sıcaklık, (C) hızlanma, (D) EKG ve (E) sinyal kalitesi ölçümlerini içerir. Postoperatif 52. günde tüm biyopotansiyellerin sinyal kalitesi mükemmel olmaya devam ediyor. Nöbet başlangıcı kırmızı okla gösterilir. Nöbet başlangıcında başlangıç ayarlaması ile işlenmiş EEG verileri (a), nöbetin tonik fazı sırasında sinyal zayıflamasını gösterir. İşlenmiş bir taban çizgisi (b) olan EKG verileri, nöbetin tonik fazı sırasında aşırı kas artefaktları ile bile görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Cerrahi sonuçlar. Cerrahi ve postoperatif komplikasyonlar implant yerleştirme prosedüründe çok sayıda değişikliğe yol açmıştır. 16 tavşanın 14'ü (%87.5) cerrahi işlemi sağ bıraktı ve 2 tavşanda ötenazi gerektiren postoperatif komplikasyonlar vardı. Hayvanlar ameliyat tarihine göre kronolojik sıraya göre gösterilir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Anestezik indüksiyon, izleme ve destek için açıklanan protokol, cerrahi yaklaşım için araştırma ihtiyaçlarını dengeler ve veteriner bakımının altın standartlarıyla kolaylık sağlar. Laboratuvar tarif edilen protokolü standart prosedür olarak benimsemeden önce, dorsal deri altı implant yerleştirilmesi, endotrakeal tüp veya laringeal maske hava yolunun kullanımı ve kalp atış hızının izlenmesi için özofagus stetoskop eklentisinin kullanımı dahil olmak üzere diğer birçok potansiyel iyileştirme denendi. Ancak, hepsi nihayetinde çeşitli nedenlerle terk edildi. Telemetri yerleştirilmesi için yeterli deri altı boşluğu olmasına rağmen, telemetri gövdesi ve kablo çıkış tasarımı nedeniyle ölü alanın kapatılamaması, hayvan büyümesine izin vermek için tellerin konumlandırılması ve sarılması zorluğu ve EKG'yi sabitlemek için intraoperatif olarak gerekli 2 pozisyon değişikliği, cerrahi süreyi önemli ölçüde uzatır ve gereksiz lojistik zorluklar ekler. Ek olarak, maske anestezisinin kullanılması genellikle tavsiye edilmese de, uygun büyüklükte LMA'ların olmaması ve yerleştirildikten sonra bir endotrakeal tüpün emniyete alınamaması ve sürdürülememesi, bunları seçenek olarak engellemiştir. Ameliyatın ortasında kiti çevirme gerekliliği ve ayrıca başın boynuna ve sırtına erişme ihtiyacı, yenidoğan tavşan entübasyonu için daha önce açıklanan bir tekniğe dayalı olarak başarılı bir yerleştirmeden sonra bile endotrakeal tüpü sabitlemek için sınırlı seçenekler25. Ayrıca, nabız oksimetresi veya Doppler'den gelen sinyalde bir kayıp olması durumunda kit örtüldükten sonra kalp atış hızının izlenmesi için bir özofagus stetoskop probunun kullanımını denedik. Bununla birlikte, ticari olarak temin edilebilen tüm özofagus stetoskopları çok büyüktü ve her yerleştirildiğinde varsayımsal olarak vagal tepkiye ve sürdürülemez bradikardiye neden oluyordu.
Anestezik sonuçlar, inhalasyon anestezisi için izofluran yerine sevofluran kullanma seçimiyle büyük ölçüde artmıştır. Sevofluranın bazı tavşan dokularında26 daha az vazodilatör etkiye sahip olduğu gösterilmiştir ve insan literatüründe yaygın olarak kardiyovasküler stabiliteyi arttırdığı düşünülmektedir27. Özellikle önemli olan, optimal olmayan hava yolu yönetimi olan bir ortamda anestezinin riskleri göz önüne alındığında, sevofluranın hızlı indüksiyonu ve ortaya çıkışı, anestezik dozajı titre etme yeteneği ile birlikte çeşitli türlerde 28,29,30 belgelenmiştir ve anestezik atakların kısalmasına neden olmuş ve hızla gelişen bir cerrahi ortamda anestezik düzlemde hızlı değişiklikler sağlamıştır. Ek olarak, inhale sevofluranın maske indüksiyonu için önemli ölçüde daha az caydırıcı olduğu düşünülmektedir ve muhtemelen yenidoğan tavşanlarda nefes tutmada bir azalmaya katkıda bulunur31. Tavşanlarda doxapram'ın yetişkin tavşanlarda etkili bir solunum uyarıcısı olduğu gösterilmiştir32,33 ve yenidoğan tavşan modelimizde bir yanıtı anekdot olarak takdir ettik.
Bu protokolün başarısı açık olmakla birlikte, analjezi ve anestezik monitörizasyon açısından iyileştirme için potansiyel yollar vardır. Yenidoğan tavşanlar için dozlama kılavuzlarını gösteren herhangi bir çalışma olmadığından, türe özgü önerilerin alt ucunda dozajlar ve frekanslar hedeflenmiştir. İyileşme ve kemirgenlere özgü anestezik izleme platformlarının denenmesi için ek bir buprenorfin dozu, bu modelde hayatta kalma oranını daha da artırabilir ve hayvan refahını iyileştirebilir. İyileşme sonrası ek buprenorfin dozu, tavşanlarda belgelenmiş doza bağlı solunum, depresif ve gastrointestinal staz etkilerini en aza indirirken multimodal analjezinin etkilerini uzatacaktır34,35. Cerrahi sonrası tüm hayvanlarda, veteriner el tipi bir glukometre kullanılarak ameliyat sonrası hemen kan şekerinde (250-400 mg / dL) orta ila şiddetli yükselmeler vardı. Bu, tavşanlarda yüksek kan şekeri seviyeleri ile gastrointestinal hastalığın şiddetini birbirine bağlayan yeni bir yayına dayanarak peri-akut postoperatif ağrıya bağlı abartılı bir stres tepkisini gösterebilir36. Tüm hayvanlar işlemden sonraki 3 gün veya daha kısa süre içinde kilo almaya geri döndüğünden ve ameliyat sonrası 12-24 saat içinde insizyon bölgesinde normal aktiviteye ve ağrı eksikliğine sahip olduğundan, bu model için uzun süreli bir opioid uygulamasının endike olduğuna inanmıyoruz. Solunum izlemeyi içeren kemirgene özgü anestezik izleme cihazları, çeşitli üreticiler tarafından sunulan ürünlerle giderek daha yaygın hale gelmektedir37. Bu sistemler, yenidoğan tavşanları gibi benzer yüksek kalp atış hızlarına sahip diğer benzer büyüklükteki hayvanlarla çalışacaksa, bu sistemlerden birinin kullanılması anestezik sağkalımı artıracaktır. Ne yazık ki, bu ürünlere erişimimiz yoktu veya bu çalışma için satın almadan önce deneme olanağımız yoktu.
İmplante edilebilir telemetri cihazları, son yıllarda daha uzun pil ömrü, daha küçük implantlar ve hayvanların serbestçe hareket etmesine izin verirken kemirgenler, köpekler ve insan olmayan primatlarda ilgilenilen çoklu biyopotansiyelleri ölçme yeteneğini içerecek şekilde ilerlemiştir ve stresi azaltır 38,39,40. Tavşanlarda eşzamanlı EEG ve EKG kaydı için implante edilebilir telemetri cihazlarının kullanılması, mevcut bağlı yöntemlere göre avantajlar sunar41. İmplante edilebilir cihazlarla, tavşanlar ev kafeslerinde herhangi bir bağ veya kısıtlama olmadan serbestçe hareket edebilir ve kitler, geyik ve çöple birlikte yuvaya dönebilir, stresi azaltır ve hayvan refahını teşvik eder. Enfeksiyon veya stres belirtileri için dikkatli postoperatif izleme prosedürleri, komplikasyonların ortaya çıkması durumunda erken veteriner müdahalesine de izin verir. İmplant kitleri, beyin gelişiminin kritik dönemlerinde EEG değerlendirmesine izin verir, bu da genetik epilepsi modellerinde barınma uygulamalarını değiştirmeden gerekli olabilir. Ek olarak, telemetri verileri implant pilinin ömrü boyunca sürekli olarak yakalanır ve nadir SUDEP olaylarının yakalanmasına olanak tanır. Transgenik tavşanların ortaya çıkışı, insan hastalığını modellemek için eşsiz fırsatlar sunar. Ek olarak, tavşan modellerinin kullanılması, FDA ilaç onayları için gerekli olan diğer büyük hayvan değerlendirmelerine göre önemli avantajlar sağlayabilir. Sunulan gibi yöntemler, bu modellerde kardiyak ve nöral fizyolojinin ileri düzeyde değerlendirilmesine ve terapötik müdahale ile değiştirilmesine izin verecektir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, NIH R61NS130070 tarafından LLI'ye sağlanan finansman için minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 inch elastic wrap - Coban or Vetwrap | 3M | https://www.3m.com/3M/en_US/p/d/b00003186/ | |
| 4-0 PDS monofilament suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| 5-0 Ethilon nylon suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| Acquisition computer | Dell | https://www.dell.com/en-us | |
| Adhesive surgical towels | N/A | N/A | |
| Anesthesia circuit - Jackson-Reevs with 0.5 L rebreathing bag | JorVet | J0248GA | |
| Betadine scrub | N/A | N/A | |
| Bupivicaine (0.5%) | N/A | N/A | Diluted to 2.5 mg/mL prior to administration |
| Buprenorphine (0.3 mg/mL) | N/A | N/A | Diluted to 0.03 mg/mL prior to administration |
| Burr - 1.00 mm | Cell Point Scientific | 60-1000 | to drill skull |
| Cafazolin (1 g lypholized) | N/A | N/A | Diluted to 50 mg/mL |
| Carprofen (50 mg/mL) | MWI Veterinary | Diluted to 25 mg/mL prior to administration | |
| Cotton tipped applicators | N/A | N/A | |
| Custom 3-D printed face mask | N/A | https://www.thingiverse.com/thing:923725 | |
| Dental acrylic | N/A | N/A | |
| Diet Gel Criticare | Clear H2O | 72-05-5042 | Nutritional support |
| Dopper Gel - Aquasonic | Patterson | 07-890-5542 | |
| Doppler - Vet-Dop2 | Patterson | 07-888-8986 | |
| Doxapram (20 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Dumont #5 Fine Forceps | Fine Science Tools | 11254-20 | For holding screws |
| Duraprep | 3M | 8630 | Final skin prep |
| ecgAuto data analysis software | emka technologies | N/A | |
| Epinephrine (1:1000) | MWI Veterinary | N/A | Emergency only |
| Gauze | N/A | N/A | |
| Glucometer ipet Pro | MWI Veterinary | 63867 | Monitor if poor recovery |
| Glycopyrrolate (0.2 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Gram scale | N/A | N/A | |
| Hemostats | Fine Science Tools | 13008-12 | Hold wire loops while tying the loop in place |
| Ideal Micro-drill | Cell Point Scientific | 67-1204 | To drill skull |
| Incubator | DRE-veterinary (Infantia - NB1) | N/A | |
| Induction box | VetEquip | 941444 | |
| Infared heating pad - RightTemp Jr | Kent Scientific Corporation | RT-0502 | |
| IOX2 data acquisition software | emka technologies | N/A | |
| IV Catheter - Covidein Monoject 26 G, 3/4 inch PTFE | Patterson | 07-836-8494 | |
| ketamine (100 mg/mL) | MWI Veterinary | N/A | |
| Medical tape | N/A | N/A | |
| Narrow Pattern Forceps - Straight/12 cm | Fine Science Tools | 11002-12 | |
| Neonatal stethescope | Ultrascope | N/A | |
| Olsen-Hegar Needle holder with scissors - 12 cm | Fine Science Tools | 12002-12 | For suturing |
| Ophthalmic ointment Puralube | MWI Veterinary | N/A | Administered to both eyes during anesthesia |
| Opthalmic Lubricant - Paralube Vet | Patterson | 07-888-2572 | |
| Pulse oximeter (AccuWave Portable ) | Patterson | 07-892-9128 | For prep and recovery; reads HR up to 400 |
| Pulse oximeter (SDI - Vet/Ox plus 4700) | Heska | N/A | Intra-operative; no longer producted |
| Receiver | emka technologies | N/A | 1 receiver for every 4 telemetry implants |
| Rectal thermometer | N/A | N/A | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scissors | Fine Science Tools | 14002-12 | To cut drape |
| Screw driver - 1.0 mm | N/A | N/A | From mini-screwdriver set for electronics |
| Screws 00-96 x 3/32 (2.4 mm) | Protech International | 8L0X3905202F | |
| Sevoflurane | MWI Veterinary | Maintenance anesthesia | |
| Sevoflurane vaporizer and anesthesia machine | N/A | N/A | |
| Skin glue, Gluture | MWI Veterinary | 34207 | Apply sparingly with syringe |
| Small scissors | Fine Science Tools | 14084-08 | |
| Sterile aluminum foil | N/A | N/A | To wrap wires prior to rotating animal |
| Sterile paint brush | N/A | N/A | To apply dental acrylic |
| Sterile Saline | N/A | N/A | |
| Sterile surgical gloves | N/A | N/A | |
| Sterile ultrasound cover | N/A | N/A | To cover the drill |
| Sterile Water | N/A | N/A | For cefazolin reconstitution |
| Surgical blade no. 15 | N/A | N/A | |
| Surgical drape | N/A | N/A | |
| Surgical gown | N/A | N/A | |
| Swivel connector - Jorgensen Labs | Patterson | 07-802-2349 | To connect anesthesia circuit to face mask |
| Telemetry implant | emka technologies | easyTEL+_M1_EETA_B_35 | |
| Trocar | SAI | TRO-10-6 | To tunnel wires |
Referanslar
- Bagnall, R. D., Crompton, D. E., Semsarian, C. Genetic Basis of Sudden Unexpected Death in Epilepsy. Front Neurol. 8, 348 (2017).
- Surges, R., et al. Pathologic cardiac repolarization in pharmacoresistant epilepsy and its potential role in sudden unexpected death in epilepsy: a case-control study. Epilepsia. 51 (2), 233-242 (2010).
- Surges, R., Thijs, R. D., Tan, H. L., Sander, J. W. Sudden unexpected death in epilepsy: risk factors and potential pathomechanisms. Nat Rev Neurol. 5 (9), 492-504 (2009).
- Shorvon, S., Tomson, T. Sudden unexpected death in epilepsy. Lancet. 378 (9808), 2028-2038 (2011).
- Schuele, S. U., et al. Video-electrographic and clinical features in patients with ictal asystole. Neurology. 69 (5), 434-441 (2007).
- Massey, C. A., Sowers, L. P., Dlouhy, B. J., Richerson, G. B. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. 10 (5), 271-282 (2014).
- Sahly, A. N., Shevell, M., Sadleir, L. G., Myers, K. A. SUDEP risk and autonomic dysfunction in genetic epilepsies. Auton Neurosci. 237, 102907 (2022).
- Cooper, M. S., et al. Mortality in Dravet syndrome. Epilepsy Res. 128, 43-47 (2016).
- Negishi, Y., et al. SCN8A-related developmental and epileptic encephalopathy with ictal asystole requiring cardiac pacemaker implantation. Brain Dev. 43 (7), 804-808 (2021).
- Meisler, M. H., et al. SCN8A encephalopathy: Research progress and prospects. Epilepsia. 57 (7), 1027-1035 (2016).
- Watanabe, H., et al. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest. 118 (6), 2260-2268 (2008).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci Transl Med. 1 (2), 2ra6 (2009).
- Nerbonne, J. M. Mouse models of arrhythmogenic cardiovascular disease: challenges and opportunities. Curr Opin Pharmacol. 15, 107-114 (2014).
- Frasier, C. R., et al. Channelopathy as a SUDEP Biomarker in Dravet Syndrome patient-derived cardiac myocytes. Stem Cell Rep. 11 (3), 626-634 (2018).
- Camacho, P., Fan, H., Liu, Z., He, J. -. Q. Small mammalian animal models of heart disease. Am J Cardiovasc. 6 (3), 70-80 (2016).
- Brodbelt, D. Perioperative mortality in small animal anaesthesia. Vet J. 182 (2), 152-161 (2009).
- Lee, H. W., Machin, H., Adami, C. Peri-anaesthetic mortality and nonfatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases. Vet Anaes Anal. 45 (4), 520-528 (2018).
- Comolli, J., et al. Comparison of endoscopic endotracheal intubation and the v-gel supraglottic airway device for spontaneously ventilating New Zealand white rabbits undergoing ovariohysterectomy. Vet Rec. 187 (10), e84-e84 (2020).
- Grint, N. J., Sayers, I. R., Cecchi, R., Harley, R., Day, M. J. Postanaesthetic tracheal strictures in three rabbits. Lab Anim. 40 (3), 301-308 (2006).
- Phaneuf, L. R., Barker, S., Groleau, M. A., Turner, P. V. Tracheal injury after endotracheal intubation and anesthesia in rabbits. J Am Assoc Lab Anim Sci. 45 (6), 67-72 (2006).
- Quesenberry, K. E., Orcutt, C. J., Mans, C., Carpenter, J. W. Gastrointestinal Diseases of Rabbits. Ferrets, Rabbits, and Rodents. , (2020).
- Desai, A., Macrae, D. . Cardiovascular Physiology in Infants, Children, and Adolescents. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. , (2020).
- Bansal, N., Momin, S., Bansal, R., Venkata, S. K. R. G., Ruser, L., Yusuf, K. Pharmacokinetics of drugs: newborn perspective. Pediatr Med. 7, 19 (2024).
- Trachsel, D., Erb, T. O., Hammer, J., von Ungern-Sternberg, B. S. Developmental respiratory physiology. Paediat Anaesth. 32 (2), 108-117 (2022).
- Benito, S., Hadley, S., Camprubí-Camprubí, M., Sanchez-de-Toledo, J. Blind endotracheal intubation in neonatal rabbits. J Vis Exp. 168, e61874 (2021).
- Okamoto, S., Matsuura, N., Ichinohe, T. Effects of volatile anesthetics on oral tissue blood flow in rabbits: A comparison among isoflurane, sevoflurane, and desflurane. J Oral Maxillofac Surg. 73 (9), 1714.e1-1714.e8 (2015).
- Elshalakany, N. A., Salah, A. M. Comparative study: evaluation of the effect of sevoflurane versus isoflurane in general anesthesia for pediatric patients undergoing cardiac catheterization. Egypt J Anaesth. 38 (1), 409-414 (2022).
- Anjana, R. R., Parikh, P. V., Mahla, J. K., Kelawala, D. N., Patel, K. P., Ashwath, S. N. Comparative evaluation of isoflurane and sevoflurane in avian patients. Vet World. 14 (5), 1067-1073 (2021).
- Johnson, R. A., Striler, E., Sawyer, D. C., Brunson, D. B. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs. Am J Vet Res. 59 (4), 478-481 (1998).
- Campbell, C., Nahrwold, M. L., Miller, D. D. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth. 42 (10), 884-890 (1995).
- TerRiet, M. F., et al. Which is most pungent: isoflurane, sevoflurane, or desflurane. Br J Anaesth. 85 (2), 305-307 (2000).
- Khanna, V. K., Pleuvry, B. J. A study of naloxone and doxapram as agents for the reversal of neuroleptanalgesic respiratory depression in the conscious rabbit. Br J Anaesth. 50 (9), 905-912 (1978).
- Flecknell, P. A., Liles, J. H., Wootton, R. Reversal of fentanyl/fluanisone neuroleptanalgesia in the rabbit using mixed agonist/antagonist opioids. Lab Anim. 23 (2), 147-155 (1989).
- Shafford, H. L., Schadt, J. C. Respiratory and cardiovascular effects of buprenorphine in conscious rabbits. Vet Anaesth Analg. 35 (4), 326-332 (2008).
- Feldman, E. R., Singh, B., Mishkin, N. G., Lachenauer, E. R., Martin-Flores, M., Daugherity, E. K. Effects of cisapride, buprenorphine, and their combination on gastrointestinal transit in New Zealand white rabbits. J Am Assoc Lab Anim Sci. 60 (2), 221-228 (2021).
- Harcourt-Brown, F. M., Harcourt-Brown, S. F. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170 (26), 674-674 (2012).
- Rivera, D. A., Buglione, A. E., Ray, S. E., Schaffer, C. B. MousePZT: A simple, reliable, low-cost device for vital sign monitoring and respiratory gating in mice under anesthesia. PLoS One. 19 (3), e0299047 (2024).
- Nicou, C. M., Passaglia, C. L. Characterization of intraocular pressure variability in conscious rats. Exp Eye Res. 239, 109757 (2024).
- Sadko, K. J., Leishman, D. J., Bailie, M. B., Lauver, D. A. A simple accurate method for concentration-QTc analysis in preclinical animal models. J Pharmacol Toxicol Methods. 128, 107528 (2024).
- Vuong, J. S., Garrett, J. J., Connolly, M. J., York, A. R., Gross, R. E., Devergnas, A. Head mounted telemetry system for seizures monitoring and sleep scoring on non-human primate. J Neurosci Methods. 346, 108915 (2020).
- Bosinski, C., Wagner, K., Zhou, X., Liu, L., Auerbach, D. S. Multi-system monitoring for identification of seizures, arrhythmias and apnea in conscious restrained rabbits. J Vis Exp. (169), e62256 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır