Method Article
השתלת מכשירי טלמטריה אלקטרואנצפלוגרמה ואלקטרוקרדיוגרמה בערכות ארנב יילודים
* These authors contributed equally
In This Article
Summary
מנגנונים של מוות פתאומי בלתי צפוי באפילפסיה (SUDEP) אינם מובנים היטב ומאתגרים לתרגום מהמודלים הנוכחיים. ארנבים טרנסגניים עשויים להציע תובנות לגבי מנגנונים אלה. אנו מתארים שיטה להקלטות אלקטרואנצפלוגרפיה ואלקטרוקרדיוגרפיה ארוכות טווח בערכות ארנבים טרנסגניות כדי להעריך אירועים חמורים שעלולים להוביל למוות.
Abstract
וריאנטים פתוגניים בגנים של תעלות יונים קשורים לשיעור גבוה של מוות פתאומי בלתי צפוי באפילפסיה (SUDEP). מנגנוני SUDEP אינם מובנים היטב אך עשויים לכלול הפרעות בתפקוד אוטונומי והפרעות קצב לב בנוסף להתקפים. חלק מהגנים של תעלות יונים באים לידי ביטוי הן במוח והן בלב, מה שעלול להגביר את הסיכון ל-SUDEP בחולים עם תעלות יונים הקשורות לאפילפסיה והפרעות קצב לב. ארנבים טרנסגניים המבטאים גרסאות אפילפסיה מספקים אורגניזם שלם לחקר הפיזיולוגיה המורכבת של SUDEP. חשוב לציין, ארנבים משכפלים יותר את הפיזיולוגיה של הלב האנושי מאשר מודלים של עכברים. עם זאת, למודלים של ארנבים יש שיקולי בריאות והרדמה נוספים כאשר הם עוברים הליכי ניטור פולשניים. פיתחנו שיטה חדשנית להשתלה כירורגית של מכשיר טלמטריה לניטור ארוך טווח של אלקטרואנצפלוגרמה סימולטנית (EEG) ואלקטרוקרדיוגרמה (ECG) בערכות ארנב יילודים. כאן, אנו מדגימים שיטות כירורגיות להשתלת מכשיר טלמטריה בערכות P14 (טווח משקל 175-250 גרם) עם תשומת לב מפורטת לגישה כירורגית, הרדמה וניטור מתאימים וטיפול לאחר הניתוח, וכתוצאה מכך שיעור סיבוכים נמוך. שיטה זו מאפשרת ניטור רציף של אלקטרופיזיולוגיה עצבית ולבבית בנקודות קריטיות בהתפתחות הפרעות קצב לב, התקפים ו-SUDEP פוטנציאלי במודלים של ארנבים של אפילפסיה גנטית או נרכשת.
Introduction
מוות פתאומי בלתי צפוי באפילפסיה (SUDEP) הוא גורם מוביל למוות בחולי אפילפסיה. המנגנונים של SUDEP אינם מובנים היטב אך עלולים לכלול הפרעות בתפקוד אוטונומי, דום נשימה והפרעות קצב לב בנוסף להתקפים 1,2,3,4,5,6,7. לחולים עם אפילפסיה גנטית הקשורה לתעלה יש את השיעורים הגבוהים ביותר של SUDEP. לדוגמה, SUDEP מתרחש אצל עד 20% מהחולים עם וריאנטים בגן תעלת הנתרן SCN1A8, הגן האחראי לתסמונת דרבט, אפילפסיה גנטית עם הופעה בשנה הראשונה לחיים. גנים רבים הקשורים לאפילפסיה מתבטאים הן במוח והן בלב, כאשר נתוני מעבדה וקליניים מצביעים על כך שהפרעות קצב לב עשויות להיות קיימות בחולים עם אפילפסיות גנטיות הקשורות לתעלה7, 9,10,11,12, מה שעלול להגביר את הסיכון שלהם ל-SUDEP עקב הפרעת קצב לב קטלנית הנגרמת על ידי התקפים או התרחשות בו-זמנית של התקפים והפרעות קצב. הערכת SUDEP במסגרת המעבדה מציבה אתגרים רבים. מנקודת מבט לבבית, פוטנציאל הפעולה הלבבית בעכברים שונה מאוד מאשר בבני אדם13, ומודלים אנושיים של iPSC-מיוציטים לבביים14 אינם יכולים לשכפל את המורכבות של האורגניזם כולו. מודלים של ארנב טרנסגני של אפילפסיה גנטית מספקים מערכת אידיאלית לחקר SUDEP, שכן פיזיולוגיה של לב ארנב משכפלת יותר את זו של האדם13,15, תוך מתן אורגניזם שלם לחקר פתופיזיולוגיה מורכבת. מכיוון ש-SUDEP עשוי להתרחש כבר בהתקף הראשון, הערכת מודלים של בעלי חיים אלה מנקודת זמן מוקדמת חיונית להבנת הופעת ההתקפים והפרעות קצב הלב. הקלטת וידאו בתקופת היילוד היא מאתגרת, מכיוון שערכות ארנב עדיין נמצאות לעתים קרובות בקן. הקלטת אלקטרואנצפלוגרמה רציפה (EEG) או אלקטרוקרדיוגרמה (ECG) עם מערכת קווית מסורתית אינה אפשרית כאשר הערכות נמצאות עם הסכר. הקלטה לסירוגין לא צפויה ללכוד אירועים נדירים וסופיים הקשורים ל-SUDEP. לכן פנינו לניטור טלמטריה מושתל אלחוטי כדי לספק רישום EEG ו-ECG לטווח ארוך, רציף ובו זמנית בערכות ארנבות.
המפתחות להצלחה בפרוטוקול זה הם הרדמה מתאימה ותמיכה לאחר הניתוח לבעלי חיים פגיעים אלה. ארנבים נמצאים בסיכון גבוה בהרבה למוות בהרדמה (1.39%-4.8%) בהשוואה לכלבים וחתולים (0.17%-0.24%) בשל מאפיינים אנטומיים ופיזיולוגיים ייחודיים16,17. התורמים העיקריים לסיכון הרדמה מוגבר זה כוללים ניהול דרכי נשימה לא אופטימלי וסיבוכים חריפים לאחר הניתוח. גורמים מרובים תורמים לקושי באינטובציה אצל ארנבים, כולל פה ארוך וצר עם לשון רחבה, זווית חדה בין הפה לגרון, תזוזה גבית של האפיגלוטיס, רגישות מוגברת לטראומה גרונית ונטייה מוגברת לעוויתות גרון 18,19,20. לאחר פרק ההרדמה המיידי, ארנבים נמצאים בסיכון לפתח תסמונת קיפאון במערכת העיכול מסכנת חיים. זוהי בעיה מורכבת ורב-גורמית, וההרדמה מניחה כתורמת באמצעות השפעות תרופתיות ישירות המעכבות את תנועתיות הקיבה ו/או אנורקסיה משנית לאחר ההליך מכל סיבה שהיא (כאבים ללא הקלה, בחילות וכו').21.
הפיזיולוגיה הייחודית של יילודים ותינוקות של ארנבים מחמירה את האתגרים הקשורים להרדמה וניתוח. לארנבים יש צעירים שנולדו עם מנגנונים לא מפותחים להומאוסטזיס פיזיולוגי ושיקולים אנטומיים מיוחדים. גישה וניטור תוך ורידי קשים מכיוון שרוב המוצרים המסחריים אינם מותאמים לגודל כלי הדם הקטן, קצב הלב הגבוה במנוחה והעור הפיגמנטי של ערכות ארנב צלב לבן הולנדי וניו זילנדי. מכיוון שתפוקת הלב תלויה בקצב הלב ביילודים22, ובאופן כללי, פינוי התרופה בדרך הכליות או הכבד יורד בהשוואה למבוגרים23, שיקולים לבחירת תרופות ומינון מתאימים הם קריטיים. הגורם העיקרי למוות בהרדמה אצל ארנבים נחשב משני לדיכאון נשימתי ודום נשימה. בנוסף לבעיות ניהול דרכי הנשימה שכבר נדונו עבור כל הארנבים, ליילודים יש דחף נשימתי מדוכא לנוכח היפוקסמיה והיפרקפניה, מה שהופך את ההיבט המאתגר ממילא של ההרדמה למסוכןיותר.
בפרוטוקול הזה אנו מתארים שיטה מוצלחת להשתלת טלמטריה של EEG ו-ECG (איור 1) במודל של ארנב יילוד של אפילפסיה עם שיעור הישרדות גבוה של ניתוח והרדמה. מידע זה יאפשר לחוקרים אחרים להתמודד עם מודלים מאתגרים של ארנבות יילודים כדי לקדם את המחקר על אפילפסיה, הפרעות קצב לב והפרעות נוירו-התפתחותיות קשורות.
Protocol
כל העבודה המתוארת נבדקה ואושרה על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת מישיגן כחלק מפרוטוקול שימוש בבעלי חיים מאושר ועולה בקנה אחד עם החוקים וההנחיות הפדרליים הרלוונטיים, כולל חוק רווחת בעלי החיים של USDA ומדיניות שירותי בריאות הציבור של NIH. אוניברסיטת מישיגן היא מוסד מוסמך AAALACi.
1. הכנת בעלי חיים
- ערכות גילוח גס (גיל P14-P19, משקל >175 גרם) 1-2 ימים לפני ההליך כדי למזער את זמן ההרדמה ביום הניתוח באמצעות קוצץ.
- חיטוי או גז מעקרים את כל הכלים והחומרים הכירורגיים (ככל האפשר) לקראת ההליך.
- השראת הרדמה עם קטמין (10 מ"ג/ק"ג IM), בופרנורפין הידרוכלוריד (0.01 מ"ג/ק"ג IM) 0.3 מ"ג/מ"ל מדולל ל-0.03 מ"ג/מ"ל, וסבופלורן וחמצן באמצעות הרדמה במסכה באמצעות מעגל ללא נשימה חוזרת.
- הנח קטטר תוך-ורידי (IV) בגודל 26 גרם 3/4 אינץ' בווריד האפרכסת (מועדף) או בווריד הצפאלי ושטוף עם מי מלח הפריניים 10 יחידות/מ"ל.
- גלח את הבטן, החזה, הגב, הצוואר והראש קרוב ככל האפשר לעור באמצעות להב #40 או #50.
- יש למרוח משחת עיניים סיכה ללא תרופות למניעת כיב בקרנית.
- מתן משככי כאבים (קרפרופן 4 מ"ג/ק"ג SQ - מדולל ל-25 מ"ג/מ"ל) ואנטיביוטיקה סביב הניתוח (צפזולין 20 מ"ג/ק"ג IV מדולל ל-50 מ"ג/מ"ל). יש לתת מחדש אנטיביוטיקה כל 90-180 דקות מזמן הניתוח.
2. הכנה כירורגית (איור 2)
- העבירו את ערכת ההרדמה לשולחן הניתוחים והניחו אותה על כרית חימום אינפרא אדום הנשלטת באמצעות מדחום רקטלי.
- הנח את האף והפה במסכת פנים מודפסת בתלת מימד מותאמת אישית המחוברת עם מחבר מסתובב למעגל ג'קסון-ריס שאינו נושם מחדש (שקית 0.5 ליטר) ושמור על הרדמה סבופלורן (1.5%-7% לביצוע) עם זרימת חמצן ב-2 ליטר לדקה.
- שמרו על הרדמה עם סבופלורן ועקבו אחר עומק ההרדמה באמצעות אוקסימטר דופק על האוזן או הכפה ו/או דופלר על עורק הירך או ישירות על הלב.
- התאם את ההרדמה לאורך כל ההליך כדי לשמור על דופק (HR) בין 180-260, ריווי חמצן >85% וקצב נשימה בין 10-50 נשימות לדקה (הדמיה ישירה של טיולים או תנועה של שקית הנשימה מחדש).
הערה: יש תרופות חירום זמינות (גליקופירולאט, אפינפרין, דוקספרם). - אבטח את הערכה למסכת הפנים על ידי הדבקה עדינה של הגפיים הקדמיות למסכה.
- מקם את הערכה במצב מעט ימני-צדדי על ידי הצמדת הרגל האחורית השמאלית לשולחן הניתוחים.
- הכינו את כל הבטן עם קרצוף כירורגי מחומם לסירוגין בטדין ומי מלח סטריליים.
הערה: ניתן להשתמש בתמיסה כירורגית נוספת לסיום השפשוף אם רוצים. המנתח, לובש קרצוף ייעודי, מצנפת שיער וכיסויי נעליים, ישפשף באופן אספטי וילבש חלוק וכפפות סטריליות כדי לבצע את ההליך בתנאים סטריליים. - הניחו מגבות כירורגיות דביקות משני צידי הערכה וכסו אותה בווילון כירורגי גדול. חותכים חור בגודל מתאים כדי לחשוף את הבטן והחזה.
- פתח את השתל על השדה הניתוחי והנח תפרי עיגון שאינם נספגים בכל אחד מחורי העיגון של השתל. השאירו את התפר מחובר עם זנב של 5-6 ס"מ (איור 3A). מניחים את השתל בקערה של מי מלח סטריליים מחוממים.
3. מיקום השתל בבטן
- לאחר הקפדה על הרדמה מספקת, בצע חתך של 3 ס"מ דרך העור לאורך הלינאה אלבה בעזרת אזמל.
- בצע חתך זהיר דרך השריר כדי לפתוח את חלל הצפק.
- הנח את השתל בחלק הגולגולתי של חלל הבטן ומקם אותו משמאל לחתך.
- השתמש בטרוקר כדי להוציא את חוט האק"ג השלילי מחלל הצפק והעור כ-2 ס"מ מימין לחתך. מנהרה את 3 החוטים הנותרים 3-4 ס"מ משמאל לחתך כדי לאפשר לשתל לשבת בנוחות בתוך חלל הצפק.
- אבטח את השתל עם תפרי העיגון לדופן הגחון של חלל הצפק, כדי להבטיח שלא יילכד מעיים (איור 3B).
- סגור את דופן הבטן בתפר נספג בתבנית רציפה.
- סגור את חתך העור עם תפר שאינו נספג בתבנית מופרעת.
4. מיקום מובילי האק"ג
- מנהרה את עופרת האק"ג השלילית תת עורית לחזה העליון הימני בגובה הצלע הראשונה.
- נתח בצורה בוטה כיס תת עורי כדי לסלסל באופן רופף כ -10 ס"מ חוט.
הערה: סלילים הדוקים מתחת לעור עלולים להוביל לשחיקת העור ולחשיפה לחוטים. - חותכים את החוט העודף ויוצרים לולאה עם החוט החשוף על ידי קשירת הקצה לחוט המבודד בתפר שאינו נספג.
- אבטח את הלולאה לשריר עם 2 תפרים שאינם נספגים.
- סגור את שריר הצפק מימין סביב החוט עם 1-2 תפרים נספגים בתבנית מופרעת.
- סגור את העור בחזה העליון הימני ובבטן הימנית עם 2-3 תפרים שאינם נספגים בתבנית מופרעת.
- מנהרה את כבל האק"ג החיובי לצלע התחתונה השמאלית וחזור על השלבים לעיל כדי להדק אותו לשריר ולסגור את החתך.
- מנהרה ה-EEG מוביל תת עורית לצד הצדדי השמאלי ככל האפשר בשדה הניתוח.
- הוסף תפר נספג אחד לשריר הצפק משמאל סביב החוטים המתהווים. סגור את העור עם תפר שאינו נספג בתבנית מופרעת.
- עטפו את חוטי ה-EEG החשופים בנייר אלומיניום סטרילי.
5. הכנת משטח הגב
- לאחר מכן עוזר לא סטרילי יסיר את הווילון הסטרילי ואת עניבת הרגליים.
- סובב את הערכה למצב שכיבה (איור 2B) תוך הקפדה על מסכת הפנים להישאר במקומה היטב על ידי סיבוב באמצעות מחבר המסתובב בין מסכת הפנים למעגל. התאם את צגי הדופק ו/או הדופלר לפי הצורך כדי להבטיח ניטור הרדמה רציף.
- הכן את שדה הניתוח עם קרצוף בטדין שיכלול את הראש, הצוואר והגב כולו תוך הקפדה על קרצוף סביב אזור החוטים היוצאים בצד שמאל.
- לאחר מכן המנתח יניח מגבת דבק סטרילית מתחת לצד שמאל בעוד חבילת חוטי נייר האלומיניום מוחזקת על ידי עוזר לא סטרילי.
- הסר בצורה סטרילית ובעדינות את החוטים מחבילת האלומיניום והנח אותם על השדה הסטרילי. מסיימים את העטיפה במגבות סטריליות.
- מכסים בווילון סטרילי וחותכים חלון גדול מספיק כדי לחשוף את כל השדה הסטרילי.
6. מיקום מוליכי EEG
- בצע חתך של 3 ס"מ דרך הקרקפת בקו האמצע כדי לחשוף את הגולגולת.
- השתמש בטרוקאר כדי לחפור באופן תת עורי את מובילי ה-EEG מהצד השמאלי לגולגולת.
- נקו וגרדו את הפריאוסטאום מהעצמות הקודקודיות החשופות בעזרת אזמל.
- הכנס מקדחה כף יד לכיסוי אולטרסאונד סטרילי. הכנס מקדחה 1.0 מ"מ למקדחה.
- קדחו חורי קוצים דו-צדדיים לעצמות הקודקודיות כ-0.5 ס"מ לפני הלמבדה ו-0.5 ס"מ לרוחב התפר הסגיטלי.
הערה: היזהר עם כמות הלחץ המופעלת על הגולגולת הגבית מכיוון שהדבר יכול לחסום את דרכי הנשימה הגחוניות, ולכן ניטור נשימתי הוא המפתח בשלב זה של ההליך. ירידה קבועה או משמעותית בקצב הלב עשויה להצביע על חסימה נשימתית (ברדיקרדיה משנית לדום נשימה) ואמורה לעורר הערכה ופעולה מיידית. - השתמש במלקחיים עדינים כדי להכניס בורג לתוך חור הבור. השתמש במברג כדי להכניס בערך באמצע הדרך (איור 3C).
- נתח בצורה בוטה כיס תת עורי לאורך החלק האחורי של הצוואר כדי לסלסל באופן רופף כ -10 ס"מ של חוט.
- חותכים את החוט העודף. הפשיט את הבידוד מהקצה ומתח את החוט.
- צור לולאה בקצה החוט החשוף על ידי קשירת קשר, תוך שמירה על לולאה קטנה. הנח את הלולאה מעל הבורג והדק את הבורג לגולגולת, וודא שהחוט נוגע בבורג. הנח את חוט ההארקה משמאל ואת חוט ההקלטה מימין.
- הערך את אותות הטלמטריה בתוכנת הניתוח לנאמנות לאחר שכל החוטים נמצאים במקומם. אות ה- EEG יופיע במשרעת נמוכה בזמן שהערכה מורדמת.
- אבטח את הברגים והחוטים לגולגולת בעזרת אקריליק דנטלי ואפשר לה להתקשות לחלוטין.
- סגור את העור עם תפר שאינו נספג על הראש והצד השמאלי.
- יש להזריק בופיבקאין (מינון מקסימלי של 2 מ"ג/ק"ג של 5 מ"ג/מ"ל מדולל ל-2.5 מ"ג/מ"ל) תת עורית בכל חתך. יש לכסות כל חתך בכמות קטנה של דבק עור הניתן באמצעות מזרק טוברקולין.
7. התאוששות בהרדמה
- כבה את הרדמת הסבופלוראן וספק רק חמצן למשך 5 דקות לפחות תוך הסרת הסרט שנותר, העטיפה וניטור ההרדמה.
- יש לבדוק את רמות הגלוקוז בדם באמצעות גלוקומטר ולתת נוזלים תת עוריים מחוממים ב-10% ממשקל הגוף (ק"ג).
- ברגע שהחיה מגיבה לגירוי כואב (צביטת הבוהן), עברו לאינקובטור התאוששות המוגדר ל-37-38 מעלות צלזיוס.
הערה: לעתים קרובות, טמפרטורת הערכה תרד משמעותית במהלך העברה זו. זה עשוי להיות מועיל להחזיר את הערכה לכרית החימום האינפרא אדום של הביופידבק או לספק חום משלים נוסף. - עקוב חזותית באופן רציף ורשום את טמפרטורת פי הטבעת, קריאות אוקסימטר דופק, דופק וקצב נשימה כל 10-15 דקות.
- ברגע שהחיה אמבולטורית וערנית באופן עקבי, הסר את הקטטר התוך ורידי והפעל לחץ על המקום עד שהדימום ייפסק.
8. טיפול וניטור לאחר הניתוח
- החזר את הערכה לסכר ולחברי המלטה. ודא שחומרי קינון ותזונה משלימה (טבלת חומרים) זמינים בכלוב כדי לסייע בוויסות חום והתאוששות.
- בדקו את הערכה מדי יום במשך 7-10 ימים לאחר הניתוח, שקלו מדי יום וספקו תזונה משלימה בכלוב.
- ביומיים הראשונים לאחר ההחלמה (D1 ו-D2), יש לתת משככי כאבים נוספים כל 24 שעות (קרפרופן 4 מ"ג/ק"ג רבוע - מדולל ל-5 מ"ג/מ"ל) ונוזלים תת עוריים (5-7 מ"ל).
- בשלושת הימים הראשונים לאחר ההחלמה (D1, D2 ו-D3), בדקו את הערכה פעמיים ביום, והעריכו אם יש עדויות לכאב, אמבולציה, מראה חתך והידרציה. פעם ביום במהלך פרק זמן זה, יש למדוד את טמפרטורת הערכה כדי להבטיח שאין עדות לזיהום וויסות חום מתאים.
- הסר תפרים אם החתכים נרפאים כראוי לאחר 7-10 ימים.
תוצאות
התוצאה המוצלחת של פרויקט זה דרשה פיתוח של פרמטרים מרובים בהליך השתל ופרוטוקול ההקלטה. ניתוח השתלה נוסה או בוצע ב-16 ערכות ארנבות, כאשר 14 שרדו בהצלחה את ההליך. מתוכם, 12 שרדו עד לנקודת הסיום של הניסוי. הסיבות למוות במהלך הניתוח או לאחר הניתוח מודגשות בטבלה 1, יחד עם שינויים בהליכים שאפשרו הצלחה עתידית בהשגת נקודת הסיום של הניסוי. הסיבוך הניתוחי השכיח ביותר היה דיכוי נשימתי, שהוביל להיפוקסיה וברדיקרדיה. הפרוטוקול שונה כך שיכלול שיטות ניטור מרובות, כולל 2 מדי דופק ומוניטור דופלר. זה מאפשר ניטור גיבוי אם צג אחד ייכשל או ישתחרר במהלך ההליך הכירורגי. בנוסף, פיגמנטים בעור אצל ארנבים יכולים להפוך את הדופק אוקסימטריה לפחות אמינה, מה שמחייב ניטור ממספר נקודות בגוף. בעוד שזירוז והחלמה נחשבים בדרך כלל לתקופות ההרדמה המסוכנות ביותר, ראינו דיכוי נשימתי המוביל לברדיקרדיה בנקודות אחרות לאורך ההליך, מה שמדגיש את הצורך בניטור סימנים חיוניים ערניים בכל עת. כהתערבות לסיבוך זה, נוספו לפרוטוקול ניטור נוסף ודוקספרם לאחר שנצפו סיבוכי ההרדמה במהלך שתי קבוצות הניתוח הראשונות של בעלי חיים (בעלי חיים 1-4). בעלי חיים 12 ו-13 היו באותה קבוצה וקיבלו דוקספרם (2-5 מ"ג/ק"ג, עירוי או תת-לשוני) עקב דחף נשימתי לקוי. שניהם עברו החייאה מוצלחת מדיכוי נשימתי ודום נשימה תוך ניתוח.
הקלטות טלמטריה יכולות להתבצע מיד ברגע שהערכות מוחזרות לכלובים הביתיים שלהן, ולעתים קרובות מראות אותות EEG עם משרעת נמוכה יחסית עד שהערכה מתאוששת במלואה מההרדמה (איור 4). מורפולוגיה של אות א.ק.ג עשויה להשתנות מעט במהלך הימים הראשונים של הרישום כצורות צלקות, ומיקום חוט האק"ג מאובטח עוד יותר (איור 4B). איכות האות EEG ו-ECG חזקה לאורך זמן ללא השפלה של האות בהינתן חוט מוגזם מספיק נותר מפותל תת עורי כדי לאפשר צמיחה. הקלטות טלמטריה יכולות להיות מותאמות אישית על סמך הצרכים האישיים של המחקר, מכיוון שהשתל יכול לנטר ביו-פוטנציאלים שונים, כולל טמפרטורה, תאוצה ואיכות אות, בנוסף ל-EEG ו-ECG (איור 5). ניתוח הנתונים מתבצע במצב לא מקוון עם תוכנת Emka ECGAuto. עם איסוף נתוני EEG ו-ECG ב-500 הרץ, סוללות השתל מחזיקות מעמד כ-55 יום. ניתן להרחיב טווח זמן זה על ידי שינוי פרמטרים של איסוף נתונים או באמצעות דגימה לסירוגין. ניתן לבצע תכנות תוכנה כדי לסייע בגילוי התקפים ב- ECGAuto (איור 5). ארנבים מושתלים מנוטרים לאריתמה של העור, משקל וטמפרטורה במשך 7 הימים הראשונים לאחר הניתוח, מכיוון שזו תקופת הסיכון הגבוהה ביותר לזיהום. לאחר הניתוח, ערכות ארנב מתחילות להראות עלייה במשקל 1-3 ימים לאחר ההליך, מה שמרמז על מצוקה מינימלית מההליך. הצוות הווטרינרי מבצע בדיקות יסודיות 2-3 פעמים בשבוע הראשון שלאחר הניתוח ויבדוק במרווחי זמן קבועים יותר אם מתעוררים חששות במהלך ההחלמה. מניסיוננו, האיילה אינה מפריעה באופן משמעותי לאתרי התפרים ברגע שהערכות מוחזרות לקן, כך שריפוי הפצעים היה מצוין. מספר ערכות פיתחו סרומה שפירה בחתך הגולגולת (טבלה 1), שעבורה ניתנו להן 3 ימים נוספים של קרפרופן, וכתוצאה מכך רזולוציה של סרומה ללא סיבוכים נוספים. לטווח ארוך, ארנבים נצפים מדי יום לאיתור סימני מצוקה על ידי צוות המעבדה או צוות הגידול. הצוות הווטרינרי זמין לבחון ולטפל בארנבים אם מתעוררים חששות כלשהם. איכות אות הטלמטר נבדקת מדי יום לאיתור תקלה במכשיר או בעופרת עד שהסוללה מתרוקנת.
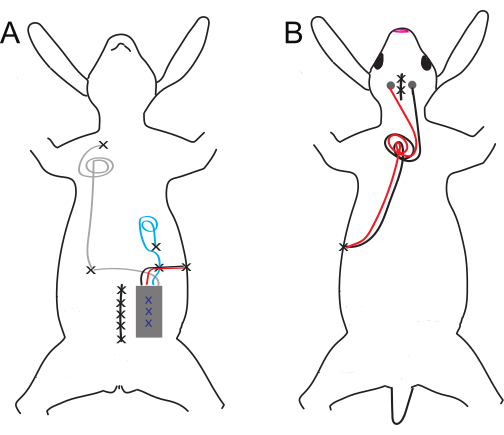
איור 1: סכמטי של השתל הגחוני והגבי ומיקום האלקטרודות. (A) שתלים גחוניים ו-(B) גב. אתרי התפרים מסומנים על ידי X שחור, בעוד ש-X כחול מציין תפרים פנימיים של שתל הבטן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
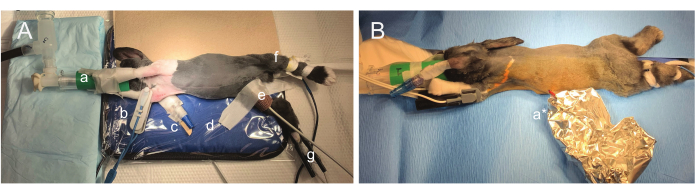
איור 2: תצלומים של מיקום כירורגי. (A) החיה מסובבת חלקית כדי לאפשר השתלת בטן, מיקום עופרת א.ק.ג בית החזה ומנהור חלקי של חוטים לגב באותה תנוחה כירורגית. האף ממוקם בנוחות בתוך מסכת פנים מותאמת אישית בהדפסת תלת מימד (a) ומודבק באופן רופף לגפיים הקדמיות. ניטור SpO2 יכול להיות לסירוגין, ולכן נעשה שימוש בבדיקות מרובות (זרוע ימין (b) וגפה אחורית ימנית (g)). קטטר תוך ורידי מאובטח באוזן ימין (c). ניטור הרדמה אחר שהוצג כולל ניטור טמפרטורת אינפרא אדום ביופידבק (d) וניטור דופלר תוך שימוש בעורק הירך הימני (e). הנשימה מנוטרת ויזואלית על ידי התבוננות בבעל החיים או בשקית הנשימה. (B) אחרי השתל ומיקום עופרת האק"ג, השדה הסטרילי נשבר, והארנב מסובב למצב שכיבה. חוטים נשארים סטריליים בתוך נרתיק נייר כסף (a*) כאשר המשטח הגבי מוכן להנחת עופרת EEG. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: שלבים עיקריים בהליך הכירורגי. (A) שלושה תפרים מאובטחים לשתל לפני חתך העור. (B) נשאר זנב ארוך כדי לקבע את השתל לדופן הגחון של חלל הצפק. (C) ברגי הגולגולת מוחזקים עם מלקחיים עדינים בזמן הברגה לתוך הגולגולת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
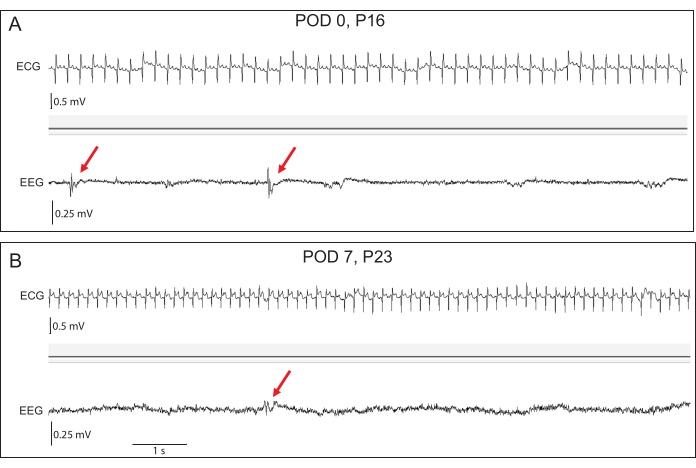
איור 4: הקלטות EEG ו-ECG מוקדמות מייצגות. (A) ביום שלאחר הניתוח (POD) 0, אמפליטודות ה-EEG הבסיסיות נמוכות, אולם ניתן לראות הפרשות אפילפטיות בין-איקטליות (חיצים אדומים) בארנבים טרנסגניים. (B) עד POD 7, משרעות ה-EEG גדלו. הפרשות אפילפטיות נותרו ניכרות. נאמנות אות א.ק.ג מצוינת בשתי נקודות הזמן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מעקב גולמי מייצג במהלך התקף טוני-קלוני בערכת ארנב טרנסגנית P66. נתוני טלמטר מעובדים מראש כוללים (A) EEG, (B) טמפרטורה, (C) תאוצה, (D) א.ק.ג ו-(E) מדידות איכות אות עבור ניתוח לא מקוון. איכות האות של כל הביו-פוטנציאלים ביום ה-52 שלאחר הניתוח נותרה מצוינת. תחילת ההתקף מסומנת על ידי החץ האדום. נתוני EEG מעובדים (א) עם התאמה בסיסית בתחילת ההתקף מראים הנחתת אות במהלך השלב הטוני של ההתקף. נתוני א.ק.ג עם קו בסיס מעובד (b) נראים אפילו עם חפצי שריר מוגזמים במהלך השלב הטוניק של ההתקף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
טבלה 1: תוצאות כירורגיות. סיבוכים כירורגיים ופוסט-ניתוחיים הובילו לשינויים מרובים בהליך הנחת השתל. 14 מתוך 16 ארנבים (87.5%) שרדו את ההליך הכירורגי, ו-2 ארנבים סבלו מסיבוכים לאחר הניתוח שדרשו המתת חסד. בעלי החיים מוצגים בסדר כרונולוגי של תאריך הניתוח. אנא לחץ כאן להורדת טבלה זו.
Discussion
הפרוטוקול המתואר לזירוז הרדמה, ניטור ותמיכה מאזן את צרכי המחקר לגישה כירורגית וקלות עם תקני הזהב של טיפול וטרינרי. לפני שהמעבדה אימצה את הפרוטוקול המתואר כנוהל סטנדרטי, נוסו מספר שיפורים פוטנציאליים אחרים, כולל מיקום שתל תת עורי גבי, שימוש בצינור אנדוטרכיאלי או בדרכי הנשימה של מסכת הגרון, ושימוש בחיבור סטטוסקופ הוושט לניטור דופק. עם זאת, כולם ננטשו בסופו של דבר מסיבות שונות. אמנם יש מספיק מקום תת עורי למיקום טלמטריה, אך חוסר היכולת לסגור שטח מת עקב גוף הטלמטריה ותכנון יציאת החוטים, האתגר של מיקום וסלילה של החוטים כדי לאפשר צמיחה של בעלי חיים, ו-2 שינויי המיקום הנדרשים תוך ניתוחיים כדי לאבטח את האק"ג מובילים להארכת זמן הניתוח באופן משמעותי והוספת אתגרים לוגיסטיים מיותרים. בנוסף, בעוד שהשימוש בהרדמה במסכה אינו מומלץ בדרך כלל, היעדר LMAs בגודל מתאים וחוסר היכולת לאבטח ולתחזק צינור אנדוטרכיאלי לאחר ההצבה מנעו זאת כאפשרויות. הדרישה להפוך את הערכה באמצע הניתוח וגם הצורך לגשת לצוואר ולגב הראש הגבילו את האפשרויות לאבטח את הצינור האנדוטרכיאלי גם לאחר מיקום מוצלח המבוסס על טכניקה שתוארה קודם לכן לאינטובציה של ארנב יילודים25. ניסינו גם את השימוש בבדיקת סטטוסקופ של הוושט לניטור דופק לאחר שהערכה נעטפה במקרה של אובדן אות מאוקסימטר הדופק או מדופלר. עם זאת, כל הסטטוסקופים הוושטיים הזמינים מסחרית היו גדולים מדי, וככל הנראה גרמו לתגובה נרדלית ולברדיקרדיה לא בת קיימא בכל פעם שהונח.
תוצאות ההרדמה ככל הנראה השתפרו מאוד על ידי הבחירה להשתמש בסבופלורן במקום באיזופלורן להרדמה בשאיפה. הוכח כי לסבופלורן יש פחות השפעות מרחיבות כלי דם בחלק מרקמות הארנב26 והוא נחשב בספרות האנושית כמשפר את יציבות הלב וכלי הדם27. חשיבות מיוחדת, בהתחשב בסיכוני ההרדמה בסביבה עם ניהול דרכי נשימה לא אופטימלי, האינדוקציה וההופעה המהירה של סבופלורן שתועדה במספר מינים 28,29,30 יחד עם היכולת לטטר את מינון ההרדמה הביאו לקיצור פרקי ההרדמה ואפשרו שינויים מהירים במישור ההרדמה בסביבה כירורגית המתפתחת במהירות. בנוסף, סבופלורן בשאיפה נחשב פחות מרתיע באופן משמעותי לאינדוקציה של מסכה, מה שככל הנראה תורם להפחתת עצירת הנשימה אצל ארנבים יילודים31. דוקספרם בארנבים הוכח כממריץ נשימתי יעיל בארנבים בוגרים32,33, והערכנו באופן אנקדוטלי תגובה במודל הארנב היילודים שלנו.
בעוד שההצלחה של פרוטוקול זה ברורה, ישנם אפיקים פוטנציאליים לעידון במונחים של משככי כאבים וניטור הרדמה. מכיוון שאין מחקרים המצביעים על הנחיות מינון לארנבות יילודים, המינונים והתדירות כוונו לקצה התחתון של ההמלצות הספציפיות למין. מנה נוספת של בופרנורפין בהתאוששות וניסוי פלטפורמות ניטור הרדמה ספציפיות למכרסמים יכולה לשפר עוד יותר את שיעור ההישרדות ולשפר את רווחת בעלי החיים במודל זה. מינון נוסף לאחר ההחלמה של בופרנורפין יאריך את ההשפעות של משככי כאבים רב-מודאליים תוך מזעור השפעות דיכאון נשימתי וקיפאון במערכת העיכול המתועדות תלויות מינון בארנבים34,35. לכל בעלי החיים לאחר הניתוח היו עליות בינוניות עד חמורות ברמת הגלוקוז בדם מיד לאחר הניתוח (250-400 מ"ג/ד"ל) באמצעות גלוקומטר כף יד וטרינרי. זה יכול להצביע על תגובת לחץ מוגזמת עקב כאב פרי-אקוטי לאחר הניתוח בהתבסס על פרסום שפורסם לאחרונה הקושר בין רמות גלוקוז גבוהות בדם לחומרת מחלות במערכת העיכול אצל ארנבים36. מכיוון שכל בעלי החיים חזרו לעלות במשקל תוך 3 ימים או פחות מההליך והיו להם פעילות רגילה וחוסר כאב באזור החתך תוך 12-24 שעות לאחר הניתוח, איננו מאמינים כי מתן אופיואידים ממושך מיועד למודל זה. מכשירי ניטור הרדמה ספציפיים למכרסמים, הכוללים ניטור נשימתי, הופכים נפוצים יותר ויותר עם מוצרים הזמינים על ידי יצרנים שונים37. הגיוני שאם מערכות אלה יעבדו עם בעלי חיים אחרים בגודל דומה עם קצב לב גבוה דומה כמו ארנבות יילודים, אז שימוש באחת מהמערכות הללו יגדיל את ההישרדות בהרדמה. למרבה הצער, לא הייתה לנו גישה למוצרים אלה או יכולת לנסות אותם לפני שרכשנו אותם למחקר זה.
מכשירי טלמטריה מושתלים התקדמו בשנים האחרונות וכוללים חיי סוללה ארוכים יותר, שתלים קטנים יותר ויכולת למדוד פוטנציאלים ביולוגיים מרובים המעניינים מכרסמים, כלבים ופרימטים שאינם אנושיים תוך מתן אפשרות לבעלי חיים לנוע בחופשיות, תוך הפחתת מתח 38,39,40. השימוש במכשירי טלמטריה מושתלים לרישום EEG ו-ECG בו זמנית בארנבים מציע יתרונות על פני השיטות הקשורות הנוכחיות41. עם מכשירים מושתלים, ארנבים יכולים לנוע בחופשיות בכלוב הביתי שלהם ללא קשירה או מעצורים, וערכות מסוגלות לחזור לקן עם האיילה והחול, להפחית מתח ולקדם את רווחת בעלי החיים. הליכי ניטור זהירים לאחר הניתוח לאיתור סימני זיהום או מתח מאפשרים גם התערבות וטרינרית מוקדמת אם מתעוררים סיבוכים. ערכות השתלה מאפשרות הערכת EEG בתקופות קריטיות של התפתחות המוח, מה שעשוי להיות חיוני במודלים של אפילפסיה גנטית מבלי לשנות את נוהלי הדיור. בנוסף, נתוני טלמטריה נלכדים באופן רציף לאורך חיי סוללת השתל, מה שמאפשר ללכוד אירועי SUDEP נדירים. הופעתם של ארנבים טרנסגניים מציעה הזדמנויות ייחודיות למידול מחלות אנושיות. בנוסף, השימוש במודלים של ארנבים עשוי להציע יתרונות משמעותיים על פני הערכות אחרות של בעלי חיים גדולים הנדרשים לאישורי תרופות של ה-FDA. שיטות כמו זו שהוצגה יאפשרו הערכה מתקדמת של הפיזיולוגיה הלבבית והעצבית במודלים אלה, כמו גם שינוי שלהם על ידי התערבות טיפולית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים אסירי תודה על המימון של NIH R61NS130070 ל-LLI.
Materials
| Name | Company | Catalog Number | Comments |
| 1 inch elastic wrap - Coban or Vetwrap | 3M | https://www.3m.com/3M/en_US/p/d/b00003186/ | |
| 4-0 PDS monofilament suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| 5-0 Ethilon nylon suture | Ethicon | https://www.jnjmedtech.com/en-US/company/ethicon/all-products | |
| Acquisition computer | Dell | https://www.dell.com/en-us | |
| Adhesive surgical towels | N/A | N/A | |
| Anesthesia circuit - Jackson-Reevs with 0.5 L rebreathing bag | JorVet | J0248GA | |
| Betadine scrub | N/A | N/A | |
| Bupivicaine (0.5%) | N/A | N/A | Diluted to 2.5 mg/mL prior to administration |
| Buprenorphine (0.3 mg/mL) | N/A | N/A | Diluted to 0.03 mg/mL prior to administration |
| Burr - 1.00 mm | Cell Point Scientific | 60-1000 | to drill skull |
| Cafazolin (1 g lypholized) | N/A | N/A | Diluted to 50 mg/mL |
| Carprofen (50 mg/mL) | MWI Veterinary | Diluted to 25 mg/mL prior to administration | |
| Cotton tipped applicators | N/A | N/A | |
| Custom 3-D printed face mask | N/A | https://www.thingiverse.com/thing:923725 | |
| Dental acrylic | N/A | N/A | |
| Diet Gel Criticare | Clear H2O | 72-05-5042 | Nutritional support |
| Dopper Gel - Aquasonic | Patterson | 07-890-5542 | |
| Doppler - Vet-Dop2 | Patterson | 07-888-8986 | |
| Doxapram (20 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Dumont #5 Fine Forceps | Fine Science Tools | 11254-20 | For holding screws |
| Duraprep | 3M | 8630 | Final skin prep |
| ecgAuto data analysis software | emka technologies | N/A | |
| Epinephrine (1:1000) | MWI Veterinary | N/A | Emergency only |
| Gauze | N/A | N/A | |
| Glucometer ipet Pro | MWI Veterinary | 63867 | Monitor if poor recovery |
| Glycopyrrolate (0.2 mg/mL) | MWI Veterinary | N/A | Emergency only |
| Gram scale | N/A | N/A | |
| Hemostats | Fine Science Tools | 13008-12 | Hold wire loops while tying the loop in place |
| Ideal Micro-drill | Cell Point Scientific | 67-1204 | To drill skull |
| Incubator | DRE-veterinary (Infantia - NB1) | N/A | |
| Induction box | VetEquip | 941444 | |
| Infared heating pad - RightTemp Jr | Kent Scientific Corporation | RT-0502 | |
| IOX2 data acquisition software | emka technologies | N/A | |
| IV Catheter - Covidein Monoject 26 G, 3/4 inch PTFE | Patterson | 07-836-8494 | |
| ketamine (100 mg/mL) | MWI Veterinary | N/A | |
| Medical tape | N/A | N/A | |
| Narrow Pattern Forceps - Straight/12 cm | Fine Science Tools | 11002-12 | |
| Neonatal stethescope | Ultrascope | N/A | |
| Olsen-Hegar Needle holder with scissors - 12 cm | Fine Science Tools | 12002-12 | For suturing |
| Ophthalmic ointment Puralube | MWI Veterinary | N/A | Administered to both eyes during anesthesia |
| Opthalmic Lubricant - Paralube Vet | Patterson | 07-888-2572 | |
| Pulse oximeter (AccuWave Portable ) | Patterson | 07-892-9128 | For prep and recovery; reads HR up to 400 |
| Pulse oximeter (SDI - Vet/Ox plus 4700) | Heska | N/A | Intra-operative; no longer producted |
| Receiver | emka technologies | N/A | 1 receiver for every 4 telemetry implants |
| Rectal thermometer | N/A | N/A | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Scissors | Fine Science Tools | 14002-12 | To cut drape |
| Screw driver - 1.0 mm | N/A | N/A | From mini-screwdriver set for electronics |
| Screws 00-96 x 3/32 (2.4 mm) | Protech International | 8L0X3905202F | |
| Sevoflurane | MWI Veterinary | Maintenance anesthesia | |
| Sevoflurane vaporizer and anesthesia machine | N/A | N/A | |
| Skin glue, Gluture | MWI Veterinary | 34207 | Apply sparingly with syringe |
| Small scissors | Fine Science Tools | 14084-08 | |
| Sterile aluminum foil | N/A | N/A | To wrap wires prior to rotating animal |
| Sterile paint brush | N/A | N/A | To apply dental acrylic |
| Sterile Saline | N/A | N/A | |
| Sterile surgical gloves | N/A | N/A | |
| Sterile ultrasound cover | N/A | N/A | To cover the drill |
| Sterile Water | N/A | N/A | For cefazolin reconstitution |
| Surgical blade no. 15 | N/A | N/A | |
| Surgical drape | N/A | N/A | |
| Surgical gown | N/A | N/A | |
| Swivel connector - Jorgensen Labs | Patterson | 07-802-2349 | To connect anesthesia circuit to face mask |
| Telemetry implant | emka technologies | easyTEL+_M1_EETA_B_35 | |
| Trocar | SAI | TRO-10-6 | To tunnel wires |
References
- Bagnall, R. D., Crompton, D. E., Semsarian, C. Genetic Basis of Sudden Unexpected Death in Epilepsy. Front Neurol. 8, 348 (2017).
- Surges, R., et al. Pathologic cardiac repolarization in pharmacoresistant epilepsy and its potential role in sudden unexpected death in epilepsy: a case-control study. Epilepsia. 51 (2), 233-242 (2010).
- Surges, R., Thijs, R. D., Tan, H. L., Sander, J. W. Sudden unexpected death in epilepsy: risk factors and potential pathomechanisms. Nat Rev Neurol. 5 (9), 492-504 (2009).
- Shorvon, S., Tomson, T. Sudden unexpected death in epilepsy. Lancet. 378 (9808), 2028-2038 (2011).
- Schuele, S. U., et al. Video-electrographic and clinical features in patients with ictal asystole. Neurology. 69 (5), 434-441 (2007).
- Massey, C. A., Sowers, L. P., Dlouhy, B. J., Richerson, G. B. Mechanisms of sudden unexpected death in epilepsy: the pathway to prevention. Nat Rev Neurol. 10 (5), 271-282 (2014).
- Sahly, A. N., Shevell, M., Sadleir, L. G., Myers, K. A. SUDEP risk and autonomic dysfunction in genetic epilepsies. Auton Neurosci. 237, 102907 (2022).
- Cooper, M. S., et al. Mortality in Dravet syndrome. Epilepsy Res. 128, 43-47 (2016).
- Negishi, Y., et al. SCN8A-related developmental and epileptic encephalopathy with ictal asystole requiring cardiac pacemaker implantation. Brain Dev. 43 (7), 804-808 (2021).
- Meisler, M. H., et al. SCN8A encephalopathy: Research progress and prospects. Epilepsia. 57 (7), 1027-1035 (2016).
- Watanabe, H., et al. Sodium channel β1 subunit mutations associated with Brugada syndrome and cardiac conduction disease in humans. J Clin Invest. 118 (6), 2260-2268 (2008).
- Goldman, A. M., Glasscock, E., Yoo, J., Chen, T. T., Klassen, T. L., Noebels, J. L. Arrhythmia in heart and brain: KCNQ1 mutations link epilepsy and sudden unexplained death. Sci Transl Med. 1 (2), 2ra6 (2009).
- Nerbonne, J. M. Mouse models of arrhythmogenic cardiovascular disease: challenges and opportunities. Curr Opin Pharmacol. 15, 107-114 (2014).
- Frasier, C. R., et al. Channelopathy as a SUDEP Biomarker in Dravet Syndrome patient-derived cardiac myocytes. Stem Cell Rep. 11 (3), 626-634 (2018).
- Camacho, P., Fan, H., Liu, Z., He, J. -. Q. Small mammalian animal models of heart disease. Am J Cardiovasc. 6 (3), 70-80 (2016).
- Brodbelt, D. Perioperative mortality in small animal anaesthesia. Vet J. 182 (2), 152-161 (2009).
- Lee, H. W., Machin, H., Adami, C. Peri-anaesthetic mortality and nonfatal gastrointestinal complications in pet rabbits: a retrospective study on 210 cases. Vet Anaes Anal. 45 (4), 520-528 (2018).
- Comolli, J., et al. Comparison of endoscopic endotracheal intubation and the v-gel supraglottic airway device for spontaneously ventilating New Zealand white rabbits undergoing ovariohysterectomy. Vet Rec. 187 (10), e84-e84 (2020).
- Grint, N. J., Sayers, I. R., Cecchi, R., Harley, R., Day, M. J. Postanaesthetic tracheal strictures in three rabbits. Lab Anim. 40 (3), 301-308 (2006).
- Phaneuf, L. R., Barker, S., Groleau, M. A., Turner, P. V. Tracheal injury after endotracheal intubation and anesthesia in rabbits. J Am Assoc Lab Anim Sci. 45 (6), 67-72 (2006).
- Quesenberry, K. E., Orcutt, C. J., Mans, C., Carpenter, J. W. Gastrointestinal Diseases of Rabbits. Ferrets, Rabbits, and Rodents. , (2020).
- Desai, A., Macrae, D. . Cardiovascular Physiology in Infants, Children, and Adolescents. Pediatric and Congenital Cardiology, Cardiac Surgery and Intensive Care. , (2020).
- Bansal, N., Momin, S., Bansal, R., Venkata, S. K. R. G., Ruser, L., Yusuf, K. Pharmacokinetics of drugs: newborn perspective. Pediatr Med. 7, 19 (2024).
- Trachsel, D., Erb, T. O., Hammer, J., von Ungern-Sternberg, B. S. Developmental respiratory physiology. Paediat Anaesth. 32 (2), 108-117 (2022).
- Benito, S., Hadley, S., Camprubí-Camprubí, M., Sanchez-de-Toledo, J. Blind endotracheal intubation in neonatal rabbits. J Vis Exp. 168, e61874 (2021).
- Okamoto, S., Matsuura, N., Ichinohe, T. Effects of volatile anesthetics on oral tissue blood flow in rabbits: A comparison among isoflurane, sevoflurane, and desflurane. J Oral Maxillofac Surg. 73 (9), 1714.e1-1714.e8 (2015).
- Elshalakany, N. A., Salah, A. M. Comparative study: evaluation of the effect of sevoflurane versus isoflurane in general anesthesia for pediatric patients undergoing cardiac catheterization. Egypt J Anaesth. 38 (1), 409-414 (2022).
- Anjana, R. R., Parikh, P. V., Mahla, J. K., Kelawala, D. N., Patel, K. P., Ashwath, S. N. Comparative evaluation of isoflurane and sevoflurane in avian patients. Vet World. 14 (5), 1067-1073 (2021).
- Johnson, R. A., Striler, E., Sawyer, D. C., Brunson, D. B. Comparison of isoflurane with sevoflurane for anesthesia induction and recovery in adult dogs. Am J Vet Res. 59 (4), 478-481 (1998).
- Campbell, C., Nahrwold, M. L., Miller, D. D. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth. 42 (10), 884-890 (1995).
- TerRiet, M. F., et al. Which is most pungent: isoflurane, sevoflurane, or desflurane. Br J Anaesth. 85 (2), 305-307 (2000).
- Khanna, V. K., Pleuvry, B. J. A study of naloxone and doxapram as agents for the reversal of neuroleptanalgesic respiratory depression in the conscious rabbit. Br J Anaesth. 50 (9), 905-912 (1978).
- Flecknell, P. A., Liles, J. H., Wootton, R. Reversal of fentanyl/fluanisone neuroleptanalgesia in the rabbit using mixed agonist/antagonist opioids. Lab Anim. 23 (2), 147-155 (1989).
- Shafford, H. L., Schadt, J. C. Respiratory and cardiovascular effects of buprenorphine in conscious rabbits. Vet Anaesth Analg. 35 (4), 326-332 (2008).
- Feldman, E. R., Singh, B., Mishkin, N. G., Lachenauer, E. R., Martin-Flores, M., Daugherity, E. K. Effects of cisapride, buprenorphine, and their combination on gastrointestinal transit in New Zealand white rabbits. J Am Assoc Lab Anim Sci. 60 (2), 221-228 (2021).
- Harcourt-Brown, F. M., Harcourt-Brown, S. F. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170 (26), 674-674 (2012).
- Rivera, D. A., Buglione, A. E., Ray, S. E., Schaffer, C. B. MousePZT: A simple, reliable, low-cost device for vital sign monitoring and respiratory gating in mice under anesthesia. PLoS One. 19 (3), e0299047 (2024).
- Nicou, C. M., Passaglia, C. L. Characterization of intraocular pressure variability in conscious rats. Exp Eye Res. 239, 109757 (2024).
- Sadko, K. J., Leishman, D. J., Bailie, M. B., Lauver, D. A. A simple accurate method for concentration-QTc analysis in preclinical animal models. J Pharmacol Toxicol Methods. 128, 107528 (2024).
- Vuong, J. S., Garrett, J. J., Connolly, M. J., York, A. R., Gross, R. E., Devergnas, A. Head mounted telemetry system for seizures monitoring and sleep scoring on non-human primate. J Neurosci Methods. 346, 108915 (2020).
- Bosinski, C., Wagner, K., Zhou, X., Liu, L., Auerbach, D. S. Multi-system monitoring for identification of seizures, arrhythmias and apnea in conscious restrained rabbits. J Vis Exp. (169), e62256 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved