Method Article
Kraniyal Nöral Krest Hücreleri Çoğullanmış Test için Üç Boyutlu İn Vitro Farklılaşma Protokolü
Bu Makalede
Özet
Fare embriyonik kök hücrelerinden kraniyal nöral krest hücreleri üretmek için tekrarlanabilir boyutta nöroküreler üreten üç boyutlu (3D) bir in vitro farklılaşma protokolü sunuyoruz. Bu metodolojinin önceki protokollere kıyasla değişkenliği azalttığını ve kraniyal nöral krest hücre gelişimini incelemek için çoğullanmış test için nasıl kullanılabileceğini gösteriyoruz.
Özet
Hem ektodermal hem de mezenkimal türevler üretme konusundaki olağanüstü kapasiteleri ile kraniyal nöral krest hücreleri (CNCC), hücre kader kararlarını ve plastisitesini düzenleyen mekanizmaların incelenmesinde büyük ilgi görmüştür. Dorsal nöroepitelyumdan kaynaklanan bu hücre popülasyonu geçicidir ve gelişmekte olan embriyoda nispeten nadirdir - fonksiyonel testleri, genomik taramaları ve biyokimya testlerini in vivo olarak gerçekleştirmeyi zorlaştırır. Bu sınırlamaların üstesinden gelmek için, CNCC gelişimini in vitro olarak modellemek için çeşitli yöntemler geliştirilmiştir.Nörosfer (NS) tabanlı kültürleme yöntemleri, gelişmekte olan ön nöroepiteli 3 boyutlu olarak özetleyen karmaşık bir mikro ortam sağlar. Bu sistemler, büyük miktarda CNCC oluşturmak için aynı plakadaki birçok NS'nin büyümesine izin verir, ancak üretilen NS, şekil, boyut ve oluşan CNCC sayısında yüksek bir değişkenlik sunar - bu da kantitatif tahlillerin gerçekleştirilmesini zorlaştırır. Bu protokol, fare embriyonik kök hücrelerinden (mESC) 96 oyuklu bir formatta NS üretmek için tekrarlanabilir bir yöntemi ana hatlarıyla belirtir. 96 oyuklu plakalarda üretilen NS, daha fazla kültürlenebilen kraniyal nöral krest hücreleri (CNCC) üretir. Bu yaklaşım, başlangıç hücrelerinin sayısını kontrol ederek, NS arasındaki boyut ve şekildeki değişkenliği azaltır ve deneyler arasında tekrarlanabilirliği artırır. Son olarak, bu kültür sistemi çeşitli uygulamalara uyarlanabilir ve daha yüksek derecede esneklik sunar, bu da onu son derece özelleştirilebilir ve deneysel koşulların çoğullanması için uygun hale getirir.
Giriş
Kraniyal nöral krest hücreleri (CNCC), gelişmekte olan embriyonun en ön kısmında, nöral plaka ile yüzey ektodermi1 arasındaki sınırda ortaya çıkan kök benzeri bir hücre popülasyonudur. CNCC daha sonra epitelyal-mezenkimal geçişe (EMT) uğrar, nöroepitelden delaminasyona uğrar ve dorsoventral olarak embriyonun çeşitli yerlerine doğru göç eder ve burada çok çeşitli hücre tiplerine farklılaşırlar2. Bu hücre popülasyonunu incelemek, dikkate değer bir plastisiteye 3 ve kraniyofasiyal kemiklerve kıkırdaklar4 gibi hem ektodermal hem de mezenkimal türevlere farklılaşma konusunda benzersiz bir yeteneğe sahip olduğu için büyük ilgi görmektedir. CNCC embriyoda nispeten erişilebilir olmasına rağmen, düşük sayıda hücreye sahip geçici bir popülasyondur ve sistemik mekanik çalışmaların in vivo olarak yürütülmesini zorlaştırır. CNCC hücre hatları, bu sınırlamaların üstesinden gelmek için son birkaç yılda izole edilmiş ve karakterize edilmiştir. Özellikle, O9-1 CNCC hücre hattı, göç ve göç sonrası nöral krest gelişimini incelemek için harika bir araçtır 5,6; Bununla birlikte, bu hücre hattı, nöral krest indüksiyonu ve spesifikasyonuna yol açan göçten önceki erken olayların incelenmesine izin vermez. Bu bağlamda, embriyonik kök hücre (ESC) kolonilerinin farklılaşmasından sonra elde edilen nörosfer (NS)7,8- adı verilen gelişmekte olan nöroepitele benzeyen 3 boyutlu yapıların kullanılması yoluyla bir tabakta CNCC'yi farklılaştırmak için in vitro farklılaşma protokollerinin geliştirilmesinde önemli gelişmeler olmuştur. Bu 3D protokoller, biyokimyasal ve genomik mekanik çalışmaların yürütülmesine izin vererek yüksek sayıda CNCC'yi sağlam bir şekilde üretir 9,10. NS, hücre proliferasyonunu uyarmak için Fibroblast Büyüme Faktörü (FGF) ve Epidermal Büyüme Faktörü (EGF)10,11 ile birlikte N2B27 takviyeli ortamda düşük bağlantı plakaları üzerinde kültürlenir. Bu protokoller Petri kaplarında gerçekleştirilir ve aynı plakada çok sayıda NS yetiştirilir. Büyüyen NS içinde, hücreler toplanır ve bölünmeye devam eder - olgunlaştığında 100-200 μm çapa ulaşır. Olgunlukta (yaklaşık 5. gün), NS substrata bağlanır ve in vivo muadillerinebenzeyen CNCC'ye farklılaşır 9,12. Bu CNCC daha sonra EMT'ye tabi tutulur ve plaka yüzeyine delaminasyon yapılır. NS boyutuna bağlı olarak morfolojik farklılıklar gözlenebilir, çünkü daha düşük besin ve oksijen mevcudiyeti nedeniyle daha büyük küreler çekirdekte daha koyu görünecek ve hücrelerin apoptoz geçirmesine yol açacaktır13. Bu tür bir prosedür, farklılaşmanın son noktasında çok sayıda CNCC oluştururken, farklılaşma işlemi sırasında meydana gelen çeşitli moleküler dinamiklerin incelenmesini neredeyse imkansız hale getiren çeşitli sınırlamalar sunar. İlk olarak, büyüklükleri değişen ESC kolonilerinin kullanılması, her deney için başlangıç hücre sayısını kontrol etmeyi zorlaştırır. Bu, spesifik sinyal yollarını aktive ederek farklı şekilde gelişen, hücre farklılaşmasının değişmesine yol açan ve dolayısıyla belirli bir zaman noktasında tek tip bir numune oluşturmayan çeşitli şekil ve çaplarda NS üretimi ile sonuçlanır. İkincisi, aynı plakada birden fazla NS'nin kültürlenmesi, genellikle14'ü bir araya getirmelerine ve potansiyel olarak komşularının mikro çevresini ve dolayısıyla gelişimlerini etkileyen sinyal moleküllerini serbest bırakmalarına yol açar. Toplamda, bu prosedürler numuneler ve deneyler arasında çok fazla değişkenlik oluşturur.
Burada, TC ile muamele edilmemiş U tabanlı 96 oyuklu plakalarda fare ESC'yi (mESC) toplayarak CNCC üretebilen tek NS üreten bu zorlukların üstesinden gelmek için bir strateji sunuyoruz. mESC'den başlamak, halihazırda kurulmuş nöral krest hücre hatlarından başlamaya kıyasla spesifikasyon sürecini ve CNCC gelişiminin erken aşamalarını incelemeye izin verir. Bu protokol, tek hücreli bir süspansiyon elde etmek için mESC kolonilerinin ayrılmasıyla başlar, ardından TC ile muamele edilmemiş U tabanlı 96 oyuklu bir plakanın her bir oyuğunda belirli sayıda mESC'nin tohumlanması ile başlar. Hücreler iki gün boyunca toplanmaya bırakılır ve daha sonra NS'nin plaka tabanına yapışabileceği, TC ile muamele edilmemiş düz tabanlı 96 oyuklu bir plakaya taşınır. Bu protokol, farklılaşma işlemi sırasında her NS'nin başlangıç hücre sayısını ve mikro ortamını kontrol ederek, numune değişkenliğini azaltır ve bu da deneysel tekrarlanabilirliği artırır. Bunun, farklı kültür koşullarının etkisini test etmek veya gen bozulma ekranları gerçekleştirmek gibi çoğullanmış deneyler tasarlamak için uygun bir platform olacağına inanıyoruz.
Protokol
1. Fare ESC kolonilerinden tek hücreli bir süspansiyonun üretilmesi
NOT: Bu protokol, jelatin kaplı TC ile muamele edilmiş 6 oyuklu bir plakada inaktive edilmiş besleyiciler üzerinde büyütülen CK35 mESC'nin (germ hattı iletimi için yetkin bir mESC hattı, daha sonra in vivo modeller15 geliştirme seçeneğine sahip olmak için) kullanımına uyarlanmıştır. TC ile muamele edilmiş 6 oyuklu bir plakanın bir kuyucuğu yaklaşık 1,5 × 106 mESC vermelidir, bu da protokolün geri kalanı için yeterlidir. Gerekirse bu ölçeklendirilebilir. İlk adımları, seçilen ESC gerinim ve bakım kültürü yönteminin yanı sıra uygun kültür ortamına göre ayarlayın. Bu protokol steril koşullar altında yapılmalıdır. Bu protokolde kullanılan tüm malzemeler, reaktifler ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
- mESC kültür ortamında yetiştirilen %70-80'lik bir birleşimde mESC'den başlayın. Bu çalışmada kullanılan mESC kültür ortamı bileşimi için Tablo 1'e bakınız.
NOT: mESC'nin %80'in üzerinde birleşmesine izin vermeyin, çünkü farklılaşmaya başlayacaklar ve bu, toplama sürecini etkileyecektir. Koloniler kompakt olmalı ve sağlıklı bir morfoloji göstermelidir (çatlak veya dalga yok, belirgin nükleer-sitoplazma kontrastı). - CNCC farklılaşma ortamını hazırlayın. CNCC farklılaşma ortamı bileşimi için Tablo 1'e bakınız.
NOT: Büyüme faktörleri eklendikten sonra, ortam 4 ° C'de 3 haftaya kadar saklanabilir. Ortamın ışıktan korunduğundan emin olun. - DMEM-Knockout ortamında 2 mg / mL konsantrasyonda taze bir kollajenaz çözeltisi hazırlayın.
NOT: Kollajenaz kullanımı, besleyicilerin değil, yalnızca kolonilerin ayrılmasını sağlar, çünkü aşağıdaki adımlardaki varlıkları NS agregasyonunu engelleyecektir. 0.22 μm'lik bir filtre ile kullanmadan önce kollajenaz çözeltisini filtreleyin. - ESC ortamını mESC'den aspire edin.
- Kuyu kenarına yavaşça 1 mL PBS ekleyin. Eşit yıkamayı sağlamak için plakayı hafifçe sallayın.
- PBS'yi çıkarın ve 2 mL kollajenaz çözeltisi ile değiştirin. 37 °C'de 30-45 dakika inkübe edin.
- Plakayı ilk 20 dakikadan sonra ve daha sonra her 5 dakikada bir 10x büyütmede bir ışık mikroskobu altında kontrol edin.
- Koloniler kıvrılmış kenarlar gösterdiğinde, plaka tarafına kuvvetlice vurun ve koloniler ayrılacaktır.
- 5 mL'lik bir serolojik pipet ile kolonileri toplayın ve 15 mL'lik konik bir tüpe aktarın.
NOT: Artık koloniler için plakayı ışık mikroskobu altında kontrol edin. Bunlar bir PBS yıkama ile toplanabilir. - Kolonileri oda sıcaklığında (RT) 3 dakika boyunca 16 × g'da santrifüjleyin.
- Tüpün altındaki kolonileri rahatsız etmemeye dikkat ederek konik tüpten mümkün olduğunca fazla besiyeri aspire edin.
- 1 mL% 0.05 tripsin çözeltisi ekleyin ve tüpü 37 ° C'de 5 dakika inkübe edin.
- Önce bir p1000 ve ardından bir p200 mikropipet ile kuvvetlice yukarı ve aşağı pipetleyerek tüpteki kolonileri ayırın.
NOT: Bu, tek hücreli bir süspansiyonun elde edilmesini sağlar. - Tripsini bloke etmek için 2 mL mESC kültür ortamı ekleyin ve RT'de 3 dakika boyunca 160 × g'da santrifüjleyin. Süpernatanı çıkarın ve 1 mL CNCC farklılaşma ortamı ekleyin.
- Üretici talimatlarını izleyerek otomatik bir hücre sayma cihazı veya mikroskop altında standartlaştırılmış bir sistem kullanarak hücreleri sayın.
- Saydıktan sonra, 50 μL'de 3000 canlı hücre konsantrasyonu elde etmek için yeterli CNCC farklılaşma ortamı ile seyreltin.
- Bir p200 mikropipet kullanarak, TC ile muamele edilmemiş U-tabanlı 96 oyuklu bir plakanın her bir oyuğuna 50 μL hücre süspansiyonu tohumlayın, daha sonra kuyuyu CNCC farklılaşma ortamı ile 200 μL'ye kadar doldurun.
NOT: Plakayı doldururken, homojen bir konsantrasyon elde etmek için zaman zaman tek hücreli süspansiyonu bir p1000 mikropipet ile yeniden süspanse edin. - Gece boyunca 37 °C, %5 CO2'de bir inkübatörde inkübe edin.
2. CNCC farklılaşması için düz tabanlı 96 oyuklu bir plakaya aktarma
- Ertesi gün (1. gün), plakayı ışık mikroskobu altında gözlemleyin. Her kuyucuğun dibinde net kenarlıkları olan küçük bir hücre kümesinin göründüğünden emin olun. Plakayı gece boyunca inkübatöre geri koyun.
NOT: Ana agreganın etrafında bazı hücreler olabilir, bazıları ölü olabilir. Bu, NS toplamayı engellemez. - 2. günde, her kuyucuktan yavaşça 100 μL ortam çıkarın.
- Ortamı aspire ederken, NS'yi çıkarmamaya dikkat edin. Bunu yapmaktan kaçınmak için pipet ucunu yüzeye yakın ve alttan uzağa yerleştirin.
- Bir p200 mikropipetin ucunu uçtan yaklaşık 3-4 mm uzakta kesin. NS'yi kalan ortamla aspire etmek için bunu kullanın.
NOT: NS'yi almayı kolaylaştırmak için, aspire etmeden önce birkaç kez hafifçe yukarı ve aşağı pipetleyin. - NS'yi ve kalan ortamı, TC ile muamele edilmemiş düz tabanlı 96 oyuklu bir plakaya aktarın ve aktarımı bir ışık mikroskobu altında doğrulayın, ardından her yeni kuyucuğu 100 μL önceden ısıtılmış CNCC farklılaştırma ortamı ile doldurun. NS'yi 4. güne kadar 37 °C, %5 CO2'de inkübatörde bırakın.
- 4. günde, her oyuktan 100 μL ortamı çıkarın ve 100 μL önceden ısıtılmış CNCC farklılaştırma ortamı ile değiştirin.
NOT: Plakanın altındaki NS ekinin bozulmasını önlemek için, ortamı yavaşça aspire edin ve değiştirin. - 5. ve 6. günlerde, NS ekini ışık mikroskobu altında kontrol edin. NS'den delaminasyona uğrayan daha hafif hücrelerin NS'nin ana gövdesini çevreleyeceğinden emin olun.
- 7. günde, ortamı 2.5'te açıklandığı gibi değiştirin. Etüdün son noktasına kadar her 2 günde bir aynı prosedürle ortamı değiştirin.
3. CNCC geçişi ve bakımı
NOT: CNCC geçişi, NS çevresinde görünür yeterli miktarda hücre olduğu anda gerçekleştirilebilir. Bu, 7. gün kadar erken olabilir, çünkü daha önceki zaman noktaları yeterli miktarda CNCC sağlamaz.
- CNCC Bakım ortamını hazırlayın. CNCC Bakım ortamı bileşimi için Tablo 1'e bakın.
- Ortama eklemeden önce, çözündürüldükten sonra BSA'yı 0.22 μm'lik bir filtreden süzün. Büyüme faktörleri eklendikten sonra, ortamı 4 ° C'de 3 haftaya kadar saklayın. Ortamın ışıktan korunduğundan emin olun.
- PBS'de 7.5 μg / mL'de fibronektin hazırlayın. Kuvvetlice karıştırın.
- Oyuk başına 100 μL fibronektin çözeltisi ekleyerek TC ile muamele edilmemiş 96 oyuklu bir plakanın kuyularını kaplayın. RT'de 30 dakika kaputun altında kaplamaya izin verin.
NOT: CNCC, immünofloresan boyama için tasarlanmışsa, kaplamadan önce kuyunun dibine steril bir cam lamel yerleştirin. Sürgünün kuyunun dibinde kaldığından ve kullanılacak olanın karşı tarafının kaplanmasını önlemek için yüzmediğinden emin olun. CNCC sabitleme ve montajı için bölüm 5'teki talimatları izleyin. - Bu arada, TC ile muamele edilmemiş düz tabanlı 96 oyuklu plakada, kuyucuklardan mümkün olduğunca fazla CNCC farklılaşma ortamını aspire edin ve 50 μL akaktaz ile değiştirin. 37 °C'de 5 dakika inkübe edin.
- İnkübasyondan sonra, accutaze'i söndürmek için kuyu başına 100 μL CNCC bakım ortamı ekleyin. Fibronektin'i, TC ile muamele edilmemiş düz tabanlı 96 oyuklu plakanın kuyucuklarından çıkarın. Ayrılmış göç sonrası CNCC'yi, alıcı TC muameleli olmayan düz tabanlı 96 oyuklu plakanın kuyusunun üstündeki 40 μm'lik bir filtreden geçirerek filtreleyin.
NOT: Bu, daha önce kaldırılmamış hücre kümelerini veya kalan NS'leri filtreleyecektir. Aynı durumda yetiştirilen CNCC, daha sonra TC ile muamele edilmiş 6 oyuklu bir plakanın aynı kuyucuğuna ekilmek üzere 50 mL'lik bir tüpte toplanabilir. Bu durumda, kuyuyu 1 mL fibronektin ile kaplayın ve accutaze'i söndürmek için 1 mL CNCC bakım ortamı kullanın. - Göç sonrası CNCC'nin 37 ° C'de 15-30 dakika bağlanmasına izin verin. Ortamı atın ve 100 μL CNCC bakım ortamı ile değiştirin. Ortamı her 2 günde bir değiştirin.
NOT: Hızlı akış, CNCC'nin nöral türevlere farklılaşmasına neden olduğu için ortamı yavaşça ekleyin. 6 oyuklu bir formatta çalışıyorsanız, 1 mL CNCC bakım ortamı kullanın.
4. İmmünofloresan için NS fiksasyonu ve montajı
- İstenilen zaman noktasında, NS'yi TC ile muamele edilmemiş düz tabanlı 96 oyuklu plakadan, bir p200 mikropipetinin ucunu keserek DNA düşük bağlayıcı 2 mL'lik bir tüpe aktarın ve NS'yi almak için hafifçe yukarı ve aşağı pipetleyin.
NOT: Daha sonraki zaman noktalarında (7. günden itibaren), NS gözle görülebilecek kadar büyük olacak, ancak çıkarılması da daha zor olacaktır. - NS'nin RT'de 3 dakika tüpe yerleşmesine izin verin, mümkün olduğunca fazla ortamı çıkarın ve 1 mL soğuk PBS ile durulayın.
NOT: Erken zaman noktalarından (3-4. günlerden önce) küçük NS aktarıyorsanız, NS'nin dibe oturmasını sağlamak için 3 dakika boyunca 16 × g'da döndürün. - PBS'yi çıkarın ve kimyasal bir başlıkta PBS'de 2 mL% 4 PFA ile değiştirin. RT'de 20 dakika inkübe edin.
- % 4 PFA çözeltisi ekledikten sonra tüpü yavaşça ters çevirin ve yan taraftaki sabitleme sırasında dinlenmeye bırakın. Amaç, NS'yi hafifçe yaymaktır, böylece bu adımda birbirine yapışmazlar.
- % 4 PFA çözeltisini (kimyasal başlıkta) çıkarın ve NS'yi 1 mL soğuk PBS /% 0.5 Tween20 ile yıkayın. 3 dakika RT'de yerleşmesine izin verin. Bunu toplamda 3 kez tekrarlayın.
NOT: NS en alta yerleşecektir. - PBS /% 0.5 Tween20'yi çıkarın ve 2 mL PBS /% 0.1 Triton X-100 ekleyin. Tüpü ters çevirin ve yan tarafta dinlenmesine izin verin. RT'de 1 saat inkübe edin.
- NS'yi adım 4.4'te belirtildiği gibi soğuk PBS/%0.5 Tween20'de 3 kez yıkayın.
- PBS/%0,5 Tween20'yi çıkarın ve PBS'de 4 °C'de en az 1 saat, tercihen gece boyunca %2 BSA ile bloke edin.
NOT: Numuneler, 4 °C'de 1 haftaya kadar %2 BSA/PBS'de saklanabilir. Işıktan koruyun. - Primer antikorun doğru seyreltmesini 500 μL'lik bir son hacimde% 2 BSA / PBS'ye ekleyerek primer antikor solüsyonu hazırlayın. Bu çalışmada kullanılan primer antikor karışımı için Tablo 2'ye bakınız.
- Blokaj solüsyonunun mümkün olduğu kadar çoğunu çıkarın ve bir p200 mikropipetinin ucunu keserek NS'yi 0,5 mL'lik bir tüpe aktarın.
- Birincil antikor solüsyonunu ekleyin ve NS'yi yeniden süspanse etmek için yavaşça yukarı ve aşağı pipetleyin. Gece boyunca 4 °C'de bir döndürücü üzerinde inkübe edin.
- NS'yi RT'de 5 dakika boyunca soğuk PBS'de 3 kez yıkayın.
- Tercih edilen ikincil antikorları% 2 BSA / PBS'de seyrelterek ve 1/1000 DAPI ekleyerek ikincil antikor çözeltisini hazırlayın. Bu çalışmada kullanılan ikincil antikor karışımı için Tablo 2'ye bakınız.
NOT: Tüpleri ışıktan koruyun. - PBS'yi 500 μL ikincil antikor çözeltisi ile değiştirin ve tüpü ışıktan korumak için alüminyum folyo ile sarın. RT'de döndürücü üzerinde 1 saat inkübe edin.
- NS'yi adım 4.11'de belirtildiği gibi soğuk PBS'de 3 kez yıkayın.
- NS'yi aspire etmeden mümkün olduğunca fazla PBS'yi çıkarın, yerine 50 μL temizleme maddesi koyun ve üretici talimatlarını izleyin.
- Işıktan korunarak gece boyunca RT'de inkübe edin.
- Montaj odalarını hazırlayın.
- Bir mikroskop lamına üç kat çift taraflı bant yerleştirin. Montaj haznesinde kalıntıları önlemek için şeffaf, lifsiz bant kullanın.
- Bir tıraş bıçağı kullanarak çift bantta 3 mm × 8 mm'lik bir pencere kesin.
NOT: Hazne boyutları, numune zaman noktasına bağlıdır. Bu örnek, daha sonraki zaman noktalarında (7-9. günler) 10-20 tek NS için en uygun olan 50 μL montaj ortamını barındırmak için uygundur.
- Bir stereoskop altında, düşük yapışma özelliğine sahip bir p200 mikropipet ucu keserek temizleme maddesindeki NS'yi dikkatlice montaj odasına aktarın. Tüm odanın görüş alanını sağlamak için 2x ile 4x arasında bir büyütme ve NS'yi tanımlamak için yeterli büyütme kullanın. Stereoskop floresan görüntüleme için donatılmışsa, mavi bir floresan filtresiyle çalışmak NS'yi tanımlamayı kolaylaştıracaktır, çünkü DAPI boyaması aksi takdirde şeffaf olan NS'yi öne çıkaracaktır.
NOT: Ortamın haznenin üzerinde hafif dışbükey bir menisküs oluşturduğunu doğrulayın. Bu, haznede kabarcık olmamasını sağlayacaktır. - Yüzeye bir lamel yerleştirin ve yapışmasını sağlamak için yanlarına hafifçe bastırın. Bu adımı stereoskop altında gerçekleştirin ve NS'nin odanın dışına itilmediğini doğrulayın.
- Görüntülemeye kadar ışıktan koruyarak 4 °C'de saklayın.
5. İmmünofloresan için CNCC fiksasyonu ve montajı
- CNCC bakım ortamını kuyulardan çıkarın ve PBS ile yıkayın. Kuyunun kenarına pipetleyerek PBS'yi nazikçe ekleyin.
- Adım 4.3-4.14'te açıklandığı gibi fiksasyon, geçirgenlik ve boyama ile devam edin.
- Lameli bir mikroskopi cam lam üzerine monte ederek monte edin, lamel cımbız kullanarak lamel tutun ve göç sonrası CNCC cam slayta bakacak şekilde döndürün ve damlanın üzerine yerleştirin.
- İsteğe bağlı: Lameli oje veya diğer yaygın olarak kullanılan sızdırmazlık sistemleriyle kapatın.
- Görüntülemeye kadar ışıktan koruyarak 4 °C'de saklayın.
Sonuçlar
Protokolü takiben, mESC kolonileri ayrıldı ve 3000 hücre, TC ile muamele edilmemiş U-dipli 96 oyuklu plakalara ekildi. 2. günde, agrega NS, yapışmalarına izin vermek için TC ile muamele edilmemiş düz tabanlı 96 oyuklu plakalara aktarıldı. NS toplama protokolünün basitleştirilmiş bir görselleştirmesi Şekil 1A'da verilmiştir. NS 9. güne kadar kültürlendi ve daha sonra immünofloresan boyama için işlendi. NS'den plakaya göç eden hücreler, görüntüleme için lamellere aktarıldı ve CNCC bakım ortamında 13. güne kadar kültürlendi. Buna paralel olarak, bir Petri kabında NS üretme protokolü bir referans ve karşılaştırma noktası olarak gerçekleştirildi. Deneyin genel amacı, Petri kabında gerçekleştirilen protokolde gözlemlenen NS'den NS'ye değişkenliği azaltmaktı.
TC ile muamele edilmemiş 96 oyuklu plakalarda ayrı ayrı kültürlendiğinde, NS azalmış fenotipik değişkenlik gösterdi. Tüm NS'ler 5. günde bağlanmaya başlarken, bağlı NS'lerin oranı çok değişkendi ve genel olarak, bir Petri kabında kültürlendiğinde 7. günde daha az önemliydi (Şekil 1B, C). Ek olarak, bir Petri kabında kültürlendiğinde, 4. günde gözlemlenebileceği gibi NS füzyonu tutarlı bir şekilde gözlenir (Şekil 1B). 9. günde, hem TC ile muamele edilmemiş 96 oyuklu plakalarda hem de Petri kabı kültürü koşullarında NS'den geniş hücre delaminasyonu gözlenebilir (Şekil 1B, C). NS, protokoller arasındaki boyut değişkenliğini karşılaştırmak için 4. ve 7. günlerde toplandı. TC ile muamele edilmemiş 96 oyuklu plakada kültürlenen NS, hem 4. günde hem de 7. günde boyut değişkenliğinde önemli bir azalma gösterir. Buna karşılık, Petri kabında kültürlendiğinde NS önemli bir boyut değişkenliği gösterir (Şekil 2A). TC ile muamele edilmemiş 96 oyuklu plakada, 4. gün NS çapı 139 μm ile 295 μm arasında ve 7. günde 383 μm ile 552 μm arasında değişirken, Petri kabında 4. gün NS çapı 126 μm ile 505 μm arasında ve 7. günde 106 μm ile 868 μm arasında değişmektedir. TC ile muamele edilmemiş 96 oyuklu plakada kültürlenen NS, 2. günden 9. güne kadar her gün toplandı ve büyümeleri ölçüldü. Hücre sayısı, 2. günde ortalama 1082 hücreden ve 9. günde ortalama 48352 hücreden katlanarak artar (Şekil 2B), NS çap boyutu ise 2. günde ortalama 136 μm çap ve 9. günde ortalama 570 μm çap ile doğrusal bir büyüme izler (Şekil 2C).
TC ile muamele edilmemiş 96 oyuklu plakada kültürden sonra, NS ve delamine hücreler CNCC belirteçleri AP2α, PAX7 ve SOX916 ve bir EMT belirteci16 olan TWIST1 için boyandı. Numune toplama, boyama ve montaj protokolünün şematik bir görselleştirmesi Şekil 3'te gösterilmiştir. NS immünofloresan analizi için montaj odasının temsili bir görüntüsü Şekil 4A'da gösterilmektedir. Bu analiz, TC ile muamele edilmemiş 96 oyuklu plakada kültürlenen NS'nin, EMT'ye tabi tutulan CNCC oluşturduğunu ve delaminasyon hücrelerinin bir CNCC kimliği sunduğunu doğrulamayı amaçladı. Hem NS hem de göç sonrası CNCC, 9. ve 13. günlerde AP2α, SOX9 ve TWIST1'in geniş ekspresyonunu gösterirken, PAX7 - göç öncesi bir CNCC belirteci16 - göç sonrası CNCC'de değil, yalnızca NS'de bulunur (Şekil 4C). Birlikte, bu sonuçlar, TC ile muamele edilmemiş 96 oyuklu plaka NS kültür protokolünün, EMT'ye tabi tutulan ve plaka yüzeyinde göç eden CNCC ürettiğini doğrulamaktadır. Göç sonrası 9. gün NS ve göç sonrası 13. gün CNCC, gelişmekte olan NS'deki nöronal türevleri görselleştirmek için nöronal belirteç TUJ117 (Şekil 4B) için de boyandı.
Son olarak, mESC ve göç sonrası 13. gün CNCC'de RT-qPCR gen ekspresyon analizi yapıldı (Şekil 4D). RNA, Trizol kullanılarak ekstrakte edildi ve daha sonra üretici talimatları kullanılarak RT-qPCR gerçekleştirildi. Göç sonrası CNCC'de, nöral krest belirteçleri Ap2α, Sox9 ve Sox1018'in ekspresyonu, mESC'ye kıyasla sırasıyla 5.42 kat, 51.07 kat ve 46.75 kat artmıştır. Nöral progenitör belirteçler Eya2, Ascl1 ve Neurog219 ekspresyonu da göç sonrası CNCC'den sonraki 13. günde mESC'ye kıyasla sırasıyla 7.78 kat, 43.92 kat ve 13.83 kat artmıştır. Mezenkimal / osteoblastik belirteçler Mef2c, Alx4 ve Ets120, göç sonrası CNCC'de mESC'ye kıyasla sırasıyla 168.44 kat, 156.47 kat ve 41.23 kat artmış ekspresyon gösterdi (Tablo 3'teki primer dizileri). Birlikte bu, bu protokolde üretilen göç sonrası CNCC'nin bir nöronal veya ektomezenşim kaderine karşı önyargılı olmadığını gösterir.
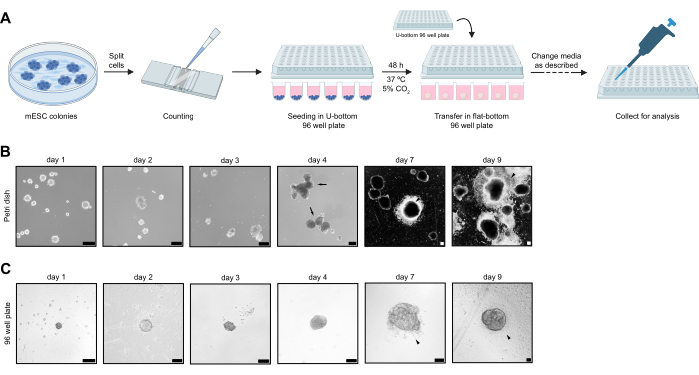
Şekil 1: NS toplama iş akışı ve Petri kabında yetiştirilen NS ile fenotipik karşılaştırma. (A) mESC tohumlama ve NS kültürünün iş akışı prosedürü. (B) Bir Petri kabında gerçekleştirilen NS farklılaşmasının temsili görüntüleri. Farklı boyutlardaki NS'ler erken zaman noktalarından gözlemlenebilir. Oklar NS füzyonunu gösterir. Beyaz ok uçları, NS'den ayrılan hücreleri gösterir. (C) TC ile muamele edilmemiş 96 oyuklu plakalarda gerçekleştirilen zaman seyri NS farklılaşması sırasında temsili görüntüler. Siyah ok uçları, NS'den ayrılan hücreleri gösterir. Günler en üstte belirtilmiştir. Ölçek çubukları 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
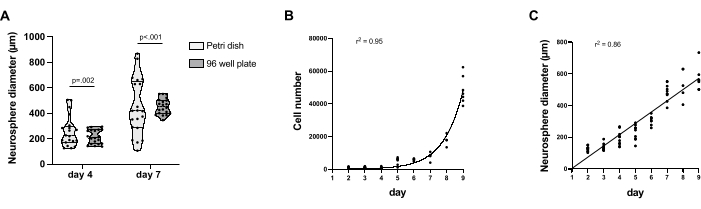
Şekil 2: Toplu NS büyüme karakterizasyonu ve Petri kabında yetiştirilen NS ile karşılaştırılması. (A) Petri kabında NS boyut değişimini ve TC ile muamele edilmemiş 96 oyuklu plaka kültürü protokolünü gösteren keman grafiği. Her protokol ve zaman noktası için 20 NS toplandı. Standart sapma değişkenliği için F-testleri yapıldı ve sonuçlar grafiğin üzerindeki çubuklarda gösterildi. (B) TC ile muamele edilmemiş 96 oyuklu plakalarda farklılaşma sırasında NS hücre sayısının zaman seyri ölçümü. (C) TC ile muamele edilmemiş 96 oyuklu plakada farklılaşma sırasında NS çap boyutu değişiminin nicelleştirilmesi. Hücre sayımı CellProfiler 4.2.5 kullanılarak gerçekleştirildi. Graphpad Prism 9 kullanılarak grafik oluşturma ve regresyon analizi yapılmıştır. Her zaman noktası için 5 ila 10 NS ölçüldü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: NS toplama ve immünofloresan analizi iş akışı. NS toplamayı, immünofloresan boyamaya hazırlığı ve üstte belirtilen her adım için gösterge niteliğindeki zaman aralıkları ile görüntülemeyi temsil eden şematik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: TC ile muamele edilmemiş 96 oyuklu plakada büyütülen NS, CNCC oluşturur. (A) Görüntüleme slaytının (1) ve hazneyi kesmek için kullanılan neşterin (2) temsili resmi. (B) 9. günde NS'nin (solda) ve göç sonrası CNCC'nin 13. günde (sağda) nöron belirteci TUJ1'in ekspresyonunu gösteren immünofloresan görüntüleri. Beyaz oklar hücre gövdelerini gösterir. Kesikli kare, orta panellerde gösterilen yakınlaştırma bölgelerini gösterir. Ölçek çubuğu 100 μm'yi temsil eder. (C) NS'nin 9. günde (üstte) ve göç sonrası CNCC'nin 13. günde (altta) CNCC spesifikasyon belirteci AP2α, CNCC belirteçleri PAX7 ve SOX9 ve EMT işaretleyicisi TWIST1'in ekspresyonunu gösteren immünofloresan görüntüleri. Ölçek çubuğu 100 μm'yi temsil eder. (D) mESC'de (siyah) ve göç sonrası CNCC'de (gri renkte) göreceli gen ekspresyonunu karşılaştıran sütun çubuğu grafikleri. CNCC (Ap2α, Sox9 ve Sox10), nöronal (Eya2, Ascl1, Neurog2) ve ektomesenşim (Mef2c, Alx4, Ets1), marker genlerinin ekspresyonu, temizlik genleri ActinB, Ywhaz ve Tbp'nin ortalama ekspresyonu ile karşılaştırılır. Hata çubukları, üç teknik kopyadan hesaplanan standart hataları temsil eder (yıldız = p<0.05, çift yıldız = p<0.01). Grafikler GraphPad Prism 9 kullanılarak oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Kültür ortamı bileşimleri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Çalışmada kullanılan primer ve sekonder antikorlar. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Primer dizileri. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
İn vitro 3D farklılaşma modelleri, 2D hücre kültüründe gözlemlenmesi zor olabilecek veya edilemeyecek karmaşık hücre etkileşimlerinin analiz edilmesine izin verir. CNCC gelişimini in vitro olarak incelemek için çeşitli modeller geliştirilmiştir. Bunlar genellikle doğrudan ESC kolonilerinden 7,21 veya doku eksplantlarından22,23 türetilir. Bu sistemlerin nöral krest hücreleri oluşturmak için verimli olduğu kanıtlanmış olsa da, bu tür yöntemler, kültürleme yöntemine ve mikro çevreye önemli bir duyarlılık gösterir, bu da NS24 içinde hem hücre bileşiminde hem de hücre özelliklerinde farklılıklara yol açar. Ayrıca, bu yöntemler ESC koloni boyutunun ve hücre sayısının başlangıçtaki heterojenliğini hesaba katmaz.
Bu sınırlamaları ele almak için, bu makale, TC ile muamele edilmemiş 96 oyuklu plakalarda mESC agregasyonu yoluyla tek NS oluşturmak için bir yöntemi özetlemektedir. Bu protokol, mESC kolonilerinden tek hücreli bir süspansiyon oluşturarak ve deneydeki ilk hücre sayısını kontrol ederek başlangıç koşullarının standardizasyonuna izin verir. Bu, farklılaşma sırasında NS çapında, boyut değişkenliğinde ve hücre sayısında bir azalmaya yol açar. Ayrıca, kuyu başına tek bir NS üretmek, NS füzyonunu iptal eder ve komşu NS'nin kontrol edilemeyen hücre dışı faktörleri serbest bırakarak mikro çevreyi etkilemesini önler. 96 oyuklu bir plaka formatının kullanılması, (i) hücre durumları veya hücre sayısı gibi başlangıç kültürü koşulunun etkisinin değerlendirilmesi; (ii) standartlaştırılmış bir ortamda çok sayıda kültür koşulunun test edilmesi; (iii) canlı görüntüleme deneyleri yapmak; ve (iv) siRNA aracılı gen susturma kullanarak yüksek verimli genetik pertürbasyon ekranı tasarlamak. Unutulmamalıdır ki, bu protokol hem fare hem de insan ESC hatları 9,25 ile gerçekleştirilebilir. Bunlar birlikte, CNCC plastisitesini ve hücre kaderi kararlarını kontrol eden moleküler mekanizmaların daha fazla araştırılmasına izin verecektir.
Bu protokolün bir sınırlaması, üretilen NS sayısının azalmasıdır, bu da aşağıdaki kültür için daha az CNCC ile sonuçlanır. CNCC daha sonra10 amplifiye edilebilirken, bu, çok sayıda hücre gerektiren prosedürler için bu protokolün kullanımını sınırlar. İkinci bir potansiyel dezavantaj, NS manipülasyonunun daha fazla el becerisi gerektirmesidir ve bu, özellikle daha erken zaman noktalarında numunelerin kaybolmasına ve dolayısıyla numune boyutunun daha da azalmasına neden olabilir. Bu, kullanılan plaka sayısını artırarak aşılabilir.
Protokolün kritik bir yönü, mESC'den tek hücreli bir süspansiyonun oluşturulmasıdır. mESC'yi kültürlemek için kullanılan herhangi bir besleyici hücrenin, agregasyona müdahale ettikleri ve beklenmedik fenotiplere ve yanıltıcı sonuçlara yol açtıkları için agregasyondan önce çıkarılması esastır.
Özetle, bu yöntem, in vivo çalışmalara paralel olarak kullanılmak üzere NS üretmek için tekrarlanabilir, ölçeklenebilir ve yüksek derecede modüle edilebilir bir yol sunar.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Astar tasarımı ve hücre kültürü uzmanlığı konusundaki tavsiyeleri için Dr. Remi Xavier Coux'a teşekkür ederiz. Bu çalışma Avrupa Araştırma Konseyi (ERC Başlangıç Hibesi 101039995 - REGENECREST) ve Fondation pour la Recherche Médicale (Amorçage - AJE202205015403) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 μm syringe filters | ClearLine | 146560 | |
| 15 mL High-Clarity Polypropylene Conical Tube | Falcon | 352096 | |
| 200 µL ClearLine Plus Low Binding Filter Tips | Dutscher | 713263 | |
| 40 µm filters | Falcon | 352340 | |
| 5 mL Serological pipette | Starstedt | 86.1253.001 | |
| 50 mL High-Clarity Polypropylene Conical Tube | Falcon | 352070 | |
| Accutase | Merck-Sigma | A6964 | |
| Alexa Fluor 488 donkey anti rabbit IgG (H+L) | Thermofisher Scientific | A21206 | |
| Alexa Fluor 594 donkey anti mouse IgG (H+L) | Thermofisher Scientific | A21203 | |
| Alexa Fluor 647 donkey anti goat IgG (H+L) | Thermofisher Scientific | A31571 | |
| Antibiotic-antimycotic solution | Merck-Sigma | A5955 | |
| B27 PLUS supplement | Thermofisher Scientific | 17504044 | |
| Bovine serum albumin (BSA) | Merck-Sigma | A9418 | |
| Chloroform | Carlo Erba | 438601 | |
| Collagenase Type IV | Thermofisher Scientific, Gibco | 17104019 | |
| Costar 6 well clear TC-treated multiple well plates | Corning | 3516 | |
| Cover glasses, round | VWR | 630-2113 | |
| DMEM KnockOut | Thermofisher Scientific | 10829018 | |
| DMEM/F12+Glutamax | Thermofisher Scientific | 10565018 | |
| DMEM high glucose | Merck-Sigma | D0822 | |
| DNA LoBind Tubes, 2 mL | Eppendorf | 30108078 | |
| DNase/RNase-Free Distilled Water | Thermofisher Scientific | 10977-035 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Thermofisher Scientific | 14190144 | |
| Eppendorf Safe-Lock Tubes, 0.5 mL | Eppendorf | 30121023 | |
| Eppendorf Safe-Lock Tubes, 2 mL | Eppendorf | 30120094 | |
| ESGRO mLIF Medium Supplement | Merck-Sigma | ESG1107 | |
| Ethanol 70% | Carlo Erba | 528170 | |
| Fetal Bovine Serum | Merck-Sigma | F7524 | |
| Fibronectin | Merck-Sigma | F085-2MG | |
| Fluoromount-G | Invitrogen | 00-4958-02 | |
| Gelatin solution | Merck-Sigma | ES-006-B | |
| GlutaMAX | Thermofisher Scientific | 35050061 | |
| Human EGF | Peprotech | AF-100-15-500UG | |
| Human FGF-basic | Peprotech | 100-18B | |
| Human SOX9 Antibody | R&Dsystems | AF3075 | |
| Insulin from bovine pancreas | Merck-Sigma | I6634 | |
| iScript cDNA Synthesis Kit | Biorad | 1708891 | |
| Mouse Anti-Human AP-2 alpha Monoclonal Antibody, Unconjugated | DSHB | 3B5 | |
| Mouse Anti-Human PAX7 Monoclonal Antibody, Unconjugated | DSHB | PAX7 | |
| N2 supplement | Thermofisher Scientific | 17502048 | |
| Neurobasal Medium | Thermofisher Scientific | 21103049 | |
| Non-Tissue culture treated plate, 96 well, Flat bottom | Falcon | 351172 | |
| Non-Tissue culture treated plate, 96 well, U-bottom | Falcon | 351177 | |
| Paraformaldehyde 16% solution, em grade | Electron Microscopy Sciences | 15710 | |
| Propan-2-ol | Carlo Erba | 415154 | |
| Purified anti-Tubulin β 3 (TUJ1) Antibody | Biolegend | MMS-435P | |
| RapiClear 1.47 | Sunjin Lab | RC147001 | |
| RapiClear 1.52 | Sunjin Lab | RC152001 | |
| Scotch Double Sided 12.7 mm × 22.8 m | Clear fibreless double sided tape | ||
| SensiFAST SYBR No-ROX Kit | Meridian Bioscience | BIO-98020 | |
| Sterile Disposable Surgical Scalpels | Swann-Morton | 05XX | |
| Superfrost Plus Adhesion Microscope Slides | Epredia | J1800AMNZ | |
| Triton X-100 | Thermofisher Scientific | A16046.AP | |
| TRIzol Reagent | FisherScientific | 15596026 | |
| Trypsine-EDTA (0.05%) | Thermofisher Scientific | 25300054 | |
| Tween-20 | Fisher Scientific | 10113103 | |
| TWIST1 Rabbit mAb (IF Formulated) | Cell signaling technology | E7E2G | |
| β-mercaptoethanol | Thermofisher Scientific | 31350010 |
Referanslar
- Rothstein, M., Bhattacharya, D., Simoes-Costa, M. The molecular basis of neural crest axial identity. Dev Biol. 444, S170-S180 (2018).
- Smeriglio, P., Zalc, A. Cranial neural crest cells contribution to craniofacial bone development and regeneration. Curr Osteoporos Rep. 21 (5), 624-630 (2023).
- Zalc, A., et al. Reactivation of the pluripotency program precedes formation of the cranial neural crest. Science. 371 (6529), eabb4776 (2021).
- Perera, S. N., Kerosuo, L. On the road again: Establishment and maintenance of stemness in the neural crest from embryo to adulthood. Stem Cells. 39 (1), 7-25 (2021).
- Nguyen, B. H., Ishii, M., Maxson, R. E., Wang, J. Culturing and manipulation of O9-1 neural crest cells. J Vis Exp. (140), e58346 (2018).
- Ishii, M., Arias, A. C., Liu, L., Chen, Y. B., Bronner, M. E., Maxson, R. E. A stable cranial neural crest cell line from mouse. Stem Cells Dev. 21 (17), 3069-3080 (2012).
- Rada-Iglesias, A., Bajpai, R., Prescott, S., Brugmann, S. A., Swigut, T., Wysocka, J. Epigenomic annotation of enhancers predicts transcriptional regulators of human neural crest. Cell Stem Cell. 11 (5), 633-648 (2012).
- Cederquist, G. Y., et al. Specification of positional identity in forebrain organoids. Nat Biotechnol. 37 (4), 436-444 (2011).
- Rada-Iglesias, A., Bajpai, R., Swigut, T., Brugmann, S. A., Flynn, R. A., Wysocka, J. A unique chromatin signature uncovers early developmental enhancers in humans. Nature. 470 (7333), 279-283 (2011).
- Prescott, S. L., et al. Enhancer divergence and cis-regulatory evolution in the human and chimp neural crest. Cell. 163 (1), 68-83 (2015).
- Chaddah, R., Arntfield, M., Runciman, S., Clarke, L., van der Kooy, D. Clonal neural stem cells from human embryonic stem cell colonies. J Neurosci. 32 (23), 7771-7781 (2012).
- Bajpai, R., et al. CHD7 cooperates with PBAF to control multipotent neural crest formation. Nature. 463 (7283), 958-962 (2010).
- Sipahi, R., Zupanc, G. K. Stochastic cellular automata model of neurosphere growth: Roles of proliferative potential, contact inhibition, cell death, and phagocytosis. J Theor Biol. 445, 151-165 (2018).
- Mori, H., et al. Effect of neurosphere size on the growth rate of human neural stem/progenitor cells. J Neurosci Res. 84 (8), 1682-1691 (2006).
- Kress, C., Vandormael-Pournin, S., Baldacci, P., Cohen-Tannoudji, M., Babinet, C. Nonpermissiveness for mouse embryonic stem (ES) cell derivation circumvented by a single backcross to 129/Sv strain: establishment of ES cell lines bearing the Omd conditional lethal mutation. Mamm Genome. 9 (12), 998-1001 (1998).
- Simões-Costa, M., Bronner, M. E. Establishing neural crest identity: a gene regulatory recipe. Development. 142 (2), 242-257 (2015).
- Memberg, S. P., Hall, A. K. Dividing neuron precursors express neuron-specific tubulin. J Neurobiol. 27 (1), 26-43 (1995).
- Kim, C. N., Shin, D., Wang, A., Nowakowski, T. J. Spatiotemporal molecular dynamics of the developing human thalamus. Science. 382, eadf9941 (2023).
- Grimaldi, A., Comai, G., Mella, S., Tajbakhsh, S. Identification of bipotent progenitors that give rise to myogenic and connective tissues in mouse. ELife. 11, e70235 (2022).
- To, K., et al. A multiomic atlas of human early skeletal development. Nature. 635 (8039), 657-667 (2024).
- Bajpai, R., et al. Molecular stages of rapid and uniform neuralization of human embryonic stem cells. Cell Death Differ. 16 (6), 807-825 (2009).
- Kerosuo, L., Nie, S., Bajpai, R., Bronner, M. E. Crestospheres, Long-term maintenance of multipotent, premigratory neural crest stem cells. Stem Cell Reports. 5 (4), 499-507 (2015).
- Abe, S., Yamaguchi, S., Sato, Y., Harada, K. Sphere-derived multipotent progenitor cells obtained from human oral mucosa are enriched in neural crest cells. Stem Cells Transl Med. 5 (1), 117-128 (2016).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol Neurobiol. 34 (3), 153-161 (2006).
- Ziegler, L., Grigoryan, S., Yang, I. H., Thakor, N. V., Goldstein, R. S. Efficient generation of Schwann cells from human embryonic stem cell-derived neurospheres. Stem Cell Rev Rep. 7 (2), 394-403 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır