Method Article
Kantitatif Polimeraz Zincir Reaksiyonu (qPCR) Bazlı Helicobacter pylori Enfeksiyonu ve Antibiyotik Direncinin Hızlı Tanısı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Protokol, Helicobacter pylori mide enfeksiyonlarının ip testi ile hızlı teşhisi için noninvaziv bir yöntem sunar ve klaritromisin ve levofloksasine karşı antibiyotik direncini kantitatif polimeraz zincir reaksiyonu (qPCR) kullanarak belirler.
Özet
Helicobacter pylori, küresel nüfusun yaklaşık yarısını enfekte eden ve artan antibiyotik direnci nedeniyle ciddi bir sağlık tehdidi haline gelen önemli bir insan patojenidir. Kronik aktif gastrit, peptik ülser hastalığı ve mide kanserinin etken maddesidir ve Uluslararası Kanser Araştırmaları Ajansı tarafından Grup I Kanserojen olarak sınıflandırılmıştır. Bu nedenle, H. pylori'nin hızlı ve doğru tanısı ve antibiyotik direncinin belirlenmesi, bu bakteriyel patojenin etkin bir şekilde yok edilmesi için önemlidir. Günümüzde, H. pylori tanı yöntemleri temel olarak üre nefes testi (UBT), antijen testi, serum antikor testi, gastroskopi, hızlı üreaz testi (RUT) ve bakteri kültürünü içerir. Bunlar arasında, ilk üç tespit yöntemi invaziv değildir, yani yapılması kolay testlerdir. Bununla birlikte, bakteriler bu tekniklerle elde edilemez; Bu nedenle ilaç direnci testi yapılamaz. Son üçü invaziv muayenelerdir, ancak maliyetlidirler, yüksek beceri gerektirirler ve hastalara zarar verme potansiyeline sahiptirler. Bu nedenle, H. pylori tespiti ve ilaç direnci testi için noninvaziv, hızlı ve eşzamanlı bir yöntem, klinik pratikte H. pylori'nin etkin bir şekilde ortadan kaldırılması için çok önemlidir. Bu protokol, H. pylori enfeksiyonunun ve antibiyotik direncinin hızlı tespiti için kantitatif polimeraz zincir reaksiyonu (qPCR) ile kombinasyon halinde sicim testini içeren spesifik bir prosedür sunmayı amaçlamaktadır. Bakteriyel kültürlerin aksine, bu yöntem H. pylori enfeksiyon durumunun ve ilaç direncinin kolay, hızlı, invaziv olmayan teşhisine izin verir. Spesifik olarak, sırasıyla klaritromisin ve levofloksasine karşı direnci kodlayan 23S rRNA ve gyrA genlerindeki H. pylori enfeksiyonu ve mutasyonları için rea'yı tespit etmek için qPCR'yi kullandık. Rutin olarak kullanılan kültürleme teknikleriyle karşılaştırıldığında, bu protokol H. pylori enfeksiyonunu tespit etmek ve qPCR kullanarak antibiyotik direncini belirlemek için invaziv olmayan, düşük maliyetli ve zaman kazandıran bir teknik sağlar.
Giriş
H. pylori, esas olarak midenin pilor bölgesinde yaşayan spiral şekilli, oldukça hareketli, gram-negatif bir bakteridir1. Küresel nüfusun yaklaşık% 50'sini enfekte eden yaygın bir patojendir2. H. pylori enfeksiyonu olan çoğu insanın klinik belirtileri yoktur ve çoğu kronik gastrit, peptik ülser, mide ülseri ve mide kanseri dahil olmak üzere birkaç yıllık enfeksiyondan sonra farklı hastalıklar geliştirir3. Farklı popülasyonlara dayanan çeşitli çalışmalarda, mide kanseri ve prekanseröz lezyonları önlemede H. pylori'yi elimine etmenin etkinliği gösterilmiştir 4,5. Bu nedenle, Dünya Sağlık Örgütü (WHO) Uluslararası Kanser Araştırmaları Ajansı, önleyici bir önlem olarak H. pylori eradikasyonunu tavsiye etmiştir6.
H. pylori enfeksiyonunu tanımlamak için noninvaziv yöntemlerin kullanılması, asemptomatik dispepsisi olan çoğu birey için tedavinin önemli bir bileşenidir. Üre nefes testi (UBT), H. pylori fekal antijen testi (SAT) ve serolojik testler popüler noninvaziv tekniklerdir. Bunlar arasında, UBT mevcut en az müdahaleci ve en doğru prosedürdür. UBT, izotopik olarak etiketlenmiş üreyi amonyak ve karbondioksite (13C veya 14C) hidrolize etmek için H. pylori'de bol miktarda bulunan üreaz kullanır. Buna karşılık, immünokromatografik tahlil (ICA)7 örnekleme için uygun, basit ve noninvazivdir. Bununla birlikte, testin doğruluğu, dışkı numunesinin kalitesi, sıcaklık ve numune toplama ile test arasındaki aralık gibi çeşitli faktörlerden etkilenir. İmmün cevaba dayanan bir başka test, hastanın serumundaki antikorları tespit eden serum H. pylori antikor testidir. Bununla birlikte, bu test tedavi sonrası analiz için uygun değildir, çünkü antikorlar bakteriler temizlendikten sonra uzun süre kalır8. Bir diğer önemli dezavantaj, bu yöntemlerin sadece H. pylori enfeksiyonunu teşhis etmesi ve duyarlılığa dayalı tedaviyi yönlendirmek için ilaç direnci testine izin vermemesidir.
İnvaziv test yöntemleri için, mide biyopsi dokusunun endoskopi ile alınması ve daha sonra histolojiye, üreaz hızlı testine ve bakteri kültürüne tabi tutulması gerekir. Bu test yöntemleri de çeşitli faktörler nedeniyle çok sınırlıdır. Günümüzde bu teknikler yaşlı hastalar, prekanseröz veya malign hastalık için yüksek risk altındaki hastalar ve gastroözofageal reflü hastalığı veya H. pylori enfeksiyonu9 için birinci basamak tedavide başarısız olan hastalar ile sınırlıdır. İkincisi, H. pylori'nin benzersiz büyüme özellikleri nedeniyle, bakteri kültürünün başarı oranı sadece% 50'ye ulaşır10. Bu nedenle, moleküler tespit yöntemleri, invaziv tespit yöntemlerinin yüksek taleplerinin üstesinden gelmek ve duyarlılığa dayalı tedaviye rehberlik etmek için yeni umutlar sunmaktadır. Moleküler tespit yöntemleri arasında, kantitatif PCR son yıllarda muazzam bir şekilde gelişmiştir. qPCR, geleneksel PCR'den farklı olarak, jel elektroforezi gerektirmez ve tavlama aşamasında primerler ve problar ekleyerek numunelerdeki DNA / RNA'yı doğru bir şekilde ölçer. H. pylori enfeksiyonunun ve ilaç direncinin tespiti için qPCR kitleri artık ticari olarak temin edilebilir. Bununla birlikte, her yöntemin kendi sınırlamaları vardır; Bu nedenle, bir hastanın klinik tanı ve tedavisi, semptomları, bulguları, öyküsü, diğer laboratuvar testleri ve tedaviye yanıtı ile birlikte düşünülmelidir.
Şu anda, H.pylori enfeksiyonlarını tedavi etmenin birincil yöntemi antibiyotik almaktır, ancak son zamanlarda, antibiyotik direncindeki artış nedeniyle bu enfeksiyonları tedavi etmek giderek zorlaşmaktadır. Daha sonra, H. pylori tedavisinin etkinliğinde küresel olarak önemli bir düşüş gözlenmiştir ve bu da H. pylori eradikasyonunu önemli bir halk sağlığı sorunu haline getirmiştir11.
Klaritromisin ve levofloksasin, H.pylori'nin neden olduğu enfeksiyonları tedavi etmek için kullanılan iki geniş spektrumlu antibiyotiktir, ancak birkaç çalışma H.pylori izolatlarında bu iki ilaca karşı yaygın direnç bildirmiştir. A2143G, A2142G ve A2142C, makrolidin bağlanmasını önleyerek klaritromisin direnci ile sonuçlanan 2.9 kb 23S rRNA geninde bulunan çok sayıda nokta mutasyonundan üçüdür. Aynı zamanda, levofloksasin direnç geninin mutasyon lokusları esas olarak gyrA geni12'nin altı mutasyon bölgesinde (A260T, C261A, T261G, G271A, G271T, A272G) bulunur. Genetik mutasyonlara dayanan bu direnç mekanizmalarının keşfi, kültürel temelli çalışmalarla H. pylori'nin tespitinde moleküler testlere kademeli bir kaymaya yol açmıştır.
Genel olarak, H. pylori enfeksiyonlarının ve ilaç direncinin saptanması için noninvaziv, etkili ve eşzamanlı bir tanı yöntemine acil bir klinik ihtiyaç vardır. Örneklemenin zorluklarının üstesinden gelmek ve farklı primer problar kullanarak H. pylori enfeksiyonunun ve ilaç direncinin eşzamanlı tespiti hedefine ulaşmak için kombine bir sicim testi ve qPCR yöntemini benimsedik.
Protokol
Bu çalışma, Guangdong İl Halk Hastanesi, Güney Tıp Üniversitesi, Guangzhou, Çin etik komitesi tarafından oluşturulan etik hususlara uygun olarak yürütülmüştür (Onay Numarası: KY-Q-2022-384-02). 18-60 yaş aralığındaki hastalar bu çalışmaya dahil edildi. Testten önceki 2 hafta içinde antibiyotikler, antibakteriyel Çin ilaçları, proton pompa inhibitörleri (PPI) veyaH2 reseptör antagonistleri gibi ilaçlar vb. Alan hastalar bu çalışmaya dahil edilmemiştir. Son 3 ay içinde H.pylori'ye karşı tedavi gören hastalar da bu çalışmanın dışında bırakıldı. Ciddi kalp, karaciğer, böbrek problemleri, ciddi nöropati veya akıl hastalığı olanların da bu çalışmaya katılmasına izin verilmedi. Bu çalışmaya dahil edilen gebe kadın ve emziren anne yoktu. Bu çalışmada kullanılan malzemelerin (reaktifler, kimyasallar, ekipman ve yazılımlar) detayları Malzeme Tablosunda verilmiştir.
1. Gastrik sıvı örneklemesi için sicim testi
- Hastadan numune toplamadan önce gece boyunca oruç tutmasını isteyin.
- Ertesi gün, dize test kitini açın, kapsülü alın ve döngüyü dizenin sonunda tutun.
- İpi hastanın yanağına bantlayın ve kapsülü boğazın arkasına yakın bir yerde dillerine yerleştirmelerini ve bir yudum su ile yutmalarını isteyin.
- Kapsülün hastanın midesinde çözünmesine izin verin, böylece mide mukusunu emmek için kapsül içindeki ipi açığa çıkarın.
- Eğitimli bir asistandan, hasta kapsülü yuttuktan 1 saat sonra ipi dikkatlice çekmesini isteyin.
- Mide sıvısına batırılmış ipin alt ucunu (40 cm) kesin, TSE (Tris/salin/EDTA) numune koruma solüsyonuna yerleştirin ve daha sonra H. pylori'nin tespiti ve qPCR kullanılarak antibiyotik direnç profillerinin belirlenmesi için oda sıcaklığında (RT) klinik laboratuvara gönderin.
2. DNA ekstraksiyonu
- Numune taşıyan toplama tüplerini, uygun şekilde etiketlenmiş bir test tüpü rafına yerleştirin ve 10 saniye boyunca vorteks yapın.
- Manyetik boncukları yeniden askıya almak için 32 delikli plakayı (nükleik asit ekstraksiyonu veya saflaştırma kiti) birkaç kez baş aşağı çevirin. 10 s boyunca kısa bir vorteksten sonra, alüminyum folyo sızdırmazlığını plakadan dikkatlice çıkarın.
- Her bir numuneden 200 μL mide sıvısı ve H. pylori DNA'sını pozitif bir kontrol olarak ayrı kuyucuklara aktarın.
- Otomatik DNA ekstraksiyonu için 32 delikli plakayı nükleik asit ekstraksiyon makinesinin ilgili numune yuvasına yerleştirin.
- DNA ekstraksiyonu ve doğrulanmasından sonra, pozitif örnekler üzerinde qPCR yoluyla klaritromisin ve levofloksasin için antibiyotik direnç testini başlatın.
- Aşırı mide sıvısını ve ekstrakte edilmiş DNA örneklerini uzun süreli depolama ve gelecekteki kullanım için -20 ° C'ye yerleştirin.
- Herhangi bir kontaminasyonu önlemek için tüm bu adımları bir biyogüvenlik kabininde gerçekleştirin.
3. H. pylori ve antibiyotiklere direnç (klaritromisin ve levofloksasin) tespiti için qPCR
- H. pylori ve genomundaki şüpheli antibiyotik direnci mutasyonlarının tespiti için qPCR uygulayın.
- qPCR reaksiyon karışımını (H. pylori nükleik asit algılama kiti) buz üzerinde çözün ve herhangi bir reaktif kaybını önlemek için hafifçe vurarak ve döndürerek karıştırın.
- 32 delikli bir plaka üzerindeki her numune için, 20 μL PCR reaksiyon karışımını (genotipleme reaksiyonu ön karışımı [Taq enzimi, deoksiribonükleozid trifosfat, reaksiyon tamponu ve magnezyum klorür içeren], ürA ileri ve geri primerler ve bir üre probu ile) ve ekstrakte edilen DNA'nın 5 μL'sini karıştırın.
- 32 delikli qPCR plakasını qPCR makinesinde çalıştırın. Termal döngüleyiciyi programlayın: reaksiyon karışımı ilk önce her biri 2 dakika boyunca 42 ° C ve 95 ° C'de (her ikisi de bir döngü için) sırayla reaksiyona sokulacaktır; daha sonra, 95 ° C'de 40 döngü, 10 s için denatürasyon ve 45 s için 58 ° C'de tavlama ve uzatma.
- Floresan sinyal alımını FAM (H. pylori) olarak ve veri alımını amplifikasyon uzatma periyoduna ayarlayın. Reaksiyon tamamlandıktan sonra, verileri gelecekteki sonuç analizi için kaydedin.
- Cihaz otomatik olarak taban çizgisi eşiklerini seçeceğinden, qPCR için belirli bir yazılım kullanarak verileri analiz edin.
- H. pylori için test sonucu pozitifse, makine numune üzerinde ilaç direnci testini otomatik olarak başlatacaktır. Reaktif kitini, H. Pylori (qPCR) kitindeki 23S rRNA geni ve gyrA gen mutasyonları için algılama reaktifleri ile değiştirin.
NOT: Reaktif kiti (Helicobacter pylori [qPCR]'deki 23S rRNA geni ve gyrA gen mutasyonları için tespit reaktifleri) PCR reaksiyon karışımını (genotipleme reaksiyonu ön karışımı [Taq enzimi, deoksiribonükleozid trifosfat, reaksiyon tamponu, magnezyum klorür], primerler ve problar içeren) içerir. Tüm negatif kalite kontrol ürünleri steril, arıtılmış sudur. H. pylori nükleik asit algılama kitindeki pozitif kalite kontrol ürünü, inaktive edilmiş H. pylori standart boncuklarıdır (ATCC 43504). Kitteki güçlü H. pylori-pozitif ve zayıf pozitif kalite kontrol ürünleri (23S rRNA geni için tespit reaktifleri ve H. pylori'deki gyrA gen mutasyonları), hedef geni ve mutant geni içeren inaktive edilmiş H. pylori suşunun DNA'sıdır. Benzer şekilde, gerçek duruma dayanarak, H. pylori enfeksiyonu veya ilaç direncinin varlığı da dahil olmak üzere tüm tanı standartları CT ≤ 35'e ayarlanır ve tipik bir S şeklinde eğriye sahiptir. Zayıf kalite kontrolünün konsantrasyonu 1.0 x 103 kopya / mL, güçlü kalite kontrolünün konsantrasyonu ise 1.0 x 108 kopya / mL'dir.
Sonuçlar
Mide sıvısında H. pylori enfeksiyonu ve antibiyotik direncinin qPCR ile saptanması
UreA genini yükselterek H. pylori enfeksiyonunun saptanması için qPCR uyguladık ve 23S rRNA geni ve gyrA genindeki nokta mutasyonlarını hedefleyerek antibiyotik direnç profilini belirledik (Tablo 1). qPCR deneylerinin her üç grubundaki kalite kontrol BT değerleri önerilen aralıktaydı, bu da numunelerin hepsinin deney sırasında normal bir durumda olduğunu ve test sonuçlarının güvenilir olduğunu gösteriyordu. Bu çalışmada, deneysel protokolün güvenilirliğini karakterize etmek için farklı test sonuçlarına (S1-S5) sahip beş örnek seçilmiştir. S1, enfeksiyonsuz H. pylori'nin temsili bir suşunu temsil ederken, S2-S5 örnekleri farklı direnç sonuçlarına sahip H. pylori ile enfekte olanlardır (Şekil 1). Sistemi, H. pylori ile enfekte olmayan numunelerle daha fazla direnç testi yapmayacak şekilde ayarladık, bu nedenle sistem testi H. pylori için negatif bir sonuç gösterdikten sonra S1 numunesi direnç testine girmedi. H. pylori enfeksiyonu için pozitif olan örnekler açısından, S2 BT değerlerinin tümü tespit aralığındaydı, bu da numunenin H. pylori-pozitif olduğunu ve klaritromisin ve levofloksasine karşı çift direnç gösterdiğini gösterdi ve klinisyenlere kendi takdirlerine bağlı olarak tedavi için başka yöntemler seçmeleri önerildi. S3 BT değerleri, H. pylori enfeksiyonu ve levofloksasin direnç testi için tespit aralığındayken, klaritromisin direnç testinde BT değeri tespit edilmedi, bu da S3 örneğinin levofloksasine dirençli bir hastadan geldiğini gösterdi. Benzer şekilde, S4 örneğinin BT değeri H. pylori enfeksiyonu ve klaritromisin direnci için tespit aralığındayken, levofloksasin direnci için BT değeri saptanmamıştır, bu da bu hastanın klaritromisin'e dirençli olduğunu göstermektedir ve tedavi için levofloksasin almaları önerilmiştir. Son olarak, S5 örnek testi, sadece H. pylori enfeksiyonunun tespiti için tespit aralığında BT değerlerini gösterdi, bu da bu hastanın her iki antibiyotiğe de duyarlı olduğunu ve iki ilaçtan biri kullanılarak tedavi edilebileceğini gösterdi. H. pylori enfeksiyonunu ve ilaç direncini de tespit eden bakteriyel kültür yöntemine kıyasla, bu yöntem hastaya zarar vermeden H. pylori enfeksiyonu ve ilaç direncinin saptanmasında güvenli ve etkilidir ve uygun bir tedavi planı oluşturmada doktora rehberlik etmek için kullanılabilir.
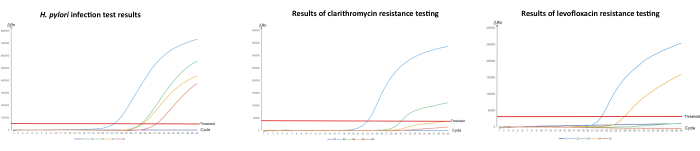
Şekil 1: Mide sıvısında H. pylori ve antibiyotik direncinin qPCR ile saptanması.
(A) H. pylori enfeksiyonunun kantitatif PCR amplifikasyonu, (B) klaritromisin direncinin tespiti ve (C) levofloksasin direncinin tespiti. "S" örnek anlamına gelir. "S1", H. pylori enfeksiyonu için negatif geri dönen ve ayrıca antibiyotik direnci için test edilen bir örnektir; "S2", hem klaritromisin hem de levofloksasine dirençli H. pylori ile enfekte olmuş bir numunedir; "S3" aynı zamanda H. pylori pozitif bir örnektir, ancak klaritromisin duyarlı ve levofloksasin dirençlidir; "S4" aynı zamanda H. pylori pozitif bir örnektir, ancak klaritromisin dirençli ve levofloksasine duyarlıdır; "S5", H. pylori pozitif bir numunedir, ancak hem klaritromisin hem de levofloksasine karşı hassastır. Zayıf kalite kontrolünün konsantrasyonu 1.0 x 103 kopya / mL, güçlü kalite kontrolünün konsantrasyonu ise 1.0 x 108 kopya / mL'dir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Örnek | H. pilori | Klaritromisin | Levofloksasin | |||
| +/- | CT | +/- | CT | +/- | CT | |
| S1 | - | U | - | U | - | U |
| S2 | + | 22.61 | + | 22.77 | + | 23 |
| S3 | + | 28.32 | - | U | + | 30.18 |
| S4 | + | 28.76 | + | 27.67 | - | U |
| S5 | + | 31.59 | - | U | - | U |
Tablo 1: H. pylori enfeksiyonu saptanmasının qPCR sonuçlarını ve klaritromisin ve levofloksasine direnci gösteren tablo. Bu tabloda, H. pylori enfeksiyonu için kalitatif sonuçlar, izolatın klaritromisin'e dirençli olduğunu gösteren 23S rRNA gen mutasyonlarının saptanması ve izolatın levofloksasine dirençli olduğunu gösteren gyrA gen mutasyonlarının saptanması sunulmaktadır. +/−, nitel sonuç; +, olumlu sonuç; −, olumsuz sonuç.
Tartışmalar
H. pylori tespiti hem invaziv hem de noninvaziv yöntemler kullanılarak yapılabilir13. Histopatoloji, hızlı üreaz testi, polimeraz zincir reaksiyonu (PCR) ve bakteriyel kültürleme gibi yaygın olarak kullanılan invaziv teknikler endoskopi ve biyopsi gerektirir. Serolojik testler, üre nefes testleri ve enzime bağlı immünosorbent testleri (ELISA) noninvaziv prosedürler arasında önerilmektedir14. Noninvaziv yöntemlerin uygulanması kolay, ekonomik ve hastalar için daha konforlu olsa da, H. pylori'nin suş tanımlama ve antibiyotik duyarlılık testi gibi ek testler yapmak için izolasyonu ve kültürlenmesi invaziv testler gerektirir. Antibiyotik direncindeki mevcut artışla birlikte, daha önce kullanılan antibiyotikler etkisiz hale gelmekte ve bu nedenle ilaca dirençli H. pylori izolatlarının neden olduğu enfeksiyonu tedavi edememektedir. Bu durumda, dirençli bakterileri büyük olasılıkla başarılı bir şekilde ortadan kaldıracak antibiyotikleri seçmek için antibiyotik duyarlılık testi yapmak için H. pylori'nin alınması gerekebilir.
Agar seyreltme yöntemi ve Epsilometre testi (E-test) gibi rutin olarak yürütülen kültür temelli duyarlılık testlerinin birkaç sınırlaması vardır: H. pylori yavaş büyüyen, maliyetli, beceri tabanlı ve invaziv teknikler gerektiren bir bakteri olduğundan zaman alıcıdır. Floresan in situ hibridizasyon (FISH) teknikleri ve qPCR gibi alternatif olarak farklı moleküler bazlı teknikler, klaritromisin15,16'ya karşı direnci kodlayan 23S rRNA geninde olduğu gibi çeşitli mutasyonları tanımlamak için kullanılabilir. H. pylori'nin 23S rRNA direnç geninin üç noktalı mutasyon bölgeleri (A2142G, A2143G, A2142C) ve kinolon antibiyotiklerinin gyrA direnç geninin altı noktalı mutasyon bölgeleri (A260T, C261A, T261G, G271A, G271T, A272G), sırasıyla klaritromisin ve levofloksasine karşı direnci belirlemek için primerler ve problar tasarlamak için seçildi.
ENTEO-TEST'ten kaynaklanan ip testi, mide salgılarını toplamak için yutulan oldukça emici bir naylon ipe bağlı bir kapsül kullanır17. Günümüzde sicim testleri tüberküloz18'i teşhis etmek, yüksek derecede virülan Klebsiella pneumoniae'yi (hvKp) geleneksel Klebsiella pneumoniae19'dan ayırt etmek, Gram-pozitif ve Gram-negatif bakteri ve mayayı tanımlamak ve H. pylori'yi mide sıvısı20'den teşhis etmek için kullanılmaktadır. Bu çalışmada, minimal invaziv bir teknik olan sicim testini klinik bir yapıda H. Pylori enfeksiyonlarının tanımlanması için qPCR ile birleştirdik ve H. pylori genomunda daha önce bildirilen direnç kodlayan mutasyonları hedefleyerek duyarlılık testi gerçekleştirdik. UreA genini seçtik çünkü diğer organizmalarla çapraz reaksiyon riski olmayan H. pylori'ye özgü bir temizlik genidir. Tüm H. pylori izolatları, insan midesinde hayatta kalmak için üreA genine sahip olmalıdır ve nakavt deneyleri, üre geni olmayan H. pylori'nin midede kolonize olma yeteneğine sahip olmadığını göstermiştir.
qPCR için kalite kontrol standartları son derece önemlidir. H. pylori'nin qPCR tespitinde, kalite kontrol standartlarının gereklilikleri aşağıdaki gibidir: negatif bir kalite kontrol ürünü (FAM algılama yolunda floresan sinyalinde artış yok, tipik S-tipi amplifikasyon eğrisi yok, BT değeri 35.00 > veya belirgin sinyal yok); pozitif bir kalite kontrol ürünü (S şeklinde bir eğri gösteren FAM tespit yolunun floresan sinyali büyüme eğrisi, BT değeri ≤ 35.00) ve yukarıdaki gereksinimler aynı anda karşılanmalıdır; aksi takdirde, test geçersiz sayılır ve tekrar yapılması gerekir. Ayrıca, antibiyotiklere (klaritromisin ve levofloksasin) karşı H. pylori direncinin qPCR tespiti için, pozitif ve negatif sonuçları birbirinden ayıran ve direnç tespiti için 30.00'a değişen BT değeri hariç, diğer gereksinimler yukarıdakiyle aynıdır. Özellikle, astarlar ve problar hakkındaki dizi bilgileri, ticari mülkiyet haklarını içerdiği için bu makalede mevcut değildir.
Her hasta için daha etkili antibiyotikler seçmek amacıyla, küresel olarak artan antimikrobiyal direnç ve ayrıca çeşitli coğrafi alanlar arasındaki direnç modellerindeki farklılıklar nedeniyle H. pylori'nin lokal prevalansını ve antibiyotik direnç profilini araştırmak çok önemlidir. Çalışmamızın en büyük sınırlaması, örneklem büyüklüğünün çok küçük olması ve H. pylori enfeksiyonunun prevalansını ve tam antibiyotik direnç profilini göstermek için Çin'deki farklı coğrafi bölgeleri kapsamamasıdır, ancak sicim testi tekniği iyi gelişmiştir ve qPCR ile birleştirerek, eşzamanlı olarak H. pylori tanısı elde ettik enfeksiyon ve ilaç direnci tespiti. Bu sonuçlar, bu yaklaşımın dünyanın farklı bölgelerinde daha büyük ölçekte kullanılabileceğini göstermektedir.
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma Shenzhen'deki Sanming Tıp Projesi tarafından desteklenmiştir (Hibe No. SZSM201510050) ve Guangdong Temel ve Uygulamalı Temel Araştırma Vakfı (Hibe No. 2022A1515220023). Guandong İl Halk Hastanesi İleri Yetenekler Araştırma Vakfı (No. KJ012021097) ve Çin Ulusal Doğa Bilimleri Vakfı (81871734, 82072380, 82272423). Fon sağlayıcıların çalışmanın tasarımında, veri toplama ve analizinde, yayınlama kararında veya makalenin hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 23S rRNA and gyrA gene point mutations detection kit (PCR-Fluorescence Probing) | Hongmed Infagen | Detection of Helicobacter pylori resistance to clarithromycin and levofloxacin | |
| ABI 7500 fluorescence quantitative PCR machine | Thermo Fisher Scientific | SEDA 20163220767 | Fluorescent quantitative PCR amplification |
| ABI 7500 software | Thermo Fisher Scientific | Data Analysis | |
| BSC-1500IIA2-X | BIOBASE | SEDA 20143222263 | Biosafety cabinet |
| DNA extraction kit | Daan Gene | ||
| E-Centrifuge | WEALTEC | Centrifuge the residual liquid off the wall of the tube. | |
| H. Pylori DNA detection kit (PCR-Fluorescence Probing) | Hongmed Infagen | Testing for H. pylori infection | |
| Stream SP96 automated nucleic acid extractor | Daan Gene | SEDA 20140104 | For DNA extraction |
| String test kit | Hongmed Infagen | It contains a capsule attached to a string, scissors, cotton swab, and sample preservation tube | |
| Ultra-low temperature freezers (DW-YL450) | MELING | SEDA 20172220091 | -20 °C for storing reagents |
| Vortex-5 | Kylin-bell | For mixing reagent |
Referanslar
- Proença-Modena, J. L., Acrani, G. O., Brocchi, M. Helicobacter pylori: Phenotypes, genotypes and virulence genes. Future Microbiology. 4 (2), 223-240 (2009).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Association between alcohol consumption, cigarette smoking, and Helicobacter pylori infection in Iraqi patients submitted to gastrointestinal endoscopy. Journal of Emergency Medicine, Trauma and Acute Care. 2022 (6), 12(2022).
- Reshetnyak, V. I., Burmistrov, A. I., Maev, I. V. Helicobacter pylori: Commensal, symbiont or pathogen. World Journal of Gastroenterology. 27 (7), 545-560 (2021).
- Thrift, A. P., Wenker, T. N., El-Serag, H. B. Global burden of gastric cancer: Epidemiological trends, risk factors, screening and prevention. Nature Reviews Clinical Oncology. 20 (5), 338-349 (2023).
- Liou, J. M., et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: The Taipei global consensus. Gut. 69 (12), 2093-2112 (2020).
- IARC Helicobacter pylori Working Group. Helicobacter Pylori Eradication as A Strategy for Preventing Gastric Cancer. , International Agency for Research on Cancer. Lyon, France. (2014).
- Vaira, D., et al. The stool antigen test for detection of Helicobacter pylori after eradication therapy. Annals of Internal Medicine. 136 (4), 280-287 (2002).
- Laheij, R. J. F., Straatman, H., Jansen, J. B. M. J., Verbeek, A. L. M. Evaluation of commercially available Helicobacter pylori serology kits: A review. Journal of Clinical Microbiology. 36 (10), 2803-2809 (1998).
- Malfertheiner, P., et al. Management of Helicobacter pylori infection - The Maastricht IV/ Florence consensus report. Gut. 61 (5), 646-664 (2012).
- Peng, X., et al. Gastric juice-based real-time PCR for tailored Helicobacter Pylori treatment: A practical approach. International Journal of Medical Sciences. 14 (6), 595-601 (2017).
- Thung, I., et al. Review article: The global emergence of Helicobacter pylori antibiotic resistance. Alimentary Pharmacology and Therapeutics. 43 (4), 514-533 (2016).
- Zhang, Y., et al. Mutations in the antibiotic target genes related to clarithromycin, metronidazole and levofloxacin resistance in Helicobacter pylori strains from children in China. Infection and Drug Resistance. 13, 311-322 (2020).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and noninvasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PLoS One. 16 (8), e0256393(2021).
- Chen, Q., et al. Advanced sensing strategies based on different types of biomarkers toward early diagnosis of H. pylori. Critical Reviews in Analytical Chemistry. , (2023).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of clarithromycin resistance and 23SrRNA point mutations in clinical isolates of Helicobacter pylori isolates: Phenotypic and molecular methods. Saudi Journal of Biological Sciences. 29 (1), 513-520 (2022).
- Xuan, S. H., Wu, L. P., Zhou, Y. G., Xiao, M. B. Detection of clarithromycin-resistant Helicobacter pylori in clinical specimens by molecular methods: A review. Journal of Global Antimicrobial Resistance. 4, 35-41 (2016).
- Perez-Trallero, E., Montes, M., Alcorta, M., Zubillaga, P., Telleria, E. Non-endoscopic method to obtain Helicobacter pylori for culture. Lancet. 345 (8950), 622-623 (1995).
- DiNardo, A. R., et al. Use of string test and stool specimens to diagnose pulmonary tuberculosis. International Journal of Infectious Diseases. 41, 50-52 (2015).
- Li, G., et al. Identification of hypervirulent Klebsiella pneumoniae isolates using the string test in combination with Galleria mellonella infectivity. European Journal of Clinical Microbiology and Infectious Diseases. 39 (9), 1673-1679 (2020).
- Agbonlahor, D. E., Odugbemi, T. O., Udofia, P. O. Differentiation of gram-positive and gram-negative bacteria and yeasts using a modification of the "string" test. The American Journal of Medical Technology. 49 (3), 177-178 (1983).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır