Method Article
Sağlam Kardiyak Trabeküller Kullanılarak Gevşemenin Mekanik Kontrolü
Bu Makalede
Özet
Hızlı miyokard ve kardiyak gevşeme normal fizyoloji için gereklidir. Mekanik gevşeme mekanizmalarının artık gerinim oranına bağlı olduğu bilinmektedir. Bu protokol, gevşemenin mekanik kontrolünü daha fazla incelemek için deneylerin edinilmesi ve analizine genel bir bakış sağlar.
Özet
Diyastolik disfonksiyon, kardiyovasküler hastalık sunumlarında sık görülen bir fenotiptir. Artmış kardiyak sertliğe (artmış sol ventrikül diyastolik sonu basıncı) ek olarak, bozulmuş kardiyak gevşeme diyastolik disfonksiyonun önemli bir tanısal göstergesidir. Gevşeme, sitozolik kalsiyumun uzaklaştırılmasını ve sarkomerik ince filamentlerin deaktivasyonunu gerektirirken, bu tür mekanizmaları hedeflemek henüz etkili tedaviler sağlamamıştır. Kan basıncı (yani, son yük) gibi mekanik mekanizmalar, gevşemeyi değiştirmek için teorize edilmiştir. Son zamanlarda, bir gerilmenin gerilme hızını değiştirmenin, son yükün değil, miyokard dokusunun sonraki gevşeme hızını değiştirmek için hem gerekli hem de yeterli olduğunu gösterdik. Gevşemenin mekanik kontrolü (MCR) olarak adlandırılan gevşemenin gerilme hızı bağımlılığı, sağlam kardiyak trabeküller kullanılarak değerlendirilebilir. Bu protokol, küçük bir hayvan modelinin hazırlanmasını, deneysel sistem ve odayı, kalbin izolasyonunu ve ardından bir trabekülün izolasyonunu, deney odasının hazırlanmasını, deney ve analiz protokollerini açıklamaktadır. Sağlam kalpteki suşların uzamasına ilişkin kanıtlar, MCR'nin farmakolojik tedavilerin daha iyi karakterizasyonu için yeni arenalar sağlayabileceğini ve sağlam kaslardaki miyofilament kinetiğinin değerlendirilmesi için bir yöntem sağlayabileceğini düşündürmektedir. Bu nedenle, MCR'yi incelemek, kalp yetmezliğinin tedavisinde yeni yaklaşımlara ve yeni sınırlara giden bir yolu aydınlatabilir.
Giriş
Kardiyak gevşeme, kalp yetmezliğinin hemen hemen tüm formlarında (ejeksiyon fraksiyonu azalmış kalp yetmezliği dahil) ve birçok kardiyovasküler hastalıkta bozulur. Permeabilize kaslarda kardiyak fonksiyonun değerlendirilmesi için sayısız yönteme ek olarak, sağlam kalp kaslarının değerlendirilmesi de ilgi çekmektedir. Bu tür dokular yüksüz (uçları kasılmaya serbest) veya yüklü (uzunluk veya kuvvet kontrollü) olarak değerlendirilir. Tarihsel olarak, bozulmamış izole miyositler, hücre gövdesinin kasılma sırasında kısalmakta özgür olduğu boş bir durumda değerlendirilmiştir. Sağlam kardiyak trabeküller genellikle uzunluğun değişmesine izin verilmediği, ancak stresin (kesit alanı başına kuvvet) üretildiği izometrik koşullarda değerlendirilir. Hem sağlam miyosit hem de trabekül yöntemleri, yük 1,2'nin modifikasyonları ile yakınsamaya başlamaktadır.
Bir kasın yük sıkıştırması için protokoller (yani, bir kasın gelişmiş stresini fizyolojik yükleri simüle eden belirli bir değerde kontrol etmek) birkaç on yıl boyunca geliştirilmiştir 3,4,5. Bozulmamış kalp dokularında, yük kelepçeleri, araştırmacıların izotonik veya Windkessel benzeri son yükler 6,7,8,9 kullanarak in vivo kardiyak döngüyü daha yakından taklit etmelerini sağlar. Bu protokolün amacı, MCR'yi ölçmek için kullanılan verileri elde etmektir (yani, gevşeme oranının gerinim oranı bağımlılığı)8,9.
MCR protokolü önceki çalışmalardan uyarlanmış olsa da, bu protokolün odak noktası (bozulmamış kalp dokularını kullanan benzer protokollerle karşılaştırıldığında), gevşemeyi değiştiren biyomekanik mekanizmalar üzerindedir. Yük sıkma 3,4,5,7,10 kullanan birkaç protokol ve Windkessel modelleri 1,2,11'e odaklanan protokoller vardır, ancak bu protokol özellikle gevşeme öncesi gerilmenin gevşeme oranını nasıl değiştirdiğini açıklar. Bu kontrolün, başlangıçta Wiggers12 tarafından tanımlanan bir faz olan proto-diyastolik dönem8 sırasında gerçekleştiğini gösterdik. Normal sağlıklı kalplerde, miyokard aort kapağının kapanmasından önce (yani izovolumik gevşemeden önce) ejeksiyon sırasında uzama gerginliğine maruz kalır13. Bu, kas gerilmeye başlayana kadar yük sonrası kontrol süresinin uzatılmasıyla taklit edilir. Klinik kanıtlar, bu uzamanın hastalık durumlarında zayıflayabileceğini veya kaybolabileceğini düşündürmektedir14 ve değişmiş son sistolik gerilme oranlarının etkileri ve mekanizmaları tam olarak aydınlatılamamıştır. Diyastolik hastalıklar ve kalp yetmezliği için korunmuş bir ejeksiyon fraksiyonu ile seyrek tedavi seçenekleri göz önüne alındığında, MCR'nin bozulmuş gevşemenin altında yatan yeni mekanizmalar hakkında fikir verebileceğini düşünüyoruz.
Burada tarif edilen brüt diseksiyon kemirgenlere odaklanırken, trabeküla izolasyonu herhangi bir sağlam kalpten yapılabilir ve daha önce bir insan kardiyak trabekül8 ile kullanılmıştır. Benzer şekilde, veri toplama ve analizi kardiyomiyositlere veya diğer izole kas tiplerine de uygulanabilir 1,10. Tartışma, yöntemdeki olası değişiklikler ve adaptasyonlar hakkında yorumların yanı sıra, kordae9'un mekanik özellikleri nedeniyle papiller kasların kullanılmasına karşı dikkatli olmak gibi sınırlamaları da içermektedir.
Protokol
Aşağıdaki protokol Wayne State Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Buradaki protokol, kemirgen deney konularını kullanma adımlarını açıklamaktadır, ancak diğer model organizmalarda kullanılmak üzere uyarlanabilir.
1. Hazırlık
- Deney konusunu elde edin ve laboratuvara alışmasına izin verin.
- Her birini pH 7.3 ile 10-20 ppmO2'ye oksijenlendirerek 250 mL perfüzyon çözeltisi ve 250 mL modifiye Tiroid çözeltisi (Tablo 1) hazırlayın.
- Bir kanül takılı 5 mL'lik bir şırınga hazırlayın. Şırıngayı perfüzyon çözeltisi ile doldurun. Bir fare için 23 G ve küçük veya büyük bir sıçan için sırasıyla 18 veya 16 G olan kanüller kullanın. Aortun bağlandıktan sonra kanülden kaymasını önlemeye yardımcı olmak için körelmiş bir iğnenin (Malzeme Tablosu) ucuna 1 mm uzunluğunda bir polietilen (PE) boruyu kaydırın.
- Diseksiyon ve kanülasyon alanının komple hazırlanması (Şekil 1)
- İki temiz tartım teknesini perfüzyon çözeltisi ile en az yarıya kadar doldurun. Kanülün ucunu, kanülün etrafına yerleştirilmiş en az bir çift ilmekli sütür ile perfüzyon çözeltisine batırın. Şırıngayı bir çubuk kelepçesi ile yerinde tutun.
- Kolay erişim için cerrahi makas, hemostat, iris forseps, bir çift küçük kavisli makas ve iki # 3 forseps yerleştirin.
- Modifiye Tyrode çözeltisini deneysel sistem boyunca astarlayarak ve dolaştırarak deneysel sistemi hazırlayın (Şekil 2). Odanın tamamen dolu ve sağlam olduğundan emin olun.
- Kuvvet dönüştürücü, uzunluk motoru, hız sistemi, sıcaklık kontrol sistemi ve veri toplama bilgisayarı dahil olmak üzere tüm veri toplama kutularını açın.
- Geçerli denemeye başvurmak için gerekli *.dap ve işaretçi dosyalarını içeren bir şablon klasörünü kopyalayıp yeniden adlandırın. Veri toplama yazılımını açın.
- Trabekül izolasyon aletlerini (Vannas makas, #5 veya #55 forseps, cam prob), metali proteinle kaplamak için uçlarını% 10 (w / v) sığır serum albüminine (BSA) ultra saf su veya perfüzyon çözeltisine batırarak hazırlayın (Şekil 2B).
NOT: Tüm deney sistemi diseksiyondan önce hazırlanmalıdır.
2. Brüt diseksiyon ve kanülasyon
- Hayvan deneğin kimliğini, vücut ağırlığını ve diğer ilgili bilgilerini kaydedin.
- İsteğe bağlı olarak, koroner perfüzyondan önce pıhtılaşma riskini en aza indirmek için ötenaziden en az 10 dakika önce intraperitoneal enjeksiyon yoluyla kemirgene steril salin içinde 1.000 U / kg heparin enjekte edin.
- Hayvanı bir indüksiyon odasına yerleştirin ve standart prosedüre göre% 100 oksijende buharlaştırılmış% 3 -% 5 izofluran kullanarak genel anesteziyi indükleyin.
NOT: İzofluran'a maruz kalmayı en aza indirmek için kullanılan tüm harici süpürücüleri, aşağı çekme tablalarını veya duman davlumbazlarını açın. - Kemirgen sağ refleksini kaybettiğinde ve solunum hızı yavaşladığında:
- (Bir sıçan için) hayvanı indüksiyon odasından çıkarın ve bir burun konisinden devam eden anestezi ile bir diseksiyon pedine sırtüstü yerleştirin.
- (Bir fare için), hayvanı indüksiyon odasından çıkardıktan hemen sonra servikal çıkık gerçekleştirin. Burun konisi gerekli değildir. İzofluran buharlaştırıcıyı% 0'a çevirin.
- Gerekirse, kemirgenin üst uzuvlarını, hayvanın içine delinmemeye dikkat ederek, pimlerle desteklenen bant kullanarak göğüs duvarından uzakta diseksiyon pedine yapıştırın. Diseksiyona geçmeden önce uygun anestezi derinliğini (ayak parmağı sıkışma yanıtı eksikliği) kontrol edin.
- Cerrahi makas kullanarak (sıçanlar için Mayo, fareler için Metzenbaum), ksifoid sürecin hemen altında, cildi kemirgenin karnının tam genişliği boyunca periton boşluğuna enine kesin.
- Cerrahi makas kullanarak, enine kesimden göğüs duvarının hem sol hem de sağ taraflarında iki dikey kesik parasagital (göğüs duvarının yanlarından yukarıya) yapın. Daha sonra, diyaframı kesin, parasagital kesikleri bağlayın ve torasik boşluğu boşaltın.
- Sternum ve göğüs duvarını kemirgenin kafasına doğru hareket ettirmek, torasik boşluğu ve kalbi açığa çıkarmak için kemirgenin kafasına doğru bir hemostat kullanarak ksifoid işlemi kelepçeleyin ve kaldırın. Gerekirse, kalbi tamamen açığa çıkarmak ve / veya perikardiyal zarı kırmak için parasagital kesikleri ikinci vertebral boşluğun yakınına kadar hızla uzatın.
- Kavisli iris forseps kullanarak, büyük damarları görselleştirmek için kalbi dikkatlice kaldırın. Forsepsleri miyokard ile kemirgenin omurgası arasına yerleştirin, daha büyük damarlara kelepçeleyin ve atriyum veya ventriküler segmentleri sıkıştırmamaya dikkat ederek kalbi kaldırın.
- Kalbi hafifçe kaldırırken, kavisli iris makaslarını (içbükey yukarı) kavisli iris forseps ile kemirgenin omurgası arasına hızla yerleştirin ve büyük damarları ve akciğerleri kalpten uzaklaştırın. Kalbi hızlı bir şekilde taze perfüzyon çözeltisi içeren bir tartım teknesine veya beher içine taşıyın ve kalpteki kanı temizlemeye yardımcı olmak için sallayın.
- İzofluran buharlaştırıcıyı, daha önce yapılmamışsa% 0'a çevirin. Akciğer, perikardial veya diğer dokuların büyük bölümleri kalbe bağlı kalırsa, kanülasyona müdahaleyi en aza indirmek için bunları şu anda dikkatlice kesin ve atın.
- Kavisli iris forsepslerini kullanarak, kalbi hazırlanan kanül suya batırılmış olarak temiz bir tartım teknesine veya beherine taşıyın. Aortu kanüle edin, ilmekli ipek sütürü sıkarak aortu sabitleyin ve 5 mL'ye kadar perfüzyon çözeltisi ile yıkayın.
- Kalbi kanülden çıkarın ve trabeküla izolasyonuna hazırlanmak için silikon elastomer kaplı bir tartım kabına yerleştirin.
3. Trabekülün izolasyonu ve dengesi
- Kalbi stereomikroskop altında silikon elastomer kaplı kaba yerleştirin ve aydınlatın.
- Sağ ventrikül çıkış yolunu bulun. Sol atriyumu ve ventriküler tepeyi çanaktaki silikon elastomere sabitleyin.
- Uzun Vannas makası kullanarak, sağ ventrikül çıkış yolundan septum boyunca tepeye kadar kesin. Sağ ventrikül çıkış yolundan aortun yakınındaki sağ atriyuma doğru kesin, ardından sağ atriyumdan kesin (Şekil 3B).
- Forseps kullanarak, sağ ventrikül (RV) serbest duvarını çıkış yolundan dikkatlice çekin ve dokuyu germemeye dikkat edin.
NOT: Deneyciler, endişe duymadan kesilebilen ince, beyaz bağ dokusu iplikçikleri bulabilirler. Daha büyük, pembe (doku) renkli iplikçikler, izole edilebilen trabeküller olabileceğinden dikkatle değerlendirilmelidir. - Sağ ventrikülü açığa çıkarmak için sağ ventrikül üçgeninin serbest duvarını çanağa sabitleyin (Şekil 3C).
- İnce (<500 μm çapında) ancak keskin uçlu olmayan erimiş ve oluşturulmuş bir cam pipet kullanarak, açıkta kalan endokardda serbest duran trabekülleri arayın (Şekil 3C).
NOT: Bağımsız bir trabekül, altında tamamen araştırılabilen bir kas şerididir. Üçgen papiller kaslardan kaçınarak paralel kenarları (sabit genişlik) olan trabekülleri kullanın. Bu işlem sırasında ve sonraki diseksiyon sırasında dikkatli olun, çünkü trabeküla gerilme uygulamak hasara neden olabilir ve gelişmiş kuvveti azaltabilir. - Trabekülayı küçük Vannas makası kullanarak diseke edin. Bağlanmaya izin vermek için trabekülün her iki ucunda ≥1 mm küp şeklinde bir doku parçası bırakın. Trabekülayı mümkün olduğunca germeyin ve metal aletlerin temasını en aza indirin, çünkü her ikisi de kaslara zarar verebilir. Tanımlanan trabeküllerin yakınındaki kas üzerindeki gerginliği en aza indirmek için kalbi tutan pimleri gerektiği gibi değiştirin.
- 7 mL'lik bir transfer pipetinin ucundan ~2 inç kesin, trabekülü yavaşça pipetin içine çekin ve %50 perfüzyon çözeltisi ve %50 modifiye Tyrode çözeltisi içeren yeni bir tartım kabına aktarın. Kasın birkaç dakika boyunca karışık çözelti içindeki hücre dışı kalsiyumdaki artışa dengelenmesine izin verin.
- Yedek olarak ek trabeküla elde etmek için şu anda ek trabekülayı incelemek üzere 3.7-3.8 arasındaki adımları yineleyin.
- Deney odasına süperfüzyon ve/veya emme sağlayan pompayı kapatın. Büyük delikli transfer pipetini kullanarak, trabeculayı Tyrode çözeltisiyle dolu deney odasına taşıyın.
- Trabekülün sonundaki bir >1 mm küp doku parçasını kuvvet dönüştürücüsündeki bir kancaya sabitleyin, ardından ikinci küpü motora sabitleyin.
NOT: Transdüsere daha iyi erişim için ilk tarafı monte ederken motoru ve kuvvet dönüştürücüyü ayırın, ardından trabekül gevşek kalırken ikinci doku küpünü monte ederken kancaları mümkün olduğunca birbirine yaklaştırın. - Superfüzyonu yeniden başlatın ve eşik voltajını belirlemek için kası hızlandırmaya başlayın. Trabekülün dengelenmesini sağlamak için yaklaşık 1 saat boyunca eşik voltajının %20 üzerinde hızlanın.
- Bu denge periyodunun sonunda, gelişmiş (minimumdan tepeye) gerilimi gözlemleyerek, optimal gelişmiş stres oluşumu sağlanana kadar motora bağlı mikrometreyi kullanarak kası yavaşça gerin. Pasif diyastolik gerginlik tepe gerginliğinden daha hızlı yükseldiğinde kas uzunluğunu arttırmayı bırakın, bu da optimal uzunluğun geçildiğini gösterir.
- İletilen mikroskop aydınlatmasını kapatın ve dik bir açıyla bir kaz boynu aydınlatıcısı kullanarak trabeculayı aydınlatın. Daha önce kalibre edilmiş mikroskop optikleri aracılığıyla bağlanmış bir kamera kullanarak, diyastol sırasında trabekülün bir görüntüsünü deneysel klasöre yakalayın. Trabekül kameranın görüş alanından daha genişse, kas boyunca birden fazla görüntü çekin.
- Görüntüyü/görüntüleri, piksel mesafelerini bildiren bir görüntüleme yazılımında açın.
- Kas çapının piksel mesafesini, uzunluğu boyunca dört kez ölçün. Kas (trabekül) uzunluğunu, büyük doku küpü hariç, piksel cinsinden ölçün.
- Kas uzunluğu görüş alanından daha uzunsa, tüm uzunluğu ölçmek için kas boyunca referans noktaları kullanın.
- Deney klasöründeki şablonu kullanarak, çap ölçümlerinin ortalamasını alın ve önceden elde edilmiş bir kalibrasyonu kullanarak çap ve uzunlukları piksellerden mm'ye dönüştürün. Kesit alanınımm2 cinsinden π*çap2/4 ve μm cinsinden kas uzunluğu olarak hesaplayın.
4. Veri toplama
- Kas dengelendikten sonra veri toplama yazılımını açın, Deneyler | Uzunluk Kontrolü yapın ve kalibre edilmiş trabekül uzunluğunu (FL) ve kesit alanını (alan [m2]) Kalibrasyon kutusuna girin.
- Şablon klasöründen (Adım 1.7), freeform_file.txt doğru klasöre işaret ettiğinden emin olun ve freeform.dap dosyasını bir metin düzenleyicisinde açın. *.dap dosyasında izotonik düzeyi (izoton) 32.000 olarak ayarlayın.
- Uzunluk Denetimi kutusunda, Serbest Form sekmesini seçin ve uygun Serbest Form liste dosyasına gidin. Veri Dosyalama yolunun da verileri kaydetmek için doğru klasör olduğundan emin olun. Orantılı ve entegrasyon kazancı parametrelerine sahip bir geri besleme kontrolü kullanarak yük kelepçesi verilerini almadan önce Run Experiment tuşuna basarak tam izometrik seğirmelerden veri almaya başlayın.
- *.dap dosyasında son yükü (izoton) tanımlayarak yük sıkıştırmalı veriler elde edin ve dosyayı metin düzenleyicisine kaydederek orantılı kazanç (propgain) ve tümleştirme (Ki) parametrelerinin değerlerini yineleyin. Veri toplama yazılımı arabiriminde Denemeyi Çalıştır'a basın.
- Modu (flswitch) birinden ayarlayarak ve yük kelepçesini (flthreshold) sıfırdan sonlandırma eşiğini artırarak, maksimum gerinim hızı aralığına ulaşmak için kelepçenin orijinal uzunluğuna (bazen gevşeme yüklemesi5 olarak da adlandırılır) geri uzatmayı içerdiğinden emin olun.
- Modu (flswitch) birden sıfıra değiştirerek yük kelepçesinin ucunu kontrol edin. Yük kelepçesinin ucunu sıfır yeniden uzatmadan başlangıç uzunluğuna geri uzatmayı tamamlamak için değiştirirken alımı tekrarlayın.
- Uzunluğu artırmak için, yük kelepçesini (flthreshold) sonlandırma eşiğini, kas neredeyse orijinal uzunluğuna geri dönene kadar sıfırdan kademeli olarak artırın.
- Modu (flswitch = 1) ve eşiği (flthreshold = 0) sıfırlayın ve son bir veri alımı çalıştırın.
- İstenirse, 4.4-4.6 adımlarını tekrarlayarak etütteki son yükü değiştirin. Bu satın alma işlemi hemen yapılabilir.
- İstenirse, kası gererek veya kısaltarak ön yükü değiştirin veya Tyrode çözeltisine bileşikler ekleyerek kası tedavi edin. Ön yükü değiştiriyorsanız veya bileşikler ekliyorsanız, yavaş kuvvet tepkisi 9,15'in stabilize olduğundan ve / veya bileşiğin kaslara tamamen nüfuz ettiğinden emin olmak için en az 20 dakika bekleyin.
- Veri alımı tamamlandıktan sonra trabekülü çıkarın. Gerekirse, biyokimyasal veya histolojik analiz için trabekülayı dondurun veya sabitleyin.
- Çalışma alanlarını ve deney sistemini temizleyin, tüm boruları suyla yıkayın ve tüm bileşenleri kapatın.
5. Veri analizi
- Programı uygun dosya yoluna yönlendirerek nicel bir analiz programı kullanarak veri dosyalarını açın.
- Veri analiz programının kelepçeli atımı analiz etmesini ve programın yük kelepçesinin başlangıcını doğru bir şekilde almasını sağlayarak gevşemeyi ölçün.
- Yük kelepçesinin ucunun tanımlandığından emin olun, böylece gevşeme oranı (1/τ), izometrik bir gevşeme sırasında stresin tepe negatif türevinden ölçülür.
- Bu üstel zaman sabitini veya gevşemenin diğer uygun niceliğini (minimum stres türevi, lojistik zaman sabiti 17 veya kinematik model18) belirlemek için Glantz yöntemi16'yı kullanın.
- Veri analiz programının, gerinimin zaman türevini alarak gerinim oranını hesapladığından emin olun; burada gerinim, optimum kasılmada uzunluğa bölünen zamanın bir fonksiyonu olarak uzunluk olarak hesaplanır.
- Belirli bir koşulun tüm izleri için yukarıdaki adımları tekrarlayın.
- Gevşeme oranı ve gerinim oranı arasındaki ilişkiyi çizin, maksimum verileri 1 s-1'den daha az fizyolojik gerinim oranıyla sınırlayın. Düşük gerinim oranlarında verileri hariç tutun (Şekil 4C), çünkü gevşeme aşaması üstel bozunumuyansıtmayabilir 17,18.
- Gevşeme oranı ile gerinim oranı arasındaki çizginin eğimini elde edin ve eğimi MCR indeksi olarak kaydedin.
- Sorgulanan her koşul için yukarıdaki analizi tekrarlayın.
Sonuçlar
Temsili bir veri seti Şekil 4'te gösterilmiştir ve ek sonuçlar önceki yayınlardabulunabilir 8,9. Kısaca, gerinim oranı, izometrik gevşemeden hemen önce, gerinimin türevinden hesaplanır. Gerinim, zamanın bir fonksiyonu olarak uzunluğun, kasın uzunluğuna optimal uzunlukta bölünmesidir. Gevşeme hızı 1/τ olarak hesaplanır, burada τ üstel zaman sabiti16'dır. Gevşemenin mekanik kontrolünü (MCR) belirlemek için çoklu gerinim oranları ve bunların sonucunda ortaya çıkan gevşeme oranları gereklidir. Bu veriler, gevşeme oranına karşı gerinim oranı grafiğinde çizilir. Çizginin eğimi MCR endeksini sağlar.
Son sistolik ve diyastolik gerinim oranlarının 1 s-1'i geçme ihtimalinin olmadığını unutmayın. Bu nedenle, eğim yalnızca 1 s-1 < gerinim oranlarını içermelidir. Düşük gerinim oranlarındaki gevşeme oranı, stresin minimum zaman türevindeki (dStress / dtdak) değişikliklerle karıştırılabilir ve bu durumlarda, yaklaşık 0.15 s-1'den daha az gerilmelerden elde edilen veriler göz ardı edilebilir.

Şekil 1: Brüt diseksiyon ve kalp kanülasyon alanının kurulumu. Sağdan sola: a. Hayvan için anestezi indüksiyon odası, diseksiyon alanının yakınında bulunur. b. İsteğe bağlı uçucu gaz temizleyici için şnorkel. c. Hayvanın sırtüstü yerleştirileceği bir diseksiyon pedi, (saat yönünde) d. kemirgene sürekli anestezi sağlamak için bir burun konisi, e. hemostatlar, f. cerrahi makas, g. baskın (kesme) el ile kolay erişim için yerleştirilmiş kavisli ince makas, h. baskın olmayan el ile kolay erişim için yerleştirilmiş kavisli iris forsepsleri ile çevrelenir. Kemirgenin üst uzuvları bant kullanılarak diseksiyon pedine yapıştırılabilir ve i. kalbi durulamak için perfüzyon çözeltisi içeren bir diseksiyon kabı (veya küçük bir beher) yerleştirilmelidir. j. Kanülasyon için sahnelenmiş bir alan yakınlara yerleştirilmelidir. Uygun bir kanüle sahip bir şırınga, bir halka standına monte edilir. k. (Inset) 1 mm PE205 borusu takılı ve gevşek düğümlenmiş bir dikiş ile 16 G kanülünün daha yakın bir görüntüsü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Deney alanı ve aletleri. (A) Deney alanı. Deney odası ve veri toplama sistemi yakındaki ters çevrilmiş bir mikroskopta (solda) hazırlanmıştır. Trabeküla izolasyonu ve montajı bir stereoskop altında gerçekleşir (sağda). (B) İki forseps, büyük ve küçük Vannas makası ve özel bir cam probunun uçları,% 10 BSA çözeltisine batırılarak hazırlanır. (C) Ek diseksiyon aletleri. Silikon elastomer kaplı bir çanak, ince diseksiyon sırasında kalbin monte edilmesine izin verir. Çanak ve cam probun altında ucu kesilmiş 7 mL'lik bir transfer pipeti gösterilir. Transfer pipetinin kesilmiş ucu atılır ve kasları transfer etmek için minimum gerilme veya dehidrasyon riski ile genişletilmiş bir delik kullanılır. (D) Yaklaşık 2 mm uzunluğunda ve 0,25-0,5 mm çapında bir cam pipetin ucunun büyütülmüş görüntüsü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: Diseksiyon kılavuzu . (A) Brüt diseksiyon, deriden ksifoid sürecin altındaki periton boşluğuna enine bir kesimle (1. yeşil) başlamalıdır (alt kaburgalar ve ksifoid ince gri bir çizgi ile gösterilir). Periton boşluğundan göğüs kafesine kadar olan parasagital kesimler takip etmeli (2. deniz mavisi ve 3. mavi çizgiler), daha sonra diyafram kesilmelidir. Daha sonra ksifoid süreci sıkıştırmak ve göğüs duvarını başa doğru yükseltmek için bir hemostat kullanılabilir. (B) Sağ ventrikül çıkış yolu (RVOT), sağ atriyum (RA), aort (Ao) ve sol atriyum (LA) görünümü ile yönlendirilmiş, silikon-elastomer bir kaba sabitlenmiş sağlam bir sıçan kalbi. İlk kesim seti RVOT'tan septum boyunca tepeye kadar olmalıdır (1. Sarı çizgi). İkinci bir kesik seti, RVOT'tan kalbin tabanı boyunca, ardından sağ atriyum boyunca (2. turuncu çizgi) olmalıdır. (C) RVOT, kalbi açmak ve geri sabitlemek için aorttan dikkatlice çekilebilir. Sarı ve turuncu çizgiler B'de açıklanan kesimlere karşılık gelir. Serbest duran trabeküller genellikle RV serbest duvarının tabanının yakınında ve septumun yakınında bulunur, ancak herhangi bir yerde oluşabilir (kırmızı çizgiler ortak yerleri gösterir). (D) Bir trabekül altındaki cam probun büyütülmüş görünümü (sarı ok, trabeküla ve probun kesişimini gösterir). (E) Bir trabekül (kırmızı ok), bir kuvvet dönüştürücü (solda) ve motor (orta-sağ) arasında deneysel sisteme monte edilir ve iki hız kesici uçla (trabekülün üstünde ve altında yatay) çevrelenir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
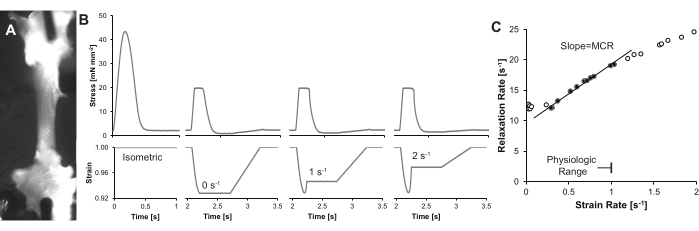
Şekil 4: Temsili izler ve sonuçlar. (A) Trabekülün kontrastını artıran mikroskop merceğinin ekseninden dik (~ 75°) bir açıyla kaz boynu LED ışığı kullanılarak aydınlatılan tek bir kardiyak trabekül. Bu örnekte, trabekülün tam uzunluğunu göstermek için iki görüntü döşenmiştir. (B) Aynı trabekula için gerilim zamanı (üstte) ve gerinim zamanı (altta) eğrileri. İzometrik bir seğirme, artan uçtaki üç yük kelepçesi seğirmesi ile birlikte sistolik gerinim oranları gösterilmiştir. (C) Temsili MCR hesaplaması. MCR, gevşeme oranı ile gerinim oranı arasındaki çizginin eğimi olarak tanımlanır. Tartışmada belirtildiği gibi, gerinim oranları niceliksel, tekrarlanabilir bir MCR sağlamak için sınırlandırılabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tablo 1: Çözümler. Bu Tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Gevşemenin mekanik kontrolü (MCR), miyokard gevşeme hızının kas ilerlemesi gevşemesinin gerilme hızına bağımlılığını ölçer 8,9. Gerinim oranı, son yükten ziyade, gevşeme oranını değiştirmek için hem gerekli hem de yeterlidir8. Kalsiyum oranını değiştirmeye yönelik müdahalelerin kardiyak gevşemeyi önemli ölçüde iyileştirdiği kanıtlanmadığından, mekanik müdahale mekanizmaya yeni bakış açıları sağlayabilir ve diyastolik disfonksiyon için yeni bir tedavi sağlayabilir.
Burada tarif edilen miyokard gerinim hızını değiştirme protokolü, izotonik yük kelepçesi 8,9 kullanır. İzotonik yük kelepçesinin bir gücü, yük sonrası stresin kantitatif kontrolüdür. Windkessel benzeri protokoller, son yük, ön yük ve kardiyak çalışmadaki değişiklikleri daha fazla araştırmak için kullanılabilir 2,6,7. Yük kelepçesi tarafından kontrol edilmeyen bir rampa, gerinimdeki değişimi gerinim oranından daha iyi izole etmek için de kullanılabilir. Ne olursa olsun, son yükün kendisi, gevşeme oranı8'in güçlü bir değiştiricisi gibi görünmemektedir.
Protokol ayrıca sıcaklık ve pacing hızı için daha fizyolojik koşullara yaklaşmak üzere uyarlanabilir. MCR'nin varlığını göstermek için mevcut protokol ayrıntıları kullanılmıştır. Deneysel soruya bağlı olarak fizyolojik koşullarda deneyler yapılması genellikle tavsiye edilir. Bununla birlikte, 37 ° C'de veya yüksek pacing hızlarında yapılan deneyler, kaslarda daha hızlı bir şekilde bozulmaya (hasara) neden olabilir. Gelişmiş oksijen taşıma kapasitesine sahip bir çözelti gerekebilir. Ayrıca, veri toplama, hızlı seğirmeleri çözmek ve geri bildirim kontrolü sağlamak için uzunluğu ve kuvveti yeterince hızlı örnekleyebilmelidir.
Mevcut protokol, kalsiyum ölçümünü veya sarkomer uzunluklarının ölçümünü ve kontrolünü tanımlamamaktadır. Kalsiyum ölçümleri diğer protokollerdeele alınmıştır 11, sarkomer uzunluğu ölçümü ise uygun ekipmanlarla eklenebilir. Sarkomer uzunluğu kontrolü mevcut MCR çalışmalarında kullanılmamaktadır, çünkü kas uzunluğu klinik durumla en ilişkili parametredir19. Daha fazla sarkomer uzunluğu kontrolü (kas uzunluğu kontrolüne karşı) kinetik sorulara spesifik cevaplar sağlayacaktır, ancak sarkomerler arası varyasyon ve sarkomer uzunluğu değişikliklerinin in vivo olarak minimum anlaşılması nedeniyle translasyonel bilgiye katkıda bulunması muhtemel değildir.
Verilerin tekrarlanabilirliğini artırmak için burada üç deneysel husus vurgulanmaktadır.
İlk olarak, serbest duran kardiyak trabeküllerin bazı hayvanlarda bulunması zor olabilir (yayınlanmamış sonuçlar ve iletişim). Çoğu sıçanda seğirme kasları bulunabilirken, sıçanlarda trabeculadan veri elde etmek için makul bir başarı oranı üçte birdir. Trabecula başarısı, tarihsel olarak20 kez kullanılan ve daha fazla trabeküle (yayınlanmamış iletişim) sahip olduğu bildirilen Brown Norway x Lewis F1 sıçanları ile daha yüksek olabilir. Fareler için, başarı oranlarının daha düşük olması muhtemeldir, BL / 6 arka planından fareler için 10'da birinden daha azı beklenir; Bununla birlikte, FVBN arka planından (yayınlanmamış iletişim ve gözlemler) fareler için daha yüksek bir oran beklenmektedir.
İkincisi, kaslara verilen hasar çıktıyı azaltabilir. Geliştirilen kuvvetler 25 ° C'de 10 mN mm-2'den az ve 0,5 Hz hızdaysa, araştırmacıların metal forseps ve kas arasında yanlışlıkla gerilme veya temas meydana gelip gelmediğini, çözeltilerin uygun şekilde hazırlanmadığını veya pacing veya deneysel ekipmanın düzgün çalışıp çalışmadığını değerlendirmek için sorun giderme yapmaları gerekebilir. Bozulmamış trabeküla kullanan diğer protokoller, Luer-lock şırıngalarının transfer kapları olarak kullanılmasını önermiştir11. Bu mümkün olsa da, özellikle kullanıcı çok yavaş bir akış hızını veya daha küçük bir kas segmentini kontrol ediyorsa, mevcut protokol olası hasarı en aza indirmek için çok daha büyük bir delik transfer pipeti kullanır. İskemik hasarın oluşabileceği bir diğer adım ise diseksiyon sırasındadır. Aort, kardiyomiyosit izolasyon protokolleri21,22'de listelenen sınırlara benzer şekilde, ilk abdominal kesimden (sıçan) veya servikal çıkıktan (fare) sonraki 3 dakika içinde kanüle edilmeli ve perfüzyon çözeltisi ile yıkanmalıdır. Bu, kalp dokusunun kardiyopleji benzeri perfüzyon çözeltisine maruz kalmadığı zamanı en aza indirir. Ayrıca, 30 dakikadan fazla süren diseksiyonlar genellikle seğirme trabekülü üretmez. Bu nedenle, operatörler hasarı en aza indirmek için hızlı ama dikkatli bir diseksiyon uygulamalıdır. 0.2mm2'nin (2 x 10-7 m2) üzerindeki bir kesit alanı çekirdek iskemisi20'den muzdarip olabilir.
Üçüncüsü, kasların motora ve kuvvet dönüştürücüsüne bağlanma şekli dikkate alınmalıdır. Bu protokol şu anda kancalara ve bağımsız trabeküllere odaklanmaktadır. Gevşemeden önce gerilmenin bazen hızlı gerilme hızı, düzgün bir şekilde yapıştırılmadığı takdirde bir kasın kaymasına neden olabilir, bu nedenle mevcut protokol trabekülayı23,24 tutmak için "sepetler" kullanmaz. Alternatif montaj yöntemleri (yapıştırıcılar, klipsler, vb.25,26) da dikkate alınabilir ve doğrulanabilir. Burada tarif edilen protokol papiller kasları değil, trabekülleri kullanır. Papiller kasın kordaları, MCR9'daki değişiklikleri engelleyebilen bir dizi elastikiyeti indükler. Bununla birlikte, ataşmanların kas içine tam olarak yerleştirilmesinin önlemleri etkilemesi muhtemel değildir, çünkü trabekül uzunluğu (ve çapı) önemli ölçüde değişir.
Kas uçlarını kancalarla delmenin bir sınırlaması, montaj noktasının kendisinin de zarar görebilmesidir. Yapıştırılmış kas dokusunun sık sık kasılmalarla (güçlerine bağlı olarak) olası yırtılması, uzunluğu veya seri elastikiyetini değiştirebilir. Bu yırtılma oranını kontrol etmek zordur. Benzer şekilde, dokuya ve kancaya verilen hasar, germe sırasında daha da şiddetlenebilir ve potansiyel olarak sorunlara neden olabilir. Görsel muayene ve dengelenmiş izometrik kuvvetin% >80'i kalan gelişmiş kuvvet değerleri, preparatın hasar görüp görmediğini değerlendirmek için kullanılmalı ve hariç tutulmalıdır.
Başka bir sınırlama veya düşünce, yöntemle hangi deneysel soruların cevaplanabileceğini etkiler. Örneğin, perfüzyon çözeltisinde 2,3-bütandion monoksitim (BDM) kullanımını düşünün. BDM, kasın işlevini değiştirebilen bir fosfatazdır. Ek olarak, uzun süreli boşaltma ve ilerleme hızı eksikliği, gizli fosforilasyon durumunun muhtemelen değiştiği anlamına gelir. Bu nedenle, bir hayvanın kas kontraktilitesini (genotipler veya tedaviler arasındaki farklara karşı) doğrudan değerlendirmeye çalışıyorsanız, kasılma durumu muhtemelen değiştiğinden, dikkatli olunmalıdır. Bununla birlikte, fosforilasyonun etkisi, yolun bir agonisti veya antagonisti eklenerek farmakolojik olarak değerlendirilebilir.
Özetle, MCR, gevşemenin kas hareketi (gerilme oranı) ile nasıl düzenlendiğine dair fikir verir. MCR, diyastolik hastalığın teşhisi ve izlenmesi ile birlikte miyozin kinetiğinin modifiye edilmesi gibi farmakolojik müdahale hedeflerinin daha iyi anlaşılmasına yardımcı olabilir. Burada özetlenen protokol ve tavsiye, birkaç yıllık denemeler sonucunda geliştirilen bilgileri ortaya koymaktadır ve diğer kalp hastalığı sistemlerine ve modellerine uygulanabilir olmalıdır.
Açıklamalar
Hiç kimse.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (1R01HL151738) ve Amerikan Kalp Derneği (18TPA34170169) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18 or 16 gauge blunted needle/canula | for cannulation of rat aorta, use 1mm of PE160 or PE205 tubing as stop | ||
| 2,3-Butanedione Monoxime | Sigma-Aldrich | B0753-25G | |
| 23 gauge blunted needle/canula | for cannulation of mouse aorta, use 1mm of PE50 tubing as stop | ||
| 5 mL syringe | BD Luer-Lock | 309646 | |
| 95% Oxygen/5% CO2 | AirGas | Z02OX9522000043 | |
| Anethesia system | EZ Systems | EZ-SA800 | Can use any appropriate anethesia method/system |
| Bovine Serum Albumin | Fisher BioReagents | BP-1600 | to coat tips of fine forcepts, scissors |
| Calcium Chloride Dihydrate | Fisher Chemical | C79-500 | |
| Containers/dissection dishes | FisherBrand | 08-732-113 | Weigh dishes for creating dissection plates |
| Crile Hemostat | Fine Science Tools | 13005-14 | for mouse gross dissection |
| D-(+)-Glucose | Sigma-Aldrich | G8270-1KG | |
| Data acquisition software | SLControl | ||
| Data acquisition system | MicrostarLabs | DAP5216a | Can use any DAQ. This is a PCI based data acqusition for use with SLControl; must have a PC with a PCI slot |
| Data analysis software | Mathworks | Matlab | Custom Script |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | 2x for cannulation of aorta |
| Dumont #5 Forceps | Fine Science Tools | 11254-20 | 2x for trabecula isolation |
| Experimental system | Aurora Scientific | 801C | Can use any appropriate experimental chamber with force and length control |
| Fine Scissors, curved | Fine Science Tools | 14061-09 | for removal of heart |
| Gooseneck Piggyback Illuminator | AmScope | LED-6WA | |
| HEPES | Sigma-Aldrich | H3375-250G | |
| Imaging software | IrfanView | ||
| Iris Forceps | World Precision Instruments | 15915 | for removal of heart |
| Isoflurane | VetOne | 502017 | |
| Magnesium Chloride Hexahydrate | Sigma-Aldrich | M2670-100G | |
| Magnesium Sulfate | Sigma-Aldrich | M7506-500G | |
| Mayo Scissors | Fine Science Tools | 14110-15 | for rat gross dissection |
| Metzenbaum Scissors | Fine Science Tools | 14116-14 | for mouse gross dissection |
| Microscope connected camera | Flir | BFS-U3-27S5M-C | Includes acquisition software |
| Microscope/digital imaging system | Olympus | IX-73 | Can use any appropriate microscope. Needed to measure muscle length, cross sectional area |
| Mounting Pin/Needle | BD PrecisionGlide | 305136 | For holding heart to dish. 27 G x 1-1/4 |
| Mounting Pin/Needle | Fine Science Tools | 26000-40 | For holding heart to dish. 0.4mm diameter insect pin (Alt to 27G needle) |
| Oxygen (O2) | AirGas | OX USP300 | |
| Peristaltic Pump | Rainin | Rabbit | Can be any means to create flow in experimental chamber |
| pH and Oxygen sensor | Mettler Toledo | SevenGo pH and DO | |
| Potassium Bicarbonate | Sigma-Aldrich | 237205-100G | |
| Potassium Chloride | Fisher Chemical | P217-500 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | 795488-500G | |
| Rochester-pean Hemostat | World Precision Instruments | 501708 | for rat gross dissection |
| Silk Suture, Size: 4/0 | Fine Science Tools | 18020-40 | cut to ~1.5 inch pieces, soaked in water |
| Sodium Bicarbonate | Sigma-Aldrich | S6297-250G | |
| Sodium Chloride | Sigma-Aldrich | S9888-1KG | |
| Sodium Hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Phosphate Dibasic | Sigma-Aldrich | S7907-100G | |
| Stereomicroscope | AmScope | SM-1TX | |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | for opening of the RV |
| SYLGARD 184 Silicone Elastomer Base | Dow Corning | 3097358-1004 | For creating dissection plates |
| Syringe Holder | Harbor Frieght | Helping Hands 60501 | Can be used as alternate for ring stand |
| Taurine | Sigma-Aldrich | T0625-1KG | |
| Transfer Pipette | FisherBrand | 13-711-7M | cut ~1" from tip to widen bore |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | for trabecula isolation |
Referanslar
- Iribe, G., Helmes, M., Kohl, P. Force-length relations in isolated intact cardiomyocytes subjected to dynamic changes in mechanical load. American Journal of Physiology. Heart and Circulatory Physiology. 292 (3), 1487-1497 (2007).
- Dowrick, J. M., et al. Work-loop contractions reveal that the afterload-dependent time course of cardiac Ca(2+) transients is modulated by preload. Journal of Applied Physiology. 133 (3), 663-675 (2022).
- ter Keurs, H. E., Rijnsburger, W. H., van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Sonnenblick, E. H. Force-velocity relations in mammalian heart muscle. The American Journal of Physiology. 202, 931-939 (1962).
- Brutsaert, D. L., Rademakers, F. E., Sys, S. U. Triple control of relaxation: implications in cardiac disease. Circulation. 69 (1), 190-196 (1984).
- Taberner, A. J., Han, J. C., Loiselle, D. S., Nielsen, P. M. F. An innovative work-loop calorimeter for in vitro measurement of the mechanics and energetics of working cardiac trabeculae. Journal of Applied Physiology. 111 (6), 1798-1803 (2011).
- De Tombe, P. P., Little, W. C. Inotropic effects of ejection are myocardial properties. Am J Physiol. 266, 1202-1213 (1994).
- Chung, C. S., Hoopes, C. W., Campbell, K. S. Myocardial relaxation is accelerated by fast stretch, not reduced afterload. Journal of Molecular and Cellular Cardiology. 103, 65-73 (2017).
- Schick, B. M., et al. Reduced preload increases Mechanical Control (strain-rate dependence) of Relaxation by modifying myosin kinetics. Archives of Biochemistry and Biophysics. 707, 108909 (2021).
- Parikh, S. S., Zou, S. Z., Tung, L. Contraction and relaxation of isolated cardiac myocytes of the frog under varying mechanical loads. Circulation Research. 72 (2), 297-311 (1993).
- Dowrick, J. M., et al. Simultaneous brightfield, fluorescence, and optical coherence tomographic imaging of contracting cardiac trabeculae ex vivo. Journal of Visualized Experiments. (176), e62799 (2021).
- Wiggers, C. J. Studies on the consecutive phases of the cardiac cycle I. The duration of the consecutive phases of the cardiac cycle and the criteria for their precise determination. American Journal of Physiology-Legacy Content. 56 (3), 415-438 (1921).
- Rosen, B. D., et al. Late systolic onset of regional LV relaxation demonstrated in three-dimensional space by MRI tissue tagging. American Journal of Physiology. Heart and Circulatory Physiology. 287 (4), 1740-1746 (2004).
- Saito, M., et al. The differences in left ventricular torsional behavior between patients with hypertrophic cardiomyopathy and hypertensive heart disease. International Journal of Cardiology. 150 (3), 301-306 (2011).
- Monasky, M. M., Biesiadecki, B. J., Janssen, P. M. L. Increased phosphorylation of tropomyosin, troponin I, and myosin light chain-2 after stretch in rabbit ventricular myocardium under physiological conditions. Journal of Molecular and Cellular Cardiology. 48 (5), 1023-1028 (2010).
- Raff, G. L., Glantz, S. A. Volume loading slows left ventricular isovolumic relaxation rate. Evidence of load-dependent relaxation in the intact dog heart. Circulation Research. 48, 813-824 (1981).
- Matsubara, H., Takaki, M., Yasuhara, S., Araki, J., Suga, H. Logistic time constant of isovolumic relaxation pressure-time curve in the canine left ventricle. Better alternative to exponential time constant. Circulation. 92 (8), 2318-2326 (1995).
- Chung, C. S., Kovacs, S. J. Physical determinants of left ventricular isovolumic pressure decline: model prediction with in vivo validation. American Journal of Physiology. Heart and Circulatory Physiology. 294 (4), 1589-1596 (2008).
- Campbell, K. B., Kirkpatrick, R. D., Tobias, A. H., Taheri, H., Shroff, S. G. Series coupled non-contractile elements are functionally unimportant in the isolated heart. Cardiovascular Research. 28 (2), 242-251 (1994).
- Raman, S., Kelley, M. A., Janssen, P. M. Effect of muscle dimensions on trabecular contractile performance under physiological conditions. Pflugers Archiv: European Journal of Physiology. 451 (5), 625-630 (2006).
- Czeiszperger, T. L., Wang, M. P., Chung, C. S. Membrane stabilizer Poloxamer 188 improves yield of primary isolated rat cardiomyocytes without impairing function. Physiol Rep. 8 (4), 14382 (2020).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Loiselle, D. S., Johnston, C. M., Han, J. C., Nielsen, P. M. F., Taberner, A. J. Muscle heat: a window into the thermodynamics of a molecular machine. American Journal of Physiology. Heart and Circulatory Physiology. 310 (3), 311-325 (2016).
- de Tombe, P. P., ter Keurs, H. E. Force and velocity of sarcomere shortening in trabeculae from rat heart. Effects of temperature. Circulation Research. 66 (5), 1239-1254 (1990).
- Palmer, B. M., Bell, S. P. Preparing excitable cardiac papillary muscle and cardiac slices for functional analyses. Frontiers in Physiology. 13, 817205 (2022).
- Brunello, E., et al. Myosin filament-based regulation of the dynamics of contraction in heart muscle. Proceedings of the National Academy of Sciences. 117 (14), 8177-8186 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır