Method Article
Controle mecânico do relaxamento utilizando trabéculas cardíacas íntegras
Neste Artigo
Resumo
O rápido relaxamento miocárdico e cardíaco é essencial para a fisiologia normal. Sabe-se hoje que os mecanismos de relaxação mecânica são dependentes da taxa de deformação. Este protocolo fornece uma visão geral da aquisição e análise de experimentos para aprofundar o estudo do controle mecânico da relaxação.
Resumo
A disfunção diastólica é um fenótipo comum em todas as apresentações de doenças cardiovasculares. Além da rigidez cardíaca elevada (pressão diastólica final do ventrículo esquerdo elevada), o relaxamento cardíaco prejudicado é um importante indicador diagnóstico de disfunção diastólica. Embora o relaxamento exija a remoção do cálcio citosólico e a desativação dos filamentos finos do sarcomérico, o direcionamento de tais mecanismos ainda não forneceu tratamentos eficazes. Mecanismos mecânicos, como a pressão arterial (isto é, pós-carga), têm sido teorizados para modificar o relaxamento. Recentemente, mostramos que modificar a taxa de deformação de um estiramento, e não a pós-carga, era necessário e suficiente para modificar a taxa de relaxamento subsequente do tecido miocárdico. A dependência da taxa de deformação do relaxamento, denominada controle mecânico do relaxamento (MCR), pode ser avaliada por meio de trabéculas cardíacas íntegras. Este protocolo descreve a preparação de um modelo animal de pequeno porte, sistema e câmara experimental, isolamento do coração e posterior isolamento de uma trabécula, preparação da câmara experimental, protocolos experimentais e de análise. Evidências de alongamento de deformações no coração intacto sugerem que a CRM pode fornecer novas arenas para melhor caracterização de tratamentos farmacológicos, juntamente com um método para avaliar a cinética dos miofilamentos em músculos intactos. Portanto, o estudo da CRM pode elucidar um caminho para novas abordagens e novas fronteiras no tratamento da insuficiência cardíaca.
Introdução
O relaxamento cardíaco é prejudicado em quase todas as formas de insuficiência cardíaca (incluindo insuficiência cardíaca com fração de ejeção reduzida) e em muitas doenças cardiovasculares. Além de inúmeros métodos para avaliar a função cardíaca em músculos permeabilizados, a avaliação da musculatura cardíaca íntegra vem ganhando interesse. Tais tecidos são avaliados descarregados (extremidades livres para contrair) ou carregados (comprimento ou força controlada). Historicamente, miócitos isolados intactos têm sido avaliados em uma condição sem carga, onde o corpo celular está livre para encurtar durante a contração. Trabéculas cardíacas intactas são frequentemente avaliadas em condições isométricas, onde o comprimento não pode mudar, mas a tensão (força por área de secção transversa) é gerada. Tanto o método do miócito intacto quanto as trabéculas começam a convergir com modificações da carga 1,2.
Protocolos para o clampeamento de carga de um músculo (isto é, controlar o estresse desenvolvido de um músculo em um valor especificado que simula pós-cargas fisiológicas) foram desenvolvidos ao longo de várias décadas 3,4,5. Em tecidos cardíacos intactos, as pinças de carga permitem mimetizar mais de perto o ciclo cardíaco in vivo usando pós-cargas isotônicas ou semelhantes às de Windkessel 6,7,8,9. O objetivo desse protocolo é obter dados usados para quantificar a MCR (ou seja, a dependência da taxa de deformação da taxa de relaxamento)8,9.
Embora o protocolo de RCM tenha sido adaptado de trabalhos anteriores, o foco desse protocolo (comparado a protocolos similares utilizando tecidos cardíacos intactos) está em mecanismos biomecânicos que modificam o relaxamento. Existem vários protocolos utilizando o clampeamento de carga 3,4,5,7,10 e protocolos focados nos modelos de Windkessel 1,2,11, mas este protocolo descreve especificamente como o alongamento prévio ao relaxamento modifica a taxa de relaxamento. Demonstramos que esse controle ocorre durante um período protodiastólico8, fase originalmente descrita por Wiggers12. Em corações normais e saudáveis, o miocárdio sofre um alongamento durante a ejeção antes do fechamento da valva aórtica (ou seja, antes do relaxamento isovolumétrico)13. Isso é imitado prolongando a duração do controle da pós-carga até que o músculo comece a se alongar. Evidências clínicas sugerem que esse alongamento pode ser atenuado ou perdido em estados patológicos14, e as implicações e os mecanismos das taxas alteradas de strain sistólico final não foram totalmente elucidados. Dadas as escassas opções de tratamento para doenças diastólicas e insuficiência cardíaca com uma fração de ejeção preservada, postulamos que a RCM pode fornecer informações sobre novos mecanismos subjacentes ao relaxamento prejudicado.
Enquanto a dissecção macroscópica aqui descrita se concentra em roedores, o isolamento da trabécula pode ser realizado a partir de qualquer coração intacto, e já foi usado com uma trabécula cardíaca humana8. Da mesma forma, a aquisição e análise dos dados também podem ser aplicadas aos cardiomiócitos ou outros tipos muscularesisolados1,10. A discussão inclui comentários sobre possíveis alterações e adaptações do método, além de limitações, como a cautela com a utilização da musculatura papilar devido às propriedades mecânicas dascordas9.
Protocolo
O protocolo a seguir foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Wayne State University. O protocolo aqui descreve etapas para a utilização de cobaias experimentais com roedores, mas pode ser adaptado para uso em outros organismos modelo.
1. Preparo
- Obter o sujeito experimental e permitir que ele se aclimate ao laboratório.
- Preparar 250 mL de solução de perfusão e 250 mL de solução de Tyrode modificada (Tabela 1), oxigenando-se cada um a 10-20 ppm de O2, com pH 7,3.
- Prepare uma seringa de 5 mL com uma cânula acoplada. Encha a seringa com solução de perfusão. Use cânulas que são 23 G para um rato, e 18 ou 16 G para um rato pequeno ou grande, respectivamente. Deslize um tubo de polietileno (PE) de 1 mm de comprimento na extremidade de uma agulha embotada (Tabela de Materiais), para ajudar a evitar que a aorta escorrege da cânula após ser amarrada.
- Preparo completo da área de dissecção e canulação (Figura 1)
- Encha dois barcos de pesagem limpos pelo menos na metade do caminho com solução de perfusão. Submergir a ponta da cânula em solução de perfusão com pelo menos uma sutura de dupla alça colocada ao redor da cânula. Segure a seringa no lugar com uma braçadeira de barra.
- Coloque uma tesoura cirúrgica, um hemostático, uma pinça de íris, um par de pequenas tesouras curvas e duas pinças #3 para facilitar o acesso.
- Preparar o sistema experimental (Figura 2) fazendo o priming e circulando a solução de Tyrode modificada por todo o sistema experimental. Certifique-se de que a câmara está completamente cheia e estável.
- Ligue todas as caixas de aquisição de dados, incluindo o transdutor de força, o motor de comprimento, o sistema de estimulação, o sistema de controle de temperatura e o computador de aquisição de dados.
- Copie e renomeie uma pasta de modelo contendo os arquivos *.dap e de ponteiro necessários para fazer referência ao experimento atual. Abra o software de aquisição de dados.
- Preparar as ferramentas de isolamento da trabécula (tesoura Vannas, pinça #5 ou #55, sonda de vidro) submergindo suas pontas em albumina de soro bovino (BSA) a 10% (p/v) em água ultrapura ou solução de perfusão, para revestir o metal com proteína (Figura 2B).
NOTA: Todo o sistema experimental deve ser preparado antes da dissecção.
2. Dissecção macroscópica e canulação
- Registre a identificação, o peso corporal e outras informações relevantes do animal sujeito.
- Opcionalmente, injetar 1.000 U/kg de heparina em solução salina estéril no roedor por injeção intraperitoneal pelo menos 10 minutos antes da eutanásia, para minimizar os riscos de coagulação antes da perfusão coronariana.
- Colocar o animal em câmara de indução e induzir anestesia geral com isoflurano a 3%-5% vaporizado em oxigênio a 100%, conforme procedimento padrão.
NOTA: Ligue quaisquer catadores externos, mesas de rascunho ou exaustores de fumaça usados para minimizar a exposição ao isoflurano. - Uma vez que o roedor perde seu reflexo de retificação e a frequência respiratória diminuiu:
- (Para um rato) retirar o animal da câmara de indução e colocá-lo em decúbito dorsal sobre uma placa de dissecção, com anestesia contínua através de um cone nasal.
- (Para um rato) realizar deslocamento cervical imediatamente após a retirada do animal da câmara de indução. O cone nasal não é necessário. Vire o vaporizador de isoflurano para 0%.
- Se necessário, fixar os membros superiores do roedor na placa de dissecção, afastando-se da parede torácica, com fita adesiva apoiada em pinos, tomando cuidado para não perfurar o animal. Verifique a profundidade adequada da anestesia (ausência de resposta de pinça dos dedos) antes de proceder à dissecção.
- Usando tesouras cirúrgicas (Mayo para ratos, Metzenbaum para camundongos), logo abaixo do processo xifoide, corte a pele transversalmente em toda a largura do abdômen do roedor para o espaço peritoneal.
- Com tesoura cirúrgica, faça dois cortes verticais parassagitais (nas laterais da parede torácica) nos lados esquerdo e direito da parede torácica a partir do corte transversal. Em seguida, cortar o diafragma, conectando os cortes parassagitais e liberando o espaço torácico.
- Aperte e levante o processo xifoide usando um hemostático em direção à cabeça do roedor, para mover o esterno e a parede torácica em direção à cabeça do roedor, expondo o espaço torácico e o coração. Se necessário, estender rapidamente os cortes parassagitais para próximo ao segundo espaço vertebral, para expor totalmente o coração e/ou romper a membrana pericárdica.
- Usando pinças de íris curvas, levante cuidadosamente o coração para visualizar os grandes vasos. Coloque a pinça entre o miocárdio e a coluna vertebral do roedor, aperte os vasos maiores e levante o coração, tomando cuidado para não apertar os átrios ou segmentos ventriculares.
- Ao levantar levemente o coração, coloque rapidamente a tesoura de íris curva (côncava para cima) entre a pinça de íris curva e a coluna do roedor, e corte os grandes vasos e pulmões para longe do coração. Mova rapidamente o coração para um barco de pesagem ou copo contendo solução de perfusão fresca e agite para ajudar a limpar o sangue do coração.
- Vire o vaporizador de isoflurano para 0%, se ainda não tiver sido feito. Se grandes segmentos de pulmão, pericárdico ou outros tecidos permanecerem aderidos ao coração, corte-os cuidadosamente e descarte-os neste momento para minimizar a interferência com a canulação.
- Usando a pinça de íris curva, mova o coração para um barco ou copo de pesagem limpo, com a cânula preparada submersa. Canular a aorta, fixar a aorta apertando a sutura de seda em alça e lavar com até 5 mL de solução de perfusão.
- Retire o coração da cânula e coloque-o em uma pesa revestida de elastômero de silicone para se preparar para o isolamento da trabécula.
3. Isolamento e equilíbrio das trabéculas
- Coloque o coração no prato revestido de elastômero de silicone sob um estereomicroscópio e ilumine-o.
- Localize a via de saída do ventrículo direito. Fixar o átrio esquerdo e o ápice ventricular no elastômero de silicone na placa.
- Com tesoura longa de Vannas, cortado da via de saída do ventrículo direito até o ápice ao longo do septo. Cortar da via de saída do ventrículo direito para o átrio direito, próximo à aorta, e então atravessar o átrio direito (Figura 3B).
- Com o uso de pinças, tracione cuidadosamente a parede livre do ventrículo direito (VD) da via de saída, tomando cuidado para não esticar o tecido.
NOTA: Os experimentadores podem encontrar fios de tecido conjuntivo finos e brancos, que podem ser cortados sem preocupação. Fios maiores e cor-de-rosa (tecido) devem ser avaliados com cuidado, pois podem ser trabéculas que podem ser isoladas. - Fixar a parede livre do triângulo do ventrículo direito na placa, para expor o ventrículo direito (Figura 3C).
- Usando uma pipeta de vidro que foi derretida e formada com uma extremidade fina (<500 μm de diâmetro), mas não afiada, procure trabéculas independentes no endocárdio exposto (Figura 3C).
NOTA: Uma trabécula independente é uma faixa de músculo que se pode sondar completamente por baixo. Utilizar trabéculas que possuam lados paralelos (largura constante), evitando músculos papilares triangulares. Tenha cuidado durante este processo e posterior dissecção, pois a aplicação de tensão nas trabéculas pode causar danos, reduzindo a força desenvolvida. - Dissecar a trabécula usando uma tesoura pequena de Vannas. Deixe um pedaço de tecido cúbico de ≥1 mm em cada extremidade da trabécula para permitir a fixação. Não estique a trabécula sempre que possível, e minimize o contato de ferramentas metálicas, pois ambas também podem causar danos ao músculo. Realoque os pinos que seguram o coração conforme necessário para minimizar a tensão no músculo próximo às trabéculas identificadas.
- Corte ~2 centímetros da extremidade de uma pipeta de transferência de 7 mL, desenhe lentamente a trabécula para dentro da pipeta e transfira-a para uma nova placa de pesagem contendo solução de perfusão a 50% e solução de Tyrode modificada a 50%. Deixe o músculo se equilibrar para o aumento do cálcio extracelular dentro da solução mista por vários minutos.
- Repita as etapas 3.7-3.8 para dissecar trabéculas adicionais neste momento, para obter trabéculas adicionais como backup.
- Desligue a bomba que fornece superfusão e/ou sucção para a câmara experimental. Usando a pipeta de transferência de furo grande, mova a trabécula para a câmara experimental preenchida com a solução de Tyrode.
- Fixe um pedaço de tecido de >1 mm no final da trabécula a um gancho no transdutor de força e, em seguida, fixe o segundo cubo no motor.
NOTA: Separe o motor e o transdutor de força ao montar o primeiro lado para melhor acesso ao transdutor e, em seguida, mova os ganchos o mais próximo possível ao montar o segundo cubo de tecido enquanto a trabécula permanece frouxa. - Reinicie a superfusão e comece a marcar o músculo para determinar a tensão limiar. Ritmo a 20% acima da tensão limite por aproximadamente 1 h para permitir que a trabécula se equilibre.
- Ao final desse período de equilíbrio, alongar lentamente o músculo utilizando o micrômetro conectado ao motor até que se atinja a geração ótima de tensão desenvolvida, observando-se a tensão desenvolvida (mínima a máxima). Pare de aumentar o comprimento muscular quando a tensão diastólica passiva aumenta mais rápido do que o pico de tensão, indicando que o comprimento ideal foi ultrapassado.
- Desligue a iluminação do microscópio transmitido e ilumine a trabécula usando um iluminador de pescoço de ganso em um ângulo íngreme. Usando uma câmera conectada através da óptica do microscópio previamente calibrada, capture uma imagem da trabécula durante a diástole para a pasta experimental. Se a trabécula for mais larga do que o campo de visão da câmera, tire várias imagens através do músculo.
- Abra a(s) imagem(ns) em um software de geração de imagens que relata as distâncias de pixel.
- Meça a distância dos pixels do diâmetro do músculo quatro vezes ao longo de seu comprimento. Meça o comprimento do músculo (trabécula) em pixels, excluindo o grande cubo de tecido.
- Se o comprimento do músculo for maior do que o campo de visão, use pontos de referência ao longo do músculo para medir todo o comprimento.
- Usando o molde na pasta experimental, faça a média das medidas de diâmetro e converta o diâmetro e os comprimentos de pixels para mm usando uma calibração previamente obtida. Calcular a área de secção transversa em π*diâmetro 2/4 em mm2 e o comprimento muscular em μm.
4. Aquisição de dados
- Uma vez que o músculo está equilibrado, abra o software de aquisição de dados, selecione Experimentos | Controle de comprimento e insira o comprimento calibrado da trabécula (FL) e a área de secção transversal (área [m2]) na caixa Calibração.
- Na pasta de modelo (etapa 1.7), verifique se o freeform_file.txt aponta para a pasta correta e abra o arquivo freeform.dap em um editor de texto. Defina o nível isotônico (isoton) como 32.000 no arquivo *.dap.
- Na caixa Controle de comprimento, selecione a guia Forma livre e navegue até o arquivo de lista Forma livre apropriado. Verifique se o caminho do Arquivamento de Dados também é a pasta correta para salvar dados. Comece a adquirir dados de contrações totalmente isométricas pressionando Run Experiment, antes de adquirir dados de fixação de carga usando um controle de feedback com parâmetros de ganho proporcional e de integração.
- Adquira dados de pressão de carga definindo a pós-carga (isoton) no arquivo *.dap e itere valores de parâmetros de ganho proporcional (propgain) e integração (Ki) salvando o arquivo no editor de texto. Pressione Executar experimento na interface do software de aquisição de dados.
- Certifique-se de que a braçadeira inclua o realongamento de volta ao seu comprimento original (às vezes referido como carga de relaxação5) durante essa iteração para atingir a faixa máxima de taxas de deformação, definindo o modo (flswitch) de um e aumentando o limite para terminar a braçadeira de carga (flthreshold) de zero.
- Controle a extremidade da braçadeira de carga alterando o modo (flswitch) de um para zero. Repita a aquisição enquanto altera a extremidade da braçadeira de carga de realongamento zero para realongamento completo de volta ao comprimento inicial.
- Para aumentar o comprimento, aumente incrementalmente o limiar para terminar a pinça de carga (flthreshold) de zero até que o músculo quase se realonge de volta ao seu comprimento original.
- Redefina o modo (flswitch = 1) e o limite (flthreshold = 0) e execute uma aquisição de dados final.
- Se desejar, modificar a pós-carga no estudo repetindo os passos 4.4-4.6. Essa aquisição pode ser feita imediatamente.
- Se desejar, modifique a pré-carga alongando ou encurtando o músculo, ou trate o músculo adicionando compostos à solução de Tyrode. Se alterar a pré-carga ou adicionar compostos, aguardar no mínimo 20 min para garantir que a resposta de força lenta 9,15 tenha estabilizado e/ou para que o composto penetre totalmente no músculo.
- Uma vez concluída a aquisição de dados, remova a trabécula. Se necessário, congelar ou fixar as trabéculas para análise bioquímica ou histológica.
- Limpe as áreas de trabalho e o sistema experimental, lave toda a tubulação com água e desligue todos os componentes.
5. Análise dos dados
- Abra os arquivos de dados usando um programa de análise quantitativa, direcionando o programa para o caminho de arquivo apropriado.
- Quantifique o relaxamento garantindo que o programa de análise de dados analise a batida de fixação e que o programa adquira corretamente o início da braçadeira de carga.
- Assegurar que a extremidade da pinça de carga seja identificada, de modo que a taxa de relaxação (1/τ) seja quantificada a partir da derivada negativa de pico de tensão durante um relaxamento isométrico.
- Use o método de Glantz 16 para determinar essa constante de tempo exponencial, ou outra quantificação apropriada de relaxamento (derivada mínima de tensão, constante de tempo logístico17 ou modelo cinemático18).
- Certifique-se de que o programa de análise de dados calcule a taxa de deformação tomando a derivada de tempo da deformação, onde a deformação é calculada como o comprimento em função do tempo dividido pelo comprimento na contração ideal.
- Repita as etapas acima para todos os vestígios de uma determinada condição.
- Plotar a relação entre a taxa de relaxamento e a taxa de deformação, limitando os dados máximos a uma taxa de deformação fisiológica inferior a 1 s-1. Excluir dados com baixas taxas de deformação (Figura 4C), pois a fase de relaxamento pode não refletir o decaimento exponencial17,18.
- Obter a inclinação da linha entre a taxa de relaxação e a taxa de deformação, e registrar a inclinação como o índice de MCR.
- Repita a análise acima para cada condição interrogada.
Resultados
Um conjunto de dados representativos é mostrado na Figura 4, e resultados adicionais podem ser encontrados em publicações anteriores 8,9. Resumidamente, a taxa de deformação é calculada a partir da derivada da deformação, imediatamente antes da relaxação isométrica. Deformação é o comprimento em função do tempo dividido pelo comprimento do músculo no comprimento ideal. A taxa de relaxamento é calculada como 1/τ, onde τ é a constante de tempo exponencial16. Múltiplas taxas de deformação e suas taxas de relaxamento resultantes são necessárias para determinar o controle mecânico de relaxamento (MCR). Esses dados são plotados em um gráfico de taxa de relaxamento versus taxa de deformação. A inclinação da reta fornece o índice MCR.
Observe que as taxas de strain sistólica e diastólica finais provavelmente não excederão 1 s-1. Portanto, a inclinação só deve incluir taxas de deformação < 1 s-1. A taxa de relaxamento em baixas taxas de deformação pode ser confundida por mudanças na derivada temporal mínima de tensão (dStress/dtmin), e nesses casos, dados de trechos inferiores a aproximadamente 0,15 s-1 podem ser ignorados.

Figura 1: Configuração da dissecção macroscópica e área de canulação cardíaca. Da direita para a esquerda: a. A câmara de indução anestésica do animal está localizada próxima à área de dissecção. b. Um snorkel para limpador de gás volátil opcional. c. Uma almofada de dissecção, onde o animal será colocado em decúbito dorsal, é ladeada por (sentido horário) d. um cone nasal, para proporcionar anestesia contínua ao roedor, e. hemostáticos, f. tesoura cirúrgica, g. tesoura fina curva colocada para fácil acesso com a mão dominante (cortante), h. pinça de íris curva colocada para fácil acesso com a mão não dominante. Os membros superiores do roedor podem ser afixados ao coxim de dissecção com fita adesiva, e i. uma placa de dissecção (ou copo pequeno) com solução de perfusão deve ser colocada nas proximidades para enxaguar o coração. j. Uma área estagiada para canulação deve ser colocada nas proximidades. Uma seringa com uma cânula apropriada é montada em um suporte de anel. k. (Inset) Imagem mais próxima de uma cânula de 16 G, com 1 mm de tubo PE205 acoplado e uma sutura frouxamente amarrada. Clique aqui para ver uma versão maior desta figura.

Figura 2: Área experimental e ferramentas . (A) Área experimental. A câmara experimental e o sistema de aquisição de dados são preparados em microscópio invertido próximo (à esquerda). O isolamento e a montagem da trabécula ocorrem sob um estereoscópio (à direita). (B) Pontas de duas pinças, tesouras de Vannas grandes e pequenas, e uma sonda de vidro personalizada são preparadas por imersão em solução BSA a 10%. (C) Ferramentas adicionais de dissecação. Um prato de elastômero de silicone permite a montagem do coração durante a dissecção fina. Uma pipeta de transferência de 7 mL com o corte final é mostrada abaixo da placa e da sonda de vidro. A ponta de corte da pipeta de transferência é descartada, e um furo aumentado é usado para transferir o músculo, com risco mínimo de alongamento ou desidratação. (D) Imagem ampliada da extremidade de uma pipeta de vidro, com aproximadamente 2 mm de comprimento e 0,25-0,5 mm de diâmetro. Clique aqui para ver uma versão maior desta figura.

Figura 3: Guia de dissecção . (A) A dissecção macroscópica deve começar com um corte transversal (1. verde) através da pele para a cavidade peritoneal abaixo do processo xifoide (costelas inferiores e xifoide são indicadas por uma fina linha cinza). Devem seguir-se cortes parassagitais da cavidade peritoneal até a caixa torácica (2. linhas azuladas e 3. linhas azuis), após o que o diafragma deve ser cortado. Um hemostático pode então ser usado para pinçar o processo xifoide e elevar a parede torácica em direção à cabeça. (B) Coração de rato intacto fixado a uma placa de elastômero de silício, orientado com vista para a via de saída do ventrículo direito (VSVD), átrio direito (AD), aorta (Ao) e átrio esquerdo (AE). O primeiro conjunto de cortes deve ser da VSVD até o ápice ao longo do septo (1. Linha amarela). Um segundo conjunto de cortes deve ser da VSVD ao longo da base do coração e, em seguida, através do átrio direito (2. linha laranja). (C) A VSVD pode ser cuidadosamente afastada da aorta para abrir o coração e fixá-lo de volta. As linhas amarelas e laranjas correspondem aos cortes descritos em B. Trabéculas independentes são frequentemente encontradas perto da base da parede livre do VD e perto do septo, mas podem ocorrer em qualquer lugar (linhas vermelhas indicam locais comuns). (D) Visão ampliada da sonda de vidro sob uma trabécula (seta amarela indica intersecção de trabécula e sonda). (E) Uma trabécula (seta vermelha) é montada no sistema experimental entre um transdutor de força (esquerda) e um motor (centro-direita), e é flanqueada por duas derivações de estimulação (horizontal acima e abaixo da trabécula). Clique aqui para ver uma versão maior desta figura.
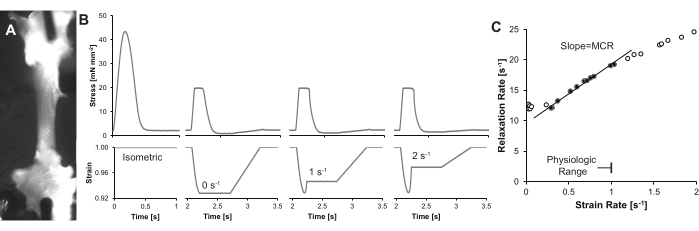
Figura 4: Traços e resultados representativos . (A) Uma única trabécula cardíaca iluminada usando uma luz LED de pescoço de ganso em um ângulo íngreme (~75°) do eixo da lente do microscópio, o que aumenta o contraste da trabécula. Neste exemplo, duas imagens são lado a lado para mostrar o comprimento total da trabécula. (B) Curvas tensão-tempo (superior) e tempo-deformação (inferior) para a mesma trabécula. Uma contração isométrica, juntamente com três contrações de clamp de carga em taxas de tensão sistólica final crescentes são mostradas. (C) Cálculo representativo do MCR. A TCM é definida como a inclinação da linha entre a taxa de relaxamento e a taxa de deformação. Como observado na discussão, as taxas de deformação podem ser restritas para fornecer uma MCR quantitativa e reprodutível. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Soluções. Clique aqui para baixar esta tabela.
Discussão
O controle mecânico do relaxamento (MCR) quantifica a dependência da taxa de relaxamento miocárdico com a taxa de deformação do músculo que procede ao relaxamento 8,9. A taxa de deformação, ao invés da pós-carga, é necessária e suficiente para modificar a taxa de relaxamento8. Como as intervenções para modificar a taxa de cálcio não demonstraram melhorar substancialmente o relaxamento cardíaco, a intervenção mecânica pode fornecer novos conhecimentos sobre o mecanismo e fornecer um novo tratamento para a disfunção diastólica.
O protocolo de modificação da taxa de deformação miocárdica aqui descrito utiliza um clamp de carga isotônica 8,9. Uma força da fixação de carga isotônica é o controle quantitativo da tensão pós-carga. Protocolos do tipo Windkessel poderiam ser usados para investigar alterações na pós-carga, pré-carga e trabalho cardíaco 2,6,7. Uma rampa não controlada pela pinça de carga também poderia ser usada para isolar melhor a mudança na deformação da taxa de deformação. Independentemente disso, a pós-carga em si não parece ser um forte modificador da taxa de relaxamento8.
O protocolo também pode ser adaptado para abordar condições mais fisiológicas de temperatura e ritmo de estimulação. Os detalhes do protocolo atual foram utilizados para mostrar a presença da RCM. A realização de experimentos em condições fisiológicas é geralmente recomendada, dependendo da questão experimental. No entanto, experimentos realizados a 37 °C, ou em altas taxas de estimulação, podem induzir mais rapidamente o rundown (dano) ao músculo. Pode ser necessária uma solução com melhor capacidade de transporte de oxigénio. Além disso, a aquisição de dados deve ser capaz de amostrar o comprimento e a força com rapidez suficiente para resolver as contrações rápidas e fornecer controle de feedback.
O protocolo atual não descreve a medida de cálcio ou a medida e controle do comprimento dos sarcômeros. As medidas de cálcio têm sido abordadas em outros protocolos11, enquanto a medida do comprimento do sarcômero pode ser adicionada com equipamento apropriado. O controle do comprimento dos sarcômeros não é utilizado nos estudos atuais da CRM, pois o comprimento muscular é o parâmetro mais correlacionado com a condição clínica19. Um maior controle do comprimento do sarcômero (vs. controle do comprimento do músculo) forneceria respostas específicas para questões cinéticas, mas é improvável que acrescente ao conhecimento translacional devido à variação inter-sarcômero e à compreensão mínima das mudanças no comprimento do sarcômero in vivo.
Três considerações experimentais são destacadas aqui para aumentar a reprodutibilidade dos dados.
Primeiro, trabéculas cardíacas independentes podem ser difíceis de encontrar em alguns animais (resultados e comunicações não publicados). Embora músculos contraídos possam ser encontrados na maioria dos ratos, uma taxa de sucesso razoável para obter dados de trabécula em ratos é de um em cada três. O sucesso da trabécula pode ser maior com ratos Brown Norway x Lewis F1, que também foram usados historicamente20 e relataram ter mais trabéculas (comunicações não publicadas). Para camundongos, as taxas de sucesso provavelmente serão menores, com menos de um em cada 10 esperados para camundongos de um fundo BL/6; no entanto, uma taxa mais alta é esperada para camundongos de um fundo FVBN (comunicações e observações não publicadas).
Em segundo lugar, danos aos músculos podem reduzir a produção. Se as forças desenvolvidas forem inferiores a 10 mN mm-2 a 25 °C e estimulação de 0,5 Hz, os investigadores podem precisar realizar a solução de problemas para avaliar se está ocorrendo alongamento inadvertido ou contato entre pinças metálicas e músculo, se as soluções não estão adequadamente preparadas ou se a estimulação ou o equipamento experimental estão funcionando corretamente. Outros protocolos utilizando trabéculas intactas sugeriram o uso de seringas Luer-lock como vasos de transferência11. Embora isso seja possível, especialmente se o usuário controlar uma taxa de fluxo muito lenta ou um segmento muscular menor, o protocolo atual utiliza uma pipeta de transferência de furo muito maior para minimizar possíveis danos. Outra etapa em que pode ocorrer dano isquêmico é durante a dissecção. A aorta deve ser canulada e lavada com solução de perfusão dentro de 3 min do primeiro corte abdominal (rato) ou luxação cervical (camundongo), semelhante aos limites listados nos protocolos de isolamento de cardiomiócitos21,22. Isso minimiza o tempo em que o tecido cardíaco não é exposto à solução de perfusão cardioplegia-like. Além disso, dissecções com duração superior a 30 min geralmente não produzem trabécula de contração. Assim, os operadores devem praticar a dissecção rápida, mas cuidadosa, para minimizar os danos. Uma área de secção transversa acima de 0,2 mm 2 (2 x 10-7 m2) pode sofrer isquemia do core20.
Terceiro, a maneira pela qual os músculos estão aderidos ao transdutor motor e de força deve ser considerada. Atualmente, esse protocolo foca em ganchos e trabéculas independentes. A taxa de alongamento do alongamento, por vezes rápida, antes do relaxamento pode fazer com que um músculo deslize se não for afixado adequadamente, razão pela qual o protocolo atual não utiliza "cestos" para segurar a trabécula23,24. Métodos alternativos de montagem (adesivos, grampos, etc25,26) também podem ser considerados e validados. O protocolo aqui descrito utiliza trabéculas e não músculos papilares. As cordas tendíneas do músculo papilar induzem uma série de elasticidade que pode inibir alterações na MCR9. No entanto, é improvável que a colocação exata dos anexos no músculo tenha impacto nas medidas, pois o comprimento (e diâmetro) da trabécula varia substancialmente.
Uma limitação de perfurar as extremidades musculares com ganchos é que o próprio ponto de montagem também pode ser danificado. Possíveis rupturas do tecido muscular afixado com contrações frequentes (dependendo de sua força) podem alterar o comprimento ou a elasticidade da série. Essa taxa de lacrimejamento é difícil de controlar. Da mesma forma, danos ao tecido e ao gancho podem ser exacerbados durante o alongamento, também potencialmente causando problemas. A inspeção visual e os valores de força desenvolvida remanescentes >80% da força isométrica equilibrada devem ser usados para avaliar se a preparação está danificada e devem ser excluídos.
Outra limitação ou consideração afeta quais questões experimentais podem ser respondidas pelo método. Por exemplo, considere o uso de 2,3-butanodiona monoxima (BDM) na solução de perfusão. O BDM é uma fosfatase, que pode alterar a função do músculo. Além disso, o longo período de descarga e a falta de estimulação significam que o estado de fosforilação latente provavelmente mudou. Assim, deve-se ter cautela ao tentar avaliar diretamente a contratilidade muscular de um animal (vs. diferenças entre genótipos ou tratamentos), pois o estado contrátil provavelmente mudou. No entanto, o impacto da fosforilação pode ser avaliado farmacologicamente pela adição de um agonista ou antagonista da via.
Em resumo, o MCR fornece informações sobre como o relaxamento é regulado pelo movimento muscular (taxa de tensão). A RCM pode ajudar a fornecer uma melhor compreensão sobre o diagnóstico e o monitoramento da doença diastólica, juntamente com alvos para intervenção farmacológica, como a modificação da cinética da miosina. O protocolo e os conselhos aqui descritos estabelecem o conhecimento desenvolvido ao longo de vários anos de estudos e devem ser aplicáveis a outros sistemas e modelos de doença cardíaca.
Divulgações
Nenhum.
Agradecimentos
Este trabalho é apoiado pelo National Institutes of Health (1R01HL151738) e pela American Heart Association (18TPA34170169).
Materiais
| Name | Company | Catalog Number | Comments |
| 18 or 16 gauge blunted needle/canula | for cannulation of rat aorta, use 1mm of PE160 or PE205 tubing as stop | ||
| 2,3-Butanedione Monoxime | Sigma-Aldrich | B0753-25G | |
| 23 gauge blunted needle/canula | for cannulation of mouse aorta, use 1mm of PE50 tubing as stop | ||
| 5 mL syringe | BD Luer-Lock | 309646 | |
| 95% Oxygen/5% CO2 | AirGas | Z02OX9522000043 | |
| Anethesia system | EZ Systems | EZ-SA800 | Can use any appropriate anethesia method/system |
| Bovine Serum Albumin | Fisher BioReagents | BP-1600 | to coat tips of fine forcepts, scissors |
| Calcium Chloride Dihydrate | Fisher Chemical | C79-500 | |
| Containers/dissection dishes | FisherBrand | 08-732-113 | Weigh dishes for creating dissection plates |
| Crile Hemostat | Fine Science Tools | 13005-14 | for mouse gross dissection |
| D-(+)-Glucose | Sigma-Aldrich | G8270-1KG | |
| Data acquisition software | SLControl | ||
| Data acquisition system | MicrostarLabs | DAP5216a | Can use any DAQ. This is a PCI based data acqusition for use with SLControl; must have a PC with a PCI slot |
| Data analysis software | Mathworks | Matlab | Custom Script |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | 2x for cannulation of aorta |
| Dumont #5 Forceps | Fine Science Tools | 11254-20 | 2x for trabecula isolation |
| Experimental system | Aurora Scientific | 801C | Can use any appropriate experimental chamber with force and length control |
| Fine Scissors, curved | Fine Science Tools | 14061-09 | for removal of heart |
| Gooseneck Piggyback Illuminator | AmScope | LED-6WA | |
| HEPES | Sigma-Aldrich | H3375-250G | |
| Imaging software | IrfanView | ||
| Iris Forceps | World Precision Instruments | 15915 | for removal of heart |
| Isoflurane | VetOne | 502017 | |
| Magnesium Chloride Hexahydrate | Sigma-Aldrich | M2670-100G | |
| Magnesium Sulfate | Sigma-Aldrich | M7506-500G | |
| Mayo Scissors | Fine Science Tools | 14110-15 | for rat gross dissection |
| Metzenbaum Scissors | Fine Science Tools | 14116-14 | for mouse gross dissection |
| Microscope connected camera | Flir | BFS-U3-27S5M-C | Includes acquisition software |
| Microscope/digital imaging system | Olympus | IX-73 | Can use any appropriate microscope. Needed to measure muscle length, cross sectional area |
| Mounting Pin/Needle | BD PrecisionGlide | 305136 | For holding heart to dish. 27 G x 1-1/4 |
| Mounting Pin/Needle | Fine Science Tools | 26000-40 | For holding heart to dish. 0.4mm diameter insect pin (Alt to 27G needle) |
| Oxygen (O2) | AirGas | OX USP300 | |
| Peristaltic Pump | Rainin | Rabbit | Can be any means to create flow in experimental chamber |
| pH and Oxygen sensor | Mettler Toledo | SevenGo pH and DO | |
| Potassium Bicarbonate | Sigma-Aldrich | 237205-100G | |
| Potassium Chloride | Fisher Chemical | P217-500 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | 795488-500G | |
| Rochester-pean Hemostat | World Precision Instruments | 501708 | for rat gross dissection |
| Silk Suture, Size: 4/0 | Fine Science Tools | 18020-40 | cut to ~1.5 inch pieces, soaked in water |
| Sodium Bicarbonate | Sigma-Aldrich | S6297-250G | |
| Sodium Chloride | Sigma-Aldrich | S9888-1KG | |
| Sodium Hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Phosphate Dibasic | Sigma-Aldrich | S7907-100G | |
| Stereomicroscope | AmScope | SM-1TX | |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | for opening of the RV |
| SYLGARD 184 Silicone Elastomer Base | Dow Corning | 3097358-1004 | For creating dissection plates |
| Syringe Holder | Harbor Frieght | Helping Hands 60501 | Can be used as alternate for ring stand |
| Taurine | Sigma-Aldrich | T0625-1KG | |
| Transfer Pipette | FisherBrand | 13-711-7M | cut ~1" from tip to widen bore |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | for trabecula isolation |
Referências
- Iribe, G., Helmes, M., Kohl, P. Force-length relations in isolated intact cardiomyocytes subjected to dynamic changes in mechanical load. American Journal of Physiology. Heart and Circulatory Physiology. 292 (3), 1487-1497 (2007).
- Dowrick, J. M., et al. Work-loop contractions reveal that the afterload-dependent time course of cardiac Ca(2+) transients is modulated by preload. Journal of Applied Physiology. 133 (3), 663-675 (2022).
- ter Keurs, H. E., Rijnsburger, W. H., van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Sonnenblick, E. H. Force-velocity relations in mammalian heart muscle. The American Journal of Physiology. 202, 931-939 (1962).
- Brutsaert, D. L., Rademakers, F. E., Sys, S. U. Triple control of relaxation: implications in cardiac disease. Circulation. 69 (1), 190-196 (1984).
- Taberner, A. J., Han, J. C., Loiselle, D. S., Nielsen, P. M. F. An innovative work-loop calorimeter for in vitro measurement of the mechanics and energetics of working cardiac trabeculae. Journal of Applied Physiology. 111 (6), 1798-1803 (2011).
- De Tombe, P. P., Little, W. C. Inotropic effects of ejection are myocardial properties. Am J Physiol. 266, 1202-1213 (1994).
- Chung, C. S., Hoopes, C. W., Campbell, K. S. Myocardial relaxation is accelerated by fast stretch, not reduced afterload. Journal of Molecular and Cellular Cardiology. 103, 65-73 (2017).
- Schick, B. M., et al. Reduced preload increases Mechanical Control (strain-rate dependence) of Relaxation by modifying myosin kinetics. Archives of Biochemistry and Biophysics. 707, 108909 (2021).
- Parikh, S. S., Zou, S. Z., Tung, L. Contraction and relaxation of isolated cardiac myocytes of the frog under varying mechanical loads. Circulation Research. 72 (2), 297-311 (1993).
- Dowrick, J. M., et al. Simultaneous brightfield, fluorescence, and optical coherence tomographic imaging of contracting cardiac trabeculae ex vivo. Journal of Visualized Experiments. (176), e62799 (2021).
- Wiggers, C. J. Studies on the consecutive phases of the cardiac cycle I. The duration of the consecutive phases of the cardiac cycle and the criteria for their precise determination. American Journal of Physiology-Legacy Content. 56 (3), 415-438 (1921).
- Rosen, B. D., et al. Late systolic onset of regional LV relaxation demonstrated in three-dimensional space by MRI tissue tagging. American Journal of Physiology. Heart and Circulatory Physiology. 287 (4), 1740-1746 (2004).
- Saito, M., et al. The differences in left ventricular torsional behavior between patients with hypertrophic cardiomyopathy and hypertensive heart disease. International Journal of Cardiology. 150 (3), 301-306 (2011).
- Monasky, M. M., Biesiadecki, B. J., Janssen, P. M. L. Increased phosphorylation of tropomyosin, troponin I, and myosin light chain-2 after stretch in rabbit ventricular myocardium under physiological conditions. Journal of Molecular and Cellular Cardiology. 48 (5), 1023-1028 (2010).
- Raff, G. L., Glantz, S. A. Volume loading slows left ventricular isovolumic relaxation rate. Evidence of load-dependent relaxation in the intact dog heart. Circulation Research. 48, 813-824 (1981).
- Matsubara, H., Takaki, M., Yasuhara, S., Araki, J., Suga, H. Logistic time constant of isovolumic relaxation pressure-time curve in the canine left ventricle. Better alternative to exponential time constant. Circulation. 92 (8), 2318-2326 (1995).
- Chung, C. S., Kovacs, S. J. Physical determinants of left ventricular isovolumic pressure decline: model prediction with in vivo validation. American Journal of Physiology. Heart and Circulatory Physiology. 294 (4), 1589-1596 (2008).
- Campbell, K. B., Kirkpatrick, R. D., Tobias, A. H., Taheri, H., Shroff, S. G. Series coupled non-contractile elements are functionally unimportant in the isolated heart. Cardiovascular Research. 28 (2), 242-251 (1994).
- Raman, S., Kelley, M. A., Janssen, P. M. Effect of muscle dimensions on trabecular contractile performance under physiological conditions. Pflugers Archiv: European Journal of Physiology. 451 (5), 625-630 (2006).
- Czeiszperger, T. L., Wang, M. P., Chung, C. S. Membrane stabilizer Poloxamer 188 improves yield of primary isolated rat cardiomyocytes without impairing function. Physiol Rep. 8 (4), 14382 (2020).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Loiselle, D. S., Johnston, C. M., Han, J. C., Nielsen, P. M. F., Taberner, A. J. Muscle heat: a window into the thermodynamics of a molecular machine. American Journal of Physiology. Heart and Circulatory Physiology. 310 (3), 311-325 (2016).
- de Tombe, P. P., ter Keurs, H. E. Force and velocity of sarcomere shortening in trabeculae from rat heart. Effects of temperature. Circulation Research. 66 (5), 1239-1254 (1990).
- Palmer, B. M., Bell, S. P. Preparing excitable cardiac papillary muscle and cardiac slices for functional analyses. Frontiers in Physiology. 13, 817205 (2022).
- Brunello, E., et al. Myosin filament-based regulation of the dynamics of contraction in heart muscle. Proceedings of the National Academy of Sciences. 117 (14), 8177-8186 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados