Method Article
Poli-Transfeksiyonlu Hücre Durumu Tanımlama Devrelerinin Hızlı Gelişimi
Bu Makalede
Özet
Karmaşık genetik devrelerin tasarlanması, test edilmesi ve optimize edilmesi zaman alıcıdır. Bu işlemi kolaylaştırmak için, memeli hücreleri, devre bileşenlerinin çoklu stokiyometrilerinin tek bir kuyuda test edilmesine izin verecek şekilde transfekte edilir. Bu protokol, deneysel planlama, transfeksiyon ve veri analizi adımlarını özetlemektedir.
Özet
Memeli genetik devreleri, çok çeşitli hastalık durumlarını algılama ve tedavi etme potansiyelini göstermiştir, ancak devre bileşenlerinin seviyelerinin optimizasyonu zorlu ve emek yoğun olmaya devam etmektedir. Bu süreci hızlandırmak için laboratuvarımız, geleneksel memeli transfeksiyonunun yüksek verimli bir uzantısı olan poli-transfeksiyonu geliştirdi. Poli-transfeksiyonda, transfekte popülasyondaki her hücre esasen farklı bir deney yapar, devrenin davranışını farklı DNA kopya numaralarında test eder ve kullanıcıların tek bir pot reaksiyonunda çok sayıda stokiyometriyi analiz etmelerine izin verir. Şimdiye kadar, tek bir hücre kuyucuğundaki üç bileşenli devrelerin oranlarını optimize eden poli-transfeksiyonlar gösterilmiştir; Prensip olarak, aynı yöntem daha büyük devrelerin geliştirilmesi için de kullanılabilir. Poli-transfeksiyon sonuçları, geçici devreler için DNA'nın ko-transfekt'e optimal oranlarını bulmak veya kararlı hücre hatlarının oluşturulması için devre bileşenleri için ekspresyon seviyelerini seçmek için kolayca uygulanabilir.
Burada, üç bileşenli bir devreyi optimize etmek için poli-transfeksiyonun kullanımını gösteriyoruz. Protokol, deneysel tasarım ilkeleriyle başlar ve poli-transfeksiyonun geleneksel ko-transfeksiyon yöntemlerine nasıl dayandığını açıklar. Daha sonra, hücrelerin poli-transfeksiyonu gerçekleştirilir ve birkaç gün sonra akış sitometrisi ile takip edilir. Son olarak, veriler, belirli bileşen oranlarına sahip hücrelerin alt kümelerine karşılık gelen tek hücreli akış sitometri verilerinin dilimleri incelenerek analiz edilir. Laboratuvarda, hücre sınıflandırıcılarını, geri besleme ve besleme denetleyicilerini, iki kararlı motifleri ve daha fazlasını optimize etmek için poli-transfeksiyon kullanılmıştır. Bu basit ama güçlü yöntem, memeli hücrelerindeki karmaşık genetik devreler için tasarım döngülerini hızlandırır.
Giriş
Memeli sentetik biyolojisi alanı, kültürlenmiş hücre hatlarında basit duyu ve tepki parçaları geliştirmekten, teşhis ve terapötiklerdeki gerçek dünyadaki zorlukları ele almak için karmaşık gen ağlarının optimizasyonuna kadar hızla ilerlemiştir1. Bu sofistike devreler, mikroRNA profillerinden sitokinlere ve küçük moleküllü ilaçlara kadar biyolojik girdileri algılayabilir ve transistörler, bant geçiş filtreleri, geçiş anahtarları ve osilatörler dahil olmak üzere mantık işleme devrelerini uygulayabilir. Ayrıca kanser, artrit, diyabetve daha birçok 1,2,3,4,5 gibi hastalıkların hayvan modellerinde umut verici sonuçlar göstermiştir. Bununla birlikte, bir devrenin karmaşıklığı arttıkça, bileşenlerinin her birinin seviyelerini optimize etmek giderek daha zor hale gelir.
Özellikle yararlı bir genetik devre türü, hücresel durumları algılamak ve bunlara yanıt vermek için programlanabilen bir hücre sınıflandırıcıdır. Belirli hücresel durumlarda protein veya RNA çıktılarının seçici üretimi, hücrelerin ve organoidlerin farklılaşmasını yönlendirmek ve programlamak, hastalıklı hücreleri ve / veya istenmeyen hücre tiplerini tanımlamak ve yok etmek ve terapötik hücrelerin işlevini düzenlemek için güçlü bir araçtır 1,2,3,4,5 . Bununla birlikte, memeli hücrelerinde, hücre durumlarını çoklu hücresel RNA ve / veya protein türlerinden doğru bir şekilde sınıflandırabilen devreler oluşturmak oldukça zor olmuştur.
Bir hücre sınıflandırma devresi geliştirmenin en çok zaman alan adımlarından biri, devre içindeki sensörler ve işleme faktörleri gibi bireysel bileşen genlerinin göreceli ekspresyon seviyelerini optimize etmektir. Devre optimizasyonunu hızlandırmak ve daha sofistike devrelerin inşasına izin vermek için, son çalışmalar optimal kompozisyonları ve topolojileri tahmin etmek için hücre sınıflandırıcı devrelerinin ve bileşenlerinin matematiksel modellemesini kullanmıştır 6,7. Bu şimdiye kadar güçlü sonuçlar göstermiş olsa da, matematiksel analiz, devredeki bileşen genlerinin giriş-çıkış davranışını sistematik olarak karakterize etme ihtiyacı ile sınırlıdır ve bu da zaman alıcıdır. Ayrıca, karmaşık genetik devrelerde bağlama bağlı sayısız problem ortaya çıkabilir ve bu da tam bir devrenin davranışının bireysel parça karakterizasyonlarına dayanan tahminlere meydan okumasına neden olabilir 8,9.
Hücre durumu sınıflandırıcıları gibi karmaşık memeli devrelerini daha hızlı geliştirmek ve test etmek için laboratuvarımız, plazmid ko-transfeksiyon protokollerinin bir evrimi olan poli-transfeksiyon10 adı verilen bir teknik geliştirdi. Ko-transfeksiyonda, çoklu plazmid DNA türleri, pozitif yüklü bir lipit veya polimer reaktifi ile birlikte kompleksleştirilir, daha sonra hücrelere korelasyonlu bir şekilde verilir (Şekil 1A). Poli-transfeksiyonda, plazmidler reaktif ile ayrı ayrı komplekslenir, böylece her transfeksiyon kompleksinden gelen DNA, hücrelere ilişkisiz bir şekilde iletilir (Şekil 1B). Bu yöntemi kullanarak, transfekte popülasyondaki hücreler, farklı devre bileşenleri taşıyan iki veya daha fazla DNA yükünün oranlarının sayısız kombinasyonuna maruz kalır.
Her hücreye verilen devre bileşenlerinin oranlarını ölçmek için, bir poli-transfeksiyon içindeki her transfeksiyon kompleksi, kompleksin hücresel alımı için bir vekil görevi gören yapısal olarak ifade edilen bir floresan muhabiri içerir. Bir memeli hücresi içinde aktif olan herhangi bir element içermeyen dolgu DNA'sı, tek bir transfeksiyon kompleksinde bir hücreye verilen floresan muhabirin ve devre bileşenlerinin nispi miktarını ayarlamak için kullanılır ve tartışmada daha ayrıntılı olarak tartışılır. Weiss laboratuvarında kullanılan dolgu DNA'sının bir örneği, bir sonlandırıcı dizisi içeren, ancak promotor, kodlama dizisi vb. İçermeyen bir plazmiddir. Farklı devre bileşenleri oranlarına sahip hücreler daha sonra gen devresi fonksiyonu için en uygun oranları bulmak için karşılaştırılabilir. Bu da, devre bileşenlerini genetik entegrasyon için tek bir vektörde (örneğin, bir lentivirüs, transpozon veya iniş pedi) birleştirirken optimum gen ekspresyon seviyelerine ulaşmak için promotörleri ve diğer devre elemanlarını seçmek için yararlı tahminler verir. Bu nedenle, sezgiye dayalı olarak veya zaman alıcı bir deneme yanılma süreci yoluyla devre bileşenleri arasındaki oranları seçmek yerine, poli-transfeksiyon, tek hazneli bir reaksiyonda genetik parçalar arasındaki çok çeşitli stokiyometrileri değerlendirir.
Laboratuvarımızda çoklu transfeksiyon, hücre sınıflandırıcıları, geri besleme ve besleme kontrolörleri ve iki kararlı motifler dahil olmak üzere birçok genetik devrenin optimizasyonunu sağlamıştır. Bu basit ama güçlü yöntem, memeli hücrelerindeki karmaşık genetik devreler için tasarım döngülerini önemli ölçüde hızlandırır. Poli-transfeksiyon o zamandan beri çok boyutlu giriş-çıkış transfer fonksiyonlarını yüksek çözünürlükte10'da ortaya çıkarmak, hücre durumu sınıflandırması 11 için alternatif bir devre topolojisini optimize etmek ve çeşitli yayınlanmış12,13 ve devam eden projeleri hızlandırmak için birkaç genetik devreyi karakterize etmek için kullanılmıştır.
Burada, bir genetik devreyi hızlı bir şekilde optimize etmek için çoklu transfeksiyon kullanma iş akışını açıklıyor ve tasvir ediyoruz (Şekil 2). Protokol, yüksek kaliteli poli-transfeksiyon verilerinin nasıl oluşturulacağını ve poli-transfeksiyon protokolünde ve veri analizinde birkaç yaygın hatadan nasıl kaçınılacağını göstermektedir (Şekil 3). Daha sonra, basit devre bileşenlerini karakterize etmek için poli-transfeksiyonun nasıl kullanılacağını gösterir ve bu süreçte, poli-transfeksiyon sonuçlarını ko-transfeksiyona karşı karşılaştırır (Şekil 4). Son olarak, poli-transfeksiyon sonuçları kanser sınıflandırıcı devresinin optimizasyonunu göstermektedir (Şekil 5).
Protokol
NOT: Tablo 1 ve Tablo 2 bu protokol için önemli referanslar olarak hizmet vermektedir. Tablo 1 , reaksiyonlar için reaktif ölçeklemesini gösterir ve Tablo 2 , protokolde (üst yarı) açıklanan örnek bir poli-transfeksiyon ve olası bir takip deneyi (alt yarı) için DNA oranı aritmetiğini gösterir.
1. Hücrelerin transfeksiyon için hazırlanması
- Protokolü başlatmadan önce insan embriyonik böbrek (HEK293) hücrelerinin kültürünün% 60 -% 80 oranında akıcı olduğundan emin olun. Bunu yapmak için, 2 gün önce 100 mm x 15 mm doku kültürü Petri kabında 1 x 106 hücre tohumlayın ve% 5 CO2 ile 37 ° C'de inkübe edin.
NOT: Protokolümüz HEK293 hücrelerine odaklansa da, diğer hücre tipleri ikame edilebilir. - Ortamı ve hücreleri aşağıda açıklandığı gibi transfeksiyonlar için hazırlayın.
- Dulbecco'nun modifiye kartal besiyeri (DMEM) çözeltisinin en az 20 mL'sini% 10 fetal sığır serumu (FBS) ve% 1 esansiyel olmayan amino asitler (NEAA; bakınız Malzeme Tablosu) ile 37 ° C'ye kadar önceden ısıtın. En az 2.4 mL Tripsin ve 2.4 mL fosfat tamponlu salin (PBS) ile 37 ° C'ye kadar önceden ısıtın. Ön ısıtma serum ortamını ~ 16 ° C'ye düşürdü.
NOT: Tüm doku kültürü çalışmaları bir biyogüvenlik kabininde özenle yapılmalıdır.
- Dulbecco'nun modifiye kartal besiyeri (DMEM) çözeltisinin en az 20 mL'sini% 10 fetal sığır serumu (FBS) ve% 1 esansiyel olmayan amino asitler (NEAA; bakınız Malzeme Tablosu) ile 37 ° C'ye kadar önceden ısıtın. En az 2.4 mL Tripsin ve 2.4 mL fosfat tamponlu salin (PBS) ile 37 ° C'ye kadar önceden ısıtın. Ön ısıtma serum ortamını ~ 16 ° C'ye düşürdü.
- DMEM çözeltisindeki hücreleri aşağıda açıklandığı gibi yeniden askıya alın.
- Mevcut medyayı aspire edin ve elden çıkarın. Hücreleri yıkamak için HEK293 hücre kültürüne 2 mL PBS dağıtın. PBS'yi aspire edin ve bertaraf edin.
- HEK293 hücre kültürüne 2 mL Tripsin dağıtın. Petri kabını 37 ° C'de bir inkübatöre 3 dakika boyunca veya hücreler artık yemeğe yapışmayana kadar yerleştirin. Çanağı biyogüvenlik kabinine geri koyun ve plakaya 8 mL DMEM çözeltisi dağıtarak hücre çözeltisini seyreltin.
- Çözeltiyi birkaç kez hafifçe yukarı ve aşağı pipetleyerek karıştırın. Tüm medyayı aspire edin ve 15 mL'lik bir konik tüpe yerleştirin.
- Hücreleri pelet haline getirmek için 3 dakika boyunca 300 x g'de santrifüjleyin. Medyayı aspire edin (hücreleri aspire etmemeye özen göstererek) ve atın. Hücreleri 5 mL DMEM çözeltisi içinde tekrar askıya alın, hafifçe yukarı ve aşağı pipetleyerek karıştırın.
- Otomatik bir hücre sayacı kullanarak geçerli hücre konsantrasyonunu tahmin edin ( Malzeme Tablosunda listelenmiştir). Altı kuyucuğu (bu örnekte) 1 x 105 hücreli 24 delikli bir plakaya (50.000 hücre/cm2 tohumlama yoğunluğu için) tohumlayın.
- DMEM çözeltisini 500 μL'ye kadar ekleyin (önce kuyucuklara DMEM çözeltisi ekleyin) ve ardından işlem başına bir kuyucuğu aşağıdaki gibi etiketleyin: renk kontrolü yok, mKO2 kontrolü, TagBFP kontrolü, NeonGreen kontrolü, tüm renk kontrolü ve çoklu transfeksiyon 1. TagBFP, mKO2 ve NeonGreen kontrol kuyuları, poli-transfeksiyona dahil olan tüm floresan proteinleri için tek renkli kontrollerdir.
2. Transfeksiyon yapılması
- Her DNA agregası için tüpler hazırlayın. 1,5 mL mikrosantrifüj tüplerini bir kenara bırakın ve tüpleri şu şekilde etiketleyin: renk kontrolü yok, mKO2 kontrolü, TagBFP kontrolü, NeonGreen kontrolü, tüm renk kontrolü, çoklu transfeksiyon karışımı 1 ve poli-transfeksiyon karışımı 2.
- Renk kontrolü, mKO2 kontrolü, TagBFP kontrolü, NeonGreen kontrolü ve tüm renk kontrol tüplerine 36 μL azaltılmış serum ortamı ekleyin. Poli-transfeksiyon karışımı 1 ve poli-transfeksiyon karışımı 2 tüplerinin her birine 18 μL indirgenmiş serum ortamı ekleyin.
NOT: Plazmid konsantrasyonlarının 150 ng/μL olduğu varsayılmaktadır. - Renk kontrol tüpüne 600 ng dolgu plazmidi ekleyin. mKO2 renk kontrol tüpüne 300 ng mKO2 ve 300 ng dolgu plazmidi ekleyin. TagBFP renk kontrol tüpüne 300 ng TagBFP ve 300 ng dolgu plazmidi ekleyin.
- NeonGreen renk kontrol tüpüne 300 ng yapısal NeonGreen plazmid ve 300 ng dolgu plazmidi ekleyin. Tüm renk kontrol tüpüne mKO2, TagBFP ve kurucu NeonGreen'in her biri 100 ng ve ayrıca 300 ng dolgu plazmidi ekleyin.
- Poli-transfeksiyon karışımı 1 tüpüne 150 ng mKO2 ekleyin. Poli-transfeksiyon karışımı 1 tüpüne 75 ng muhabir NeonGreen plazmid ve 75 ng dolgu plazmidi ekleyin.
- Poli-transfeksiyon karışımı 2 tüpüne 150 ng TagBFP ekleyin. Poli-transfeksiyon karışımı 2 tüpüne 75 ng L7ae plazmid ve 75 ng dolgu plazmidi ekleyin.
- Renk kontrolü, mKO2 kontrolü, TagBFP kontrolü, NeonGreen kontrolü ve tüm renk kontrol tüplerine 36 μL azaltılmış serum ortamı ekleyin. Poli-transfeksiyon karışımı 1 ve poli-transfeksiyon karışımı 2 tüplerinin her birine 18 μL indirgenmiş serum ortamı ekleyin.
- 216 μL indirgenmiş serum ortamını 9,48 μL transfeksiyon reaktifi ile birleştirerek 1,5 mL'lik bir mikrosantrifüj tüpünde transfeksiyon ana karışımını oluşturun (reaktif oranları ve reaksiyon ölçeklemesi için Tablo 1'e bakınız). Yukarı ve aşağı pipetleme yaparak iyice karıştırın ve bir kenara koyun.
- Renk kontrolü, tek renk kontrolü ve tüm renk kontrol tüplerinin her birine 1,58 μL arttırıcı reaktif ekleyin. Poli-transfeksiyon karışım tüplerinin her birine 79 μL arttırıcı reaktif ekleyin. Pipetleyerek her tüpü ayrı ayrı karıştırın.
- Transfeksiyon ana karışımını DNA içeren her tüpe ekleyin.
- Renk kontrolü olmayan, tek renk kontrolü ve tüm renk kontrol tüplerinin her birine 37,58 μL transfeksiyon ana karışımı ekleyin. Pipetleyerek her tüpü ayrı ayrı karıştırın.
- Poli-transfeksiyon karışım tüplerinin her birine 18.79 μL transfeksiyon ana karışımı ekleyin. Pipetleyerek her tüpü ayrı ayrı karıştırın.
- Transfeksiyon karışımlarını kuyucuklara dağıtın.
- Pipet, renksiz, tek renk ve tüm renk kontrolleri için her transfeksiyonun 65,97 μL'sini ilgili kuyucuklara karıştırır.
- Poli-transfeksiyonun 32.98 μL'lik pipeti, 1'i poli-transfeksiyon kuyusuna karıştırın ve kompleksleri etkili bir şekilde dağıtmak için plakayı düz bir yüzey boyunca sıkı bir şekilli sekiz şekilli desende hızlı ama nazikçe döndürün. Daha sonra, poli-transfeksiyonun 32.98 μL'lik pipeti, 2'yi aynı poli-transfeksiyon kuyusuna karıştırır ve plakayı aynı şekilde döndürür.
- Plakayı 37 ° C'de,% 5 CO2 ile ve sallamadan, 48 saatlik bir süre boyunca bir inkübatöre yerleştirin.
NOT: Hücre canlılığını arttırmak için, hücre ortamı transfeksiyondan sonra her 6 saatte bir değiştirilebilir (bu her zaman gerekli olmasa da ve HEK293 hücreleri ve türevleri ile, ortamı değiştirirken hücreleri plakadan ayırmamaya dikkat edilmelidir).
| Reaktif | Miktar | Ölçekleme | ||||
| DNA karışımı için azaltılmış serum ortamı | Kontrol tüpü başına 36 μL, poli-transfeksiyon tüpü başına 18 μL | 0,05 μL Pipetlemeyi hesaba katmak için %10-20 ekstra hacimle tüp başına azaltılmış serum ortam/ng DNA'sı | ||||
| DNA | Tüp başına 300-600 ng | |||||
| P3000 | Kontrol tüpü başına 1.58 μL, poli-transfeksiyon tüpü başına 0.79 μL | Tüp başına 0,0022 μL P3000/ng DNA, %10-20 ekstra | ||||
| Lipo master mix için azaltılmış serum ortamı | Kontrol tüpü başına 36 μL, poli-transfeksiyon tüpü başına 18 μL | 0,05 μL, serum ortam/ng toplam DNA'sını azalttı ve pipetlemeyi hesaba katmak için %10-20 ekstra hacim sağladı | ||||
| Transfeksiyon ve arttırıcı reaktif | Kontrol tüpü başına 1.58 μL, poli-transfeksiyon tüpü başına 0.79 μL | 0.0022 μL Lipofectamine 3000/ng DNA, %10-20 ekstra ile | ||||
Tablo 1: Transfeksiyonlar için reaktif ölçekleme. Tablo, tek bir kuyucukta bulunan DNA miktarı için dahil edilecek reaktifin doğru oranını göstermektedir. Bu, reaksiyonları etkili bir şekilde ölçeklendirmek ve ana karışımlar oluşturmak için kullanılabilir. Reaktif miktarları% 20'lik bir fazlalık içerecek şekilde ölçeklendirilmiştir.
3. Hücrelerin akış sitometrisi için hazırlanması
- DMEM çözeltisinin en az 4,2 mL'sini önceden 37 °C'ye ısıtın. En az 4.2 mL Tripsin ve 4.2 mL PBS'yi 37 °C'ye kadar önceden ısıtın. Floresan ile aktive hücre sıralama (FACS) tampon çözeltisini kullanıma hazır olana kadar 4 °C'de tutun.
- Topaklanmayı azaltmak için FACS tampon çözeltisindeki hücreleri (PBS% 1 BSA, 5 mM etilendiamintetraasetik asit [EDTA] ve% 0.1 sodyum azid [NaN3] ile desteklenmiş; Malzeme Tablosuna bakınız) yeniden askıya alın.
- Mevcut medyayı her bir kuyucuğa aspire edin ve bertaraf edin. Hücreleri yıkamak için her bir kuyucuğa 5 mL PBS dağıtın. PBS'yi aspire edin ve bertaraf edin.
- Her bir kuyucuğa 5 mL Tripsin dağıtın. Plakayı 3 dakika boyunca 37 ° C'de bir inkübatöre yerleştirin veya hücreler artık yemeğe yapışmayana kadar. Plakayı biyogüvenlik kabinine geri koyun ve her bir kuyucuğa 5 mL DMEM çözeltisi dağıtarak hücre çözeltilerini seyreltin.
- Her bir kuyucuk için, çözeltiyi birkaç kez yukarı ve aşağı hafifçe pipetleyerek karıştırın. Her kuyu için, tüm medyayı aspire edin ve 15 mL'lik bir konik tüpe yerleştirin.
- Hücreleri pelet haline getirmek için 3 dakika boyunca 300 x g'de santrifüjleyin. Medyayı aspire edin, hücreleri aspire etmemeye ve atmamaya özen gösterin. Her tüpte, hücreleri 5 mL FACS tampon çözeltisi içinde yeniden askıya alın, yavaşça yukarı ve aşağı pipetleyerek karıştırın.
- Her hücre süspansiyon çözeltisini bir süzgeçten geçirin (kümeleri çıkarmak için) ayrı akış sitometrisi konik tüplerine geçirin. Bu tüpleri buz üzerinde en fazla 1 saat tutun ve mümkün olan en kısa sürede akış sitometrisi yapın.
4. Akış sitometrisinin yapılması
NOT: Bir akış sitometresinin çalıştırılması, gerekli görevler hakkında uygun eğitim ve bilgi gerektirir. Yazılım ve ekipman değişiklik gösterebileceğinden ve kullanıcıların genel olarak eğitilmesi gerektiğinden, bu bölüm gerçekleştirilmesi yararlı olan belirli işlemleri ifade eder.
- İlk olarak, hücre özelliklerini seçmek ve anormalliklerden (agregalar, döküntüler vb. Dahil) kaçınmak için dolgu plazmid kontrolü (renk kontrolü yok) ile transfekte edilen hücreleri inceleyin. Hücreleri ayırt etmek için birçok parametre kombinasyonu olsa da, ayırt edici özellikleri görselleştirmek için iyi bir yol olarak aşağıdaki üç genel seçeneği kullanın.
- İleri saçılma alanına (doğrusal ölçek) karşı yan saçılma alanına (tercih/hücre tipi başına log veya doğrusal ölçek) bakın.
- Yan saçılma yüksekliğine (günlük ölçeği) ve yan saçılma genişliğine (doğrusal ölçek) bakın.
- İleri saçılma genişliğine (doğrusal ölçek) karşı ileri saçılma yüksekliğine (doğrusal ölçek) bakın.
- Ardından, tek renk denetimlerine bakın. Cihaz voltajlarını ayarlamak için tüm renk kontrolünü kullanın, böylece her floresan proteininden gelen sinyaller eşdeğer rastgele floresan birimlerine (a.u.) normalleştirilir. Ardından, kompanzasyon matrisini ayarlamak için kullanılan her floresan proteini için tek renk kontrollerini çalıştırın ve bu da taşma düzeltmesine izin verir.
NOT: İdeal olarak, floresan değerlerinin tam dinamik aralığı görünür olmalıdır. Floresan protein sinyallerinin daha da normalleştirilmesi, standartlaştırılmış birimlere (örneğin, eşdeğer floresein molekülleri [MEFL'ler; bakınız Beal ve ark.15]) dönüştürülerek yapılabilir. Analiz sırasında MEFL dönüşümünü etkinleştirmek için gökkuşağı kalibrasyon boncuklarını çalıştırın. Bu kalibrasyon aynı zamanda cihazdan cihaza ve günlük sinyal değişimini azaltmak için de yararlıdır16. - Poli-transfeksiyon numune tüpünü çalıştırın.
NOT: Mümkün olduğunda, 1.000 x 10^ (^ = karışımlar) hücrelerin çalıştırılması önerilir, çünkü daha yüksek boyutlu çoklu transfeksiyonların analiz sırasında daha fazla kutuya bölünmesi gerekir ve her bölmenin istatistiksel olarak anlamlı karşılaştırmalar yapmak için yeterli hücreye (ideal olarak >10) ihtiyacı vardır.
5. Deney sonrası analiz gerçekleştirme
- Başlangıçta, doğru sonuçlar elde etmek için kontrollerden (ve varsa boncuklardan) gelen verileri kullanın. Canlı hücre geçidi (yukarıda özetlenen kapıları kullanarak), telafi ve otomatik floresan düzeltmesi gerçekleştirmek için mevcut yazılım araçlarından birini kullanın.
NOT: Genellikle hem grafiksel bir kullanıcı arayüzüne hem de ön işleme aşaması ve çoklu transfeksiyon analizi için uygun bir python kütüphanesine sahip özel MATLAB kodunu (örneğin, https://github.com/jonesr18/MATLAB_Flow_Analysis veya Cytoflow17) kullanırız.
| Yöntem | Karmaşık | ng Floresan Marker | ng L7ae (fraksiyon) | ng Reporter (kesir) | ng Dolgu DNA'sı (fraksiyon) | Toplam (ng) |
| Poli-transfeksiyon 1 | 600 | |||||
| → | 1 | 150 | 75 (½) | 75 (½) | 300 | |
| → | 2 | 150 | 75 (½) | 75 (½) | 300 | |
| Poli-transfeksiyon 2 | 600 | |||||
| → | 1 | 150 | 25 (1/6) | 125 (5/6) | 300 | |
| → | 2 | 150 | 125 (5/6) | 25(1/6) | 300 |
Tablo 2: Protokolde gösterilen poli-transfeksiyon için DNA miktarları ve ayarlanmış plazmid oranları ile örnek bir takip deneyi. Tablonun üst yarısı, basit bir poli-transfeksiyon deneyinde kullanılan plazmidlerin bileşimini göstermektedir. Alt yarı, plazmid oranlarını, gen ekspresyon modülatörünün muhabirine göre daha optimal bir 1: 5 oranında olduğu varsayımsal bir konsantrasyon alanını daha iyi alt örneklemek için ayarlayan güncellenmiş bir deneyin bileşimini gösterir ve bu oran etrafında örneklemek için daha fazla transfekte hücre verir.
Sonuçlar
Şekil 1'de, ko-transfeksiyonu poli-transfeksiyonla karşılaştırıyoruz. Bir ko-transfeksiyonda, tüm plazmidler aynı transfeksiyon karışımında verilir, bu da herhangi bir hücrenin aldığı her plazmidin miktarı arasında yüksek korelasyon ile sonuçlanır (Şekil 1A). Her hücreye verilen toplam plazmidlerin sayısı önemli ölçüde değişmekle birlikte, popülasyondaki bireysel hücrelerdeki iki muhabir proteinin floresansı iyi ilişkilidir, bu da iki plazmidin oldukça sabit bir oranda birlikte verildiğini göstermektedir. Transfekte hücreler az sayıda veya daha fazla kompleks alabilir, ancak her kompleks her plazmidin ilişkili miktarlarına sahip olduğundan, ko-transfeksiyon sadece iki plazmid arasındaki konsantrasyon boşluğunun küçük bir diyagonal bölgesini araştırır. Buna karşılık, bir poli-transfeksiyonda, plazmidler çoklu transfeksiyon komplekslerinde verilir, bu da plazmidlerin farklı transfeksiyon karışımlarında korelasyonsuz olarak verilmesiyle sonuçlanır (Şekil 1B). Transfekte hücreler, komplekslerin farklı kombinasyonlarını alır, bu da hiçbirinden, birinden veya her ikisinden de farklı dozlarda plazmid içeren hücrelerle sonuçlanır.
Şekil 2'de temsili bir çoklu transfeksiyon iş akışı gösterilmektedir. Genel olarak, bir poli-transfeksiyon deneyi aşağıdaki adımlardan oluşur: problemi tanımlayın, transfeksiyon karışımlarını oluşturun, hücreleri inkübe edin, akış sitometrisi ve analiz. İlk poli-transfeksiyon sonuçları optimum parça oranlarını tam olarak daraltamazsa, poli-transfeksiyonu optimize edilmiş parça oranlarıyla tekrarlamak için isteğe bağlı bir adım da vardır. Bu adımlar protokolde özetlenmiştir.
Şekil 3'te, iyi gerçekleştirilen ko- ve poli-transfeksiyonlara ve yaygın hatalara bazı örnekler verilmiştir. Şekil 3A, birlikte verilen TagBFP ve eYFP eksprese eden plazmidler arasında sıkı bir korelasyon ile iyi gerçekleştirilmiş bir ko-transfeksiyonu göstermektedir. Buna karşılık, Şekil 3B'deki ko-transfeksiyon, bu iki plazmid arasında zayıf korelasyon göstermektedir. Gösterilen şekilde, zayıf korelasyon, plazmidler eklenmeden önce azaltılmış serum ortamına arttırıcı reaktif eklenmesinden kaynaklanmaktadır. Deneylerdeki bu zayıf korelasyon, floresan proteinlerinin ekspresyonunu yönlendiren farklı promotörlerden, transfeksiyon karışımı oluşturma sırasında zayıf karıştırmadan veya kompleksin çok kısa veya çok uzun bir aralıkta inkübe edilmesine izin vermekten de kaynaklanabilir.
Şekil 3C , iki boyutlu uzayın iyi bir şekilde kapsanması ve floresan proteinler arasındaki herhangi bir spektral kanamanın iyi bir şekilde telafi edilmesi ile iyi gerçekleştirilmiş bir poli-transfeksiyonu göstermektedir. Şekil 3D , analiz için her bir bölmede yeterli sayıda hücre bulunan yeterli sayıda kutuya bölünmesi zor olan düşük sayıda canlı hücreye sahip poli-transfeksiyon verilerini göstermektedir. Bu sorunu iyileştirmek için, başlangıç hücre popülasyonu sağlıklı olmalı ve fazla büyümemeli ve farklı bir transfeksiyon reaktifi kullanılarak ve / veya daha az toplam DNA ile transfekte edilerek deneysel toksisite azaltılmalıdır. Şekil 3E , transfeksiyon verimliliğinin zayıf olduğu ve analiz için iki boyutlu uzayın seyrek kapsama alanına neden olan bir poli-transfeksiyonu göstermektedir. Bu durumda, morfoloji geçidini geçen hücrelerin sayısı yüksektir, ancak hücreler floresan proteinleri eksprese etmez. Verimliliği artırmak için, transfeksiyon reaktifi seçimi optimize edilmeli ve üreticinin protokolü yakından takip edilmelidir. Her transfeksiyon karışımı eşdeğer miktarda DNA kütlesi içermeli, bu da hücrelerin her bir kompleks tipini alma şansının yaklaşık olarak eşit olmasını sağlamalıdır ve her transfeksiyon karışımı kit talimatlarına uygun olarak yapılmalıdır. Farklı transfeksiyon kitleri farklı hücre tipleri için idealdir; İlgilenilen hücre tipinde en iyi verimi veren kit kullanılmalıdır. Son olarak, kullanılan kitten bağımsız olarak bazı hücre tiplerinin transfektasyonu zordur. Bu durumlarda, daha fazla sayıda hücre transfekte edilmeli ve analiz edilecek yeterli sayıda hücre sağlamak için akış sitometrisi sırasında mümkün olduğunca çok sayıda hücre toplanmalıdır. Şekil 3F , floresan protein belirteçlerinden birinin başka bir floresan proteinine spektral kanamayı açıkça gösterdiği poli-transfeksiyon verilerini göstermektedir. Sistemdeki tüm floresan proteinleri için her zaman tek renk kontrolleri çalıştırılmalı ve analizden önce tüm poli-transfeksiyonlara uygulanması gereken bir kompanzasyon matrisi oluşturmak için kullanılmalıdır.
Poli-transfeksiyon deneylerini ilk kez gerçekleştirirken (genel olarak veya yeni bir deneysel sistem için), standart ko-transfeksiyona karşı kıyaslama yapılmalıdır. Bir yaklaşım, hem ko-transfeksiyon (DNA dozajlarını ayarlayarak ) hem de poli-transfeksiyon kullanarak anahtar sistem parçaları için giriş-çıkış transfer fonksiyonunu ayrı ayrı ölçmektir.
Şekil 4'te, orijinal poli-transfeksiyon yayını10'dan uyarlanan translasyonel baskılayıcı L7Ae'nin kıyaslamasını gösteriyoruz. L7Ae, RNA bükülme-dönüş (KT) motiflerini tanıyan bir RNA bağlayıcı proteindir20; iki KT (2xKT) bir mRNA'nın 5' çevrilmemiş bölgesine (UTR) yerleştirildiğinde, aşağı akış açık okuma çerçevesi (ORF) çevirisi L7Ae21 tarafından etkili bir şekilde bastırılabilir. L7Ae daha önce RNA tabanlı hücre tipi sınıflandırıcıları21 ve diğer RNA tabanlı devreler22'yi oluşturmak için kullanılmıştır. L7Ae'yi standart ko-transfeksiyonla test etmek için, L7Ae'yi kodlayan plazmidlerin ve hedef raporlayıcısının oranlarını farklı transfeksiyon karışımları içinde ayarlayabilirsiniz (Şekil 4A ve Tablo 3). Poli-transfeksiyon için, bağımsız olarak kurucu L7Ae ve karşılık gelen 2xKT muhabirini ayrı transfeksiyon karışımlarında vermelidir, böylece hücrelere çok çeşitli plazmid oranları verilir (Şekil 4B). Transfeksiyon ve akım sitometrisi yapıldıktan sonra veri analizi yapılabilir. Verileri karşılaştırılabilir hale getirmek için, bireysel birlikte transfeksiyon sonuçlarını tek bir veri kümesinde harmanlayabilir, ardından çoklu transfeksiyon verilerine benzer bir çok boyutlu bağlama gerçekleştirebilir (Şekil 4C, D). Çıkış raporlayıcısını baskılayan L7Ae'nin doz-yanıt eğrileri karşılaştırıldığında, bin başına medyan çıkış seviyesinin ko-transfeksiyon ve poli-transfeksiyon verileri arasında çok benzer olduğu görülebilir (Şekil 4E-G).
Genel olarak, poli-transfeksiyon verilerinin, geniş DNA oranlarındaki ko-transfeksiyon verileriyle, yüksek derecede çarpık DNA dozaj oranlarında daha az hassasiyetle iyi bir şekilde ilişkili olduğunu gördük (kısmen, poli-transfeksiyon deneyleri için kutulardaki daha düşük hücre kapsamı nedeniyle, özellikle düşük plazmid dozajlarında çok güçlü bir şekilde aktif olan parçalar için). Bu tür hassas parçaların ölçüm doğruluğunu artırmak için, ifade seviyeleri daha zayıf bir promotör, yukarı akış açık okuma çerçeveleri18 veya mikroRNA susturma aracılı ince ayarlayıcılar (miSFIT'ler)19 ile azaltılabilir.
Şekil 5, yine Gam ve ark. 10'dan uyarlanmış bir hücre tipi sınıflandırıcısının optimizasyonu için başarılı bir poli-transfeksiyon uygulamasını göstermektedir. Sınıflandırıcı, birçok tümör hücresinde aşırı eksprese edilen bir miRNA olan miR-21-5p'nin ekspresyonuna yanıt olarak bir çıktı üreten nispeten basit bir tasarımdır23. MiR-21'in yokluğunda, sınıflandırıcı çıktısı, adaptasyonunun daha önce memeli hücrelerinde çalıştığı gösterilen bakteriyel olarak türetilmiş bir transkripsiyonel baskılayıcı olan BM3R124 tarafından bastırılır25. MiR-21 mevcut olduğunda, BM3R1'in hem 3' hem de 5' UTR'lerine yerleştirilen dört hedef bölgeyi bağlar, ifadesini düşürür ve böylece çıkış transkripsiyonuna izin verir (Şekil 5A). Bu sistemi optimize etmek için, üç devre bileşeni ayrı transfeksiyon karışımlarında teslim edildi: (1) BM3R1 (miR-21 hedef bölgeleri ile), (2) çıkış muhabiri (mKO2) ve (3) Gal4-VP16, çıktının transkripsiyonunu etkinleştirir (Tablo 4). Çıkış promotörünün Gal4-VP1625 varlığında bile çıkışı bastıran BM3R1 değil, mantık (Gal4-VP16) üzerinde çalıştığını unutmayın. Her parça, her bir kompleksin göreceli DNA dozajını belirtmek için aynı plazmid üzerinde sırasıyla bir transfeksiyon belirteci olan TagBFP, mNeonGreen ve iRFP720'yi kodlar. Genel olarak, artan Gal4-VP16 ifadesi muhabir mKO2 çıkışını artırmalı, artan BM3R1 ifadesi ise daha düşük mKO2 çıkışına neden olmalıdır. BM3R1, miR-21-5p tarafından yıkıldığından, çıkış ekspresyonu, daha yüksek miR-21-5p seviyelerine sahip olan ve bu nedenle HEK hücrelerinden daha az BM3R1 eksprese eden HeLa hücrelerinde daha yüksek olmalıdır.
Hem HEK293 hem de HeLa hücrelerine poli-transfeksiyondan sonra, farklı plazmid oranlarının 3D dağılımını elde ettik (Şekil 5B-HEK hücreleri). Gam ve ark.10 , bu dağılımı, belirli bir Öklid uzaklığındaki hücreleri bir ilgi oranından dikkate alarak çeşitli oranlarda alt örnekleme; Bu mesafe, analizden istatistiksel olarak anlamlı sonuçlara izin verecek kadar hücre içerecek kadar geniş olmalı, ancak gereksiz gürültünün üç parçanın çok geniş bir bileşen oranları kümesini içermesini önlemek için yeterince dar olmalıdır. Gam ve ark.10 daha sonra ko-transfeksiyon için sınıflandırma doğruluğunu en üst düzeye çıkaran parçaların oranını tanımlamak için bir optimizasyon algoritması kullandılar (yani, transfekte HeLa hücreleri çıkış ekspresyonu için pozitifken, transfekte HEK hücreleri değildir). Parçaların optimal oranı 10.9:1.5:1: Gal4-VP16:output:BM3R1; Tüm poli-transfeksiyon alanı içindeki optimal oran etrafında alt örneklenen hücreler Şekil 5C'de gösterilmiştir. Bu alt örnekleme, bu oranda, birlikte transfekte edilen devrenin, HEK293'ü HeLa hücrelerine karşı sınıflandırırken% 91 özgüllüğe,% 62 duyarlılığa ve% 77 doğruluğa sahip olduğunu öngörmüştür (Şekil 5D). Bu optimuma ayarlanmış plazmid oranları ile birlikte transfeksiyon daha da iyi sonuçlar verdi: %99 özgüllük, %68 duyarlılık ve %84 doğruluk10. Ayrıca, oranlar devrenin tek plazmidli bir versiyonunun uygulanmasına rehberlik etti, farklı kesilmiş promotörler ve yukarı akış ORF'leri (uORF'ler) kullanılarak göreceli ifade ayarlandı ve% 91 özgüllük,% 90 hassasiyet ve% 90 doğruluk10 ile bir devre elde edildi. Bu nedenle, poli-transfeksiyon, hücre sınıflandırıcılarının ve gen devrelerinin tasarımını daha geniş bir şekilde yönlendirmek için güçlü bir araçtır.

Şekil 1: Ko-transfeksiyon ve poli-transfeksiyonun karşılaştırılması . (A,B) Plazmid dağıtımına iki plazmidin ko-transfeksiyonu ve iki plazmidin poli-transfeksiyonu ile genel bakış ve karşılaştırma. Her transfeksiyon yöntemi için, en soldaki diyagram, negatif yüklü DNA ve pozitif yüklü lipitler arasındaki transfeksiyon komplekslerinin oluşumunu göstermektedir. Bu örneklerde, her renkli plazmid (mavi ve kırmızı) farklı bir floresan proteininin ekspresyonunu kodlar. Merkez diyagramı, hücrelere plazmid dağıtımının örneklerini ve ayrıca bir histogram veya dağılım grafiğinde beklenen dağılımlar için bir şema gösterir. Histogramdaki renk yoğunluğu, karşılık gelen plazmid renginden floresana karşılık gelir. En sağdaki diyagram, verilen her yöntem kullanılarak transfekte edilen hücrelerden gelen gerçek verileri gösterir. (A) İki farklı plazmid ile birlikte transfeksiyonda, transfeksiyon reaktifi eklenmeden önce her iki plazmid birlikte karıştırılır, bu da iki plazmid türünün yüksek oranda korelasyonlu paketlenmesine neden olur. Gerçek ko-transfeksiyon verilerinde, hücreler her iki plazmidin korelasyonlu sunumunu sergiler (sağda). (B) Bir poli-transfeksiyonda, bir devre parçasına ve bir transfeksiyon markörüne karşılık gelen her bir birlikte verilen plazmid seti, transfeksiyon reaktifi ile ayrı ayrı karıştırılır ve bu da sadece bu plazmidleri içeren komplekslerle sonuçlanır (solda). Gerçek poli-transfeksiyon verilerinde, hücreler aynı anda araştırılan birçok farklı plazmid stokiyometrisi ile geniş bir konsantrasyon alanı yelpazesini araştırırlar (sağda). Bu rakam10'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 2: Poli-transfeksiyon iş akışı. Adım 1: Sorunu tanımlayın. Parçalar arasındaki ideal oranın bilinmediği birden fazla bileşen parçasına sahip bir sistemle başlayın ve bileşen parçaları arasında bir başlangıç oranı seçin. Adım 2: Transfeksiyon karışımlarını oluşturun. Her transfeksiyon karışımı bir devre bileşeni ve bir floresan transfeksiyon işaretleyicisi içerir. Bir hücreye verilen devre parçasının miktarı, işaretleyicinin floresansı ile ilişkilidir. Adım 3: Hücreleri inkübe edin. Tipik bir iş akışında, hücreleri transfeksiyon ve akış sitometrisi arasında 48 saat boyunca inkübe ediyoruz. Adım 4: Akış sitometrisi. Protokolde açıklandığı gibi uygun denetimleri çalıştırın ve ardından örnekleri çalıştırın. Adım 5: Analiz.Hücrenin aldığı parçaların miktarına veya oranlarına göre hücreleri bölmek için transfeksiyon işaretleyicilerini kullanın. Devre performansını ölçmek için çıkış proteinlerini kullanın. Devre performansını optimize eden parçaların kutularını/oranlarını bulun. Adım 6: Optimize edilmiş parça oranlarıyla tekrarlayın (isteğe bağlı). Optimum kutular/oranlar çok çarpık oranlardaysa, pilot poli-transfeksiyon optimal parça oranlarını tam olarak daraltmayabilir. Poli-transfeksiyonu ayarlanmış parça oranlarıyla tekrarlayın, böylece her transfeksiyon karışımından eşit miktarda alan bir hücre, önceki turda belirlendiği gibi, artık optimuma yakın bir parça oranı alır. Bu rakam10'dan değiştirilmiştir. Bir inkübatörün görüntüsü Servier Medical Art'tan ve BioRender'dan bir sitometrenin görüntüsü kullanıldı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
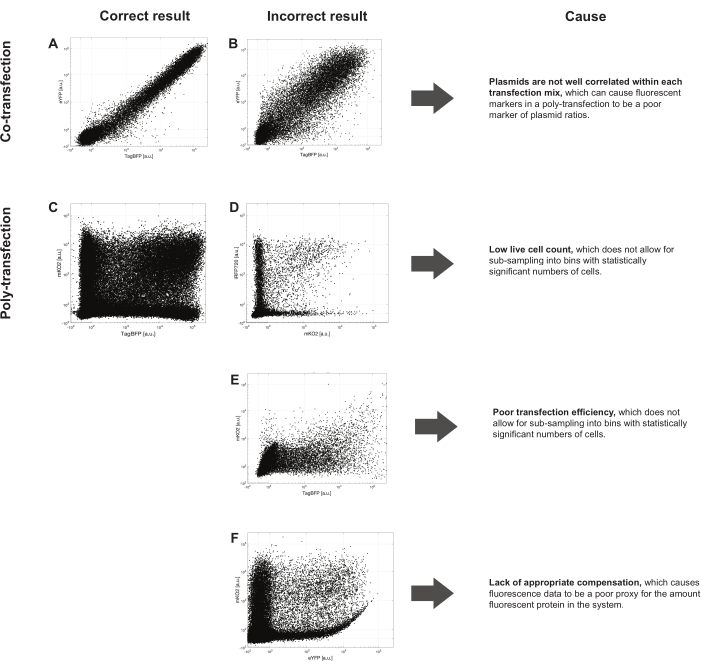
Şekil 3: Temsili pozitif ve negatif poli-transfeksiyon sonuçları . (A) İki floresan muhabirin sıkı bir korelasyon gösteren iyi yapılmış birlikte transfeksiyonu. Karşılaştırma için hem burada hem de (B) içinde toplam 20.000 hücre çizilmiştir. Plazmidlerin transfeksiyon karışımları içinde iyi korelasyon gösterdiğinden emin olmak için, bir poli-transfeksiyon deneyine başlamadan önce iki floresan muhabirin benzer bir küçük deneme birlikte transfeksiyonunu gerçekleştirmek iyi bir fikirdir. (B) Daha gürültülü ko-transfeksiyon: plazmidler her transfeksiyon karışımı içinde iyi korelasyon göstermez, bu da bir poli-transfeksiyondaki floresan belirteçlerin plazmid oranlarının zayıf bir belirteci olmasına neden olabilir. (C) İyi hücre sayısı, transfeksiyon etkinliği ve kompanzasyon gösteren iyi yapılmış çoklu transfeksiyon sonuçları. (D) İstatistiksel olarak anlamlı sayıda hücreye sahip kutulara alt örneklemeye izin vermeyen düşük canlı hücre sayısı. (E) İstatistiksel olarak anlamlı sayıda hücreye sahip kutulara alt örneklemeye izin vermeyen zayıf transfeksiyon verimliliği. (F) Floresan verilerinin sistemdeki floresan protein miktarı için zayıf bir vekil olmasına neden olan uygun tazminat eksikliği. İdeal bir doğrusal kompanzasyon matrisi belirlemek için tek renk kontrollerini kullanın ve daha fazla işlemeden önce verilere uygulayın. Yazılım seçimine bağlı olarak tüm renk kontrolleri de önerilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: Poli-transfeksiyonun ko-transfeksiyona karşı karşılaştırılması. (A) Bir ko-transfeksiyonda, translasyonel baskılayıcı L7Ae'nin floresan muhabir plazmidlere bir oranı, her deney kuyusunda test edilebilir. (B) Poli-transfeksiyonda, L7Ae'nin muhabirlere olan birçok oranı aynı kuyuda test edilebilir. Poli-transfeksiyon plazmid karışımlarının ayrıntıları için Tablo 3'e bakınız. (C,D) Çoklu transfeksiyonu çoklu ko-transfeksiyonlarla karşılaştırmak için gruplama iş akışı. Her bir transfeksiyon işaretleyici boyutu için, iki plazmidin her birinin seviyelerine yaklaşan toplam 10 adet çift taraflı aralıklı kutu atandı. Burada, farklı plazmid #2 seviyelerini gösteren kutular gösterilmektedir. Binning, hem çeşitli plazmid oranlarını (C) kapsayan harmanlanmış 11 ko-transfeksiyon örneği seti hem de her biri yaklaşık 500.000 hücreden (D) oluşan tek bir poli-transfeksiyondan elde edilen veriler üzerinde gerçekleştirildi. Renkler, gen 2 (TagBFP) seviyeleri tarafından tanımlanan kutu kümelerine karşılık gelir. (E-G) Temsili bir devre için poli-transfeksiyon ile ko-transfeksiyonun karşılaştırılması. Her bir kutudaki hücreler için medyan çıkış floresansı değerlendirildi ve temsili sistem L7Ae translasyonel baskılama yöntemleri arasında karşılaştırıldı. (E) L7Ae aktivitesini ölçmek için yapılar. mKO2 floresansı, L7Ae'nin (gen # 1) verilmesi için bir tahmin görevi görürken, TagBFP floresansı, düzenlenmiş mNeonGreen çıktısının (gen # 2) verilmesi için bir tahmin görevi görür. (F) L7Ae için çok boyutlu titrasyon eğrileri. Her satır, (C) ve (D) bölümlerinde gösterildiği gibi TagBFP'nin bir düzeyindeki bölme kümesini temsil eder. Düz çizgiler çoklu transfeksiyon verilerini, kesikli çizgiler ise ko-transfeksiyon verilerini gösterir. Her bir ciltlenmiş muhabir plazmidi seviyesinde, L7Ae arttıkça muhabir çıkışı azalır. (G) L7Ae sistemi için ko-transfeksiyon ve poli-transfeksiyon arasındaki görsel karşılaştırma. Her nokta, daha fazla eşdeğer değerin kırmızı 1: 1 çizgisine daha yakın olduğu poli-transfeksiyon ve ko-transfeksiyon ölçümleri için karşılık gelen kutularda ölçülen çıktıyı temsil eder. Genel olarak, poli-transfeksiyon ve ko-transfeksiyon kaynaklı arasında gözlenen farklılıklar düşüktür, bu da poli-transfeksiyon yönteminin güvenilirliğine güven sağlar. Bu rakam10'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Poli-transfeksiyon için veri analizi. Poli-transfeksiyonda, hücreler analiz için kutular veya dilimler halinde gruplandırılabilir. Şekil 4 , hücrelerin, model uyumu ve dozaj yanıtlarını anlamak için yararlı olabilecek raporlayıcı plazmid seviyesi gibi bir sistem bileşeninin seviyelerine karşılık gelen dilimler halinde bağlandığı bir analiz biçimini göstermektedir. Bir başka yararlı strateji, devre bileşenlerinin farklı oranlarında devre performansını analiz etmektir. (A) Optimizasyon için bir sınıflandırıcı devrenin diyagramı. TagBFP, NeonGreen ve iRFP720 seviyeleri sırasıyla BM3R1, çıkış mKO2 ve Gal4-VP16 seviyelerine karşılık gelir. Poli-transfeksiyon plazmid karışımlarının ayrıntıları için Tablo 4'e bakınız. (B) Poli-transfeksiyon karışımlarının deneysel kurulumu. (C) (A)'daki devre ile poli-transfeksiyondan toplanan akış sitometri verileri. HEK hücrelerine devre poli-transfeksiyonunun bir sonucu olarak üç muhabir floresan proteininin her birinin seviyeleri, verilerde bulunan çok çeşitli devre bileşen oranlarını göstermektedir. Benzer sonuçlar hem HEK hem de HeLa hücrelerinde devre transfeksiyonundan elde edildi. (D) Belirli bir oranda poli-transfeksiyon alt örneklemesi. Verileri analiz etmek için, devre bileşenleri arasındaki çok sayıda oranı taradık ve her oranda sınıflandırıcı performansını belirledik. Örnek olarak, burada iyi performans gösteren belirli bir oranı gösteriyoruz (Gal4-VP16 = 435 ng DNA, muhabir = 60 ng ve BM3R1 = 40 ng). Mavi renkte çizilen, üç farklı devre bileşeni için floresan işaretleyicilerin karşılık gelen oranıdır. Daha sonra, verileri yalnızca floresan yörüngesinden belirli bir Öklid mesafesi içindeki noktaları göz önünde bulundurarak alt örneklemeyi yaptık. Hem HEK hem de HeLa transfeksiyonlarından aynı yörüngedeki hücreleri alt örneklemeyi yaptık. (E) HEK ve HeLa hücrelerinde aynı yörüngedeki devre performansının karşılaştırılması. Birçok oranda hassasiyet, özgüllük ve sınıflandırmanın doğruluğu gibi istatistikleri karşılaştırarak, bileşen oranları ideal bir genetik devre oluşturmak için optimize edilebilir. Bu rakam10'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Karmaşık | ng L7Ae plazmid | ng Reporter plazmid | OptiMEM (μL) | P3000 (μL) | Lipo 3000 (μL) |
| 1 | 250 | 75 | 1.5 | 1.5 | |
| 2 | 250 | 75 | 1.5 | 1.5 |
Tablo 3: Şekil 4'e karşılık gelen transfeksiyon karışımları. HEK293 hücreleri, 24 delikli bir plakanın bir kuyucuğunda bu transfeksiyon karışımları ile çoklu transfekte edildi.
| Karmaşık | ng BM3R1 plazmid | ng Gal4-VP16 plazmid | ng Reporter plazmid | OptiMEM (μL) | P3000 (μL) | Lipo 3000 (μL) |
| 1 | 900 | 75 | 1.5 | 1.5 | ||
| 2 | 900 | 75 | 1.5 | 1.5 | ||
| 3 | 900 | 75 | 1.5 | 1.5 |
Tablo 4: Şekil 5'e karşılık gelen transfeksiyon karışımları. HEK293 ve HeLa Hücrelerinin her biri, 6 delikli bir plakanın her birinde bir kuyucukta bu transfeksiyon karışımları ile poli-transfekte edildi.
Tartışmalar
Bilgisayar destekli tasarım (CAD), breadboard ve 3D baskı gibi hızlı prototipleme yöntemleri mekanik, elektrik ve inşaat mühendisliği disiplinlerinde devrim yarattı. Belirli bir zorluğa yönelik birçok olası çözümü hızlı bir şekilde arama yeteneği, bir alandaki ilerlemeyi büyük ölçüde hızlandırır. Poli-transfeksiyonun, genetik devrelerin hızlı prototiplenmesini sağlayan biyolojik mühendislik için benzer bir teknoloji olduğuna inanıyoruz. Ek olarak, diğer hızlı prototipleme teknolojileri, birden fazla olası çözümün uygulamalı sıralı yinelemesini gerektirirken, çoklu transfeksiyon aynı anda birçok çözümü keşfedebilir. Poli-transfeksiyon, çok sayıda genetik devre bileşen oranı kombinasyonunun tek bir kuyucukta test edilmesini sağlar ve yayınlanmış birkaç genetik devreyi optimize etmek için kullanılmıştır10,11,13. Deneysel protokol, standart birlikte transfeksiyonun basit bir uzantısıdır ve birçok memeli hücre araştırmacısı tarafından doğrudan benimsenmesine izin verir. Genel olarak, poli-transfeksiyon ve ko-transfeksiyon sonuçları arasında çok yakın bir anlaşma görülmektedir10 (bir örnek Şekil 4'tür). Bu nedenle, poli-transfeksiyon, plazmid oranlarının ko-transfeksiyon karışımları içinde titre edildiği ve çıktıların tek hücre seviyesinde ölçüldüğü çoğu durumda kullanılabilir.
Çoklu transfeksiyonun karmaşıklığı ve ölçeği, optimize etmek için genetik devrelerin karmaşıklığı ile birlikte artar. Analiz edilecek boyutların sayısı arttıkça, farklı parçaların kombinatoryal oranları ve analizleri için gereken hücre sayısı katlanarak artar. Örneğin, Şekil 5'teki sınıflandırıcıyı optimize etmek için, hücreler 6 delikli bir plaka biçiminde transfekte edildi ve en az 1,5 milyon canlı hücre hakkında veri toplandı. Ayrıca, 10 cm'lik bir plaka ölçeğinde transfeksiyon ve milyonlarca hücrenin toplanmasını gerektiren ek bir devre bileşeni10 ile bir sınıflandırıcıyı optimize ettik. Bu ölçekte ve üstünde, DNA üretimi zaman alıcıdır ve transfeksiyon reaktifleri pahalıdır. Bununla birlikte, poli-transfeksiyon, bireysel kuyucuklarda karşılaştırılabilir sayıda devre bileşeni oranı kombinasyonunu test etmekten daha az hücre, DNA ve transfeksiyon reaktifleri kullanır. Ek olarak, büyüklük sıraları daha az transfeksiyon karışımı yapılarak önemli miktarda zaman tasarrufu sağlanır.
Poli-transfeksiyon, akış sitometri verileri için gelişmiş analiz yöntemleri sağlar. İki ana yaklaşım, (1) her bir transfeksiyon belirtecinin ekspresyonuna göre hücreleri bağlamak ve (2) transfeksiyon belirteçlerinin tanımlanmış oranlarında hücreleri ekstrakte etmek, böylece ko-transfeksiyonu simüle etmektir. İlki, her kompleks (ve dolayısıyla her bir parça) için belirli bir DNA dozajı kombinasyonuna sahip hücreleri seçer ve giriş-çıkış transfer fonksiyonları verir. İkincisi, hücreleri her parça için DNA dozajlarının belirli bir oranında seçer ve plazmid DNA kütlelerinin böyle bir oranında birlikte transfeksiyonu simüle eder. Alt örneklenmiş seçimlerde devre çıkış raporlayıcılarının ifade düzeyini çizmek, girişlerin tanımlanmış düzeylerinde veya oranlarında bir çıktı ölçüsü verir. Devre optimizasyonu için, devrenin amacına göre tanımlanan en iyi performans gösteren kutular / oranlar tanımlanabilir - hücre sınıflandırıcıları söz konusu olduğunda, bunlar devrenin hedef hücre tipinde AÇIK ve hedef olmayan hücre tiplerinde KAPALI olduğu kutular / oranlardır. Bir bölme boyutu seçerken, gerekli hassasiyet düzeyinin yanı sıra kutu başına düşen hücre sayısı da dikkate alınmalıdır. Daha küçük kutular, devre bileşenlerinin ideal kombinasyonuna daha hassas bir şekilde odaklanır, ancak bir kutuda çok az hücre varsa, ölçümlere istenmeyen gürültü getirebilir.
Poli-transfeksiyon verilerinin hesaplamalı analizinde gelecekteki gelişmeler, bin / oran başına düşük hücre kapsama alanı ile bile optimizasyonu kolaylaştırabilir. Şu anda, aşırı gürültülü ölçümlerden kaçınmak için belirli bir hücre eşiğinden (ör. 10) daha az hücre eşiğine sahip kutulardaki verileri hariç tutuyoruz. Tekrarlanan ölçümlerle birlikte bu, doz-yanıt eğrilerinin, sınıflandırıcı doğruluklarının ve kutu başına tanımlanan diğer metriklerin daha doğru ve hassas bir şekilde hesaplanmasını sağlar. Bununla birlikte, poli-transfeksiyondaki her hücre, devre çıkışlarını hassas bir giriş seviyesinde ince bir çözünürlükte ölçen bağımsız bir deney olarak düşünülebilir. Bunu akılda tutarak, doz yanıtlarının ve devre optimizasyonlarının mekanik ve fenotipik modelleri, gen ekspresyonunun her bir belirteç ve raportörden dağılımına, binlenmiş özet istatistiklerinden ziyade, doğrudanuyabilir10. Bu, daha sağlam ölçümler sağlar ve deney başına toplanan birçok bireysel veri noktasından yararlanır. Bu tür modelleme yaklaşımları, seyrek örneklenmiş yüksek boyutlu poli-transfeksiyonlarla bile öngörücü devre karakterizasyonu ve optimizasyonu sağlayabilir. Ayrıca, yanıt yüzeyi metodolojisi ve rastgele orman regresyonu gibi makine öğrenimi yöntemleri, nispeten seyrek, yüksek boyutlu verileri analiz etmek için kullanılabilir10.
Giderek daha büyük olan poli-transfeksiyonlara alternatif bir yaklaşım, poli-transfeksiyon hiyerarşilerini kullanarak devreleri sırayla optimize etmektir. Bu yaklaşımda, ilk olarak, daha büyük bir devre içindeki genetik bileşenlerin bir alt kümesini içeren bir modülü optimize etmek için poli-transfeksiyon kullanılır. Daha sonra, bu optimize edilmiş modüller ayrı poli-transfeksiyon karışımları olarak teslim edilir ve her devre modülünün optimum oranını / dozajını bulmasını sağlar. Bu yaklaşım, önemli ölçüde daha az sayıda hücre, DNA ve transfeksiyon reaktifi kullanır. Bununla birlikte, bileşen grupları diğer bileşenlere göre modüler olmak zorunda değildir ve bu nedenle izolasyonda ölçülen bir modüldeki bileşen parçalarının optimal oranı, daha büyük devre bağlamı8 içinde yetersiz olabilir.
Poli-transfeksiyon yöntemleri, veri toplamak için kullanılan akış sitometresinin lazer/filtre konfigürasyonu ile de sınırlıdır. Ölçülen floresan çıkışlarına ek olarak, her transfeksiyon karışımı bir floresan protein belirteci içerir. Bu nedenle, sitometrede iyi telafi edilebilen floresan proteinleri seçmek çok önemlidir. Daha önce beş lazerli bir akış sitometresinde (BD LSRFortessa) 22 floresan proteinden oluşan bir panelin kanamasını sistematik olarak analiz ettik ve Sirius, TagBFP, mNeonGreen, mKO2 ve iRFP720 setinin birlikte kullanılabileceğini ve önemli sorunlar olmadan iyi bir şekilde telafi edilebileceğini bulduk10. Bununla birlikte, daha büyük devrelerin optimizasyonu, floresan proteinlerini daha fazla örtüşen spektrumla ayırmak için spektral sitometri gibi gelişmiş sitometri yöntemleri gerektirebilir ve laboratuvarımız şu anda sekiz floresan proteini ile optimize etmektedir. Floresan protein veritabanı (https://www.fpbase.org) gibi veritabanları, belirli spektral örtüşmeye sahip floresan proteinleri seçmek için kullanışlıdır. Bununla birlikte, bu süreç, bazıları belirli sitometrelere özgü olan çeşitli faktörlerle karmaşık olabilir. Örneğin, tdDomates gibi bazı kırmızı proteinlerin kullanımı, yalnızca belirli lazer/filtre konfigürasyonlarında mavi kanallara istenmeyen kanamaya neden olabilir10. Ek olarak, birkaç uzak kırmızı protein, DNA dozu ile floresan çıktısı10 arasında doğrusal olmayan ilişkiler göstermiş ve DNA dozajı için etkili belirteçler olarak kullanımlarını azaltmıştır.
Farklı sayıda kompleksle (bir, iki, üç, vb.) gerçekleştirilen deneyler arasında tutarlılık için, transfeksiyon karışımı başına aynı fraksiyonel miktarda plazmid kullanmak yararlıdır. Örneğin, üç plazmidden birinde (A, B ve C) kodlanmış her bir gen ile üç genli bir sistemi test edersek, devre plazmidlerini 1: 1: 1 oranında bir transfeksiyon işaretleyicisini kodlayan bir plazmidin eşit bir oranıyla birlikte birlikte transfekte edebilir. Bu, her plazmidi karışımın toplam kütlesinin dörtte birini ve dolayısıyla oluşan her transfeksiyon kompleksinin kütlesinin yaklaşık dörtte birini yapar. A, B ve C'yi kendi muhabirleriyle ayrı komplekslerde çoklu transfekte ederken, plazmidleri 1: 1'i muhabirlerle karıştırmak veya toplam DNA kütlelerini korumak yerine, her plazmidi her kompleksin kütlesinin dörtte birinde tutmak, dolgu DNA'sının kalan kütleyi alması daha tutarlıdır (örnekler için Tablo 5'e bakınız). Bunun nedeni, gen ekspresyonunun transfekte hücreler arasındaki dağılımının, komplekslerde verilen toplam DNA kütlesine daha az ve her bir kompleks10'daki fraksiyonel DNA miktarına daha fazla bağlı olmasıdır. 1: 1: 1 dışındaki oranlar istenirse, her parça için transfeksiyon karışımındaki toplam DNA kütlesinin karşılık gelen fraksiyonlarını hesaplayın. Örneğin, Tablo 5 [altta] 1:1:4 oranını göstermektedir.
| Yöntem | Karmaşık | ng A (kesir) | ng B (kesir) | ng C (fraksiyon) | ng Reporter (kesir) | ng Dolgu DNA'sı (fraksiyon) | Toplam (ng) |
| Ko-transfeksiyon | 1 | 150 (¼) | 150 (¼) | 150 (¼) | 150 (¼) | 0 (0) | 600 |
| Poli-transfeksiyon | 600 | ||||||
| → | 1 | 50 (¼) | 50 (¼) | 100 (½) | 200 | ||
| → | 2 | 50 (¼) | 50 (¼) | 100 (½) | 200 | ||
| → | 3 | 50 (¼) | 50 (¼) | 100 (½) | 200 | ||
| Ko-transfeksiyon | 1 | 75 (⅛) | 75 (⅛) | 300 (½) | 150 (¼) | 0 (0) | 600 |
| Poli-transfeksiyon | 600 | ||||||
| → | 1 | 25 (⅛) | 50 (¼) | 125 (⅝) | 200 | ||
| → | 2 | 25 (⅛) | 50 (¼) | 125 (⅝) | 200 | ||
| → | 3 | 100 (½) | 50 (¼) | 50 (¼) | 200 |
Tablo 5: Ko- ve poli-transfeksiyon deneylerinde tutarlılık için dolgu DNA'sı kullanma örnekleri. Burada, aynı miktarda dolgu DNA'sı ile üç plazmidin birlikte transfekte edilmesinin iki genel örneği gösterilmiştir. En üstteki örnekte, plazmidlerin hepsi eşit kütlededir. Alttaki örnekte, bir plazmid diğerlerine kıyasla daha yüksek bir kütlede verilir. Bir ko-transfeksiyon kompleksinde kullanılacak toplam DNA'nın fraksiyonu, poli-transfeksiyon komplekslerine dönüştürülür, kalan DNA miktarı (kompleksler arasında sabit ve eşit olan her kompleks için toplam miktara kadar) dolgu DNA'sı ile oluşturulur.
Dolgu DNA'sının genel amacı, benzersiz transfeksiyon karışımlarının sayısından bağımsız olarak, hücre başına benzer plazmid dozajlarını korumaktır. Bu prensibin kaba bir yaklaşımı olarak, her birinin aynı DNA kütlesini (ve transfeksiyon reaktifinin uygun oranını) korurken üç plazmidi üç karışıma ayırmak, belirli bir kompleksi alan hücrelerin yüzdesini, üç plazmidin tümünü içeren tek bir karışıma kıyasla üçte bir oranında azaltır. Bununla birlikte, her transfekte hücre daha sonra ~ 3x daha yüksek bir gen dozu alır. Bu nedenle, dolgu DNA'sı olmadan plazmidlerin nispi miktarını tek başına azaltmak, tutarlı plazmid dozajlarını korumak için yetersizdir, çünkü bu, transfekte hücreler arasındaki ekspresyonun altta yatan dağılımını değiştirmeden transfeksiyon verimliliğini azaltır10. Öte yandan, dolgu DNA'sı, genel transfeksiyon verimliliğini etkilemeden DNA dozajının ayarlanmasına izin verir (ancak tespit edilebilir transfekte hücreler düşük sinyal nedeniyle azalabilir)10. Yukarıdaki kaba yaklaşımı takiben, poli-transfeksiyon karışımlarındaki DNA fraksiyonunu üçte birine indirgemek ve dolgu DNA'sı eklemek, orijinal ko-transfeksiyona kıyasla göreceli gen dozajlarını korur. Dolgu DNA'sı bu nedenle verimli ve doğru transfeksiyon kompleksi oluşumunu sağlar.
Muhabiri tarafından kapsanan ilgi çekici bir genin ekspresyon aralığını değiştirmek için, geni sürmek için kullanılan her test plazmidinin ve / veya promotörünün fraksiyonu, muhabire göre ayarlanabilir. Bir parça düşük DNA dozajlarında güçlü / oldukça aktifse, daha düşük bir DNA fraksiyonu kullanmak, parçanın dinamik aralığını, transfekte hücrelerde raporlayıcının floresan dağılımının ortasında merkezlemeye yardımcı olabilir. Benzer şekilde, zayıf / sadece yüksek DNA dozajlarında aktif olan parçalar için, daha yüksek bir fraksiyon kullanmak yararlı olabilir. Bununla birlikte, DNA fraksiyonlarının çok fazla azaltılması, muhabir10'a kıyasla hücrelere verilen stokastikliği arttırdığından ve yüksek gen ekspresyon seviyeleri hücresel gen ekspresyon makinesini aşırı yükleyebileceğinden, bu tür bir ayarlamaya dikkat edilmelidir12,14. Stokastiklikten kaçınmak için ve her genin hücrelere sabit bir oranda verildiği durumlarda (örneğin, devre tek bir lenti, PiggyBac veya Landing Pad vektörü olarak üretilecekse), her genin göreceli ifadesi daha güçlü / zayıf promotörler, küçük uORF'ler18 ve / veya miSFIT'ler19 kullanılarak ayarlanabilir.
Protokol bir ters transfeksiyon tekniğini tanımlasa da, ileri transfeksiyon ile çoklu transfeksiyon da mümkündür. Ters transfeksiyonda, hücreler aynı anda tohumlanır ve transfekte edilir; İleri transfeksiyonda, hücreler ilk kaplamadan ~ 24 saat sonra, ters transfeksiyonda kullanılacak yoğunluğun yaklaşık yarısında (transfeksiyon sırasında hücre bölünmesine izin vermek için) transfekte edilir. Genel olarak, ters transfeksiyon daha verimli ama aynı zamanda daha toksiktir ve reaktife, transfeksiyon süresine ve hücre hattına bağlı olarak transfeksiyon dağılımlarının şeklinde bazı farklılıklar olduğunu fark ettik. Bu nedenle, transfekte hücrelerin sayısını ve hücre başına plazmid dozajlarının çok boyutlu konsantrasyon alanının kapsamını en üst düzeye çıkarmak için tercih edilen transfeksiyon yöntemi, her hücre hattı için optimize edilmelidir.
Genel olarak, poli-transfeksiyon, memeli genetik devrelerinin hızlı optimizasyonunu sağlar. Devre bileşenlerinin birçok olası oransal kombinasyonu tek bir kuyuda kolayca test edilebilir. Ek olarak, poli-transfeksiyon, bir sistemdeki her bir parçanın seviyeleri hakkında geleneksel bir transfeksiyondan daha fazla bilgi içerdiğinden, çeşitli genetik parçaların davranışını karakterize etmek için oldukça değerli olduğu bulunmuştur10,11,12,13. Poli-transfeksiyonun benimsenmesinin, memeli hücrelerinde kullanılmak üzere yeni ve geliştirilmiş gen devreleri geliştirme hızını hızlandırması beklenmektedir.
Açıklamalar
R.W., Strand Therapeutics ve Replay Bio'nun kurucu ortaklarındandır; R.W. ve R.J., hücre tipi sınıflandırıcı ile ilgili geçici bir patent başvurusunda bulundu.
Teşekkürler
Poli-transfeksiyon yönteminin geliştirilmesine ve hücre sınıflandırıcılarına uygulanmasına öncülük eden veya katkıda bulunan eski Weiss Lab üyelerine teşekkür etmek isteriz: Jeremy Gam, Bre DiAndreth ve Jin Huh; Daha fazla yöntem geliştirme/optimizasyona katkıda bulunan diğer Weiss laboratuvar üyeleri: Wenlong Xu, Lei Wang ve Christian Cuba-Samaniego; Prof. Josh Leonard ve Patrick Donahue ve Hailey Edelstein da dahil olmak üzere grup üyeleri, çoklu transfeksiyonu test etmek ve geri bildirim sağlamak için; ve Prof. Nika Shakiba bu makaleyi davet ettiği ve geri bildirimde bulunduğu için. Ulusal Sağlık Enstitüleri'ne [R01CA173712, R01CA207029, P50GM098792] de teşekkür ederiz; Ulusal Bilim Vakfı [1745645]; Bu çalışmayı finanse etmek için NCI'den Kanser Merkezi Desteği (çekirdek) Hibe [P30CCA14051, kısmen] ve Ulusal Sağlık Enstitüleri [P50GM098792].
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15mL Corning Falcon conical tubes | ThermoFisher Scientific | 14-959-53A | |
| 24-well petri dish | Any company of choice | (Non-pyrogenic, Sterile, RNase, DNase, DNA and Pyrogen Free) | |
| Bovine serum albumin | NEB | B9000S | |
| Centrifuge | Any company of choice | Capable of exposing 15mL Falcon tubes to 300 rcf | |
| Countess 3 Automated Cell Counter | ThermoFisher Scientific | AMQAX2000 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| Cytoflow | Non-commercial software package | https://cytoflow.readthedocs.io/en/stable/# | |
| DMEM | VWR | 10-013-CV | Use the correct media for your cell type |
| EDTA | ThermoFisher Scientific | 03690-100ML | |
| Fetal bovine serum | Sigma Aldrich | F4135 | |
| HEK cells | ATCC | CRL-1573 | Use the relevant cell type for your experiments. HEK cells tend to transfect very efficiently. |
| HeLa cells | ATCC | CRL-12401 | Use the relevant cell type for your experiments. |
| Lipofectamine 3000 and P3000 enhancer | ThermoFisher Scientific | L3000001 | Use the correct reagent for your cell type; transfection and enhancer reagent |
| LSRFortessa flow cytometer | BD Biosciences | N/A | |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140050 | |
| Microcentrifuge Tubes, 1.5 mL | Any company of choice | ||
| Opti-MEM | ThermoFisher Scientific | 31985070 | reduced serum medium |
| Phosphate buffered saline | ThermoFisher Scientific | 70011044 | |
| Rainbow calibration beads | Spherotech | URCP-100-2H | |
| Sodium azide | Sigma Aldrich | S2002 | |
| Trypsin | VWR | 25-053-CI |
Referanslar
- Prochazka, L., Benenson, Y., Zandstra, P. W. Synthetic gene circuits and cellular decision-making in human pluripotent stem cells. Current Opinion in Systems Biology. 5, 93-103 (2017).
- Sayeg, M. K., et al. Rationally designed microRNA-based genetic classifiers target specific neurons in the brain. ACS Synthetic Biology. 4 (7), 788-795 (2015).
- Zhen, X., Wroblewska, L., Prochazka, L., Weiss, R., Benenson, Y. Multi-Input RNAi-based logic circuit for identification of specific cancer cells. Science. 333 (6047), 1307-1311 (2011).
- Nissim, L., et al. Synthetic RNA-based immunomodulatory gene circuits for cancer immunotherapy. Cell. 171 (5), 1138-1150 (2017).
- Nissim, L., Bar-Ziv, R. H. A tunable dual-promoter integrator for targeting of cancer cells. Molecular Systems Biology. 6, 444 (2010).
- Mohammadi, P., Castel, S. E., Brown, A. A., Lappalainen, T. Quantifying the regulatory effect size of cis-acting genetic variation using allelic fold change. Genome Research. 27 (11), 1872-1884 (2017).
- Prochazka, L., et al. Discrete-to-analog signal pluripotent stem cells conversion in human. BioRxiv. , (2021).
- Del Vecchio, D. Modularity, context-dependence, and insulation in engineered biological circuits. Trends in Biotechnology. 33 (2), 111-119 (2015).
- Shakiba, N., Jones, R. D., Weiss, R., Del Vecchio, D. Context-aware synthetic biology by controller design: Engineering the mammalian cell. Cell Systems. 12 (6), 561-592 (2021).
- Gam, J. J., DiAndreth, B., Jones, R. D., Huh, J., Weiss, R. A 'poly-transfection' method for rapid, one-pot characterization and optimization of genetic systems. Nucleic Acids Research. 47 (18), 106 (2019).
- Jones, R. D., et al. Robust and tunable signal processing in mammalian cells via engineered covalent modification cycles. Nature Communications. 13 (1), 1720 (2022).
- Jones, R. D., et al. An endoribonuclease-based feedforward controller for decoupling resource-limited genetic modules in mammalian cells. Nature Communications. 11 (1), 5690 (2020).
- DiAndreth, B., Wauford, N., Hu, E., Palacios, S., Weiss, R. PERSIST platform provides programmable RNA regulation using CRISPR endoRNases. Nature Communications. 13 (1), 2582 (2022).
- Frei, T., et al. Characterization and mitigation of gene expression burden in mammalian cells. Nature Communications. 11 (1), 4641 (2020).
- Beal, J., Weiss, R., Yaman, F., Adler, A., Davidsohn, N. A method for fast, high-precision characterization of synthetic biology devices. Computer Science and Artificial Intelligence Laboratory Technical Report. Massachusetts institute of technology. , (2012).
- Beal, J., et al. Meeting measurement precision requirements for effective engineering of genetic regulatory networks. ACS Synthetic Biology. 11 (3), 1196-1207 (2022).
- Teague, B. Cytoflow: A Python toolbox for flow cytometry. bioRxiv. , (2022).
- Ferreira, J. P., Overton, K. W., Wang, C. L. Tuning gene expression with synthetic upstream open reading frames). Proceedings of the National Academy of Sciences. 110 (28), 11284-11289 (2013).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nature Communications. 10 (1), 818 (2019).
- Saito, H., et al. Synthetic translational regulation by an L7Ae-kink-turn RNP switch. Nature Chemical Biology. 6 (1), 71-78 (2010).
- Wroblewska, L., et al. Mammalian synthetic circuits with RNA binding proteins for RNA-only delivery. Nature Biotechnology. 33 (8), 839-841 (2015).
- Wagner, T. E., et al. Small-molecule-based regulation of RNA-delivered circuits in mammalian cells. Nature Chemical Biology. 14 (11), 1043-1050 (2018).
- Sekuklu, S. D., Donoghue, M. T. A., Spillane, C. miR-21 as a key regulator of oncogenic processes. Biochemical Society Transactions. 37, 918-925 (2009).
- Stanton, B. C., et al. Genomic mining of prokaryotic repressors for orthogonal logic gates. Nature Chemical Biology. 10 (2), 99-105 (2014).
- Stanton, B. C., et al. Systematic transfer of prokaryotic sensors and circuits to mammalian cells. ACS Synthetic Biology. 3 (12), 880-891 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır