Method Article
Kırmızı Kan Hücrelerinin Viskoelastik Özelliklerinin Optik Cımbız ve Bulanıklaştırma Mikroskobu Kullanılarak Kantitatif Analizi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, hücrelerin reolojik özelliklerini ölçmek için optik cımbız ve defokus mikroskobuna dayanan entegre bir protokol açıklanmaktadır. Bu protokol, değişken fizyo-patolojik koşullar altında eritrositlerin viskoelastik özelliklerinin incelenmesinde geniş uygulanabilirliğe sahiptir.
Özet
Eritrositlerin viskoelastik özellikleri bir dizi teknikle araştırılmıştır. Bununla birlikte, bildirilen deneysel veriler farklılık göstermektedir. Bu sadece hücrelerin normal değişkenliğine değil, aynı zamanda hücre yanıtının yöntem ve modellerindeki farklılıklara da atfedilir. Burada, 1 Hz ila 35 Hz frekans aralığında kırmızı kan hücrelerinin reolojik özelliklerini elde etmek için optik cımbız ve bulanıklaştırma mikroskobu kullanan entegre bir protokol kullanılır. Eritrosit-kompleks elastik sabitini ölçmek için optik cımbız kullanılırken, defokus mikroskobu hücre yüksekliği profilini, hacmini ve form faktörünü karmaşık elastik sabitin karmaşık kesme modülüne dönüştürülmesine izin veren bir parametre elde edebilir. Ayrıca, yumuşak camsı bir reoloji modeli uygulanarak, her iki modül için ölçekleme üssü elde edilebilir. Geliştirilen metodoloji, çeşitli fizyolojik ve patolojik durumlar için iyi tanımlanmış deneysel koşullar altında elde edilen viskoelastik parametrelerini karakterize eden kırmızı kan hücrelerinin mekanik davranışlarını keşfetmeye izin verir.
Giriş
Eritrositler olarak da bilinen olgun kırmızı kan hücreleri (RBC'ler), insan vücudunun en dar kılcal damarlarından geçerken boyutlarının iki katından fazla uzayabilirler1. Bu kapasite, dış yüklere maruz kaldıklarında deforme olma konusundaki benzersiz yeteneklerine atfedilir.
Son yıllarda, RBC yüzeylerinde farklı çalışmalar bu özelliği karakterize etmiştir 2,3. Malzemelerin dış yüklerden kaynaklanan elastik ve viskoz tepkilerini tanımlayan fizik alanına reoloji denir. Genel olarak, bir dış kuvvet uygulandığında, ortaya çıkan deformasyon malzemenin özelliklerine bağlıdır ve enerjiyi dağıtan enerjiyi depolayan elastik deformasyonlara veya viskoz deformasyonlara ayrılabilir4. RBC'ler de dahil olmak üzere tüm hücreler viskoelastik bir davranış sergiler; Başka bir deyişle, enerji hem depolanır hem de dağıtılır. Bir hücrenin viskoelastik tepkisi, karmaşık kesme modülü G * (ω) = G' (ω) + iG "(ω) ile karakterize edilebilir, burada G' (ω) elastik davranışla ilgili depolama modülüdür ve G" (ω), viskozitesi4 ile ilgili kayıp modülüdür. Dahası, hücre tepkilerini tanımlamak için fenomenolojik modeller kullanılmıştır, en çok kullanılanlardan biri, karmaşık kesme modülünün yük frekansı ile güç yasası bağımlılığı ile karakterize edilen yumuşak camsı reoloji modeli5 olarak adlandırılır.
RBC'lerin viskoelastik özelliklerini karakterize etmek için, kuvvet uygulayarak ve dayatılan yükün bir fonksiyonu olarak yer değiştirmeyi ölçerek tek hücreli tabanlı yöntemler kullanılmıştır 2,3. Bununla birlikte, kompleks kesme modülü için literatürde çok az sonuç bulunabilir. Dinamik ışık saçılması kullanılarak, RBC depolama ve kayıp modülü için değerlerin 1-100 Hz6 frekans aralığında 0,01-1 Pa arasında değiştiği bildirilmiştir. Optik manyetik büküm sitometrisi kullanılarak, görünür bir kompleks elastik modülelde edildi 7 ve karşılaştırma amacıyla, çarpım faktörünün muhtemelen tutarsızlıkları açıklığa kavuşturduğu iddia edildi.
Daha yakın zamanlarda, zamana bağlı yükler üzerinde insan eritrositlerinin kesme modüllerinin depolanmasını ve kaybını nicel olarak haritalamak için entegre bir araç olarak optik cımbıza (OT) ve defokus mikroskobuna (DM) dayanan yeni bir metodoloji kuruldu 8,9. Ek olarak, sonuçlara uymak ve RBC'leri karakterize eden bir güç yasası katsayısı elde etmek için yumuşak bir camsı reoloji modeli kullanıldı 8,9.
Genel olarak, protokolü aşağıda ayrıntılı olarak açıklanan geliştirilen metodoloji8,9, kuvvet ve deformasyonları RBC yüzeyindeki gerilmeler ve gerinimlerle ilişkilendiren ve farklı kana sahip bireylerden elde edilen RBC'lerin viskoelastik parametrelerini ve yumuşak camsı özelliklerini nicel olarak belirleyebilen yeni bir tanı yöntemi olarak kullanılabilen form faktörü Ff için ölçülen değerleri kullanarak önceki tutarsızlıkları açıklığa kavuşturur Patoloji. Aşağıda açıklanan protokolü kullanarak bu tür bir karakterizasyon, RBC'lerin davranışını mekanobiyolojik bir perspektiften anlamak için yeni olanaklar açabilir.
Protokol
İnsan kan örnekleri, Rio de Janeiro Federal Üniversitesi Araştırma Etik Komitesi (Protokol 2.889.952) tarafından onaylanan protokollere göre yetişkin erkek ve kadın gönüllüler tarafından sağlanmış ve 88140418.5.0000.5699 CAAE numarası altında Brezilya Platformuna kaydedilmiştir. Tüm gönüllülere yazılı bir onay formu verildi ve onlardan toplandı. Herhangi bir hemoglobinopatisi olan ve / veya kontrollü ilaç kullananlar hariç tutuldu. Tüm süreç, enstitünün etik kurulu tarafından onaylanan yönergeleri takip etti.
1. Numune tutucuların hazırlanması
- Her numune tutucu için iki kapak parçası (24 mm x 60 mm ve 24 mm x 32 mm; kalınlık = 0,13-0,17 mm) ve bir kauçuk halka (çap = 10 mm; kalınlık = 2 mm) elde edin.
- Silikon gresi kauçuk halka yüzeyinin üzerine tüm çevreyi kaplayacak şekilde dökün.
- Kauçuk halkayı, gres tarafı kapak kaymasına bakacak şekilde kapak kapağının üzerine yerleştirin. Doğru bağlantı için 5 dakika bekleyin, numune tutucular daha sonra hücre kültürünü almaya hazırdır.
NOT: Ek olarak, daha önce açıklandığı gibi ticari veya ev yapımı cam tabanlı tabaklar da kullanılabilir10.
2. Hücre kültürü
NOT: Aşağıdaki adımlar, insan kanından sağlıklı RBC'lerin nasıl elde edileceğini açıklamaktadır. Numunelerin her deneyden önce taze olarak hazırlanması önemlidir.
- 20 μL kanı, 137 mM NaCl, 2.7 mM KCl, 10 mM Na 2 HPO 4, 1.8 mM KH2PO4, 10 mM glikoz içeren 250 μL 1x fosfat tampon salin (PBS) çözeltisi içinde seyreltin ve 1 mg /mL sığır serum albümini (BSA) ile destekleyin.
- Oda sıcaklığında 2 dakika boyunca 200 x g'de santrifüjlemeden sonra, süpernatantı bir pipet kullanarak aspire edin ve hücre peletini 1 mL'lik 1x PBS / BSA çözeltisi içinde yeniden askıya alın. Hücreleri tamponda 2 kez yıkayın.
- Bir hemositometrer kullanarak hücre yoğunluğunu hesaplayın ve 1. adımda hazırlanan numune tutucuda 50.000 ila 100.000 hücreyi tohumlayın. Kapak kaymasına spesifik olmayan hücre bağlantısı için 10-15 dakika bekleyin; Bekleme süresi hücreleri etkilemez.
- Daha fazla OT deneyi için numuneye %10 v/v polistiren küre çözeltisinin 0,2 μL'sini (yarıçap = 1,52 ± 0,02 μm) ekleyin. Mikroskop altındaki numunelere bakarak uygun karıştırmayı onaylayın.
- Hücrelerin tohumlanmasından sonra, ikinci kapak kaymasını kauçuk halkanın üzerine yerleştirin (tutturma için gres eklemek gerekli değildir), kurulumu kapatın ve numune hazırlığını bitirin. Numuneler mikroskopi analizi ve manipülasyonu için hazırdır.
3. Optik cımbız mikroskop kurulumu
NOT: OT, mikroskobik nesneleri yakalamak ve pikonewton aralığındaki kuvvetleri ve nanometre ölçeğindeki yer değiştirmeleri ölçmek için oldukça odaklanmış bir lazer ışını kullanan araçlardır. Kullanılan OT lazer (1064 nm dalga boyu), daha önce tarif edildiği gibi düzgün bir şekilde hizalanmalıdır10.
- Kısaca, birkaç santimetrelik (en az 10-20 cm) bir mesafe ile ayrılmış en az iki ayna kullanarak, doğrusal polarize bir lazer ışınını ters çevrilmiş bir mikroskobun arka girişine doğru yönlendirin. Mikroskopa düz bir çizgide girmek için lazer ışınını hassas bir şekilde hizalayın (Şekil 1).
- Ardından, objektif lensin eksenine paralel ilerlemek ve lense arka girişinin merkezine yakın bir yere girmek için mikroskopa monte edilmiş dikroik bir ayna kullanarak lazer ışınını yansıtın. Bu, optik tuzağı oluşturmak için lazeri odaklayacaktır (Şekil 1).
- Daha sonra, OT ile kuvvetleri ölçmek için, tuzak sertliğini (κOT) elde etmek için sistemi kalibre edin. OT kalibrasyon prosedürünün daha ayrıntılı bir açıklaması için10'a bakın. κ OT bulunduğunda, OT sistemi reoloji deneyleri için hazırdır.
4. DM kurulumu
NOT: DM, mikroskop hafifçe bulanıklaştırıldığında saydam nesnelerin görünür olmasını sağlayan parlak alan tabanlı bir optik mikroskopi tekniğidir11,12. RBC şekil13'ü elde etmek için böyle bir teknik uygulanmıştır. OT sistemi için kullanılan aynı mikroskop, 3D rekonstrüksiyonlar yoluyla bir yükseklik profili elde etmek için DM için kullanılabilir.
- Köhler aydınlatma14'ü uygulayarak mikroskop aydınlatma sistemini ayarlayın ve daha iyi çözünürlük için deneyleri gerçekleştirmek üzere kondenser-diyaframı tamamen açın.
- Numuneyi z ekseninde nanometrik hassasiyetle tüm koordinatlarda yer değiştirmek için bir piezoelektrik konumlandırma sistemi kullanın. Piezoelektrik sistemin otomatik kalibrasyonunu tüm eksenlerde gerçekleştirin. Tüm prosedürler gerçekleştirildikten sonra, mikroskop sistemi DM deneyleri için hazırdır.
5. OT tabanlı reoloji deney ve analizi
NOT: Reoloji deneyi, hücrenin değişen frekanslardaki küçük salınımlara verdiği tepkileri gözlemlemekten ibarettir.
- Deneme
- OT sistemini kullanarak, küreyi OT lazer ile yakalayın ve ardından küreyi üst yüzeye yakın ve hücre kenarına yakın hücre yüzeyine bastırarak bir RBC'ye takın. Bu adım için mikroskopu kullanın. Ardından, başka bir küreyi yakalayın ve aynı ekleme prosedürünü tekrarlayın, ancak şimdi hücreye yakın olan kapak fişine takın. Kapak kaymasına tutturulmuş küre, piezo yer değiştirmesini takip etmek ve RBC küresi ile karşılaştırmak için gerekli olan referans boncuktur (Şekil 2).
- Ölçüme başlamadan önce, seçilen hücrenin kapak fişine iyi bir şekilde tutturulduğundan ve RBC ve referans kürelerinin sırasıyla RBC yüzeyine ve kapak kaymasına yapıştığından emin olun. Yapışmamış hücreleri, yüksek yapışma oranına rağmen (yaklaşık% 80 -% 90) zamanla hareket edecekleri için görsel olarak tanımlayın.
- Piezoelektrik aşama yazılımına ξ 0 = 0.500 ± 0.001 μm genlikli bir sinüzoidal fonksiyon ve 1 Hz, 7 Hz, 14 Hz, 21 Hz, 28 Hz ve 35 Hz'lik değişen frekanslarla, ω, 6.3 rad / s, 169 rad / s, 88 rad / s, 132 rad / s, 176 rad / s ve 220 rad / s, Piezoelektrik yazılımı kullanarak, daha önce gösterildiği gibi 8,9.
- Piezoelektrik aşamayı kullanarak, piezoelektrik yer değiştirmeye izin vermek ve RBC küresini tuzakta tutmak için başlat düğmesine basın, numuneyi daha önce ayarlanmış sinüzoidal fonksiyonu kullanarak bir hareket döngüsüne gönderin. Örnek hareketi kaydetmek için 790 kare/sn veya daha yüksek çözünürlükte görüntü üretebilen bir kamera kullanın. Deneyin şeması Şekil 2'de gösterilmiştir.
- Numune sinüzoidal hareketlere gönderilirken, RBC yüzeyine bağlı küreyi yakalamak için OT'yi aktive edin. Deneyleri gerçekleştirmek için seçilen sıcaklıktan bağımsız olarak, oda sıcaklığı, 37 ° C veya başka bir sıcaklık, ölçümler sırasında değişimleri önlemek için sıcaklığı dikkatlice izleyin. OT'yi oluşturmak için kullanılan kızılötesi (1064 nm) lazer, hücrelere neredeyse hiç zarar vermez veya ısınmaz.
- Analiz
- Zaman içinde kürelerin her birinin kütle konumunun merkezini bulmak için ImageJ'yi kullanarak sinüzoidal hareketler sırasında elde edilen görüntüleri analiz edin.
NOT: Bu veriler, her iki küre arasındaki faz ve genlik farklılıklarını gösterebilen grafiklerin oluşturulmasına izin verir. Bu tür bilgiler, RBC'lerin viskoelastik tepkisini elde etmek için çok önemlidir. - Kürelerin her biri için kütle merkezini elde etmek üzere ImageJ yazılımını açın. Sinüzoidal hareketler sırasında elde edilen filmin tamamını içe aktarın.
- Görüntü sekmesinde, Ayarla'ya tıklayın ve ardından Eşik'i seçin. Eşik penceresi açılacaktır. S&B'yi seçin. Bu, arka planı beyaza ve küreleri siyaha çevirir.
- Histogramın altındaki her iki kaydırma çubuğuyla da eşiği ayarlayarak her iki kürenin de maksimum piksel miktarıyla görünmesini sağlayın.
- Dosya > Dikdörtgeni'ne tıklayarak referans küresini seçin. Küreyi seçmek için bir dikdörtgen çizin. Bir görüntüdeki referans küreyi seçtikten sonra, dikdörtgenin filmin diğer tüm görüntülerinde de aynı küreyi doğru seçtiğinden emin olun.
- Ardından, Analiz sekmesinde , Ölçümleri Ayarla'ya tıklayın ve Kütle Merkezi seçeneğini seçin.
- Analiz Et sekmesine tekrar tıklayın ve Parçacıkları Analiz Et'i seçin. Yeni bir pencere açılacaktır. Boyutu ve daireselliği tanımlayın (küre yarıçapına bağlı olarak). Aşağıdaki kutuları işaretleyin: Sonuçları Görüntüle ve Sonuçları Temizle. Son olarak, tüm görüntüleri işlemek için Tamam'a tıklayın.
- Kütlenin merkezi için xy koordinatlarına sahip bir tablo içeren yeni bir pencere görünecektir. Bu koordinat değerlerini .txt dosyası olarak kaydedin. RBC yüzeyine bağlı diğer küre için prosedürü tekrarlayın.
- Her iki küre için fazdaki genliği ve farklılıkları elde etmek için, analiz yazılımını açın. Daha önce elde edilen .txt dosyalarını içe aktarın.
- Üç sütunlu yeni bir tablo oluşturun. İlk sütunda (c0) kare sayısını, ikinci sütunda (c1) referans küre için x koordinatlarını ve üçüncü sütunda (c2), RBC yüzeyine bağlı küre için x koordinatlarını ekleyin.
NOT: Bu örnekte, sinüzoidal hareketler yalnızca x ekseninde gerçekleştirildiğinden, her iki küre için yalnızca x koordinatlarının kullanılması gerekir. - Ardından, çerçeveleri zamanla ilişkilendirin. Windows > Formül Girişi'ne tıklayın. Formül girişi adlı yeni bir pencere açılır. Bu pencerede, her biri belirli bir anahtarda (F1'den F8'e) sekiz farklı denklem kurmak mümkündür.
- F1'i seçin, aşağıdaki formülü yazın:
c 3 = c0 / (kamera fps)
Çalıştır'a tıklayın. Bu, tabloda bir süre için yeni bir sütun oluşturur (sütun 4). - Her karenin x koordinat değerini ilgili ortalama değeriyle çıkarın. Bunu yapmak için, formül girişinde herhangi iki anahtar belirleyin ve her anahtar için aşağıdaki denklemleri yazın:
c 4 = (c 1 - ortalama(c 1)) ve c 5 = (c 2 - ortalama(c2))
Çalıştır düğmesine tıklayın. Sonuçlar, sırasıyla referans ve RBC küreleri için sütun 5 ve 6'da görünür. - Kütle değerlerinin merkezini piksellerden mikrometrelere dönüştürün. Bunun için, formül girişinde başka bir anahtar kullanın ve aşağıdaki denklemi yazın:
c 4 = c 4 / dönüşüm sayısı
Aynı işlemi sütun 5 için tekrarlayın.
NOT: Dönüştürme, bir mikrometre ölçeği/cetveli kullanılarak elde edilir ve görüntüsü, ölçümler için kullanılan aynı mikroskop kurulumuyla (aynı objektif lens dahil) elde edilir. Bu prosedür mikroskop kalibrasyonu sırasında gerçekleştirilebilir. Böylece bir piksel/mikrometre ilişkisi elde edilir. - Her iki kürenin kütle merkezlerini y ekseninde ve zamanı x ekseninde içeren bir grafik oluşturun. Bunun için Galeri > Doğrusal ve Dağılım'a tıklayın. Yeni bir pencere açılacaktır. X ekseni için zaman sütununu seçin ve y ekseninde hem referans hem de RBC küreleri için mikrometre cinsinden kütle merkezinin sütunlarını seçin.
- Grafikte, yalnızca ilk açısal frekansla (6,3 rad / s) ilgili verileri seçin. Şekil 3'te belirtilen araçları kullanın.
- Referans küresi için veri eğrisini ayarlayan denklemi tanımlayın. Bunun için Genel ve Fit1> Eğri Sığdır'a tıklayın, referans kürenin konumuyla ilgili veri kutusunu seçin ve ardından Tanımla'ya tıklayın. Denklemi tanımlamak için yeni bir pencere açılacaktır. Referans kürenin ξ(t) konumu şu şekilde tanımlanır:
ξ(t) = ξ0cos(ωt)
burada ξ , numunenin sinüzoidal hareketidir, ω açısal frekanstır ve t , s cinsinden zamandır. Bu denklemi analiz yazılımına aktararak, aşağıdaki gibi görünecektir: , burada m1 ξ, m2 f, m0 t zamanı ve m3, t = 0 için kosinüs fonksiyonunun fazıdır.
, burada m1 ξ, m2 f, m0 t zamanı ve m3, t = 0 için kosinüs fonksiyonunun fazıdır. - Grafikten m1, m2 ve m3 değerlerini tahmin edin. Denklemi tanımladıktan sonra Tamam'a tıklayın. Veriler denkleme göre yerleştirilecek ve grafikte m1, m2 ve m3 değerleriyle küçük bir kare ile birlikte bir eğri görünecektir.
- RBC küresi için veri eğrisini ayarlayan denklemi tanımlayın. Bunun için Eğri Sığdırma > Genel'e tıklayın ve veriler için eğriyi ayarlayacak denklemi tanımlayın. RBC küresinin ρ(t) konumu şu şekilde verilir:

burada ξ' faz dışı genliğidir ve φ faz dışı açıdır. Bu formülü analiz yazılımına aktararak, aşağıdaki gibi görünecektir: , burada m1, m2 ve m3, referans kürenin eğri uyumunda elde edilen değerlerdir. m4 ξ' ve m5 φ'dir.
, burada m1, m2 ve m3, referans kürenin eğri uyumunda elde edilen değerlerdir. m4 ξ' ve m5 φ'dir. - Grafikten m4 ve m5 değerlerini tahmin edin. Formülü tanımladıktan sonra Tamam'a tıklayın. Veriler denkleme göre yerleştirilecek ve grafikte m4 ve m5 değerleriyle küçük bir kare ile birlikte bir eğri görünecektir.
- Ardından, eğri uydurmasından elde edilen verileri ilgili sütunlarına eklemek için yeni bir tablo oluşturun. Aşağıdaki parametreler için beş farklı sütun tanımlayın: açısal frekans, genlik (referans küre), başlangıç zamanı, genlik (RBC küresi) ve faz dışı açı. Diğer tüm frekanslar için aynı prosedürü uygulayın.
- Depolama (K') ve kayıp sabitlerini (K") bulmak için aşağıdaki denklemleri kullanın:
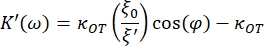

burada κ OT, OT elastik sabitidir ve β Stokes sürükleme katsayısıdır. Denklemleri analiz yazılımına aktararak, aşağıdaki gibi görünecektir: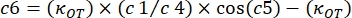 ve
ve
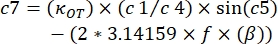 , burada β ve κOT'nin sistemde bulunan değerlerle değiştirilmesi gerekir.
, burada β ve κOT'nin sistemde bulunan değerlerle değiştirilmesi gerekir. - K" için x eksenini ve K' için y eksenini kullanarak sonuçları bir grafik üzerinde çizin (Şekil 4).
- Zaman içinde kürelerin her birinin kütle konumunun merkezini bulmak için ImageJ'yi kullanarak sinüzoidal hareketler sırasında elde edilen görüntüleri analiz edin.
6. Genel hücre form faktörünü elde etmek için DM deneyi ve analizi
- Video edinme
- Piezoelektrik aşamayı, kapak fişine bağlı izole bir hücreyi aramak için yazılımı kullanarak xy yönünde hareket ettirin. RBC yüzeyine çapı bilinen bir polistiren küreyi yakalayın ve takın. Piezoelektrik aşamayı kullanarak, hücreyi deforme etmek için RBC yüzeyine de tutturulmuş sıkışmış boncuğu hafifçe hareket ettirin ve ardından boncuğu kapak kaymasına takın.
NOT: OT ölçümlerinden aynı hücreyi kullanmak da mümkündür. - Netleme düzleminin seçilen hücrenin ortasında olduğu odaklanmış görüntüyü bulmak için z ekseni konumunu değiştirin. Bu görüntü, hücrenin ortasındaki gri düzeyle hücrenin dışındaki gri düzeye (arka plan) eşit olan daha küçük karşıtlığı sunar.
- Konum sabitlendiğinde, 25 fps kare hızında 8 bit ve 256 piksel x 256 pikselde yaklaşık 5.000 görüntüyle tüm hücrenin bir filmini oluşturmak için kamera yazılımını kullanın. Ardından, seçilen hücre için bulanıklaştırılmış bir görüntü elde etmek üzere z ekseni konumunu 2 μm aşağı veya yukarı hareket ettirin. Bu durum için bir film oluşturmak üzere parametreleri yineleyin.
- Son olarak, z ekseni konumunu değiştirmeden, aynı prosedürü tekrarlamak ve görüntü arka planının bir filmini oluşturmak için hücreler olmadan bir bölge arayın.
- Piezoelektrik aşamayı, kapak fişine bağlı izole bir hücreyi aramak için yazılımı kullanarak xy yönünde hareket ettirin. RBC yüzeyine çapı bilinen bir polistiren küreyi yakalayın ve takın. Piezoelektrik aşamayı kullanarak, hücreyi deforme etmek için RBC yüzeyine de tutturulmuş sıkışmış boncuğu hafifçe hareket ettirin ve ardından boncuğu kapak kaymasına takın.
- Kontrast görüntü alma
- Üç filmin her birini üç ortalama görüntüye dönüştürün. ImageJ'yi kullanarak filmlerden birini seçin, Z Projesi > Görüntü > Yığınları'na tıklayın ve Ortalama Yoğunluk seçeneğini belirleyin. Diğer filmlerin kendi görüntülerini elde etmeleri için bu prosedürü tekrarlayın.
- Elde edilen tüm görüntüleri 8 bit'ten kayan nokta 32 bit'e değiştirin. ImageJ'yi kullanarak, Image > Type > 32-bits'e tıklayın. Ardından, Ölçümleri Analiz > Ayarla'ya tıklayın ve Ortalama Gri Değer seçeneğini belirleyin. Son olarak, Analiz > Ölç'e tekrar tıklayın.
- Ardından, Görüntü Hesaplayıcı> İşleme'ye tıklayın ve odaklanmış görüntüyü arka plan resmine bölün. Bu sonuç için, odaklanılan görüntünün gri düzeyinin ortalama değerini çarpın. İşlem > Matematik > Çarp'a tıklayarak ortalama değeri elde edin.
- Ortalama değeri elde etmek için, odaklanmış görüntüyü seçin ve ardından Analiz > Ölç'e tıklayın. Temsili görüntü için gri seviyenin ortalama değeri 69.199'dur. Bulanıklaştırılmış görüntü için yukarıdaki yordamları tekrarlayın. Bu durumda, gri seviyenin ortalama değeri 69.231'dir. Şekil 5 , işlemden önce ve sonra odaklanmış ve bulanıklaştırılmış görüntüleri göstermektedir.
- İşlemler sırasında görüntüler görsel kontrastı kaybedebilir. Görüntüleri daha iyi görselleştirmek için, Görüntü > Parlaklık / Kontrast > Ayarla'ya tıklayın ve Otomatik seçeneğini belirleyin.
- Ardından, görüntü karşıtlığını bulmak için aşağıdaki ilişkiyi kullanın:
 , burada N Img hücrenin gri seviyesidir, N0 hücrenin dışındaki gri seviyedir ve kameraya bağlı sıfır ışık yoğunluğu için gri seviyeye karşılık gelen sabit bir parametredir.
, burada N Img hücrenin gri seviyesidir, N0 hücrenin dışındaki gri seviyedir ve kameraya bağlı sıfır ışık yoğunluğu için gri seviyeye karşılık gelen sabit bir parametredir. - B değerini bulmak için, ışık yoğunluğunu ölçmek üzere bir güç ölçer kullanın. Her ışık yoğunluğu değeri için bir video kaydedilmelidir; Böylece, farklı yoğunluk değerleri farklı gri seviyeleriyle ilişkilendirilebilir. Son olarak, doğrusal bir uyum elde edin ve B'yi sıfır ışık yoğunluğu15 ile ilişkilendirin.
- N0 değerini bulun, Poligon Seçimi simgesine tıklayın ve Şekil 6'daki gibi bir çokgen çizin. Ardından, Analiz sekmesine tıklayın ve seçilen alanın ortalama gri düzeyini bulmak için Ölçüm'ü seçin. Her görüntü bir piksel kümesinden oluşur ve her pikselin belirli bir gri seviyesi vardır. Görüntüyü oluşturan tüm pikseller nedeniyle tüm gri seviyelerin kümesi NImg'ye karşılık gelir.
- N Img - No'yu belirlemek için kontrast denklemini kullanın ve bunu İşleme > Matematik > Çıkar'ı seçerek yürütün. Sonucu N0 - B arasında bölün. Son olarak, odaklanmış (C 0) ve bulanıklaştırılmış görüntü (C1) için kontrastı bulun.
- Yükseklik profilinin elde edilmesi
- Yükseklik profilini elde etmek için, daha önce açıklanan yöntem13'ü kullanın. Kısacası, RBC kalınlığını elde etmek için Hartley dönüşümünü (FHT) kullanın. ImageJ'de, FFT Seçenekleri > FFT İşleme'> tıklayın ve ardından FHT'yi seçin.
- Aşağıdaki yordam için görüntüyü elde etmek üzere Process > Math > Subtract kullanarak ImageJ'deki C0 ve C1 görüntülerini çıkarın.
- Resim C için, FFT Seçenekleri > FFT İşleme > tıklayın ve ardından görüntünün Hartley dönüşümünü gerçekleştirmek için FHT'yi seçin. Ardından, özel yapım eklentiDivideQ2'yi kullanarak uzamsal frekans q 2'ye bölün. DivideQ2 > Eklentiye tıklayın.
NOT: DivideQ2.class dosyası, ImageJ'nin yüklü olduğu eklentiler dizinine kopyalanmalıdır. Eklenti, ImageJ'nin eklenti klasörüne dahil edilmek üzere bir .class dosyası (Ek Dosya 1) olarak sağlanır. - Ardından, hücrenin yüksekliğiyle orantılı gri düzeyde bir görüntü elde etmek için FFT > FFT'> İşle'yi kullanarak ters dönüşüm FHT'sini gerçekleştirin.
- Son olarak, aşağıdaki sabiti kullanarak elde edilen görüntüyü çarpmak için Matematik >İşlem > Çarp'a tıklayın:
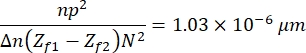
görüntülerin özelliklerine, örneğe ve deney düzeneğine göre tanımlanan13. Burada, n = 1.51 yağ kırılma indisi, p = 0.0721 μm, görüntülerin mikrometreleri ve pikselleri arasındaki ilişkidir, Δ n = 0.058, RBC ve sulu ortam kırılma indeksleri arasındaki fark, netleme ve bulanıklaştırma görüntüleri arasındaki mesafe (Z f1 - Z f2) = 2μm ve görüntülerin boyutu, N 2 = 256 pxl2. - Yükseklik profilini elde etmek için elde edilen görüntüyü kullanın (Şekil 7). Elde edilen görüntü, farklı yükseklik profillerini gözlemlemek için ImageJ'de kullanılır. Hücrede sarı dikey çizginin nereye yerleştirildiğine bağlıdır, örneğin, Şekil 7'de dikey çizgiyle sınırlı bir yükseklik profili elde edilir, bunu Ctrl + K tuşlarına basarak gözlemleyin.
- Biçim katsayısı
- RBC yükseklik profilini içeren görüntüyü bulduktan sonra, ImageJ'de iki görüntüden oluşan bir küme oluşturmak için 2 μm bulanık kontrastı kullanın. Görüntü > Yığınları'na tıklayın ve ardından Yığınlanacak Görüntüler seçeneğini belirleyin. Form faktörünü bulmak için, yığını çözümlemek üzere bir ImageJ özelleştirilmiş makrosu kullanın. ImageJ özelleştirilmiş makrosu Ek Dosya 2 olarak indirilebilir.
NOT: Program, hücre kenarlarını belirlemek için bulanıklaştırma görüntüsünü kullanır. Ardından, her yatay konum için yükseklik profilini içeren görüntüyü kullanarak çevreyi belirler. Kenarlara ek olarak, çevrenin tersini ve çevreyi belirler. Piksel kalınlığı ile çarpılan ters çevre değerlerinin toplamı, form faktörünün tersine karşılık gelir. - Programa piksel/mikrometre ilişkisini ekleyin. Bu değeri mikroskop objektif kalibrasyon deneyinden elde edin. Kullanılan örnekte, değer 13,87 piksel/μm'dir.
- Sarı çizgiyi yığının ilk görüntüsüne koymak için yatay başlangıç konumunu seçin. Çizgiyi hücrenin başlangıcından önce başlatın ve hücrenin dikey sınırlarının ötesine çizin. Örnekte, sarı çizginin uzunluğu 153 pikseldir ve başlangıç konumu i = 70, y1 = 80 ve i = 70 ve y2 = 195 arasındadır. Ardından, son konum f = 245, y1 = 80 ve f = 245 ve y2 = 195 olana kadar sarı çizgiyi yatay olarak hareket ettirin.
- Son olarak, hücre kenarlarını, çevreyi ve çevrenin tersini bulmak için, Makro sekmesini seçin ve Makroyu Çalıştır'ı tıklatın. Makro, kenarların konumunu, çevresini ve çevrenin tersini içeren bir tablo ve analiz edilen hücrenin bir görüntüsünü sunar. Bu görüntünün kenarlarının Şekil 7'nin kenarlarına benzer olup olmadığını kontrol edin, aksi takdirde yordamı tekrarlayın.
- Form faktörü 8'i bulmak için çevrenin tersinin toplamını kullanın.
- RBC yükseklik profilini içeren görüntüyü bulduktan sonra, ImageJ'de iki görüntüden oluşan bir küme oluşturmak için 2 μm bulanık kontrastı kullanın. Görüntü > Yığınları'na tıklayın ve ardından Yığınlanacak Görüntüler seçeneğini belirleyin. Form faktörünü bulmak için, yığını çözümlemek üzere bir ImageJ özelleştirilmiş makrosu kullanın. ImageJ özelleştirilmiş makrosu Ek Dosya 2 olarak indirilebilir.
7. Yumuşak camsı reoloji modeli ve deneysel analiz
- Deneysel verileri bir tabloda düzenleme
- Dosya sekmesine tıklayarak analiz yazılımında yeni bir tablo oluşturun. Aşağıdaki parametreler için 10 farklı sütun (c0'dan c9'a) belirleyin: kullanılan açısal frekanslar (rad/s): c0; Her açısal frekans için elde edilen K' (pN/μm) değerleri: c1; ErrK': c2; Her açısal frekans için elde edilen K" (pN/μm) değerleri: c3; ErrK": c4; Her açısal frekans için elde edilen G'(Pa) değerleri: c5; ErrG': c6; Her açısal frekans için elde edilen G" (Pa) değerleri: c7; ErrG": c8 ve Ff, ilgili hatasıyla birlikte: c9 (Şekil 8). Aşağıdaki sütunları doldurmak için aşağıdaki formülü kullanın:
c5 = (3 x c1) / (8 x 1,28 x 0,087)
c6 = (3 / (8 x 0,087 x 1,28)) x sqrt (c2^2 + (c1 x 0,01 / 1,28)^2 + (c1 x 0,008 / 0,087) ^ 2)
c7 = (3 x c3) / (8 x 1,28 x 0,087)
c8 = (3 / (8 x 0,087 x c4)) x sqrt (c4^2 + (c3 x 0,01 / 1,28)^2 + (c3 x 0,008 / 0,087)^2)
- Dosya sekmesine tıklayarak analiz yazılımında yeni bir tablo oluşturun. Aşağıdaki parametreler için 10 farklı sütun (c0'dan c9'a) belirleyin: kullanılan açısal frekanslar (rad/s): c0; Her açısal frekans için elde edilen K' (pN/μm) değerleri: c1; ErrK': c2; Her açısal frekans için elde edilen K" (pN/μm) değerleri: c3; ErrK": c4; Her açısal frekans için elde edilen G'(Pa) değerleri: c5; ErrG': c6; Her açısal frekans için elde edilen G" (Pa) değerleri: c7; ErrG": c8 ve Ff, ilgili hatasıyla birlikte: c9 (Şekil 8). Aşağıdaki sütunları doldurmak için aşağıdaki formülü kullanın:
- G' (ω) ve G" (ω) eğrisini çizme
- Analiz yazılımında G' (ω) ve G" (ω) eğrisini oluşturmak için önceki tablodaki verileri kullanın. Galeri > Lineer'e tıklayın ve Dağılım Grafiği formatını seçin.
- Yeni bir pencere açılacaktır. X ekseni olarak G" sütununu ve y ekseni olarak G' sütununu seçin. Son olarak, grafiği elde etmek için Çiz düğmesine tıklayın.
- Hata çubuklarını grafiğe eklemek için, Grafik penceresine tıklayın ve ardından Grafik > Hata Çubukları'na tıklayın. Yeni bir pencere açılacaktır. İlk olarak, Y Err seçeneğini işaretleyin. Hata Çubuğu Ayarları adlı başka bir pencere açılacaktır.
- % of Value (Değerin Yüzdesi) öğesine tıklayın, Data Column' (Veri Sütunu) öğesini seçin ve ardından ErrG' sütununa tıklayın. Son olarak, Tamam > Grafiği'ne tıklayın, y değerleri için hata çubukları görünecektir. Şimdi X Err karesini ve ErrG için doğru sütunu seçerek x ekseni değerleri için aynı prosedürü tekrarlayın". Son çizim Şekil 9'da gösterilene benzer olacaktır.
- Parametrelerin yumuşak camsı reoloji modeline uyması
NOT: Veri analizi iki bölüme ayrılmıştır: 1) Γ ve G m parametrelerini elde etmek için G' (ω) ve G" (ω) grafiğine uyan eğri; 2) güç yasası üs α elde etmek için ω frekansının bir fonksiyonu olarak G' (ω) ve G" (ω) eğrisinin uyarılması.- Γ ve G m parametrelerini elde etmek için G' (ω) ve G" (ω) grafiğine uyan eğri.
- Curve Fit sekmesine tıklayın, Fit1'i seçin. Yeni bir pencere açılacaktır. Meydanı seçin ve Tanımla düğmesine tıklayın. Genel eğri sığdırma tanımı adı verilen bir pencere görünecektir. Aşağıdaki denklemi yazın:
m1 + m0/m2
burada m1 = 61.576; m2 = 1, izin verilen hata 1 x 10-5 ile. Burada m0 G"yi, m1 Gm'yi ve m2 Γ temsil eder.
NOT: m1 ve m2 için, eğri uyumu tanımı sırasında ilgili değerlerinin tahmin edilmesi gerekir. Yukarıdaki tahminler, gösterilen örnek deneye dayanmaktadır. Deneylerde, sayıları grafikte gözlemlenen değerlere göre tahmin edin. - Hem pencerelerdeki OK düğmesine tıklayın hem de Şekil 10'da gösterildiği gibi bağlantı parçası görünecektir - siyah bir eğri. Grafikle birlikte görünen eğri sığdırma tablosunda listelenen m1 ve m2 için doğru değerleri kontrol edin.
- Curve Fit sekmesine tıklayın, Fit1'i seçin. Yeni bir pencere açılacaktır. Meydanı seçin ve Tanımla düğmesine tıklayın. Genel eğri sığdırma tanımı adı verilen bir pencere görünecektir. Aşağıdaki denklemi yazın:
- Açısal frekansın ω bir fonksiyonu olarak G' ve G" eğrisine uyması
- Daha sonra, ω'un bir fonksiyonu olarak G' ve ω'un bir fonksiyonu olarak G' olmak üzere iki başka grafik oluşturun. Hata çubuklarını daha önce gösterildiği gibi yalnızca y eksenine yerleştirin.
- Eğri uydurma prosedürünü tekrarlayın, ancak şimdi Eğriye Sığdırma Seçimleri'nde G" seçeneğini seçin ve ardından Genel Sığdırma > Eğri Tanımı'nda aşağıdaki denklemi yazın:

Bu durumda, m1'in G" (ω) = 23.683 Pa değeri olduğu tahmin edilirken, ω = 6.3 rad / s; m2'nin 0,5 olduğu tahmin edilmektedir (m2'nin üs α olduğunu ve 0 ile 1 arasında değiştiğini unutmayın). Şekil 10'daki m2 sonucuna göre Γ = 2.0293 değerini girin. - Ağırlık Verileri seçeneğini işaretleyin. Tüm bu işlemlerden sonra, Tamam'a tıklayın ve Şekil 11'dekine benzer bir eğri uyumu - mavi bir eğri görünecektir. α, α = 0,63 ± 0,02 ve G 0, G 0 = (3,7 ± 0,3)Pa değerleri görünecektir. Bir sonraki eğri olan G' (ω) eğrisine sığdırmak için bu değerleri kullanın.
- Bir sonraki eğriye tıklayın, eğri uydurma prosedürünü tekrarlayın, ancak şimdi Genel Uyum Eğrisi Tanımı'nda aşağıdaki denklemi yazın:

Bu durumda, m3, daha önce elde edilen değeri doğrulamak için sadece tahmini bir α değeridir. ω = 6,3 rad/s olduğunda G 0 = 3,703 ve G' (ω) = 23,683 Pa değerlerini kullanın. - Yine, izin verilen hata olarak 1 x 10-5 ekleyin ve Ağırlık Verileri seçeneğini işaretleyin. Tüm bu işlemlerden sonra, Tamam'a tıklayın ve Şekil 11'dekine benzer bir eğri uyumu - yeşil bir eğri görünecektir.
- Γ ve G m parametrelerini elde etmek için G' (ω) ve G" (ω) grafiğine uyan eğri.
Sonuçlar
Şekil 1, reoloji ölçümleri için kullanılan OT sisteminin şematiklerini göstermektedir. Şekil 2, her iki küre ile mikroreoloji deneyinin şematiklerini göstermektedir ve temsili bir RBC de gösterilmiştir. Şekil 3, sinüzoidal hareketlerin piezoelektrik aşama tarafından üretildiği zamanın bir fonksiyonu olarak her iki kürenin genlikleri için tipik bir eğri göstermektedir. Referans küre (Şekil 3 - kırmızı eğri) sahne hareketini takiben salınırken, RBC küresi (Şekil 3 - mavi bir eğri) farklı bir genlik ve faz ile salınır. Bu parametreleri ölçerek, numunedeki farklı RBC'ler için karmaşık elastik sabit K* (ω) belirlemek mümkündür. Şekil 4, kayıp elastik sabiti K" (ω) 'nin bir fonksiyonu olarak depolama elastik sabiti K' (ω) için tipik bir grafik göstermektedir. Gözlemlenen doğrusal bağımlılık, RBC yüzeyinin yumuşak camsı bir malzeme olarak kabul edilebileceğini göstermektedir. Daha sonra, genel hücre form faktörü olan Ff'yi elde etmek için bir DM prosedürü gereklidir ve Şekil 5, Şekil 6 ve Şekil 7, amaç için gerekli adımlardan bazılarını içerir. Daha sonra, kuvvetleri ve deformasyonları gerilmelere ve gerinimlere dönüştürmek için, K * (ω) 'yi G * (ω) 'ye dönüştürmek gerekir.
Karmaşık RBC elastik sabiti K* (ω) = K' (ω) + iK" (ω) olarak tanımlanır. Ayrıca, K* (ω), RBC kompleks kesme modülü G* (ω) = G' (ω) + iG" (ω) ile ilişkilidir. G' (ω) ve G" (ω) sırasıyla RBC kesme depolama ve kayıp modülüdür. K* (ω) ve G* (ω) arasındaki ilişki şu şekilde verilir:

burada F, daha önce de belirtildiği gibi RBC geometrisine bağlı bir form faktörüdür ve ζ, daha önce ζ = (0,087 ± 0,009) μm 8,15 olarak belirlenen RBC membran kalınlığıdır.
Ayrıca, depolama G' (ω) ve G" (ω) kayıp kesme modülü,sırasıyla 8,9 denklemleri aracılığıyla depolama K' (ω) ve kayıp K" (ω) elastik sabitleri ile ilişkilidir
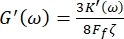 ve
ve 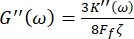
Sırasıyla G' (ω) ve G" (ω), Err G' ve Err G" için standart hataları bulmak için, aşağıdaki denklemlere göre 8,9'a göre, belirsizlikler denklemlerinin K' (ω) ve K " (ω) sonuçlarıyla yayılmasını kullanın:

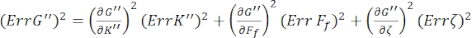 .
.
Yumuşak camsı reoloji teorisine göre, RBC'ler emülsiyonlar, macunlar ve bulamaçlargibi viskoelastik malzemeler gibi davranırlar 8,9 ve depolama ve kayıp modülleri aşağıdaki denklemlere uyar: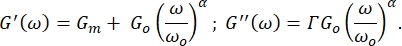
Böylece, G m'nin hücre zarı kesme modülü olduğu yerde, G 0 düşük frekanslı depolama modülüdür Γ orandır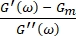 , α yumuşak camsı reoloji modelinin güç yasası üssüdür ve ω0 = 1 rad / s 8,9'dur.
, α yumuşak camsı reoloji modelinin güç yasası üssüdür ve ω0 = 1 rad / s 8,9'dur.
Ff ve ayrıca RBC yüzey kalınlığı ζ için bulunan değerler kullanılmıştır (87 ± 8 nm 8,9,15 olarak tahmin edilmektedir). Sonuçlar Şekil 8, Şekil 9 ve Şekil 10'da gösterilmiştir. Yine, G' ve G" arasındaki doğrusal bağımlılık, RBC yüzeylerinin yumuşak camsı malzemeler olarak modellenebileceği hipoteziyle uyumludur. Ayrıca, bu grafiğin doğrusal uyumundan G m değeri elde edilebilir ve bu değeri G" nin yumuşak camsı reoloji eğrisi uyumuna sokarak, G0 ve α değerleri belirlenir (Şekil 11 - mavi bir eğri). Ayrıca, G0 için elde edilen sonucu kullandıktan ve G' nin yumuşak camsı reoloji eğrisi uyumuna ekledikten sonra, hata çubukları içinde üs için aynı değer türetilir (Şekil 11 - yeşil bir eğri).

Resim 1: OT mikroskobunun şematik gösterimi. Tüm sistem titreşim önleyici bir masa üzerine inşa edilmiştir. Lazer, en az iki farklı dikroik ayna (beyaz) kullanılarak hizalanır ve başka bir dikroik ayna (açık mavi) kullanılarak mikroskop objektif lensinin arka girişine yönlendirilir. Piezoelektrik bir sahne ve bir bilgisayara bağlı dijital bir bilimsel kamera da gereklidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
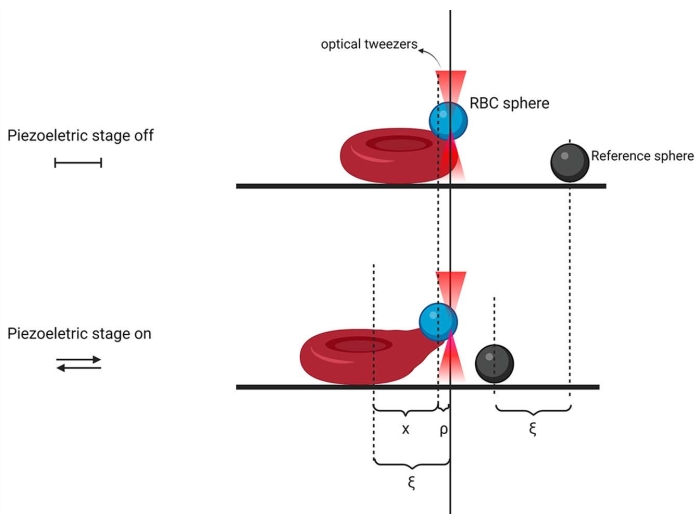
Şekil 2: Mikroreoloji deneyinin şematiği. Referans küre (koyu gri) kapak kaymasına tutturulur ve RBC küresi (mavi) eritrosit yüzeyine (kırmızı) tutturulur ve OT tarafından tutulur (lazer açıkken şeftali üçgenleri ile gösterilir). ρ , RBC küresinin tuzaktaki denge konumudur; ξ , numunenin sinüzoidal hareketidir ve x, hücre deformasyonudur. Şematik görüntü Biorender'da oluşturuldu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
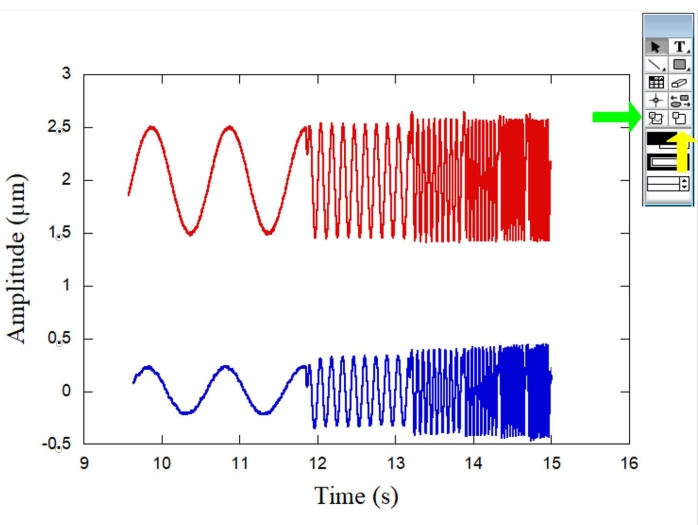
Şekil 3: Piezoelektrik aşama tarafından sinüzoidal hareketler üretildiğinde her iki kürenin zaman içindeki genliklerini (μm) gösteren grafik. Referans küre (kırmızı eğri) sahne hareketini takiben salınırken, RBC küresi (mavi eğri) farklı bir genlik ve faz ile salınır. Sağdaki yeşil ok veri seçim aracını, sarı ok ise yakınlaştırma seçim aracını gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: RBC mikroreoloji sonuçları. Elastik sabiti, numunedeki farklı RBC'ler için kayıp elastik sabitinin bir fonksiyonu olarak saklayın (n = üç farklı numuneden 10 farklı hücre). Veri noktaları, hem K ' (y ekseni) hem de K" (x ekseni) ortalama değerlerini, deney kurulumunda kullanılan her açısal frekans için elde edilen ilgili hata çubuklarıyla (ortalamanın standart hatası) temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
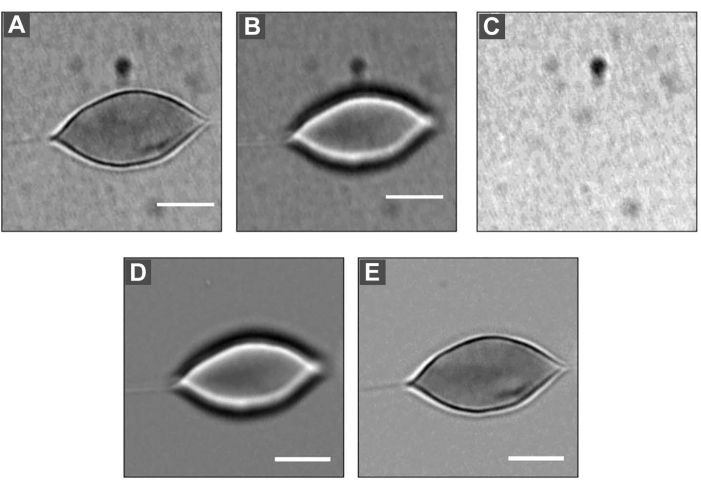
Şekil 5: Bir RBC'ye uygulanan DM . (A) Bulanıklaştırılmış görüntü, boyut = 2 μm. (B) Netlemedeki görüntü. (C) Arka plan resmi. Her görüntüyü (A) ve (B) arka plan görüntüsüne (C) bölerek ve ardından her görüntünün ortalama gri değeri ile çarparak, (D) ve (E) görüntülerini elde etmek mümkündür. Ölçek çubuğu: 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
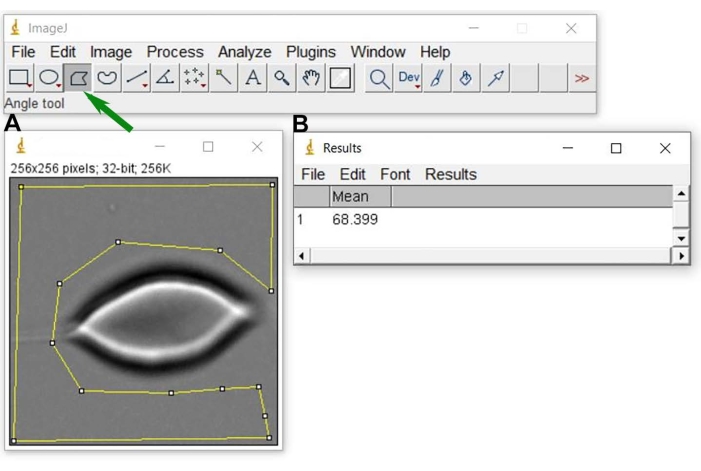
Şekil 6: Arka plan gri seviyesi N0. Temsili görüntüyü ImageJ (A) içinde açtıktan sonra, arka plan gri düzeyinin ve sonucun (B) ortalama değerini elde etmek için kullanılan bir bölge (RBC hücresinin etrafındaki sarı geometrik şekil) seçin. A'da sarı seçimi gerçekleştirmek için, Resim J'nin çokgen seçim aracını kullanın (yeşil okla gösterilir). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 7: Deforme olmuş RBC için yükseklik profili. Görüntünün dikey sarı çizgisi (sağda) boyunca temsil edilen yükseklik profili (solda). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 8: Analiz yazılımındaki tipik bir sonuç tablosunun temsili ekran görüntüsü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 9: RBC viskoelastik parametreleri. Kesme modülünü, numunedeki farklı RBC'ler için kayıp kesme modülünün bir fonksiyonu olarak saklayın (n = üç farklı numuneden 10 farklı hücre). Veri noktaları, deneylerde kullanılan her açısal frekans için elde edilen ilgili hata çubuklarıyla (ortalamanın standart hatası) hem G' (y ekseni) hem de G " (x ekseni) ortalama değerlerini temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 10: G " (Pa)'nın bir fonksiyonu olarak G ' (Pa)'nın eğri uyumu. Doğrusal siyah çizgi, veri noktaları için uygun eğridir. N = Üç farklı örnekten 10 farklı hücre. Hata çubukları, ortalamanın standart hatasını temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
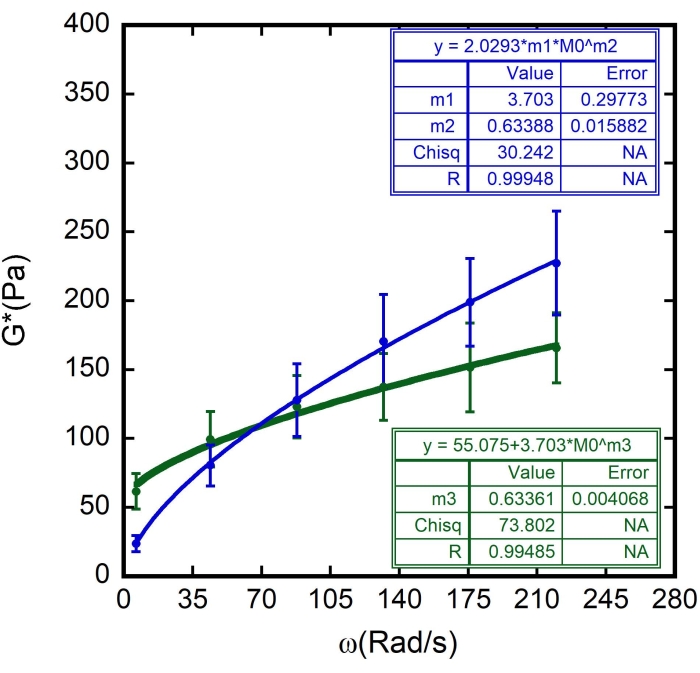
Şekil 11: Yumuşak camsı reoloji modelinin sonuçlara göre ayarlanması. Numunedeki farklı RBC'ler için açısal frekans ω'un bir fonksiyonu olarak karmaşık kesme modülü (G*). Grafikteki yeşil daireler G'nin ortalama değerlerini temsil ederken, mavi daireler G'nin ortalama değerlerini temsil eder. Sürekli yeşil ve mavi çizgiler, yumuşak camsı reoloji modeli için eğri bağlantı parçalarını temsil eder. m1, m2ve m3parametreleri grafikte belirtilmiştir. m1 G0 iken, m2 ve m3üs oluştururken, α. N = üç farklı örnekten 10 farklı hücre. Hata çubukları, ortalamanın standart hatasını temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Ek Dosya 1: ImageJ eklentisi DivideQ2.class. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: ImageJ, form faktörünü elde etmek için makroyu özelleştirdi. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, RBC'lerin viskoelastik özelliklerini nicel olarak haritalamak için optik cımbız ve defokus mikroskobuna dayanan entegre bir yöntem sunulmaktadır. depolama ve kayıp kesme modülü için sonuçlar, RBC'nin yumuşak camsı reolojisini karakterize eden ölçekleme üssü ile birlikte belirlenir. Bu protokolün, fizyolojik durum8'de veya P. falciparum intra-eritrositik siklus9'un her aşaması boyunca olduğu gibi farklı deneysel koşullar için uygulanması zaten gerçekleştirilmiştir.
Literatürdeki referanslar, RBC reolojisindeki tutarsızlıklara işaret etmekte olup, kısmen ölçümler sırasında uygun şekilde dikkate alınmayan hücre morfolojisindeki değişikliklere atfedilmektedir 6,7. Dinamik ışık saçılması kullanılarak, RBC depolama ve kayıp modülü için değerler, 1-100 Hz6 frekans aralığında 0,01-1 Pa arasında değişen değerler bildirilmiştir. Başka bir çalışmada, optik manyetik büküm sitometrisi kullanılarak, görünür kompleks elastik modül7 olarak belirlendi, ancak dinamik ışık saçılma değerlerinden ayrıldı; Böylece, karşılaştırmalı amaçlar için 84'lük bir çarpma faktörü kullanılmıştır. Bu protokolde açıklanan prosedürleri takiben, bu farklılıklar noninvaziv bir defokus mikroskobu tekniği 11,12,13 kullanılarak RBC form faktörü karakterize edilerek açıklığa kavuşturulmuştur 8. Hücre yüzeylerini karakterize eden karmaşık kesme modülü, ancak geometri16,17 olarak kabul edilirse ve bu her zaman uygun şekilde gerçekleştirilmemişse elde edilebilir.
Bu protokolde sunulan entegre metodoloji, aynı tek hücre için birbiri ardına her iki yöntemin de (OT ölçümü ve DM ölçümü) gerçekleştirilmesine izin verir. Ayrıca, bir popülasyondaki farklı hücreler için OT ölçümleri yapmaya ve daha sonra aynı hücre popülasyonundaki diğer hücreler için DM ölçümleri yapmaya izin verir. Son seçenek muhtemelen her iki sonuca da daha fazla değişkenlik getirecektir, ancak hatalar, sonuçların genel RBC morfolojisini, belirli bir deneysel duruma karşılık gelen belirli bir hücre popülasyonundaki genel RBC viskoelastik özellikleriyle ilişkilendireceği şekilde buna göre yayılabilir.
Bu protokolün yürütülmesinin ana sınırlaması, optik cımbız ve defokus mikroskobunun bir entegrasyonu olduğu için yöntemin kendisini gerçekleştirmedeki içsel zorluktur; Bu nedenle, açıklanan tüm adımları gerçekleştirmek için cihazların mevcudiyeti zor olabilir. Bununla birlikte, bir OT tesisine erişimi varsa, sonunda deneyleri gerçekleştirmek için tesisi uyarlamak çok daha uygundur. Mevcut protokolün uyduğu yer burasıdır, sadece ölçümleri ve analizleri gerçekleştirmek için her adımı detaylandırmakla kalmaz, aynı zamanda insanların sıfırdan bir kurulum oluşturmak yerine bu OT sistemlerini tanımlamalarına ve benimsemelerine yardımcı olur.
Ayrıca, kapaklara RBC bağlanması, yapışkan olmayan hücreler oldukları için sınırlayıcı bir faktör haline gelir ve bu tür adımlar, bazı RBC'ler ayrılabileceğinden, ölçümlerde zorluklara neden olabilir. Bu nedenle, iyi yapışmış bir RBC seçmek önemlidir. Seçimin başarılı olup olmadığını kontrol etmenin bir yolu, numunenin ölçüm için hazırlanması sırasında gerçekleşebilir. OT sıkışmış RBC küresini hücre yüzeyine yerleştirdikten sonra, hücrenin sıkıca sabitlendiğinden ve OT sıkışmış boncuğun ardından konumunun değişmediğinden emin olmak için numuneyi hafifçe hareket ettirin. Bu durumda, örnekte başka bir hücre arayın. RBC'yi aynı anda yakalamak ve reoloji ölçümlerini aynı anda gerçekleştirmek için çift ışınlı OT kullanımı gibi gelecekteki iyileştirmeler de yapılabilir.
Bunun dışında, RBC'lerin tek hücre bazlı kantitatif viskoelastik bilgilerini çıkarma olasılığı, yeni keşfedilmeye başlanan çeşitli uygulamalara olanak tanır 8,9. Bu nedenle, sunulan yöntem, örneğin orak hücre hastalığı ve talasemi gibi diğer fizyo-patolojik durumlar altında veya orak hücre hastalığı ve talasemi gibi genetik kan hastalıklarında RBC mekanik davranışının karakterizasyonuna genişletilebilir. Böyle bir entegre araç, RBC viskoelastik özelliklerindeki değişiklikleri farklı patolojilere sahip bireylerin kan akışındaki değişikliklerle ilişkilendirebilen yeni tanı yöntemlerinin geliştirilmesi için temel sağlayabilir.
Açıklamalar
Yazarların bu makalede açıklanan ürünlerde hiçbir finansal çıkarları yoktur ve açıklayacak başka bir şeyleri yoktur.
Teşekkürler
Yazarlar, CENABIO gelişmiş mikroskopi tesisinin tüm üyelerine tüm önemli yardımları için teşekkür etmek isterler. Bu çalışma Brezilya ajansları Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Financial Code 001, Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) ve Instituto Nacional de Ciência e Tecnologia de Fluidos Complexos (INCT-FCx) ile Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) tarafından desteklenmiştir. B.P., FAPERJ'den bir JCNE hibesi ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 35mm culture dishes | Corning | 430165 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| Coverslips | Knittel Glass | VD12460Y1A.01 and VD12432Y1A.01 | |
| Glass-bottom dishes | MatTek Life Sciences | P35G-0-10-C | |
| Glucose | Sigma-Aldrich | G7021 | |
| ImageJ | NIH | https://imagej.nih.gov/ij/ | |
| Immersion oil | Nikon | MXA22165 | |
| Inverted microscope | Nikon | Eclipse TE300 | |
| KaleidaGraph | Synergy Software | https://www.synergy.com/ | |
| KCl | Sigma-Aldrich | P5405 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Microscope camera | Hamamatsu | C11440-10C | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S5886 | |
| Neubauer chamber | Sigma-Aldrich | BR717805-1EA | |
| Objective lens | Nikon | PLAN APO 100X 1.4 NA DIC H; PLAN APO 60x 1.4 NA DIC H and Plan APO 10x XXNA PH2 | |
| Optical table | Thorlabs | T1020CK | |
| OT laser | IPG Photonics | YLR-5-1064-LP | |
| Polystyrene microspheres | Polysciences | 17134-15 | |
| rubber ring | Forever Seals | NBR O-Ring | |
| Silicone grease | Dow Corning | Z273554 | |
| Stage positioning | PI | P-545.3R8S | |
| Pipette | Gilson | P1000 |
Referanslar
- Fowler, V. M. The human erythrocyte plasma membrane: a Rosetta Stone for decoding membrane-cytoskeleton structure. Current Topics in Membranes. 72, 39-88 (2013).
- Tomaiuolo, G. Biomechanical properties of red blood cells in health and disease towards microfluidics. Biomicrofluidics. 8 (5), 051501 (2014).
- Depond, M., Henry, B., Buffet, P., Ndour, P. A. Methods to investigate the deformability of RBC during malaria. Frontiers in Physiology. 10, 1613 (2019).
- Boal, D. . Mechanics of the Cell. 2 edn. , (2012).
- Balland, M., et al. Power laws in microrheology experiments on living cells: Comparative analysis and modeling. Physical Review E. 74 (2), 021911 (2006).
- Amin, M. S., et al. Microrheology of red blood cell membranes using dynamic scattering microscopy. Optics Express. 15 (25), 17001-17009 (2007).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. American Journal of Physiology Cell Physiology. 293 (2), 597-605 (2007).
- Gomez, F., et al. Effect of cell geometry in the evaluation of erythrocyte viscoelastic properties. Physical Review E. 101 (6-1), 062403 (2020).
- Gomez, F., et al. Plasmodium falciparum maturation across the intra-erythrocytic cycle shifts the soft glassy viscoelastic properties of red blood cells from a liquid-like towards a solid-like behavior. Experimental Cell Research. 397 (2), 112370 (2020).
- Pompeu, P., et al. Protocol to measure the membrane tension and bending modulus of cells using optical tweezers and scanning electron microscopy. STAR Protocols. 2 (1), 100283 (2021).
- Agero, U., Mesquita, L. G., Neves, B. R., Gazzinelli, R. T., Mesquita, O. N. Defocusing microscopy. Microscopy Research and Technique. 65 (3), 159-165 (2004).
- Agero, U., Monken, C. H., Ropert, C., Gazzinelli, R. T., Mesquita, O. N. Cell surface fluctuations studied with defocusing microscopy. Physical Review E. 67 (5), 051904 (2003).
- Roma, P. M. S., Siman, L., Amaral, F. T., Agero, U., Mesquita, O. N. Total three-dimensional imaging of phase objects using defocusing microscopy: Application to red blood cells. Applied Physics Letters. 104 (25), 251107 (2014).
- Köhler, A. New method of illumination for photomicrographical purposes. Journal of the Royal Microscopical Society. 14, 261-262 (1894).
- Nans, A., Mohandas, N., Stokes, D. L. Native ultrastructure of the red cell cytoskeleton by cryo-electron tomography. Biophysical Journal. 101 (10), 2341-2350 (2011).
- Ayala, Y. A., et al. Rheological properties of cells measured by optical tweezers. BMC Biophysics. 9, 5 (2016).
- Ayala, Y. A., et al. Effects of cytoskeletal drugs on actin cortex elasticity. Experimental Cell Research. 351 (2), 173-181 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır