Method Article
Kalsiyum Görüntüleme Tekniği ile Nöron-Glia Devresindeki Değişimlerin Görselleştirilmesi
Bu Makalede
Özet
Hücre kalsiyum görüntüleme, benzersiz fonksiyonel imzalar veren kalsiyum geçirgen kanalların / reseptörlerin ekspresyonuna dayanarak, bireysel hücrelerin, kültürdeki karışık popülasyonların ve hatta uyanmış hayvanların dinamik sinyalizasyonunu incelemek için çok yönlü bir metodolojidir.
Özet
Burada, kalsiyum kaymaları açısından dinamik olarak incelenen glia (astrositler, oligodendrositler ve mikroglia) ve / veya periferik (dorsal kök ganglionları) ve merkezi dokulardan (korteks, subventriküler zon, organoid) nöronlara dayanan devrelerin seçici in vitro modelleri hakkında rapor verdik. Sonuçları göstermek için seçilen model, karmaşık hücresel etkileşimlere sahip basit bir doku olan retinadır. Kalsiyum, önemli hücresel rollerin çoğunda yer alan evrensel bir habercidir. Kültürdeki retinal nöron-glial hücrelerin kalsiyum kaymalarını öngörerek nasıl hazırlanabileceğini ve değerlendirilebileceğini adım adım bir protokolle açıklıyoruz. Bu modelde, nöronları KCl ve ATP'ye seçici tepkilerine dayanarak glia'dan ayırıyoruz. Kalsiyum geçirgen reseptörleri ve kanalları seçici olarak farklı bölmelerde eksprese edilir. Kalsiyum yanıtlarını analiz etmek için, Fura-2 gibi oranmetrik floresan kalıpları kullanıyoruz. Bu prob, Ca2 + serbest ve Ca2 + 'ya bağlı formlara dayanarak serbest Ca2 + konsantrasyonunu ölçer ve iki dalga boyunda algılanan floresan yoğunluğuna dayanan iki farklı tepe noktası sunar.
Giriş
Kalsiyumun ikinci bir haberci olarak evrensel özellikleri nedeniyle, bu iyon çok sayıda sinyal aktivitesinde rol oynar: gen transkripsiyonu, doğum ve ölüm, çoğalma, göç ve farklılaşma, sinaptik iletim ve plastisite. Bu nedenle, kalsiyum aktivasyon dinamiklerini sadakat ve çeviklikle izleyebilen bir yöntem, benzersiz mekansal-zamansal tepkileri gözlemlemenin bir yolunu sağlayacaktır. Böyle bir yöntem, kalsiyum kaymalarını fonksiyonel verileri, farklı yanıtlarına göre spesifik hücre fenotipleriyle ilişkilendiren hücresel kalsiyum görüntüleme tekniğidir.
Ca2+ probları ilk olarak 1980'lerde geliştirildi ve daha sonraki iyileştirmeler bu moleküllerin canlı hücre tahlillerinde kullanılmasına izin verdi1. Kimyasal bir gösterge olarak, Fura-2 kantitatif [Ca2+]i ölçümleri için standart olarak kabul edilir. Bu göstergenin asetoksimetil (AM) esteri (yani, Fura-2 AM) hücre zarına kolayca nüfuz eder ve inkübasyon seyreltmesinden 20 kat daha büyük hücre içi konsantrasyonlara ulaşabilir (örneğin, [5 μM]o / [100 μM]i). Fura-2'nin bir diğer avantajı, iyi fotobeyazlatma direncine sahip olmasıdır; Bu nedenle, bu göstergenin daha uzun süre görüntülenmesi, floresan yeteneklerini büyük ölçüde etkilemeyecektir. Son olarak, Fura-2, ~ 100 nM'den ~ 100 μM'ye kadar çok çeşitli kalsiyum seviyelerine duyarlıdır ve dinlenme [Ca2 +] i2 ile karşılaştırılabilir olan ~ 145 nM'lik bir Kd'ye sahiptir. Daha sonra, boya yüklemesinden etkilenmeyen oranmetrik problarla birlikte daha iyi floresan mikroskoplar ve hesaplama yöntemleri ile hücre kalsiyum görüntüleme geliştirilmiştir.
Her hücre, nihai cevaba belirli bir imza olarak katkıda bulunan farklı kalsiyum cihazlarını (pompalar, taşıyıcılar, reseptörler ve kanallar) ifade eder. Önemli ipucu, fenotipik ifadeleriyle ilişkili farklı hücre tiplerinin seçici yanıtlarını bulmaktır. Buna göre, kalsiyum kaymaları yoluyla çalışan en az iki farklı reseptör vardır: Ca2 + 'ya hızlı modda nüfuz eden iyonotropik reseptörler ve sinyal yolaklarına ve inositol trifosfat ve siklik ADP-riboz3 gibi ikinci haberciler tarafından aktive edilen Ca2 + 'yı serbest bırakan hücre içi stoklara bağlı yavaş metabotropik reseptörler.
Örneğin, progenitör hücreler olgunlaşmamış retinada nestin eksprese eder ve GABA (veya mussimol) tarafından depolarize edilen GABAA reseptörlerini gösterir4. Bu, yüksek hücre içi Cl− seviyelerine sahip Cl-elektrokimyasal gradyanı nedeniyle olur; Doku geliştikçe, KCC2 taşıyıcıları progenitörler üzerinde uyarılmadan olgun GABAerjik nöronlar üzerinde inhibisyona geçer5. Öte yandan, doğum sonrası kemirgenlerin olgunlaşmamış subventriküler bölgesinde (SVZ) sox-2 eksprese eden kök hücreler de yavaş bir şekilde Ca2 + 'yı artıran histamin tarafından aktive edilen metabotropik H1 reseptörleri sunar6. Proteaz ile aktive edilmiş reseptör-1 (PAR-1) ailesinden ikinci bir metabotropik reseptör, trombin ve aşağı akış tarafından G (q / 11) ve fosfolipaz C'ye (PLC) aktive edilir, multipotent SVZ nöral kök hücrelerinden üretilen oligodendrositlerde (O4 ve PLP'yi eksprese eden) yavaş Ca2 + kaymaları verir7.
Genel olarak, nöronlar voltaja bağımlı kalsiyum kanallarının yanı sıra glutamaterjik (AMPA, NMDA, kainat) ve periferik ve merkezi nikotinik reseptörler olarak Ca2 + 'ya geçirgen olan majör nörotransmitter reseptörlerini eksprese eder. Potasyum klorür genellikle subventriküler bölge9 veya retina10'dan itibaren dorsal kök ganglion nöronları8 veya merkezi nöronlar olarak periferik nöronları aktive etmek için depolarizan bir ajan olarak kullanılır. Öte yandan, ATP, seçici Ca2 + geçirgen P2X üyelerini P2X7 ve P2X4 olarak aktive eden ana gliotransmitter (D-serine ek olarak) olarak kabul edilmektedir. Her iki reseptör de, vericiler tarafından aktive edilen en büyük Ca2+ akımları olarak kabul edilen NMDA reseptörleri tarafından gösterilenlere benzer şekilde eşdeğer Ca2+ akımları sunar11. P2X7 reseptörleri mikroglia üzerinde yüksek oranda eksprese edilir, ancak astrositler ve oligodendrositler üzerinde daha düşük bir yoğunlukta, proinflamatuar sitokinlerin salınımında rol oynar12. P2X7 reseptörleri ayrıca retinadaki Schwann hücreleri13 ve Müller glia üzerinde de eksprese edilir14,15.
Retinanın beyinde görülen hemen hemen tüm vericileri gösterdiği bilinmektedir. Örneğin, dikey eksen (fotoreseptörler, bipolar ve retinal ganglion hücreleri) esas olarak glutamaterjiktir, kalsiyum geçirgen AMPA veya kainat reseptörleri OFF-bipolar hücrelerde eksprese edilir ve mgluR6 ON-bipolar hücrelerde eksprese edilir16. İlginçtir ki, her üç reseptör de kalsiyum ve inositol trifosfat yolaklarına bağlı olan Müller glia'da da bulunur17,18. Yatay ve amakrin hücreler tarafından yapılan yatay inhibitör eksen, sadece GABA'yı değil, aynı zamanda dopamin, asetilkolin ve diğer klasik nörotransmiterleri de salgılar. Amakrin hücreler, kuş retina kültürlerinde bulunan ve glutamaterjik, pürinerjik, nikotinik ve voltaja bağımlı kalsiyum kanalları gibi çeşitli kalsiyum ile çalışan kanallar gösteren ana hücre tipleridir. Bu nedenle, bu, nöronlar ve glia arasındaki kalsiyum kaymalarının farklı özelliklerini değerlendirmek için mükemmel bir modeldir.
Bu nedenle, gelişim sırasında seçici fenotipik belirteçlere özetlenen farklı reseptörlerin ve kanalların farklı agonist yanıt paternleri ile kombinasyonu, seçici sinyal cihazları aracılığıyla çalışan gövde, progenit, nöron, astrosit, oligodendrosit ve mikroglia'da benzersiz imzalara izin verir.
Protokol
Hayvanları içeren tüm deneyler, Rio de Janeiro Federal Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin "Laboratuvar Hayvanları Bakımı İlkeleri" (NIH, Bethesda, ABD) kurallarına uygun olarak onaylanmış ve gerçekleştirilmiştir; döllenmiş Beyaz Leghorn tavuk yumurtası için IBCCF-035 izin numarası.
1. Çözeltilerin hazırlanması
- Krebs çözeltisini hazırlayın: (132 mM NaCl, 4 mM KCl, 1.4 mM MgCl2, 2.5 mM CaCl2, 6 mM glikoz, 10 mM HEPES, pH 7.4, 373 mOsm).
- Tuzlu tampon hazırlayın (Ca2+ ve Mg2+ içermeyen çözelti - CMF): 76.55 g/L NaCl, 3.05 g/L KCl, 1.65 g/L Na2HPO4, 0.610 g/L KH2PO4, 21.95 g/L glikoz ve 7.90 g/L NaHCO3.
- Kuluçka çözeltisi hazırlayın (Krebs çözeltisinde Fura-2 ile:) 5 μM Fura-2-asetoksimetil ester (Fura-2),% 0.1 yağ asidi içermeyen sığır serum albümini (BSA) ve% 0.02 Poloxamer 407.
- Karışık popülasyon veya glia kültürü için, DMEM / F12'yi% 10 fetal buzağı serumu (FCS) ve ortam olarak 40 mg / L gentamisin ile hazırlayın.
- Nöron ile zenginleştirilmiş kültür için,% 1 FCS, nöronal hücre kültürü takviyesi, 40 mg / L ve gentamisin ile DMEM / F12'yi ortam olarak hazırlayın.
2. Retina diseksiyonu ve hücre kültürü hazırlama
- Hava hücresinin bulunduğu 8 günlük civciv embriyosu (E8) yumurtasını açın.
- Yumurta içeriğini bir Petri kabına çıkarın ve bir çift cımbızla kafasını keserek embriyo ötenazisine devam edin.
- Kafayı temiz bir Petri kabına getirin ve yıkamak için biraz kalsiyum ve magnezyum içermeyen çözelti (CMF) dökün.
- Gözleri çıkarın, süreçte zarar vermemeye özen gösterin.
NOT: Göz boşluğundan çıkarmadan önce göz katmanlarını kesmekten veya parçalamaktan kaçının. - Gözleri CMF içeren temiz bir Petri kabına getirin.
- Lensi çıkararak göz diseksiyonuna başlayın.
- Lensin bıraktığı delikten başlayarak gözde 3 veya 4 uzunlamasına kesik yapın. Cımbızı çekerek, göz sklerasını zıt yönlerde tutarak kesikler yapın.
- Şeffaf vitreus gövdesini dikkatle çıkarın, retinanın ona bağlı olmadığından emin olun.
- Retinayı pigmentli epitelden ayırın ve kalan dokuları çıkarın.
- Berrak retinayı küçük parçalar halinde kesin.
- Retinayı başka bir alıcıya aktarın ve CMF'yi çıkarmak için kısaca santrifüj yapın (1 dakika boyunca ~ 1.800 x g).
- Retinayı 10 dakika boyunca 37 ° C'de inkübe ederek 1 mL% 0.25 tripsin ile enzimatik olarak ayırın.
- % 10 FCS içeren 1 mL ortam ekleyerek reaksiyonu durdurun.
- Retinayı 2 veya 3 kez ortamla yıkayın. Yıkama, ortam ekleme ve santrifüjleme ile çıkarma döngülerinden oluşur (1 dakika boyunca ~ 1.800 x g).
- Retina başına 2 mL tam ortam ekleyin ve retinayı yukarı ve aşağı pipetleyerek yavaşça mekanik olarak ayırın.
NOT: Burada, araştırmacılar hangi kültür türünün hazırlanacağını seçebilirler. Zenginleştirilmiş bir nöronal kültür için, DMEM-F12 + nöronal takviye +% 1 FCS + antibiyotik kullanın. Karışık popülasyon veya saflaştırılmış glia için DMEM-F12 +% 10 FCS + antibiyotik kullanın. - Hücreleri sayın ve istenen yoğunluğa kadar seyreltin.
NOT: İdeal olarak, bu ~ 2 x 106 hücre veya daha az hücreli düşük yoğunluklu bir kültür olmalıdır. - Her bir kapak kaymasına 50 μL hücre süspansiyonu ekleyin.
- Kapak kayması tedavisi
- 37 °C'de sterilize edilmiş arıtılmış suda 10-50 μg/mL poli-L-lizin 1 mL'de en az 1 saat (ideal olarak gece boyunca) inkübe edin.
- Poli-L-lizin çözeltisini çıkarın ve kapak kapaklarını sterilize edilmiş arıtılmış suyla 2-3 kez yıkayın.
- UV ışıkları açıkken bir güvenlik kabininde kapakların kurumasına izin verin. Bu noktada, bunları 4 ° C'de kapalı bir kapta 1 aya kadar saklayın.
- İsteğe bağlı adım: Nöron ile zenginleştirilmiş kültürler için, PBS'de 50 μL 10-20 ng / mL laminin veya 37 ° C'de 2 saat boyunca her bir kapak kaymasına orta derecede ekleyin. Kuluçkadan sonra, laminin çözeltisi fazlalığını çıkarın ve kapak kayması kullanıma hazırdır.
- Hücreleri cama yapışana kadar %5 CO2 atmosferinde 37 °C'de inkübe edin. Bu yaklaşık 1-2 saat sürmelidir.
- Her bir kuyucuğa 1 mL tam ortam ekleyin ve plakayı deney gününe kadar inkübatöre geri koyun. Gerekirse, ortamı her 2-3 günde bir değiştirin.
3. Fura-2 ile hücrelerin yüklenmesi
- 50 μL DMSO ile 50 μg'lık bir Fura-2 şişesini yeniden oluşturun.
- Çalışan Fura-2 çözeltisini hazırlamak için, DMSO'da 3 μL% 10 Poloxamer 407, 7.5 μL Fura-2 ve Krebs çözeltisi q.s.p.'yi 1.5 mL'ye ekleyin.
- Karışımı bir su banyosunda 7 dakika boyunca sonikleştirin.
- Fura-2'de inkübe etmeden önce kapak fişini Krebs çözeltisi ile hücre kültürü 3x ile yıkayın.
- 37 °C'de ve 30 dakika boyunca %5 CO2'de inkübe edin.
- Kuluçkadan sonra, 3x tekrar yıkayın ve Krebs içeren ve ışıktan korunan başka bir alıcıya aktarın.
NOT: Çalışma Fura-2 çözümü, ışıktan korunursa 24 saat boyunca sabit kalır.
4. Hücrelerin kalsiyum görüntülemesi
- Her çalıştırmadan önce, deney sırasında sızıntıyı önlemek için kapak kaydırma desteğine ve haznesine silikon ekleyin.
- Mikroskop merceğinde tuz kristalleşmesini önlemek için kapak kapağının altını damıtılmış suyla yıkayın.
- Kapak fişini desteğin üzerine koyun, kenarlıklara hafifçe bastırın.
- Destek ve odacığı mikroskopa takın ve hücreleri Krebs çözeltisi ile perfüzyona başlayın.
NOT: Tek hücreli kalsiyum görüntüleme deneyleri sırasında hücre perfüzyonu 0,5 mL/dak akış hızına kalibre edilir ve platform çözeltisinin tamamen değiştirilmesi 8-10 s sürer. - Hücrelere bir göz atın ve uygun bir görüş alanı seçin.
- Hücre gövdelerini farklı morfolojilerine göre manuel olarak seçin.
- Herhangi bir uyaran uygulamadan önce, temel stabilizasyonu bekleyin. Her uyaran yaklaşık 30 saniye sürmelidir.
NOT: Her deneyden hemen önce tüm çözümleri hazırlayın. - 340 ve 380 nm'de alternatif uyarılmayı (750 milisaniye) takiben 510 nm'de yayılan floresan oranını ölçerek [Ca2+]i'deki varyasyonları değerlendirin.
- Bir floresan analiz yazılımı kullanarak elde edilen değerleri işlemek.
- Deneysel sonuçları, her satırın tek bir hücreyi ve her satırın bir zaman noktasını temsil ettiği bir tabloda ifade edin.
5. Veri işleme
- Bir elektronik tablo yazılımı kullanarak, tekil hücrelerin Fura-2 floresan oranı değerlerinin varyasyonunu ayrı ayrı veya hepsinin aynı anda çizin.
- Belirlenen uyarana reaktif hücrelerin sayısını ölçmek için, kalsiyum bazal seviyelerinde %30'luk bir artış artışı ayarlayın.
Sonuçlar
Burada, nöronların ve glia'nın kalsiyum kaymaları açısından nasıl sinyal verdiğini araştırmak için embriyonik gün 8 civcivlerinden kültürdeki retina hücrelerini kullandık. Kültürler esas olarak tarif edildiği gibi15,19 olarak karışık nöron-glial hücreler (≥ 1 x 106 hücre / çanak yoğunluğunda) in vitro olarak 7 günlük bir aşamada hazırlandı (Şekil 1A). Alternatif olarak, düşük yoğunlukta (5 x 105 hücre / çanak) hazırlanan, işlenmiş poli-L-lizin (10 μg / mL) üzerine tohumlanmış zenginleştirilmiş nöronal hücreler, in vitro olarak 3 günlük bir aşamada kayar (Şekil 1B). Ek olarak, saflaştırılmış Müller glia, nöronlar çıkarıldığında% 10 FCS içeren DMEM'de 10 gün boyunca muhafaza edildi. Nöronların ve gliaların tepkilerini fonksiyonel olarak ölçmek için, hücreler 50 mM KCl veya 1 mM ATP ile uyarıldı. Gösterildiği gibi (Şekil 1A), 302 hücreden% 50'si KCl'ye yanıt verirken,% 53'ü ATP'ye sinyal verdi. Bu anlamda, zenginleştirilmiş nöronal hücre kültürü, ATP'ye yanıt veren% 17'ye kıyasla, KCl'ye kalsiyum yanıtının% 89'una sahipti (Şekil 1B). Gerçekten de, nöronların kültürde 10 gün sonra çıkarıldığı saflaştırılmış bir Müller glia kültürü, yalnızca ATP tarafından aktive edilmiştir (Şekil 1C).
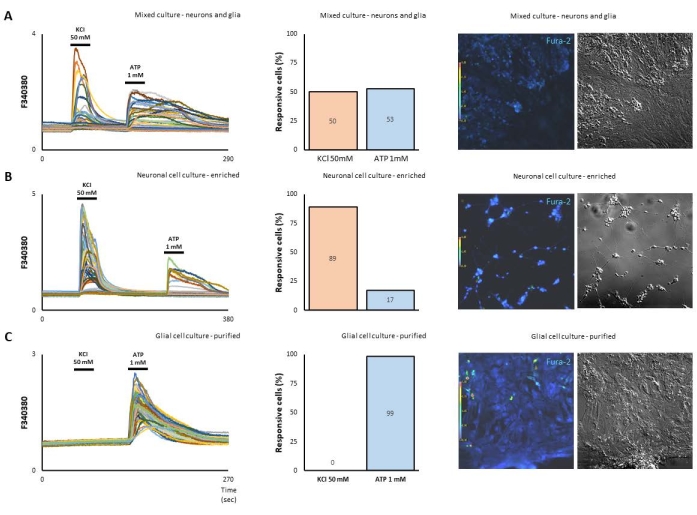
Şekil 1. Karışık, nöronal zenginleştirilmiş veya glia saflaştırılmış kültürler halinde hazırlanan retinal hücreler, kalsiyum görüntülemede farklı yanıt paternleri gösterir. (A) Kültürdeki karışık embriyonik retinal hücrelerin parlak ve floresan alanları. Aynı mikroskop alanı 5 μM fura-2 floresan altında gösterilmiştir. 50 mM KCl, hücrelerin yarısını (nöronal fenotip) aktive ederken, 1 mM ATP, hücre içi kalsiyum ([Ca2 +]i) seviyelerindeki artışlara karşılık gelen yüksek F340/380 oranlarıyla diğer yarısını (glial fenotip) aktive eder. (B) Zenginleştirilmiş nöronal hücre kültürü, ATP'ye yanıt veren% 17'ye kıyasla, KCl'ye% 89'luk bir kalsiyum yanıtına sahipti. (C) Öte yandan, nöronların kültürde 10 gün sonra çıkarıldığı saflaştırılmış bir Müller glia kültürü, yalnızca ATP tarafından aktive edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Retina dokusunu, KCl veya ATP'nin aracılık ettiği kalsiyum yanıtlarının sırasıyla nöronal ve glial yanıtlara açıkça bölümlere ayrıldığını göstermek için kullandık (Şekil 1). Literatürdeki bazı veriler, P2X7 reseptörlerinin nöronal aktiviteyi ve sinaptik nörotransmitter salınımını20 düzenleyen nöronlarda eksprese edildiğini ima etse de, diğer yazarlar nöronal P2X7 reseptörlerinin varlığını sorgulamaktadır. Gerçekten de, mevcut sonuçlar, primer glial P2X7 reseptörlerinin, sağlıksız dokularda bulunan yüksek hücre dışı ATP konsantrasyonlarına özetlenen nöronal etkilere aracılık ettiği fikrini desteklemektedir21.
Daha önce retina hücrelerinin fonksiyonel farklılaşmasını fenotipik göstergeleri ile ilişkilendirmiştik, böylece KCl veya AMPA (bir glutamat agonisti) tarafından aktive edilen [Ca2 +]i kaymalarının varyasyonları, olgun bir nöronun belirteci olan mikrotübül ile ilişkili proteini (MAP-2) ifade eder1. Alternatif olarak, ATP tarafından aktive edilen hücreler, tipik bir Muller glia belirteci olan glutamin sentetazı eksprese eder.
Glutamaterjik22, dopaminergik19, GABAergic23, kanabinoid9,10, purinerjik14,24, serotoninerjik25 gibi farklı nörokimyasal sistemlerle ilgili birçok soruyu cevaplamak için türetilmiş nörosferlere4 ek olarak, burada gösterildiği gibi farklı hücre kültürleri (karışık, nöronal zenginleştirilmiş veya saflaştırılmış glial hücreler) kullanıyoruz. , diğerleri arasında nöro-glial retinal iletişimi anlamak için. Müller glia çok sayıda nörotransmitter reseptörü26 eksprese eder ve gliotransmitterleri veziküler, Ca2+ bağımlı bir şekilde salınabilen D-serin, ATP ve glutamat olarak salgılar27.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Hibeler, sponsorlar ve finansman kaynakları: MH, doktora CNPq bursu sahibidir. HRF, CNPq tarafından desteklenen bir doktora sonrası burs alıcısıdır (HRF hibe numarası 152071/2020-2). RAMR, CNPq ve FAPERJ (hibe numaraları E-26/202.668/2018, E-26/010.002215/2019, 426342/2018-6 ve 312157/2016-9 ve INCT-INNT (Ulusal Translasyonel Sinirbilim Enstitüsü) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mm coverslip | Paul Marienfeld GmbH & Co. KG | 111550 | Cell suport |
| 510 nm long-pass filter | Carl Zeiss | ||
| ATP | Sigma | A1852 | |
| B-27 Supplement | Gibco | 17504044 | Suplement |
| CaCl2 | Sigma-Aldrich | C8106 | |
| CoolSNAP digital camera | Roper Scientific, Trenton, NJ | ||
| D-(+)-Glucose | Neon | 1466 | |
| DMEM/ F-12 | Gibco | 12400-24 | Cell culture medium |
| Excel Software | Microsoft | ||
| Fetal Calf Serum | Sigma-Aldrich | F9665 | Suplement |
| Fluorescence Microscope | Axiovert 200; Carl Zeiss | B 40-080 | |
| Fura-2 AM | Molecular Probes | F1221 | Ratiometric Ca2+ indicator |
| Gentamicin Sulfate | Calbiochem | 1405-41-0 | antibiotics |
| HEPES | Sigma | H4034 | |
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Lambda DG-4 apparatus | Sutter Instrument, Novato, CA | DG-4PLUS/OF30 | |
| Laminin | Gibco | 23017-015 | Help cell adhesion |
| Metafluor software | Universal Imaging Corp. West Chester, PA | ||
| MgCl2 | Sigma | M4880 | |
| Na2HPO4 | Vetec | 129 | |
| NaCl | Isofar | 310 | |
| NaHCO3 | Vetec | 306 | |
| PH3 platform | Warner Intruments, Hamden, CT | 64-0286 | |
| Pluronic F-127 | Molecular Probes | P6866 | nonionic, surfactant |
| Poly-L-lysine | Sigma-Aldrich | P8920 | Help cell adhesion |
| Trypsin-EDTA 0.25% | Gibco | 25200056 | Dissociation enzyme |
Referanslar
- Tsien, R. Y., Pozzan, T., Rink, T. J. Calcium homeostasis in intact lymphocytes: cytoplasmic free calcium monitored with a new, intracellularly trapped fluorescent indicator. Journal of Cell Biology. 94 (2), 325-334 (1982).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Islam, M. S. Calcium Signaling: From Basic to Bedside. Advances in Experimental Medicine and Biology. 1131, 1-6 (2020).
- De Melo Reis, R. A., et al. Functional identification of cell phenotypes differentiating from mice retinal neurospheres using single cell calcium imaging. Cellular and Molecular Neurobiology. 31 (6), 835-846 (2011).
- Ganguly, K., Schinder, A. F., Wong, S. T., Poo, M. GABA itself promotes the developmental switch of neuronal GABAergic responses from excitation to inhibition. Cell. 105 (4), 521-532 (2001).
- Schitine, C., et al. Ampakine CX546 increases proliferation and neuronal differentiation in subventricular zone stem/progenitor cell cultures. European Journal of Neuroscience. 35 (11), 1672-1683 (2012).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin. Frontiers in Cellular Neuroscience. 8, 59(2014).
- Ribeiro-Resende, V. T., et al. Mice lacking GD3 synthase display morphological abnormalities in the sciatic nerve and neuronal disturbances during peripheral nerve regeneration. PLoS One. 9 (10), 108919(2014).
- Xapelli, S., et al. Activation of type 1 cannabinoid receptor (CB1R) promotes neurogenesis in murine subventricular zone cell cultures. PLoS One. 8 (5), 63529(2013).
- Kubrusly, R. C. C., et al. Neuro-glial cannabinoid receptors modulate signaling in the embryonic avian retina. Neurochemistry International. 112, 27-37 (2018).
- Egan, T. M., Khakh, B. S. Contribution of calcium ions to P2X channel responses. Journal of Neuroscience. 24 (13), 3413-3420 (2004).
- Illes, P. P2X7 Receptors Amplify CNS Damage in Neurodegenerative Diseases. International Journal of Molecular Sciences. 21 (17), (2020).
- Faroni, A., et al. Purinergic signaling mediated by P2X7 receptors controls myelination in sciatic nerves. Journal of Neuroscience Research. 92 (10), 1259-1269 (2014).
- Freitas, H. R., et al. Cannabinoids Induce Cell Death and Promote P2X7 Receptor Signaling in Retinal Glial Progenitors in Culture. Molecular Neurobiology. 56 (9), 6472-6486 (2019).
- Freitas, H. R., et al. Glutathione-Induced Calcium Shifts in Chick Retinal Glial Cells. PLoS One. 11 (4), 0153677(2016).
- Yang, X. L. Characterization of receptors for glutamate and GABA in retinal neurons. Progress in Neurobiology. 73 (2), 127-150 (2004).
- Reis, R. A., Kubrusly, R. C., de Mello, M. C., de Mello, F. G. Transient coupling of NMDA receptor with ip3 production in cultured cells of the avian retina. Neurochemistry International. 26 (4), 375-380 (1995).
- López-Colomé, A. M., Ortega, A., Romo-de-Vivar, M. Excitatory amino acid-induced phosphoinositide hydrolysis in Müller glia. Glia. 9 (2), 127-135 (1993).
- Ventura, A. L., de Mello, F. G., de Melo Reis, R. A. Methods of dopamine research in retina cells. Methods in Molecular Biology. 964, 25-42 (2013).
- Miras-Portugal, M. T., Sebastián-Serrano, Á, de Diego García, L., Díaz-Hernández, M. Neuronal P2X7 Receptor: Involvement in Neuronal Physiology and Pathology. Journal of Neuroscience. 37 (30), 7063-7072 (2017).
- Illes, P., Khan, T. M., Rubini, P. Neuronal P2X7 Receptors Revisited: Do They Really Exist. Journal of Neuroscience. 37 (30), 7049-7062 (2017).
- Schitine, C. S., et al. Functional plasticity of GAT-3 in avian Müller cells is regulated by neurons via a glutamatergic input. Neurochemistry International. 82, 42-51 (2015).
- Ferreira, D. D., Stutz, B., de Mello, F. G., Reis, R. A., Kubrusly, R. C. Caffeine potentiates the release of GABA mediated by NMDA receptor activation: Involvement of A1 adenosine receptors. Neuroscience. 281, 208-215 (2014).
- Faria, R. X., Freitas, H. R., Reis, R. A. M. P2X7 receptor large pore signaling in avian Müller glial cells. Journal of Bioenergetics and Biomembranes. 49 (3), 215-229 (2017).
- Passos, A., et al. Regulation of the Serotonergic System by Kainate in the Avian Retina. Cellular and Molecular Neurobiology. 39 (7), 1039-1049 (2019).
- de Melo Reis, R. A., Ventura, A. L., Schitine, C. S., de Mello, M. C., de Mello, F. G. Müller glia as an active compartment modulating nervous activity in the vertebrate retina: neurotransmitters and trophic factors. Neurochemical Research. 33 (8), 1466-1474 (2008).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional Developmental, and Pathological Implications in the Brain. Frontiers in Neuroscience. 9, 499. 9, 499(2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır