Method Article
使用钙成像技术可视化神经元 - 神经胶质细胞回路上的位移
摘要
细胞钙成像是一种多功能方法,用于研究单个细胞的动态信号传导,在培养物中的混合群体上,甚至在觉醒的动物上,基于钙渗透通道/受体的表达,提供独特的功能特征。
摘要
在这里,我们报告了基于神经胶质细胞(星形胶质细胞,少突胶质细胞和小胶质细胞)和/或来自外周(背根神经节)和中心组织(皮层,脑室下区,类器官)的神经元的选择性体外模型,这些电路在钙位移方面进行了动态研究。选择用于说明结果的模型是视网膜,一种具有复杂细胞相互作用的简单组织。钙是一种普遍的信使,参与大多数重要的细胞作用。我们在分步方案中解释了如何制备和评估培养物中的视网膜神经元 - 神经胶质细胞,设想钙的转移。在这个模型中,我们根据神经元对KCl和ATP的选择性反应来区分神经元和神经胶质细胞。钙渗透受体和通道在不同的区室中选择性表达。为了分析钙反应,我们使用成比例的荧光芯片,如Fura-2。该探针基于无Ca2 + 和Ca2 +结合形式量化游离Ca2 +浓度,呈现两个不同的峰,基于在两个波长上感知的荧光强度。
引言
由于钙作为第二信使的普遍特性,这种离子参与大量的信号活动:基因转录,出生和死亡,增殖,迁移和分化,突触传递和可塑性。因此,一种能够以保真度和敏捷性跟踪钙活化动力学的方法将提供一种观察独特时空响应的方法。这种方法是细胞钙成像技术,它根据钙转移功能数据与特定细胞表型的不同反应相关联。
Ca2+探针最初是在20世纪80年代开发的,后来的改进允许这些分子用于活细胞测定1。作为化学指示剂,Fura-2被认为是定量[Ca2 + ]i测量的标准。该指示剂的乙酰氧基甲基(AM)酯(即Fura-2 AM)容易渗透到细胞膜中,并且可以达到比孵育稀释液大20倍的细胞内浓度(例如,[5μM]o/[100μM]i)。Fura-2的另一个优点是它具有良好的耐光漂白性;因此,对该指示剂进行更长时间的成像不会对其荧光能力产生很大影响。最后,Fura-2对从~100 nM到~100μM的广泛钙水平敏感,Kd为~145 nM,与静息的[Ca2 +]i2相当。 后来,使用更好的荧光显微镜和计算方法开发了细胞钙成像,以及不受染料负载影响的比例探针。
每个细胞表达不同的钙装置(泵,转运蛋白,受体和通道),这些装置作为特定特征有助于最终反应。重要的提示是找到与其表型表达相关的不同类型细胞的选择性反应。因此,至少有两种不同的受体通过钙转移起作用:以快速模式渗透Ca2 + 的电离异性受体和慢速代谢受体耦合到信号通路和细胞内储备,释放由第二信使激活的Ca2 + ,例如肌醇三磷酸和环ADP-核糖3。
例如,祖细胞在未成熟的视网膜中表达巢蛋白,并显示GABAA 受体被GABA(或肌肉酚)去极化4。这是由于Cl- 电化学梯度具有高细胞内Cl− 水平而发生的;随着组织的发展,KCC2 转运蛋白从对祖细胞的激发转变为对成熟 GABA 能神经元的抑制5。另一方面,在产后啮齿动物未成熟的脑室下区(SVZ)表达sox-2的干细胞也以缓慢的方式呈现由组胺增加Ca2 + 激活的代谢性H1受体6。来自蛋白酶激活受体-1(PAR-1)家族的第二个代谢性受体,由凝血酶激活,下游为G(q/11)和磷脂酶C(PLC),在多能SVZ神经干细胞产生的少突胶质细胞(表达O4和PLP)中给予缓慢的Ca2 + 转移7。
一般来说,神经元表达电压依赖性钙通道以及可渗透到Ca2 +的主要神经递质受体,如谷氨酸能(AMPA,NMDA,空穴)以及外周和中枢烟碱受体。氯化钾通常用作去极化剂来激活外周神经元,如背根神经节神经元8 或中枢神经元,如来自脑室下区9 或视网膜10。另一方面,ATP被认为是主要的神经质递质(除了D-丝氨酸之外),它激活选择性的Ca2 + 渗透性P2X成员,如P2X7和P2X4。两种受体都呈现等效的Ca2 + 电流,类似于NMDA受体所显示的被确认为由发射器激活的最大Ca2 + 电流11。P2X7受体在小胶质细胞上高度表达,但在星形胶质细胞和少突胶质细胞上的密度较低,在促炎细胞因子的释放中起作用12。P2X7受体也在视网膜中的雪旺细胞13 和Müller神经胶质细胞14,15上表达。
已知视网膜显示大脑中几乎所有的发射器。例如,垂直轴(光感受器、双极和视网膜神经节细胞)主要是谷氨酸能细胞,透钙 AMPA 或空心酸受体在 OFF-双极细胞中表达,mgluR6 在 ON-双极细胞中表达16。奇怪的是,所有三种受体也存在于Müller神经胶质细胞中,它们与钙和肌醇三磷酸途径偶联17,18。由水平和柏宁细胞组成的水平抑制轴不仅分泌GABA,还分泌多巴胺,乙酰胆碱和其他经典神经递质。Amacrine细胞是在禽类视网膜培养物中发现的主要类型的细胞,显示出几种类型的钙操作通道,如谷氨酸能,嘌呤能,烟碱和电压依赖性钙通道。因此,这是评估神经元和神经胶质细胞之间钙转移不同性质的极好模型。
因此,在发育过程中,将不同受体和通道组合成具有不同激动剂反应模式的选择性表型标志物,允许在通过选择性信号装置操作的茎,祖细胞,神经元,星形胶质细胞,少突胶质细胞和小胶质细胞中具有独特的特征。
研究方案
所有涉及动物的实验均由里约热内卢联邦大学机构动物护理和使用委员会的指导方针批准并按照"实验动物护理原则"(美国国立卫生研究院,贝塞斯达)进行;受精白里窝蛋的许可证编号IBCCF-035。
1. 溶液的制备
- 准备克雷布斯溶液:(132 mM NaCl,4 mM KCl,1.4 mM MgCl2,2.5 mM CaCl2,6 mM葡萄糖,10 mM HEPES,pH 7.4,373 mOsm)。
- 制备生理盐水缓冲液(Ca2+和Mg2+游离溶液 - CMF):76.55克/升NaCl、3.05克/升千氯化钾、1.65克/升Na2HPO4、0.610克/升KH2PO4、21.95克/升葡萄糖和7.90克/升NaHCO3。
- 准备培养皿溶液(在克雷布斯溶液中加入 Fura-2:)5μM呋喃-2-乙酰氧基甲酯(Fura-2),0.1%无脂肪酸牛血清白蛋白(BSA)和0.02%泊洛沙姆407。
- 对于混合人群或神经胶质细胞培养,以10%胎儿小牛血清(FCS)和40mg / L庆大霉素作为培养基制备DMEM / F12。
- 对于神经元富集培养物,用1%FCS,神经元细胞培养补充剂,40mg / L和庆大霉素作为培养基制备DMEM / F12。
2. 视网膜解剖和细胞培养准备
- 打开空气细胞所在的8天大雏鸡胚胎(E8)蛋。
- 将鸡蛋内容物取出到培养皿中,然后用一对镊子斩首进行胚胎安乐死。
- 将头部放入干净的培养皿中,倒入一些不含钙和镁的溶液(CMF)进行清洗。
- 去除眼睛,注意不要在此过程中损坏眼睛。
注意:在将眼睛从眼腔中取出之前,尽量避免切割或切碎眼睛的层。 - 将眼睛带到含有CMF的干净培养皿中。
- 通过取下晶状体开始眼睛解剖。
- 在眼睛上做3或4个纵向切口,从晶状体留下的孔开始。通过拉动镊子进行切割,将眼睛巩膜朝相反的方向握住。
- 小心地取出透明的玻璃体,确保视网膜不与它结合。
- 将视网膜从色素上皮上分离出来,并去除任何剩余的组织。
- 将透明的视网膜切成小块。
- 将视网膜转移到另一个受体并短暂离心(约1,800×g,持续1分钟)以除去CMF。
- 通过在37°C下孵育10分钟,用1mL 0.25%胰蛋白酶酶解离视网膜。
- 通过加入1mL含有10%食品接触物质的培养基停止反应。
- 用培养基清洗视网膜2或3次。洗涤包括加入培养基并通过离心(〜1,800×g 1分钟)除去的循环。
- 每个视网膜加入 2 mL 完全培养基,并通过上下移液轻轻机械地分离视网膜。
注意:在这里,研究者可以选择将要制备哪种类型的培养物。对于富集的神经元培养,使用DMEM-F12 +神经元补充剂+ 1%FCS +抗生素。对于混合人群或纯化的神经胶质细胞,使用DMEM-F12 + 10%食品接触物质+抗生素。 - 计数细胞并将它们稀释到所需的密度。
注意:理想情况下,这应该是具有〜2 x 10 6 个细胞或更少的低密度培养物。 - 向每个盖玻片中加入50μL细胞悬浮液。
- 盖玻片处理
- 将盖玻片在1 mL 10-50μg/ mL聚-L-赖氨酸中孵育至少1小时(理想情况下过夜)在37°C的灭菌纯净水中。
- 除去聚-L-赖氨酸溶液,用灭菌的纯净水清洗盖玻片2-3次。
- 让盖玻片在打开紫外线灯的安全柜中干燥。此时,将它们储存在4°C的密封容器中长达1个月。
- 可选步骤:对于神经元富集培养物,在PBS或培养基中向每个盖玻片中加入50μL10-20ng / mL层粘连蛋白,在37°C下2小时。 孵育后,除去多余的层粘连蛋白溶液,盖玻片即可使用。
- 将细胞在37°C的5%CO2 气氛中孵育,直到它们附着在玻璃上。这应该需要大约1-2小时。
- 向每个孔中加入1mL完整培养基,并将板返回培养箱直到实验当天。如果需要,每2-3天更换一次培养基。
3. 使用 Fura-2 AM 上样传感器
- 将50μgFura-2 AM小瓶与50μLDMSO重新配制。
- 为了制备有效的Fura-2 AM溶液,在DMSO和克雷布斯溶液中加入3μL10%泊洛沙姆407,7.5μLFura-2 AM至1.5mL。
- 在水浴中超声处理混合物7分钟。
- 用克雷布斯溶液用细胞培养物洗涤盖玻片3x,然后将其孵育在Fura-2中。
- 在37°C和5%CO 2 下孵育30分钟。
- 孵育后,再次洗涤3次,然后将其转移到另一个含有克雷布斯的受体中,并使其免受光照。
注意:如果保护Fura-2 AM溶液免受光线照射,则工作Fura-2 AM溶液可保持稳定24小时。
4. 细胞钙成像
- 在每次运行之前,将硅添加到盖玻片支撑和腔室中,以避免在实验过程中泄漏。
- 用蒸馏水清洗盖玻片的底部,以避免在显微镜镜片上盐结晶。
- 将盖玻片放在支架上,轻轻按压边框。
- 将支架和腔室连接到显微镜,并开始用克雷布斯溶液灌注细胞。
注意:单细胞钙成像实验期间的细胞灌注被校准为0.5 mL / min的流速,并且需要8-10秒才能完全更换平台溶液。 - 查看单元格并选择适当的视野。
- 根据细胞体的独特形态手动选择细胞体。
- 在应用任何刺激措施之前,请等待基线稳定。每次刺激大约需要30秒。
注意:在每次实验之前立即准备所有溶液。 - 通过量化在340和380nm处交替激发(750毫秒)后在510nm处发射的荧光的比率来评估[Ca2 + ]i 的变化。
- 使用荧光分析软件处理采集的值。
- 在表格中表达实验结果,其中每行表示一个单独的单元格,每行表示一个时间点。
5. 数据处理
- 使用电子表格软件,单独绘制或同时绘制所有细胞的Fura-2荧光比值的变化。
- 为了量化确定刺激的反应细胞的数量,设定钙基线水平增加30%的截止值
结果
在这里,我们使用胚胎第8天雏鸡培养的视网膜细胞来研究神经元和神经胶质细胞在钙变化方面的信号。基本上按照描述15,19 在体外7天的阶段制备培养物作为混合神经元 - 神经胶质细胞(密度 ≥为1 x 10 10 6 细胞/培养皿)(图1A)。或者,在低密度(5 x 105 细胞/培养皿)中制备富集的神经元细胞,在体外3天的阶段接种在处理过的聚-L-赖氨酸(10μg/ mL)盖玻片上(图1B)。此外,当神经元被移除时,纯化的Müller神经胶质细胞在含有10%FCS的DMEM中维持10天。为了功能上量化神经元和神经胶质细胞的反应,用50mM KCl或1mM ATP刺激细胞。如图1A所示(图1A),在302个细胞中,50%对KCl有反应,而53%对ATP有信号。从这个意义上说,富集神经元细胞培养物对KCl的钙反应为89%,而对ATP的反应为17%(图1B)。事实上,纯化的Müller神经胶质细胞培养物,其中神经元在培养物中培养10天后被移除,仅由ATP激活(图1C)。
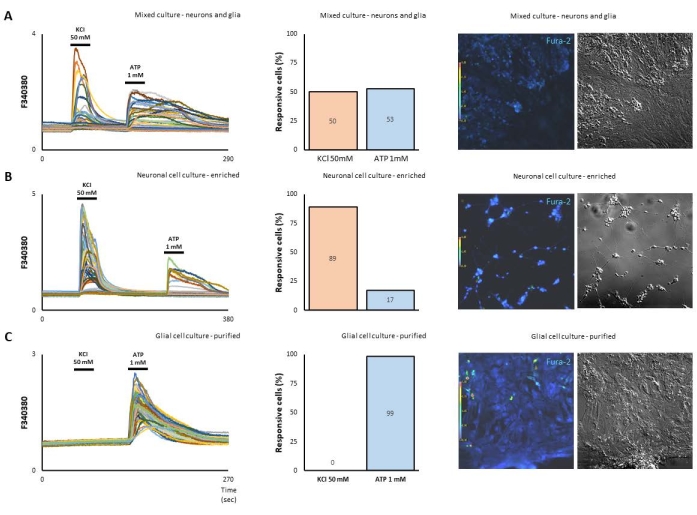
图 1.制备为混合、富集神经元或神经胶质细胞纯化的视网膜细胞在钙成像上显示出不同的反应模式。 (A)培养物中混合胚胎视网膜细胞的明亮和荧光场。相同的显微镜场在5μM fura-2 AM荧光下显示。50 mM KCl激活一半的细胞(神经元表型),而1mM ATP激活另一半(神经胶质表型),高F340/ 380比率对应于细胞内钙([Ca2 + ]i)水平的增加。(B)富集的神经元细胞培养物对KCl的钙反应为89%,而对ATP的反应为17%。(C)另一方面,纯化的Müller神经胶质细胞培养物,其中神经元在培养物中培养10天后被移除,仅由ATP激活。 请点击此处查看此图的放大版本。
讨论
我们使用视网膜组织表明,由KCl或ATP介导的钙反应分别清楚地划分为神经元和神经胶质反应(图1)。尽管文献中的一些数据表明P2X7受体在神经元中表达,神经元调节神经元活动和突触神经递质释放20,但其他作者质疑神经元P2X7受体的存在。事实上,目前的结果支持原代神经胶质P2X7受体介导神经元效应,这些神经元效应总和为不健康组织中发现的高细胞外ATP浓度21。
我们之前已经将视网膜细胞的功能分化与其表型显示联系起来,其方式是由KCl或AMPA(谷氨酸激动剂)激活的[Ca2 + ]i移位的变异表达微管相关蛋白(MAP-2),这是成熟神经元的标志物1。或者,由ATP激活的细胞表达谷氨酰胺合成酶,这是一种典型的Muller神经胶质标志物。
我们一直在使用不同类型的细胞培养物,如图所示(混合,神经元富集或纯化的神经胶质细胞),除了衍生的神经球4之外,还回答了许多与不同神经化学系统相关的问题,如谷氨酸能22,多巴胺能19,GABAergic23,大麻素9,10,嘌呤能14,24,5-羟色胺能25,除其他外,了解神经 - 神经胶质视网膜的沟通。Müller 神经胶质细胞表达大量神经递质受体26,并分泌 D-丝氨酸、ATP 和谷氨酸等神经质递质,这些物质可能以水泡、Ca2+ 依赖性方式释放27。
披露声明
作者没有什么可透露的。
致谢
赠款,赞助商和资金来源:MH是博士CNPq奖学金的获得者。HRF是CNPq支持的博士后奖学金的获得者(HRF资助编号152071 / 2020-2)。RAMR由CNPq和FAPERJ支持(授权号E-26/202.668/2018,E-26/010.002215/2019,426342/2018-6和312157/2016-9以及INCT-INNT(国家转化神经科学研究所)。
材料
| Name | Company | Catalog Number | Comments |
| 15 mm coverslip | Paul Marienfeld GmbH & Co. KG | 111550 | Cell suport |
| 510 nm long-pass filter | Carl Zeiss | ||
| ATP | Sigma | A1852 | |
| B-27 Supplement | Gibco | 17504044 | Suplement |
| CaCl2 | Sigma-Aldrich | C8106 | |
| CoolSNAP digital camera | Roper Scientific, Trenton, NJ | ||
| D-(+)-Glucose | Neon | 1466 | |
| DMEM/ F-12 | Gibco | 12400-24 | Cell culture medium |
| Excel Software | Microsoft | ||
| Fetal Calf Serum | Sigma-Aldrich | F9665 | Suplement |
| Fluorescence Microscope | Axiovert 200; Carl Zeiss | B 40-080 | |
| Fura-2 AM | Molecular Probes | F1221 | Ratiometric Ca2+ indicator |
| Gentamicin Sulfate | Calbiochem | 1405-41-0 | antibiotics |
| HEPES | Sigma | H4034 | |
| KCl | Sigma | P5405 | |
| KH2PO4 | Sigma | P5655 | |
| Lambda DG-4 apparatus | Sutter Instrument, Novato, CA | DG-4PLUS/OF30 | |
| Laminin | Gibco | 23017-015 | Help cell adhesion |
| Metafluor software | Universal Imaging Corp. West Chester, PA | ||
| MgCl2 | Sigma | M4880 | |
| Na2HPO4 | Vetec | 129 | |
| NaCl | Isofar | 310 | |
| NaHCO3 | Vetec | 306 | |
| PH3 platform | Warner Intruments, Hamden, CT | 64-0286 | |
| Pluronic F-127 | Molecular Probes | P6866 | nonionic, surfactant |
| Poly-L-lysine | Sigma-Aldrich | P8920 | Help cell adhesion |
| Trypsin-EDTA 0.25% | Gibco | 25200056 | Dissociation enzyme |
参考文献
- Tsien, R. Y., Pozzan, T., Rink, T. J. Calcium homeostasis in intact lymphocytes: cytoplasmic free calcium monitored with a new, intracellularly trapped fluorescent indicator. Journal of Cell Biology. 94 (2), 325-334 (1982).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Islam, M. S. Calcium Signaling: From Basic to Bedside. Advances in Experimental Medicine and Biology. 1131, 1-6 (2020).
- De Melo Reis, R. A., et al. Functional identification of cell phenotypes differentiating from mice retinal neurospheres using single cell calcium imaging. Cellular and Molecular Neurobiology. 31 (6), 835-846 (2011).
- Ganguly, K., Schinder, A. F., Wong, S. T., Poo, M. GABA itself promotes the developmental switch of neuronal GABAergic responses from excitation to inhibition. Cell. 105 (4), 521-532 (2001).
- Schitine, C., et al. Ampakine CX546 increases proliferation and neuronal differentiation in subventricular zone stem/progenitor cell cultures. European Journal of Neuroscience. 35 (11), 1672-1683 (2012).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Ribeiro-Resende, V. T., et al. Mice lacking GD3 synthase display morphological abnormalities in the sciatic nerve and neuronal disturbances during peripheral nerve regeneration. PLoS One. 9 (10), 108919 (2014).
- Xapelli, S., et al. Activation of type 1 cannabinoid receptor (CB1R) promotes neurogenesis in murine subventricular zone cell cultures. PLoS One. 8 (5), 63529 (2013).
- Kubrusly, R. C. C., et al. Neuro-glial cannabinoid receptors modulate signaling in the embryonic avian retina. Neurochemistry International. 112, 27-37 (2018).
- Egan, T. M., Khakh, B. S. Contribution of calcium ions to P2X channel responses. Journal of Neuroscience. 24 (13), 3413-3420 (2004).
- Illes, P. P2X7 Receptors Amplify CNS Damage in Neurodegenerative Diseases. International Journal of Molecular Sciences. 21 (17), (2020).
- Faroni, A., et al. Purinergic signaling mediated by P2X7 receptors controls myelination in sciatic nerves. Journal of Neuroscience Research. 92 (10), 1259-1269 (2014).
- Freitas, H. R., et al. Cannabinoids Induce Cell Death and Promote P2X7 Receptor Signaling in Retinal Glial Progenitors in Culture. Molecular Neurobiology. 56 (9), 6472-6486 (2019).
- Freitas, H. R., et al. Glutathione-Induced Calcium Shifts in Chick Retinal Glial Cells. PLoS One. 11 (4), 0153677 (2016).
- Yang, X. L. Characterization of receptors for glutamate and GABA in retinal neurons. Progress in Neurobiology. 73 (2), 127-150 (2004).
- Reis, R. A., Kubrusly, R. C., de Mello, M. C., de Mello, F. G. Transient coupling of NMDA receptor with ip3 production in cultured cells of the avian retina. Neurochemistry International. 26 (4), 375-380 (1995).
- López-Colomé, A. M., Ortega, A., Romo-de-Vivar, M. Excitatory amino acid-induced phosphoinositide hydrolysis in Müller glia. Glia. 9 (2), 127-135 (1993).
- Ventura, A. L., de Mello, F. G., de Melo Reis, R. A. Methods of dopamine research in retina cells. Methods in Molecular Biology. 964, 25-42 (2013).
- Miras-Portugal, M. T., Sebastián-Serrano, &. #. 1. 9. 3. ;., de Diego García, L., Díaz-Hernández, M. Neuronal P2X7 Receptor: Involvement in Neuronal Physiology and Pathology. Journal of Neuroscience. 37 (30), 7063-7072 (2017).
- Illes, P., Khan, T. M., Rubini, P. Neuronal P2X7 Receptors Revisited: Do They Really Exist. Journal of Neuroscience. 37 (30), 7049-7062 (2017).
- Schitine, C. S., et al. Functional plasticity of GAT-3 in avian Müller cells is regulated by neurons via a glutamatergic input. Neurochemistry International. 82, 42-51 (2015).
- Ferreira, D. D., Stutz, B., de Mello, F. G., Reis, R. A., Kubrusly, R. C. Caffeine potentiates the release of GABA mediated by NMDA receptor activation: Involvement of A1 adenosine receptors. Neuroscience. 281, 208-215 (2014).
- Faria, R. X., Freitas, H. R., Reis, R. A. M. P2X7 receptor large pore signaling in avian Müller glial cells. Journal of Bioenergetics and Biomembranes. 49 (3), 215-229 (2017).
- Passos, A., et al. Regulation of the Serotonergic System by Kainate in the Avian Retina. Cellular and Molecular Neurobiology. 39 (7), 1039-1049 (2019).
- de Melo Reis, R. A., Ventura, A. L., Schitine, C. S., de Mello, M. C., de Mello, F. G. Müller glia as an active compartment modulating nervous activity in the vertebrate retina: neurotransmitters and trophic factors. Neurochemical Research. 33 (8), 1466-1474 (2008).
- Harada, K., Kamiya, T., Tsuboi, T. Gliotransmitter Release from Astrocytes: Functional Developmental, and Pathological Implications in the Brain. Frontiers in Neuroscience. 9, 499. 9, 499 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。