Method Article
İnsan Kaynaklı Pluripotent Kök Hücrelerden İnsan Ventral Orta Beyin Astrositlerinin Verimli ve Ölçeklenebilir Üretimi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, hiPSC'lerden ventral orta beyin paternli astrositlerin tekrarlanabilir üretimi için bir yöntem ve fenotip ve işlevi değerlendirmek için karakterizasyonları için protokoller sunuyoruz.
Özet
Parkinson hastalığında, ventral orta beyindeki dopamin nöronlarının ilerleyici disfonksiyonu ve dejenerasyonu, yaşamı değiştiren semptomlara neden olur. Nöronal dejenerasyonun, Parkinson'da astrositlerin aracılık ettiği hücre dışı otonom mekanizmalar da dahil olmak üzere çeşitli nedenleri vardır. CNS boyunca, astrositler, nöral ortamda metabolik homeostazı sürdürdükleri için nöronal sağkalım ve işlev için gereklidir. Astrositler, Parkinson'un en erken evrelerinden itibaren gözlenen nöroinflamasyonu modüle etmek için CNS'nin bağışıklık hücreleri, mikroglia ile etkileşime girer ve patolojisinin ilerlemesi üzerinde doğrudan bir etkiye sahiptir. Parkinson da dahil olmak üzere kronik bir nöroinflamatuar elementi olan hastalıklarda, astrositler nörotoksik bir fenotip kazanır ve böylece nörodejenerasyonu arttırır. Sonuç olarak, astrositler hastalığı yavaşlatmak veya durdurmak için potansiyel bir terapötik hedeftir, ancak bu, Parkinson'daki özelliklerinin ve rollerinin daha derin bir şekilde anlaşılmasını gerektirecektir. Bu nedenle, in vitro çalışma için insan ventral orta beyin astrositlerinin doğru modellerine acilen ihtiyaç duyulmaktadır.
Parkinson araştırmaları için kullanılabilecek hiPSC'lerden ventral orta beyne özgü astrositlerin (vmAstros) yüksek saflıkta kültürlerini oluşturmak için bir protokol geliştirdik. vmAstros rutin olarak birden fazla hiPSC hattından üretilebilir ve spesifik astrositik ve ventral orta beyin belirteçlerini ifade eder. Bu protokol ölçeklenebilir ve bu nedenle ilaç taraması da dahil olmak üzere yüksek verimli uygulamalar için uygundur. En önemlisi, hiPSC'den türetilen vmAstros, in vivo muadillerine özgü immünomodülatör özellikler gösterir ve Parkinson'da nöroinflamatuar sinyallemenin mekanik çalışmalarını mümkün kılar.
Giriş
Parkinson hastalığı, 65 yaşın üzerindeki kişilerin %2-3'ünü etkiler ve bu da onu en yaygın nörodejeneratif hareket bozukluğu yapar1. Substantia nigra içindeki ventral orta beyin dopamin nöronlarının dejenerasyonundan kaynaklanır, bu da zayıflatıcı motor semptomların yanı sıra sık bilişsel ve psikiyatrik sorunlara neden olur2. Parkinson patolojisi, nöronlar için toksik olan ve işlev bozukluğu ve ölümleriyle sonuçlanan protein, α-sinüklein agregatları ile karakterize edilir 1,2,3. Dopaminerjik nöronlar, Parkinson hastalığındaki dejenere popülasyon olduğundan, tarihsel olarak araştırmanın odak noktasıydılar. Bununla birlikte, beyindeki başka bir hücre tipi olan astrositlerin de Parkinson'da anormallikler gösterdiği ve Parkinsonmodellerinde dejenerasyona katkıda bulunduğuna inanılmaktadır 4,5,6,7.
Astrositler, gerektiğinde hem fiziksel hem de işlevsel olarak dönüşebilen heterojen bir hücre popülasyonudur. Nöronal sinyallemenin modülasyonu, sinaptik mimarinin şekillendirilmesi ve spesifik faktörlerin 6,8,9,10 salgılanması yoluyla nöronal popülasyonların trofik desteği dahil olmak üzere çok sayıda mekanizma yoluyla nöronal işlevi ve sağlığı desteklerler. Bununla birlikte, astrositler ayrıca nöroinflamasyonun gelişimi ve yayılmasının ayrılmaz bir parçası olan önemli bir immünomodülatör role sahiptir10,11. Parkinson hastalarının beyinlerinde nöroinflamasyon görülür ve son zamanlarda Parkinson semptomlarının başlangıcını önlediği önemli ölçüde gösterilmiştir 12,13,14,15 ve böylece Parkinson araştırmalarında merkez sahneyi alır.
Hücresel düzeyde, astrositlerin nöroproteksiyonu kolaylaştırma girişimi olarak yaralanma, enfeksiyon veya hastalığa yanıt olarak reaktif hale geldiği söylenir 9,6,10,16. Reaktivite, gen ekspresyonu, sekretom, morfoloji ve hücre kalıntılarının ve toksik yan ürünlerin temizlenme mekanizmalarındaki değişikliklerle karakterize edilen astrosit fenotipindeki bir değişimi tanımlar 9,10,11,17. Bu reaktif kayma, CNS'nin bağışıklık hücreleri ve yaralanma ve hastalığa ilk yanıt verenler olan mikrogliadan gelen endüktif sinyallere yanıt olarak ortaya çıkar9. Hem astrositler hem de mikroglia, kendi işlevlerini düzenleyerek inflamatuar sinyallere yanıt verir ve inflamatuar sinyalleri iletebilir ve böylece nöroinflamasyonu doğrudan etkileyebilir 9,10. Bununla birlikte, Parkinson'un kronik doğası, reaktif astrositlerin nöronlar için toksik hale geldiği ve kendilerinin dejenerasyon ve hastalık patolojisini teşvik ettiği bir geçişle sonuçlanır 6,9,10,18,19. Önemli bir şekilde, astrositlerin reaktif nörotoksik fenotipe dönüşümünü engellemenin, hayvan modellerinde Parkinson'un ilerlemesini önlediği gösterilmiştir11. Nöroinflamasyon paradigmasındaki astrosit reaktivitesi bu nedenle Parkinson araştırmalarının ana odak noktası haline gelmiştir ve benzer şekilde CNS'nin geniş bir hastalık spektrumu ile ilgilidir. Bu bulgular birlikte, Parkinson etiyolojisinde önemli astrositik katılımın bir resmini oluşturur ve Parkinson hastalığında yer alan insan astrosit popülasyonlarının fenotipini özetleyen doğru araştırma modellerine duyulan ihtiyacı vurgular.
Embriyonik beyinde, nöronlar önce ortaya çıkar, astroglial soy, yani astrositler ve oligodendrositler, daha sonra gelişim6'da ortaya çıkar. İn vivo ve in vitro çalışmalar, nöral progenitör hücrelerin gücünü nöronaldan astroglial türevlere kadar kontrol ediyor gibi görünen bir dizi sinyal yolunu vurgulamıştır. Özellikle, JAK / STAT, EGF ve BMP sinyali, astroglia20,21'in çoğalması, farklılaşması ve olgunlaşmasında rol oynar. Bu yollar, hiPSC 6,22,23 dahil olmak üzere pluripotent hücrelerden astrositlerin üretilmesi için in vitro protokollerin odak noktası olmuştur. HiPSC 6,24,25'ten astrosit üretmenin birçok başarılı örneği olmuştur. Bununla birlikte, CNS'deki in vivo astrositlerin, bu astrositlerin özel nöronal komşuları 17,24,25,26 ile ilgili özel gereksinimlerine uygun olarak, doğrudan işlevleriyle ilgili belirli bölgesel kimliklere sahip oldukları açıktır. Örneğin, özellikle ventral orta beyin ile ilgili olarak, bu bölgedeki astrositlerin, orta beyin dopamin nöronlarının yerel popülasyonu ile iletişimi sağlayan dopamin reseptörleri de dahil olmak üzere spesifik protein setlerini eksprese ettiği gösterilmiştir26. Ayrıca, ventral orta beyin astrositleri benzersiz sinyalleşme özellikleri gösterir26. Bu nedenle, ventral orta beyin astrositlerinin Parkinson'daki rolünü incelemek için, benzersiz özelliklerini yansıtan bir in vitro modele ihtiyacımız var.
Bunu ele almak için, hiPSC'lerden ventral orta beyin astrositleri (vmAstros) oluşturmak için bir protokol geliştirdik. Ortaya çıkan vmAstros, spesifik proteinlerin ekspresyonu ve immünomodülatör fonksiyonlar gibi in vivo ventral orta beyin muadillerinin özelliklerini sergiler. Sunulan sonuçlar, Dr. Tilo Kunath27 tarafından türetilen ve bize hediye edilen NAS2 ve AST23 hiPSC hatlarının farklılaşmasından elde edilmiştir. NAS2 sağlıklı bir kontrol deneğinden üretilirken, AST23 α-Sinüklein (SNCA) kodlayan lokusta bir triplikasyon taşıyan bir Parkinson hastasından türetilmiştir. Bu hiPSC hatları daha önce karakterize edilmiş ve çeşitli nöral hücre tiplerinin üretilmesi de dahil olmak üzere bir dizi yayınlanmış araştırma makalesindekullanılmıştır 27,28,29,30,31.
Protokol
1. İnsan hiPSC hattı çözdürme, bakım ve kriyoprezervasyon
- HiPSC kültür plakalarını kaplamak için, vitronektini PBS'de 10 cm 2 hücre kültürü plakası yüzey alanı başına 1 mL'de 5 μg/mL'ye (1:100 ) seyreltin. Oda sıcaklığında 1 saat bekletin.
- Vitronektini çıkarın ve hemen kültür plakasına hiPSC'ler/ortam eklemeye devam edin.
NOT - Vitronektini plakadan çıkarırken, kültür yüzeyinin kurumasına izin verilmemesi çok önemlidir. - HiPSC'leri çözmek için, hiPSC içeren kriyoviyalleri sıvı nitrojenden çıkarın ve içindekiler tamamen çözülene kadar 37 °C'lik bir su banyosuna koyun.
- 1x hücre takviyesi (örneğin, Revitacell) içeren 9 mL önceden ısıtılmış hücre kültürü ortamı (örneğin, E8 veya E8 Flex) hazırlayın. Kriyoviyal içeriğine damla damla 1 mL ekleyin. Kalan 8 mL ortamı 15 mL'lik bir santrifüj tüpüne yerleştirin ve buna kriyoviyalin seyreltilmiş içeriğini ekleyin.
DİKKAT: İçeriği ezmeyin. - 3 dakika boyunca 150 x g'da santrifüjleyin. Hücre peletini bozmadan sıvıyı aspire edin ve 1x hücre takviyesi (örneğin, Revitacell) içeren uygun bir hacimde hücre kültürü ortamında (örneğin, E8 veya E8 Flex) yeniden süspanse edin. Örneğin, 6 oyuklu bir plakanın oyuğu başına 2 mL.
- Vitronektin kaplı kaplara yeniden süspanse edilmiş hiPSC'ler ekleyin ve 37 °C/%5 CO2 inkübatöre yerleştirin.
NOT: hiPSC'ler, çözüldükten sonra 30 dakika-2 saat içinde vitronektin kaplı plastik malzemelere yapışmaya başlamalıdır. - HiPSC'leri hücre kültürü ortamında koruyun (örneğin, E8 veya E8 Flex). Medya alışverişi ile hücreleri günlük olarak besleyin. Beslemeden önce daima kültür ortamını 30 dakika önceden ısıtın.
NOT E8 Flex kullanılıyorsa, hiPSC'ler her 24 saatte bir medya değişikliği gerektirmez ve gerekirse besleme artışları 48 saate kadar uzatılabilir. E8 Flex veya E8 ortamı eşit derecede yüksek kaliteli hiPSC kültürleri sağlar. HiPSC'ler çözülmeden sonra ve farklılaşma adımlarına başlamadan önce en az 14 gün boyunca kültürlenmelidir. 14 günden kısa kültür dönemleri, ilk farklılaşma periyodu sırasında hiPSC'lerin sağkalımını olumsuz yönde etkilemektedir. Yaklaşık% 80 birleşmede geçiş hiPSC'leri (Şekil 1A: 3-4 günlük geçiş aralığı). - Başlamadan 1 saat önce, hiPSC kültürüne 1x hücre takviyesi (örneğin, Revitacell) ekleyin.
- hiPSC'leri bir kez PBS ile yıkayın (kalsiyum veya magnezyum olmadan) ve 0,5 mM EDTA ekleyin (kalsiyum veya magnezyum olmadan PBS'de stoktan seyreltilmiş).
- Oda sıcaklığında 5 dakika veya hiPSC'ler birbirinden ayrılmaya başlayana ve daha yuvarlak bir görünüm alana kadar inkübe edin, her bir iPSC'nin sınırları parlak alan mikroskobu altında daha parlak görünür.
- Bir pipet ile hiPSC'lerin odaklanmış bir alanına 200 μL EDTA ekleyin. Hücre tabakasında açık bir alan bırakarak kolayca ayrılırlarsa, hasat edilmeye hazırdırlar. Kolayca ayrılmazlarsa, EDTA'da bırakın ve 1 dakika sonra tekrarlayın.
- Devam etmeye hazır olduğunuzda, EDTA'yı nazikçe çıkarın ve bir pipet kullanarak hiPSC'leri hücre kültürü ortamıyla (örneğin, E8 veya E8 Flex) iki kez nazikçe yıkayın.
NOT: Bunu hiPSC'ler ayrılmadan elde etmek için, plakayı eğin ve kültür plakasının yanından aşağıya doğru damla damla ortam ekleyin. - HiPSC'leri hasat etmek için 1x hücre takviyesi (örneğin, Revitacell) içeren 1 mL hücre kültürü ortamı (örneğin, E8 veya E8 Flex) kullanın. Ortamı doğrudan hiPSC katmanına bırakın ve hücreler ayrılmalıdır. Gerekirse, başka bir 1 mL medya ile tekrarlayın.
- hiPSC'leri mikroskop altında görüntüleyin. İdeal olarak, hiPSC'ler Şekil 1B'de gösterildiği gibi nispeten tek tip kümelerde görünmelidir. hiPSC kümeleri çok daha büyükse veya boyutları çok değişkense, daha büyük hiPSC kümelerini ayırmak için pipeti kullanın (Şekil 1B).
NOT: hiPSC'leri aşırı derecede ezmeyin. Takviye genel hücre sağkalımını artırsa da, aşırı tritürasyon hiPSC kültürünün sağkalımını olumsuz etkiler. Pipet ile 1-4 geçiş önerilir. - Serolojik bir pipet kullanarak, hiPSC süspansiyonunu adım 1.1'de hazırlandığı gibi vitronektin kaplı bir plakaya aktarın. hiPSC kültürünü 37 °C/%5 CO2 inkübatöre geri koyun.
NOT: hiPSC'leri yaklaşık %80 birleşimde kriyoprezervasyon yapın. - Başlamadan 1 saat önce, hiPSC kültürüne 1x hücre takviyesi (örneğin, Revitacell) ekleyin.
- Adım 1.4'te açıklandığı gibi 0,5 mM EDTA kullanarak hiPSC'leri kültür plakalarından ayırın, hücreleri 1x hücre takviyesi (örneğin, Revitacell) içeren hücre kültürü ortamında (örneğin, E8 veya E8 Flex) toplayın. 3 dakika boyunca 150 x g'da santrifüjleyin.
- Peletlenmiş hiPSC'leri hücre dondurma ortamında yeniden süspanse edin (bkz. Malzeme Tablosu). 10cm'lik 2 kültür alanı başına 700 μL kullanın, bu da 6 oyuklu bir plakanın oyuğu başına 1 kriyoviyal hücreye eşdeğerdir.
- Kriyoviyalleri uygun bir hücre dondurma kabına aktarın (ayrıntılar için Malzeme Tablosuna bakın).
- Dondurma kabını 24 saat boyunca -80 °C'lik bir dondurucuya aktarın. 24 saat sonra, kriyoviyaller uzun süreli depolama için sıvı nitrojene (-196 °C) aktarılabilir.
2. vmAstro Farklılaşma protokolü
NOT: vmAstros farklılaşma protokolünün şematik bir özeti Şekil 1A'da gösterilmiştir. Protokol ve bunların hazırlanması için gerekli olan reaktiflerin ayrıntılı bir listesi Tablo 1'de verilmiştir.
- vmNPC'lerin indüksiyonu
NOT: Bu protokol, yaklaşık 4-5 x 104 hücre/cm2 olan 6 oyuklu bir plakanın (10 cm2) %70-80 birleşiminin minimum 1x kuyusu ile başlayacak şekilde optimize edilmiştir (Şekil 1B)30. Başlangıç hücre sayısı ve yoğunluğu, hayatta kalma ve farklılaşma verimliliğini önemli ölçüde etkilediği için her hiPSC hattı için optimize edilmelidir.- Hücre kültürü ortamını hiPSC'lerden çıkarın ve 3x'i DMEM / F12 + glutamax içinde yıkayın. Ortamı 2 mL vmNPC indüksiyon ortamıyla değiştirin (N2B27 + CHIR99021 + SB431542 + SHH(C24ii) + LDN193189. Ortam ve reaktiflerin hazırlanmasıyla ilgili ayrıntılar için Tablo 1'e bakın).
- 24 saat sonra yarım medya değişikliği ve 48 saat sonra tam medya değişikliği ile alternatif günlerde besleyin.
NOT: 3-4 gün sonra vmNPC kültürünün geçmesi gerekecektir. 1:3 veya 1:4'lük standart bir geçiş oranı önerilir - bunun kullanılan her hiPSC hattı için optimize edilmesi gerekir. - Geçişten 1 saat önce, vmNPC'lere 1x hücre takviyesi (örn. Revitacell) ekleyin ve 1x bazal membran matrisi (örn. Geltrex) kaplı doku kültürü plastiği hazırlayın (bölüm 2.2 Bazal membran matrisinin hazırlanması ve rissue kültür plastiğinin kaplanması).
- Ortamı vmNPC'lerden çıkarın ve 2x'i D-PBS ile yıkayın. 10 cm2 kültür alanı başına (6 oyuklu bir plakanın oyuğu başına 1 mL) 1 mL önceden ısıtılmış hücre ayırma çözeltisi (örn., Accutase).
- 37 °C'de 1 dakika bekletin ve ardından vmNPC'leri bir faz kontrast mikroskobu kullanarak inceleyin.
NOT: vmNPC'ler yuvarlanmaya başlayacak, işlemleri yeniden çekilecek ve hücre katmanında boşluklar görünecektir. Bu, hücre yoğunluğuna bağlı olarak 1-3 dakika sürebilir. - vmNPC'ler bu görünümü aldığında, vmNPC katmanına 100 μL hücre ayırma solüsyonu (örneğin, Accutase) ekleyin.
NOT: vmNPC'ler ayrılmaya hazırsa, hücre katmanında bir delik görünecektir. Bu olmazsa, vmNPC'ler hücre ayırma çözeltisi ile daha fazla inkübasyon gerektirir. - vmNPC'ler kolayca ayrılırsa, hücre ayırma solüsyonunu nazikçe çıkarın ve vmNPC'leri 2x N2B27 ortamıyla yıkayın. N2B27 ortamını kuyu veya kültür kabının yan tarafına nazikçe ekleyin ve vmNPC'lerin ayrılmamasını sağlamak için yıkamak için hafifçe döndürün.
NOT: vmNPC'lerin hücre yüzeyine yeniden yapışmamasını sağlamak için bu adımın hızlı bir şekilde tamamlanması gerekir. VmNPC'ler yıkama adımlarında ayrılmaya başlarsa, 3 dakika boyunca 150 x g'da santrifüjleme yoluyla toplayın. vmNPC'ler, hayatta kalmalarını azaltabileceğinden, geçerken standart olarak santrifüjlenmez. - Son olarak, 1x hücre takviyesi (örneğin, Revitacell) içeren vmNPC indüksiyon ortamını doğrudan hücre katmanına kuvvetlice çıkararak bir pipet kullanarak vmNPC'leri çıkarın. Bu, daha sonra doğrudan yeni matris kaplı kaplanmış kültür kaplarına aktarılabilen vmNPC'leri çıkarmalıdır.
NOT: Daha fazla hücreyi çıkarmak için halihazırda askıya alınmış vmNPC'ler içeren ortamları yeniden kullanmayın, çünkü bu, onların aşırı yıpranmasına neden olur ve bu da hayatta kalmalarını azaltır. - 37 °C /% 5 CO2 inkübatörde değiştirin. vmNPC'ler 20-30 dakika sonra matris kaplı yüzeye yapışmaya başlamalıdır. 24 saat sonra ortamın yarısını yeni vmNPC indüksiyon ortamıyla (hücre takviyesi olmadan) değiştirin ve besleme programına daha önce olduğu gibi devam edin.
- 10 gün boyunca beslenme ve geçiş rejimine devam edin.
- Bazal membran matriksinin hazırlanması ve doku kültürü plastiğinin kaplanması
NOT: vmNPC'lerin bakımı için, plastik malzemeleri kaplamak için 1x bazal membran matrisi (örneğin, Geltrex) kullanılır. vmAPC'lerin veya vmAstros'un bakımı için 0,25x bazal membran matrisi kullanılabilir.- Bodrum membran matris stoğunu -80 °C'lik bir dondurucudan çıkarın ve çözülmesi için gece boyunca 4 °C'lik bir buzdolabına koyun.
- 1:10'u buz gibi DMEM/F12 + glutamax, alikot ile seyreltin ve -80 °C'de 10x stok olarak saklayın.
- Plastik malzemeleri kaplarken, bu 10x stoğu buz gibi DMEM/F12 + glutamax ile 1x (vmNPC'ler için) veya 0.25x'e (vmAPC'ler veya vmAstros için) seyreltin.
- Hemen doku kültürü plastiğine 10cm2 başına 1 mL, örneğin 6 oyuklu bir plakanın oyuğu başına 1 mL ekleyin.
- 37 °C'de 1 saat bekletin. Bodrum membran matris çözeltisi, kaplanmış plastik malzemenin kurumamasını sağlamak için ortam/hücre eklemeye hazır olana kadar plastik malzemeden çıkarılmamalıdır. Matris kaplı plakalar, hücre eklemeden önce yıkama gerektirmez.
- vmNPC'lerin genişletilmesi
- Protokolün 10. gününde, indüksiyon ortamını vmNPC genişletme ortamıyla (N2B27 + GDNF + BDNF + askorbik asit) değiştirin. Ortam ve reaktiflerin hazırlanmasıyla ilgili ayrıntılar için Tablo 1'e bakın).
NOT: vmNPC'ler, proliferasyonu indüklemek için mitojenlerin eklenmesini gerektirmez. BDNF, GDNF ve askorbik asit, vmNPC'lerin30 hayatta kalmasını ve bakımını destekler. - 24 saat sonra yarım medya değişikliği ve 48 saat sonra tam medya değişikliği ile alternatif günlerde besleyin.
NOT: 3-4 gün sonra, vmNPC kültürünün geçmesi gerekecektir. Geçiş için, 1:3 veya 1:4'lük standart bir geçiş oranı önerilir (bu, kullanılan her hiPSC hattı için optimize edilmesi gerekir. vmNPC'lerin en iyi hayatta kalmasını, çoğalmasını ve üretilmesini sağlayan oranı belirleyin). - Geçişten 1 saat önce, vmNPC'lere 1x hücre takviyesi (örneğin, Revitacell) ekleyin ve önceden 1x matris kaplı plakalar/şişeler hazırlayın (bölüm 2.2 Bazal membran matrisinin hazırlanması ve rissue kültür plastiğinin kaplanması). Hücre ayırma solüsyonunu (örn., Accutase) 37 ° C'ye önceden ısıtın. 1x hücre takviyesi (örneğin, Revitacell) içeren taze vmNPC genişletme ortamını önceden ısıtın.
- Ortamı vmNPC'lerden çıkarın ve D-PBS ile 2x'i yıkayın. 10 cm 2 kültür alanı başına 1 mLhücre ayırma çözeltisi (örneğin, Accutase) ekleyin (6 oyuklu bir plakanın oyuğu başına 1 mL). 1 dakika boyunca 37 ° C'ye yerleştirin ve ardından vmNPC'leri bir faz kontrast mikroskobu kullanarak inceleyin.
NOT: vmNPC'ler yuvarlanmaya başlayacak, işlemleri yeniden çekilecek ve hücre katmanında boşluklar görünecektir. Bu, hücre yoğunluğuna bağlı olarak 1-3 dakika sürebilir. - vmNPC'ler yuvarlak bir görünüm aldığında, vmNPC katmanına 100 μL hücre ayırma solüsyonu (örneğin, Accutase) ekleyin.
NOT: vmNPC'ler ayrılmaya hazırsa, hücre katmanında bir delik görünecektir. Bu olmazsa, vmNPC'ler hücre ayırma çözeltisi ile daha fazla inkübasyon gerektirir. - vmNPC'ler kolayca ayrılıyorsa, hücre ayırma solüsyonunu nazikçe çıkarın ve vmNPC'leri 2x N2B27 ortamıyla yıkayın. N2B27 ortamını kuyu veya kültür kabının yan tarafına nazikçe ekleyin ve vmNPC'lerin ayrılmamasını sağlamak için yıkamak için hafifçe döndürün.
NOT: vmNPC'ler yıkama adımlarında çok sayıda ayrılmaya başlarsa, 3 dakika boyunca 150 x g'da santrifüjleme yoluyla toplayın. vmNPC'ler, hayatta kalmalarını azaltabileceğinden, geçerken standart olarak santrifüjlenmez. vmNPC'lerin hücre yüzeyine yeniden yapışmamasını sağlamak için bu adımın hızlı bir şekilde tamamlanması gerekir. - Bir pipet kullanarak vmNPC'leri çıkarın ve 1x hücre takviyesi (örneğin, Revitacell) içeren vmNPC genişletme ortamını doğrudan hücre katmanına kuvvetlice çıkarın. Bu, daha sonra doğrudan önceden hazırlanmış matris kaplı plakalara/şişelere aktarılabilen vmNPC'leri çıkarmalıdır (bkz. bölüm 2.2 'Bazal membran matrisinin hazırlanması ve doku kültürü plastiğinin kaplanması').
NOT: Daha fazla hücreyi çıkarmak için halihazırda askıya alınmış vmNPC'ler içeren ortamları yeniden kullanmayın, çünkü bu, onların aşırı yıpranmasına neden olur ve bu da hayatta kalmalarını azaltır. - 37 °C /% 5 CO2 inkübatörde değiştirin. vmNPC'ler 20-30 dakika sonra matris kaplı yüzeye yapışmaya başlamalıdır. 24 saat sonra, kültür ortamının yarısını taze vmNPC genişletme ortamıyla (hücre takviyesi olmadan) değiştirin ve önceki besleme programına devam edin.
- Bu beslenme ve geçiş rejimine 10 gün boyunca devam edin. vmNPC'ler 50. güne kadar genişletilebilir.
- Protokolün 10. gününde, indüksiyon ortamını vmNPC genişletme ortamıyla (N2B27 + GDNF + BDNF + askorbik asit) değiştirin. Ortam ve reaktiflerin hazırlanmasıyla ilgili ayrıntılar için Tablo 1'e bakın).
- vmAPC'lerin farklılaşması ve genişletilmesi
NOT: vmNPC'ler, ilk hiPSC aşamasından itibaren 30 ila 50 gün arasında herhangi bir yerde vmAPC'lerin/vmAstro'ların oluşturulması için başarıyla kullanılabilir (Şekil 1A).- Birleşmiş bir vmNPC kültürü alın ve vmNPC genişletme ortamının bileşenlerinin izlerini kaldırmak için vmNPC'leri gelişmiş DMEM/F12'de 3x yıkayın. Ortamı vmAPC genişletme ortamıyla değiştirin (ASTRO ortamı +EGF +LIF. Ortam ve reaktiflerin hazırlanmasıyla ilgili ayrıntılar için Tablo 1'e bakın).
- 72 saatlik geçişten sonra, vmNPC kültürü yüksek bir orandadır (1: 7.5). Örneğin, vmNPC'lerin 6 oyuklu bir plakanın tek bir kuyusunda tutulduğunu varsayarsak, şimdi 1x matris kaplı 75cm2'lik bir şişeye geçirilmelidir (bölüm 2.2 'Bazal membran matrisinin hazırlanması ve doku kültürü plastiğinin kaplanması' bölümünde açıklandığı gibi kaplanmıştır). Bölüm 2.3 'vmNPC'lerin genişletilmesi' bölümünde vmNPC'ler için açıklandığı gibi hücre ayırma çözümü kullanılarak geçiş.
- vmNPC'leri uygun bir hacimde vmAPC Genişletme ortamında (75 cm2 şişe başına 7,5-15 mL ortam) yeniden askıya alın. Her 3 günde bir veya hücrelerin gerektirdiği şekilde tam ortam değişiklikleri.
NOT: Bu noktadan sonra, vmNPC'ler vmAPC'ler olarak adlandırılır ve hücre kümeleri yerine tek hücreler olarak geçilmelidir. vmAPC'ler her 3-7 günde bir veya aşırı birleşimden kaçınmak için birleştikçe geçilmelidir. Bu noktadan itibaren, plastik malzemeleri kaplamak için azaltılmış 0.25x matris konsantrasyonu kullanılmalıdır (bölüm 2.2, Bazal membran matrisinin hazırlanması ve doku kültürü plastiğinin kaplanmasında açıklandığı gibi). - vmAPC'leri 90. güne ulaşana kadar (hiPSC aşamasından itibaren) genişletin ve vmAPC'leri genişlemelerinin çeşitli noktalarında dondurarak koruyun.
- vmAPC'lerden olgun vmAstro'ların oluşturulması
NOT: Bu aşamada vmAPC'ler 175cm2'lik doku kültürü şişelerinde büyütülebilir. Bu, çok sayıda olgun vmAstros'un üretilmesi için genişletilebilir.- vmAPC'ler %80 birleşmeye ulaştığında, 3x'i ASTRO ortamıyla yıkayın ve vmAstros olgunlaşma ortamıyla değiştirin (ASTRO ortamı +BMP4 +LIF. Ortam ve reaktiflerin hazırlanmasıyla ilgili ayrıntılar için Tablo 1'e bakın).
- Her 3 günde bir veya hücrelerin gerektirdiği şekilde 10 gün boyunca tam bir ortam değişikliği yapın.
NOT: a) Bu noktada, karakterizasyon, immünositokimya (Şekil 2G - I) ve gen ekspresyon analizi (hazırlık aşamasındaki el yazması) ile onaylandığı gibi, vmAstros'un olgun olduğunu gösterir. b) Olgunlaşmadan hemen sonra kullanılan vmAstros, yeni hazırlanmış matris kaplı bir yüzey üzerine yeniden kaplanmalıdır. vmAPC'leri veya vmAstros'u aynı kültür yüzeyinde 14 günden fazla tutmak, hücrelerin boyutlarının küçülmeye ve hatta ayrılmaya başladığı optimal olmayan kültürlere yol açabilir. c) Nöroinflamatuar modülasyonu inceleyen uygulamalar için, nöroinflamatuar stimülasyondan 72 saat önce BMP ve LIF çıkarılır. Bu, BMP / LIF sinyali ile indüklenmiş nöroinflamatuar sinyaller arasındaki herhangi bir potansiyel etkileşimi önlemek içindir. - vmAstros artık deneysel tahliller için, örneğin immünositokimya için lameller üzerine yeniden kaplanabilir veya gelecekteki uygulamalar için dondurularak saklanabilir (bölüm 3, 4).
NOT: Protokolün bu aşamasında pasaj gerekli olmamalıdır, çünkü çoğalma sadece çok düşük bir oranda gerçekleşmelidir. Bu aşamada çok yoğun bir şekilde kaplanan vmAPC'ler daha yüksek proliferasyon seviyelerini korur. Bu durumda, Şekil 1F'de gösterildiği gibi bir yoğunluk elde etmek için hücreleri geçin ve bölün.
3. vmNPC'lerin, vmAPC'lerin ve vmAstros'un dondurularak saklanması
NOT: vmNPC'leri/vmAPC'leri/vmAstros'u tam birleşimde kriyoprezervasyon yapın.
- Başlamadan 1 saat önce, kültüre 1x hücre takviyesi (örneğin, Revitacell) ekleyin. Kriyo depolama kabını ( Malzeme Tablosuna bakın) oda sıcaklığında izopropanol ile doldurun.
- Daha önce tarif edildiği gibi hücre ayırma solüsyonu kullanarak hücreleri kültür plakalarından ayırın, hücreleri 1x hücre takviyesi (örneğin, Revitacell) içeren uygun ortamda (N2B27 veya ASTRO ortamı) toplayın. 3 dakika boyunca 150 x g'da santrifüjleyin.
- Peletlenmiş vmNPC'leri/vmAPC'leri/vmAstros'ları hücre dondurma ortamında (Malzeme Tablosuna bakın) hacimlerde aşağıdaki gibi yeniden askıya alın (adım 3.3.1. - 3.3.3.)
- vmNPC'ler için: 10 cm2 kültür alanı başına 700 μL kullanın, 1 kriyoviyal içine.
- vmAPC'ler için: 60cm2 kültür alanı başına 700 μL, 1 kriyoviyal (bir T175 kültür şişesinin yaklaşık 1/3'ü) kullanın.
- vmAstros için: 2 mL'lik bir ortamda yeniden askıya alın ve vmAstros sayısını sayın. Hücre dondurma ortamında (Malzeme Tablosuna bakınız) gelecekteki uygulamalara uygun kriyovial başına bir sayıda yeniden santrifüjleyin ve yeniden süspanse edin. Dondurarak çözülme nedeniyle yaklaşık %15'lik bir hücre kaybı olduğu varsayıldığında, yeni çözülmüş vmAstro'lar sayılır ve donma-çözülme sürecinde hücre ölümünü telafi etmek için %15 fazla hücre sayısı ile kaplanır. Bu nedenle bu,cm2 başına 74.750 vmAstros'a eşdeğerdir. Çözülmüş vmAstro'lar, tahlilden önce ASTRO ortamında 72 saat boyunca muhafaza edilir.
- Kriyoviyalleri bir hücre dondurma kabına aktarın (ayrıntılar için Malzeme Tablosuna bakın) ve dondurma kabını 24 saat boyunca -80 ° C'lik bir dondurucuya aktarın. 24 saat sonra, kriyoviyaller uzun süreli depolama için sıvı nitrojene (-196 °C) aktarılabilir.
4. vmAstro fenotipinin karakterizasyonu
- İmmünositokimya
- 100-200 adet 13 mm'lik cam lamellerin cam Petri kaplarına bir filtre kağıdı tabakası üzerine yerleştirilmesi ve kuru bir otoklavda sterilize edilmesi.
- Lamelleri steril forseps kullanarak 4 veya 24 oyuklu plakaların kuyularına aktarın. Lamellerin üzerine 50 μL damlacıklar halinde 1x matris çözeltisi (örneğin Geltrex) ekleyin ve 37 °C'de 1 saat inkübe edin.
- vmAstros'u geçin veya çözün, ASTRO ortamında yeniden askıya alın ve bir sayım yapın. 50 μL'lik bir damlacıkta lamel başına 25-100.000 hücrede vmAstros plakası.
- Matrisi lamelden çıkarın ve hemen bir medya damlasına vmAstros ekleyin. 30 dakika boyunca 37 °C'ye yerleştirin ve ardından kuyucukları ek 250 μL ASTRO ortamı ile doldurun.
NOT: Astrosit ve orta beyin belirteç ekspresyonunu basitçe kontrol etmek için immünositokimya yapılıyorsa, vmAstros kaplamadan 24 saat sonra sabitlenebilir. - %36 formaldehit çözeltisini D-PBS'de 1:9 oranında seyrelterek %4 formaldehit çözeltisi hazırlayın.
- vmAstros 1x'i D-PBS ile yıkayın. Hemen% 4 formaldehit ekleyin ve oda sıcaklığında 10 dakika bekletin.
- Formaldehiti çıkarın ve D-PBS ile değiştirin. Ya 4 ° C'de saklayın ya da immünositokimyaya devam edin.
- Lamelleri D-PBS ile 3x kuyucuklarda yıkayın. Oda sıcaklığında 1 saat boyunca% 10 keçi serumu,% 0.1 PBTx içinde% 1 BSA (D-PBS + 1: 1000 Triton-X) geçirgen hale getirin ve bloke edin.
- % 1 keçi serumuna% 0.1 BSA'ya,% 0.1 PBTx'e% 0.1 (D-PBS + 1: 1000 Triton-X) ekleyin ve bir külbütör üzerinde 4 ° C'de gece boyunca inkübe edin.
- Ertesi gün, primer antikorları çıkarın ve lamelleri D-PBS ile 3 kez yıkayın.
- % 1 keçi serumuna% 0.1 BSA'ya% 0.1 PBTx'e uygun ikincil antikorlar (Malzeme Tablosu) ekleyin ve oda sıcaklığında 1-2 saat inkübe edin ve bir külbütör üzerindeki ışıktan koruyun. Lamelleri 3 kez D-PBS ile yıkayın.
- DAPI çözeltisi (D-PBS'de 0.1 μg/mL DAPI) ekleyin ve oda sıcaklığında 10 dakika inkübe edin. Lamelleri 3 kez D-PBS ile yıkayın.
- Lameli monte etmek için, 5 μL'lik bir damla Mowiol/DABCO montaj ortamı [%12 Mowiol (a/h), %12 gliserol (a/v), gece boyunca çözülerek 0,2 M Tris (pH 8,5) ile 25 mg/mL 1,4-diazabicylo[2.2.2]oktan (DABCO)] ile bir cam mikroskop lamı ekleyin. Forseps kullanarak, lameli kuyudan dikkatlice çıkarın; Fazla sıvıyı çıkarmak için lamel kenarını doku üzerine sürün ve vmAstros tarafı aşağı bakacak şekilde Mowiol/DABCO damlacığının üzerine yerleştirin.
- Her lamel için tekrarlayın ve mikroskobik incelemeden önce 8 saat kurumaya bırakın.
- Sitokin tedavisine yanıt olarak IL-6'nın vmAstros sekresyonunun ELISA ölçümü
NOT: BMP4 ve LIF ile 10 günlük olgunlaşmanın ardından, vmAstros geçiştirilmeli, sayılmalı ve 0.25x matris kaplı doku kültürü plastik kap üzerine kaplanmalıdır ( Bölüm 2.2Bazal membran matriksinin hazırlanması ve doku kültürü plastiğinin kaplanması), cm başına 65.000 vmAstros yoğunlukta2 ASTRO medyada. BMP4 ve LIF, sitokin tedavisinden 72 saat önce vmAstros'tan çıkarılmalıdır, çünkü bu faktörlerden gelen aktif sinyaller sitokin tedavisinin etkinliğini etkileyebilir. Alternatif olarak, dondurularak saklanmış vmAstros çözülebilir ve tahliller için kullanılabilir.- Test gününde, vmAstros 3x'i redoks olmayan ortamda (DMEM/F-12 + glutamax + N2) nazikçe yıkayın.
- Karşılaştırma için tedavi edilmemiş bir kontrol ve sitokin ile tedavi edilmiş bir kuyu kullanın. Seçilen sitokini optimize edilmiş konsantrasyonda ekleyin. Şekil 2J - L'deki veriler, 10cm2 hücre kültürü alanı başına 1 mL'de redoks olmayan ortamda 3 ng/mL9'da IL-1α kullanılarak üretildi.
- vmAstros'u 37 °C/%5 CO2 inkübatörde 24 saat boyunca değiştirin. 24 saat sonra, kültür ortamını steril mikrofüj tüplerine toplayın.
- ELISA hemen gerçekleştirilmeyecekse, mikrofüj tüplerini sıvı nitrojene batırarak dondurma ortamı örneklerini çekin ve gelecekteki analizler için -80 ° C'de saklayın.
NOT: Aşağıdaki protokol, Malzeme Tablosunda ayrıntıları verilen IL-6 ELISA kiti ile kullanım için özel olarak optimize edilmiştir. Yeni bir ELISA kitinde liyofilize toz olarak verilen antikorlar ve standartlar, ilk kullanımdan önce yeniden oluşturulmalı ve gelecekteki kullanım için ayrı ayrı belirtilmelidir. Kit ile birlikte verilen veri sayfası, sulandırma için gerekli reaktifleri ve hacimleri detaylandırır. Yakalama antikoru PBS'de (taşıyıcı protein olmadan) yeniden oluşturulmalıdır. - ELISA'yı 96 oyuklu plaka formatında gerçekleştirin ve kullanılan kuyucuklara göre reaktiflerin hacimlerini hesaplayın. ELISA gününde, PBS'de stoğu 1:120 oranında seyrelterek yakalama antikoru hazırlayın. Kuyucuk başına 50 μL yakalama antikoru yükleyerek plakayı kaplayın. Plakayı yapışkan bir şeritle örtün ve gece boyunca oda sıcaklığında inkübe edin.
- Ertesi gün, plakayı 3x D-PBS-Tween (% 0.05 Tween-20 ile D-PBS), kuyucuk başına 100 μL ile yıkayın. Kuru kurulayın.
- Kuyucuk başına 150 μL D-PBS/%1 BSA yükleyerek plakayı bloke edin. Oda sıcaklığında en az 1 saat inkübe edin. Plakayı tarif edildiği gibi yıkayın.
- Örnekleri buz üzerinde çözdürün (bu 1-2 saat sürebilir). 10 μL numune ve 40 μL D-PBS/%1 BSA yükleyerek numuneleri 1:5 oranında seyreltin. Yüklemeden önce her numuneyi vorteksleyin.
NOT: Bir IL-6 ELISA gerçekleştirirken numuneleri seyreltmek gerekir, seyreltmeler optimize edilmelidir. - En üst standardı (1.000 ρg/mL) D-PBS/%1 BSA'da stoğu 1:180 oranında seyrelterek hazırlayın. En üst standardın seri seyreltmesini gerçekleştirerek 7 standart hazırlayın. Her seyreltme arasında girdap.
- Kuyucuklara 50 μL standart/numune ekleyin. Boş olarak D-PBS/%1 BSA kullanın. Seyreltilmiş numuneleri uygun şekilde karıştırmak için bir orbital çalkalayıcı üzerinde oda sıcaklığında 2 saat inkübe edin. Plakayı tarif edildiği gibi yıkayın.
- D-PBS /% 1 BSA'da stoğu 1:60 oranında seyrelterek tespit antikoru hazırlayın. Kuyucuk başına 50 μL tespit antikoru yükleyin. Plakayı örtün ve RT'de 2 saat inkübe edin. Plakayı tarif edildiği gibi yıkayın.
- Yaban turpu peroksidaz (Strep-HRP) ile konjuge streptavidin hazırlayın, stoğu 1:40 oranında D-PBS /% 1 BSA'da seyreltin. Kuyucuk başına 50 μL Strep-HRP yükleyin ve karanlıkta 20 dakika oda sıcaklığında inkübe edin. Plakayı tarif edildiği gibi yıkayın.
- Oyuk başına 50 μL TMB substrat çözeltisi yükleyerek renk reaksiyonunu başlatın. Oda sıcaklığında karanlıkta 20 dakika (veya standartlar ve numuneler mavi bir renk geliştirene kadar) inkübe edin.
NOT: TMB 4 °C'de saklanır ancak oda sıcaklığında kullanılmalıdır. - Kuyucuk başına 25 μL durdurma çözeltisi (1 M, H,2,S04) ekleyerek reaksiyonu durdurun ve maviden sarıya renk değişimine dikkat edin.
- Bir mikroplaka okuyucu kullanarak plakayı 450 nm absorbansta okuyun. Doğruluğu en üst düzeye çıkarmak için dalga boyu düzeltmesini 540 nm absorbansa ayarlayın. Üretilen standart eğriden numunelerdeki protein konsantrasyonlarını hesaplayın.
Sonuçlar
Farklılaşma metodolojisi ve ilerlemesi
Burada, hem vmAstros'un üretilmesi için kullanılan yöntemlerin hem de sonraki fenotipik karakterizasyonları için kullanılan protokollerin ayrıntılarını sunuyoruz. vmAstros oluşturma yöntemi, mikroskopi ile izlenebilen ve farklı morfolojik özellikleri tanımlayabilen birkaç farklı farklılaşma aşamasından oluşur (Şekil 1A-F). Besleyici içermeyen bir hiPSC kültürü (Şekil 1B), özellikle ventral orta beynin (CHIR99021, SHH-C24ii) bir nöral soyuna (LDN193189, SB431542) doğru farklılaşmalarını indüklemek için spesifik faktörlere maruz bırakılır. Bu, hiPSC'lerden morfolojik olarak farklı olan bir vmNPC kültürünün oluşturulmasıyla sonuçlanır - vmNPC'ler hiPSC'lerden daha az yuvarlaktır ve vmNPC'ler, nöral progenitörler için tipik olan uzun poligonal veya üçgen bir şekle sahiptir (Şekil 1B, C). Morfolojik ayrım 7-10. günden itibaren belirgindir. vmNPC'ler geçtiğinde, hiPSC'lere benzer şekilde, hücre sağkalımını artırmak için bunları tek hücreler yerine küçük hücre kümeleri olarak tutmayı hedefliyoruz (Şekil 1D). Bununla birlikte, hiPSC'ler hızlı bir şekilde geçildiğinde ayrı koloniler oluşturur ve ayrı koloniler olarak kalırken, vmNPC'ler kolayca bir tek tabaka oluşturur (Şekil 1C). 20. günden itibaren, vmNPC'ler daha önce yayınladığımız orta beyin dopaminerjik nöronları oluşturmak için kullanılabilir (Şekil 1A)30,31.
vmNPC'lerden vmAstros üretme stratejimiz, gelişmekte olan embriyonik beynin, embriyoda astroglial kaderin edinilmesinin ve ayrıca bunun astrositler üretmek için ex vivo nöral progenitörlere ve hiPSC'lere nasıl uygulandığının anlaşılmasına dayanıyordu 22,23,25,32,33,34,35,36,37. Spesifik sinyal yollarının aktivasyonu ile birlikte kültürde uzun sürenin, memeli NPC'leri tarafından, in vitro 6,21,22,23,32'de nöronal potansiyelin astroglial soya doğru kaymasını sağlayan zamanlamayı özetlemek için gerekli olduğu gösterilmiştir. Bu nedenle, kültürlerin 30-90. günden itibaren uzamış genişlemesini desteklemek için LIF ve EGF'yi kullandık (Şekil 1A). Hem LIF'in aşağı akışındaki JAK / STAT sinyali hem de EGF sinyali, astroglial kimliğin indükleyicileridir ve ayrıca astroglial progenitörler 22,23,25,33,34 üzerinde seçici olarak mitojen görevi görür. vmAPC'lerin kültürü için medya bileşenleri, hiPSC'lerden astrosit oluşumunu desteklemek için22 tarafından gösterilenlerden modifiye edilmiştir.
EGF/LIF aracılı genişleme periyodu sırasında, hücreler vmAPC'ler olarak adlandırılır (Şekil 1A,E). 50 ila 90. günler arasında vmAPC'lerin 175cm2'lik doku kültürü şişelerinde kültürlenmesini, her 4 günde bir 1:4 ile 1:6 arasındaki oranlarda geçirilmesini ve böylece ileride kullanılmak üzere dondurularak saklanabilen vmAPC'lerin hızlı bir şekilde genişlemesini sağlamasını bekliyoruz.
90. günden itibaren vmAstros, LIF ile birlikte BMP4 uygulaması aracılığıyla vmAPC'lerden oluşturulur (Şekil 1F). BMP sinyali, olgun astrosit farklılaşması için in vivo gereklidir ve bu etkiyi in vitro 21,23,37,38 olarak özetler. Kültür şişesinde, olgun vmAstro'lar vmAPC'lerden daha büyük görünür (Şekil 1F).
Burada ayrıntıları verilen protokol, hiPSC hattı NAS2 ve AST23'ten tekrarlanabilir şekilde vmAstros üreten altı bağımsız tekrar üzerinde gerçekleştirilmiştir. Ek olarak, vmNPC'lerin üretilmesi (ventral orta beyin dopamin nöronları üretmek için),30'da detaylandırıldığı gibi çoklu hiPSC ve hESC hatları üzerinde gerçekleştirilmiştir.
vmAstros farklılaşması ve fenotipinin karakterizasyonu
vmNPC'lerin ventral orta beyin kimliği, nöral progenitör belirteç Musashi1 (MSI1) ve ventral orta beyin transkripsiyon faktörü FOXA2'nin birlikte ekspresyonu ile doğrulandı (Şekil 2A). vmNPC'ler, FOXA2 ve dopaminerjik belirteç tirozin hidroksilazı (TH) birlikte eksprese eden orta beyin dopamin nöronlarını kolayca üretir (Şekil 2B). EGF ve LIF varlığında vmNPC'lerin genişlemesi, vmAPC'lerin ortaya çıkmasına neden olur (Şekil 2C). Protokolün 90. gününden itibaren, vmAPC'ler, vmAstros'a olgunlaşmayı indüklemek için LIF ile birlikte BMP4'e maruz bırakılır (Şekil 2D). İmmünositokimya, ventral orta beyin transkripsiyon faktörleri LMX1A, LMX1B ve FOXA2'nin astrosit belirteci S100β ile birlikte ekspresyonunu doğruladı (Şekil 2E-G). vmAstros ayrıca olgun astrosit belirteci GFAP'ı (Şekil 2H) ve olgun, fonksiyonel astrositlere özgü olduğu gösterilen yeni belirteç CD49f'yide ifade eder 39,40 (Şekil 2I). Bu sonuçlar birlikte, BMP4 ve LIF ile tedavinin hem in vivo hem de in vitro olarak gösterildiği gibi olgun bir astrosit kimliğini indüklediğini ve olgun vmAstros'un, farklılaşma protokolünün 21,37,38 birincil aşamalarında edinilen bölgesel ventral orta beyin kimliğini koruduğunu doğrulamaktadır (Şekil 2E-I).
vmAstros'un in vivo muadilleriyle uyumlu olarak nöroinflamatuar modülasyon yeteneğine sahip olduğunu doğrulamak için, sitokin maruziyetine tepkilerini karakterize ettik. vmAstros'un 24 saat boyunca sitokin IL-1α'ya maruz kalması, ex vivo reaktif fare astrositleri9 tarafından gösterilenlere benzer morfolojik değişikliklere neden oldu (Şekil 2J, K). Spesifik olarak, IL-1α'nın eklenmesi üzerine, vmAstros'un büyük bir kısmı, çoklu çıkıntılara sahip daha küçük, yuvarlak bir hücre gövdesi gösterdi (Şekil 2K). Bu değişikliklerin nöroinflamatuar uyaranlara yanıt olarak reaktif bir astrosit fenotipini temsil ettiğini doğrulamak için, vmAstros tarafından salgılanan IL-6 seviyesini ölçtük. Artan IL-6 sekresyonu, astrositlerdeki reaktivitenin bir göstergesidir. IL-1α ile 24 saatlik bir tedaviden sonra ELISA ile IL-6 seviyelerini ölçtük, bu da salgılanan IL-6'da büyük ve anlamlı bir artışı doğruladı, böylece vmAstros'un reaktif bir fenotip gösterdiğini doğruladı (Şekil 2L).

Şekil 1: HiPSC'nin vmAstros'a farklılaşması. (A) hiPSC'den vmAstros oluşturmak için optimize edilmiş protokolün şematik bir gösterimi. Protokol farklı aşamalardan oluşur; ilk olarak nöral, ventral orta beyin kaderi, ventral orta beyin patern molekülleri (SHH (C24ii) ve CHIR99021) ile kombinasyon halinde ikili SMAD inhibisyonu (SB431542 ve LDN193189 ile) yoluyla olur. vmNPC'ler, vmNPC genişleme aşaması sırasında herhangi bir dışsal mitojenin yokluğunda hızla çoğalır. BDNF, GDNF ve askorbik asit ilavesi, vmNPC'lerin hayatta kalmasını teşvik ederek hücre sayısında bir artışı destekler. EGF ve LIF ilavesi proliferasyonu sürdürür ve uzun bir kültür periyodu boyunca astroglial kaderin kazanılmasını teşvik eder. İlk hiPSC'den en az 90 gün sonra, vmAPC'ler BMP4'e maruz kaldıklarında olgun vmAstro'lar oluşturur. (B-F) Protokolün farklı aşamalarında görünmesi gerektiği gibi hücrelerin görüntüleri. hiPSC'ler ve vmNPC'lerin hücreleri, tek hücreler (C) yerine küçük kümeler halinde geçer. Ölçek çubukları: B = 500 μm; C = 250 μm; D ve E = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
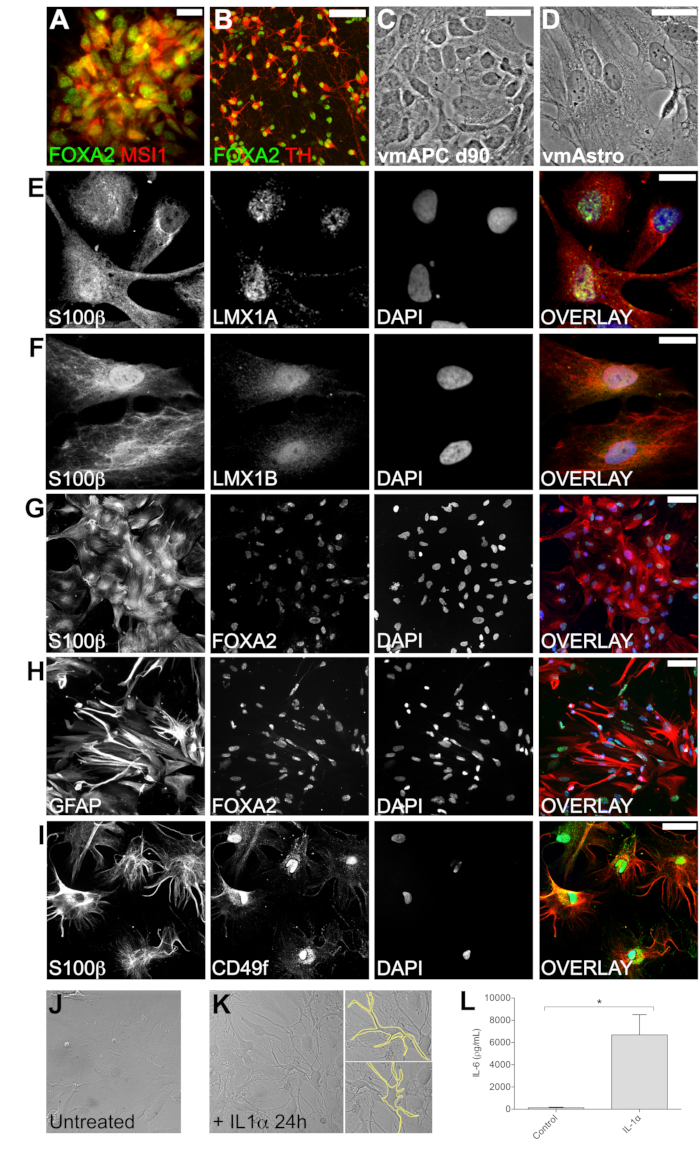
Şekil 2: Açıklanan protokol kullanılarak oluşturulan ara hücrelerin ve vmAstros'un fenotipinin karakterizasyonu, ventral orta beyin kimliğini doğrular. (A) İmmünositokimya, vmNPC'lerin nöral progenitör belirteç MSI1'i (kırmızı) ve ventral orta beyin transkripsiyon faktörü FOXA2'yi (yeşil) eksprese ettiğini gösterdi. (B) vmNPC'ler, dopaminerjik belirteç tirozin hidroksilaz (TH; kırmızı) ve ventral orta beyin transkripsiyon faktörü FOXA2'yi (yeşil) (daha önce30'da yayınlanmıştı) birlikte eksprese eden orta beyin dopamin nöronları üretme yeteneğine sahiptir. (C) Yüksek büyütme fazı kontrast görüntüleri, (D) çekirdekten hücre zarına kadar daha geniş bir alana sahip olan olgun vmAstros'a kıyasla vmAPC'lerin morfolojisini gösterir. İmmünositokimya, olgun vmAstros ko-eksprese astrosit belirteci S100β ve ventral orta beyin belirteçleri LMX1A (E), LMX1B (F) ve FOXA2 (G) gösterdi. (H,I) vmAstros, olgun bir astrosit fenotipi ile ilişkili olan GFAP ve CD49f'yi eksprese eder. (J,L) 24 saat (K) boyunca IL-1α'ya maruz kalanlarla karşılaştırıldığında, işlenmemiş vmAstros (J) kültürlerinin morfolojisini gösteren temsili görüntüler. IL-1α'ya maruz kalma, net morfolojik değişikliklere (K) neden oldu. (L) IL-1α'ya yanıt olarak, vmAstros, IL-6'nın salgılanmasını önemli ölçüde artırdı, bu da vmAstros'un nöroinflamatuar uyaranlara yanıt olarak reaktif bir fenotip oluşturduğunu gösterir (n = 3 bağımsız deney, SEM, eşleşmemiş t-testi p = 0.0227). Tüm immünofloresan görüntüler konfokal mikroskopta çekildi. Ölçek çubukları: A, B, I = 50 μm; C, D = 100 μm; E, F = 25 μm; G,H = 100 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1. Ventral orta beyin astrositlerine (vmAstros) hiPSC farklılaşması için reaktif hazırlığı Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
hiPSC'lerden vmAstros oluşturmaya yönelik bu yöntem son derece verimlidir, saf vmAstros kültürleri oluşturur ve farklı hiPSC hatlarından vmAstros oluşturmak için tekrarlanabilirdir. Bu protokol, gelişmekte olan orta beyni doğru bir şekilde modellemek ve astrositler oluşturmak için embriyoda gerekli olan gelişimsel olayların özetlenmesi etrafında geliştirilmiştir ve tanımlanmış üç aşamadan oluşur: 1) vmNPC'leri oluşturmak için nöral ventral orta beyin indüksiyonu, 2) vmAPC'lerin üretilmesi ve genişletilmesi ve son olarak 3) vmAstros'un olgunlaşması.
Daha önce yayınlanmış çalışmamızda, ventral orta beyin belirteçlerinin optimal ekspresyonunu sağlamak için vmNPC'leri oluşturmak için kullanılan her bir hiPSC hattı için CHIR99021 ve SHH(C24ii) konsantrasyonlarının optimize edilmesinin önemini vurgulamıştık30,31; 200 ng/mL SHH (C24ii) ve 0,8 μM CHIR99021, birden fazla hiPSC hattında tutarlı bir şekilde tekrarlanabilir sonuçlar verir. Bununla birlikte, 300 ng/mL SHH (C24ii) ve 0.6 μM CHIR99021, belirli hiPSC hatları için daha etkili olabilir, ancak hücre sağkalımını da etkileyebilir30,31. Bu nedenle, kullanıcı tarafından optimizasyon yapılması önerilir.
vmAPC'lerin üretilmesi için bu protokolü geliştirirken, hücre yoğunluğunun her aşamada kritik olduğu açıktı. vmNPC indüksiyon aşamasında, hücre sağkalımını desteklemek için hücre yoğunluğu yüksek kalmalıdır, çünkü vmNPC yoğunluğu %75'in altındadır, çünkü çok sayıda vmNPC'nin ölümüne yol açar. vmNPC'lerin proliferasyon hızı, ana hiPSC kültürünün proliferasyon hızına bağlıdır ve hatlar arasında farklılık gösterir; bununla birlikte, proliferatif bir popülasyonu korumak için vmNPC yoğunluğunun yüksek kalması gerekir. Bu nedenle, kullanıcı geçiş rejimini optimize edene kadar vmNPC'lerin muhafazakar oranlarda geçirilmesini öneririz. Buna karşılık, vmAPC'ler yüksek oranlarda geçilmeli, geçtikten sonra yaklaşık% 30-40'lık bir hücre yoğunluğu elde edilmeli ve hücreler birleşir birleşmez geçilmelidir. Ön deneylerimizde, vmAPC'lerin çok yüksek birleşme hızında tutulmasının, çeşitli morfoloji ve astrosit işaretleyici GFAP'ın ekspresyonu ile gösterildiği gibi (veriler gösterilmemiştir) ortaya çıkan vmAstros'ta daha fazla heterojenliğe yol açtığını bulduk. Uygun hücre yoğunluklarının mikrografları referans için bu protokole dahil edilmiştir.
Hem vmNPC'ler hem de vmAPC'ler oldukça proliferatiftir ve nispeten küçük bir başlangıç iPSC popülasyonundan çok sayıda hücre üretir. Örneğin, bu protokole genellikle 10cm'lik 2'lik tek bir iPSC kabı ile başlarız ve 60. güne ulaştığımızda, APC'leri 175cm'lik 2 şişelerde kültürlemeyi bekleriz, her geçişte 4-6 yeni şişe üretir ve bu genişleme hızı 90. güne kadar devam eder. Bundan yola çıkarak, en azından 4.000'e kadar vmAPC şişesi üretme yeteneğine sahip olacağız. Bu genişleme periyodu boyunca vmAPC'leri dondurarak muhafaza ediyoruz ve böylece gelecek nesil olgun vmAstros için büyük bir kriyobank hücre oluşturabiliyoruz. Bu, ilaç taraması gibi uygulamalar için gerekli olan yüksek verimli analizlere olanak sağladığı için son derece avantajlıdır.
Bu protokolün benzersiz yönü, ortaya çıkan vmAstros'un orta beyin kimliğidir. Beyinde, nöronal muadillerine benzer şekilde belirli bölgesel astroglial popülasyonlar, belirli özelliklere sahiptir25,26. Parkinson araştırmasının ana odak noktası, astroglial hücrelerin nöroinflamasyona katılımı ve bunun hastalığın ilerlemesini nasıl etkilediğidir. Nöroinflamasyon, erken Parkinson ve diğer birçok yaralanma veya hastalık senaryosunda mevcuttur12. Nöroinflamatuar yanıtın bir parçası olarak, astrositler nöronları hasardan korumak amacıyla dönüşür - buna "reaktif astrosit" denir. Bununla birlikte, reaktif astrositlerin kendileri Parkinson 9,11 gibi kronik hastalıklarda nörotoksiktir. Parkinson'un hayvan ve in vitro modellerinde, reaktif astroglial aracılı nöroinflamasyon, nörotoksik α-sinüklein patolojisi ve nörodejenerasyon için bir katalizördür 9,14,41,42,43. Bu nedenle, vmAstros'u proinflamatuar sitokinler IL-1α veya IL-1β ile tedavi ederek in vitro nöroinflamatuar bir ortam yarattık. Buna cevaben, vmAstros önemli morfolojik değişiklikler gösterdi ve Parkinson'da da yükselen ve astrosit reaktivitesinin bir ölçüsü olarak yaygın olarak kullanılan IL-6'nın salgılanmasında önemli bir artış gördük.
Sonuç olarak, bu protokol, ventral orta beyindeki in vivo muadillerine paralel bir fenotip gösteren çok sayıda hiPSC'den türetilmiş vmAstros üretmek için tekrarlanabilir ve verimli bir yöntem sağlar. Bu nedenle bu protokol, çok sayıda insan hücresi gerektiren ilaç taraması gibi yüksek verimli uygulamalar için oldukça uygulanabilir. Son zamanlarda yapılan çalışmalar, Parkinson hastalıklarında nöroinflamasyonun rolünü ve astroglia'nın farmakolojik hedeflemesinin nöroinflamasyonu nasıl etkilediğini ve bunun da hastalık patolojisini nasıl modüle ettiğini vurgulamıştır11. Gösterildiği gibi, bu protokolle oluşturulan vmAstros, nöroinflamatuar stimülasyona uygun şekilde yanıt verir ve Parkinson hastalığında astroglial tutulumu incelemek için kapsamlı bir hücresel model sağlar.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, Parkinson Birleşik Krallık proje hibesi (G-1402) ve öğrencilik tarafından finanse edildi. Yazarlar, bu çalışmadaki destek ve yardımları için Wolfson Biyogörüntüleme Tesisine minnetle teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.2M Tris-Cl (pH 8.5) | n/a | n/a | Made up from Tris base and plus HCl |
| 0.5M EDTA, PH 8 | ThermoFisher | 15575-020 | 1:1000 in D-PBS to 0.5 mM final |
| 1,4-diazabicylo[2.2.2]octane (DABCO) | Sigma | D27802- | 25 mg/mL in Mowiol mounting solution |
| 13 mm coverslips | VWR | 631-0149 | |
| 2-Mercaptoethanol (50 mM) | ThermoFisher | 31350010 | |
| Accutase | ThermoFisher | 13151014 | |
| Advanced DMEM/F12 | ThermoFisher | 12634010 | Has 1x NEAA but we add to final concentration of 2x (0.2 mM) |
| Ascorbic acid | Sigma | A5960 | 200 mM stock, 1:1000 to 200 µM final |
| B27 Supplement | ThermoFisher | 17504-044 | 50x stock |
| BSA | Sigma | 5470 | |
| Cell freezing media | Sigma | C2874 | Cryostor CS10 |
| Cell freezing vessel | Nalgene | 5100-0001 | |
| CHIR99021 | Axon Medchem | 1386 | 0.8 mM stock, 1:1000 dilution to 0.8 µM final |
| Cryovials | Sigma | CLS430487 | |
| DAPI | Sigma | D9542 | 1 mg/mL, 1:10,000 to 100ng/mL final (in PBS) |
| DMEM/F12 + Glutamax | ThermoFisher | 10565018 | |
| Dulbeccos-PBS (D-PBS without Mg or Ca) | ThermoFisher | 14190144 | pH 7.2 |
| E8 Flex medium kit | ThermoFisher | A2858501 | |
| Formaldehyde (36% solution) | Sigma | 47608 | |
| Geltrex | ThermoFisher | A1413302 | 1:100 or 1:400 in ice-cold DMEM/F12 |
| Glutamax | ThermoFisher | 35050038 | 2 mM stock (1:200 in N2B27, 1:100 in ASTRO media to 20 µM final) |
| Glycerol | Sigma | G5516 | |
| Human BDNF | Peprotech | 450-02 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human BMP4 | Peprotech | 120-05 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human EGF | Peprotech | AF-100-15 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human GDNF | Peprotech | 450-10 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human insulin solution | Sigma | I9278 | 10 mg/mL stock, 1:2000 to 5 µg/mL final |
| Human LIF | Peprotech | 300-05 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| IL-6 ELISA kit | Biotechne | DY206 | |
| Isopropanol | Sigma | I9516-4L | For filling Mr Frosty cryostorage vessel |
| LDN193189 | Sigma | SML0559 | 100 µM stock, 1:10,000 dilution to 10 nM final |
| Mowiol 40-88 | Sigma | 324590 | |
| N2 Supplement | ThermoFisher | 17502048 | 100x stock |
| NEAA | ThermoFisher | 11140035 | 10 mM stock, 1:100 to 0.1 mM final |
| Neurobasal media | ThermoFisher | 21103049 | |
| Normal Goat serum | Vector Labs | S-1000-20 | |
| Revitacell | ThermoFisher | A2644501 | 100x stock, 1:100 to 1x final |
| SB431542 | Tocris | 1614 | 10 mM stock, 1:1000 dilution to 10 µM final |
| SHH-C24ii | Biotechne | 1845-SH-025 | 200 µg/mL stock, 1:1000 to 200 ng/mL final |
| Tris-HCl | Sigma | PHG0002 | |
| Triton-X | Sigma | X100 | |
| Tween-20 | Sigma | P7949 | |
| Vitronectin | ThermoFisher | A14700 | 1:50 in D-PBS |
| Antibodies for immunocytochemistry | Company | Catalogue Number | Host species |
| Antibody against S100b | Sigma | SAB4200671 | Mouse; 1:200 |
| Antibody against FOXA2 | SCBT | NB600501 | Mouse; 1:50 |
| Antibody against LMX1A | ProSci | 7087 | Rabbit; 1:300 |
| Antibody against LMX1A | Millipore | AB10533 | Rabbit; 1:2000 |
| Antibody against LMX1B | Proteintech | 18278-1-AP | Rabbit; 1:300 |
| Antibody against GLAST | Proteintech | 20785-1-AP | Rabbit; 1:300 |
| Antibody against GFAP | Dako | Z0334 | Rabbit; 1:400 |
| Antibody against CD49f | Proteintech | 27189-1-AP | Rabbit; 1:100 |
| Antibody against MSI1 | Abcam | ab52865 | Rabbit; 1:400 |
| Alexa Fluor 488 Goat Anti-Rabbit | ThermoFisher | A32731 | Goat; 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse | ThermoFisher | A32723 | Goat; 1:500 |
| Alexa Fluor 568 Goat Anti-Rabbit | ThermoFisher | A11036 | Goat; 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse | ThermoFisher | A11031 | Goat; 1:500 |
Referanslar
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013(2017).
- Lees, A. J., Hardy, J., Revesz, T. Parkingson's disease. Lancet. 373, 2055-2066 (2009).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24, 197-211 (2003).
- Booth, H. D. E., Hirst, W. D., Wade-Martins, R. The role of astrocyte dysfunction in Parkinson's disease pathogenesis. Trends in Neurosciences. 40, 358-370 (2017).
- Lindstrom, V., et al. Extensive uptake of alpha-synuclein oligomers in astrocytes results in sustained intracellular deposits and mitochondrial damage. Molecular and Cellular Neuroscience. 82, 143-156 (2017).
- Crompton, L. A., Cordero-Llana, O., Caldwell, M. A. Astrocytes in a dish: Using pluripotent stem cells to model neurodegenerative and neurodevelopmental disorders. Brain Pathology. 27, 530-544 (2017).
- di Domenico, A., et al. Patient-specific iPSC-derived astrocytes contribute to non-cell-autonomous neurodegeneration in Parkinson's disease. Stem Cell Reports. 12, 213-229 (2019).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: an underappreciated topic in neurobiology. Current Opinions in Neurobiology. 20, 588-594 (2010).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: production, function, and therapeutic Potential. Immunity. 46, 957-967 (2017).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24, 931-938 (2018).
- Stokholm, M. G., et al. Assessment of neuroinflammation in patients with idiopathic rapid-eye-movement sleep behaviour disorder: a case-control study. The Lancet Neurology. 16, 789-796 (2017).
- Williams-Gray, C. H., et al. Serum immune markers and disease progression in an incident Parkinson's disease cohort (ICICLE-PD). Movement Disorders. 31, 995-1003 (2016).
- Gelders, G., Baekelandt, V., Vander Perren, A. Linking neuroinflammation and neurodegeneration in Parkinson's disease. Journal of Immunology Research. 2018, 4784268(2018).
- Hall, S., et al. Cerebrospinal fluid concentrations of inflammatory markers in Parkinson's disease and atypical parkinsonian disorders. Scientific Reports. 8, 13276(2018).
- Zamanian, J. L., et al. Genomic analysis of reactive astrogliosis. Journal of Neuroscience. 32, 6391-6410 (2012).
- Clarke, B. E., et al. Human stem cell-derived astrocytes exhibit region-specific heterogeneity in their secretory profiles. Brain. 143 (10), 85(2020).
- Sevenich, L. Brain-resident microglia and blood-borne macrophages orchestrate central nervous system inflammation in neurodegenerative disorders and brain cancer. Frontiers in Immunology. 9, 697(2018).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22, 832-847 (2018).
- Viti, J., Feathers, A., Phillips, J., Lillien, L. Epidermal growth factor receptors control competence to interpret leukemia inhibitory factor as an astrocyte inducer in developing cortex. Journal of Neuroscience. 23, 3385-3393 (2003).
- Nakashima, K., Yanagisawa, M., Arakawa, H., Taga, T. Astrocyte differentiation mediated by LIF in cooperation with BMP2. FEBS Letters. 457, 43-46 (1999).
- Serio, A., et al. Astrocyte pathology and the absence of non-cell autonomy in an induced pluripotent stem cell model of TDP-43 proteinopathy. Proceedings of the National Academy of Sciences of the United States of America. 110, 4697-4702 (2013).
- Gupta, K., et al. Human embryonic stem cell derived astrocytes mediate non-cell-autonomous neuroprotection through endogenous and drug-induced mechanisms. Cell Death and Differentiation. 19, 779-787 (2012).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 25(2013).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -J., Zhang, S. -C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29, 528-534 (2011).
- Xin, W., et al. Ventral midbrain astrocytes display unique physiological features and sensitivity to dopamine D2 receptor signaling. Neuropsychopharmacology. 44, 344-355 (2019).
- Devine, M. J., et al. Parkinson's disease induced pluripotent stem cells with triplication of the alpha-synuclein locus. Nature Communications. 2, 440(2011).
- Chen, Y., et al. Engineering synucleinopathy-resistant human dopaminergic neurons by CRISPR-mediated deletion of the SNCA gene. European Journal of Neuroscience. 49, 510-524 (2019).
- Crompton, L. A., et al. non-adherent differentiation of human pluripotent stem cells to generate basal forebrain cholinergic neurons via hedgehog signaling. Stem Cell Research. 11, 1206-1221 (2013).
- Stathakos, P., et al. A monolayer hiPSC culture system for autophagy/mitophagy studies in human dopaminergic neurons. Autophagy. , 1-17 (2020).
- Stathakos, P., et al. Imaging autophagy in hiPSC-derived midbrain dopaminergic neuronal cultures for Parkinson's disease research. Methods in Molecular Biology. 1880, 257-280 (2019).
- Bilican, B., et al. Mutant induced pluripotent stem cell lines recapitulate aspects of TDP-43 proteinopathies and reveal cell-specific vulnerability. Proceedings of the National Academy of Sciences of the United States of America. 109, 5803-5808 (2012).
- Cordero-Llana, O., et al. Clusterin secreted by astrocytes enhances neuronal differentiation from human neural precursor cells. Cell Death and Differentiation. 18, 907-913 (2011).
- Morrow, T., Song, M. R., Ghosh, A. Sequential specification of neurons and glia by developmentally regulated extracellular factors. Development. 128, 3585-3594 (2001).
- Namihira, M., et al. Committed neuronal precursors confer astrocytic potential on residual neural precursor cells. Developmental Cell. 16, 245-255 (2009).
- Ochiai, W., Yanagisawa, M., Takizawa, T., Nakashima, K., Taga, T. Astrocyte differentiation of fetal neuroepithelial cells involving cardiotrophin-1-induced activation of STAT3. Cytokine. 14, 264-271 (2001).
- Nakashima, K., Yanagisawa, M., Arakawa, H. Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science. 284 (5413), 479-482 (1999).
- Nakashima, K., et al. Developmental requirement of gp130 signaling in neuronal survival and astrocyte differentiation. Journal of Neuroscience. 19, 5429-5434 (1999).
- Barbar, L., et al. CD49f is a novel marker of functional and reactive human iPSC-derived astrocytes. Neuron. 107, 436-453 (2020).
- Barbar, L., Rusielewicz, T., Zimmer, M., Kalpana, K., Fossati, V. Isolation of human CD49f(+) astrocytes and in vitro iPSC-based neurotoxicity assays. STAR Protocols. 1, 100-172 (2020).
- Gao, H. M., et al. Neuroinflammation and alpha-synuclein dysfunction potentiate each other, driving chronic progression of neurodegeneration in a mouse model of Parkinson's disease. Environmental Health Perspectives. 119, 807-814 (2011).
- Gao, H. M., et al. Neuroinflammation and oxidation/nitration of alpha-synuclein linked to dopaminergic neurodegeneration. Journal of Neuroscience. 28, 7687-7698 (2008).
- Horvath, I., et al. Co-aggregation of pro-inflammatory S100A9 with alpha-synuclein in Parkinson's disease: ex vivo and in vitro studies. Journal of Neuroinflammation. 15, 172(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
ISSN 1940-087X
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.