Method Article
Эффективная и масштабируемая генерация вентральных астроцитов среднего мозга человека из индуцированных человеком плюрипотентных стволовых клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе мы представляем метод воспроизводимой генерации вентральных астроцитов среднего мозга из ИПСК и протоколы их характеризации для оценки фенотипа и функции.
Аннотация
При болезни Паркинсона прогрессирующая дисфункция и дегенерация дофаминовых нейронов в вентральном среднем мозге вызывают симптомы, изменяющие жизнь. Дегенерация нейронов при болезни Паркинсона имеет различные причины, в том числе неклеточные автономные механизмы, опосредованные астроцитами. По всей ЦНС астроциты необходимы для выживания и функционирования нейронов, поскольку они поддерживают метаболический гомеостаз в нервной среде. Астроциты взаимодействуют с иммунными клетками ЦНС, микроглией, модулируя нейровоспаление, которое наблюдается с самых ранних стадий болезни Паркинсона, и оказывает непосредственное влияние на прогрессирование ее патологии. При заболеваниях с хроническим нейровоспалительным элементом, в том числе при болезни Паркинсона, астроциты приобретают нейротоксический фенотип, и тем самым усиливают нейродегенерацию. Следовательно, астроциты являются потенциальной терапевтической мишенью для замедления или остановки заболевания, но для этого потребуется более глубокое понимание их свойств и роли при болезни Паркинсона. Поэтому срочно требуются точные модели вентральных астроцитов среднего мозга человека для исследования in vitro.
Мы разработали протокол для получения культур высокой чистоты вентральных среднемозговых специфических астроцитов (vmAstros) из ИПСК и которые могут быть использованы для исследования болезни Паркинсона. vmAstros может быть рутинно получен из нескольких линий hiPSC и экспрессировать специфические астроцитарные и вентральные маркеры среднего мозга. Этот протокол является масштабируемым и, таким образом, подходит для приложений с высокой пропускной способностью, в том числе для скрининга лекарственных средств. Важно отметить, что vmAstros, производные от hiPSC, демонстрируют иммуномодулирующие характеристики, типичные для их аналогов in vivo, что позволяет изучать механистическую передачу нейровоспалительной сигнализации при болезни Паркинсона.
Введение
Болезнь Паркинсона поражает 2-3% людей старше 65 лет, что делает ее наиболее распространенным нейродегенеративным двигательным расстройством1. Он вызван дегенерацией вентральных дофаминовых нейронов среднего мозга в пределах черной субстанции, что приводит к изнурительным двигательным симптомам, а также к частым когнитивным и психиатрическим проблемам2. Патология болезни Паркинсона характеризуется агрегатами белка α-синуклеина, которые токсичны для нейронов и приводят к их дисфункции и гибели 1,2,3. Поскольку дофаминергические нейроны являются дегенеративной популяцией при болезни Паркинсона, они исторически были в центре внимания исследований. Тем не менее, очевидно, что другой тип клеток в мозге, астроциты, также демонстрируют аномалии при болезни Паркинсона и, как полагают, способствуют дегенерации в моделях болезни Паркинсона 4,5,6,7.
Астроциты представляют собой гетерогенную клеточную популяцию, которая может трансформироваться как физически, так и функционально по мере необходимости. Они поддерживают функцию и здоровье нейронов с помощью множества механизмов, включая модуляцию нейронной сигнализации, формирование синаптической архитектуры и трофическую поддержку нейронных популяций посредством секреции специфических факторов 6,8,9,10. Тем не менее, астроциты также играют существенную иммуномодулирующую роль, являясь неотъемлемой частью развития и распространения нейровоспаления 10,11. Нейровоспаление наблюдается в мозге пациентов с болезнью Паркинсона, и недавно было показано, что оно значительно предвосхищает появление симптомов болезни Паркинсона 12,13,14,15, тем самым занимая центральное место в исследованиях болезни Паркинсона.
На клеточном уровне считается, что астроциты становятся реактивными в ответ на травму, инфекцию или болезнь в попытке облегчить нейропротекцию 9,6,10,16. Реактивность описывает сдвиг в фенотипе астроцитов, характеризующийся изменениями в экспрессии генов, секретоме, морфологии и механизмах выведения клеточного мусора и токсичных побочных продуктов 9,10,11,17. Этот реактивный сдвиг происходит в ответ на индуктивные сигналы от микроглии, которая является иммунными клетками ЦНС и первыми реагирует на травмы и болезни9. Как астроциты, так и микроглия реагируют на воспалительные сигналы, замедляя свою собственную функцию, и могут трансдуцировать воспалительные сигналы и, таким образом, напрямую влиять на нейровоспаление 9,10. Тем не менее, хронический характер болезни Паркинсона приводит к переходу, когда реактивные астроциты становятся токсичными для нейронов и сами способствуют дегенерации и патологии заболеваний 6,9,10,18,19. Важно отметить, что недавно было продемонстрировано, что блокирование трансформации астроцитов в реактивный нейротоксический фенотип предотвращает прогрессирование болезни Паркинсона в животных моделях11. Таким образом, реактивность астроцитов в парадигме нейровоспаления стала основным направлением исследований болезни Паркинсона и также связана с широким спектром заболеваний ЦНС. Вместе эти результаты создают картину значительного участия астроцитов в этиологии болезни Паркинсона, подчеркивая необходимость точных исследовательских моделей, которые повторяют фенотип популяций астроцитов человека, вовлеченных в болезнь Паркинсона.
В эмбриональном мозге нейроны появляются первыми, а астроглиальная линия, а именно астроциты и олигодендроциты, появляются на более позднихэтапах развития. Исследования in vivo и in vitro выявили ряд сигнальных путей, которые, по-видимому, контролируют активность нейронных клеток-предшественников от нейрональных до астроглиальных производных. В частности, сигнализация JAK/STAT, EGF и BMP играют роль в пролиферации, дифференцировке и созревании астроглии20,21. Эти пути были в центре внимания протоколов in vitro для получения астроцитов из плюрипотентных клеток, включая hiPSC 6,22,23. Существует множество успешных примеров получения астроцитов из ИПСК 6,24,25. Тем не менее, очевидно, что in vivo астроциты в ЦНС обладают специфическими регионарными идентичностями, которые непосредственно связаны с их функцией, в соответствии со специфическими потребностями этих астроцитов по отношению к их специализированным нейронным соседям 17,24,25,26. Например, в отношении конкретно вентрального среднего мозга было продемонстрировано, что астроциты в этой области экспрессируют специфические наборы белков, включая рецепторы дофамина, обеспечивающие связь с местной популяцией дофаминовых нейронов среднего мозга26. Кроме того, вентральные астроциты среднего мозга демонстрируют уникальные сигнальные свойства26. Поэтому для изучения роли вентральных астроцитов среднего мозга при болезни Паркинсона нам требуется модель in vitro, отражающая их уникальный набор характеристик.
Чтобы решить эту проблему, мы разработали протокол генерации вентральных астроцитов среднего мозга (vmAstros) из ИПСК. Полученные в результате vmAstros демонстрируют характеристики своих вентральных аналогов среднего мозга in vivo, такие как экспрессия специфических белков, а также иммуномодулирующие функции. Представленные результаты получены в результате дифференциации линий NAS2 и AST23 hiPSC, которые были получены и подарены нам доктором Тило Кунатом27. NAS2 был получен от здорового контрольного субъекта, в то время как AST23 получен от пациента с болезнью Паркинсона, несущего трипликацию в локусе, кодирующем α-синуклеин (SNCA). Эти линии hiPSC были ранее охарактеризованы и использованы в ряде опубликованных научных работ, в том числе для генерации различных типов нервных клеток 27,28,29,30,31.
протокол
1. Размораживание, поддержание и криоконсервация линии гиПСК человека
- Для нанесения покрытия на планшеты для культивирования hiPSC разбавьте витронектин до 5 мкг/мл (1:100) в PBS со скоростью 1 мл на 10 см2 площади поверхности планшета для культивирования клеток. Оставить на 1 час при комнатной температуре.
- Удалите витронектин и немедленно приступайте к добавлению ИПСК / среды в культуральный планшет.
ПРИМЕЧАНИЕ При удалении витронектина из планшета крайне важно, чтобы поверхность культуры не высыхала. - Чтобы разморозить иПСК, удалите криовалиалы, содержащие ИПСК из жидкого азота и поместите на водяную баню при температуре 37 °C до полного оттаивания содержимого.
- Приготовьте 9 мл предварительно подогретой среды для клеточных культур (например, E8 или E8 Flex), содержащей 1x клеточную добавку (например, Revitacell). Добавьте по 1 мл по каплям к содержимому криовиала. Поместите оставшиеся 8 мл среды в центрифужную пробирку объемом 15 мл и добавьте к этому разбавленное содержимое криовиала.
ВНИМАНИЕ: Не растирайте содержимое. - Центрифуга при 150 х г в течение 3 мин. Аспирируйте жидкость, не нарушая клеточную гранулу, и ресуспендируйте в соответствующем объеме среды для культивирования клеток (например, E8 или E8 Flex), содержащей 1x клеточную добавку (например, Revitacell). Например, 2 мл на лунку 6-луночного планшета.
- Добавьте ресуспендированные ИПСК в посуду, покрытую витронектином, и поместите в инкубатор с температурой 37 °C/5%CO2 .
ПРИМЕЧАНИЕ: ИПСК следует начинать прикреплять к пластиковой посуде с покрытием из витронектина через 30 мин-2 ч после размораживания. - Поддерживайте уровень ИПСК в среде для культивирования клеток (например, E8 или E8 Flex). Ежедневно подавайте клетки путем обмена средами. Перед кормлением питательную среду всегда прогревайте за 30 минут.
ПРИМЕЧАНИЕ При использовании E8 Flex гиПСК не требует смены среды каждые 24 часа, а при необходимости время подачи может быть увеличено до 48 часов. Из сред E8 Flex или E8 можно получить культуры hiPSC одинаково высокого качества. HiPSCs следует культивировать в течение как минимум 14 дней после размораживания и до начала этапов дифференцировки. Периоды культивирования менее 14 дней, по-видимому, негативно влияют на выживаемость ИПСК в течение начального периода дифференцировки. Пассаж иПСК примерно на 80% слияние (Рисунок 1A: 3-4-дневный интервал пассажа). - За 1 ч до начала добавьте 1x клеточную добавку (например, Revitacell) в культуру hiPSC.
- Промойте ИПСК один раз PBS (без кальция или магния) и добавьте 0,5 мМ ЭДТА (разбавленного из поголовья в PBS без кальция или магния).
- Инкубируйте в течение 5 минут при комнатной температуре или до тех пор, пока иПСК не начнут отделяться друг от друга и приобретать более округлый вид, при этом границы каждого ИПСК будут казаться ярче под светлым микроскопом.
- Добавьте 200 мкл ЭДТА в сфокусированную область гиПСК с помощью пипетки. Если они легко отделяются, оставляя свободное пространство в клеточном слое, то они готовы к сбору. Если они не сразу отделяются, оставьте в ЭДТА и повторите через 1 минуту.
- Когда все будет готово, аккуратно удалите ЭДТА и с помощью пипетки дважды осторожно промойте ИПСК клеточной питательной средой (например, E8 или E8 Flex).
ПРИМЕЧАНИЕ: Чтобы добиться этого без отсоединения иПСК, наклоните пластину и добавьте среду по каплям вниз по боковой стороне питательной пластины. - Для сбора ИПСК используйте 1 мл клеточной питательной среды (например, E8 или E8 Flex), содержащей 1x клеточную добавку (например, Revitacell). Выпустите среду непосредственно на слой hiPSC, и ячейки должны отсоединиться. При необходимости повторите то же самое с другим 1 мл среды.
- Просмотрите иПСК под микроскопом. В идеале ИПСК должны проявляться в относительно однородных кластерах, как показано на рисунке 1B. Если кластеры hiPSC намного больше или очень изменчивы по размеру, используйте пипетку, чтобы разбить более крупные кластеры hiPSC (рис. 1B).
ПРИМЕЧАНИЕ: Не перетирайте ИПСК чрезмерно. Несмотря на то, что добавка увеличивает общую выживаемость клеток, чрезмерное растирание негативно влияет на выживаемость культуры ИПСК. Рекомендуется 1-4 прохода пипеткой. - С помощью серологической пипетки перенесите суспензию гиПСК на пластину, покрытую витронектином, как это было приготовлено на шаге 1.1. Верните культуру гиПСК в инкубатор с температурой 37 °C/5%CO2 .
ПРИМЕЧАНИЕ: Криоконсервируйте ИПСК при конфлюенции примерно 80%. - За 1 ч до начала добавьте 1x клеточную добавку (например, Revitacell) в культуру hiPSC.
- Отделите гиПСК от культуральных планшетов с помощью 0,5 мМ ЭДТА, как описано в шаге 1.4, собирая клетки в среде для культивирования клеток (например, E8 или E8 Flex), содержащей 1x клеточную добавку (например, Revitacell). Центрифуга при 150 х г в течение 3 мин.
- Ресуспендируйте гранулированные ИПСК в средах для замораживания клеток (см. Таблицу материалов). Используйте 700 мкл на 10 см2 площади культивирования, что эквивалентно 1 криовиалу клеток на лунку 6-луночного планшета.
- Переложите криовиалы в соответствующий сосуд для заморозки клеток (подробнее см. Таблицу материалов).
- Переведите морозильную камеру в морозильную камеру с температурой -80 °C на 24 часа. Через 24 ч криовики можно переводить на жидкий азот (-196 °C) для длительного хранения.
2. Протокол дифференциации vmAstro
ПРИМЕЧАНИЕ: Схематическое описание протокола дифференцировки vmAstros показано на рисунке 1A. Подробный перечень необходимых для протокола реагентов и их приготовления приведен в таблице 1.
- Индукция vmNPC
ПРИМЕЧАНИЕ: Этот протокол был оптимизирован для начала с минимальной конфлюенции 1x лунки из 6-луночного планшета (10 см2) hiPSCs 70%-80%, что составляет примерно 4-5 x 104 клеток/см2 (Рисунок 1B)30. Количество и плотность исходных клеток должны быть оптимизированы для каждой линии hiPSC, поскольку это значительно влияет на выживаемость и эффективность дифференцировки.- Удалите питательную среду для клеточных клеток из ИПСК и промойте 3 раза в DMEM/F12 + глутамакс. Замените носитель на индукционный носитель vmNPC объемом 2 мл (N2B27 + CHIR99021 + SB431542 + SHH(C24ii) + LDN193189. Подробнее о подготовительных средах и реагентах см. в таблице 1 .
- Кормите через день с половинной сменой среды через 24 часа и полной сменой среды через 48 часов.
ПРИМЕЧАНИЕ: Через 3-4 дня культуре vmNPC потребуется пассирование. Рекомендуется использовать стандартное соотношение пассажа 1:3 или 1:4 - его необходимо оптимизировать для каждой используемой линии hiPSC. - За 1 час до пассажа добавьте 1x клеточную добавку (например, Revitacell) к vmNPC и приготовьте 1x пластик для культуры тканей, покрытый матрицей базальной мембраны (например, Geltrex) (раздел 2.2 Подготовка матрицы базальной мембраны и нанесение покрытия на пластик культуры).
- Извлеките носитель из vmNPC и промойте 2 раза с помощью D-PBS. Добавьте 1 мл предварительно подогретого раствора для отслойки клеток (например, Аккутазы) на 10 см2 площади культуры (1 мл на лунку 6-луночного планшета).
- Поместите при температуре 37 °C на 1 минуту, а затем исследуйте vmNPC с помощью фазово-контрастного микроскопа.
ПРИМЕЧАНИЕ: vmNPC начнут округляться, их отростки снова втягиваются, а в клеточном слое появляются пробелы. Это может занять от 1 до 3 минут в зависимости от плотности клеток. - Когда vmNPC приобретают такой вид, добавьте 100 μL раствора для отслоения клеток (например, Accutase) в слой vmNPC.
ПРИМЕЧАНИЕ: Если vmNPC готовы к отделению, в клеточном слое появится отверстие. Если этого не происходит, то vmNPC требуется дальнейшая инкубация с раствором для отслойки клеток. - Если vmNPC легко отделяются, аккуратно удалите раствор для отсоединения клеток и промойте vmNPC 2x с помощью носителя N2B27. Аккуратно добавьте фильтрующий материал N2B27 на стенку лунки или емкости для культуры и аккуратно покрутите для промывки, следя за тем, чтобы vmNPC не отсоединились.
ПРИМЕЧАНИЕ: Этот шаг должен быть выполнен быстро, чтобы гарантировать, что vmNPC не прикрепятся к поверхности клетки. Если vmNPC начинают отделяться на этапах промывки, соберите их с помощью центрифугирования при 150 x g в течение 3 мин. vmNPC не центрифугируются как обычно при прохождении, так как это может снизить их выживаемость. - Наконец, удалите vmNPC с помощью пипетки, энергично выбрасывая индукционную среду vmNPC, содержащую 1x клеточную добавку (например, Revitacell), непосредственно на клеточный слой. Это должно привести к удалению vmNPC, которые затем могут быть перенесены непосредственно в новые культуральные сосуды, покрытые матричным покрытием.
ПРИМЕЧАНИЕ: Не используйте повторно среды, уже содержащие ресуспендированные vmNPC, для удаления других клеток, так как это приведет к их чрезмерной тритурации, что снижает их выживаемость. - Замените в инкубаторе при температуре 37 °C/5%CO2 . vmNPC должны начать прикрепляться к поверхности с матричным покрытием через 20-30 минут. Замените половину среды свежими индукционными средами vmNPC (без добавки клеток) через 24 ч и продолжайте график кормления, как и раньше.
- Продолжайте режим кормления и пассажа в течение 10 дней.
- Подготовка матрицы базальной мембраны и покрытие культуры тканей пластиком
ПРИМЕЧАНИЕ: Для обслуживания vmNPC используется матрица базальной мембраны 1x (например, Geltrex) для покрытия пластиковых изделий. Для обслуживания vmAPC или vmAstros можно использовать матрицу базальной мембраны 0,25x.- Выньте матрицу с базальной мембраной из морозильной камеры при температуре -80 °C и поместите в холодильник с температурой 4 °C на ночь для оттаивания.
- Разбавьте 1:10 ледяным DMEM/F12 + глутамакс, аликвотой и храните при -80 °C в 10-кратном запасе.
- При нанесении покрытия на пластиковую посуду разбавьте этот 10-кратный сток до 1x (для vmNPC) или 0,25x (для vmAPC или vmAstros) ледяным DMEM/F12 + глутамакс.
- Немедленно добавьте в тканевые культуры пластику из расчета 1 мл на 10 см2 , например, 1 мл на лунку 6-луночного планшета.
- Хранить при температуре 37 °C в течение 1 часа. Матричный раствор базальной мембраны не следует удалять с пластиковой посуды до тех пор, пока он не будет готов к добавлению среды/ячеек, чтобы пластиковая посуда с покрытием не высыхала. Пластины с матричным покрытием не требуют промывки перед добавлением ячеек.
- Расширение vmNPC
- На 10-й день протокола замените индукционную среду на среду расширения vmNPC (N2B27 + GDNF + BDNF + аскорбиновая кислота. Подробнее о подготовительных средах и реагентах см. в таблице 1 .
Примечание: vmNPC не требуют добавления митогенов, чтобы индуцировать пролиферацию. BDNF, GDNF и аскорбиновая кислота поддерживают выживание и поддержание vmNPCs30. - Кормите через день с половинной сменой среды через 24 часа и полной сменой среды через 48 часов.
ПРИМЕЧАНИЕ: Через 3-4 дня культуре vmNPC потребуется пассирование. Для пропускания рекомендуется использовать стандартное соотношение пропускания 1:3 или 1:4 (его необходимо оптимизировать для каждой используемой линии hiPSC). Определите соотношение, которое обеспечивает наилучшую выживаемость, пролиферацию и генерацию vmNPC). - За 1 час до пассирования добавьте 1x клеточную добавку (например, Revitacell) к vmNPC и заранее подготовьте 1x матричные покрытые пластины/колбы (раздел 2.2 Подготовка матрицы базальной мембраны и покрытие из пластика для выпускаемой культуры). Предварительно подогрейте раствор для отслоения клеток (например, Аккутазу) до 37 °C. Предварительно подогрейте свежую расширяющую среду vmNPC, содержащую 1x клеточную добавку (например, Revitacell).
- Извлеките носитель из vmNPC и промойте 2 раза с помощью D-PBS. Добавьте 1 мл раствора для отсоединения клеток (например, Аккутазы) на 10 см2 площади культивирования (1 мл на лунку 6-луночного планшета). Поместите при температуре 37 °C на 1 минуту, а затем исследуйте vmNPC с помощью фазово-контрастного микроскопа.
ПРИМЕЧАНИЕ: vmNPC начнут округляться, их отростки снова втягиваются, а в клеточном слое появляются пробелы. Это может занять от 1 до 3 минут в зависимости от плотности клеток. - Когда vmNPC приобретут округлый вид, добавьте 100 μL раствора для отслойки клеток (например, Accutase) на слой vmNPC.
ПРИМЕЧАНИЕ: Если vmNPC готовы к отделению, в клеточном слое появится отверстие. Если этого не происходит, то vmNPC требуется дальнейшая инкубация с раствором для отслойки клеток. - Если vmNPC легко отделяются, аккуратно удалите раствор для отсоединения клеток и промойте vmNPC 2x с помощью носителя N2B27. Аккуратно добавьте фильтрующий материал N2B27 на стенку лунки или емкости для культуры и аккуратно покрутите для промывки, следя за тем, чтобы vmNPC не отсоединились.
ПРИМЕЧАНИЕ: Если vmNPC начинают отделяться в больших количествах на этапах промывки, соберите с помощью центрифугирования при 150 x g в течение 3 мин. vmNPC не центрифугируются в стандартной комплектации при прохождении, так как это может снизить их выживаемость. Этот шаг должен быть выполнен быстро, чтобы гарантировать, что vmNPC не прикрепятся к поверхности клетки. - Удалите vmNPC с помощью пипетки и энергично выбросьте расширяющую среду vmNPC, содержащую 1x клеточную добавку (например, Revitacell), непосредственно на клеточный слой. При этом vmNPC должны быть удалены, которые затем могут быть перенесены непосредственно в предварительно подготовленные пластины/колбы с матричным покрытием (см. раздел 2.2 «Подготовка матрицы базальной мембраны и покрытие пластика тканевой культуры»).
ПРИМЕЧАНИЕ: Не используйте повторно среды, уже содержащие ресуспендированные vmNPC, для удаления других клеток, так как это приведет к их чрезмерной тритурации, что снижает их выживаемость. - Замените в инкубаторе при температуре 37 °C/5%CO2 . vmNPC должны начать прикрепляться к поверхности с матричным покрытием через 20-30 минут. Через 24 ч замените половину питательных сред свежими расширяющими средами vmNPC (без клеточной добавки) и продолжайте прежний график кормления.
- Продолжайте такой режим кормления и пассажа в течение 10 дней. vmNPC могут быть расширены до 50-го дня.
- На 10-й день протокола замените индукционную среду на среду расширения vmNPC (N2B27 + GDNF + BDNF + аскорбиновая кислота. Подробнее о подготовительных средах и реагентах см. в таблице 1 .
- Дифференциация и расширение vmAPC
ПРИМЕЧАНИЕ: vmNPC могут быть успешно использованы для генерации vmAPCs/vmAstros в любом месте от 30 до 50 дней с начальной стадии hiPSC (Рисунок 1A).- Возьмите конфлюентную культуру vmNPC и промойте vmNPC 3 раза в усовершенствованном DMEM/F12, чтобы удалить следы компонентов среды расширения vmNPC. Замените носитель на носитель расширения vmAPC (носитель ASTRO + EGF + LIF. Подробнее о подготовительных средах и реагентах см. в таблице 1 .
- После 72-часового пассажа культура vmNPC находится в высоком соотношении (1:7,5). Например, предполагая, что vmNPC содержались в одной лунке 6-луночного планшета, теперь их следует пропускать в колбу 1x с покрытием из матрицы 75 см2 (с покрытием, как описано в разделе 2.2 «Подготовка матрицы базальной мембраны и покрытие пластикой культуры тканей»). Прохождение с использованием раствора для отделения клеток, как описано для vmNPC в разделе 2.3 «Экспансия vmNPC».
- Ресуспендируйте vmNPC в соответствующем объеме среды vmAPC Expansion (7,5-15 мл среды на 75 см2 колбы). Выполняйте смену носителей каждые 3 дня или по мере необходимости ячеек.
ПРИМЕЧАНИЕ: С этого момента vmNPC называются vmAPC и должны передаваться как отдельные клетки, а не кластеры клеток. vmAPC следует пропускать каждые 3-7 дней или по мере их слияния, чтобы избежать чрезмерного слияния. Начиная с этого момента, для нанесения покрытия на пластиковые изделия следует использовать уменьшенную концентрацию матрицы 0,25x (как описано в разделе 2.2 «Подготовка матрицы базальной мембраны и покрытие пластика культуры тканей»). - Расширяйте vmAPC до тех пор, пока они не достигнут 90-го дня (со стадии hiPSC), криоконсервируя vmAPC на различных этапах их расширения.
- Генерация зрелых vmAstro из vmAPC
ПРИМЕЧАНИЕ: На этом этапе vmAPC можно выращивать в колбах для культуры тканей размером 175 см2 . Эта возможность может быть расширена для генерации большого количества зрелых vmAstro.- Когда vmAPC достигнет 80% конфлюенции, промойте 3 раза фильтрующим материалом ASTRO и замените его на фильтрующий материал vmAstros (фильтрующий материал ASTRO + BMP4 + LIF. Подробнее о подготовительных средах и реагентах см. в таблице 1 .
- Проводите полную смену среды каждые 3 дня или в зависимости от требований клеток в течение 10 дней.
ПРИМЕЧАНИЕ: a) На этом этапе определение характеристик указывает на то, что vmAstros являются зрелыми, что подтверждается иммуноцитохимией (рисунок 2G - I) и анализом экспрессии генов (рукопись в стадии подготовки). б) vmAstros, используемый сразу после созревания, должен быть повторно нанесен на вновь подготовленную поверхность с матричным покрытием. Хранение vmAPC или vmAstros на одной и той же поверхности культуры в течение более 14 дней может привести к неоптимальным культурам, когда клетки начинают уменьшаться в размерах и даже отделяться. в) При исследовании нейровоспалительной модуляции BMP и LIF удаляют за 72 ч до нейровоспалительной стимуляции. Это необходимо для того, чтобы избежать любого потенциального взаимодействия между передачей сигналов BMP/LIF и индуцированной нейровоспалительной сигнализацией. - Теперь vmAstros можно повторно покрывать для экспериментальных анализов, например, на покровных стеклах для иммуноцитохимии или криоконсервировать для будущих применений (разделы 3, 4).
ПРИМЕЧАНИЕ: На данном этапе протокола не должно быть необходимости в прохождении, поскольку распространение должно происходить только с очень низкой скоростью. Слишком плотно покрытые vmAPC на этой стадии поддерживают более высокие уровни пролиферации. Если это так, пассаж и разделение ячеек для достижения плотности, как показано на рисунке 1F.
3. Криоконсервация vmNPC, vmAPC и vmAstros
ПРИМЕЧАНИЕ: Криоконсервация vmNPCs/vmAPCs/vmAstros при полном слиянии.
- За 1 час до начала добавьте в культуру 1x клеточную добавку (например, Revitacell). Наполните сосуд для криохранения (см. Таблицу материалов) изопропанолом при комнатной температуре.
- Отделите клетки от культуральных планшетов с помощью раствора для отслойки клеток, как описано выше, собирая клетки в соответствующих средах (N2B27 или ASTRO), содержащих 1x клеточную добавку (например, Revitacell). Центрифуга при 150 х г в течение 3 мин.
- Ресуспендируйте гранулированные vmNPCs/vmAPCs/vmAstros в средах для замораживания клеток (см. Таблицу материалов) следующим образом (шаги 3.3.1. - 3.3.3.):
- Для vmNPC: используйте 700 μл на 10 см2 площади культивирования, на 1 криовиальную область.
- Для vmAPC: используйте 700 μл на 60 см2 площади культивирования на 1 криовиальную (примерно 1/3 колбы для культур T175).
- Для vmAstros: повторно суспензируйте в 2 мл среды и посчитайте количество vmAstros. Повторно центрифугируйте и ресуспендируйте в средах для замораживания клеток (см. Таблицу материалов) в количестве на криовиал, подходящем для будущих применений. Предполагая, что приблизительная потеря клеток составляет 15% из-за замораживания-размораживания, только что размороженные vmAstro подсчитываются и покрываются 15% избыточным числом клеток, чтобы компенсировать гибель клеток в процессе замораживания-размораживания. Таким образом, это эквивалентно 74 750 vmAstros насм2. Размороженные vmAstro выдерживаются в течение 72 ч в среде ASTRO перед анализом.
- Переложите криовиалы в контейнер для заморозки клеток (подробнее см. Таблицу материалов) и переведите контейнер для заморозки в морозильную камеру при температуре -80 °C на 24 часа. Через 24 ч криовики можно переводить на жидкий азот (-196 °C) для длительного хранения.
4. Характеристика фенотипа vmAstro
- Иммуноцитохимия
- Поместите 100-200 стеклянных покровных стекол 13 мм в стеклянные чашки Петри на слой фильтровальной бумаги и простерилизуйте их в сухом автоклаве.
- Перенесите покровные стекла в лунки 4- или 24-луночных планшетов с помощью стерильных щипцов. Добавьте 1x матричный раствор (например, Geltrex) на покровные стекла в виде капель объемом 50 мкл и инкубируйте при 37 °C в течение 1 часа.
- Пропустите или разморозьте vmAstros, повторно суспендируйте в среде ASTRO и проведите подсчет. Планшет vmAstros по 25-100 000 клеток на покровное стекло в капле объемом 50 мкл.
- Снимите матрицу с покровного стекла и сразу же добавьте vmAstros в каплю носителя. Поместите при температуре 37 °C на 30 минут, а затем затопите лунки дополнительным 250 μл фильтрующего материала ASTRO.
ПРИМЕЧАНИЕ: При проведении иммуноцитохимии для простой проверки экспрессии астроцитов и маркеров среднего мозга, vmAstros можно зафиксировать через 24 часа после нанесения. - Приготовьте 4% раствор формальдегида, разбавив 36% раствор формальдегида 1:9 в D-PBS.
- Промойте vmAstros 1x с D-PBS. Сразу же добавьте в лунки 4% формальдегид и оставьте при комнатной температуре на 10 минут.
- Удалите формальдегид и замените его на D-PBS. Либо хранить при температуре 4 °C, либо приступать к иммуноцитохимии.
- Постирайте покровные стекла в лунках 3 раза с D-PBS. Пермеабилизируйте и заблокируйте в 10% козьей сыворотке, 1% BSA в 0,1% PBTx (D-PBS + 1:1000 Triton-X) на 1 ч при комнатной температуре.
- Добавьте первичные антитела (Таблица материалов) в 1% козью сыворотку, 0,1% BSA в 0,1% PBTx (D-PBS + 1:1000 Triton-X) и инкубируйте в течение ночи при 4 °C на коромысле.
- На следующий день удалите первичные антитела и промойте покровные стекла 3 раза с D-PBS.
- Добавьте соответствующие вторичные антитела (Таблица материалов) в 1% козью сыворотку, 0,1% BSA в 0,1% PBTx и инкубируйте в течение 1-2 часов при комнатной температуре и защищайте от света на качалке. Стирайте покровные стекла 3 раза с D-PBS.
- Добавьте раствор DAPI (0,1 мкг/мл DAPI в D-PBS) и инкубируйте при комнатной температуре в течение 10 минут. Стирайте покровные стекла 3 раза с D-PBS.
- Чтобы установить покровное стекло, добавьте каплю 5 мкл монтажного материала Mowiol/DABCO [12% Mowiol (w/v), 12% глицерина (w/v), растворенного в течение ночного перемешивания в 0,2 M Tris (pH 8,5) с 25 мг/мл 1,4-диазабицила[2.2.2]октанового числа (DABCO)] на предметное стекло микроскопа. С помощью щипцов осторожно снять покровный стекло с колодца; Промокните край покровного стекла на салфетке, чтобы удалить лишнюю жидкость, и поместите vmAstros стороной вниз на каплю Mowiol/DABCO.
- Повторите для каждого покровного стекла и дайте высохнуть в течение 8 часов перед микроскопическим исследованием.
- Измерение с помощью иммуноферментного анализа секреции vmAstros IL-6 в ответ на лечение цитокинами
ПРИМЕЧАНИЕ: После 10-дневного созревания с BMP4 и LIF, vmAstros следует пропустить, подсчитать и нанести на пластиковую посуду с тканевым покрытием 0,25x (как подробно описано в Раздел 2.2Подготовка матрицы базальной мембраны и покрытие культуры тканей пластиком), при плотности 65 000 вмАстро на см2 в ASTRO media. BMP4 и LIF должны быть удалены из vmAstros за 72 ч до лечения цитокинами, так как активная передача сигналов от этих факторов может повлиять на эффективность лечения цитокинами. В качестве альтернативы можно разморозить криоконсервированный vmAstros и использовать его для анализа.- В день проведения анализа аккуратно промойте vmAstros 3x в неокислительно-восстановительных средах (DMEM/F-12 + глутамакс + N2).
- Для сравнения используйте необработанный контроль и хорошо обработанный цитокинами. Добавьте выбранный цитокин в оптимизированной концентрации. Данные на рисунке 2J - L были получены с использованием IL-1α в концентрации 3 нг/мл9 в неокислительно-восстановительных средах из расчета 1 мл на 10 см2 площади клеточной культуры.
- Замените vmAstros в инкубаторе с температурой 37 °C/5%CO2 на 24 часа. Через 24 ч соберите питательные среды в стерильные микрофуговые пробирки.
- Если ИФА не будет проведен немедленно, заморозьте образцы среды, погрузив микрофужеру в жидкий азот и храня при температуре -80 °C для последующего анализа.
ПРИМЕЧАНИЕ: Следующий протокол оптимизирован специально для использования с набором ИЛ-6 ИФА, подробно описанным в Таблице материалов. Антитела и стандарты, поставляемые в виде лиофилизированного порошка в новом наборе для ИФА, должны быть восстановлены перед первым использованием и аликвотированы для использования в будущем. В техническом паспорте, прилагаемом к набору, подробно описаны реагенты и объемы, необходимые для восстановления. Антитело захвата должно быть восстановлено в PBS (без белка-носителя). - Проведите ИФА в формате 96-луночных планшетов и рассчитайте объемы реагентов в соответствии с используемыми скважинами. В день ИФА приготовьте антитела захвата, разбавив бульон в соотношении 1:120 в PBS. Покройте планшет, загрузив 50 мкл антитела захвата в лунку. Накройте тарелку клейкой лентой и выдерживайте при комнатной температуре в течение ночи.
- На следующий день вымойте пластину 3 раза с D-PBS-Tween (D-PBS с 0,05% Tween-20), 100 μл на лунку. Промокните насухо.
- Заблокируйте планшет, загрузив 150 μL D-PBS/1% BSA на лунку. Инкубировать при комнатной температуре не менее 1 ч. Умойте тарелку, как описано.
- Разморозьте образцы на льду (на это может уйти 1-2 ч). Разбавьте образцы в соотношении 1:5, загрузив образец в 10 мкл и 40 мкл d-PBS/1% BSA. Сделайте вихревую обработку каждого образца перед загрузкой.
ПРИМЕЧАНИЕ: При проведении ИФА ИЛ-6 необходимо разбавлять пробы, разведения следует оптимизировать. - Приготовьте верхний стандарт (1 000 г/мл), разбавив исходное вещество 1:180 в D-PBS/1% BSA. Подготовьте 7 стандартов, проведя серийное разбавление верхнего стандарта. Вихрь между каждым разведением.
- Добавьте в лунки 50 мкл стандартов/образцов. Используйте D-PBS/1% BSA в качестве заготовки. Инкубировать при комнатной температуре в течение 2 ч на орбитальном шейкере, чтобы правильно перемешать разведенные образцы. Умойте тарелку, как описано.
- Приготовьте антитела для обнаружения путем разбавления бульона в соотношении 1:60 в D-PBS/1% BSA. Загрузите 50 мкл антител для обнаружения на лунку. Накройте тарелку крышкой и выдерживайте при RT в течение 2 ч. Умойте тарелку, как описано.
- Стрептавидин получают конъюгированную с пероксидазой хрена (Strep-HRP) путем разведения бульона 1:40 в D-PBS/1% BSA. Загрузите 50 мкл Strep-HRP в лунку и инкубируйте при комнатной температуре в течение 20 минут в темноте. Умойте тарелку, как описано.
- Инициируйте цветовую реакцию, загрузив 50 μл раствора субстрата TMB в лунку. Инкубировать при комнатной температуре в темноте в течение 20 мин (или до тех пор, пока стандарты и образцы не приобретут синий цвет).
ПРИМЕЧАНИЕ: TMB хранится при температуре 4 °C, но его следует использовать при комнатной температуре. - Остановите реакцию, добавив 25 мкл стоп-раствора (1 М Н2SO4) в лунку и обратите внимание на изменение цвета с синего на желтый.
- Считывание показаний с пластины при поглощении 450 нм с помощью микропланшетного ридера. Установите коррекцию длины волны на поглощение 540 нм для максимальной точности. Рассчитайте концентрации белка в образцах по полученной стандартной кривой.
Результаты
Методология дифференцировки и прогрессия
Здесь мы подробно описываем как методы, использованные для генерации vmAstros, так и протоколы, используемые для их последующей фенотипической характеристики. Метод получения vmAstros состоит из нескольких различных стадий дифференцировки, которые можно контролировать с помощью микроскопии и выявлять различные морфологические характеристики (рис. 1A-F). Культура гиПСК без фидеров (рис. 1B) подвергается воздействию специфических факторов, чтобы индуцировать их дифференцировку в направлении нейронной линии (LDN193189, SB431542), в частности, вентрального среднего мозга (CHIR99021, SHH-C24ii). Это приводит к получению культуры vmNPC, которые морфологически отличаются от hiPSCs — vmNPC менее округлые, чем hiPSCs, а vmNPC имеют удлиненную многоугольную или треугольную форму, типичную для нейронных предшественников (рис. 1B, C). Морфологическое различие становится очевидным с 7-10 дня и далее. Когда vmNPC пассируются, подобно hiPSCs, мы стремимся поддерживать их в виде небольших клеточных кластеров, а не отдельных клеток, чтобы повысить выживаемость клеток (рис. 1D). Однако, в то время как иПСК при прохождении быстро образуют и остаются отдельными колониями, vmNPC легко образуют монослой (рис. 1C). Начиная с 20-го дня, vmNPC можно использовать для генерации дофаминергических нейронов среднего мозга (рис. 1A), которые мы ранее опубликовали30,31.
Наша стратегия создания vmAstros из vmNPC основывалась на понимании развивающегося эмбрионального мозга, приобретения астроглиальной судьбы у эмбриона, а также того, как это было применено к ex vivo нейронным предшественникам и hiPSCs для создания астроцитов 22,23,25,32,33,34,35,36,37 . Было продемонстрировано, что удлиненное время в культуре вместе с активацией специфических сигнальных путей требуется NPC млекопитающих для повторения времени, позволяющего сдвиг нейронной активности в сторону астроглиальной линии in vitro 6,21,22,23,32. Поэтому мы использовали LIF и EGF для поддержки удлиненного наращивания культур с 30-90 дня (рис. 1A). Как передача сигналов JAK/STAT после LIF, так и передача сигналов EGF являются индукторами астроглиальной идентичности и также избирательно действуют как митогены на предшественниках астроглиальных предшественников 22,23,25,33,34. Компоненты среды для культивирования vmAPC модифицированы по сравнению с теми, которые были продемонстрированыв 22, для поддержки генерации астроцитов из hiPSCs.
В период экспансии, опосредованной EGF/LIF, клетки называются vmAPC (рис. 1A, E). Мы ожидаем, что между 50 и 90-м днями можно будет культивировать vmAPC в колбах для культуры тканей размером 175 см2 , пропуская их в соотношении от 1:4 до 1:6 каждые 4 дня, что обеспечит быстрое увеличение vmAPC, которые могут быть крионированы.
Начиная с 90-го дня, vmAstro генерируются из vmAPC с помощью BMP4 в сочетании с LIF (рис. 1F). Передача сигналов BMP необходима in vivo для дифференцировки зрелых астроцитов и повторяет этот эффект in vitro 21,23,37,38. В колбе для культур зрелые vmAstros кажутся крупнее, чем vmAPC (рис. 1F).
Описанный здесь протокол был выполнен на основе шести независимых повторов, воспроизводимо генерируя vmAstros из hiPSC-линий NAS2 и AST23. Кроме того, генерация vmNPC (для продуцирования вентральных дофаминовых нейронов среднего мозга) проводилась на нескольких линиях hiPSC и hESC, как описано впункте 30.
Характеристика дифференцировки и фенотипа vmAstros
Вентральная идентичность vmNPC в среднем мозге была подтверждена совместной экспрессией нейронного маркера-предшественника Musashi1 (MSI1) и вентрального фактора транскрипции среднего мозга FOXA2 (рис. 2A). vmNPC легко генерируют дофаминовые нейроны среднего мозга, которые совместно экспрессируют FOXA2 и дофаминергический маркер тирозингидроксилазу (TH) (рис. 2B). Расширение vmNPC в присутствии EGF и LIF приводит к появлению vmAPC (рис. 2C). Начиная с 90-го дня протокола, vmAPC подвергаются воздействию BMP4 в сочетании с LIF для индуцирования созревания в vmAstros (Рисунок 2D). Иммуноцитохимия подтвердила совместную экспрессию вентральных факторов транскрипции среднего мозга LMX1A, LMX1B и FOXA2 с астроцитарным маркером S100β (рис. 2E-G). vmAstros также экспрессируют маркер зрелых астроцитов GFAP (рисунок 2H) и новый маркер CD49f, который, как было показано, специфичен для зрелых, функциональных астроцитов39,40 (рисунок 2I). В совокупности эти результаты подтверждают, что лечение BMP4 и LIF индуцирует идентичность зрелых астроцитов, как показано как in vivo, так и in vitro, и что зрелые vmAstros поддерживают регионарную вентральную идентичность среднего мозга, приобретенную на первичных стадиях протокола дифференцировки21,37,38 (Рисунок 2E-I).
Чтобы подтвердить, что vmAstros способны к нейровоспалительной модуляции в соответствии с их аналогами in vivo, мы охарактеризовали их реакцию на воздействие цитокинов. Воздействие на vmAstros цитокина IL-1α в течение 24 ч приводило к морфологическим изменениям, аналогичным тем, которые демонстрировались реактивными астроцитами мышейex vivo 9 (рис. 2J, K). В частности, при добавлении IL-1α большая часть vmAstros продемонстрировала меньшее округлое клеточное тело с множественными проекциями (рис. 2K). Чтобы подтвердить, что эти изменения являются репрезентативными для реактивного фенотипа астроцитов в ответ на нейровоспалительные стимулы, мы измерили уровень IL-6, секретируемого vmAstros. Повышенная секреция IL-6 является показателем реактивности в астроцитах. Мы измерили уровни IL-6 с помощью иммуноферментного анализа после 24-часового лечения IL-1α, что подтвердило значительное и значительное увеличение секретируемого IL-6, тем самым подтвердив, что vmAstros демонстрируют реактивный фенотип (рис. 2L).

Рисунок 1: Дифференциация HiPSC в vmAstros. (A) Схематическое представление оптимизированного протокола для генерации vmAstros из hiPSC. Протокол состоит из отдельных этапов; Во-первых, невральная, вентральная судьба среднего мозга происходит за счет двойного ингибирования SMAD (с SB431542 и LDN193189) в сочетании с вентральными молекулами среднего мозга (SHH (C24ii) и CHIR99021). vmNPC быстро размножаются в отсутствие каких-либо экзогенных митогенов на стадии экспансии vmNPC. Добавление BDNF, GDNF и аскорбиновой кислоты способствует выживанию vmNPC, способствуя увеличению количества клеток. Добавление EGF и LIF поддерживает распространение и способствует приобретению астроглиальной судьбы в течение длительного периода культивирования. По прошествии не менее 90 дней после первоначального hiPSC vmAPC образуют зрелые vmAstros при воздействии BMP4. (Б-Ж) Изображения клеток такими, какими они должны быть на разных этапах в протоколе. Клетки hiPSCs и vmNPCs проходят в виде небольших кластеров, а не отдельных клеток (C). Масштабные линейки: B = 500 μм; С = 250 мкм; D & E = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
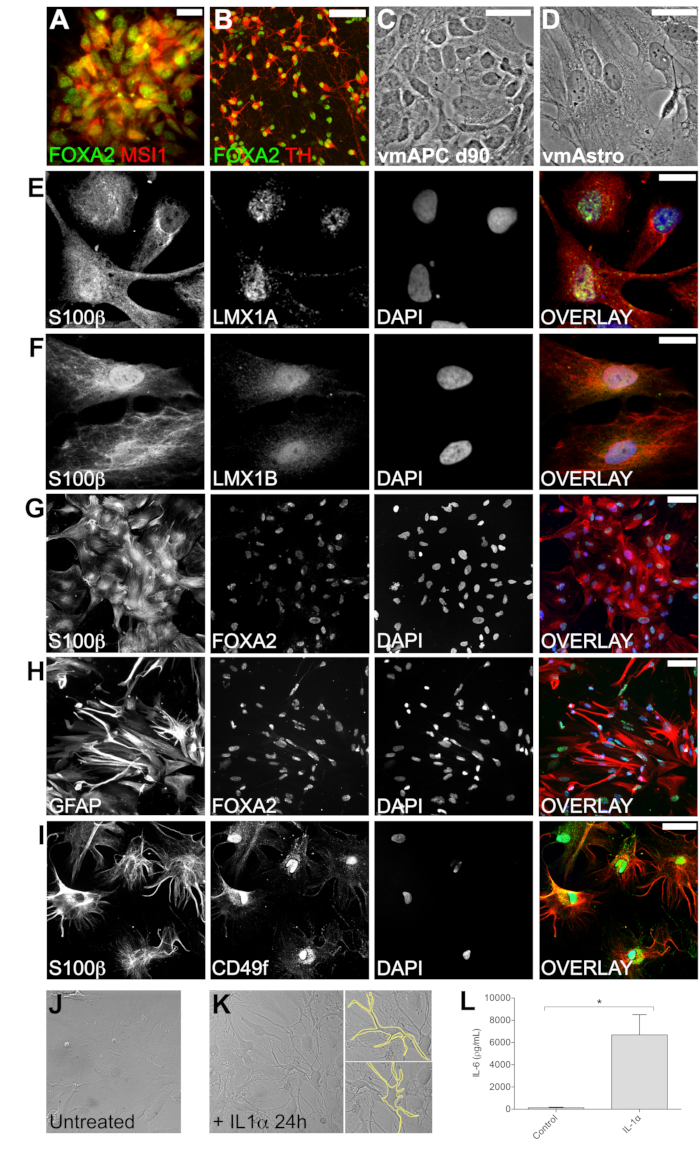
Рисунок 2: Характеристика фенотипа промежуточных клеток и vmAstros, сгенерированных с использованием описанного протокола, подтверждающая вентральную идентичность среднего мозга. (A) Иммуноцитохимия показала, что vmNPC экспрессируют нейральный маркер-предшественник MSI1 (красный) и вентральный фактор транскрипции среднего мозга FOXA2 (зеленый). (B) vmNPC способны генерировать дофаминовые нейроны среднего мозга, совместно экспрессирующие дофаминергический маркер тирозингидроксилазу (TH; красный) и вентральный фактор транскрипции среднего мозга FOXA2 (зеленый) (ранее опубликовано в30). (C) Фазово-контрастные изображения с большим увеличением показывают морфологию vmAPC по сравнению с (D) зрелыми vmAstros, которые имеют большую площадь от ядра до клеточной мембраны. Иммуноцитохимия продемонстрировала зрелые vmAstros ко-экспрессирующие астроцитарный маркер S100β и вентральные маркеры среднего мозга LMX1A (E), LMX1B (F) и FOXA2 (G). (H,I) vmAstros экспрессируют GFAP и CD49f, которые связаны со зрелым фенотипом астроцитов. (Дж,Л) Репрезентативные изображения, демонстрирующие морфологию необработанных культур vmAstros (J) по сравнению с теми, кто подвергался воздействию IL-1α в течение 24 ч (K). Воздействие IL-1α приводило к явным морфологическим изменениям (K). (L) В ответ на IL-1α vmAstros значительно увеличивал секрецию IL-6, что указывает на то, что vmAstros генерируют реактивный фенотип в ответ на нейровоспалительные стимулы (n = 3 независимых эксперимента, SEM, непарный t-критерий p = 0,0227). Все иммунофлуоресцентные изображения были получены на конфокальный микроскоп. Масштабные линейки: A, B, I = 50 μм; С, D = 100 мкм; E, F = 25 μм; G,H = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1. Реагентный препарат для дифференцировки ИПСК в вентральные астроциты среднего мозга (vmAstros) Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Этот метод получения vmAstros из hiPSCs является высокоэффективным, он позволяет получать чистые культуры vmAstros и может быть воспроизведен для получения vmAstros из различных линий hiPSC. Этот протокол был разработан на основе повторения событий развития, необходимых в эмбрионе для правильного моделирования развивающегося среднего мозга и генерации астроцитов, и включает в себя три определенных этапа: 1) нейронная вентральная индукция среднего мозга для генерации vmNPC, 2) генерация и расширение vmAPC и, наконец, 3) созревание vmAstros.
В нашей предыдущей опубликованной работе мы подчеркнули важность оптимизации концентраций CHIR99021 и SHH(C24ii) для каждой линии hiPSC, используемой для генерации vmNPC, чтобы обеспечить оптимальную экспрессию вентральных маркеров среднего мозга30,31; 200 нг/мл SHH (C24ii) и 0,8 мкМ CHIR99021 дает стабильно воспроизводимые результаты на нескольких линиях hiPSC. Тем не менее, 300 нг/мл SHH (C24ii) и 0,6 мкМ CHIR99021 могут быть более эффективными для определенных линий hiPSC, но также могут влиять на выживаемость клеток30,31. Поэтому рекомендуется оптимизация со стороны пользователя.
При разработке этого протокола для генерации vmAPC было очевидно, что плотность клеток имеет решающее значение на всех стадиях. На стадии индукции vmNPC плотность клеток должна оставаться высокой для поддержания клеточной выживаемости, так как плотность vmNPC ниже 75% приводит к гибели vmNPC в больших количествах. Скорость пролиферации vmNPC зависит от скорости пролиферации родительской культуры hiPSC и варьирует между линиями; однако для поддержания пролиферативной популяции плотность vmNPC должна оставаться высокой. Поэтому мы рекомендуем пропускать vmNPC в консервативном соотношении до тех пор, пока пользователь не оптимизирует режим передачи. Напротив, vmAPC следует пропускать в высоких соотношениях, достигая плотности клеток около 30-40% после пассирования, и пассировать, как только клетки сливаются. В наших предварительных экспериментах мы обнаружили, что поддержание vmAPC на очень высокой конфлюенции приводит к большей гетерогенности в результирующем vmAstros, на что указывает разнообразная морфология и экспрессия маркера астроцитов GFAP (данные не показаны). Микрофотографии соответствующей плотности клеток включены в этот протокол для справки.
Как vmNPC, так и vmAPC обладают высокой пролиферацией, генерируя большое количество клеток из относительно небольшой исходной популяции iPSCs. Например, мы обычно начинаем этот протокол с одной чашки ИПСК размером 10см2 , и когда мы достигаем 60-го дня, мы ожидаем, что АПК будут культивироваться в колбах размером 175см2 , при этом каждый проход будет генерировать 4-6 новых колб, и такая скорость расширения будет продолжаться до 90-го дня. Экстраполируя из этого, у нас будет как минимум возможность создать до 4000 колб с vmAPC. Мы криоконсервируем vmAPC в течение этого периода экспансии и, таким образом, можем создать большой криобанк клеток для будущего поколения зрелых vmAstro. Это чрезвычайно выгодно, поскольку позволяет проводить высокопроизводительный анализ, необходимый для таких приложений, как скрининг лекарственных средств.
Уникальным аспектом этого протокола является идентификация среднего мозга результирующего vmAstros. В головном мозге специфические регионарные астроглиальные популяции, подобно их нейронным аналогам, обладают специфическими характеристиками25,26. Основным направлением исследований болезни Паркинсона является участие астроглиальных клеток в нейровоспалении и то, как это влияет на прогрессирование заболевания. Нейровоспаление присутствует на ранних стадиях болезни Паркинсона и многих других сценариях травм или заболеваний12. В рамках нейровоспалительной реакции астроциты трансформируются в попытке защитить нейроны от повреждений — это называется «реактивным астроцитом». Тем не менее, реактивные астроциты сами по себе нейротоксичны при хронических заболеваниях, таких как болезньПаркинсона 9,11. В животных и in vitro моделях болезни Паркинсона реактивное астроглиально-опосредованное нейровоспаление является катализатором нейротоксической патологии α-синуклеина и нейродегенерации 9,14,41,42,43. Поэтому мы создали нейровоспалительную среду in vitro путем лечения vmAstros провоспалительными цитокинами IL-1α или IL-1β. В ответ на это vmAstros продемонстрировал значительные морфологические изменения, и мы увидели значительное увеличение секреции IL-6, который также повышен при болезни Паркинсона и широко используется в качестве меры реактивности астроцитов.
В заключение следует отметить, что этот протокол обеспечивает воспроизводимый и эффективный метод генерации большого количества vmAstro, полученных из hiPSC, которые демонстрируют фенотип, параллельный их аналогам in vivo в вентральном среднем мозге. Таким образом, этот протокол широко применим для высокопроизводительных приложений, таких как скрининг лекарственных препаратов, для которых требуется большое количество человеческих клеток. В недавних работах была подчеркнута роль нейровоспаления при болезни Паркинсона, а также то, как фармакологическое нацеливание на астроглию влияет на нейровоспаление, которое, в свою очередь, модулирует патологиюзаболевания. Как было продемонстрировано, vmAstros, сгенерированные с помощью этого протокола, адекватно реагируют на нейровоспалительную стимуляцию, обеспечивая всестороннюю клеточную модель для изучения астроглиального вовлечения в болезнь Паркинсона.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована за счет гранта на проект Паркинсона в Великобритании (G-1402) и стипендии. Авторы выражают благодарность Wolfson Bioimaging Facility за поддержку и помощь в этой работе.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.2M Tris-Cl (pH 8.5) | n/a | n/a | Made up from Tris base and plus HCl |
| 0.5M EDTA, PH 8 | ThermoFisher | 15575-020 | 1:1000 in D-PBS to 0.5 mM final |
| 1,4-diazabicylo[2.2.2]octane (DABCO) | Sigma | D27802- | 25 mg/mL in Mowiol mounting solution |
| 13 mm coverslips | VWR | 631-0149 | |
| 2-Mercaptoethanol (50 mM) | ThermoFisher | 31350010 | |
| Accutase | ThermoFisher | 13151014 | |
| Advanced DMEM/F12 | ThermoFisher | 12634010 | Has 1x NEAA but we add to final concentration of 2x (0.2 mM) |
| Ascorbic acid | Sigma | A5960 | 200 mM stock, 1:1000 to 200 µM final |
| B27 Supplement | ThermoFisher | 17504-044 | 50x stock |
| BSA | Sigma | 5470 | |
| Cell freezing media | Sigma | C2874 | Cryostor CS10 |
| Cell freezing vessel | Nalgene | 5100-0001 | |
| CHIR99021 | Axon Medchem | 1386 | 0.8 mM stock, 1:1000 dilution to 0.8 µM final |
| Cryovials | Sigma | CLS430487 | |
| DAPI | Sigma | D9542 | 1 mg/mL, 1:10,000 to 100ng/mL final (in PBS) |
| DMEM/F12 + Glutamax | ThermoFisher | 10565018 | |
| Dulbeccos-PBS (D-PBS without Mg or Ca) | ThermoFisher | 14190144 | pH 7.2 |
| E8 Flex medium kit | ThermoFisher | A2858501 | |
| Formaldehyde (36% solution) | Sigma | 47608 | |
| Geltrex | ThermoFisher | A1413302 | 1:100 or 1:400 in ice-cold DMEM/F12 |
| Glutamax | ThermoFisher | 35050038 | 2 mM stock (1:200 in N2B27, 1:100 in ASTRO media to 20 µM final) |
| Glycerol | Sigma | G5516 | |
| Human BDNF | Peprotech | 450-02 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human BMP4 | Peprotech | 120-05 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human EGF | Peprotech | AF-100-15 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human GDNF | Peprotech | 450-10 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| Human insulin solution | Sigma | I9278 | 10 mg/mL stock, 1:2000 to 5 µg/mL final |
| Human LIF | Peprotech | 300-05 | 20 µg/mL stock, 1:1000 to 20 ng/mL final |
| IL-6 ELISA kit | Biotechne | DY206 | |
| Isopropanol | Sigma | I9516-4L | For filling Mr Frosty cryostorage vessel |
| LDN193189 | Sigma | SML0559 | 100 µM stock, 1:10,000 dilution to 10 nM final |
| Mowiol 40-88 | Sigma | 324590 | |
| N2 Supplement | ThermoFisher | 17502048 | 100x stock |
| NEAA | ThermoFisher | 11140035 | 10 mM stock, 1:100 to 0.1 mM final |
| Neurobasal media | ThermoFisher | 21103049 | |
| Normal Goat serum | Vector Labs | S-1000-20 | |
| Revitacell | ThermoFisher | A2644501 | 100x stock, 1:100 to 1x final |
| SB431542 | Tocris | 1614 | 10 mM stock, 1:1000 dilution to 10 µM final |
| SHH-C24ii | Biotechne | 1845-SH-025 | 200 µg/mL stock, 1:1000 to 200 ng/mL final |
| Tris-HCl | Sigma | PHG0002 | |
| Triton-X | Sigma | X100 | |
| Tween-20 | Sigma | P7949 | |
| Vitronectin | ThermoFisher | A14700 | 1:50 in D-PBS |
| Antibodies for immunocytochemistry | Company | Catalogue Number | Host species |
| Antibody against S100b | Sigma | SAB4200671 | Mouse; 1:200 |
| Antibody against FOXA2 | SCBT | NB600501 | Mouse; 1:50 |
| Antibody against LMX1A | ProSci | 7087 | Rabbit; 1:300 |
| Antibody against LMX1A | Millipore | AB10533 | Rabbit; 1:2000 |
| Antibody against LMX1B | Proteintech | 18278-1-AP | Rabbit; 1:300 |
| Antibody against GLAST | Proteintech | 20785-1-AP | Rabbit; 1:300 |
| Antibody against GFAP | Dako | Z0334 | Rabbit; 1:400 |
| Antibody against CD49f | Proteintech | 27189-1-AP | Rabbit; 1:100 |
| Antibody against MSI1 | Abcam | ab52865 | Rabbit; 1:400 |
| Alexa Fluor 488 Goat Anti-Rabbit | ThermoFisher | A32731 | Goat; 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse | ThermoFisher | A32723 | Goat; 1:500 |
| Alexa Fluor 568 Goat Anti-Rabbit | ThermoFisher | A11036 | Goat; 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse | ThermoFisher | A11031 | Goat; 1:500 |
Ссылки
- Poewe, W., et al. Parkinson disease. Nature Reviews Disease Primers. 3, 17013 (2017).
- Lees, A. J., Hardy, J., Revesz, T. Parkingson's disease. Lancet. 373, 2055-2066 (2009).
- Braak, H., et al. Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of Aging. 24, 197-211 (2003).
- Booth, H. D. E., Hirst, W. D., Wade-Martins, R. The role of astrocyte dysfunction in Parkinson's disease pathogenesis. Trends in Neurosciences. 40, 358-370 (2017).
- Lindstrom, V., et al. Extensive uptake of alpha-synuclein oligomers in astrocytes results in sustained intracellular deposits and mitochondrial damage. Molecular and Cellular Neuroscience. 82, 143-156 (2017).
- Crompton, L. A., Cordero-Llana, O., Caldwell, M. A. Astrocytes in a dish: Using pluripotent stem cells to model neurodegenerative and neurodevelopmental disorders. Brain Pathology. 27, 530-544 (2017).
- di Domenico, A., et al. Patient-specific iPSC-derived astrocytes contribute to non-cell-autonomous neurodegeneration in Parkinson's disease. Stem Cell Reports. 12, 213-229 (2019).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: an underappreciated topic in neurobiology. Current Opinions in Neurobiology. 20, 588-594 (2010).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: production, function, and therapeutic Potential. Immunity. 46, 957-967 (2017).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24, 931-938 (2018).
- Stokholm, M. G., et al. Assessment of neuroinflammation in patients with idiopathic rapid-eye-movement sleep behaviour disorder: a case-control study. The Lancet Neurology. 16, 789-796 (2017).
- Williams-Gray, C. H., et al. Serum immune markers and disease progression in an incident Parkinson's disease cohort (ICICLE-PD). Movement Disorders. 31, 995-1003 (2016).
- Gelders, G., Baekelandt, V., Vander Perren, A. Linking neuroinflammation and neurodegeneration in Parkinson's disease. Journal of Immunology Research. 2018, 4784268 (2018).
- Hall, S., et al. Cerebrospinal fluid concentrations of inflammatory markers in Parkinson's disease and atypical parkinsonian disorders. Scientific Reports. 8, 13276 (2018).
- Zamanian, J. L., et al. Genomic analysis of reactive astrogliosis. Journal of Neuroscience. 32, 6391-6410 (2012).
- Clarke, B. E., et al. Human stem cell-derived astrocytes exhibit region-specific heterogeneity in their secretory profiles. Brain. 143 (10), 85 (2020).
- Sevenich, L. Brain-resident microglia and blood-borne macrophages orchestrate central nervous system inflammation in neurodegenerative disorders and brain cancer. Frontiers in Immunology. 9, 697 (2018).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer's disease not evident in mouse models. Cell Reports. 22, 832-847 (2018).
- Viti, J., Feathers, A., Phillips, J., Lillien, L. Epidermal growth factor receptors control competence to interpret leukemia inhibitory factor as an astrocyte inducer in developing cortex. Journal of Neuroscience. 23, 3385-3393 (2003).
- Nakashima, K., Yanagisawa, M., Arakawa, H., Taga, T. Astrocyte differentiation mediated by LIF in cooperation with BMP2. FEBS Letters. 457, 43-46 (1999).
- Serio, A., et al. Astrocyte pathology and the absence of non-cell autonomy in an induced pluripotent stem cell model of TDP-43 proteinopathy. Proceedings of the National Academy of Sciences of the United States of America. 110, 4697-4702 (2013).
- Gupta, K., et al. Human embryonic stem cell derived astrocytes mediate non-cell-autonomous neuroprotection through endogenous and drug-induced mechanisms. Cell Death and Differentiation. 19, 779-787 (2012).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 25 (2013).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29, 528-534 (2011).
- Xin, W., et al. Ventral midbrain astrocytes display unique physiological features and sensitivity to dopamine D2 receptor signaling. Neuropsychopharmacology. 44, 344-355 (2019).
- Devine, M. J., et al. Parkinson's disease induced pluripotent stem cells with triplication of the alpha-synuclein locus. Nature Communications. 2, 440 (2011).
- Chen, Y., et al. Engineering synucleinopathy-resistant human dopaminergic neurons by CRISPR-mediated deletion of the SNCA gene. European Journal of Neuroscience. 49, 510-524 (2019).
- Crompton, L. A., et al. non-adherent differentiation of human pluripotent stem cells to generate basal forebrain cholinergic neurons via hedgehog signaling. Stem Cell Research. 11, 1206-1221 (2013).
- Stathakos, P., et al. A monolayer hiPSC culture system for autophagy/mitophagy studies in human dopaminergic neurons. Autophagy. , 1-17 (2020).
- Stathakos, P., et al. Imaging autophagy in hiPSC-derived midbrain dopaminergic neuronal cultures for Parkinson's disease research. Methods in Molecular Biology. 1880, 257-280 (2019).
- Bilican, B., et al. Mutant induced pluripotent stem cell lines recapitulate aspects of TDP-43 proteinopathies and reveal cell-specific vulnerability. Proceedings of the National Academy of Sciences of the United States of America. 109, 5803-5808 (2012).
- Cordero-Llana, O., et al. Clusterin secreted by astrocytes enhances neuronal differentiation from human neural precursor cells. Cell Death and Differentiation. 18, 907-913 (2011).
- Morrow, T., Song, M. R., Ghosh, A. Sequential specification of neurons and glia by developmentally regulated extracellular factors. Development. 128, 3585-3594 (2001).
- Namihira, M., et al. Committed neuronal precursors confer astrocytic potential on residual neural precursor cells. Developmental Cell. 16, 245-255 (2009).
- Ochiai, W., Yanagisawa, M., Takizawa, T., Nakashima, K., Taga, T. Astrocyte differentiation of fetal neuroepithelial cells involving cardiotrophin-1-induced activation of STAT3. Cytokine. 14, 264-271 (2001).
- Nakashima, K., Yanagisawa, M., Arakawa, H. Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science. 284 (5413), 479-482 (1999).
- Nakashima, K., et al. Developmental requirement of gp130 signaling in neuronal survival and astrocyte differentiation. Journal of Neuroscience. 19, 5429-5434 (1999).
- Barbar, L., et al. CD49f is a novel marker of functional and reactive human iPSC-derived astrocytes. Neuron. 107, 436-453 (2020).
- Barbar, L., Rusielewicz, T., Zimmer, M., Kalpana, K., Fossati, V. Isolation of human CD49f(+) astrocytes and in vitro iPSC-based neurotoxicity assays. STAR Protocols. 1, 100-172 (2020).
- Gao, H. M., et al. Neuroinflammation and alpha-synuclein dysfunction potentiate each other, driving chronic progression of neurodegeneration in a mouse model of Parkinson's disease. Environmental Health Perspectives. 119, 807-814 (2011).
- Gao, H. M., et al. Neuroinflammation and oxidation/nitration of alpha-synuclein linked to dopaminergic neurodegeneration. Journal of Neuroscience. 28, 7687-7698 (2008).
- Horvath, I., et al. Co-aggregation of pro-inflammatory S100A9 with alpha-synuclein in Parkinson's disease: ex vivo and in vitro studies. Journal of Neuroinflammation. 15, 172 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены