Method Article
Schwann Hücre Fenotip Spesifikasyonunu Değerlendirmek Için Hücre Dışı Matriks Mikroortamlarının Hazırlanması
Bu Makalede
Özet
Bu metodoloji, substrat sertliği, protein bileşimi ve hücre morfolojisi gibi hücre dışı matris ipuçlarının Schwann hücresi (SC) fenotipini düzenleyen mekanizmalarını göstermeyi amaçlamaktadır.
Özet
Travmatik periferik sinir sistemi (PNS) yaralanmaları şu anda tam fonksiyonel iyileşme yitirmek için uygun tedaviler eksikliği. Schwann hücreleri (SCs), PNS önemli glial hücreleri olarak, yaralanma sonrasında bir rejeneratif hücre fenotip içine dedifferentiating tarafından PNS rejenerasyon teşvik hayati bir rol oynamaktadır. Ancak, SCs defarklılaştırılmış devlet rejenerasyon için gerekli zaman dilimi boyunca korumak için zor ve çevreleyen ekstrasellüler matris (ECM) değişikliklerden etkilenir. Bu nedenle, SC'lerin rejeneratif potansiyeline ilişkin ipuçları sağlamak için SC'ler ile farklı ECM arasındaki karmaşık etkileşimin belirlenmesi esastır. Bunu gidermek için, farklı ECM proteinlerinin sertlik ve protein bileşiminin modüle edilebildiği bir platform sağlayan, ölçülü polidimetilsiloksane (PDMS) substratına adsord edildikleri bir strateji oluşturuldu. SC'ler ölçülebilir yüzeylere tohumlanmış ve SC fenotipinin dinamiklerini temsil eden kritik hücresel fonksiyonlar ölçüldü. SC protein ekspresyonu ile hücresel morfoloji arasındaki etkileşimi göstermek için, bireysel mikrotemas baskılı hücresel desenlere ek olarak SC'lerin farklı tohumlama yoğunlukları kullanıldı ve immünfloresans boyama ve batı lekesi ile karakterize edildi. Sonuçlar, daha küçük yayılma alanı ve hücresel uzama daha yüksek ölçüde olan hücrelerin sc rejeneratif phenotipik belirteçleri daha yüksek düzeyde teşvik gösterdi. Bu metodoloji sadece ECM ve SCs hücresel fonksiyonu arasındaki önemli ilişkiyi çözmek için başlar, ama aynı zamanda periferik sinir onarım biyomalzemelerin gelecekteki optimizasyonu için kurallar sağlar.
Giriş
Periferik sinir sistemi (PNS) yaralanmaları hastalar için yaşam kalitesini tehlikeye atarak ve sosyoekonomik faktörlerin çok sayıda ile önemli bir etki yaratarak sağlık önemli bir klinik sorun olmaya devam etmektedir1,2. Schwann hücreleri (SC), PNS'deki başlıca glial hücreler olarak, PNS rejenerasyonuna neden olmak ve kısa boşluk yaralanmalarında fonksiyonel iyileşmelere yardımcı olmak için gerekli moleküler ve fiziksel ipuçlarını sağlar. Bunun nedeni, SC'lerin miyelinating veya Remak fenotip3'ten"onarım" hücre fenotipine ayrıştırma yeteneğine sahip olmasıdır. Onarım SC çeşitli şekillerde ayırt edici bir hücre fenotip. Yaralanmadan sonra, SC'ler hücre döngüsüne yeniden girerek çoğalma hızlarını artırır lar ve reinnervasyonu kolaylaştırmak için çeşitli transkripsiyonel faktörlerin ekspresyonuna başlarlar. C-Jun ve p75 NTR gibi bu faktörler, miyelin temel protein (MBP) gibi miyelinating SC belirteçleri, downregulated4,,5ise upregulated vardır. Buna ek olarak, SCs uzun olmak için morfolojideğiştirmek ve yaralanma site6genelinde Büngner bantları oluşturmak için birbirleri ile hizalanmış . Bu aksonlar için doğru distal hedef7genişletmek için fiziksel bir rehberlik mekanizması sağlar. Ancak, SCs kısa boşluk yaralanmalarında sinir rejenerasyonu teşvik etmek için sahip yeteneğine rağmen, fonksiyonel iyileşme sonucu ciddi yaralanmalarda kötü kalır. Bu kısmen ekstrasellüler matriks kaybı nedeniyle (ECM) rehberlik ipuçları, hem de uzun süreler boyunca rejeneratif fenotip korumak için SCs yetersizlik8.
Sinir rejenerasyon ve iyileşme süreci yakından yaralanma sonrasında bazal lamina durumuna bağlıdır. Bazal lamina rehberlik kolaylaştırır ve yaralanma9aşağıdaki bozulmadan kalır durumlarda akson ve SCs için ECM bağlı ipuçları sağlar sinir etrafında ECM bir tabakadır . ECM durumu ve hücrelere matris bağlı ipuçları sunmak için yeteneği hayati önem taşımaktadır ve daha önce farklı bağlamlarda çeşitli araştırılmıştır10,11,12,13,14. Örneğin, ECM sertliği gibi çoğalma ve farklılaşma11,,15,16gibi hücre fonksiyonları rehberlik göstermiştir. ECM bileşimi de farklı bir hücresel yanıt yol açabilir ve hücre içi sinyal yolları 17 ile göç ve farklılaşma gibi hücre davranışlarını düzenleyen17,18. Ayrıca, hücre morfolojisi, yayılma alanı ve hücresel uzama da dahil olmak üzere, fonksiyonudüzenleyen önemli bir rol oynamaktadır ve ECM bağlı ipuçları tarafından yönetilebilir19,20. Birçok önceki çalışmalarda kök hücrelerin tanımlanmış soylara farklıştırılması üzerinde duruldu, henüz SCs bir homeostatik fenotipi değiştirmek için benzer bir yeteneğe sahip, sağlıklı bir sinir içinde yetişkin SC, bir onarım SC protein ve büyüme faktörleri salgılama yeteneğine sahip ise Sinir yaralanması aşağıdaki ECM remodeling5,21. Bu nedenle, özellikle doğuştan Gelen SC rejeneratif kapasite ve ECM bağlı ipuçları arasındaki ilişkinin altında yatan mekanizmaları belirlemek için sonuçta sinir rejenerasyonu için bu kapasiteyi koşum içgörü için çok önemlidir.
Bu sorunu çözmek için, mekanik sertlik ve ligand tipinin fizyolojik olarak uygun aralıklarda kolayca ayarlanabildiği bir hücre kültürü alt katmanı üretmek için ayrıntılı bir metodoloji geliştirdik. Polidimethyl siloksan (PDMS) poliakrilamid jel ile karşılaştırıldığında son derece table mekaniği nedeniyle bir substrat olarak seçildi, maksimum Genç modülü yaklaşık 12 kPa yaklaşık 1000 kPa22,,,24PDMS tezat .23 Bu eldeki çalışma için yararlıdır, son çalışmalar bir tavşan siyatik sinir Young modülü göstermiştir gibi gelişme sırasında 50 kPa aşabilir, böylece PNS içinde sinirlerin sertlik aralığı daha önce incelenen daha geniş olduğunu düşündürmektedir. Farklı proteinler, mekanik ve ligandların SC davranışı nın kombinatoryal regülasyonlarını analiz etmek için PDMS yüzeyleri üzerine adsorpsiyon yapabilme yeteneğine sahiptir. Bu, PNS rejenerasyon sürecinde bulunan birden fazla mikroçevresel ipuçlarının araştırılmasına ve sadece25. Ayrıca, bu mühendislik hücre kültürü substratları immünohistokimya, batı lekeve kantitatif polimeraz zincir reaksiyonu (q-PCR) gibi çok sayıda kantitatif analiz yöntemi ile uyumludur.
Bu tasarlanmış hücre kültürü platformu, her ECM'ye bağlı sinyalin bireysel ayarı yüksek düzeyde nedeniyle mekanistik yolları analiz etmek için son derece uygundur. Buna ek olarak, mikrotemas baskı da dahil olmak üzere hücre mikrodesenleme için popüler yöntemler, diğer ECM bağlı ipuçları 24 ile ilgili olarak hücre şeklini analiz etmek için kontrollü hücresel yapışma sağlamak için yüzeyler üzerinde elde edilebilir24. Bu çok önemlidir, çünkü hücre popülasyonlarında uzamayı teşvik eden çizgi desenli yüzeyler, sinir rejenerasyonu sırasında Büngner bantları içindeki uzamış ve rejeneratif SC'leri taklit etmek ve incelemek için bir araç sağlar. Ayrıca, hücresel morfoloji birden fazla hücre fonksiyonlarının güçlü bir düzenleyici ve potansiyel olarak26,,27kontrollü değilse şaşırtıcı deneysel sonuçlar tanıtabilir. ECM ipuçları28,29,,30tarafından düzenlenen olarak SC rejeneratif fenotip yöneten mekanizmalar şimdi önemli dikkat sağlanmaktadır. Bu PNS sinir rejenerasyonu yardım için sinir rehberlik kanalları olarak uygulanabilir biyomalzemelerin tasarımı içine fikir sağlamak için gereklidir. Bu ayrıntılı protokoller sonuçta ECM bağlı ipuçları tarafından düzenlenen SC ve diğer hücre tipi fonksiyonunun mekanizmaları deşifre etmek için potansiyel bir araç olarak uygulanabilir.
Protokol
1. Tunable hücre kültürü substrat hazırlama ve karakterizasyonu
- Substrat hazırlama
- 10:1 ile 60:1 arasında bir oranda pipet ucu kullanarak PDMS baz elastomer ve kür ajanlarını karıştırın, kabarcıklar karışım içinde homojen bir şekilde dağılına kadar. Kabarcıklar dağılına kadar vakum desiccation kullanarak kabarcıklar kaldırın.
NOT: PDMS polimerizasyonu sırasında, son polimer istenilen mekanik özellikleri sağlamak için baz elastomer ile kür ajan çapraz bağlantılar. Çapraz bağlantı oranları, PDMS sertliğini değiştirmek için ayarlanabilir. - Bir kare veya dairesel kapak lı (örneğin, 22 mm x 22 mm) üzerine kurutulmuş PDMS karışımıbir damla (~0,2 mL) yerleştirin ve 30 s için 2500 rpm bir spin coater üzerinde coverslip döndürün.
- PDMS'nin katılaması için kapak kaymasını 60 °C'de 1-2 saat veya oda sıcaklığında bir gecede kuluçkaya yatırın.
- Yüzey hidrofililiğini artırmak için 7 dk (UV dalga boyu: 185 nm ve 254 nm) uv-ozon temizleyici kullanarak coverslip'i tedavi edin. Sterilize edilmiş 6 kuyulu bir tabağa koyun.
- Hücre kültürü için kullanmadan önce, en az 30 dakika boyunca% 70 etanol inkübasyon yüzeyler.
DİkKAT: UV-Ozon temizleyici insanlar için zararlı ozon üretebilir. Kimyasal bir duman kaputunda veya bir çeşit havalandırma ile çalışın. - 37 °C'de steril bir kuluçka makinesinde 60 dakika boyunca protein çözeltisine (10 μg/mL kollajen I, fibronektin veya laminin) kapak lar batırın.
NOT: UV-Ozon tedavisi nin ardından PDMS yüzeyi hala hidrofobik olabilir. Her coverslip protein çözeltisi ile kaplı olduğundan emin olmak için kuyu plakası döndürün. - Protein çözeltisini aspire edin ve kapak kaymasını fosfat tamponlu salin (PBS) 3x ile yıkayın.
- RT4-D6P2T Schwann hücre hattını (SCs) ticari olarak kullanılabilir EDTA çözeltisi (1x) kullanarak %2,5 tripsin içeren çanak geçişinden uzaklaştırın ve hemositometreli hücreleri sayın. İstenilen hücre yoğunluğunda taşınabilir PDMS yüzeyinde tohum C'leri. SC tohumlama yoğunlukları her farklı uygulama için değişebilir.
- Deney boyunca hücreleri istenilen hücre kültürü parametrelerinde (%90 nem, %5 CO2,37 °C, vb.) koruyun. Hücre kültürü aracı olarak %10 fetal sığır serumu (FBS) ve %1 penisilin-streptomisin ile desteklenen Dulbecco'nun Modifiye Kartal Orta (DMEM) kullanın.
- 10:1 ile 60:1 arasında bir oranda pipet ucu kullanarak PDMS baz elastomer ve kür ajanlarını karıştırın, kabarcıklar karışım içinde homojen bir şekilde dağılına kadar. Kabarcıklar dağılına kadar vakum desiccation kullanarak kabarcıklar kaldırın.
- Mikro desenli substrat hazırlama
- Bilgisayar destekli tasarım (CAD) yazılımı kullanarak istenilen geometri ve hücre yapıştırıcı alanlarını (900 μm2, 1600 μm2 ve 2.500 m2)çizin. Ticari bir tedarikçinin bu desenlerini temel alan bir krom fotoğraf maskesi oluşturun.
- Temiz bir odada veya tozsuz bir ortamda, silikon gofret ler imal etmek için standart fotolitografi tekniklerini kullanın (protokoller başka bir yerdeayrıntılı 31). Bu özel uygulama için kritik parametreler şunlardır: Photoresist: SU-8 2010; Fotodirenç dağıtmak için spin profili: 100 rpm/s ivme ile 10 s için 500 rpm, sonra 30 0 s için 3500 rpm 300 rpm/s ivme ile; UV ışığının pozlama enerjisi: 130 mJ/cm2.
NOT: Silikon gofretlerin desen yüksekliği bu parametreleri takip ederek yaklaşık 10 μm'dir. Dikdörtgen veya üçgen desenler dışında kenar çevresinde potansiyel çatlaklar adım 1.2.2 sonra bir ışık mikroskop kullanılarak görülebilir. 30 dk için 190 °C'de silikon gofret pişirme çatlaklar ortadan kaldırmak için yardımcı olur. - Desenli silikon gofreti dairesel 150 mm çapında x 15 mm yüksekliğindepetri kabın içine yerleştirin ve 1.1.1 adımda hazırlanan gazsız PDMS'yi (karıştırma oranı 10:1) silikon gofrete dökün.
NOT: Mikrotemas baskı basamaklarında kullanım kolaylığı için PDMS kalınlığının en az 5 mm olduğundan emin olun. - PDMS'yi bir gecede 60 °C'de bir fırında silikon gofret üzerinde katılatın. PDMS'nin oda sıcaklığına kadar soğumasını bekleyin. Cerrahi bir neşter kullanarak silikon gofretten doğru desenleri içeren 30 mm x 30 mm karelik pulları kesin olarak kesin olarak kesin. Silikon gofrete zarar vermez.
NOT: Silikon gofret izopropanol ile temizlik sonrasında daha fazla pul üretmek için bu noktada birçok kez yeniden kullanılabilir. - PDMS pulları ve table kapakları (adım 1.1.1 ila 1.1.3 olarak hazırlanır) 30 dakika boyunca %70 etanol içine daldırarak sterilize edin.
- Mikrotemas baskıdan sonra PDMS pulları ile mikrodesenin etkinliğini doğrulamak için, PDMS pullarının yüzeyini filtrelenmiş hava akımı ve pipet 50 g/mL BSA (Texas Red konjuge) çözeltisi kullanarak PDMS damgasının tüm desenli tarafını kapsayacak şekilde kurulayın.
- Protein adsorpsiyonuna izin vermek için oda sıcaklığında 1 saat bsa çözeltisi ile inkübate PDMS pulları.
- Filtrelenmiş bir hava akımı kullanarak tunable kapakların yüzeyini kurutun, 1.1.5 adımda açıklandığı gibi yüzey hidrofililiğini artırın.
- Kalan BSA çözeltisini çıkarmak için PDMS pullarını hava kurutun.
NOT: Kalan herhangi bir çözüm mikrotemas baskı sırasında pulların kapak kaymasına neden olacağından BSA çözeltisinin puldan tamamen çıkarılmasına dikkat edin. - Pulun desenli tarafını, kapak yüzeyindeki BSA adsorpsiyon için çekileme kapak lı ile temas halinde getirin. Pulu kapağına doğru hafifçe 5 dakika bastırın.
NOT: Pul büküleceği ve pul ile kapak fişi arasında spesifik olmayan temaslara neden olacağı için damgaya aşırı güç uygulamayın. Başarılı mikrotemas baskısı için damgaya uygulanan uygun kuvvet miktarı esastır. - Bir FITC (Floresan izotiyosiyanat) filtre ile floresan mikroskobu kullanarak mikro patern inceleyin.
- Floresan desenler yerine hücre yapışkan alanları yazdırmak için, BSA proteini yerine laminin ve adım 1.2.5-1.2.10 tekrarlayın.
- Kapakları pulları çıkarın, kapakları sterilize edilmiş 6 kuyulu bir tabağa aktarın. Kapak kaymayüzeyini kapsayacak şekilde her kuyuya %0,2 w/v Pluronic F-127 çözeltisi 2 mL ekleyin ve oda sıcaklığında 1 saat kuluçkaya yatırın.
NOT: Pluronik F-127, PDMS yüzeyinin hidrofobikliğini artırarak pdms yüzeyine yapışarak hücrelerin yapışmasını engelleyebilir. - Aspir pluronic F-127 çözeltisi ve tohumlama hücreleri önce PBS ve 1x hücre kültürü orta ile 5x yıkayın. SC'ler için tipik bir tohumlama yoğunluğu 1.000 hücre/cm2'dir.
- Hücre tohumlamayı takip eden 45 dk, hücre kültürü ortamını çıkarın ve birden fazla SC'nin aynı modele yapışmasını önlemek için kapakları PBS 2x ile yıkayın. Hücreleri nicelemeden önce istenilen hücre kültürü ortamında 48 saat boyunca koruyun.
- Hizalanmış hücreleri incelemek için satır desenli hücre kültürü yüzeyleri oluşturmak için, mikrotemas yazdırma için puloluşturmak için adım 1.2.1 ile 1.2.4'u izleyin.
NOT: Damga üzerindeki çizgili desenlerin oluk/çıkıntı boyutları, özetlenen hücreler için 50 μm x 50 m'dir. Pulun toplam boyutları 10 mm x 10 mm'dir. - Pulları yalnızca istenen çizgi desenlerini içeren boyutlara kesin.
NOT: CAD'de pul oluştururken, pulun çizgi desenleri etrafındaki desensiz alanı, mikrotemas baskısını takiben hücre yapışkan alanına karşılık gelir. Bu nedenle, yüzeyde tohumlanmış her SC desenleri takip sağlamak için damga keserken desensiz alanları ortadan kaldırmak için gereklidir. - İki Petri kabını tunable PDMS yüzey kaplaması hazırlamak için adım 1.1.1'den 1.1.3'e kadar izleyin.
NOT: Bu pdms Petri çanak yüzey kendisi kapsayan olacak ve bir coverslip üzerinde değil. - PDMS kaplamalı Petri kaplanmış tabaklardan birinde çizgi desenli hücre yapıştırıcı alanlarını yazdırmak için mikro temaslı baskı yapmak için adım 1.2.5 ile 1.2.10'u izleyin.
NOT: 60 mm x 15 mm Petri kabının yüzey alanı, 6 PDMS puldan çizgi desenli alanlar içerebilir. - Pulları çıkarın ve Petri kabını 4 mL %0,2 w/v Pluronic F-127 çözeltisi ile doldurun ve 1 saat kuluçkaya yatırın.
- Mikrotemas baskıdan sonra PDMS pullarının her iki tarafını %70 etanol 3x ile durulayın ve havayla kurulayın. PDMS pullarını döndürün ve ikinci Petri kabındaki damganın desensiz tarafını kullanarak desensiz hücre yapışkanalanını yazdırmak için 1.2.5 ila 1.2.10 adımını izleyin. Adımı 1.2.13'ün tekrarlayın.
- Yemeklerden F-127 çözeltisi aspirat, PBS ile 3x yıkayın ve ardından taze hücre kültürü ortamı kullanılarak 1x yıkama. Yemeklerde Tohum SC'leri.
NOT: Bir çizgi desenli çanak için tohumlama yoğunluğu 5.000 hücre/cm2 ve desensiz bir çanak için 10.000 hücre/cm2'dir. - 48 saat için istenilen koşullarda SC'leri koruyun ve SC lysates32hazırlamak için protokolleri izleyin.
NOT: Desensiz yemekler için hücre tohumlama yoğunluğu, çizgi desenli yemekler için olduğundan 2 kat daha yüksektir, çünkü çizgi desenli çanak desensiz yemeğin hücre yapışkan alanının sadece yarısına sahiptir.- Lysates hazırlamak için, yeterli radyoimmünopalan atayma (RIPA) tamponu 10 mL konik santrifüj tüpüne aktarın. Seyreltik proteaz ve fosfataz inhibitörü (100x) RIPA tampon 1:100 oranında, pipetleme ile iyice karıştırın.
- Hücreleri 2 dakika boyunca buz gibi PBS (1x) ile yıkayın, 1.2.23.1 adımdan hazırlanan çözeltinin 80 μL'sini petri kaplarına her hücre yapıştırıcı alanına (PDMS pulları ve adsordi proteinle temas eden alan) ekleyin. 15 dakika boyunca bir buz bloğu üzerinde çözelti ile hücreleri kuluçka.
NOT: Çözüm sadece pluronic F-127 adsorpsiyonunun başka bir yerde hidrofobikliği nedeniyle hücre yapıştırıcı alanında kalacaktır. Bu özellik, çizgi desenli SC'ler için başarılı ve yeterli protein ekstraksiyonu sağlar. - 5 dk. Etiketli 1,5 mL mikrosantrifüj tüp içine lysate toplamak için bir hücre kazıyıcı ile SCs kazıyın.
- Mikrocentrifuge lysate 12, 000 x g için 15 dk 4 °C'de. 1.000 μL pipet ile supernatant toplayın ve temiz bir mikrosantrifüj tüp aktarın. Hücre lisatlarını -20 °C'de saklayın.
- Substrat karakterizasyonu
NOT: Kapak üzerindeki polimer mekaniğini karakterize etmek için, genellikle toplu sıkıştırma testi11,33 veya atomik kuvvet mikroskobu testi34dahil olmak üzere birden fazla yöntem kullanılmaktadır. Bu protokol toplu sıkıştırma testini anahatlayacaktır.- İstenilen karıştırma oranının (adım 1.1) PDMS öncüsünü 30 mm'lik petri kabına dökün ve Petri kabıiçindeki PDMS tabakasının kalınlığının en az 20 mm olduğundan emin olun.
- Petri kabını 60 °C'lik fırından 1 saat sonra katılaşmış PDMS ile çıkarın ve oda sıcaklığında soğumaya bırakın. 10 mm x 10 mm kareler halinde kesilmiş polimer. Kaliperler kullanarak PDMS kalınlığını ölçün.
- SıKıŞTıRMA kuvveti ölçüm makinesinin sahnesine PDMS yerleştirin. Sensör bağlantı noktasına sıkıştırma kuvveti sensörünü (model: 112C) takın ve sensörü test makinesinin eksenine sabitle.
- Sensörün yüksekliğini, göstergenin ön panelinde "jog" denetimini kullanarak PDMS damgasının yaklaşık 0,5 cm yukarısına ayarlayın.
- İlişkili yazılımı "Test Kurulumu" penceresini kullanarak açın, "Servo profiliniseçin " ve "Segment" penceresini açın. "Segment" penceresinde, test için "Kontrol Oranı" ve "Bitiş Tutarı" istenir.
NOT: Kontrol hızı sensörün PDMS'ye doğru ilerleme hızını belirler. Bitiş miktarı sensörün kat gittiği toplam mesafeyi belirler. - Bu noktadaki tüm ölçümleri sıfırlamak için yazılımın kontrol panelinde bulunan "Z" düğmesini kullanın.
- Sensörü, 1-2 newton (N) yüklenene kadar PDMS'ye hafifçe temas ettirin. Sensörün yüklenmesi ve kat ettiği mesafe yazılımda görüntülenir.
- "Z" düğmesini kullandıktan sonra , "Play" kullanarak ölçüm çalıştırın ve dosya kayıt kuvvetini ve mesafeyi kaydedin.
- PDMS'nin her deneysel durumu için 1,3.3 ile 1.3.8 adımlarını tekrarlayın.
- Dosyayı açın ve her oran için Genç modülü (E) PDMS hesaplamak için aşağıdaki formülü kullanın. (F = sıkıştırma kuvveti, A = PDMS damgasının alanı, •L = sensörün seyahat mesafesi ve L0 = PDMS damgasının orijinal kalınlığı).

2. Hücresel özelliklerin tunable substratlar üzerinde ölçülmesi
- Proliferasyon tsay
- 6 kuyulu bir plakada 5.000 hücre/cm2 yoğunlukta 1.1.9 adımdan hazırlanan yüzeylerdeki tohum SC'leri. SC'lerin standart hücre kültürü koşullarında (37 °C ve %5 CO2)48 saat kuluçkaya yatmasını bekleyin.
- Seyreltik 10 mM Bromodeoxyuridine (BrdU) stok çözeltisi 12 mL içine 37 °C hücre kültürü orta, 10 μM BrdU etiketleme çözeltisi yapmak için pipet ile iyice karıştırın.
- Hücre kültürünü orta çıkarın ve SCs 2x PBS ile yıkayın.
- Her kuyuya 2 mL BrdU etiketleme çözeltisi ekleyin ve 2 saat boyunca SC'leri kuluçkaya yatırın.
NOT: BrdU etiketleme çözeltisinin kuluçka süresi belirli hücre çoğalma hızına bağlıdır. RT4-D6P2T SC hattı yüksek çoğalma oranına sahiptir, bu nedenle kuluçka süresi 2 saat kullanılmıştır. - BrdU etiketleme çözeltisi çıkarın ve SCs 3x'i PBS ile yıkayın. Her kuyuya PBS'de %3,7 formaldehit 1 mL ekleyin ve hücre fiksasyonu için 15 dakika oda sıcaklığında kuluçkaya yatırın.
DİkKAT: Formaldehit bir insan karsinojendir; bu nedenle, uygun koruma ile bir kimyasal duman başlık içinde tüm çalışmaları yürütmek.
NOT: PBS ile yıkanırken kuyuda hücre kültürü ortamı yoktur ve bu nedenle PDMS yüzeyi hidrofobik olabilir. Hücre hasarını önlemek için substrat yüzeyini tamamen kurutmamak için önlem alın. - Aspire formaldehit çözeltisi ve PBS (her 3 dk) ile 3x yıkayın. PBS'yi çıkarın ve hücre zarını permeabilize etmek için pbs'ye %0,2 Triton X-100 ilave edin. Oda sıcaklığında 20 dakika triton X-100 çözeltisi ile tüp lütfed.
- Triton X-100 çözeltisini çıkarın ve SC'leri 3x PBS ile yıkayın (her biri 3 dk).
- Her kuyuya 1 mL 1 N HCl ekleyin ve 10 dk buz üzerinde kuluçkaya yatırın. 1 N HCl çıkarın ve her kuyuya 1 mL 2 N HCl ekleyin ve 10 dk. HCl tedavisi için oda sıcaklığında kuluçkaya yatırın DNA hidrolizi içindir.
- 182 mL 0,2 mM Na2HPO4 ve 18 mL 0,1 mM sitrik asit karıştırarak antijen alımı için fosfat/sitrik asit tamponu üretin. 2 N HCl çıkarın ve her kuyuya 1 mL fosfat/sitrik asit tamponu ekleyin ve 10 dakika oda sıcaklığında kuluçkaya yatırın.
- SC'leri PBS'de %0,2 Triton X-100 ile yıkayın. Her kuyuya PBS'de %3'lük büyükbaş serum albumini (BSA) ekleyin ve 30 dakika oda sıcaklığında antikora nonspesifik bağlanmasıiçin kuluçkaya yatırın.
- Seyreltik BrdU primer antikor, BrdU boyama çözeltisi için 1:300 oranında %3 BSA çözeltisinde Alexa Fluor 488 ile konjuge edilmiştir. Plaka alüminyum folyo ile kaplı iken oda sıcaklığında bir gecede boyama çözeltisi ile tüplü CS.
- Proliferasyonu ölçmek için, sırasıyla BrdU ve çekirdekleri algılamak için bir floresan mikroskobunun FITC ve DAPI kanalını kullanan görüntü SC'leri. Görüntüleri "nd.2" dosyaları olarak kaydedin.
- Aynı mekansal konumlarda çekilen her görüntü için "nd.2" dosyalarını açın.
- Görüntü analizi yazılımını açın. " AnalizKontrolü" bölümündeki "Otomatik Ölçüm Sonuçları" ve " OtomatikÖlçüm" penceresini açmak için arka plana sağ tıklayın.
- "Count & Taksonomi" menüsünde "Count" seçeneğini belirleyin. FITC resminde, yeşil floresangösteren her çekirdeğe (BrdU pozitif) ve resmin üzerine sağ tıklayın.
NOT: BrdU pozitif hücrelerin sayısı "Otomasyonlar ve Ölçümler" penceresinde gösterilmiştir. - DAPI görüntüleri için, toplam çekirdek sayısını saymak için adım 2.1.14'ü yineleyin. Bu görüntü için BrdU pozitif hücrelerinin yüzdesini hesaplayın.
- 2.1.13 adımını istatistiksel amaçlarla diğer görüntüler için 2.1.13'e kadar tekrarlayın ve her substrat koşulu için BrdU pozitif hücrelerin ortalama yüzdesini hesaplayın.
- Immünofloresan görüntü analizi ile c-Jun ekspresyonunun sayısallaştırılması
- 1.1.9 ve 1.2.23 basamaklarından 6 kuyulu plakalar içinde hazırlanan hücreler daha önce açıklanan prosedürlerle sabit ve permeabilize edilir (adım 2.1.5-2.1.7).
NOT: Farklı ECM koşullarına sahip hücreler arasında floresan yoğunluğunun doğru karşılaştırmalarını gerçekleştirmek için, aynı parametrelere sahip tüm örneklerle kamera ayarlarını tüm numunelere aynı şekilde uygulayın. - Görüntüleri ".nd2" dosyaları olarak kaydedin.
- Görüntü analizi yazılımını açın. "Otomatik Ölçüm Sonuçları" ve "Otomatik Ölçüm" penceresiniAnalysis Controlaçmak için arka plana sağ tıklayın.
- "Otomatik Ölçüm Sonuçları" nda "Nesne Verileri" seçeneğini belirleyin. "Keep upup measurement" düğmesini etkinleştirin.
- Yazılımın üst panelinde "Ölçü" ve ardından "Object özellikleri" seçeneğini belirleyin. " Ölçü için Seçilen" bölümüne " OrtalamaYoğunluk" ekleyin.
- C-Jun ve çekirdeklerin görüntülerini içeren iki "nd2" resim dosyalarını açın ve birleştirin.
- Üst panelde "ROI" seçeneğini seçin ve "Dikdörtgen Yatırım Getirisi Çiz" seçeneğini belirleyin. Tek bir hücrenin nükleer alanını içeren dikdörtgen bir alan çizin.
NOT: c-Jun ifadesi çekirdekler içinde yoğunlaşmıştır35. - Yazılımın üst panelinde "İkili" ve "Eşik Tanımla" seçeneğini seçin, c-Jun floresan alanını tam olarak tanımlayan yeni bir pencere görünür.
- Yeni pencerede, programı tam görüntü modelinden YG modeline geçmek için "Tam Resim/Kullanım Yatırım Getirisi" seçeneğini tıklayın. Dikdörtgen Yatırım Getirisi içinde vurgulanan alanın boyutunun/şeklinin ayarlanması için pencerenin sol tarafında bulunan arama tablosunu ayarlamak için "Yoğunluk" kullanın.
NOT: Vurgulanan alanın boyutunun/şeklinin çekirdekle aynı olduğundan emin olun. - "Otomatik Ölçüm Sonuçları" penceresinde ortalama FITC yoğunluğunu elde etmek için "Tamam" düğmesine tıklayın ve ardından "Verileri Depola"'ı tıklatın.
- Penceresinde "Otomatik Ölçüm", "Nesne Sil" kırmızı vurgulu alanı kaldırmak için. Sol taraftaki panelde, dikdörtgen YG'yi seçmek ve silmek için "İşaretLeme Aracı" kullanın.
- Her ek hücre için ortalama FITC yoğunluğunu ölçmek için adım 2.2.6 ile 2.2.11'i tekrarlayın.
- "Otomatik Ölçüm Sonuçları" penceresinde "Depolanan"seçeneğini belirleyin ve depolanan tüm veriler sunulacaktır. Dışa aktarılan elektronik tabloyu kaydetmek ve ek hesaplamalar gerçekleştirmek için "Dışaaktar " işlevini kullanın ve "Excel'e Veri" seçeneğini belirleyin.
- 1.1.9 ve 1.2.23 basamaklarından 6 kuyulu plakalar içinde hazırlanan hücreler daha önce açıklanan prosedürlerle sabit ve permeabilize edilir (adım 2.1.5-2.1.7).
- Nükleer uzamanın ölçülmesi
- 2.1.5-2.1.7 adımlarını takiben 1.2.22 adımdan hazırlanan SC'leri düzeltin ve geçirin. DAPI ile montaj ortamı kullanarak nükleer boyama gerçekleştirin.
- DAPI kanalını ve 40x objektif lensi kullanarak, örneğin görüntülerini edinin ve ".nd2" dosyaları olarak kaydedin.
- Görüntü analiz yazılımında "Otomatik Ölçüm Sonuçları" ve " OtomatikÖlçüm" penceresini açmak için adım 2.2.3 ve 2.2.4'nü takip edin.
- "Otomatik Ölçüm Sonuçları"nda , "Option" işlevini ve ardından "Nesne Özelliğini Seç" işlevini kullanın. "Özellik" sütununda "Uzama" ve "Ölçümler için Seçilmiş" sütununa ekleyin. Bu işlevi etkinleştirmek için "Keep Updating Measurement" kullanın.
- Nükleer görüntüleri içeren "nd.2" resim dosyasını açın. "Otomatik Ölçüm" penceresinde , "Otomatik Algılama" işlevini seçin ve bir çekirdek seçin. Resme sağ tıkla ve ölçülen nükleer en boy oranı "Otomatik Ölçüm Sonuçları" bölümünde gösterilecektir.
- Görüntüdeki diğer çekirdekler için nükleer en boy oranlarını ölçmek için adım 2.3.5'i tekrarlayın. "Otomatik Ölçüm Sonuçları" penceresinde " VerileriDepola" seçeneğini belirleyin.
- Ek görüntüler için 2,3,5 ile 2,3,6 arası tekrarlayın. Verileri daha önce çözümleme için 2.2.13'te yapılan bir elektronik tablo dosyasına dışa aktarın.
- Protein ekspresyonunu ölçmek için batı lekesi
- Batı leke analizi için standart protokolleri izleyin başka bir yerde ayrıntılı32. Çalışmada kullanılan antikorların seyreltmeleri aşağıda gösterilmiştir: Tavşan anti c-Jun 1:2,000; Fare anti β-actin 1:1,000; Tavşan anti p75NTR 1:1,000; Tavşan anti miyelin temel protein 1:1,000; Anti-fare/tavşan IgG, HRP'ye bağlı antikor 1:10,000.
Sonuçlar
SC fenotipüzerinde substrat sertliği ile protein bileşimi arasındaki etkileşimi analiz etmek ve ölçmek için, bir pdms hücre kültürü alt tabakası geliştirilmiştir(Şekil 1A). Polimerin farklı tabanda sıkıştırma testi: genç modülünün (E) substratını ölçmek için kür ajan oranları kullanılmıştır(Şekil 1B). Ortaya çıkan modül değerleri fizyolojik olarak ilgili substrat koşullarını temsil eder. Substratların hazırlanmasından sonra, SC'ler kültürlü ve hücresel özellikler, mikro ortamda analiz edildi. Farklı protein bileşiminin substratlarında SC'lerin proliferasyon oranları ilk olarak analiz edildi. Lamina kaplı substratlar kollajen I ve fibronektin adsorpsiyon10 μg/mL(Şekil 2A,B)ile karşılaştırıldığında daha yüksek bir proliferasyon oranı ile sonuçlandı. Laminin kaplamalı ve farklı modüler li yüzeylerdeki SC'ler, nispeten daha yumuşak yüzeylerin (E=3.85kPa) tüm koşullarda hücre çoğalma oranlarını azalttığını göstermiştir(Şekil 2C,D). Ancak, sert substratlar (E=1119kPa) ile nispeten yumuşak substratlar (E=8.67kPa) arasındaki farklar önemsizdi(Şekil 2D).
SC'ler ayrıca immünohistokimya ve batı blot yoluyla protein ekspresyonu açısından analiz edildi. Transkripsiyonel faktör c-Jun düzeyleri immünfloresan mikroskopi(Şekil 3A)ile analiz edildi ve ortalama piksel floresan yoğunluğu ile temsil edildi (Şekil 3B-D). c-Jun ekspresyonu, substratlar daha yumuşak hale geldikçe (E=1119 kPa - E=8.67 kPa) yükseltildi, ancak yumuşak substratlarda (E=3.85 kPa), c-Jun ekspresyonu önemli ölçüde azaldı. Sert yüzeylerde (E=1119 kPa), kollajen I kaplı yüzeyler en yüksek c-Jun ifadesi ile sonuçlanır, ancak substratlar daha yumuşak hale geldikçe (E=8.67 kPa ve 3.85 kPa), laminin en yüksek c-Jun düzeylerini göstermiştir (Şekil 3E). Batı lekede ayrıca c-Jun ve miyelin temel protein (MBP) ile c-Jun düzeyleri upregulated ve MBP daha yumuşak yüzeylerde downregulated analiz etmek için kullanılmıştır(Şekil 3F). Ayrıca, lamina kaplı yüzeylerde tohumlu SC'ler kollajen I ve fibronektin ile karşılaştırıldığında en yüksek c-Jun ekspresyonu ile sonuçlandı.
Farklı tohumlama yoğunluklarına sahip hücreler daha sonra kültürlenmiş ve c-Jun ekspresyonunda hücre yayılımı ve alan rolünü araştırmak için rhodamine-phalloidin ile boyanmıştır(Şekil 4A,B). Hücrelerin nükleer uzamasını kontrol etmek için hücre kültürü alt tabakalarında hücre yapışkan çizgileri oluşturmak için ortak bir mikrodesenleme tekniği (mikrotemas baskı36)kullanılmıştır. Bir çizgi desenli substrat üzerinde tohumlanmış hücrelerin nükleer boy oranı, desensiz yüzeylerüzerinde tohumlanmış hücrelerden önemli ölçüde daha yüksek olarak gösterilmiştir(Şekil 4C,D). SC rejeneratif fenotiplerde önemli olan c-Jun ve başka bir belirteç ekspresyonunun p75 nörotrofin reseptörü (p75 NTR), daha küçük yayılma alanına sahip yoğun hücrelerde düzenlendiği saptandı(Şekil 4E). Çizgi desenli hücreler de desensiz hücrelere kıyasla hem c-Jun hem de p75 NTR'nin daha yüksek bir ekspresyonu ile sonuçlanmıştır(Şekil 4F). Bu nedenle, hücre-hücre etkileşimlerini ortadan kaldırırken hücre yayılma alanını ve uzamasını tam olarak kontrol etmek için mikrotemas baskılı hücre yapıştırıcı geometrileri oluşturulmuştur(Şekil 5A). Toplam hücre yapışkanlı alanların boyutları 900 μm2, 1.600 μm2ve 2.500 μm2 olup en boy oranı 1 veya 4 (hücre uzunluğu: hücre genişliği) idi. Floresan büyükbaş serum albumin (fBSA, Texas kırmızısı) boyama mikrotemas baskı sonra hücre kültürü substrat mikrodesenler durumunu ortaya çıkarmak için kullanılmıştır(Şekil 5B). Her hücre alanı için SC'lerin nükleer en boy oranı ölçüldü ve nükleer en boy oranı artırılarak hücresel uzamanın arttığı gösterilmiştir(Şekil 5C). Buna ek olarak, SC en boy oranı arttıkça, c-Jun upregulated oldu (Şekil 5D). İlginçtir ki, ancak, hücre yayma alanı arttıkça c-Jun ekspresyonu indirgenmiş olarak bulunmuştur (Şekil 5E). Hem çekirdekler hem de aktin için immünoforesans boyama doğrulanmış hücre yayılma alanı ve uzama bu mikro desenleme yöntemi ile yüksek oranda kontrol edildi(Şekil 5F).

Şekil 1: Hücre kültürü, kasma sertliği ve protein bileşimi ile substratlar. (A) PDMS hücre kültürü alt tabakalarının gelişimini gösteren şema. (B) Baz ilk PDMS karıştırma oranı: kür ajan Young modülü belirler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
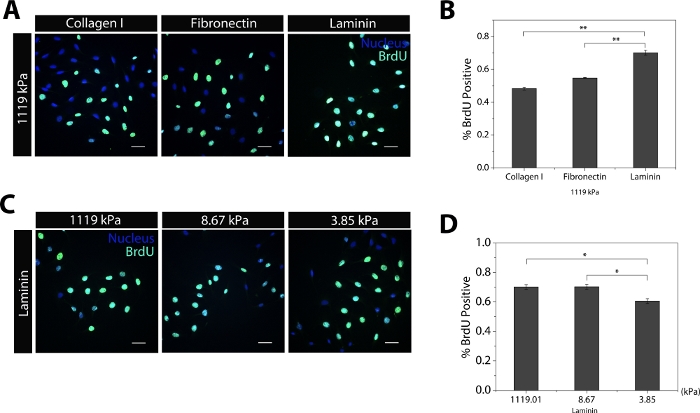
Şekil 2: SC proliferasyon oranları substrat sertliği ve protein bileşimi ile düzenlenir. (A) Aynı modülün alt tabakalarında kültürlendiğinde BrdU boyamasını gösteren temsili görüntüler. (B) Her protein kaplaması için BrdU pozitif hücrelerin inkişa sını gösteren histogram. (C) Aynı protein kaplamanın alt tabakalarında tohumlanmış SC'lerde BrdU'nun kuruluş olduğunu gösteren temsili görüntüler. (D) Her Young'ın modül değeri için BrdU pozitif hücrelerinin yüzdesini gösteren histogram. Ölçek çubukları = 50 μm. Veriler ortalama ± SEM. *p < .05, **p < .005, ***p < .0005 olarak sunulur. Rakamın bazı bölümleri ref.24'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Substrat sertliği ve protein regüle SC protein ekspresyonu. (A) Temsili görüntüler farklı sertlik ve protein bileşimi substratları üzerinde tohumlu SCs için c-Jun immünofloresan boyama göstermektedir. C-Jun'un ortalama piksel floresan yoğunluğu , (B) kollajen I (C) fibronektin ve (D) farklı sertlikteki laminin kaplı yüzeyler de ölçüldü. (E) c-SC'lerin Jun floresan düzeyi Young'ın substrat modülü ile gruplandırılır. (F) Substratlar üzerinde tohumlanmış SC'lerin c-Jun ve miyelin temel proteinini (MBP) gösteren batı lekeleri. Gliserinaldehit 3-fosfat dehidrogenaz (GAPDH) yükleme kontrolü olarak kullanıldı. Ölçek çubuğu = 50 μm. Veriler ortalama ± SEM. *p < .05, **p < .005, ***p < .0005 olarak sunulur. Rakamın bazı bölümleri ref.24'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
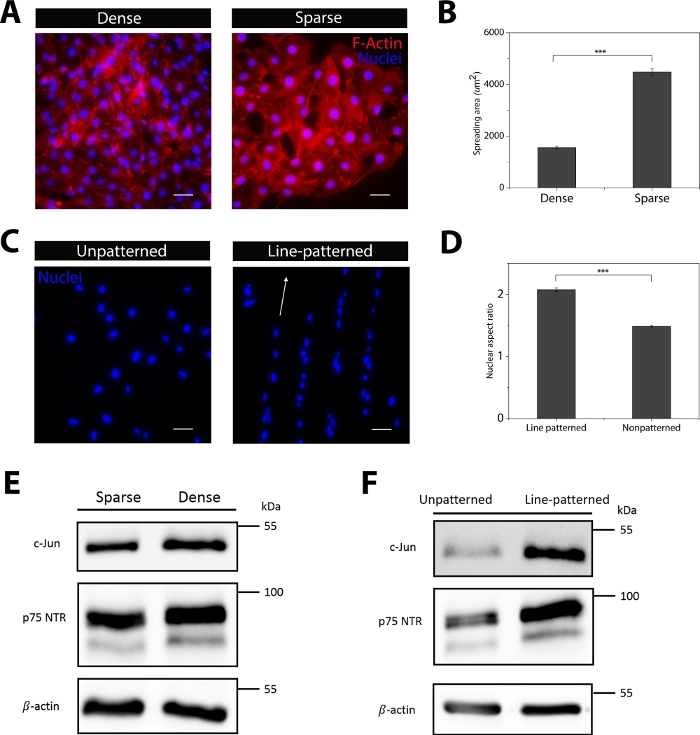
Şekil 4: Hücresel yayılma alanı SC'lerin protein ekspresyonunu etkiler. (A) Farklı tohumlama yoğunluklarının hücre yayılma alanı rhodamine-phalloidin (kırmızı) ve çekirdek boyama (mavi) ile görselleştirildi. (B) Histogram her durumda SCs ortalama yayılma alanı gösteren. (C) Desensiz veya çizgi desenli yüzeylerüzerinde tohumlanan SC'lerin çekirdekleri morfolojiyi göstermek için DAPI (mavi) ile boyanmıştır. (D) Desenli ve desensiz yüzeylerde nükleer enboy oranının niceliğini gösteren histogram. (E) Farklı yayılma alanına sahip hücrelerin c-Jun ve p75NTR ekspresyonunu gösteren batı lekesi. (F) SC'lerin desensiz ve çizgi desenli yüzeylerde protein ekspresyonunu gösteren batı lekesi. Ölçek çubuğu = 50 μm. Veriler ortalama ± SEM. *p < .05, **p < .005, ***p < .0005 olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: SC morfolojisi ve uzama etkisi c-SC'lerin Haz ekspresyonu. (A) Farklı en boy oranına göre şekiller için hücre mikrodesenlerini gösteren şema. (B) mikrotemas baskısını takiben mikro desenlerin şeklini gösteren fBSA boyama (kırmızı). Ölçek çubuğu = 10 μm. (C) Mikro desenli SC'lerin nükleer enboy oranını gösteren histogram. (D, E) Geometrik koşulların her biri için c-Jun'un ortalama piksel floresan yoğunluğunu gösteren histogram. (F) Rhodamine-phalloidin (kırmızı), çekirdekleri (mavi) ve c-Jun (yeşil) farklı mikro desenler üzerinde boyandı. Ölçek çubuğu = 10 μm. Veriler ortalama ± SEM. *p < .05, **p < .005, ***p < .0005 olarak sunulur. Rakamın bazı bölümleri ref.24'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
SCs onların phenotipik dönüşüm ve sinir yaralanması aşağıdaki rejeneratif potansiyel nedeniyle sinir rejenerasyonu teşvik edebilir. Ancak, ECM ipuçlarının bu rejeneratif kapasiteyi nasıl düzenlediği çoğunlukla belirsizliğini korumaktadır ve bu da sadece sinir rejenerasyonu yla ilgili biyomalzemelerin geliştirilmesini değil, aynı zamanda sinir yenilenmesinde yer alan mekanizmaların anlaşılmasını da engellemektedir. Bu etkileşimi incelemeye başlamak için, sertlik, protein kaplama ve yapışkan topografya gibi ECM ipuçlarının kontrol edilebildiği hücre kültürü alt tabakaları oluşturulmuştur. Mikrolekyapıştırlı topografya nın mikrodesen yeteneği, mikrotemas baskının yaygın yöntemini kullanarak protokol içinde önemli bir özelliktir. Ancak, bu alt tabaka, PDMS pullarına uygulanan sıkıştırma kuvvetinin hücre kültürü alt tabakalarında hücre yapıştırıcıalanlarının istenilen şekli elde etmek için uygun düzeyde olması gerektiği için camdan farklıdır. Hücre yapışkan alanlarını görselleştirmek ve PDMS pullarında sıkıştırma kuvvetlerini ayarlamak için model protein olarak floresan sığır serum albumini (fBSA) kullanmak sonuçta bu sorunu hafifletebilir. Cam dan bir diğer önemli fark substrat yapışmaz kalan işlemek için kullanılan aşırı Pluronic F-127 kaldırılmasıdır. Bu tedaviden sonra, hücre kültürü substratları yüksek hidrofobik, bu mikro desenli protein yapısal bütünlüğü için önemli olan yıkıyor boyunca ıslak hücre kültürü substratları korumak için zor hale37. Bu nedenle, substratların tamamen susuz kalmasını önlemek için çözeltileri neredeyse aynı anda aspire etmek ve enjekte etmek için birden fazla pipet kullanılması tavsiye edilir.
Mikro desenleme hücre şeklini tam olarak kontrol edebilse ve OEGMA gibi hücre bloke eden polimerler kullanarak karmaşık sentetik prosedürler gerektirmese de, mikro desenli hücrelerin protein ekspresyonunu ölçmek için kullanılan yöntemler bazen38ile sınırlıdır. Örneğin, mikro desenlemeden elde edilen numuneler genellikle kapak başına birkaç yüz hücre ile sınırlıdır ve bu da batı lekeleri veya qPCR için kullanılacak hücre likatlarını hazırlamak için yetersizdir. Bu göz önüne alındığında, immünoresans boyama tek başına mikro desenli hücreler için protein ekspresyonunu ölçmek için kullanılan, ölçülebilir proteinlerin çeşitliliği sınırlayan. Bunu gidermek için, daha büyük hücre popülasyonları için hücre uzamasını teşvik etmek için çizgi desenleri kullandık ve batı lekeleri tarafından analiz edilen hücre lysates'i başarıyla hazırladık. Uygulanan elektrik alanları veya hizalanmış elektrospun lifleri gibi diğer yöntemler de hücre popülasyonlarının uzamasını kontrol etmek için uygulanabilir39,40. Ancak, kollajen bazlı polimer ve ipek gibi yaygın olarak kullanılan biyomalzemelerin iletkenliği çok düşük28,41,42olduğundan Elektrik alanları NGCs için tüm uygulamalara sığmayabilir. Buna karşılık, hizalanmış electrospun nanofibers başarıyla SC hizalama, uzama ve göç yanı sıra neurite outgrowth 43 ,,44teşvik NGCs içine implante edilmiştir.43 Ayrıca çizgili desenler ve hizalanmış nanofibers NGCs45dahil en yaygın rehberlik mekanizmaları iki olduğundan, hizalanmış nanofibers ile yüzeylerde olanlara karşı çizgi desenli yüzeylerde SC davranışı karşılaştırmak için zorlayıcı kanıtlayabilir.
Mikro desenleme protokolü nde PDMS kaplı kapaklar hücre kültürü yüzeyleri olarak kullanılır ve maksimum yüzeyli Young'ın 1119 kPa modülü bulunur. Bu sertlik birçok dokuyu taklit eder, ancak genellikle yüzey Young'ın modülünün 1 Gpa46'yıaşmasını gerektiren mezenkimal kök hücrelerin osteogeneziyi modellemek mümkün olmayabilir. Bu gibi durumlar için, cam alternatif bir aday, ancak Pluronic F-127 adsorpsiyon cam sahip olmayan nispeten yüksek yüzey hidrofobiklik gerektirir. Hidrofobikliği artırmak için, cam diklorobenzen dimetil diklorosilane ile tedavi edilebilir. Bunu takiben, UV-Ozon tedavisi mikrotemas baskı için hidrofilisite artırmak için kullanılabilir47.
Sonuç olarak, ECM uyaranların protein ekspresyonu ile ayrı ayrı ayarlanabildiği bir hücre kültürü platformu geliştirilmiştir. SC rejeneratif kapasitenin belirli mekanik ve kimyasal ECM ipuçları tarafından teşvik edildiğine karar verdik, bu da daha sonra ECM özelliklerinin optimize edilmesi gerekebileceği StK'lar ve hücre nakli süreçleri gibi biyomalzeme uygulamalarının gelecekteki tasarımında ilham kaynağı olabilir24. Yine de, bu ECM ipuçlarını ayarlama zorlu bir girişim olabilir, özellikle in vivo. İleriye doğru hareket eden bu platform, ECM tarafından denetlenen SC'lerin henotipik geçişinde yer alan önemli mekanizmaları ayrışdırmak için kullanılabilir. Bunu başararak, hücre içi ipuçları manipülasyon in vitro48,,49özel platformlar için gerek kalmadan SC rejeneratif kapasite teşvik etmek mümkün olabilir. Bu sinir onarım ı için teknolojilerin geliştirilmesinde çığır açan çalışma potansiyeline sahiptir.
Açıklamalar
Yazarlar tarafından olası bir çıkar çatışması bildirilmedi.
Teşekkürler
Yazarlar minnetle Cincinnati Üniversitesi'nden fon desteği kabul. Yazarlar da Ron Flenniken Cincinnati Üniversitesi Gelişmiş Malzeme Karakterizasyon laboratuvarı destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Albumin from Bovine Serum (BSA), Texas Red conjugate | Thermo Fisher Scientific | A23017 | BSA staining to show micropatterns |
| Anti-mouse IgG, HRP-linked Antibody | Cell Signaling Technology | 7076S | Antibody used for western blot analysis |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074S | Antibody used for western blot analysis |
| BrdU | Thermo Fisher Scientific | B23151 | Reagent used to measure cell proliferation |
| BrdU primary antibody conjugated with Alexa Fluor 488 | Thermo Fisher Scientific | B35130 | Used to visualize BrdU in cell proliferation assays |
| Collagen I | Thermo Fisher Scientific | A10483-01 | Protein used to coat coverslips |
| Compression force test machine | TestResources | Instrument to quantify mechanical properties of polymers | |
| Dulbecco's Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | Cell culture medium |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | Cell culture medium supplemental |
| Fibronectin | Thermo Fisher Scientific | 33010-018 | Protein used to coat coverslips |
| Fluorescence microscope | Nikon | Eclipse Ti2 | Fluorescence microscope |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78440 | Protease and Phosphatase Inhibitor |
| Laminin | Thermo Fisher Scientific | 23017015 | Protein used to coat coverslips |
| Mounting medium with DAPI | Thermo Fisher Scientific | P36971 | Coverslip mountant and nuclei staining |
| Mouse c-Jun primary antibody | Thermo Fisher Scientific | 711202 | Primary antibody to visualize c-Jun protein |
| Mouse β-Actin primary antibody | Cell Signaling Technology | 3700S | Loading control for western blot experiments |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Cell culture medium supplemental |
| Photoresist SU 2010 | KAYAKU | SU8-2010 | Photoresist |
| Pluronic F-127 | Sigma Aldrich | P-2443 | Block non-specific protein binding |
| Rabbit c-Jun primary antibody | Cell Signaling Technology | 9165S | Primary antibody for visualization of c-Jun protein |
| Rabbit myelin basic protein primary antibody | Abcam | ab40390 | Primary antibody for visualization of MBP |
| Rabbit p75NTR primary antibody | Cell Signaling Technology | 8238S | Primary antibody for visualization of p75NTR |
| Rhodamine phalloidin | Thermo Fisher Scientific | R415 | Visualization of cell cytoskeleton |
| RIPA buffer | Abcam | ab156034 | Cell lysis buffer |
| RT4-D6P2T Schwann cell line | ATCC | CRL-2768 | Cell line used in experiments |
| SYLGARD 184 PDMS base and curing agent | Sigma Aldrich | 761036 | Tunable polymer used to coat coverslips |
| Trypsin | Thermo Fisher Scientific | 15090-046 | Cell dissociation reagent |
| UV-Ozone cleaner | Novascan | Increase hydrophicility of PDMS | |
| Versene (1x) | Thermo Fisher Scientific | 15040066 | Cell dissociation reagent |
Referanslar
- Taylor, C. A., Braza, D., Rice, J. B., Dillingham, T. The Incidence of Peripheral Nerve Injury in Extremity Trauma. American Journal of Physical Medicine & Rehabilitation. 87, 381-385 (2008).
- Noble, J., Munro, C. A., Prasad, V. S. S. V., Midha, R. Analysis of Upper and Lower Extremity Peripheral Nerve Injuries in a Population of Patients with Multiple Injuries. Journal of Trauma and Acute Care Surgery. 45, 116-122 (1998).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594, 3521-3531 (2016).
- Arthur-Farraj, P. J., et al. c-Jun Reprograms Schwann Cells of Injured Nerves to Generate a Repair Cell Essential for Regeneration. Neuron. 75, 633-647 (2012).
- Jessen, K. R., Mirsky, R. The Success and Failure of the Schwann Cell Response to Nerve Injury. Frontiers in Cell Neurosciences. 13, 33(2019).
- Gomez-Sanchez, J. A., et al. After Nerve Injury, Lineage Tracing Shows That Myelin and Remak Schwann Cells Elongate Extensively and Branch to Form Repair Schwann Cells, Which Shorten Radically on Remyelination. Journal of Neuroscience. 37 (37), 9086-9099 (2017).
- Deumens, R., et al. Repairing injured peripheral nerves: Bridging the gap. Progress in Neurobiology. 92, 245-276 (2010).
- Höke, A., Gordon, T., Zochodne, D. W., Sulaiman, O. A. R. A decline in glial cell-line-derived neurotrophic factor expression is associated with impaired regeneration after long-term Schwann cell denervation. Experimental Neurology. 173, 77-85 (2002).
- Jones, S., Eisenberg, H. M., Jia, X. Advances and future applications of augmented peripheral nerve regeneration. International Journal of Molecular Sciences. 17, 1-17 (2016).
- Harris, G. M., et al. Nerve Guidance by a Decellularized Fibroblast Extracellular Matrix. Matrix Biology. 60-61, 176-189 (2017).
- Harris, G. M., Piroli, M. E., Jabbarzadeh, E. Deconstructing the Effects of Matrix Elasticity and Geometry in Mesenchymal Stem Cell Lineage Commitment. Advanced Function Mater. 24 (16), 2396-2403 (2014).
- Pryzhkova, M. V., Harris, G. M., Ma, S., Jabbarzadeh, E. Patterning pluripotent stem cells at a single cell level. Journal of Biomaterials and Tissue Engineering. 3 (4), 461-471 (2013).
- Engler, A. J., Sweeney, H. L., Discher, D. E., Schwarzbauer, J. E. Extracellular matrix elasticity directs stem cell differentiation. Journal of Musculoskeleton and Neuronal Interaction. 7 (4), 335(2007).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Reports. 15, 1243-1253 (2014).
- Chernousov, M. A., Carey, D. J. Schwann cell extracellular matrix molecules and their receptors. Histology and Histopathology. 15, 593-601 (2000).
- Shibata, S., et al. Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct Ocular Lineages. Cell Reports. 25 (6), 1668-1679 (2018).
- Mcbeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell Shape, Cytoskeletal tenstion and RhoA regulate stem cell lineage committment. Developmental Cell. 6, 483-495 (2004).
- Halder, G., Dupont, S., Piccolo, S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nature Reviews Molecular Cell Biology. 13, 591-600 (2012).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594 (13), 3521-3531 (2016).
- Lopez-Fagundo, C., Bar-Kochba, E., Livi, L. L., Hoffman-Kim, D., Franck, C. Three-dimensional traction forces of Schwann cells on compliant substrates. Journal of The Royal Society Interface. 11, 20140247(2014).
- Gu, Y., et al. The influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials. 33, 6672-6681 (2012).
- Xu, Z. Y., Orkwis, J. A., DeVine, B. M., Harris, G. M. Extracellular matrix cues modulate Schwann cell morphology, proliferation, and protein expression. Journal of Tissue Engineering and Regenerative. , (2019).
- Urbanski, M. M., et al. Myelinating glia differentiation is regulated by extracellular matrix elasticity. Scientific Reports. 6, 1-12 (2016).
- Sun, Y., et al. Tunable stiffness of graphene oxide/polyacrylamide composite scaffolds regulates cytoskeleton assembly. Chemical Sciences. 9 (31), 6516-6522 (2018).
- Hwang, J. H., et al. Extracellular matrix stiffness regulates osteogenic differentiation through MAPK activation. PLoS One. 10, 1-16 (2015).
- Ryan, A. J., et al. A Physicochemically Optimized and Neuroconductive Biphasic Nerve Guidance Conduit for Peripheral Nerve Repair. Advanced Healthcare Materials. 6, 1-13 (2017).
- Du, J., et al. Prompt peripheral nerve regeneration induced by a hierarchically aligned fibrin nanofiber hydrogel. Acta Biomaterialia. 55, 296-309 (2017).
- Huang, L., et al. A compound scaffold with uniform longitudinally oriented guidance cues and a porous sheath promotes peripheral nerve regeneration in vivo. Acta Biomaterialia. 68, 223-236 (2018).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Jouranl of Visualized Experiments. (119), e55276(2017).
- Gupta, R., et al. Shear stress alters the expression of myelin-associated glycoprotein (MAG) and myelin basic protein (MBP) in Schwann cells. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 23, 1232-1239 (2005).
- Harris, G. M., Shazly, T., Jabbarzadeh, E. Deciphering the combinatorial roles of geometric, mechanical, and adhesion cues in regulation of cell spreading. PLoS One. 8 (11), (2013).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Schreck, I., et al. C-Jun localizes to the nucleus independent of its phosphorylation by and interaction with JNK and vice versa promotes nuclear accumulation of JNK. Biochemical and Biophysical Research Communications. 407, 735-740 (2011).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. Journal Visualized Experiments. (22), e1065(2008).
- Treter, J., et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion. Applied Surface Science. 303, 147-154 (2014).
- Lutz, J. F. Polymerization of oligo(ethylene glycol) (meth)acrylates: Toward new generations of smart biocompatible materials. Journal of Polymer Science Part A: Polymer Chemistry. 46 (11), 3459-3470 (2008).
- Marcus, M., et al. Interactions of Neurons with Physical Environments. Advanced Healthcare Materials. 6, (2017).
- Pu, J. Golgi polarization in a strong electric field. Journal of Cell Science. 118, 1117-1128 (2005).
- Blaker, J. J., et al. Bioactive Silk-Based Nerve Guidance Conduits for Augmenting Peripheral Nerve Repair. Advanced Healthcare Materials. 7, 1800308(2018).
- Daly, W., Yao, L., Zeugolis, D., Windebank, A., Pandit, A. A biomaterials approach to peripheral nerve regeneration : bridging the peripheral nerve gap and enhancing functional recovery. Journal of the Royal Society of Interface. 9 (67), 202-221 (2012).
- Xia, H., et al. Directed neurite growth of rat dorsal root ganglion neurons and increased colocalization with Schwann cells on aligned poly(methyl methacrylate) electrospun nanofibers. Brain Research. 1565, 18-27 (2014).
- Wang, H. B., Mullins, M. E., Cregg, J. M., McCarthy, C. W., Gilbert, R. J. Varying the diameter of aligned electrospun fibers alters neurite outgrowth and Schwann cell migration. Acta Biomaterialia. 6, 2970-2978 (2010).
- Carvalho, C. R., Oliveira, J. M., Reis, R. L. Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. 7, 337(2019).
- Yang, Y., Wang, K., Gu, X., Leong, K. W. Biophysical Regulation of Cell Behavior - Cross Talk between Substrate Stiffness and Nanotopography. Engineering. 3, 36-54 (2017).
- Tan, J. L., Liu, W., Nelson, C. M., Raghavan, S., Chen, C. S. Simple Approach to Micropattern Cells on Common Culture Substrates by Tuning Substrate Wettability. Tissue Engineering. 10, 865-872 (2004).
- Grove, M., et al. YAP/TAZ initiate and maintain schwann cell myelination. Elife. 6, 1-27 (2017).
- Poitelon, Y., et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells. Nature Neuroscience. 19, 879-887 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır