Method Article
Preparación de microambientes de matriz extracelular sintonizable para evaluar la especificación del fenotipo celular Schwann
En este artículo
Resumen
Esta metodología tiene como objetivo ilustrar los mecanismos por los cuales las señales de matriz extracelular tales como rigidez del sustrato, composición de proteínas y morfología celular regulan el fenotipo de células Schwann (SC).
Resumen
Las lesiones traumáticas del sistema nervioso periférico (PNS) actualmente carecen de tratamientos adecuados para recuperar la recuperación funcional completa. Las células Schwann (SCs), como las principales células gliales del PNS, juegan un papel vital en la promoción de la regeneración del PNS mediante la desdiferenciación en un fenotipo celular regenerativo después de la lesión. Sin embargo, el estado desdiferenciado de los CC es difícil de mantener durante el período de tiempo necesario para la regeneración y se ve afectado por los cambios en la matriz extracelular circundante (ECM). Por lo tanto, determinar la compleja interacción entre los CC y el ECM diferente para proporcionar señales de potencial regenerativo de los CC es esencial. Para hacer frente a esto, se creó una estrategia en la que se adsorbieron diferentes proteínas ECM sobre un sustrato de polidimetilsiloxano (PDMS) que proporcionaba una plataforma donde se puede modular la rigidez y la composición de proteínas. Los SC se siembran sobre los sustratos sintonizables y se midieron las funciones celulares críticas que representan la dinámica del fenotipo SC. Para ilustrar la interacción entre la expresión de proteína SC y la morfología celular, se utilizaron y caracterizaron las diferentes densidades de siembra de SC, además de patrones celulares impresos de microcontacto individuales, y se caracterizaron por la tinción por inmunofluorescencia y la mancha occidental. Los resultados mostraron que las células con un área de propagación más pequeña y mayor extensión de alargamiento celular promovieron mayores niveles de marcadores fenotípicos regenerativos SC. Esta metodología no sólo comienza a desentrañar la relación significativa entre el ECM y la función celular de los SCs, sino que también proporciona pautas para la optimización futura de los biomateriales en la reparación de los nervios periféricos.
Introducción
Las lesiones del sistema nervioso periférico (PNS) siguen siendo un desafío clínico importante en la atención médica al comprometer la calidad de vida de los pacientes y crear un impacto significativo a través de una multitud de factores socioeconómicos1,,2. Las células Schwann (SC), como las principales células gliales en el PNS, proporcionan las señales moleculares y físicas necesarias para inducir la regeneración del PNS y ayudar en las recuperaciones funcionales en lesiones de brecha corta. Esto se debe a la notable capacidad de los SCs para desdiferenciar en un fenotipo celular de "reparación" de un fenotipo mielinizante o Remak3. El SC de reparación es un fenotipo celular distintivo de varias maneras. Después de la lesión, las CC aumentan su tasa de proliferación volviendo a entrar en el ciclo celular y comienzan la expresión de varios factores transcripcionales para facilitar la reinvervación. Estos factores, como c-Jun y p75 NTR, se regulan al alza mientras que los marcadores SC mielinantes, como la proteína básica de mielina (MBP), están regulados hacia abajo4,5. Además, los SCs cambian la morfología para que se alargar y se alineen entre sí para formar bandas de B-ngner a través del sitio de lesiones6. Esto proporciona un mecanismo de orientación física para que los axones se extiendan al objetivo distal correcto7. Sin embargo, a pesar de la capacidad que poseen los CC para promover la regeneración nerviosa en lesiones de brecha corta, el resultado de la recuperación funcional sigue siendo pobre en lesiones graves. Esto se debe en parte a una pérdida de indicaciones de orientación de matriz extracelular (ECM), así como a la incapacidad de los CC para mantener el fenotipo regenerativo durante largos períodos de tiempo8.
El proceso de regeneración y recuperación nerviosa está íntimamente ligado al estado de la lámina basal después de una lesión. La lámina basal es una capa de ECM alrededor del nervio que facilita la orientación y proporciona señales enlazadas a ECM para axones y SCs en los casos en que permanece intacta después de la lesión9. El estado del ECM y su capacidad para entregar señales de matriz enlazadas a las células es de vital importancia y se ha explorado previamente en una variedad de contextos diferentes10,,11,,12,,13,,14. Por ejemplo, se ha demostrado que la rigidez del ECM puede guiar funciones celulares como la proliferación y la diferenciación11,15,16. La composición del ECM también puede conducir a una respuesta celular distinta y regular los comportamientos celulares como la migración y la diferenciación a través de las vías de señalización intracelulares17,,18. Además, la morfología celular, incluida la zona de propagación y el alargamiento celular, desempeñan un papel importante en la regulación de la función y pueden regirse por las señales19,,20. Muchos estudios anteriores se han centrado en células madre que se diferencian en linajes definidos, sin embargo, las SC poseen una capacidad similar para alterar el fenotipo de un SC homeostático, adulto dentro de un nervio sano, a una reparaciones SC capaces de secretar proteínas y factores de crecimiento mientras se remodela el ECM después de la lesión nerviosa5,,21. Por lo tanto, es especialmente crucial identificar los mecanismos subyacentes a la relación entre la capacidad regenerativa de SC innata y las señales enlazadas a ECM para que la información aproveche en última instancia esta capacidad para la regeneración nerviosa.
Para abordar esto, hemos desarrollado una metodología detallada para producir un sustrato de cultivo celular donde la rigidez mecánica y el tipo de ligando se pueden ajustar fácilmente en rangos fisiológicamente relevantes. El siloxano de polidimetil (PDMS) fue elegido como sustrato debido a su mecánica altamente sintonizable en comparación con el gel de poliacrilamida, donde el módulo máximo de Young es de alrededor de 12 kPa contrastado con PDMS en alrededor de 1000 kPa22,,23,,24. Esto es beneficioso para el trabajo en cuestión, ya que estudios recientes han demostrado que el módulo de young de un nervio ciático de conejo puede superar los 50 kPa durante el desarrollo, lo que sugiere que el rango de rigidez de los nervios dentro del PNS es más amplio de lo examinado anteriormente. Diferentes proteínas son capaces de adsorción sobre sustratos de PDMS para analizar la regulación combinatoria de la mecánica y los ligandos sobre el comportamiento sc. Esto permite la investigación de múltiples señales microambienmentales presentes en el proceso de regeneración de PNS y la comparación de un alto grado de tunabilidad con el trabajo centrándose únicamente en la rigidez del sustrato25. Además, estos sustratos de cultivo celular de ingeniería son compatibles con una multitud de métodos de análisis cuantitativos como la inmunohistoquímica, la mancha occidental y la reacción cuantitativa en cadena de la polimerasa (q-PCR).
Esta plataforma de cultivo celular de ingeniería es muy adecuada para analizar vías mecanicistas debido al alto nivel de tunabilidad individual de cada señal enlazada a ECM. Además, se pueden lograr métodos populares para el micropatrón celular, incluida la impresión de microcontactos, en los sustratos para permitir la adhesión celular controlada para analizar la forma de la célula en relación con otras señales enlazadas a ECM24. Esto es fundamental porque los sustratos con patrón de línea, que promueven el alargamiento en las poblaciones celulares, proporcionan una herramienta para imitar y estudiar los SCs alargados y regenerativos dentro de las bandas de B-ngner durante la regeneración nerviosa. Además, la morfología celular es un potente regulador de múltiples funciones celulares y potencialmente puede introducir resultados experimentales confusos si no se controlan26,,27. Ahora se presta una atención significativa a los mecanismos que rigen el fenotipo regenerativo SC regulado por las señales28,29,,30del MEC. Esto es esencial para proporcionar información sobre el diseño de biomateriales que se pueden aplicar como conductos de orientación nerviosa para la ayuda en la regeneración nerviosa PNS. Estos protocolos detallados se pueden aplicar en última instancia como una herramienta potencial para descifrar los mecanismos de SC y otras funciones de tipo de células según lo regulado por señales enlazadas a ECM.
Protocolo
1. Preparación y caracterización del sustrato de cultivo celular tunable
- Preparación del sustrato
- Mezclar el elastómero base PDMS y los agentes de curado utilizando una punta de pipeta vigorosamente en una relación entre 10:1 y 60:1 hasta que las burbujas se dispersen homogéneamente dentro de la mezcla. Retire las burbujas con desicación al vacío hasta que las burbujas se disipen.
NOTA: Durante la polimerización de PDMS, el agente de curado cruza con el elastómero base para proporcionar las propiedades mecánicas deseadas del polímero final. Las relaciones de entrecruzamiento se pueden ajustar para alterar la rigidez de PDMS. - Coloque una gota (0,2 ml) de la mezcla de PDMS desecada en un cubreobjetos cuadrado o circular (por ejemplo, 22 mm x 22 mm) y gire el cubreobjetos en una recubridora de centrifugado a 2500 rpm durante 30 s.
- Incubar el cubreobjetos en un horno a 60oC durante 1-2 h o a temperatura ambiente durante la noche para que PDMS se solidifique.
- Tratar el cubreobjetos usando limpiador UV-Ozono durante 7 min (longitud de onda UV: 185 nm y 254 nm) para aumentar la hidrofilia superficial. Colóquelo en una placa esterilizada de 6 pozos.
- Antes de usar para el cultivo celular, incubar sustratos en 70% de etanol durante al menos 30 min.
ADVERTENCIA: El limpiador UV-Ozono puede generar ozono que es dañino para los seres humanos. Trabajar en una campana de humo químico o con algún tipo de ventilación. - Sumergir los cubreobjetos en la solución proteica (10 g/ml de colágeno I, fibronectina o laminin) durante 60 min en una incubadora estéril a 37oC.
NOTA: Tras el tratamiento con UV-Ozono, la superficie PDMS puede seguir siendo hidrófoba. Gire la placa del pozo para asegurarse de que cada cubreobjetos esté cubierto con la solución proteica. - Aspirar la solución proteica y lavar el cubreobjetos con solución salina tamponada de fosfato (PBS) 3x.
- Vuelva a suspender la línea celular RT4-D6P2T Schwann (SCs) de la placa de transpamiento utilizando la solución EDTA disponible comercialmente (1x) con 2,5% de trippsina y contar células con hemocitociómetro. SCs de semilla en la superficie DE PDMS sintonizable con la densidad de celda deseada. Las densidades de siembra SC pueden variar para cada aplicación diferente.
- Mantener las células en los parámetros de cultivo celular deseados (90% de humedad, 5% CO2,37 oC, etc.) para la duración del experimento. Utilice el medio de águila modificada (DMEM) de Dulbecco complementado con 10% de suero bovino fetal (FBS) y 1% de penicilina-estreptomicina como medio de cultivo celular.
- Mezclar el elastómero base PDMS y los agentes de curado utilizando una punta de pipeta vigorosamente en una relación entre 10:1 y 60:1 hasta que las burbujas se dispersen homogéneamente dentro de la mezcla. Retire las burbujas con desicación al vacío hasta que las burbujas se disipen.
- Preparación del sustrato micropatrnado
- Dibuje las áreas de geometría y adhesivas celulares deseadas (900 m2,1.600 m2 y 2.500 m2)utilizando el software de diseño asistido por ordenador (CAD). Crea una fotomasca cromada basada en esos patrones de un proveedor comercial.
- En una sala limpia o en un entorno libre de polvo, utilice técnicas de fotolitografía estándar para fabricar obleas de silicio (los protocolos se detallan en otros lugares31). Los parámetros críticos para esta aplicación en particular son los siguientes: Fotorresistir: SU-8 2010; Girar perfil para dispersar el fotorresistir: 500 rpm para 10 s con una aceleración de 100 rpm/s, luego 3500 rpm para 30 s con una aceleración de 300 rpm/s; Energía de exposición de la luz UV: 130 mJ/cm2.
NOTA: La altura de los patrones en las obleas de silicio es de aproximadamente 10 m siguiendo estos parámetros. Las posibles grietas alrededor del borde fuera de los patrones rectangulares o triangulares se pueden ver usando un microscopio de luz después del paso 1.2.2. Hornear la oblea de silicio a 190 oC durante 30 minutos ayuda a eliminar las grietas. - Coloque la oblea de silicio con patrón dentro de una placa Petri circular de 150 mm de diámetro x 15 mm de altura y vierta PDMS desgasíz (relación de mezcla 10:1) como se prepara en el paso 1.1.1 sobre la oblea de silicio.
NOTA: Asegúrese de que el espesor de PDMS sea de al menos 5 mm para facilitar la manipulación durante los pasos de impresión de microcontactos. - Solidifique PDMS en obleas de silicio en un horno a 60 oC durante la noche. Permita que PDMS se enfríe a temperatura ambiente. Sellos de corte preciso de cuadrados de 30 mm x 30 mm que contienen los patrones correctos de la oblea de silicio utilizando un bisturí quirúrgico. No dañe la oblea de silicio.
NOTA: Las obleas de silicio se pueden reutilizar muchas veces en este punto para producir más sellos después de la limpieza con isopropanol. - Esterilice los sellos PDMS y los cubreobjetos sintonizables (preparados en los pasos 1.1.1 a 1.1.3) sumergiéndolos en 70% de etanol durante 30 min.
- Para confirmar la eficacia de los sellos de micropatrón por PDMS después de la impresión de microcontactos, seque la superficie de los sellos PDMS utilizando una corriente de aire filtrada y la solución BSA (Texas Red conjugada) de 50 g/ml para cubrir todo el lado estampado del sello PDMS.
- Incubar sellos PDMS con solución BSA durante 1 h a temperatura ambiente para permitir la adsorción de proteínas.
- Seque la superficie de los cubreobjetos sintonizables utilizando una corriente de aire filtrada, aumente la hidrofilia superficial como se describe en el paso 1.1.5.
- Seque al aire los sellos PDMS para eliminar la solución BSA restante.
NOTA: Tenga cuidado de que la solución BSA se elimine completamente del sello porque cualquier solución restante hará que los sellos se deslicen en el cubreobjetos durante la impresión de microcontactos. - Ponga el lado estampado del sello en contacto conformado con el cubreobjetos sintonizable para la adsorción BSA en la superficie del cubreobjetos. Presione suavemente el sello contra el cubreobjetos durante 5 min.
NOTA: No aplique fuerza excesiva en el sello, ya que se doblará y causará contacto no específico entre el sello y el cubreobjetos. La cantidad adecuada de fuerza aplicada en el sello es esencial para una impresión de microcontacto exitosa. - Examine el micropatrón con un microscopio de fluorescencia con un filtro FITC (Fluorescein isotiocianato).
- Para imprimir áreas adhesivas celulares en lugar de patrones fluorescentes, sustituya la laminin por proteína BSA y repita los pasos 1.2.5 a 1.2.10.
- Retire los sellos de los cubreobjetos, transfiera los cubreobjetos en una placa esterilizada de 6 pozos. Añadir 2 ml de 0,2% p/v Pluronic F-127 solución en cada pozo para cubrir la superficie del cubreobjetos e incubar durante 1 h a temperatura ambiente.
NOTA: Pluronic F-127 se puede adsorbier a la superficie PDMS aumentando la hidrofobicidad de la superficie PDMS para bloquear las células de la adhesión. - Aspirar la solución Pluronic F-127 y lavar 5x con PBS y 1x con el medio de cultivo celular antes de sembrar las células. Una densidad de siembra típica para SCs es de 1.000 células/cm2.
- 45 minutos después de la siembra celular, retire el medio de cultivo celular y lave los cubreobjetos con PBS 2x para evitar que varios SCs se adhimenten al mismo patrón. Mantener las células en el entorno de cultivo celular deseado durante 48 h antes de la cuantificación.
- Para crear sustratos de cultivo celular con patrón de línea para examinar celdas alineadas, siga los pasos 1.2.1 a 1.2.4 para crear sellos para la impresión de microcontactos.
NOTA: Las dimensiones de la ranura/cresta de los patrones de forrados en el sello son de 50 m x 50 m para las celdas esbozadas. Las dimensiones totales del sello son de 10 mm x 10 mm. - Corte sellos en cotas que contengan solo los patrones de línea deseados.
NOTA: Al crear sellos en CAD, el área sin patrón del sello alrededor de los patrones de línea corresponderá al área de adhesivo celular después de la impresión de microcontactos. Por lo tanto, es necesario eliminar las áreas sin patrón al cortar el sello para asegurar que cada SC sembrado en la superficie sigue los patrones. - Siga los pasos 1.1.1 a 1.1.3 para preparar el revestimiento de superficie DE PDMS sintonizable dos platos Petri.
NOTA: Esto será PDMS que cubre la superficie de la placa Petri en sí y no en un cubreobjetos. - Siga los pasos 1.2.5 a 1.2.10 para realizar la impresión de microcontactos para imprimir áreas adhesivas de celda con patrón de línea en uno de los platos Petri recubiertos por PDMS.
NOTA: El área de superficie de una placa Petri de 60 mm x 15 mm puede contener áreas con patrón de línea de 6 sellos PDMS. - Retire los sellos y llene el plato Petri con 4 ml de 0,2% p/v solución Pluronic F-127 e incubar durante 1 h.
- Después de la impresión de microcontactos, enjuague cada lado de los sellos PDMS con 70% de etanol 3x y seque con aire. Gire los sellos PDMS y siga los pasos 1.2.5 a 1.2.10 para imprimir el área adhesiva de celda sin colocar utilizando el lado sin colocar del sello en la segunda placa Petri. Repita el paso 1.2.13.
- Aspirar la solución F-127 de los platos, lavar 3x con PBS seguido con 1x lavado utilizando medio de cultivo de células frescas. Semillas SCs en platos.
NOTA: La densidad de siembra para un plato con patrón de línea es de 5.000 células/cm2 y para un plato sin balancear es de 10.000 células/cm2. - Mantenga los SCs en las condiciones deseadas durante 48 h y siga los protocolos para preparar los lysates SC32.
NOTA: La densidad de siembra celular para platos sin patrón es 2 veces mayor que la de los platos con patrón de línea, ya que el plato con patrón de línea tiene sólo la mitad del área adhesiva celular del plato sin patrón.- Para preparar los lincesatos, transfiera el tampón adecuado de ensayo de radioinmunoprecipitación (RIPA) a un tubo de centrífuga cónica de 10 ml. Diluir la proteasa y el inhibidor de la fosfatasa (100x) a una proporción de 1:100 en el tampón RIPA, mezclar bien por pipeteo.
- Lavar las células con PBS frío con hielo (1x) durante 2 min, añadir 80 l de la solución preparada a partir del paso 1.2.23.1 en cada área adhesiva celular (el área que contactó con sellos PDMS y proteína adsorbida) dentro de los platos petri. Incubar las células con la solución en un bloque de hielo durante 15 min.
NOTA: La solución solo permanecerá en el área adhesiva celular debido a la hidrofobicidad de la adsorción Pluronic F-127 en otros lugares. Esta característica permite una extracción de proteínas exitosa y suficiente para los SCs con patrón de línea. - Raspar los SCs con un rascador de células durante 5 min. Recoger el lysate en un tubo de microcentrífuga de 1,5 ml etiquetado.
- El izado de microcentrífuga a 12.000 x g durante 15 min a 4oC. Recoger el sobrenadante con una pipeta de 1.000 l y transferir a un tubo de microcentrífuga limpia. Almacene el lesate de celda a -20 oC.
- Caracterización de sustratos
NOTA: Para caracterizar la mecánica del polímero en el cubreobjetos, generalmente se emplean múltiples métodos, incluyendo pruebas de compresión a granel11,33 o pruebas de microscopía de fuerza atómica34. Este protocolo describirá las pruebas de compresión masiva.- Vierta el precursor PDMS de la relación de mezcla deseada (paso 1.1) en una placa Petri de 30 mm, asegúrese de que el espesor de la capa PDMS dentro de la placa Petri sea de al menos 20 mm.
- Retire el plato Petri con PDMS solidificado de horno de 60oC después de 1 h y deje enfriar a temperatura ambiente. Corte el polímero en cuadrados de 10 mm x 10 mm. Mida el grosor de PDMS utilizando pinzas.
- Coloque PDMS en el escenario de la máquina de medición de fuerza de compresión. Enchufe el sensor de fuerza de compresión (modelo: 112C) al puerto del sensor y fije el sensor al eje de la máquina de prueba.
- Ajuste la altura del sensor a aproximadamente 0,5 cm por encima del sello PDMS utilizando el control "jog" en el panel frontal del instrumento.
- Abra el software asociado utilizando la ventana "Configuración de prueba", seleccione " Perfil deservo"y abra la ventana "Segmento". En la ventana "Segmento", introduzca la opción"Velocidad de control"deseada y"Cantidad final"para la prueba.
NOTA: La velocidad de control determina la velocidad a la que el sensor se desplaza hacia abajo hacia el PDMS. La cantidad final determina la distancia total que recorre el sensor. - Utilice el botón "Z"situado en el panel de control del software para restablecer todas las mediciones en este punto.
- Mueva el sensor hacia abajo para ponerse en contacto ligeramente con PDMS hasta que se carguen 1-2 newtons (N). La carga y la distancia que recorre el sensor se mostrarán en el software.
- Después de utilizar el botón "Z", ejecute la medición usando "Reproducir", y guarde la fuerza y la distancia de grabación de archivos.
- Repita los pasos 1.3.3 a 1.3.8 para cada condición experimental de PDMS.
- Abra el archivo y utilice la siguiente fórmula para calcular el módulo de Young (E) de PDMS para cada proporción. (F - fuerza de compresión, A - área del sello PDMS, ∆L - distancia de viaje del sensor y L0 - espesor original del sello PDMS).

2. Cuantificación de las propiedades celulares en sustratos sintonizables
- Ensayo de proliferación
- SCs de semillas en sustratos preparados a partir del paso 1.1.9 a una densidad de 5.000 células/cm2 en una placa de 6 pozos. Permita que los CC se incuban durante 48 h en condiciones de cultivo celular estándar (37 oC y 5% de CO2).
- Diluir 12 l de solución en stock de Bromodeoxyuridina (BrdU) de 10 mM en 12 ml de medio de cultivo celular de 37 oC, mezclar bien con pipeta para hacer una solución de etiquetado BrdU de 10 m.
- Retire el medio de cultivo celular y lave los SCs 2x con PBS.
- Añadir 2 ml de solución de etiquetado BrdU en cada pozo e incubar los SCs durante 2 h.
NOTA: El tiempo de incubación de la solución de etiquetado BrdU depende de la tasa específica de proliferación celular. La línea RT4-D6P2T SC tiene una alta tasa de proliferación por lo que se utilizaron 2 horas de tiempo de incubación. - Retire la solución de etiquetado BrdU y lave SCs 3x con PBS. Añadir 1 ml de 3.7% de formaldehído en PBS a cada pozo e incubar a temperatura ambiente durante 15 min para la fijación celular.
ADVERTENCIA: El formaldehído es un carcinógeno humano; por lo tanto, llevar a cabo todo el trabajo dentro de una campana de humo químico con la protección adecuada.
NOTA: Al lavar con PBS, no hay ningún medio de cultivo celular en el pozo, y por lo tanto la superficie PDMS puede ser hidrófoba. Tome precauciones para no secar completamente la superficie del sustrato para evitar daños celulares. - Aspirar la solución de formaldehído y lavar 3x con PBS (3 min cada uno). Retire PBS y agregue 1 mL de 0.2% Tritón X-100 en PBS a cada pozo para permeabilizar la membrana celular. Incubar SCs con solución Triton X-100 durante 20 minutos a temperatura ambiente.
- Retire la solución Triton X-100 y lave SCs 3x con PBS (3 min cada una).
- Añadir 1 ml de 1 N HCl en cada pozo e incubar sobre hielo durante 10 min. Retire 1 N HCl y agregue 1 ml de 2 N HCl en cada pozo e incubar a temperatura ambiente durante 10 min. El tratamiento de HCl es para hidrólisis de ADN.
- Mezclar 182 mL de 0,2 mM Na2HPO4 y 18 ml de ácido cítrico de 0,1 mM para producir un tampón de fosfato/ácido cítrico para la recuperación de antígenos. Retire 2 N HCl y agregue 1 ml de fosfato/tampón de ácido cítrico en cada pozo e incubar a temperatura ambiente durante 10 min.
- Lavar los SCs 3x con 0.2% Triton X-100 en PBS. Añadir 2 ml de albúmina sérica bovina (BSA) al 3% en PBS en cada pozo e incubar durante 30 minutos a temperatura ambiente para cronometrific la unión inespecífica del anticuerpo.
- Diluir el anticuerpo primario BrdU conjugado con Alexa Fluor 488 en una solución de BSA al 3% en una proporción de 1:300 para la solución de tinción BrdU. Incubar SCs con solución de tinción durante la noche a temperatura ambiente, mientras que la placa está cubierta de papel de aluminio.
- Para cuantificar la proliferación, imagine SCs utilizando el canal FITC y DAPI de un microscopio fluorescente para detectar BrdU y núcleos, respectivamente. Guarde las imágenes como archivos "nd.2".
- Abra archivos "nd.2" para cada imagen tomada en posiciones espaciales idénticas.
- Abra el software de análisis de imágenes. Haga clic con el botón derecho en el fondo para abrir la ventana "Resultados de medición automatizados" y "Medición automatizada" en la sección de " Control deanálisis".
- En el menú "Recuento y taxonomía", seleccione "Contar". En la imagen FITC, haga clic en cada núcleo que muestre la fluorescencia verde (BrdU positivo) y haga clic con el botón derecho en la imagen.
NOTA: El número de celdas positivas de BrdU se muestra en la ventana de"Automatizaciones y medidas". - Para las imágenes DAPI, repita el paso 2.1.14 para contar el número total de núcleos. Calcule el porcentaje de celdas positivas de BrdU para esta imagen.
- Repita los pasos 2.1.13 a 2.1.16 para otras imágenes con fines estadísticos y calcule el porcentaje medio de células positivas brdU para cada condición de sustrato.
- Cuantificación de la expresión c-Jun mediante análisis de imagen inmunofluorescente
- Las células preparadas dentro de las placas de 6 pozos de los pasos 1.1.9 y 1.2.23 se fijan y permeabilizan con los procedimientos descritos anteriormente (paso 2.1.5-2.1.7).
NOTA: Para realizar comparaciones precisas de la intensidad fluorescente entre celdas de diferentes condiciones de ECM, aplique la configuración de la cámara de forma idéntica en todas las muestras con todas las muestras con los mismos parámetros. - Guarde las imágenes como archivos ".nd2".
- Abra el software de análisis de imágenes. Haga clic con el botón derecho en el fondo para abrir la ventana "Resultados de medición automatizados" y "Medición automatizada" en la sección de " Control deanálisis".
- En "Resultados de medición automatizados", seleccione "Datos de objeto". Active el botón "Mantener la actualización dela medición".
- En el panel superior del software, seleccione"Medir"seguido de "Características del objeto". Agregue "Intensidad media" a la sección de " Seleccionadopara Medición".
- Abra y combine dos archivos de imagen ".nd2" que contienen imágenes de c-Jun y núcleos.
- En el panel superior, seleccione "ROI"y seleccione "Dibujar ROI rectangular". Dibuje un área rectangular que contenga el área nuclear de una sola célula.
NOTA: la expresión c-Jun se concentra en los núcleos35. - En el panel superior del software, seleccione"Binario"y"Definir umbral",aparecerá una nueva ventana para definir con precisión el área fluorescente c-Jun.
- En una ventana nueva, haga clic en "Imagen completa/Usar ROI"para cambiar el programa del modelo de imagen completa al modelo de ROI. Utilice "Intensidad" para ajustar la tabla de búsqueda situada en el lado izquierdo de la ventana para ajustar el tamaño/forma del área resaltada dentro del ROI rectangular.
NOTA: Tenga cuidado de asegurarse de que el tamaño/forma del área resaltada sea idéntica al núcleo. - Haga clic en el botón "OK", para obtener la intensidad media FITC en la ventana de"Resultados de medición automatizados"y luego haga clic en"Almacenar datos".
- En la ventana de"Medida automatizada","Eliminar objeto" para eliminar el área roja resaltada. En el panel lateral izquierdo, utilice"Herramienta de apuntamiento"para seleccionar el ROI rectangular y eliminar.
- Repita los pasos 2.2.6 a 2.2.11 para medir la intensidad media de FITC para cada celda adicional.
- En el área de la ventana de "Resultados de medición automatizados", seleccione "Almacenado"y se presentarán todos los datos almacenados. Utilice la función"Exportar"y seleccione"Datos a Excel"para guardar la hoja de cálculo exportada y realizar cálculos adicionales.
- Las células preparadas dentro de las placas de 6 pozos de los pasos 1.1.9 y 1.2.23 se fijan y permeabilizan con los procedimientos descritos anteriormente (paso 2.1.5-2.1.7).
- Cuantificar el alargamiento nuclear
- Corrija y permeabilice los SCs preparados a partir del paso 1.2.22 siguiendo los pasos 2.1.5-2.1.7. Realice la tinción nuclear utilizando un medio de montaje con DAPI.
- Usando el canal DAPI y una lente objetivo 40x, adquiera imágenes de la muestra y guárdelas como archivos ".nd2".
- Siga los pasos 2.2.3 y 2.2.4 para abrir la ventana"Resultados de medición automatizados"y"Medida automatizada"en el software de análisis de imágenes.
- En "Resultados de medición automatizados",utilice la función "Opción" seguido de "Seleccionar función de objeto". En la columna "Característica", seleccione "Elongation" y agregue a "Selected for Measurements" columna. Utilice"Mantener la medición de actualización"para activar esta función.
- Abra el archivo de imagen "nd.2" que contiene las imágenes nucleares. En la ventana"Medida automatizada",seleccione la función"Detección automática"y seleccione un núcleo. Haga clic con el botón derecho en la imagen y la relación de aspecto nuclear medida se mostrará en"Resultados de medición automatizados".
- Repita el paso 2.3.5 para cuantificar las relaciones de aspecto nuclear para otros núcleos dentro de la imagen. Seleccione"Almacenar datos"en la ventana de "Resultados de medición automatizados".
- Repita 2.3.5 a 2.3.6 para obtener imágenes adicionales. Exporte los datos a un archivo de hoja de cálculo como se hizo anteriormente en 2.2.13 para su análisis.
- Western blot para cuantificar la expresión proteica
- Siga los protocolos estándar para el análisis de manchas occidentales detallados en otro lugar32. Las diluciones de los anticuerpos utilizados en el estudio se muestran a continuación: Conejo anti-Jun 1:2,000; Ratón anti-actin 1:1,000; Conejo anti p75NTR 1:1,000; Proteína básica anti mielina de conejo 1:1,000; Anti-ratón/conejo IgG, anticuerpo ligado a HRP 1:10,000.
Resultados
Para analizar y cuantificar la interacción entre la rigidez del sustrato y la composición de proteínas en el fenotipo SC, se desarrolló un sustrato de cultivo celular PDMS sintonizable (Figura 1A). Pruebas de compresión del polímero en base diferente: se utilizaron relaciones de agente de curado para cuantificar el módulo del joven (E) del sustrato (Figura 1B). El rango resultante de los valores del módulo representa condiciones de sustrato fisiológicamente relevantes. Después de la preparación de los sustratos, se cultivaron SCs y se analizaron las propiedades celulares en el microambiente sintonizable. Primero se analizaron las tasas de proliferación de CC en sustratos de diferente composición proteica. Los sustratos recubiertos de Laminina dieron lugar a una mayor tasa de proliferación en comparación con el colágeno I y la adsorción de fibronectina, todo a 10 g/ml(Figura 2A,B). Los CC en sustratos con recubrimiento de laminina y módulos diferentes mostraron que los sustratos relativamente más blandos (E-3,85kPa) disminuyen las tasas de proliferación celular en todas las condiciones(Figura 2C,D). Sin embargo, las diferencias entre sustratos rígidos (E-1119kPa) y sustratos relativamente blandos (E-8,67kPa) eran insignificantes (Figura 2D).
Los CC también se analizaron para la expresión de proteínas a través de la inmunohistoquímica y la mancha occidental. Los niveles del factor transcripcional c-Jun fueron analizados por microscopía inmunofluorescente (Figura 3A) y representados por la intensidad media fluorescente del píxel (Figura 3B-D). La expresión c-Jun se demostró que estaba regulada a medida que los sustratos se volvían más blandos (E-1119 kPa a E-8,67 kPa), sin embargo, en los sustratos más blandos (E-3,85 kPa), la expresión c-Jun fue significativamente regulada. Sobre sustratos rígidos (E-1119 kPa), los sustratos recubiertos de colágeno I dieron lugar a la expresión c-Jun más alta, sin embargo, a medida que los sustratos se volvían más blandos (E-8,67 kPa y 3,85 kPa), laminina mostró los niveles más altos de c-Jun (Figura 3E). Western blot también se utilizó para analizar tanto la proteína básica c-Jun como la mielina (MBP) con los niveles de c-Jun regulados hacia arriba y MBP regulados en sustratos más blandos (Figura 3F). Además, las SEMILLAs de SCs en sustratos recubiertos de laminina dieron lugar a la expresión c-Jun más alta en comparación con el colágeno I y la fibronectina.
Las células de diferentes densidades de siembra se cultivaron y teñiron con rhodamine-faloideína para explorar el papel de la propagación celular y el área en la expresión c-Jun (Figura 4A,B). Para controlar el alargamiento nuclear de las células, se utilizó una técnica común de micropatrón (impresión de microcontactos36)para crear líneas adhesivas celulares en los sustratos de cultivo celular. Se demostró que la relación de aspecto nuclear de las células sembradas en un sustrato con patrón de línea era significativamente mayor que las células sembradas en sustratos sin patrón(Figura 4C,D). Se encontró que la expresión de c-Jun y otro marcador significativo en los fenotipos regenerativos SC, receptor de neurotrofina p75 (p75 NTR), fueron regulados en células densas con un área de propagación más pequeña (Figura 4E). Las celdas con patrón de línea también dieron lugar a una expresión más alta de C-Jun y p75 NTR en comparación con las celdas no nutridas (Figura 4F). Por lo tanto, se crearon geometrías adhesivas celulares impresas de microcontacto para controlar con precisión el área de propagación celular y el alargamiento, al tiempo que se eliminan las interacciones entre células (Figura 5A). Las dimensiones de las áreas totales de adhesivos celulares fueron de 900 m2, 1.600 m2y 2.500m2 con una relación de aspecto de 1 o 4 (longitud de celda: anchura de celda). La tinción fluorescente de albúmina sérica bovina (fBSA, Texas red) se utilizó para revelar el estado de las micropatrón en el sustrato de cultivo celular después de la impresión de microcontactos (Figura 5B). Se midió la relación de aspecto nuclear de las CC para cada área celular y se demostró que al aumentar la relación de aspecto nuclear, la elongación celular aumenta(Figura 5C). Además, a medida que la relación de aspecto SC aumentó, c-Jun se reguló(Figura 5D). Curiosamente, sin embargo, se encontró que a medida que el área de propagación celular aumenta la expresión c-Jun se regula hacia abajo (Figura 5E). La tinción de inmunofluorescencia tanto para los núcleos como para el área de propagación celular confirmada por actina y el alargamiento fueron altamente controladas a través de este método de micropatrrina(Figura 5F).

Figura 1: Sustratos de cultivo celular con rigidez sintonizable y composición proteica. (A) Esquema que muestra el desarrollo de sustratos de cultivo celular PDMS. (B) La relación de mezcla inicial de PDMS de base: agente de curado determina el módulo de Young. Haga clic aquí para ver una versión más grande de esta figura.
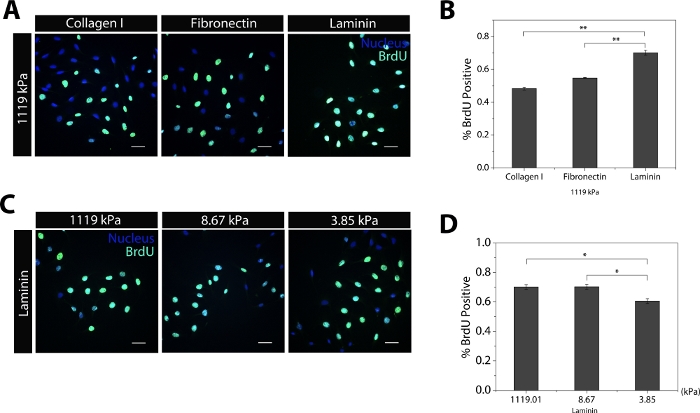
Figura 2: Tasas de proliferación de SC reguladas por rigidez del sustrato y composición de proteínas. (A) Imágenes representativas que muestran la tinción de BrdU cuando se cultivan en sustratos del mismo módulo. (B) Histograma que muestra el porcentaje de células positivas BrdU para cada recubrimiento proteico. (C) Imágenes representativas que muestran la incorporación de BrdU en SCs sembrados en sustratos del mismo recubrimiento proteico. (D) Histograma que muestra el porcentaje de celdas positivas BrdU para el valor del módulo de cada joven. Barras de escala a 50 m. Los datos se presentan como medias de SEM. *p < .05, **p < .005, ***p < .0005. Partes de la figura se han modificado de la referencia24. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Rigidez del sustrato y expresión de proteína SC regulada por proteínas. (A) Las imágenes representativas muestran la tinción por inmunofluorescencia c-Jun para las CC sembradas en sustratos de diferente rigidez y composición proteica. La intensidad media fluorescente de píxeles de c-Jun se midió para los SCs sembrados en (B) colágeno I (C) fibronectina y (D) sustratos recubiertos de laminina de diferente rigidez. (E) c-Jun nivel de fluorescencia de SCs agrupado por el módulo de sustrato de Young. (F) Mancha occidental que muestra c-Jun y proteína básica de mielina (MBP) de SCs sembrados en sustratos. Glyceraldehyde 3-fosfato deshidrogenasa (GAPDH) se utilizó como control de carga. Barra de escala a 50 m. Los datos se presentan como medias de SEM. *p < .05, **p < .005, ***p < .0005. Partes de la figura se han modificado de la referencia24. Haga clic aquí para ver una versión más grande de esta figura.
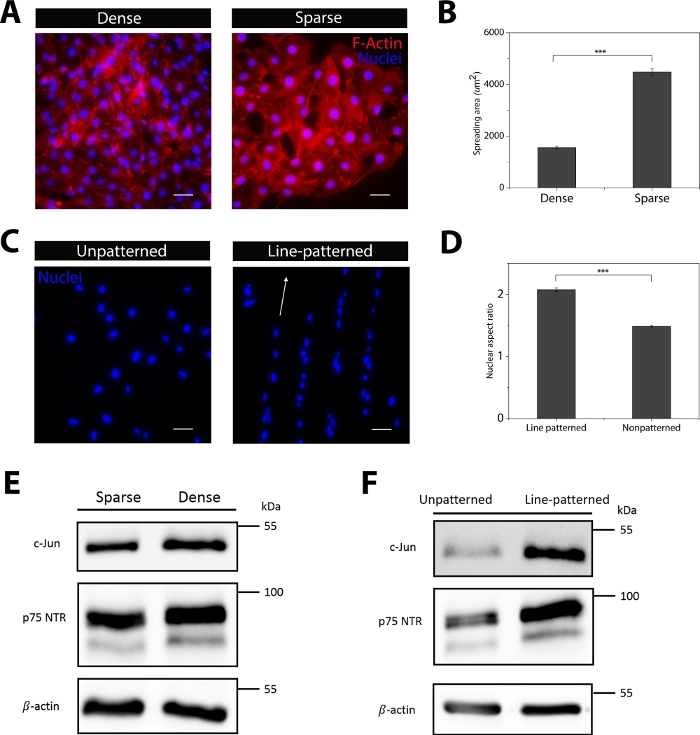
Figura 4: El área de propagación celular influye en la expresión proteica de los CC. (A) El área de propagación celular de diferentes densidades de siembra se visualizó a través de la rodamina-faloideina (rojo) y la tinción de núcleos (azul). (B) Histograma que muestra el área de propagación promedio de los CC en cada condición. (C) Los núcleos de SCs sembrados en sustratos sin patrón o con patrón de línea se teñiron con DAPI (azul) para mostrar morfología. (D) Histograma que muestra la cuantificación de la relación de aspecto nuclear en sustratos estampados y sin patrón. (E) Mancha occidental que muestra la expresión de c-Jun y p75NTR de células con diferentes áreas de propagación. (F) Mancha occidental que muestra la expresión proteica de los CER en sustratos sin patrón y de línea. Barra de escala a 50 m. Los datos se presentan como medias de SEM. *p < .05, **p < .005, ***p < .0005. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: La morfología de SC y la elongación afectan a la expresión c-Jun de las SC. (A) Esquema que muestra la micropatrón de celdas para formas de diferente relación de aspecto. (B) tinción fBSA (rojo) que muestra la forma de los micropatrón tras la impresión de microcontactos. Barra de escala a 10 m. (C) Histograma que muestra la relación de aspecto nuclear de las CC micropatrnadas. (D, E) Histograma que muestra la intensidad fluorescente del píxel medio de c-Jun para cada una de las condiciones geométricas. (F) Rhodamine-phalloidin (rojo), núcleos (azul) y c-Jun (verde) se teñiron en los diferentes micropatrón. Barra de escala a 10 m. Los datos se presentan como medias de SEM. *p < .05, **p < .005, ***p < .0005. Partes de la figura se han modificado de la referencia24. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los CC pueden promover la regeneración nerviosa debido a su transformación fenotípica y potencial regenerativo después de una lesión nerviosa. Sin embargo, la forma en que las señales ECM regulan esta capacidad regenerativa sigue siendo en su mayoría poco clara, lo que puede obstaculizar no sólo el desarrollo de biomateriales que tienen como objetivo promover la regeneración nerviosa, sino también la comprensión de los mecanismos involucrados en la regeneración nerviosa. Para comenzar a examinar esta interacción, se crearon sustratos de cultivo celular donde se pueden controlar las señales de ECM, como la rigidez, el recubrimiento proteico y la topografía adhesiva. La capacidad de micropatrnografía adhesiva es una característica clave dentro del protocolo, utilizando el método común de impresión de microcontactos. Sin embargo, este sustrato es diferente del vidrio en que la fuerza de compresión que se aplica a los sellos PDMS debe estar en un nivel adecuado para lograr la forma deseada de áreas adhesivas celulares en sustratos de cultivo celular. El uso de albúmina sérica bovina fluorescente (fBSA) como proteína modelo para visualizar las áreas adhesivas celulares y ajustar las fuerzas de compresión en los sellos PDMS puede, en última instancia, mitigar este problema. Otra diferencia clave del vidrio es la eliminación del exceso de Pluronic F-127 que se utiliza para hacer que el resto del sustrato no sea adhesivo. Después de este tratamiento, los sustratos de cultivo celular son altamente hidrófobos, por lo que es difícil mantener sustratos de cultivo celular húmedo en todos los lavados, lo que es importante para la integridad estructural de la proteína micropatrnada37. Por lo tanto, se recomienda utilizar varias pipetas para aspirar e inyectar soluciones casi simultáneamente para evitar que los sustratos se deshidratan por completo.
Aunque el micropatrón puede controlar con precisión la forma celular y no requiere procedimientos sintéticos complicados utilizando polímeros de bloqueo celular como OEGMA, los métodos utilizados para cuantificar la expresión proteica de las células micropatrnadas a veces son limitados38. Por ejemplo, las muestras que están disponibles a partir de micropatrnografía generalmente se limitan a unos pocos cientos de células por cubreobjetos, lo que es inadecuado para preparar los listos celulares que se utilizarán para manchas occidentales o qPCR. Teniendo en cuenta esto, la tinción de inmunofluorescencia por sí sola se utilizó para cuantificar la expresión de proteínas para las células micropatrnadas, limitando la variedad de proteínas que se pueden cuantificar. Para abordar esto, utilizamos patrones de línea para promover el alargamiento celular para poblaciones celulares más grandes y preparamos con éxito los linsates celulares que fueron analizados por la mancha occidental. También se pueden aplicar otros métodos como campos eléctricos aplicados o fibras electrospun alineadas para controlar el alargamiento de las poblaciones celulares39,,40. Sin embargo, los campos eléctricos pueden no encajar en todas las aplicaciones para las CNGC, ya que la conductividad de los biomateriales de uso común, como el polímero a base de colágeno y laseda,es muy baja28,41,42. Por el contrario, las nanofibras electrospun alineadas se han implantado con éxito en las CNGC para promover la alineación, elongación y migración de SC, así como el crecimiento de la neurita43,,44. También puede resultar convincente comparar el comportamiento de SC en sustratos con patrón de línea con los de sustratos con nanofibras alineadas, ya que los patrones forrados y las nanofibras alineadas son dos de los mecanismos de orientación más comunes incorporados en las CNG45.
El protocolo de micropatrnografía detallado utiliza cubreobjetos recubiertos de PDMS como sustratos de cultivo celular, con una superficie máxima El módulo de Young de 1119 kPa. Tal rigidez imita muchos tejidos, sin embargo, puede no ser posible modelar la osteogénesis de células madre mesenquimales, que generalmente requieren que el módulo de la superficie Young supere 1 Gpa46. Para tales situaciones, el vidrio es un candidato alternativo, sin embargo, la adsorción de Pluronic F-127 requiere una hidrofobicidad superficial relativamente alta que el vidrio no posee. Para aumentar la hidrofobicidad, el vidrio se puede tratar con dimetil diclorosilano en diclorobenceno. Después de esto, el tratamiento UV-Ozono se puede utilizar para aumentar la hidrofilia para la impresión de microcontactos47.
En última instancia, se desarrolló una plataforma de cultivo celular donde los estímulos ECM se pueden ajustar individualmente con la expresión de proteínas cuantificada. Hemos determinado que la capacidad regenerativa de SC es promovida por ciertas señales ECM mecánicas y químicas, que posteriormente pueden proporcionar inspiración en el diseño futuro de aplicaciones de biomateriales como las CNG y los procesos de trasplante celular donde las características de ECM pueden necesitar ser optimizadas24. No obstante, ajustar estas señales de ECM puede ser una tarea difícil, particularmente in vivo. En el futuro, esta plataforma se puede utilizar para analizar los mecanismos clave implicados en la transición fenotípica de los CC regulada por el ECM. Para ello, la manipulación de las señales intracelulares puede ser posible promover la capacidad regenerativa de SC sin necesidad de plataformas específicas in vitro48,49. Esto tiene el potencial de un trabajo innovador en el desarrollo de tecnologías para la reparación de los nervios.
Divulgaciones
Los autores no informaron de un posible conflicto de intereses.
Agradecimientos
Los autores agradecen el apoyo de la Universidad de Cincinnati. Los autores también agradecen a Ron Flenniken, del laboratorio de caracterización de materiales avanzados de la Universidad de Cincinnati, por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Albumin from Bovine Serum (BSA), Texas Red conjugate | Thermo Fisher Scientific | A23017 | BSA staining to show micropatterns |
| Anti-mouse IgG, HRP-linked Antibody | Cell Signaling Technology | 7076S | Antibody used for western blot analysis |
| Anti-rabbit IgG, HRP-linked Antibody | Cell Signaling Technology | 7074S | Antibody used for western blot analysis |
| BrdU | Thermo Fisher Scientific | B23151 | Reagent used to measure cell proliferation |
| BrdU primary antibody conjugated with Alexa Fluor 488 | Thermo Fisher Scientific | B35130 | Used to visualize BrdU in cell proliferation assays |
| Collagen I | Thermo Fisher Scientific | A10483-01 | Protein used to coat coverslips |
| Compression force test machine | TestResources | Instrument to quantify mechanical properties of polymers | |
| Dulbecco's Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | Cell culture medium |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | Cell culture medium supplemental |
| Fibronectin | Thermo Fisher Scientific | 33010-018 | Protein used to coat coverslips |
| Fluorescence microscope | Nikon | Eclipse Ti2 | Fluorescence microscope |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | 78440 | Protease and Phosphatase Inhibitor |
| Laminin | Thermo Fisher Scientific | 23017015 | Protein used to coat coverslips |
| Mounting medium with DAPI | Thermo Fisher Scientific | P36971 | Coverslip mountant and nuclei staining |
| Mouse c-Jun primary antibody | Thermo Fisher Scientific | 711202 | Primary antibody to visualize c-Jun protein |
| Mouse β-Actin primary antibody | Cell Signaling Technology | 3700S | Loading control for western blot experiments |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Cell culture medium supplemental |
| Photoresist SU 2010 | KAYAKU | SU8-2010 | Photoresist |
| Pluronic F-127 | Sigma Aldrich | P-2443 | Block non-specific protein binding |
| Rabbit c-Jun primary antibody | Cell Signaling Technology | 9165S | Primary antibody for visualization of c-Jun protein |
| Rabbit myelin basic protein primary antibody | Abcam | ab40390 | Primary antibody for visualization of MBP |
| Rabbit p75NTR primary antibody | Cell Signaling Technology | 8238S | Primary antibody for visualization of p75NTR |
| Rhodamine phalloidin | Thermo Fisher Scientific | R415 | Visualization of cell cytoskeleton |
| RIPA buffer | Abcam | ab156034 | Cell lysis buffer |
| RT4-D6P2T Schwann cell line | ATCC | CRL-2768 | Cell line used in experiments |
| SYLGARD 184 PDMS base and curing agent | Sigma Aldrich | 761036 | Tunable polymer used to coat coverslips |
| Trypsin | Thermo Fisher Scientific | 15090-046 | Cell dissociation reagent |
| UV-Ozone cleaner | Novascan | Increase hydrophicility of PDMS | |
| Versene (1x) | Thermo Fisher Scientific | 15040066 | Cell dissociation reagent |
Referencias
- Taylor, C. A., Braza, D., Rice, J. B., Dillingham, T. The Incidence of Peripheral Nerve Injury in Extremity Trauma. American Journal of Physical Medicine & Rehabilitation. 87, 381-385 (2008).
- Noble, J., Munro, C. A., Prasad, V. S. S. V., Midha, R. Analysis of Upper and Lower Extremity Peripheral Nerve Injuries in a Population of Patients with Multiple Injuries. Journal of Trauma and Acute Care Surgery. 45, 116-122 (1998).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594, 3521-3531 (2016).
- Arthur-Farraj, P. J., et al. c-Jun Reprograms Schwann Cells of Injured Nerves to Generate a Repair Cell Essential for Regeneration. Neuron. 75, 633-647 (2012).
- Jessen, K. R., Mirsky, R. The Success and Failure of the Schwann Cell Response to Nerve Injury. Frontiers in Cell Neurosciences. 13, 33(2019).
- Gomez-Sanchez, J. A., et al. After Nerve Injury, Lineage Tracing Shows That Myelin and Remak Schwann Cells Elongate Extensively and Branch to Form Repair Schwann Cells, Which Shorten Radically on Remyelination. Journal of Neuroscience. 37 (37), 9086-9099 (2017).
- Deumens, R., et al. Repairing injured peripheral nerves: Bridging the gap. Progress in Neurobiology. 92, 245-276 (2010).
- Höke, A., Gordon, T., Zochodne, D. W., Sulaiman, O. A. R. A decline in glial cell-line-derived neurotrophic factor expression is associated with impaired regeneration after long-term Schwann cell denervation. Experimental Neurology. 173, 77-85 (2002).
- Jones, S., Eisenberg, H. M., Jia, X. Advances and future applications of augmented peripheral nerve regeneration. International Journal of Molecular Sciences. 17, 1-17 (2016).
- Harris, G. M., et al. Nerve Guidance by a Decellularized Fibroblast Extracellular Matrix. Matrix Biology. 60-61, 176-189 (2017).
- Harris, G. M., Piroli, M. E., Jabbarzadeh, E. Deconstructing the Effects of Matrix Elasticity and Geometry in Mesenchymal Stem Cell Lineage Commitment. Advanced Function Mater. 24 (16), 2396-2403 (2014).
- Pryzhkova, M. V., Harris, G. M., Ma, S., Jabbarzadeh, E. Patterning pluripotent stem cells at a single cell level. Journal of Biomaterials and Tissue Engineering. 3 (4), 461-471 (2013).
- Engler, A. J., Sweeney, H. L., Discher, D. E., Schwarzbauer, J. E. Extracellular matrix elasticity directs stem cell differentiation. Journal of Musculoskeleton and Neuronal Interaction. 7 (4), 335(2007).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Pickup, M. W., Mouw, J. K., Weaver, V. M. The extracellular matrix modulates the hallmarks of cancer. EMBO Reports. 15, 1243-1253 (2014).
- Chernousov, M. A., Carey, D. J. Schwann cell extracellular matrix molecules and their receptors. Histology and Histopathology. 15, 593-601 (2000).
- Shibata, S., et al. Selective Laminin-Directed Differentiation of Human Induced Pluripotent Stem Cells into Distinct Ocular Lineages. Cell Reports. 25 (6), 1668-1679 (2018).
- Mcbeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell Shape, Cytoskeletal tenstion and RhoA regulate stem cell lineage committment. Developmental Cell. 6, 483-495 (2004).
- Halder, G., Dupont, S., Piccolo, S. Transduction of mechanical and cytoskeletal cues by YAP and TAZ. Nature Reviews Molecular Cell Biology. 13, 591-600 (2012).
- Jessen, K. R., Mirsky, R. The repair Schwann cell and its function in regenerating nerves. Journal of Physiology. 594 (13), 3521-3531 (2016).
- Lopez-Fagundo, C., Bar-Kochba, E., Livi, L. L., Hoffman-Kim, D., Franck, C. Three-dimensional traction forces of Schwann cells on compliant substrates. Journal of The Royal Society Interface. 11, 20140247(2014).
- Gu, Y., et al. The influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials. 33, 6672-6681 (2012).
- Xu, Z. Y., Orkwis, J. A., DeVine, B. M., Harris, G. M. Extracellular matrix cues modulate Schwann cell morphology, proliferation, and protein expression. Journal of Tissue Engineering and Regenerative. , (2019).
- Urbanski, M. M., et al. Myelinating glia differentiation is regulated by extracellular matrix elasticity. Scientific Reports. 6, 1-12 (2016).
- Sun, Y., et al. Tunable stiffness of graphene oxide/polyacrylamide composite scaffolds regulates cytoskeleton assembly. Chemical Sciences. 9 (31), 6516-6522 (2018).
- Hwang, J. H., et al. Extracellular matrix stiffness regulates osteogenic differentiation through MAPK activation. PLoS One. 10, 1-16 (2015).
- Ryan, A. J., et al. A Physicochemically Optimized and Neuroconductive Biphasic Nerve Guidance Conduit for Peripheral Nerve Repair. Advanced Healthcare Materials. 6, 1-13 (2017).
- Du, J., et al. Prompt peripheral nerve regeneration induced by a hierarchically aligned fibrin nanofiber hydrogel. Acta Biomaterialia. 55, 296-309 (2017).
- Huang, L., et al. A compound scaffold with uniform longitudinally oriented guidance cues and a porous sheath promotes peripheral nerve regeneration in vivo. Acta Biomaterialia. 68, 223-236 (2018).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Jouranl of Visualized Experiments. (119), e55276(2017).
- Gupta, R., et al. Shear stress alters the expression of myelin-associated glycoprotein (MAG) and myelin basic protein (MBP) in Schwann cells. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 23, 1232-1239 (2005).
- Harris, G. M., Shazly, T., Jabbarzadeh, E. Deciphering the combinatorial roles of geometric, mechanical, and adhesion cues in regulation of cell spreading. PLoS One. 8 (11), (2013).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Schreck, I., et al. C-Jun localizes to the nucleus independent of its phosphorylation by and interaction with JNK and vice versa promotes nuclear accumulation of JNK. Biochemical and Biophysical Research Communications. 407, 735-740 (2011).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. Journal Visualized Experiments. (22), e1065(2008).
- Treter, J., et al. Washing-resistant surfactant coated surface is able to inhibit pathogenic bacteria adhesion. Applied Surface Science. 303, 147-154 (2014).
- Lutz, J. F. Polymerization of oligo(ethylene glycol) (meth)acrylates: Toward new generations of smart biocompatible materials. Journal of Polymer Science Part A: Polymer Chemistry. 46 (11), 3459-3470 (2008).
- Marcus, M., et al. Interactions of Neurons with Physical Environments. Advanced Healthcare Materials. 6, (2017).
- Pu, J. Golgi polarization in a strong electric field. Journal of Cell Science. 118, 1117-1128 (2005).
- Blaker, J. J., et al. Bioactive Silk-Based Nerve Guidance Conduits for Augmenting Peripheral Nerve Repair. Advanced Healthcare Materials. 7, 1800308(2018).
- Daly, W., Yao, L., Zeugolis, D., Windebank, A., Pandit, A. A biomaterials approach to peripheral nerve regeneration : bridging the peripheral nerve gap and enhancing functional recovery. Journal of the Royal Society of Interface. 9 (67), 202-221 (2012).
- Xia, H., et al. Directed neurite growth of rat dorsal root ganglion neurons and increased colocalization with Schwann cells on aligned poly(methyl methacrylate) electrospun nanofibers. Brain Research. 1565, 18-27 (2014).
- Wang, H. B., Mullins, M. E., Cregg, J. M., McCarthy, C. W., Gilbert, R. J. Varying the diameter of aligned electrospun fibers alters neurite outgrowth and Schwann cell migration. Acta Biomaterialia. 6, 2970-2978 (2010).
- Carvalho, C. R., Oliveira, J. M., Reis, R. L. Modern Trends for Peripheral Nerve Repair and Regeneration: Beyond the Hollow Nerve Guidance Conduit. Frontiers in Bioengineering and Biotechnology. 7, 337(2019).
- Yang, Y., Wang, K., Gu, X., Leong, K. W. Biophysical Regulation of Cell Behavior - Cross Talk between Substrate Stiffness and Nanotopography. Engineering. 3, 36-54 (2017).
- Tan, J. L., Liu, W., Nelson, C. M., Raghavan, S., Chen, C. S. Simple Approach to Micropattern Cells on Common Culture Substrates by Tuning Substrate Wettability. Tissue Engineering. 10, 865-872 (2004).
- Grove, M., et al. YAP/TAZ initiate and maintain schwann cell myelination. Elife. 6, 1-27 (2017).
- Poitelon, Y., et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells. Nature Neuroscience. 19, 879-887 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ISSN 2578-2614
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.