Method Article
Murine Kardiyak Perisitlerin İzolasyon ve Safifikasyonu
Bu Makalede
Özet
Temel araştırma ve biyoloji ve tedavi potansiyelini araştırmak için murine kardiyak perisitleri izole etmek ve arındırmak için bir protokol optimize ettik.
Özet
Perisitlerin, mikrodamarların ve kılcal damarların perivasküler hücreleri, anjiyogenez, damar stabilizasyonu ve endotel bariyer bütünlüğünde rol oynadığı bilinmektedir. Ancak, kalpte dokuya özgü işlevleri iyi anlaşılamamıştır. Ayrıca, kardiyak kökenli perisitleri izole etmek ve arındırmak için kolayca erişilebilen malzemeler kullanan bir protokol de bulunmamaktadır. Protokolümüz, yaygın olarak kullanılan memeli modeli fareyi hücre kaynağımız olarak kullanmaya odaklanıyor. Enzimatik sindirim ve kalp dokusunun mekanik dissociation kullanarak, daha fazla floresan aktive hücre sıralama (FACS) işaretleri bir bolluk tarafından saflaştırılmış bir ham hücre karışımı elde etti. Perisitler için tek bir kesin belirteç olmadığından, CD31 - CD34- CD45-CD140b+NG2+CD146+olan hücreler için kapılı . Arınmayı takiben, bu birincil hücreler morfoloji ve marker ekspresyonunda herhangi bir değişiklik olmaksızın birden fazla kez kültürlendi ve geçirildi. Protokolümüzü kullanarak primer minrosi kardiyak perisitleri düzenli olarak elde edebilme yeteneğiile, perisitlerin kardiyovasküler fizyolojideki rolünü ve tedavi potansiyelini daha iyi anlamayı umuyoruz.
Giriş
Perisit olarak bilinen perivasküler hücreler vasküler ağacın mikrodamarlarını ve kılcal damarlarını çevreler1,2. Fizyolojik olarak, onlar teşvik etmek ve anjiyogenez bir rol oynamak için bilinen, endotel hücreleri ile yakın ilişki nedeniyle bariyer bütünlüğünü artırmak yanı sıra stabilize ve olgun damarlar1,2. Ayrıca, disfonksiyon ve / veya bu hücrelerin kaybı Alzheimer hastalığı 2 gibi hastalıklarda karıştığı olmuştur2,3 ve çeşitli kardiyovasküler hastalıklar4. Bu hücreler tüm vücutta bulunur, ancak hücre numaraları dokuya bağlıdır. Perisitler en önemlisi kan-beyin bariyerinin yüksek vaskülarizasyon nedeniyle beyinde çalışılmıştır1,2. Ancak, kalpte perisitlerin biyolojisi incelenmiştir.
Son zamanlarda, kardiyak perisitler için alanında artan ilgi vardır, ama şu anda biyolojien çok kullanılan araçlardan biri onların izolasyon için kullanılabilir aerodinamik protokol yoktur - fare. Beyinden perisitlerin izole ile ilgili literatürde protokoller vardır5, retina6, plasenta7, ve iskelet kası8,9; ancak, birkaç protokolleri kalpten perisit izole vardır. Kardiyak perisitleri izole eden çeşitli gruplar vardır. Nees ve ark. fare de dahil olmak üzere birden fazla tür kardiyak perisit bol miktarda izole başardık; ancak, kendi yöntemleri tekrarlanabilirlik10azaltır house dahili ekipman kullanılır. Avolio ve ark.11, Chen ve ark.12, ve Baily ve ark.13 de başarıyla insan kalp dokusundan kardiyak perisit izole, ama insan dokuları her zaman mevcut değildir ve bazı araştırmacılar için elde etmek zor. Burada, araştırmacıların biyolojilerini hazır malzemelerle daha fazla incelemeleri için fare modellerinden kardiyak perisit elde etmek için bir izolasyon yöntemi geliştirdik.
Bilinen anahtar perisit belirteçleri14ile enzimatik sindirim ve floresan aktif hücre sıralama (FACS) kullanarak, protokolümüz bize izole ve CD31 ile karakterize perisitlerin bir popülasyon arındırmak için izin verir-CD34-CD45- CD140b+NG2+CD146+ . İşaretleyiciler panelimiz hem dahil etme hem de dışlama işaretleri içerir. CD45 hematopoetik hücreleri dışlamak için bir belirteç olarak kullanılır. CD31 endotel hücrelerini dışlamak için bir belirteç olarak kullanılır. CD34 hem hematopoetik hem de endotel dölhücrelerini dışlamak için bir belirteç olarak kullanılır. CD146 perivasküler hücreler için bir belirteçtir. Son olarak, NG2 ve CD140b (ayrıca trombosit kaynaklı büyüme faktörü reseptörü beta olarak da bilinir— PDGFRβ) perisitler için kabul edilen belirteçleri 14 . Elde edilen birincil kültür, morfoloji veya marker ekspresyonunda değişiklik olmadan birden çok kez kültürlenebilir ve geçilebilir. Ayrıca, bu hücreler, etkileşimlerini incelemek ve birbirleriyle çapraz konuşmak için endotel hücreleri ile birlikte kültürlenebilir. Bu hücre izolasyon yöntemi araştırmacılar ın yabani tip, hastalık ve genetik varyant fare modellerinden kardiyak perisitlerin biyolojive patofizyolojisini incelemelerine olanak sağlayacaktır.
Protokol
Tüm hayvanlar, Laboratuvar Hayvan Bakımı Uluslararası (AAALAC) akredite tesisi Değerlendirme ve Akreditasyon Derneği'nde barındırılan ve kullanılan ve tüm hayvan çalışmaları uygun veteriner gözetimi altında ve Kurumsal Hayvan altında yapılmıştır Bakım ve Kullanım Komitesi (IACUC) Amgen A.Ş. protokolünü onayladı.
1. Araç ve Kültür Medyasının Hazırlanması
- Otoklav cerrahi 9 cm düz ucu ince nokta makası ve 10 cm açılı tırtıklı forceps.
- 500 mL kalsiyum magnezyum içermeyen Dulbecco'nun fosfat-tamponlu salinine (CMF-DPBS) 25 mL fetal sığır serumu (FBS) ve 5 mL %1 penisilin streptomisin (P/S) ekleyin. Kullanım sırasında soğuk olmasını sağlamak için çözeltiyi bir buz banyosuna yerleştirin. Aliquot 50 mL kalp izolasyonu için 50 mL konik tüp içine. 50 mL aliquot içine 250 adet/mL heparin sodyum çözeltisi ekleyin. Buna heparinize CMF-DPBS olarak anılacaktır.
- 500 mL'lik yüksek glikozlu Dulbecco'nun modifiye kartal ortamına (DMEM) %20 FBS (100 mL) ve %1 P/S (5 mL) ekleyin. Bu enzimsiz kültür medya olarak anılacaktır. Aliquot 20 mL DMEM + %20 FBS + %1 P/S ve kollajenaz B 500 μg/mL ekleyin. Bu enzim çözeltisi olarak anılacaktır. Hem enzimiçermeyen kültür ortamını hem de enzim çözeltisini 37 °C'de bir kuvözde veya su banyosunda sıcak tutun.
2. Hayvan Ve Kardiyak Doku Temini Hazırlanması
- İntraperitoneally 31 G iğne şırınga ile 250 adet heparin sodyum çözeltisi ile bir fare enjekte. Ardından fare ev kafesinde aktif kalırken 10−15 dk bekleyin.
NOT: Bu çalışmada 4 aylık erkek C57BL/6 fareden elde edilen temsili veriler elde edilebildi. Ancak, bu protokol ne olursa olsun gerginlik, yaş, cinsiyet, ağırlık, vb herhangi bir fare üzerinde kullanılabilir. - % 5 izoflurane ile fare anestezik. Çimdik refleksi ile farenin anestezi derinliğini kontrol edin.
- Anestezili fareyi supine pozisyonunda yerleştirin ve ön ayaklarını bantlayın. Göğüs boşluğunu dikkatlice açın ve 25 G kelebek iğnesi kullanarak alçalan aortu kanüle edin.
- Sağ atriyumda bir çentik yapın ve 2 mL/dk'da en az 20 mL 250 birim/mL heparinize CMF-DPBS ile kalbe değişken akışlı peristaltik pompa saptan. PBS sağ atria temiz çıktığında, perfüzyon tamamlanır.
- Kalbi aorttan kesin ve buz gibi CMF-DPBS'ye yerleştirin.
3. Kalp Dokusunun Dissociasyonu
- Kalbi 15 cm x 15 cm Petri kabına aktarın. Kalbi, yay makası ve ince nokta forsepslerini kullanarak parçaları (10−15 mL) kaplayacak kadar enzim çözeltisi kullanarak küçük parçalara (1 mm/adet) kesin.
- Parçaları ve çözeltiyi 50 mL konik bir tüpe aktarın, parafin plastik filmle mühürleyin ve 37 °C'de 120 rpm'de 75 dakika boyunca bir orbital shaker'da kuluçkaya yatırın.
- Enzim çözeltisi ile kollajenaz sindirim sonra, yeni bir 50 mL tüp içine 100 μm hücresüz ile sıvı decant ama parçaları kurumasını sağlamak için yeterli çözüm bırakın.
- İnce nokta forceps kullanarak, tüp ten doku çıkarmak ve bir mikroskop slayt üzerine birkaç parça yerleştirin. Sonra iki mikroskop slaytlar arasında doku kırmak için doku eziyet. Yeni bir 50 mL konik tüp içine enzimsiz kültür medya ile slaytlar durulayın.
- Tüm doku parçaları ayrıştırılıncaya kadar adım 3.4 tekrarlayın.
- 3.3−3.5 adımlarından gelen çözümleri tek bir tüpte birleştirin. Ortaya çıkan süspansiyonu 100 m hücreli süzgeçten yeni bir 50 mL konik tüpe zorlayın.
- Santrifüj 220 x g, 4 °C, 5 dk. Önceki çözelti kapalı aspire ve taze enzimiçermeyen kültür medya hücre pelet yavaşça askıya.
- Hücreleri sayın ve hücre sayacı kullanarak canlılığı kontrol edin. 500 mL DPBS ve 10−25 mL 2−5% büyükbaş hayvan serum albumini (BSA) içeren soğuk FACS boyama tamponu ile hücreleri 1 x 10 6/mL'ye seyreltin. Hücreler lekelenmeye ve sıraya girmeye hazırdır.
4. Facs kullanarak Ham Hücre Karışımından Perisitar
- Tüm kontroller ve hücre örnekleri için 5 mL FACS tüpleri hazırlayın ve etiketleyin. Lekesiz bir örnek için hücreleri (tüp başına 1 mL) aliquot, floresan eksi bir (FMO) kontrolleri ve isotip uyumlu kontroller için. Sıralama için kalan hücreleri kullanın. Tüm kontroller ve numuneler aynı anda hazırlanabilir ve elde edilebilir.
Not:0,5 x 10'da toplam 13 mL6hücreleri/mL'si tek kalpten temsili sıralama için kullanılmıştır. Ancak, hacim araştırmacı onların izolasyon elde kaç hücre bağlıdır, kaç kalp kullanmak, ve ne kadar iyi kalp dokusu sindirilir; her kalbin boyutu da hacmi ni değiştirebilecek bir değişkendir.- Floresan telafikontrollerini optimize etmek için tazminat boncukları (Malzeme Tablosu) kullanın. 5 mL FACS etiketli bir tüpte deneydeki her florokrom için bir telafi kontrolü hazırlayın. Bu deney için toplam 9 telafi kontrolü hazırlayın — 2 çeşit lekesiz boncuk artı NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 ve hücre canlılığı-APC-Cy7 dahil olmak üzere işaret panelinden 7 farklı florokrom ( Malzeme Tablosu).
- Sıkma şişesinden her tüpe bir damla tazminat boncukları (~ 50°L) ekleyin. Daha sonra boncuklara 1 μL antikor ekleyin. Marker panelinden her antikor için tekrarlayın. Darbe girdapları ile şiddetle karıştırın. Oda sıcaklığında ışıktan korunan hücre canlılığı boncukları dışında 4 °C'de 30 dakika boyunca ışıktan korunur.
- Daha sonra, her tüpe 3 mL FACS boyama tamponu ekleyin ve 4 °C'de 5 dk için 300 x g'de santrifüj ekleyin. Çözeltiyi aspire edin ve her boncuk peletini 400 μL FACS boyama tamponunda yeniden askıya alın. Telafi denetimleri kullanıma hazırdır. Buzda kal.
- Spektral çakışma nedeniyle arka plan boyama optimize etmek için FMO kontrolleri kullanın.
- 5 mL FACS tüpünde bölüm 4.1'den alınan 1 mL hücre yi kullanarak ve 1:100 seyreltmede adım 4.1.1'de tanımlanan marker panelinden tüm antikorları ekleyerek ancak bir antikor hariç olmak üzere FMO kontrollerini hazırlayın. Örneğin, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, hücre canlılığı boya sıcabilir boya değil, NG2-AF488 antikor için antikorlar ekleyerek bir NG2-AF488 FMO hazırlayın. Darbe girdap tarafından yavaşça karıştırın. Her antikor için toplam 7 kontrol için tekrarlayın. 4 °C'de 30 dk boyunca ışıktan korunan kuluçka.
- Daha sonra, her tüpe 3 mL FACS boyama tamponu ekleyin ve 4 °C'de 5 dk için 300 x g'de santrifüj ekleyin. Çözeltiyi aspire edin ve her hücre peletini 400 μL FACS boyama tamponunda yeniden askıya alın. FMO kontrolleri kullanıma hazırdır. Buzda kal.
- Nonspesifik boyama için isotipuyumlu kontrol antikorları (Malzeme Tablosu) kullanın.
- Her biri 5 mL FACS tüpte 1:100 seyreltme de bölüm 4.1'den hazırlanan hücre örneğinin 1 mL'sine isotip uyumlu kontrol antikoru (MalzemeTablosu)ekleyerek isotip kontrolleri hazırlayın. Darbe girdap tarafından yavaşça karıştırın. 4 °C'de 30 dk boyunca ışıktan korunan kuluçka.
- Daha sonra, her tüpe 3 mL FACS boyama tamponu ekleyin ve 4 °C'de 5 dk için 300 x g'de santrifüj ekleyin. Çözeltiyi aspire edin ve her hücre peletini 400 μL FACS boyama tamponunda yeniden askıya alın. Isotip denetimleri kullanıma hazırdır. Buzda kal.
- Taze izole hücrelere antikor kokteylekleyerek sıralanacak hücreleri hazırlayın.
- Bölüm 4.1'den hücre örneğini fare karşıtı NG2-AF488, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7'yi 1:100 seyreltme de ve hücre canlılığını 1:100 000 seyreltme de içeren bir antikor kokteyline ekleyerek hazırlayın. Yavaşça girdap karıştırmak için. Işıktan korunan 30 dk için 4 °C'de kuluçka numuneleri.
- Boyama dan sonra, 5 dk 4 °C için 300 x g santrifüj ile FACS boyama tampon ile hücreleri yıkayın. Çözeltiyi aspire edin ve FACS boyama tamponundaki hücre peletini 0,5 x 106 hücre/mL'ye yeniden askıya alın.
- 35 μm filtre üstleri, pipet lekeli hücre örnekleri kapakları ve yerçekimi filtrasyon üzerine tek hücresüspansiyonlar elde etmek için yeni FACS tüpleri kullanarak. Buzda kal.
- Floresan telafikontrollerini optimize etmek için tazminat boncukları (Malzeme Tablosu) kullanın. 5 mL FACS etiketli bir tüpte deneydeki her florokrom için bir telafi kontrolü hazırlayın. Bu deney için toplam 9 telafi kontrolü hazırlayın — 2 çeşit lekesiz boncuk artı NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 ve hücre canlılığı-APC-Cy7 dahil olmak üzere işaret panelinden 7 farklı florokrom ( Malzeme Tablosu).
- Hücreleri arındırmak için bir hücre ayırıcısı kullanın.
- Gerilimleri ayarlamak ve arka plan sinyalini düzeltmek için hücre ayırıcısındaki lekesiz hücreleri çalıştırın (örneğin, ileri dağılım için 490−560 ve yan dağılım için 180−250' ye ayarlayın).
- Her kanal için voltajları ayarlamak ve pozitif sinyal için kapıları ayarlamak için her tek renkli kompanzasyon boncuk örneğini teker teker çalıştırın. Veri toplayın. Kompanse matrisini hesaplayarak spektral çakışmayı hesaplamak için yazılımı kullanın. Tüm voltajlar hazır ve ayarlanmış.
- Her izotip denetimini birer birer çalıştırın ve varsa belirli olmayan bağlama için kapıları ayarlamak için bu veriler kullanılabilir.
- Her FMO örneğini birer birer çalıştırın ve çok renkli bir panel sayesinde spektral kanamayı düzeltmek için her kanalın voltajlarını ayarlayın.
- Lekeli hücre örneklerini hücre ayırıcısında çalıştırın ve 15 mL konik toplama tüpünde 10 mL enzimsiz kültür medyasında (DMEM + %20 FBS + %1 P/S) hücre toplayın. Aşağıdaki gating stratejisini kullanın: tek hücreler için kapı, canlı hücreler için kapı, CD45 negatif hücreler için kapı, CD34 ve CD31 negatif hücreler için kapı, NG2 pozitif hücreler için kapı ve son olarak CD146 ve CD140b pozitif hücreler için kapı.
5. Perisit lerin Culturing
- 5 dk için %0,2 jelatin içeren 24 kuyulu bir plakayı kaplayın ve jelatin çözeltisini aspire edin. Tohum taze elde edilen hücreler 4.2.5 adım dmem + 20% FBS + 1% P / S kadar 2 x 104 hücreleri /cm2. Bir hücre kuluçka makinesindeki kültür hücreleri 37 °C, %5 CO2 ve %95 O2olarak ayarlanır.
- Perisitlerin geçişi
- Hücreler %95 konakıcı olduktan sonra hücreleri sıcak 1x DPBS ile yıkayın ve 3−5 dk oda sıcaklığında her kuyuda 200 μL 0,1 tripsin ile hücreleri kaldırın.
- Hücreleri gevşetmek için tabağa hafifçe dokunun.
- Tripsini 3,5 x kültür ortamı miktarı (700 μL DMEM + %20 FBS + %1 P/S) ve tohum geçişi iki (P2) hücreyi 2 x 104 hücre/cm 2'ye kadar kaplamasız 6 kuyulu bir tabağa yerleştirin.
- Her kuyu, ne zaman confluent, sonra 1:6 oranında bölünebilir P3 hücreleri olarak tek bir T-75 şişesine taşınabilir.
6. Perisitlerin Karakterizasyonu
-
Akış sitometri analizi
- Bölüm 4'te daha önce açıklandığı gibi aynı FACS boyama protokolünü ve gating stratejisini kullanın.
- Akış sitometresi üzerinde kontrolleri ve lekeli örnekleri çalıştırın. Analiz yazılımını kullanarak veri toplamakve verileri analiz etmek (Malzeme Tablosu).
- Parlak alan görüntülerini toplamak için, 37 °C, %5 CO2 ve %95 O2olarak belirlenen bir hücre kuluçka makinesindeki bir şişedeki hücreleri büyütün. Hücreler yüzeye bağlandıktan sonra görüntüleri mikroskopta yakalayın.
-
İmmünositokimya
- Hücreleri %90'a kadar 96 kuyuluk bir tabakta büyütün. Hücreleri sıcak 1x DPBS ile yıkayın ve oda sıcaklığında 30 dakika boyunca %4 paraformaldehit ile düzeltin.
- Hücreleri 1x DPBS ile 3x yıkayın ve oda sıcaklığında 10 dakika boyunca %0,1 deterjanla permeabilize edin.
- Oda sıcaklığında 1 saat boyunca tampon engelleme ile inkübül hücreleri. Bloke sonra, birincil antikorlar ekleyin (kuyu başına bir antikor) 1:100 tampon engelleme ve 4 ° C gecede kuluçka seyreltilmiş. Primer antikorlar şunlardır: anti-NG2, anti-CD140b, anti-CD31, anti-vimentin, anti-desmin, ve anti-alfa düz kas aktin.
- Ertesi gün, yıkama tampon (TabloMalzemeler)ile hücreleri 3x yıkayın. İkincil antikor 1:1.000 bloke tampon ve karanlıkta oda sıcaklığında 2 saat kuluçka seyreltilmiş ekleyin. İkincil antikor FITC'ye konjuge bir anti-tavşandır.
- Yıkama tampon ile hücreleri 3x yıkayın. Oda sıcaklığında 5 dakika için 1:1.000 seyreltilmiş 300 μM nükleer leke ekleyin.
- Hücreleri 1x DPBS ile 3 x yıkayın ve montaj lı ortamla monte edin.
- Konfokal mikroskoplu görüntü hücreleri.
Sonuçlar
Enzimatik sindirim ve tüm kalbin dissociation sonra ve hücrelerin FACS saflaştırma önce, hücreler kalpten birçok farklı hücre türleri içeren bir ham karışımdır (Şekil1A). FACS arınma ve kültürlenme den sonra hücreler homojendir. Onlar tek çekirdekli, oldukça düz, ve tipik perisit rhomboid morfolojisi var (Şekil 1B).
FACS kullanılarak hücreler homojenolarak saflaştırılır. Lekesiz kontrol hücresi örneği gating stratejisini göstermek için kullanılır (Şekil2). İlk olarak, enkaz ve doublets ileri ve yan dağılım dağılımları dayalı dışarı kapılı edildi. Daha sonra ölü hücreler, canlı hücrelerden daha büyük ve daha yoğun bir sinyal üreten boya ile amin reaksiyonu nedeniyle dışarı kapılandı. Canlı hücrelerden hematopoetik hücreler CD45+olarak çıkarıldı. Hematopoetik ve endotel hücrelerini daha da uzaklaştırmak için CD34+ ve CD31+ hücreler çıkarıldı. Son olarak, TIPIK perisit belirteçlerinin ekspresyonu ile perivasküler hücreler olduğu için NG2+ ve CD140b+/CD146+ hücreler seçilmiştir (Şekil 3). Marker paneli ayrıca fare koroner endotel hücrelerinde kontrol olarak test edildi (Ek Şekil 1). Ham hücre karışımının sadece %1'i sıralamadan sonra perisitlerden oluşuyordu.
Hücrelerin gerçekten perisit olduğunu doğrulamak için, daha fazla karakterizasyon için hücreleri geçitli. T-75 şişelerinde P3'e ulaştıklarında hücreler yaşlandıkça canlılıkta değişiklik olmadan hızla büyümüştir (EkŞekil 2). İnsan beyin perisitleri ile karşılaştırıldığında, hücreler benzer bir morfolojiye sahipti (Şekil4A). Fare ve insan düz kas hücreleri ile karşılaştırıldığında, hücrelerin farklı bir morfolojisi vardı (Şekil4A). Ayrıca P7'de immünosülyalı veya geçiş sonrası akış sitometri analizi nde morfoloji veya marker ekspresyonunda gözlenen bir değişiklik yoktu (Şekil 4B,C).
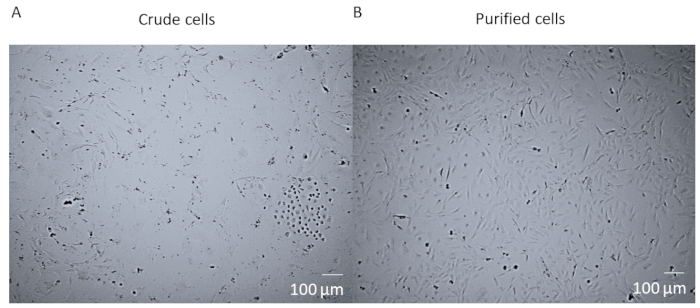
Şekil 1 : Ham hücreler saflaştırılmış hücrelere karşı. (A) Ham hücre karışımının brightfield görüntüsü 14 gündür bir T25 şişesinde kültürlenmiş olan tüm kalp enzimatik sindirim ve dissosilasyon sonrası. (B) 14 gün sonra homojen bir kardiyak perisit popülasyonunun 14 gün sonra ayrıştırma ve kültürleme sonrası parlak alan görüntüsü. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
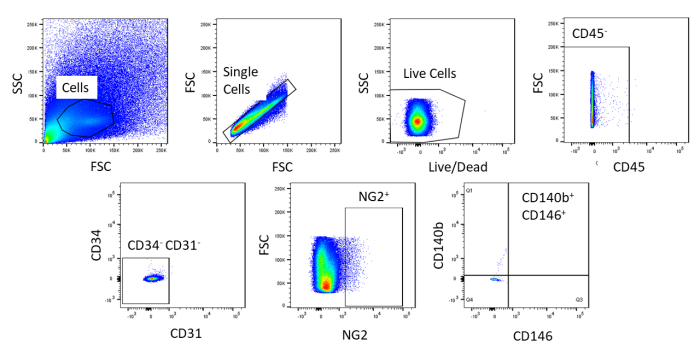
Şekil 2 : Lekesiz hücrelerin FACS analizinin temsili görüntüleri. Ham hücre karışımını arındırmak için kullanılan gating stratejisinin şematik gösterimi. Kapı tek hücreler için, canlı, CD45-, CD31-, CD34-, NG2+, CD146+, ve CD140b+. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3 : Ham hücrelerin FACS analizinin temsili görüntüleri. Kardiyak perisithomojen bir popülasyon elde etmek için kullanılan sıralama şematik gösterimi. Ham hücrelerin kabaca% 1 CD31-CD34-CD45-CD140b+NG2+CD146+vardır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4 : Primer izole kardiyak perisitlerin karakterizasyonu (A) Insan beyni (hPC) ve fare kalplerinden (mPC) kültürlü hücrelerin Brightfield görüntüleri benzer perisit hücre morfolojisi ama insan düz kas hücrelerinden farklı morfoloji hSMC) ve fare düz kas hücreleri (mSMC) göstermektedir. Ölçek çubuğu = 100 μm. (B) P7'deki hücrelerin perisit belirteçleri için immünositokimya ile phenotipik karakterizasyonu. Ölçek çubuğu = 100 μm. (C) Negatif belirteçler CD31, CD34, CD45 ve pozitif belirteçler NG2, CD140b ve CD146 için geçitli oldukları P7'deki perisitlerin akış sitometrisi ile analiz. Nüfus homojen kalır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Marker paneli kullanılarak endotel hücrelerinin akış sitometri analizinin temsili görüntüleri. Bir fare koroner endotel hücre hattı belirteçleri için bağlayıcı özgüllük için kontrol olarak kullanılmıştır. Negatif bir kapı yerine CD31 için pozitif bir kapı dışında sıralamada kullanılan aynı gating stratejisini kullanarak, endotel hücreleri CD45, CD34, NG2, CD140b ve CD146 için negatifti, ancak beklendiği gibi CD31 için pozitifti. Bu rakamı indirmek için lütfen tıklayınız.
Ek Şekil 2: MPC'nin farklı pasajlarının akış sitometri analizinin temsili görüntüleri. Primer izole kardiyak perisitler kültürlendi ve 12. Hücreler propidium iyodür ile boyandı ve bir akış sitometre üzerinde analiz edildi. Kontrol popülasyonu ölü hücreler ve canlı hücrelerin karışımıdır. Pasajlar arasında canlı hücre sayısında anlamlı bir fark yoktu. Bu rakamı indirmek için lütfen tıklayınız.
Tartışmalar
Kardiyak perisitler üzerinde yapılan çalışmalar nispeten yeni olduğundan, perisitlerin kardiyovasküler fizyoloji ve patofizyolojideki rolü henüz tanımlanmamıştır. Diğer organlarda, onlar damar homeostaz ve perfüzyon önemli rol oynadığı gösterilmiştir1,2. Beyin gibi diğer organlardan perisit lerin literatürü ile karşılaştırıldığında, kardiyak perisitler üzerinde önemli ölçüde daha az yayın vardır. Kardiyak perisitlerin izolasyonu fonksiyonel özelliklerinin ve sinyal mekanizmalarının anlaşılması açısından çok önemlidir. Bu nedenle, bu protokol araştırmacılara kardiyak perisitlere daha kolay ulaşılabilen bir doku kaynağından erişmeleri ve biyolojileri üzerine çalışmaları desteklemeleri için daha kolay bir yol sağlayacaktır. Kardiyak perisitlerin kardiyak homeostaz ve patofizyolojiye nasıl katkıda bulunduklarına ilişkin soruların yanıtlatınyanı, terapötik potansiyellerinin araştırılmasına yardımcı olacaktır.
Murine kalpten izole edilen ve CD31-CD34-CD45-CD140b + NG2+CD146+ ile karakterize perisit popülasyonu birden çok kez (P12'ye kadar ve hala güçlü gidiyordu) geçilmiştir, ki bu da canlılık azalması ve hızlı bir şekilde yayılır (Ek Şekil 2). Hücreler de kriyodondurulmuş ve en az% 95 canlılık ile kurtarıldı edilmiştir. Ancak, deneylerimiz için P7 veya daha genç hücreleri kullanmayı tercih ediyoruz. Perisitlerimizin parlak alan görüntülerini insan beyni perisitleriyle karşılaştıran iki hücre çizgisi, düz kas hücrelerinden morfolojide farklılık gösterirken, benzer hücre morfolojisi (Şekil4A)sahiptir (Şekil 4A). P7 hücrelerimiz perisit belirteçleri için immünosit kimyası ile, bazıları FACS panelimizden (NG2 ve CD140b) ve panelde olmayan birkaç ı (vimentin, desmin, αSMA) ile karakterize edildi ve hücrelerin perisit belirteçlerini homojen olarak ifade ettiğini bulduk (Şekil4B). Ayrıca, P7 hücrelerimiz yine aynı marker paneli ile akış sitometrisi ile analiz edilerek, geçiş nedeniyle marker ekspresyonundaki değişiklikleri değerlendirmek için herhangi bir değişiklik olmadığını tespit ettik (Şekil4C). Bu nedenle, hem fenotipik hem de morfolojik olarak hücrelerimiz perisittir.
Nees ve ark.10, Avolio ve ark.11, Chen ve ark.12ve Baily ve ark.13 tarafından yapılan çalışmalar da başarılı kardiyak perisit izolasyonları göstermiştir. Ancak, Nees ve ark.10 tarafından mikrogemilerden perisitayırmak için bir şirket içinde özel inşa ekipman kullanımı onlar gibi çoğaltmak zordu bir örgü ağ yığını ile ileri geri proteaz çözeltisi perfüzyon pompaları ile iki oda dahil aparatın şematik ve/veya resmini ve nasıl inşa edildiğini sağlamadı. Nees ve ark.10 birçok türden başarılı bir şekilde izole edilmiş kardiyak perisitler olmasına rağmen, onların yöntemini asla üretemedik. Protokolümüzdeki perisit kopma adımımız, tüm laboratuvarlarda olmasa bile, tüm laboratuvarlarda bulunan bir orbital shaker (tüm hücreleri ayırmak için) kullanır ve konik bir tüpteki doku ve enzim çözeltisi ve ardından mekanik bir ayrışma adımı kullanır. Özel bir aparat gerekmez. İkinci olarak, kalan protokoller insan dokularının kullanımını içerir ve böylece insan dokusunun temini müfettişler için sınırlayıcıdır. Protokolümüz, fare modelleri (vahşi tip, genetiği değiştirilmiş, hastalıklı) ve tüm araştırmacıların kullanımına hazır malzemeler kullanılarak mevcut protokollerin9,12'de değiştirilmesi ve optimizasyonudur.
Genel olarak perivasküler hücreler hassas olduğundan, hücrelerin canlılığı iyi bir verim elde etmek için önemlidir. Kardiyak dokunun temini ve hücrelerin boyanması sırasında, doku/hücrelerin buz soğuk tutulması gerekir. İkincisi, doku enzimatik sindirim bireysel olarak optimizasyon gerektirebilir. Enzimlerin kişinin şişeleri üzerinde aktivite birimlerine bağlı olarak, konsantrasyon ve sindirim süresi optimize edilmesi gerekebilir. Enzimatik çözeltinin her seferinde taze olarak hazırlandıklısa, aksi takdirde verim azalır. Üçüncü olarak, ham karışım hücrelerin bir sürü içerir, bazı ölü ve / veya ölüyor, bu boyama tampon% 5'ten% 2 FBS konsantrasyonu düşürmek için en iyisidir. Sıralama sırasında meme tıkanan hücreler ile sorun yaşıyorsanız, ölü bir hücre kaldırma kiti kullanarak ilk hücreleri zenginleştirin. Hücre kümelenmesini önlemek için hücre öncesi sıralamaya EDTA/HEPES tamponu veya DNase tedavisi de ekleyebilirsiniz. Son olarak, antikor lar bizim panel oldukça büyük ve birçok floroforkullanır, fmo kontrolleri ve kompanzasyon kontrolleri doğru yapılır emin olun.
Bu yöntemin bir sınırlama kalp başına elde edilebilir kardiyak perisit miktarıdır. Bizim durumumuzda, bir fare kalp bizim ham karışımı sadece% 1.1 insan kalp izolasyonları yüzde karşılaştırılabilir perisitler vardı, ama hücre sayısı önemli ölçüde daha az kalp dokusu miktarı nedeniyle bir fare sağlar. Facs'tan sonra başlangıç hücre sayısı çok düşük olduğundan, aynı anda birden fazla kalpten izole etmek daha iyi olacaktır. Ancak, bununla ilgili sorun, bir gün içinde sıralamanız gereken hücrelerin sayısıdır. Eğer 30 milyondan fazla hücre varsa, hücrelerin canlılığını etkilemeden sıralama yoluyla almak zor olacaktır. Eğer araştırmacının birden fazla hücre ayırıcısı olsaydı, bir günde birden fazla kalpten izole etmek mümkün olurdu. Başka bir sınırlama biz iskelet kası 15 gibi kalpte perisit alt popülasyonları olupolmadığını bilmiyorum çünkü, biz bizim gating stratejisinde bir alt tip ortadan kaldırarak olup olmadığını bilmiyorum. Kardiyak perisitlerimizi karakterize etme sürecindeyiz ve şimdiye kadar yayınlanmamış verilerimizde, bunlar işlevsel olarak literatürdeki diğer perisitler gibidir.
Protokolümüz, araştırmacıların kardiyak perisit özellikleri, özellikleri, işlevselliği ve kardiyak homeostaz ve hemodinamik katkılarının tanımlanmasına yardımcı olacak diğer yönleri hakkındaki soruları yanıtlamalarını sağlayacaktır. Bu hücreler, biyolojileri daha iyi anlaşıldıktan sonra kardiyovasküler hastalıklara karşı terapötik potansiyele sahip olabilirler.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar florofor panel tasarımı, sorun giderme ve hücre sıralama ile ilgili yardım için Amgen Akış Sitometri Çekirdek teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 G butterfly needle | FisherSci | 22-253-146 | |
| 31 G needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
Referanslar
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043 (2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252 (2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır