Method Article
Aislamiento y Purificación de Pericitas Cardíacos Murinos
En este artículo
Resumen
Hemos optimizado un protocolo para aislar y purificar los pericitas cardíacos murinos para la investigación básica y la investigación de su biología y potencial terapéutico.
Resumen
Pericitas, células perivasculares de microvasculares y capilares, se sabe que juegan un papel en la angiogénesis, la estabilización de los vasos y la integridad de la barrera endotelial. Sin embargo, sus funciones específicas del tejido en el corazón no se entienden bien. Además, actualmente no existe un protocolo que utilice materiales de fácil acceso para aislar y purificar los pericitos de origen cardíaco. Nuestro protocolo se centra en el uso del modelo de mamífero ampliamente utilizado, el ratón, como nuestra fuente de células. Usando la digestión enzimática y la disociación mecánica del tejido cardíaco, obtuvimos una mezcla celular bruta que fue purificada aún más por la clasificación celular activadora por fluorescencia (FACS) por una plétora de marcadores. Debido a que no hay un solo marcador inequívoco para los pericitas, nos ennegró para las celdas que eran CD31-CD34-CD45-CD140b+NG2+CD146+. Después de la purificación, estas células primarias fueron cultivadas y pasajeras varias veces sin ningún cambio en la morfología y la expresión de marcador. Con la capacidad de obtener regularmente pericitos cardíacos murinas primarias utilizando nuestro protocolo, esperamos comprender mejor el papel de los pericitas en la fisiología cardiovascular y su potencial terapéutico.
Introducción
Las células perivasculares conocidas como pericitos rodean los microvasculares y capilares del árbol vascular1,2. Fisiológicamente, son conocidos por promover y jugar un papel en la angiogénesis, aumentar la integridad de la barrera debido a su estrecha relación con las células endoteliales, así como estabilizar y madurar los vasos1,2. Además, la disfunción y/o pérdida de estas células sehan implicado en enfermedades como la enfermedad de Alzheimer 2,3 y diversas enfermedades cardiovasculares4. Estas células se encuentran en todo el cuerpo, pero los números celulares dependen del tejido. Pericytes se han estudiado más notablemente en el cerebro debido a la alta vascularización de la barrera hematoencefálica1,2. Sin embargo, en el corazón, la biología de los pericytes no está estudiada.
Recientemente, hay mayores intereses en el campo de los pericíticos cardíacos, pero actualmente no hay un protocolo simplificado disponible para su aislamiento de una de las herramientas más utilizadas en biología: el ratón. Hay protocolos en la literatura sobre el aislemiento de los pericitas del cerebro5, retina6, placenta7,y músculo esquelético8,9; sin embargo, pocos protocolos están en aislar los pericytes del corazón. Hay varios grupos que tienen perifitos cardíacos aislados. Nees y otros fueron capaces de aislar una cantidad abundante de pericytes cardíacos de múltiples especies, incluyendo el ratón; sin embargo, sus métodos utilizaron equipos específicos construidos internamente que disminuye la reproducibilidad10. 12, y Baily et al.13 también aislaron con éxito los pericitas cardíacos del tejido cardíaco humano, pero los tejidos humanos no siempre están disponibles y son difíciles de obtener para algunos investigadores. Aquí, hemos desarrollado un método de aislamiento para obtener pericytes cardíacos de modelos de ratón para que los investigadores estudien más su biología con materiales fácilmente disponibles.
Utilizando la digestión enzimática y la fluorescencia activada de clasificación celular (FACS) con marcadores de pericita clave conocidos14, nuestro protocolo nos permite aislar y purificar una población de pericitas que se caracterizan por CD31-CD34-CD45- CD140b+NG2+CD146+. Nuestro panel de marcadores contiene marcadores de inclusión y exclusión. CD45 se utiliza como marcador para excluir células hematopoyéticas. CD31 se utiliza como marcador para excluir celdas endoteliales. CD34 se utiliza como marcador para excluir las células progenitoras hematopoyéticas y endoteliales. CD146 es un marcador para las células perivasculares. Por último, NG2 y CD140b (también conocidocomo receptor de factor de crecimiento derivado de plaquetas beta — PDGFR) son marcadores aceptados para pericicias14. La referencia cultural primaria obtenida se puede cultivar y pasar varias veces sin cambios en la morfología ni en la expresión de marcador. Además, estas células se pueden co-cultivar con células endoteliales para estudiar sus interacciones y hablar entre sí. Este método de aislamiento celular permitirá a los investigadores estudiar la biología y la fisiopatología de los pericitas cardíacos de tipo salvaje, enfermedad y modelos de ratón genéticamente variantes.
Protocolo
Todos los animales fueron alojados y utilizados en una instalación acreditada de la Asociación de Evaluación y Acreditación de Laboratorio de Cuidado Animal Internacional (AAALAC) y todo el trabajo animal se llevó a cabo bajo la supervisión veterinaria apropiada y bajo la Oficina Institucional de Animales Protocolo aprobado por el Comité de Cuidado y Uso (IACUC) de Amgen Inc.
1. Preparación de herramientas y medios de cultura
- Autoclave quirúrgico 9 cm punta recta tijeras de punta fina y 10 cm fórceps serrados en ángulo.
- Añadir 25 ml de suero bovino fetal al 5% (FBS) y 5 ml de 1% de estreptomicina penicilina (P/S) en un frasco de 500 ml de magnesio cálcico libre de salina con fosfato (CMF-DPBS). Coloque la solución en un baño de hielo para asegurarse de que esté fría en el momento de su uso. Aliquot 50 mL en un tubo cónico de 50 ml para aislamiento cardíaco. Añadir 250 unidades/ml de solución de heparina sódica en la alícuota de 50 ml. Esto se denominará CMF-DPBS heparinizado.
- Añadir 20% FBS (100 mL) y 1% P/S (5 mL) en una botella de 500 ml de alto nivel de glucosa del medio de águila modificada de Dulbecco (DMEM). Esto se denominará medio de cultivo libre de enzimas. Aliquot 20 mL de DMEM + 20% FBS + 1% P/S y añadir 500 g/ml de colagenasa B. Esto se denominará solución enzimática. Mantenga calientes tanto los medios de cultivo libres de enzimas como la solución enzimática a 37 oC en una incubadora o baño de agua.
2. Preparación de animales y adquisición de tejido cardíaco
- Inyecte por vía intraperitoneal un ratón con 250 unidades de solución de heparina sódica con una jeringa de aguja de 31 G. A continuación, espere de 10 a 15 minutos mientras el ratón permanece activo en su jaula doméstica.
NOTA: Los datos representativos de este estudio se obtuvieron de un ratón C57BL/6 masculino de 4 meses de edad. Sin embargo, este protocolo se puede utilizar en cualquier ratón independientemente de la tensión, edad, sexo, peso, etc. - Anestetizar el ratón con 5% de isoflurano. Compruebe la profundidad de la anestesia del ratón mediante el reflejo de pellizcar.
- Coloque el ratón anestesiado en posición supina y pegue las extremidades delanteras. Abra cuidadosamente la cavidad torácica y cándala la aorta descendente usando una aguja de mariposa de 25 G.
- Haga un nick en la aurícula derecha y perpetúe el corazón con al menos 20 ml de 250 unidades/ml de CMF-DPBS heparinizado a 2 ml/min con una bomba peristáltica de flujo variable. Cuando el PBS sale de las mismas correctas, la perfusión es completa.
- Corta el corazón en la aorta y colócalo en el CMF-DPBS helado.
3. Disociación del tejido cardíaco
- Transfiera el corazón a una placa Petri de 15 cm x 15 cm. Corta el corazón en trozos diminutos (1 mm/pieza) usando tijeras de resorte y fórceps de punto fino con suficiente solución enzimática para cubrir las piezas (10 x 15 ml).
- Transfiera las piezas y la solución a un tubo cónico de 50 ml, selle con película plástica de parafina e incubar a 37 oC en un agitador orbital a 120 rpm durante 75 minutos.
- Después de la digestión de la colagenasa con la solución enzimática, decantar el líquido a través de un colador de células de 100 m en un tubo nuevo de 50 ml, pero dejar suficiente solución para asegurarse de que las piezas no se sequen.
- Usando fórceps de punto fino, saque el tejido del tubo y coloque algunas piezas en una diapositiva del microscopio. A continuación, muele el tejido entre dos diapositivas de microscopio para romper el tejido. Enjuague las diapositivas con medios de cultivo libres de enzimas en un nuevo tubo cónico de 50 ml.
- Repita el paso 3.4 hasta que todas las piezas de tejido se disocien.
- Combine las soluciones de los pasos 3.3 a 3.5 en un tubo. Colar la suspensión resultante a través de un colador de células de 100 m en un nuevo tubo cónico de 50 ml.
- Centrífuga a 220 x g, 4oC, durante 5 min. Apiratee la solución anterior y resuspenda suavemente el pellet celular en medios de cultivo frescos libres de enzimas.
- Cuente las celdas y compruebe la viabilidad usando un contador de celdas. Diluir las células a 1 x 106/ml con tampón de tinción FS frío que contiene 500 ml de DPBS y 10 x 25 ml de albúmina sérica bovina (BSA) de 2 x 5%. Las celdas están listas para ser manchadas y ordenadas.
4. Purificación de pericitas a partir de la mezcla de células brutas utilizando FACS
- Preparar y etiquetar tubos FACS de 5 ml para todos los controles y muestras de células. Células alícuotas (1 ml de células por tubo) para una muestra no manchada, controles de fluorescencia menos uno (FMO) y controles coincidentes con isotipos. Utilice las celdas restantes para la ordenación. Todos los controles y muestras se pueden preparar y manchar al mismo tiempo.
Nota:Un total de 13 ml a 0,5 x 106células/ml se utilizaron para la clasificación representativa de un corazón. Sin embargo, el volumen depende de cuántas células obtiene el investigador de su aislamiento, cuántos corazones utilizan y qué tan bien se digiere el tejido cardíaco; el tamaño de cada corazón es también una variable que puede alterar el volumen.- Utilice perlasdecompensación (Tabla de materiales) para optimizar los controles de compensación de fluorescencia. Prepare un control de compensación para cada fluorocromo en el experimento en un tubo FACS de 5 ml etiquetado. Para este experimento, prepare un total de 9 controles de compensación: 2 tipos de cuentas no retenidas más 7 fluorocromos diferentes del panel de marcadores, incluidos NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 y viabilidad celular-APC-Cy7 ( Tabla de Materiales).
- Agregue una gota de perlas de compensación (50 l) del vial de compresión a cada tubo. A continuación, añada 1 l de anticuerpo a las perlas. Repita el procedimiento para cada anticuerpo desde el panel de marcadores. Mezclar vigorosamente por pulso-vórtice. Incubar durante 30 minutos a 4 oC protegido de la luz, excepto por las perlas de viabilidad celular que se pueden dejar a temperatura ambiente protegida de la luz.
- A continuación, añadir 3 ml de tampón de tinción FACS a cada tubo y centrifugar a 300 x g durante 5 min a 4 oC. Aspirar la solución y resuspender cada pellet de perla en 400 l de tampón de tinción FACS. Los controles de compensación están listos para ser utilizados. Manténgase en hielo.
- Utilice los controles FMO para optimizar la tinción de fondo debido a la superposición espectral.
- Prepare los controles de FMO utilizando 1 ml de células que se acotó de la sección 4.1 en un tubo FACS de 5 ml y agregando todos los anticuerpos del panel de marcadores descrito en el paso 4.1.1 a una dilución 1:100, pero excluyendo un anticuerpo. Por ejemplo, prepare una FMO NG2-AF488 incluyendo anticuerpos para CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7, colorante de viabilidad celular, pero no el anticuerpo NG2-AF488. Mezclar suavemente por pulso-vórtice. Repita el proceso para cada anticuerpo para un total de 7 controles. Incubar durante 30 min a 4oC protegido de la luz.
- A continuación, añadir 3 ml de tampón de tinción FACS a cada tubo y centrifugar a 300 x g durante 5 min a 4 oC. Aspirar la solución y resuspender cada gránulo celular en 400 l de tampón de tinción FACS. Los controles FMO están listos para ser utilizados. Manténgase en hielo.
- Utilice anticuerpos de control coincidentes con isotipos (Tablade materiales)para manchas inespecíficas.
- Preparar los controles de isotipo añadiendo el anticuerpo de control emparejado con isotipo (Tablade Materiales)a 1 ml de muestra celular preparada a partir de la sección 4.1 a una dilución de 1:100 cada una en un tubo FACS de 5 ml. Mezclar suavemente por pulso-vórtice. Incubar durante 30 min a 4oC protegido de la luz.
- A continuación, añadir 3 ml de tampón de tinción FACS a cada tubo y centrifugar a 300 x g durante 5 min a 4 oC. Aspirar la solución y resuspender cada gránulo celular en 400 l de tampón de tinción FACS. Los controles de isotipo están listos para ser utilizados. Manténgase en hielo.
- Preparar las células para ser ordenadas mediante la adición de cóctel de anticuerpos a las células recién aisladas.
- Prepare la muestra celular de la sección 4.1 agregando un cóctel de anticuerpos que contenga antiratón NG2-AF488, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 a 1:100 de dilución cada uno y tinte de viabilidad celular a 1:1,000 dilución. Suavemente vórtice para mezclar. Incubar muestras a 4oC durante 30 min protegidas de la luz.
- Después de la tinción, lave las células con tampón de tinción FACS por centrifugación a 300 x g durante 5 min 4 oC. Aspirar la solución y resuspender el pellet celular en el tampón de tinción FACS a 0,5 x 106 células/ml.
- Usando nuevos tubos FACS que tienen tapas de filtro de 35 m, muestras de células manchadas de pipeta en las tapas y filtrado de gravedad para obtener suspensiones de una sola célula. Manténgase en hielo.
- Utilice perlasdecompensación (Tabla de materiales) para optimizar los controles de compensación de fluorescencia. Prepare un control de compensación para cada fluorocromo en el experimento en un tubo FACS de 5 ml etiquetado. Para este experimento, prepare un total de 9 controles de compensación: 2 tipos de cuentas no retenidas más 7 fluorocromos diferentes del panel de marcadores, incluidos NG2-FITC, CD31-APC, CD140b-PE, CD146-BV605, CD34-BV421, CD45-PE-Cy7 y viabilidad celular-APC-Cy7 ( Tabla de Materiales).
- Utilice un clasificador de células para purificar las células.
- Ejecute las celdas no manchadas en el clasificador de celdas para establecer voltajes y corregir la señal de fondo (por ejemplo, establezca voltajes para la dispersión hacia delante a 490-560 y para la dispersión lateral a 180-250).
- Ejecute cada muestra de perlas de compensación de un solo color de una en una para ajustar los voltajes de cada canal y ajustar las puertas para la señal positiva. Recopilar datos. Utilice el software para calcular la superposición espectral calculando la matriz de compensación. Todos los voltajes están listos y ajustados.
- Ejecute cada control de isotipo de uno en uno y estos datos se pueden usar para ajustar puertas para enlaces inespecíficos si los hay.
- Ejecute cada muestra de FMO una a la vez y ajuste los voltajes de cada canal para corregir el sangrado espectral debido a un panel multicolor.
- Ejecute las muestras de células manchadas en el clasificador de células y recopile células en medios de cultivo libres de enzimas de 10 ml (DMEM + 20% FBS + 1% P/S) en un tubo de recolección cónica de 15 ml. Utilice la siguiente estrategia de gating: puerta para celdas individuales, puerta para células vivas, puerta para celdas negativas CD45, puerta para células negativas CD34 y CD31, puerta para celdas positivas NG2 y, finalmente, puerta para células positivas CD146 y CD140b.
5. Cultivo de pericitas
- Cubra una placa de 24 pocillos con gelatina al 0,2% durante 5 min y aspirar la solución de gelatina. Células recién obtenidas de semillas del paso 4.2.5 en DMEM + 20% FBS + 1% P/S hasta 2 x 104 células/cm2. Células de cultivo en una incubadora de células establecidas a 37 oC, 5% CO2 y 95% O2.
- Passaging of pericytes
- Una vez que las células sean 95% confluentes, lave las células con 1x DPBS caliente, y levante las células con 200 ol de trippsina al 0,1% en cada poca a temperatura ambiente durante 3 a 5 minutos.
- Toque suavemente la placa para aflojar las celdas.
- Neutralizar la trippsina con 3,5 veces la cantidad de medios de cultivo (700 l DMEM + 20% FBS + 1% P/S) y paso de semilla dos células (P2) en una placa de 6 pocillos sin recubrimiento a 2 x 104 células/cm2.
- Cada pozo, cuando confluente, se puede mover a un solo matraz T-75 como células P3 que luego se pueden dividir en una proporción de 1:6.
6. Caracterización de Pericytes
-
Análisis de citometría de flujo
- Utilice el mismo protocolo de tinción FACS y la misma estrategia de gating como se describió anteriormente en la sección 4.
- Ejecute controles y muestras manchadas en el citometro de flujo. Recopilar datos y analizar datos utilizando el software de análisis (Tablade materiales).
- Para recoger imágenes de campo brillante, haga crecer las células en un matraz en una incubadora de células establecida a 37 oC, 5% CO2 y 95% O2. Capturar imágenes en un microscopio después de que las células se adhieran a la superficie.
-
Immunocytochemistry
- Cultivar células en una placa de 96 pocillos hasta que el 90% de confluente. Lavar las células con 1x DPBS caliente y fijar con 4% de paraformaldehído durante 30 min a temperatura ambiente.
- Lavar las células 3 veces con 1x DPBS y permeabilizar con 0.1% detergente durante 10 min a temperatura ambiente.
- Incubar celdas con tampón de bloqueo durante 1 h a temperatura ambiente. Después del bloqueo, añadir anticuerpos primarios (un anticuerpo por pozo) diluido 1:100 en tampón de bloqueo e incubar a 4 oC durante la noche. Los anticuerpos primarios son: anti-NG2, anti-CD140b, anti-CD31, anti-vimentina, anti-desmin, y anti-alfa acto muscular lisa.
- Al día siguiente, lavar las celdas 3x con tampón de lavado (Tablade Materiales). Añadir anticuerpo secundario diluido 1:1,000 en tampón de bloqueo e incubar durante 2 h a temperatura ambiente en la oscuridad. El anticuerpo secundario es un anticonejo conjugado con FITC.
- Lave las células 3x con tampón de lavado. Añadir la mancha nuclear de 300 m diluida a 1:1.000 durante 5 minutos a temperatura ambiente.
- Lave las celdas 3x con 1x DPBS y montar con medios de montaje.
- Células de imagen con un microscopio confocal.
Resultados
Después de la digestión enzimática y la disociación de todo el corazón y antes de la purificación FACS de las células, las células son una mezcla bruta que contiene muchos tipos celulares diferentes del corazón (Figura1A). Después de la purificación y el cultivo de FACS, las células son homogéneas. Son de una sola nucleada, bastante planas, y tienen la morfología romboide pericita típica (Figura1B).
Usando FACS, las células se purifican a homogeneidad. La muestra de celda de control sin mancha se utiliza para mostrar la estrategia de gating (Figura 2). En primer lugar, los escombros y los dobletes fueron cerrados en función de las distribuciones de dispersión hacia adelante y hacia los lados. Entonces las células muertas fueron cerradas debido a su reacción de amina con el tinte que produce una señal mayor e intensa que las células vivas. De las células vivas, las células hematopoyéticas fueron cerradas por ser CD45+. Para eliminar aún más las células hematopoyéticas y endoteliales, las células CD34+ y CD31+ fueron cerradas. Finalmente, se seleccionaron las células NG2+ y CD140b+/CD146+ por ser células perivasculares con expresión de marcadores típicos de pericita (Figura3). El panel de marcadores también se probó en células endoteliales coronarias de ratón como un control (Figura Suplementaria 1). Sólo alrededor del 1% de la mezcla de células brutas consistía en pericitas después de la clasificación.
Para validar que las células eran de hecho pericytes, pasamos las celdas para una mayor caracterización. Las células crecieron rápidamente una vez que alcanzaron P3 en los matraces T-75 sin cambios en la viabilidad a medida que se hicieron mayores (FiguraSuplementaria 2). En comparación con los pericíticos cerebrales humanos, las células tenían una morfología similar (Figura4A). En comparación con el ratón y las células musculares lisas humanas, las células tenían una morfología diferente (Figura4A). Tampoco se observaron cambios en la morfología o expresión de marcadores en P7 cuando se hanintroducido inmunoestántes o mediante análisis de citometría de flujo después del paso (Figura4B,C).
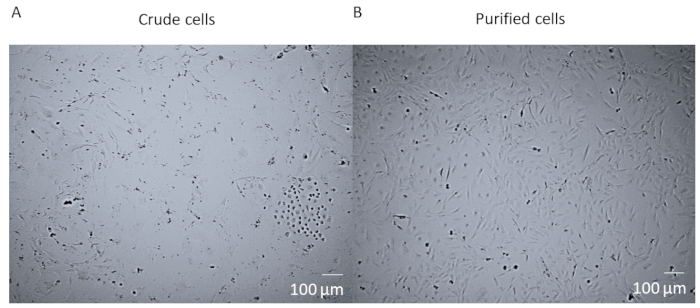
Figura 1 : Células brutas frente a células purificadas. (A) La imagen de campo brillante de la mezcla de células brutas después de la digestión enzimática del corazón entero y la disociación que se ha cultivado en un matraz T25 durante 14 días. (B) La imagen de campo brillante de una población homogénea de pericitas cardíacas después de la clasificación y el cultivo después de 14 días. Barra de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
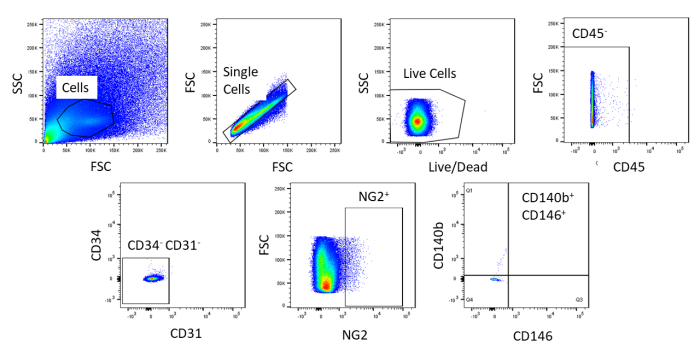
Figura 2 : Imágenes representativas del análisis FACS de células no retenidas. Representación esquemática de la estrategia de gating utilizada para purificar la mezcla de células brutas. Puerta para celdas que son simples, en vivo, CD45-, CD31-, CD34-, NG2+, CD146+, y CD140b+. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Imágenes representativas del análisis FACS de células brutas. Representación esquemática de la clasificación utilizada para obtener una población homogénea de pericitas cardíacas. Aproximadamente el 1% de las células brutas son CD31-CD34-CD45-CD140b+NG2+CD146+. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Caracterización de los pericitos cardíacos aislados primarios (A) Las imágenes de Brightfield de células cultivadas del cerebro humano (hPC) y corazones de ratón (mPC) muestran una morfología de células pericitas similares pero diferentes morfologías de las células musculares lisas humanas hSMC) y las células musculares lisas del ratón (mSMC). Barra de escala a 100 m. (B) Caracterización fenotípica de las células en P7 por inmunocitoquímica para marcadores de pericitos. Barra de escala a 100 m.(C) Análisis por citometría de flujo de los pericitas en P7 donde se encerradon por los marcadores negativos CD31, CD34, CD45 y marcadores positivos NG2, CD140b y CD146. La población sigue siendo homogénea. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Imágenes representativas del análisis de citometría de flujo de células endoteliales mediante el panel de marcadores. Se utilizó una línea celular endotelial coronaria de ratón como control para la especificidad de unión para los marcadores. Usando la misma estrategia de gating que se utilizó en la ordenación excepto por una puerta positiva para CD31 en lugar de una puerta negativa, las celdas endoteliales fueron negativas para CD45, CD34, NG2, CD140b y CD146, pero positivas para CD31 como se esperaba. Haga clic aquí para descargar esta figura.
Figura suplementaria 2: Imágenes representativas del análisis de citometría de flujo de diferentes pasajes de mPC. Los pericitos cardíacos aislados primarios fueron cultivados y pasados hasta el pasaje 12. Las células se tiñieron con yoduro de propidium y se analizaron en un citómetro de flujo. La población de control es una mezcla de células muertas y células vivas. No hubo diferencias significativas en el número de células viables entre pasajes. Haga clic aquí para descargar esta figura.
Discusión
Como los estudios sobre los pericitas cardíacos son relativamente nuevos, el papel de los pericitas en la fisiología cardiovascular y la fisiopatología aún no se han definido. En otros órganos, se ha demostrado que desempeñan un papelclave en la homeostasis de los vasos y la perfusión 1,2. En comparación con la literatura de pericitos de otros órganos como el cerebro, hay significativamente menos publicaciones sobre pericytes cardíacos. El aislamiento de los pericitas cardíacos es fundamental para la comprensión de sus características funcionales y mecanismos de señalización. Por lo tanto, este protocolo proporcionará a los investigadores una manera más fácil de acceder a los pericitas cardíacos desde una fuente de tejido más fácilmente disponible y promover estudios sobre su biología. Ayudará a responder preguntas sobre cómo los pericitas cardíacos contribuyen a la homeostasis cardíaca y la fisiopatología, así como a investigar su potencial terapéutico.
La población de pericitas aislada del corazón murino y caracterizada por CD31-CD34-CD45-CD140b+NG2+CD146+ ha sido recida varias veces (hasta P12 y todavía iba fuerte), lo que no disminución de la viabilidad y se propaga rápidamente (FiguraSuplementaria 2). Las células también han sido criocongeladas y recuperadas con al menos 95% de viabilidad. Sin embargo, preferimos usar células P7 o más jóvenes para nuestros experimentos. Comparando las imágenes de campo brillante de nuestros pericidas con los pericitos cerebrales humanos, las dos líneas celulares tienen morfología celular comparable (Figura4A)mientras que difieren en morfología de las células musculares lisas (Figura4A). Nuestras células P7 se caracterizaron por inmunocitoquímica para marcadores de pericita, algunas de nuestro panel FACS (NG2 y CD140b), y algunas no en el panel (vimentina, desmin, SMA) y encontramos que las células expresaban marcadores de pericita homogéneamente (Figura4B). Además, nuestras celdas P7 fueron analizadas por citometría de flujo de nuevo con el mismo panel de marcadores para evaluar los cambios en la expresión de marcador debido al passing y encontramos que no hubo cambios (Figura4C). Por lo tanto, tanto fenotípicamente como morfológicamente, nuestras células son pericitas.
10, Chen etal.12y 13 han mostrado aislamientos de pericita cardíaca exitosas. Sin embargo, el uso de un equipo construido a medida interno para separar los perilículos de los microbuques por Nees et al.10 involucró dos cámaras con bombas que perfundieron la solución de proteasa de ida y vuelta a través de una pila de red de malla, que era difícil de replicar ya que no proporcionó un esquema y / o imagen del aparato y cómo se construyó. 10 islamente así de cerca de periferias cardíacas de muchas especies, nunca pudimos reproducir su método. Nuestro paso de desprendimiento de pericita en nuestro protocolo simplemente utiliza un agitador orbital (para disociar todas las células) que está disponible en la mayoría, si no en todos los laboratorios, con la solución de tejido y enzima en un tubo cónico seguido de un paso de disociación mecánica. No se requiere ningún aparato personalizado. En segundo lugar, los protocolos restantes implican el uso de tejidos humanos y, por lo tanto, la adquisición de tejido humano está limitando a los investigadores. Nuestro protocolo es una modificacióny optimización de los protocolos actuales 9,12 utilizando modelos de ratón (tipo salvaje, modificado genéticamente, enfermos) y materiales que están fácilmente disponibles para todos los investigadores.
Debido a que las células perivasculares en general son sensibles, la viabilidad de las células es fundamental para obtener un buen rendimiento. Durante la adquisición de tejido cardíaco y la tinción de las células, el tejido /células deben mantenerse helados. En segundo lugar, la digestión enzimática del tejido puede requerir optimización de forma individual. Dependiendo de las unidades de actividad en los viales de enzimas, la concentración y el tiempo de digestión pueden necesitar ser optimizados. Asegúrese de que la solución enzimática se prepara fresca cada vez que el rendimiento de lo contrario disminuirá. En tercer lugar, la mezcla bruta contiene una gran cantidad de células, algunas muertas y / o muriendo, es mejor reducir la concentración de FBS en el tampón de tinción de 5% a 2%. Si tiene problemas con las células que obstruyen la boquilla durante la clasificación, enriquezca primero las células utilizando un kit de eliminación de células muertas. También puede agregar el tampón EDTA/HEPES o el tratamiento DNase a la preclasificación celular para evitar el aglutinamiento celular. Por último, debido a que nuestro panel de anticuerpos es bastante grande y utiliza muchos fluoróforos, asegúrese de que sus controles de FMO y controles de compensación se realizan correctamente.
Una limitación a este método es la cantidad de pericytes cardíacos que se pueden obtener por corazón. En nuestro caso, sólo el 1,1% de nuestra mezcla bruta de un corazón de ratón eran pericitos que es comparable al porcentaje en los aislamientos del corazón humano, pero el número de células es significativamente menor debido a la cantidad de tejido cardíaco que proporciona un ratón. Debido a que el número inicial de células es tan bajo después de FACS, sería mejor aislar de varios corazones a la vez. Sin embargo, el problema con eso es el gran número de celdas que necesita ordenar en un día. Si tiene más de 30 millones de células, será difícil atravesar la clase sin afectar la viabilidad de las células. Si el investigador tuviera varios clasificadores de células, aislar se aletea de múltiples corazones en un día sería factible. Otra limitación es que debido a que no sabemos si hay subpoblaciones de pericitos en el corazón como si hubiera músculo esquelético15,16,no sabemos si estamos eliminando un subtipo en nuestra estrategia de gating. Estamos en el proceso de caracterizar nuestros pericitas cardiacos y hasta ahora en nuestros datos inéditos, son funcionalmente como otros pericitas en la literatura.
Nuestro protocolo permitirá a los investigadores responder preguntas sobre propiedades de pericitas cardíacas, características, funcionalidad y otros aspectos que ayudarán a definir su contribución a la homeostasis cardíaca y la hemodinámica. Estas células podrían tener potencial terapéutico a las enfermedades cardiovasculares una vez que su biología se entiende mejor.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al núcleo de citometría de flujo de Amgen por su ayuda con el diseño de paneles de fluoróforos, la solución de problemas y la clasificación de células.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-053-Cl | dilute with 1x DPBS to get 0.1% |
| 100 μM Cell strainer | FisherSci | 22363549 | |
| 15 mL Falcon conical tubes | BD | 352096 | |
| 24-well plate | Corning | CLS3527 | |
| 25 G butterfly needle | FisherSci | 22-253-146 | |
| 31 G needle syringe | FisherSci | B328446 | |
| 50 mL Falcon conical tubes | BD | 352098 | |
| 6-well plate | Corning | CLS3516 | |
| anti-alpha smooth muscle actin rabbit mAb | abcam | ab32575 | Antibody used in ICC 1:100 dilution |
| anti-CD140b rabbit mAb | Cell Signaling | 28E1 | Antibody used in ICC 1:100 dilution |
| anti-CD31 rabbit pAb | abcam | ab28364 | Antibody used in ICC 1:100 dilution |
| anti-desmin rabbit pAb | abcam | ab8592 | Antibody used in ICC 1:100 dilution |
| anti-NG2 conjugated to AF488 | Millipore | MAB5384A4 | Antibody used in ICC 1:100 dilution |
| anti-vimentin rabbit mAb | abcam | ab92547 | Antibody used in ICC 1:100 dilution |
| ArC Amine Reactive Compensation bead kit | Invitrogen | A10346 | compensation beads for Live/Dead Near IR dye |
| Brightfield Microscope | camera attached | ||
| CD140b-PE (clone APB5) | eBioscience | 12-1402-81 | Antibody used in FACS 1:100 dilution |
| CD146-BV605 (clone ME-9F1) | BD | 740434 | Antibody used in FACS 1:100 dilution |
| CD31-APC (clone MEC 13.3) | BD | 551262 | Antibody used in FACS 1:100 dilution |
| CD34-BV421 (clone RAM 34) | BD | 56268 | Antibody used in FACS 1:100 dilution |
| CD45-PE-Cy7 (clone 30-F11) | BD | 552848 | Antibody used in FACS 1:100 dilution |
| Centrifuge | eppendorf | ||
| Collagenase B | Roche | 11088815001 | 0.226 U/mg lyo. |
| Confocal Microscope | |||
| DAPI | ThermoFisher | D1306 | nuclear stain |
| DMEM with 4.5 g/L glucose, L-glutamine & sodium pyruvate | Corning | 10-013-CV | 500 mL |
| Dowell scissors | FST | 15040-11 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Corning | 21-030-CV | 500 mL |
| Dulbecco's Phosphate-Buffered Saline without Ca and Mg (CMF-DPBS) | Corning | 21-031-CV | 500 mL |
| Dumont #5 Fine Forceps | FST | 11254-20 | |
| FACSAria cell sorter | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| FACSAria software | BD | ||
| Falcon tube round-bottom polypropylene, 5 mL | BD | 38057 | |
| Falcon tube with cell strainer cap, 5 mL | BD | 08-771-23 | |
| Fetal Bovine Serum | Corning | 35-015-CV | 500 mL |
| Fine scissors | FST | 14060-09 | |
| FlowJo software | FlowJo LLC | ||
| Fortessa LSR flow cytometer | BD | Lasers: 405 nm 50 mW, 488 nm 100 mW, 561 nm 50mW, 633 nm 11 mW | |
| Gelatin-based coating | Cell Biologics | 6950 | |
| Goat anti-rabbit IgG (H+L) Cross-Absorbed Secondary antibody, Alexa Fluor 488 | Invitrogen | A-11008 | Antibody used in ICC 1:1000 dilution |
| Graefe Forceps | FST | 11049-10 | |
| Heparin sodium solution | Hospira | NDC 0409-2720-02 | 10,000 USP units/10 mL; from porcine intestines |
| Incubator | set at 37 °C, 5% CO2, 95% O2 | ||
| Live/Dead-Near IR | Life Technologies | L10119 | |
| Microscope slides | FisherSci | 12-550-343 | |
| NG2-FITC | Millipore | AB5320A4 | Antibody used in FACS 1:100 dilution |
| Oribital shaker | VWR | Inside 37 °C incubator or room | |
| Paraformaldehyde | FisherSci | 50-980-487 | dilute with 1x DPBS to get 4% |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Petri dish | FisherSci | FB0875714 | |
| Pipette and tips | |||
| ProLong Diamond | ThermoFisher | P36965 | mounting media |
| Propidum Iodide | ThermoFisher | cell viability dye for supplemental figure 2 | |
| Rabbit IgG FITC | eBiosciences | 11-4614-80 | Isotype control antibody - FITC |
| Rat IgG2a APC | Biolegend | 400512 | Isotype control antibody - APC |
| Rat IgG2a BV421 | Biolegend | 400536 | Isotype control antibody - BV421 |
| Rat IgG2a BV605 | BD | 563144 | Isotype control antibody - BV605 |
| Rat IgG2a PE | Biolegend | 400308 | Isotype control antibody - PE |
| Rat IgG2b PE-Cy7 | Biolegend | 400617 | Isotype control antibody - PE-Cy7 |
| SuperBlock | ThermoFisher | 37515 | blocking buffer |
| T75 | ThermoFisher | 156499 | |
| Triton X-100 | Sigma | X100 | detergent, dilute with x DPBS to get 0.1% |
| UltraComp beads | Invitrogen | 01-2222-42 | compensation beads |
| Variable-Flow Peristaltic Pump | FisherSci | 13-876-1 | |
| ViCell Cell counter | Beckman | ||
| Wash buffer | 1:10 dilution of Superblock in 1x DPBS |
Referencias
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Sengillo, J. D., et al. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathology. 23 (3), 303-310 (2013).
- Avolio, E., Madeddu, P. Discovering cardiac pericyte biology: From physiopathological mechanisms to potential therapeutic applications in ischemic heart disease. Vascular Pharmacology. 86, 53-63 (2016).
- Dore-Duffy, P. Isolation and characterization of cerebral microvascular pericytes. Methods in Molecular Medicine. 89, 375-382 (2003).
- Bryan, B. A., D'Amore, P. A. Pericyte isolation and use in endothelial/pericyte coculture models. Methods in Enzymology. 443, 315-331 (2008).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant outgrowth, propagation and characterization of human pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Crisan, M., Corselli, M., Chen, W. C., Peault, B. Perivascular cells for regenerative medicine. Journal of Cellular Molecular Medicine. 16 (12), 2851-2860 (2012).
- Crisan, M., et al. Purification and long-term culture of multipotent progenitor cells affiliated with the walls of human blood vessels: myoendothelial cells and pericytes. Methods in Cellular Biology. 86, 295-309 (2008).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology Heart Circulatory Physiology. 302 (1), H69-H84 (2012).
- Avolio, E., et al. Expansion and characterization of neonatal cardiac pericytes provides a novel cellular option for tissue engineering in congenital heart disease. Journal of the American Heart Association. 4 (6), e002043(2015).
- Chen, W. C., et al. Human myocardial pericytes: multipotent mesodermal precursors exhibiting cardiac specificity. Stem Cells. 33 (2), 557-573 (2015).
- Baily, J. E., et al. Isolation of Perivascular Multipotent Precursor Cell Populations from Human Cardiac Tissue. Journal of Visualized Experiments. (116), e54252(2016).
- Murray, I. R., et al. Skeletal and cardiac muscle pericytes: Functions and therapeutic potential. Pharmacology & Therapeutics. 171, 65-74 (2017).
- Birbrair, A., et al. Role of pericytes in skeletal muscle regeneration and fat accumulation. Stem Cells Development. 22 (16), 2298-2314 (2013).
- Birbrair, A., et al. Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Research. 10 (1), 67-84 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados