Method Article
In vivo Iki foton floresans ömür boyu görüntüleme mikroskobu kullanarak kafa-sabit davranan fareler Içinde bir aktivite, protein kinaz görselleştirme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bir prosedür protein kinaz görselleştirmek için sunulmuştur baş-sabit, davranan fareler bir aktivite. Gelişmiş A-kinaz aktivite muhabiri, tAKARα, kortikal nöronlar içinde ifade edilir ve kafatası penceresinden görüntüleme için erişilebilir hale gelmiştir. İki foton floresans ömür boyu görüntüleme mikroskopisi, uygulanan lokomotif sırasında PKA etkinliklerini görselleştirmek için kullanılır.
Özet
Nöromodüller beyin fonksiyonunda güçlü kontrol sağlar. Nöromodüller sistemlerinin fonksiyon bozukluğu nörolojik ve psikiyatrik bozukluklarla sonuçlanır. Önemini rağmen, hücresel çözünürlük ile nöromodüller olayları izlemek için teknolojiler sadece ortaya çıkmaya başlıyor. Nöromodulatörler, dopamin gibi, norepinefrin, asetilkolin, ve serotonin, onların ilgili G protein-bağlantılı reseptörleri ile nöronal uyarabilirlik modüle için hücre içi sinyal olayları tetikleyici, sinaptik iletişim, ve diğer nöronal fonksiyonları, böylece nöronal ağda bilgi işleme düzenleyen. Yukarıda belirtilen nöromodüller cAMP/protein kinaz A (PKA) yolu üzerine yakınsama. Bu nedenle, tek hücreli çözünürlüğe sahip in vivo PKA görüntüleme, nöronal elektrik faaliyetleri için kalsiyum görüntülemede benzer bir şekilde nöromodüller olayları için bir okuma olarak geliştirilmiştir. Burada, bir yöntem kafa sabit davranan fareler korteks bireysel nöronlar düzeyinde PKA etkinliğini görselleştirmek için sunulmaktadır. Bunu yapmak için, Förster rezonans enerji transferine (FRET) dayanan, tAKARα adlı geliştirilmiş A-kinaz aktivite muhabiri (AKAR) kullanılır. Bu genetik olarak kodlanmış PKA sensörü, DNA plazmidlerinin utero Elektroporasyon (IUE) veya Adeno ile ilişkili virüsün (AAV) stereotaktik enjeksiyonu ile motor korteks haline getirilmiştir. FRET değişiklikleri iki foton floresans ömür boyu görüntüleme mikroskobu (2pFLIM), ışık-saçılma beyin dokusunda FRET sinyali ölçmek için onay FRET ölçümleri üzerinde avantajları sunan kullanılarak görüntülenmiş. Zorunlu lokomotif sırasında PKA etkinliklerini incelemek için tAKARα, hızlı kontrollü bir motorlu koşu bandı üzerinde çalışan veya istirahat eden, uyanık, baş sabit fareler korteks üzerinde kronik kraniyal pencere aracılığıyla görüntülenmiştir. Bu görüntüleme yaklaşımı, ilgili davranışlara bağlı PKA etkinliklerini ve diğer FLIM tabanlı sensörlere in vivo görüntüleme için çalışmak üzere diğer birçok beyin bölgesine geçerli olacaktır.
Giriş
Neuromodulation, ayrıca yavaş sinaptik iletim olarak bilinen, farklı davranışsal durumlar sırasında beyin fonksiyonu üzerinde güçlü bir kontrol oluşturur, stres gibi, uyarılma, dikkat, ve lokomotasyon1,2,3, 4. önemini rağmen, ne zaman ve nerede nöromodüller olayların yer alır çalışma hala kendi bebeklik içindedir. Nöromodüller, asetilkolin dahil, dopamin, noradrenalin, serotonin, ve birçok nörofobiler, G protein birleştiğinde reseptörleri etkinleştirmek (GPCRs), hangi sırayla sıra tetikleyici hücre içi ikinci haberci yolları zaman çizelgelerin geniş bir pencere ile değişen saniyeye kadar saat. Her nöromodülatör sinyalizasyon olayları ayrı bir dizi tetikler iken, Camp/protein kinaz a (PKA) yolu birçok nöromodüller için ortak bir aşağı yol olduğunu1,5. Kamp/PKA yolu nöronal uyarılabilirlik, sinaptik iletim ve plastisite6,7,8,9düzenler ve bu nedenle, nöronal ağ dinamikleri tunes. Farklı nöronlar veya nöronal türler nöromodüller reseptörlerinin farklı türleri veya seviyeleri ifade çünkü10, aynı hücre içi nöromodüller içinde hücre dışı etkileri farklı nöronlar arasında heterojen olabilir, ve böylece, olması gerekir hücresel çözünürlükte okudu. Bugüne kadar, davranış sırasında bireysel nöronlar in vivo nöromodüller olayları izlemek için zor kalır.
Nöromodülasyonun yer alan dinamiklerini incelemek için uygun bir kayıt modalitesi gereklidir. Mikrodializ ve hızlı tarama döngüsel voltammetri sık nöromodüller serbest çalışma için kullanılır, ancak hücresel olayları izlemek için uzamsal çözünürlük eksikliği11,12. Nüfus görüntüleme13nöronal elektrik aktivitesi için bir vekil olarak kullanılan kalsiyum dinamiklerine benzer, PKA görüntüleme hücresel çözünürlükte nöronal bir nüfus arasında nöromodüller olayları okumak için kullanılabilir. Mevcut protokol, hayvan davranışları sırasında PKA etkinliklerini izlemek için geliştirilmiş A-kinase aktivite muhabirinin (AKAR) kullanımını açıklar. Burada açıklanan yöntem, fizyolojik nöromodüller içeren olayları izleyen temporal çözünürlüğe sahip hücre dışı çözünürlükte nöronal nüfusun eşzamanlı olarak görüntülenmesi için izin verir.
Akars bir donör ve bir PKA fosforilasyon substrat peptid ve bir Forkhead-ilişkili (FHA) alan, alt substrat fosforile serin veya treonin bağlanan bir Acceptor floresan proteinleri oluşur14,15. PKA yolunun aktivasyonu üzerine, AKAR substrat peptid fosforilated olduğunu. Sonuç olarak, FHA etki alanı fosforilated substrat peptid bağlar, böylece yakın yakınlığı içine iki fluorophores getiren, AKAR kapalı devlet olarak anılacaktır. Fosforilated AKAR 'ın kapalı durumu, donör ve alıcı fluorophores arasındaki Förster rezonans enerji transferinin (FRET) artması ile sonuçlanır. Fosforile akars oranı PKA aktivite16düzeyine bağlı olduğundan, biyolojik bir örnekteki fret miktarı PKA aktivite seviyesini ölçmek için kullanılabilir16,17,18, 19,20.
AKARs 'ın erken versiyonları, öncelikle iki renkli onay görüntüleme14için tasarlanmıştır. Beyin dokusuna daha derin görüntüleme yapılırken, onay yöntemi, dalga boyu bağımlı ışık saçılma17,18,21nedeniyle sinyal distorsiyonu muzdarip. Aşağıda anlatıldığı gibi, floresans ömür boyu görüntüleme mikroskopisi (flim) Bu sorunu ortadan kaldırır, çünkü flim sadece florophore18,21tarafından yayılan fotonları ölçer. Sonuç olarak, FRET 'in FLıTM ölçümü doku derinliği17' den etkilenmez. Buna ek olarak, bir "karanlık" (yani, düşük kuantum verimi [QY]) alıcı fluorophore varyantı kullanılabilir. Bu, ikinci bir sensördeki eşzamanlı görüntüleme veya morfolojik Marker17,19,20ile ortogonal nöronal özelliklerin çoğullu ölçümünü kolaylaştırmak için bir renk kanalını serbest bırakır.
FLM görüntüleme bir fluorophore heyecanlı durumda, yani, floresan ömrü18harcıyor zaman nicelik. Bir fluorophore zemin devlet, böylece heyecanlı devletin sonuna dönüş, genellikle bir foton emisyonu ile koncomitates. Bireysel bir heyecanlı molekül için bir foton emisyon Stokastik olmasına rağmen, bir nüfusun ortalama floresan ömrü bu özel fluorophore bir özelliğidir. Florozların saf nüfusu aynı anda heyecanlı olduğunda, ortaya çıkan floresan tek bir üstel çürüme takip edecektir. Bu üstel çürümenin zaman sabiti, genellikle floresan proteinleri için bir ila dört nanosaniyeden oluşan ortalama floresans ömürüne karşılık gelir. Bir heyecanlı donör fluorophore zemin devlet dönüş de FRET tarafından ortaya çıkabilir. FRET varlığında, donör fluorophore floresans ömrü azalır. Fosforlu AKARs, nispeten daha uzun donör floresans ömrünü sergiler. PKA tarafından fosforilasyon üzerine, sensör daha kısa bir ömür sergiliyor çünkü donör ve alıcı fluorophores birbirlerine yakın getirilir ve FRET artar. AKARs nüfusunun floresans ömrünü ölçmek bu nedenle PKA aktivitesinin seviyesini temsil eder.
AKARs 'ın erken versiyonları, tek hücreli çözünürlükte in vivo görüntüleme için başarıyla kullanılmadı. Bu esas olarak, AKAR sensörlerin düşük sinyal amplitüle fizyolojik aktivasyonlarının17' si nedeniyle olur. Son zamanlarda, iki foton floresan ömür boyu görüntüleme mikroskobu (2pFLIM) için mevcut AKAR sensörlerini sistematik olarak karşılaştırarak, alternatif sensörlerin daha fazla gerçekleştirilmesi için FLIM-AKAR denilen bir sensör bulunmuştur. Ayrıca, hedeflenen akars (takars) denilen flim-akar türevleri bir dizi belirli alt hücresel konumlarda PKA etkinliğini görselleştirmek için geliştirilmiştir: mikrotübüller (takarα), sitossol (takarβ), aktin (takarδ), filasentous aktin (takarε), membran (takarγ), ve postsinaptik yoğunluk (tAKARζ). TAKARs arasında, tAKARα 2,7-Fold tarafından norepinefrin tarafından ortaya çıkarılan sinyal genliği arttı. Bu bilgi ile tutarlı olduğunu PKA nöronlar çoğunluğu mikrotübüller için dinlenme durumunda demirlemiş22,23. tAKARα 2pFLIM için mevcut AKARs arasında en iyi oyuncu oldu. Ayrıca, tAKARα birden fazla nöromodüller tarafından saptanan fizyolojik olarak ilgili PKA aktivitesini algıladı ve tAKARα ifadesi nöronal fonksiyonları17değiştirmez.
Son zamanlarda, tAKARα başarıyla kafa sabit davranan fareler17PKA etkinliklerini görselleştirmek için kullanıldı. Bu uygulanan lokomotif yüzeysel tabaka nöronların Soma içinde PKA etkinliğini tetikleyen gösterildi (Katman 1 ile 3, bir derinliğe kadar ~ 300 μm Pia) motor, varil, ve görsel korseleler. Lokomotlama tetiklenen PKA aktivitesi, β-adrenergik reseptörleri ve D1 Dopamin reseptörlerinin sinyallerine bağlı olarak, ancak D2 dopamin reseptör antagonisti tarafından etkilenmez. Bu çalışma, takars 'ın 2pflim kullanarak nöromodülasyon olaylarını izleme yeteneğini göstermektedir.
Geçerli protokolde, uygulanan lokomotif paradigma sırasında baş sabit uyanık fareler içinde PKA aktivite görüntüleme için tüm yöntem altı adımda açıklanmıştır. İlk olarak, geleneksel iki foton mikroskobu 2pFLIM yetenekleri eklenmesi (Şekil 1). İkincisi, motorlu bir koşu bandı inşaatı (Şekil 2). Üçüncü olarak, DNA plazmidlerin utero Elektroporasyon (IUE) veya Adeno ile ilişkili virüsün (AAV) stereotaktik enjeksiyonu ile fare korteksinde takarα sensörünün ifadesi. IUE için ameliyatlar için mükemmel protokoller24,25 ve viral parçacıklar stereotaktik enjeksiyon26 daha önce yayınlandı. Kullanılan anahtar parametreler aşağıda açıklanmıştır. İleri, kraniyal pencerenin montajı. Mükemmel protokoller daha önce kranial pencere cerrahisi için yayımlandı27,28. Standart protokollerden değiştirilmiş birkaç adım açıklanmıştır. Beşinci, performans içinde vivo 2pFLIM. Altıncı, 2pFLIM görüntü analizleri (Şekil 3 ve Şekil 4). Bu yaklaşım, diğer birçok baş-sabit davranışsal paradigmalar ve beyin alanları için kolayca uygulanabilir olmalıdır.
Protokol
Burada açıklanan tüm yöntemler, Oregon Sağlık ve Bilim Üniversitesi Kurumsal hayvan bakımı ve kullanım Komitesi (ıAYUC) tarafından onaylanmıştır.
1.2pFLIM mikroskop kurulum
- Bir foton Zamanlama sayımı modülü (PTCM, malzeme tablosu) yükleyin ve üreticinin kılavuzuna göre bilgisayara (Şekil 1) bağlanın.
Not: Ptcm genellikle lazer darbe zamanlaması için bir "Senkronizasyon" girişi ve fotomultipler tüpünden (PMT) bir foton girişi alan bir bilgisayar tahtasındadır. Ayrıca iki foton görüntüleme kontrol yazılımından pikseller, çizgiler ve çerçeveler için saat zamanlaması alır. PTCM, bireysel fotonları farklı piksel ve çerçevelere ayırmak için saat sinyallerini kullanır. - Lazer zamanlamasını ölçmek için > 200 MHz bant genişliğine sahip bir fotodiyot ekleyin. Işık yoluna dik olarak yerleştirilen fotodiyot içine lazer ışığın küçük bir kısmını yansıtmak için ışık yoluna standart bir cam lamel magazini yerleştirin (Şekil 1). Fotodiyot çıkışını PTCM 'nin "Senkronizasyon" girişine bağlayın.
Not: Birçok modern lazerler de lazer zamanlaması çıktı. Bu lazerler için, fotodiyot gerekli değildir ve bir doğrudan PTCM senkron girişine lazer zamanlama çıkışını bağlayabilirsiniz. -
Düşük gürültü, hızlı GaAsP PMT (Şekil 1) ile yeşıl kanal PMT 'Nin tAKARα durumunda PMT 'yi değiş tokuş yapın. PMT çıkışını PTCM 'nin sinyal girişine bağlayın.
- Konvansiyonel iki foton görüntüleme kanalı ile aynı anda yoğunluğun elde edilmesi durumunda isteğe bağlı bir sinyal bölücü (Şekil 1) ekleyin. PMT çıkışını sinyal Bölücüsü ile Birleştir ve Splitter çıkışını PTCM 'ye ve geleneksel iki foton görüntüleme modülüne bağlayın.
Not: GaAsP PMTs, konvansiyonel bialkali PMTs 'den daha hızlı tek foton sinyalleri verir ve foton zamanlamasının daha hassas bir şekilde belirlenmesi için izin verir. GaAsP PMTs 'nin bazı modelleri, ortam sıcaklığının altında 10 − 35 °C ' ye kadar soğutulabilir ve karanlık sayılarının saniyede birkaç yüz altında bir seviyeye bastırılmasına izin verir (genellikle ≤ 200 sayar/s). Bu düşük gürültü seviyesi, floresan ömrünü kesin olarak ölçmek için önemlidir, çünkü gürültü foton sayımları floresans ömür eğrisinden kolayca ayırt edilemez veya çıkartılamaz.
- Konvansiyonel iki foton görüntüleme kanalı ile aynı anda yoğunluğun elde edilmesi durumunda isteğe bağlı bir sinyal bölücü (Şekil 1) ekleyin. PMT çıkışını sinyal Bölücüsü ile Birleştir ve Splitter çıkışını PTCM 'ye ve geleneksel iki foton görüntüleme modülüne bağlayın.
- Eğer varsa, alıcı fluorophore gelen spektral kontaminasyonu en aza indirir bir bant-Pass floresan emisyon filtresi ekleyin. Örneğin, takarα için, yeşil kanal için 500 Nm ± 20 Nm bariyer filtresi, karanlık (qy ~ 0,07) Sarı floresan protein (YFP)29,30olan Acceptor Sreach 'ten gelen kontaminasyonunu azaltmak için kullanılır. Kontrol yazılımına uygun olarak ve PTCM kullanım kılavuzunda açıklandığı gibi, bireysel görüntü pikselleri, çizgiler ve çerçeveler için saatler gibi zamanlama sinyallerini bağlayın. Uygun veri denetimi ve edinme yazılımını yükleyin.
Not: Bazı PTCM üreticileri (malzeme tablosu) 2pFLIM görüntüleme için kendi yazılım sağlar. Burada, özel yazılım Flimımage denilen kullanılır, hangi Yasuda Lab tarafından geliştirilen (Max Planck Florida, kişisel iletişim yoluyla). Bu yazılım, belirli iki foton edinme yazılımına (malzeme tablosu) bir eklenti Kullanıcı işlevi olarak işlev görür. 2pFLIM görüntü elde etmek için iki foton görüntüleme sırasında uygun zamanlamayla PTCM ile iletişim kurar ve kontrol eder.
2. Motorlu Koşu bandı inşaatı
Not: Özel yapılı Motorlu Koşu bandı tasarımı Şekil 2' de gösterilir.
- Bir köpük silindiri (Ø = 200 mm), ince bir testere ile 150 mm uzunluğa keser. Alternatif olarak, tutkal bir köpük topu iki yarısı birlikte ve dikiş üzerine yer bandı. İsteğe bağlı olarak, silindir üzerinde çekiş artırmak için silindir üzerinde profil ile bir kauçuk Mat tutkal.
- Silindir düz tarafında silindir merkezi üzerinden bir 1/4 inç çapı delik matkap veya köpük topu kullanılırsa topun her yarısında ortasında bir 1/4 inç çapı delik matkap.
-
Bir 1/4 inç çapı çelik aks delik üzerinden yükleyin. Köpük silindir/topu aks için köpük uyumlu tutkal kullanarak tutkal. İsteğe bağlı olarak, iki esnek şaft kavramaları değiştirin (1/4 inç iç çapı) köpük silindir/topu aks bağlantı güçlendirmek için.
Not: Birçok ortak yapıştırıcı köpük çözünebilir unutmayın.- Her Şaft bağlantısı için, şaft bağını düz tarafına ve dikdörtgen metal plakasının (0,7 mm x 15 mm x 76 mm) ortasına yerleştirin. Plakayı şaft bağlamasına kaynak yapın. Matkap bir 1/4 inç delik plakanın merkezinde modifiye mil montaj için izin aks ve iki vida delik orta metal plaka lateral içine.
- Şaft bağını, köpük silindiri/topuna karşı aks üzerine takın. İkincisi kullanıldığında, hafifçe topun eğriliği sığacak şekilde plaka viraj. Makarayı/topu aks üzerinde düzeltmek için yan deliklere vidalar yerleştirin.
- Bir kafes plakasının merkezinde 3/8-32 bir iplik matkap ve dokunun ve döner kodlayıcı takın. Motorun Post tutucuya ekmesine izin vermek için sağ açılı motor Braketinin tabanına bir vida deliği takın. Esnek şaft bağlantısı kullanarak hem döner kodlayıcı hem de motoru aks sonuna takın.
- Motor ve döner kodlayıcı için mesajlar kullanarak bir alüminyum ekmek tahtası üzerinde monte koşu bandı yükleyin (Şekil 2). Motor girişlerini hız kumandasını ve döner kodlayıcı çıkışını bilgisayar veri edinme (DAQ) kartının analog girişine bağlayın.
Not: Rotasyon açısal hız voltaj olarak döner kodlayıcı tarafından kodlanmış ve MATLAB yazılmış AnimalTracker denilen özel yazılım kullanılarak dijimleştirilmiş. - Headplate uyumlu tutucuyu sağ açılı bir braket üzerine takın. Koşu bandı önünde ekmek plakasına sağlam bir yazı takın ve montajlı headplate tutucuyu gönderinin sağ açılı braketi ile takın (Şekil 2). Headplate tutucu çubukların aks ile hizalandığından emin olun, böylece Mouse koşu bandı üzerinde yeterli ve rahat bir yürüyüş pozisyonu kabul edebilir (Şekil 2C).
3. fare Cortex tAKARα sensörü ifadesi
-
Utero Elektroporasyon içinde
- IUE için bir DNA çözümünü, bir plazmid DNA 'Sı (3 − 4 μg/μL; bir CAG promotor, sensör dizisi ve bir Woodchuck hepatit virüsü içeren sensör yapıları) hızlı yeşil boya (enjeksiyon sırasında görselleştirme için)% 0,2 son konsantrasyonu ekleyerek hazırlayın Transkripsiyon sonrası yanıt elemanı [WPRE] translasyonel arttırıcı) çözünür/su veya Tris-EDTA seyreltilmiş.
- E1624' de IUE için zamanlanmış hamile kadın fareyi (örn. C57BL/6) hazırlayın. Isoflurane ile fareyi anestezize (indüksiyon için% 4 ve bakım için% 1,5,% 95 O2 ile% 5 CO2) ve 5 mg/kg Meloxicam ve 4 mg/kg Bupivacaine içeren peri-operatif analjeziklerin subkutan enjeksiyonu uygulayın. Karın boşluğunu bir neşter ve bir çift makas ile açın ve uterin boynuzlarını dikkatlice açığa çıkarın.
- Daha önce24tarif olarak, bir yarımküre lateral ventrikül embriyo başına 1 ΜL DNA çözeltisi enjekte.
- Düzenli ıUE gerçekleştirin24 kortikal nöronlar için korteks pozitif elektrot sonu ayak yerleştirerek ve kullanarak 5 100-ms kare bakliyat (38 V) 1 Hz bir electroporator ile.
Not: Elektroporasyon için farklı kortikal bölgeler, elektrot son ayak lateral ventrikül göreli yerleştirme değiştirerek hedeflenebilir.
-
Stereotaktik enjeksiyon
- Stereotaktik cerrahi26için postnatal gün 30 bir fare hazırlayın. Adım 3.1.2 ' de açıklandığı gibi fareyi anestezize ve 5 mg/kg Carprofen içeren peri-operatif analjeziklerin subkutan enjeksiyonu uygulayın.
- Dilute AAV serotip 2/1 (AAV2/1) şırınga filtrelenmiş (0,2 μm selüloz asetat membranı) fosfat tamponlu salin içinde hsyn-takarα-wpre ' i ampirik olarak belirlenmiş bir titresi (~ 1 x 109− 1 x 1010 genomes/μL) olarak ifade eder.
- Motor korteks için aşağıdaki koordinatlarda bir mikroskoptan altında bir el matkap kullanarak bir ~ 500 μm çapı delik matkap: 0,5 mm anterior bregma, 1,2 AA lateral orta çizgi için.
- Bir enjektör monte (örneğin, yağ hidrolik manipülatör, özel yapılan dalgıç/Cam Pipet tutucu ile) bir motorlu manipülatör. Enjeksiyon iğnesini bregma-lambda düzlemine göre 15 ° açıyla yerleştirin. Sırasıyla anterior-posterior ve dorsal-ventral eksenler boyunca 700 μm ve 200 μm ilerlemesine eşdeğer x-ve z-Axes arasında diyagonal bir hareket programlamak.
Not: Amaçlanan görüntüleme alanının hemen üstündeki dokuya zarar vermemek için, AAV parçacıkları bregma-lambda düzlemine göre bir açıyla enjekte edilir. - Enjeksiyon iğnesinin ucunu matkap deliğinin ortasına yerleştirin ve yukarıda açıklanan diyagonal hareketi (~ 25 μm/s) yavaşça çalıştırın. Bu prosedür enjeksiyonu Merkezi 1,2 mm anterior bregma, 1,2 mm lateral orta hat, 0,2 mm Pia altında konumlandıracaktır.
- 20 nL seyreltilmiş viral parçacıklar (~ 10 nL/dak) enjekte edilir. En az 10 dakika bekleyin ve yavaşça enjeksiyon iğnesini (~ 12,5 μm/s) geri çekin.
- Stereotaktik enjeksiyon prosedürü ve tutkal/sütür cilt26bitirmek.
4. kraniyal pencerenin montajı
- IUE (Bölüm 3,1) veya viral partiküllerin stereotaktik enjeksiyonu (Bölüm 3,2), postnatal gün 30 ve 60 arasında tAKARα ifade fareler üzerinde kraniyal pencerenin yerleştirme gerçekleştirin. Viral parçacıklar ile enfekte fare için, virüs enjeksiyonu sonra en az iki hafta kraniyal pencereyi uygulayın. Aşağıdaki detaylar ile daha önce27,28, açıklandığı gibi kranial pencereyi yükleyin. Adım 3.1.2 olarak açıklandığı gibi fareyi anestezize ve peri-operatif analjezikler 0,075 mg/kg Buprenex ve anti-inflamatuar Ajan Dexamethasone 4 mg/kg deri altı enjeksiyon uygulayın.
- Periost çıkarın ve boyun kas geri çekin. Cerrahi sonrası boyun kas maruz önlemek için doku yapıştırıcı ile kafatası cildin kenarı tutkal.
- Bir neşter kullanarak yavaşça kazarak kafatasından herhangi bir periost kurur ve çıkarın. İstenilen görüntüleme alanını çevreleyen görüntüleme başlığı (8 mm iç çapı) yerleştirin. Yapıştırıcı, siyoakrilat bazlı tutkal kullanarak kafatası headplate, diş akrilik çimento izledi. Optimum yapışma için, headplate maruz ve kurutulmuş kafatası bağlı olduğundan emin olun. Tutkal Hızlandırıcı sertleştirme hızlandırmak için kullanılabilir.
- Bir diş matkap kullanarak ve Dura mater maruz (adım 3.2.3 belirtildiği gibi koordinatlar) hedeflenen görüntüleme alanı üzerinde çapı 5 mm 'lik bir daire çizin.
- Tüm kraniyal pencereyi kapsayacak şekilde dura yüzeyine, yapay dura olarak da adlandırılan şeffaf polimer ince bir tabaka uygulayın. Polimer korur ve Dura mater stabilize. Dura mater üzerinde steril bir dairesel lamel magazini (5 mm çapı) yerleştirin. Pencerenin kenarlarında uygulanan siyoakrilat tutkal ile lamel magazini sabitleyin ve ardından diş akrilik çimento.
5. In vivo Two-foton floresans ömür boyu görüntüleme mikroskobu
- Kranial pencerenin yükleme sonrası 2 hafta içinde veya ötesinde 2pFLIM görüntüleme başlar (Bölüm 4). Fare habituate görüntüleme çalışması başlamadan önce fare sık kullanım ve scru, stres nedeniyle deneysel girişim minimize.
- İki foton lazeri kontrol eden yazılımı kullanarak 960 Nm 'ye iki foton uyarma lazer dalga boyu ayarlayın.
- Fare% 4 Isoflurane kullanarak anestezize. Kuyruk-tutam ve nefes oranları gözlemleyerek uygun anestezizasyon onaylayın. Yani, Kuyruk-tutam ve solunum hızı hiçbir yanıt olmalıdır ~ 1 saniye başına nefes azaltılmalıdır. Gereksiz prosedür süresini en aza indirmek ve anestezinin sadece 2-3 dakika sürdüğü için göz yağları kullanılmaz.
- Anestezileştirilmiş fareyi Motorlu Koşu bandına aktarın (Şekil 2C) ve Mouse 'un headplate 'i koşu bandı kurulumunun headplate tutucusuna bağlayın (Ayrıntılar için bkz. Şekil 2 ). 70% etanol ile Mouse üzerinde kranial pencere lamel magazini yüzeyini temizleyin.
- 2pFLIM amacı altında monte fare ile motorlu koşu bandı yerleştirin. Kranial pencere lamel magazini ve amaç arasında damıtılmış su bir damla uygulayın.
- Takılı fare anesteziden uyanırken, takılı fare anesteziden uyanıp, Mouse 'un en az 10 dk. monitör solunum hızı için koşu bandı ve mikroskop ortamına acclimated hale bırakın.
- Epi-aydınlatma altında enjeksiyon konumuna gidin. Sonraki görüntüleme seanslarında aynı ilgi alanının (YG) görüntülemesinde yardımcı olmak için, aydınlık alan altında belge fiducial özellikleri (yani, kan damarlarını).
- Beyin dokusu yayılan ışık dışında herhangi bir gelen ışık ortadan kaldırır. Epi-aydınlatma ışık kaynağını kapatın ve 2pFLIM makinesinin muhafazasının kapanmasını yapın. Donanım komut voltajı kontrolünü değiştirerek 2pFLIM PMT 'yi etkinleştirin.
- Bir z-Stack 2pFLIM görüntü kullanarak 2pFLIM edinme yazılımı Flimımage aşağıdaki önerilen ayarları görüntüleme tAKARα-pozitif somata uyanık fareler. Kare ortalaması 3 kare, tarama hızı 2 ms/hat, görüntü boyutu 128 x 128 piksel ve görüş alanı 90 − 100 μm olarak ayarlanır. Hazırlama ve donanım yapılandırmasına göre görüntüleme ayarlarını yapın.
-
Elde edilen görüntüyü FLIMview 'de inceleyin (ev içinde geliştirilen özel yazılımlar; bkz. Bölüm 6). Foton sayımı optimize etmek ve fotobleaching en aza indirmek için adım 5,9 aşağıdaki görüntüleme ayarlarını yapın.
Not: Bir tAKARα-pozitif Soma in vivo yaşam boyu görüntüleme için YG 'de uygulanabilir bir entegre foton sayısı, belirli bir uyarıcının sonucu olan sinyal genine bağlı olarak ~ 1000 − 10000 fotonlar ( tartışmakonusuna bakın).- Gerektiğinde, azaltılmış görüş alanı, düşük tarama hızı, artan lazer gücü ve entegre foton sayılarını artırmak ve ömür boyu tahmin hatasını azaltmak için ortalamanın artan kare sayısı kullanın. Aynı zamanda, fotoobleaching en aza indirmek için minimal temel lazer gücü, çerçeve ortalamasını ve tarama hızını kullandığınızdan emin olun.
- 5,10 adımda belirlenen ayarları kullanarak z-yığını alımını tekrarlayarak normal bir zaman aralığında görüntü (örn. her 30 − 60 s). Sıfır koşu bandı hızında en az 15 dakika için temel 2pFLIM görüntüleri kazanın.
- 2pFLIM görüntüler alırken 15 dk için ~ 15 cm/s koşu bandı rotasyon hızını ayarlayın. Koşu bandı rotasyonunu kapattıktan sonra ≥ 20 dk için görüntüleme işlemine devam edin, zorunlu lokomotif durdurulduktan sonra PKA aktivitesinin süresini değerlendirmek için.
6.2pFLIM görüntü analizi
-
Elde edilen görüntüleri FLIMview içinde açın ve aşağıdaki parametreleri FLIMview olarak ayarlayın.
Not: parametre ayrıntıları tartışma bölümünde açıklanmıştır.- FLIMview 'deki tek foton sayımı (SPC) minimum ve maksimum Aralık alanlarını tıklayın. Genellikle sırasıyla 1,2 − 2 ile 10 − 12 NS arasında değişen uygun minimum ve maksimum SPC aralığı değerini girin.
- FLIMview t0 değer alanına tıklayın ve t0 değeri (genellikle ~ 2 NS) girin. FLIMview 'da ömür boyu parlaklık minimum eşik değeri alanına tıklayın ve istenen eşik değerini 5 − 30 fotonlara girin.
- Yeni Grup düğmesine (N) tıklayın ve bir deneme grubu adı atayın. Bu, eklenen her FLIM görüntüsünden veri birleştiren bir grup oluşturur.
- FLIMview Roi kontrolleri modülünde Roi düğmesine tıklayın ve bir takarα-pozıtıf Soma etrafında bir ROI çizin. Diğer z derinliklerindeki arka plan fotonlardan kaynaklanan sinyal kontaminasyonunu en aza indirmek için, FLIMview 'daki z-yığını kontrol sürgülerinde alt ve üst z sınırını taşıyarak z-yığını aralığını azaltın.
- + Butonuna tıklayarak gruba flim görüntüsünü ekleyin (adım 6,2). YG ve ömür boyu tahmin hatası (δ,) için Ortalama yaşam süresini (LT, ortalama foton emisyon süresi [MPET] olarak da adlandırılır) hesaplamak için Calc düğmesine tıklayın.
- Kronik 2pflim görüntüleme dizisinde bir sonraki dosyayı açın. 6,4 adımı yineleyin. Zaman içinde doku sürüklenme olabilir, çünkü zaman içinde aynı tAKARα-pozitif Soma ölçmek için YG ve z-Stack aralığının konumunu ayarlamak emin olun.
- Grup denetimleri modülünün açılan menüsünde DELTAMPET/mpet0 ' ı seçin. Taban çizgisi # alanına tıklayın ve dizin (ler) girin (örn., 6,3 adımda oluşturulan gruptaki ilk beş görüntü için 1 2 3 4 5 ). Bu, temel kullanım ömrünü hesaplamak için kullanılan görüntüleri (LT0) tanımlayacaktır.
- Grafiğe tıklayın tanımlanan ROI 'de deneme sırasında tAKARα 'NıN flim yanıtı (δlt/lt0) içeren bir grafik oluşturmak için. Tek ROIs 'in ömür boyu (ΔLT) karşılık gelen temel ömür (LT0) arasında normalleştirilmiş değişiklikler, farklı roıs genelinde lokomotlama SıRASıNDA PKA aktivitesinin karşılaştırılması için izin verir.
Sonuçlar
FRET-FLıTM sensörleri, neuromodulation ile ilgili cAMP/PKA yolu da dahil olmak üzere birçok farklı sinyalizasyon yollarının görselleştirilmesine olanak tanır. Geçerli protokol, son zamanlarda geliştirilen tAKARα sensörünü 2pFLIM ile kombinasyon halinde kullanır ve kafa sabit davranan farelerde PKA etkinliklerini görselleştirebilir. Çoğu mevcut iki foton mikroskopları, Şekil 1 ' de gösterildiği gibi üç ila dört bileşen ekleyerek 2pFLIM yetenekleriyle yükseltilebilir (Ayrıca bkz. Bölüm 1). 2pFLIM elde edilen görüntülerde FRET 'i görselleştirmek için, piksel başına toplanan foton zamanlamasının histogram grafiklerinde ortalama ömür oranının ölçülmesiyle gerçekleştirildi (Şekil 3A, B). Ortalama yaşam süresi, yüksek (soğuk renk) ve düşük (sıcak renk) Ortalama ömürleri, sırasıyla düşük ve yüksek PKA etkinliklerini temsil eden, PKA aktivasyonu ömür boyu düşüşe yol açan pseudo-renkli bir görüntü kullanılarak görselleştirildi. SPC aralığını doğru ayarlamak için bakım alınmalıdır; Bu Aralık, lazer darbe aralığı içinde (örn: 80 MHz darbe hızı 12,5 NS) küçültülmüş donanım kenarı yapıları ile ayarlanmalıdır (Ayrıca bkz. Bölüm 6 ve TARTıŞMA). ROIs içindeki PKA aktivitesinin hesaplanması, belirli bir YG içindeki tüm piksellerin LT 'sini birleştirerek yapılmıştır (Şekil 3c, D). Baş-sabit uyanık fareler bazal yaşam süreleri arasında değişmektedir 1,3 ve 1,8 NS (Şekil 3E). Bazal ve yürürlüğe giren lokomotif sırasında hücresel çözünürlüğe sahip PKA aktivitesinin gerçek zamanlı ölçülmesi için izin verilen baş-sabit uyanık fareler içinde motor korteks takarα görüntüleme (Şekil 4). Deney gün ve aylar içinde tekrarlanabilirler. Zorlanan lokomotif, fare motoru korteks17' nin yüzeysel katmanlarında nöronların popülasyonunda PKA etkinliğini tetikler. Bu PKA aktivitesi β-adrenergik ve D1 reseptörlerinin aktivasyonu ile nöromodülasyon bağlıdır17.
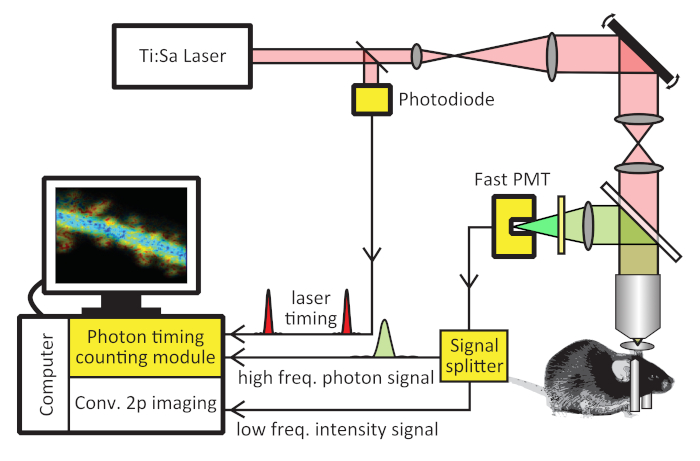
Şekil 1:2pFLIM sisteminin şematik. 2pflim sarı vurgulanan donanım bileşenlerinin ilavesi ile geleneksel bir iki foton mikroskop üzerinde uygulanabilir: bir foton zamanlama sayma modülü, düşük gürültü hızlı fotomultipler tüp (PMT), bir fotodiyot (sadece lazer bir yoksa gerekli Lazer zamanlaması için çıkış sinyali) ve opsiyonel bir sinyal ayırıcı. Bu rakam ma ve al.17' den değiştirildi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
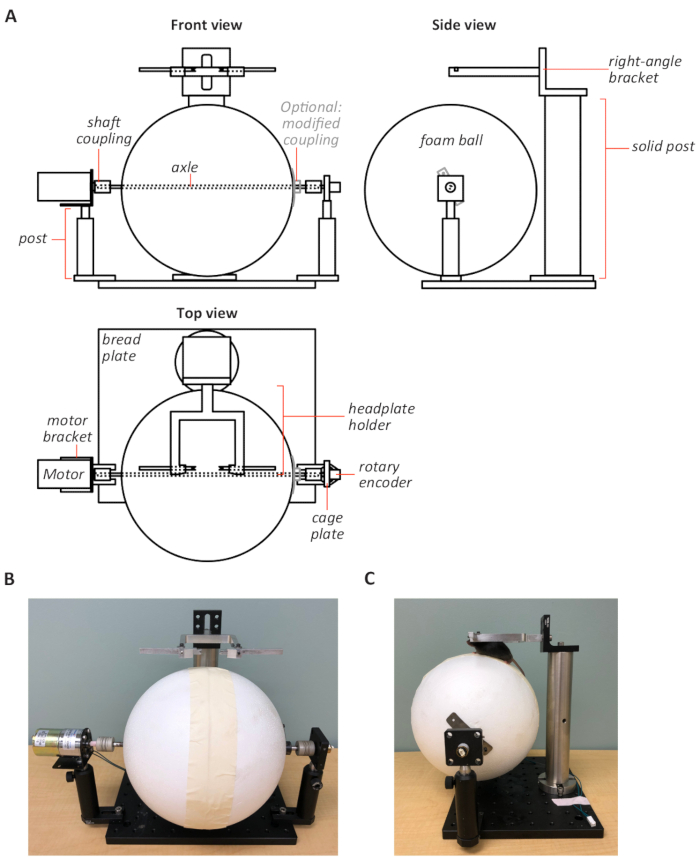
Şekil 2: özel yapılı Motorlu Koşu bandı tasarımı. (A) önden koşu bandı tasarımı şematik (sol üst), yan (sağ üst), ve üst görünümler (sol alt). Koşu bandı (köpük topu) aks bir döner kodlayıcı ve toplu olarak sağlam bir alüminyum ekmek plaka üzerinde iki mesaj üzerine monte edilen bir motor bağlanır. Sağ açılı braket üzerindeki headplate uyumlu tutucu sağlam bir postaya sabitlenir ve koşu bandı üzerinde konumlandırılmış. Şematik çizimler ölçeklemek için değil. Ön (B) ve yan (C) görünüm koşu bandı fotoğrafları. Mouse 'un koşu bandı üzerinde doğru konumlandırılması panel C'de gösterilir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
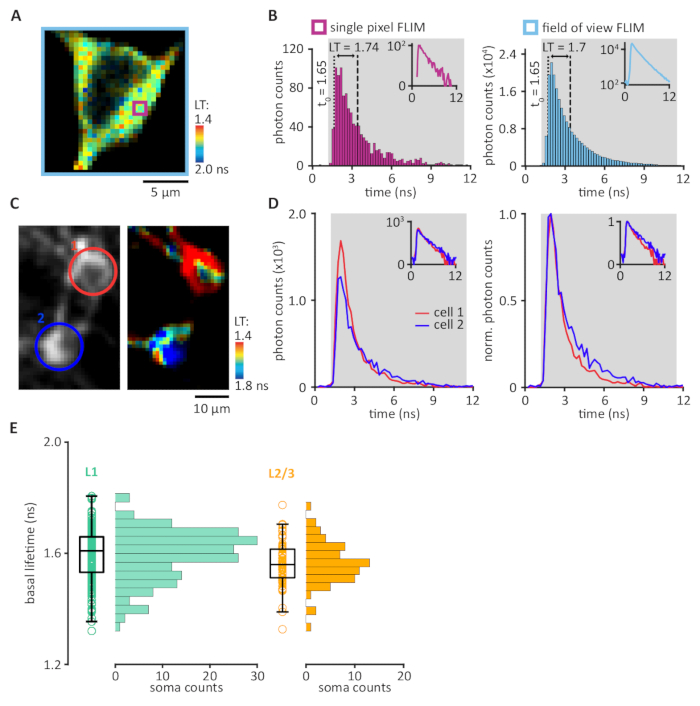
Şekil 3:2pFLIM verilerinin ölçülmesini. (A) her pikseldeki sahte renkli bir flim görüntüsü, bu pikseldeki tüm fotonların lazer zamanlamasına göre ortalama ömrü (lt) temsil eder. (B) tek bir piksel içinde foton varış süreleri ( apanelinde mor kare) bir histogram (sol panel) çizilir. Entegrasyon sınırları tek foton sayım aralığını (SPC, gri) belirlemek için ayarlandı. SPC aralığında, foton zamanlamanın integral fotonların toplam sayısına bölünmüştür ve sonra t0 (1,65 NS, kesik çizgi) tarafından çıkarılır, ortalama bir ömür (lt, kesikli ve noktalı çizgiler arasındaki uzaklık) sonuçlanan 1,74 NS. Tüm görüş alanının ortalama yaşam süresini ölçmek ( Apanelinde açık mavi kare), tüm piksellerde toplanan foton zamanlamasının entegrasyonu (sağ panel), 1,7 NS ortalama bir ömür ile sonuçlanan. İnsets yarı günlük ölçek aynı verileri gösterir. (C ve D) Faiz bölgesi başına ortalama ömür (YG) miktarının belirlenmesi. (C) 2pFLIM görüntü temsili örneği. İki ROIs motor korteks 2/3 katmanında iki somata etrafında çizilmiş. (D) her YG içindeki tüm pikseller arasında entegre edilen foton zamanlama dağıtımları (sol panel). Hücre ROIs renk kodlu (panel Cgösterildiği gibi) kırmızı, hücre 1; mavi, hücre 2. Normalleştirilmiş foton sayısı, iki ROI (sağ panel, ortalama ömür; hücre 1, 1,33 NS; hücre 2, 1,73 NS) arasındaki foton zamanlama dağılımlarının karşılaştırılması için izin verir. İnsets yarı günlük ölçek aynı verileri gösterir. (E) motor korteks yüzeysel katmanlarda 254 görüntülenmiş hücrelerden ortalama bazal ömürleri dağıtım arsa. PIA altında 100 μm içinde ikamet eden L1 hücreleri (n = 186 hücreler/11 hayvan, sol panel), AAV2/1-hSyn-tAKARα-WPRE ve L2/3 piramit hücrelerinin (n = 68 hücreler/4 hayvan, sağ panel) stereotaktik enjeksiyonu sonra tAKARα ifade, Pia altında en az 150 μm ikamet, CAG-tAKARα-WPRE DNA yapısının ıUE 'den sonra tAKARα 'Yı ifade etti. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
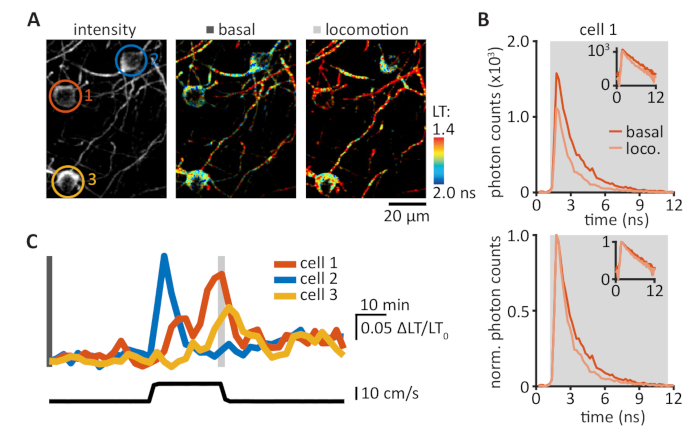
Şekil 4: tAKARα, motor korteksinde lokomotuna bağlı PKA etkinliklerini zorlanıyor. (A) motor korteksinde üç L1 hücrenin temsili yoğunluğu (sol panel) ve ömür (orta ve sağ paneller) görüntüleri. Hücre ROIs renk kodlu: turuncu, hücre 1; mavi, hücre 2; sarı, hücre 3. (B) foton zamanlama dağılımları, bazal durumda (orta panel Αcinsinden ölçülen turuncu iz) ve zorlanan lokomotif (sağ panelde ölçülen, hafif turuncu iz) sırasında hücre 1 ' de (üst panel) ölçülür. Normalleştirilmiş foton sayıları doğrudan karşılaştırma için izin foton zamanlama dağılımı (alt panel, ortalama ömür: Bazal, 1,72 NS; lokomotlama, 1,42 NS). İnsets yarı günlük ölçek aynı verileri gösterir. (C) buna karşılık gelen hücrelerin (üst panel, bkz. Panel A) (alt panel) ile ilgili hücrelerde (b) δlifetime/ömür boyu0 (δlt/lt0) izleri. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
Bu protokol, beyin-sabit davranan fareler içinde nöromodülasyon-tetiklenen PKA etkinliğini görselleştirmek için FRET-FLıTM sensörü tAKARα kullanımını gösterir. Bu uygulama, elde edilen FLIM sinyalinin fizyolojik nöroformüller arasındaki olayların17ile alakalı olduğunu göstermek Için tAKARα in vitro ve in vivo kapsamlı test ve karakterizasyonu üzerine kuruludur. Burada, bir in vivo uygulama, motor korteks lokomotif kaynaklı PKA aktivite, beyin sensörü teslim prosedürleri tanımlamak için kullanılır, görüntüleme için hayvan cerrahisi, davranış ve görüntüleme veri edinme için donanım ve yazılım gereksinimleri ve yazılım ve algoritmalar görüntüleme veri analizleri için.
TAKARα sensörü, DNA plazmidlerinin ıUE veya AAV parçacıklarının stereotaktik enjeksiyonu ile korteks ile tanıtılmaktadır. Elektroporasyon parametreleri ve DNA konsantrasyonları bağlı olarak, kortikal nöronların çeşitli etiketleme yoğunluğuna aksel25nispeten büyük bir alan üzerinde sonuçları. IUE kullanılarak etiketli kortikal tabaka, cerrahi yapıldığında embriyonik aşama tarafından belirlenir. AAV parçacıklarının stereotaktik enjeksiyonu, tanımlanmış bir beyin subregion içinde birçok hücreye görüntü istendiği zaman kullanılır. Genellikle enjeksiyon merkezinde yoğun etiketli nöronlar sonuçları ve giderek daha seyrek merkezden daha etiketleme. Önemlisi, beynin içindeki hücrelerin enfeksiyon verimliliği kullanılan AAV serotipi bağlıdır. AAV2/1, nispeten düşük retrograd etiketleme faaliyetleri ile kortikal, thalamic ve striatal nöronlar büyük verimlilik sunar. Hedeflenen beyin bölgesi ve hücre tipi için hangi AAV serotürün en verimli olduğunu ampirik olarak kurmak tavsiye edilir. Hem transfeksiyon yöntemleri başarıyla tAKARα ifade etmiştir. İfade seviyesi için "tatlı nokta" ampirik olarak belirlenir.
Zorlanan lokomotif, motor korteks 2/3 nöron katmanında artan PKA faaliyetlerine neden olmaktadır. Şu anda, 2pFLIM fare Head-Fixation nedeniyle testlenebilir davranışlar aralığını sınırlar. Ancak, davranışsal paradigmalar sürekli büyüyen bir liste başarıyla bu kısıtlama içinde, raporlama uyaranlara gelen sanal gerçeklik uzamsal oryantasyon go/no-go görevleri arasında değişen uygulandı31,32,33 . Buna ek olarak, geliştirilmiş Yöntemler, striatum, amilala ve hipokampus gibi derin beyin bölgelerinde, iğne benzeri degrade indeksi (unıng) lens13 (yayınlanmamış gözlemler) aracılığıyla görüntüleme özelliğini etkinleştirebilir. Bu nedenle, nöromodüller olayların in vivo görselleştirme için tAKARα ve 2pFLIM kullanımı ayrıntılarıyla mevcut protokol kolayca baş sabit davranışsal paradigmalar bağlamında birçok beyin bölgeleri için uygulanabilir olmalıdır.
Piksel başına ömür veya eğrisi sığdırma kullanarak YG hesaplama zaman alıcı ve piksel başına sınırlı toplam foton sayısı genellikle montaj hataları sonuçlanır. Bu nedenle, ortalama ömür (lt) aritmetik yaşam süresi için bir yaklaşım olarak hesaplanır (τ)17,34:
 (Denklem 1)
(Denklem 1)
Burada SPCMinve SPCMaks ölçüm penceresi (SPC) kenarlıkları ve F (t) Floresan yaşam boyu çürüme eğrisi olduğunu. Diğer bir deyişle, her hesaplanan birim (piksel veya YG, Şekil 3A) için foton zamanlama dağılımı bir histogram içinde çizilir (Şekil 3B). SPC aralığında bu dağılımın ağırlıklı integral (ağırlık süresi ile), ortalama bir emisyon süresi ile sonuçlanır toplam foton sayısına ayrılır. Bu kez t0için düzeltilmiştir. Ömür boyu görüntü oluşturmak için (Şekil 3A) Bu yordam her piksel için gerçekleştirilir, ancak YG başına yaşam süresi hesaplaması (Şekil 3c, D) tüm fotonları YG hacmi içindeki eşiğin üzerindeki tüm piksellerden tümleştirir. Ömür boyu tahmin hatası (δ,) entegre yoğunluk (Nfoton: Toplam foton sayısı) kullanılarak hesaplanır:
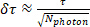 (Denklem 2)
(Denklem 2)
Ömür boyu tahmin hatasını en aza indirmek için, δ, ve uygun sinyal algılama verimi FRET-FLıTM YG başına yeterli fotonların alımını gerektirir. İstenen sinyal-gürültü oranı (SNR) elde etmek için, δ, ayrıca aşağıdaki denklemin karşılaması gerekir:
 (Denklem 3)
(Denklem 3)
Örneğin, motor korteks içinde nöronal Soma içinde lokomotasyon sırasında tipik ölçüm (lt = 1,57 NS, Nfoton = 9075, δlt = 0,15 NS; Şekil 4, hücre 1) bir ömür boyu tahmin hatası verir:

 δ, 0,016 NS
δ, 0,016 NS  (denklem 4)
(denklem 4)
hangi bir sinyal-gürültü oranı sonuçlanır:
Snr 
 =
= 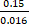
 9,4 (denklem 5)
9,4 (denklem 5)
Eğer istenen bir SNR sadece 5 ise, ΔLT = 0,15 NS ile bir δτ izin verilir:

en az toplam foton sayımı gerektirir:

Yukarıda açıklandığı gibi, ömür boyu ölçüme SPC aralığı, t0ve ömür boyu parlaklık minimum eşik gibi çeşitli parametreler uygun şekilde ayarlanması gerekir. SPC aralığı, donanım ölçüm penceresi içinde yayılan fotonların ölçüm penceresini belirler (denklem 1; lazer 80 MHz 'de tekrarlanırsa, donanım ölçüm penceresi genellikle 0 − 12.5 NS 'dir). Bu protokolde kullanılan PTCM kenar yapıları olduğundan bu gereklidir. SPC Serisi, kenar yapıları dahil olmadan donör foton ömür boyu dağılımının çoğunu birleştirmek için ayarlanır. Ortalama yaşam süresini hesaplamak için, ölçüm penceresinden ortalama foton zamanlaması t0ile çıkarılır ve bu da pencerenin içindeki lazer nabzının zamanlamasına karşılık gelir (denklem 1, Şekil 3A, B)17,34. t0 , sinyal kablosu uzunlukları veya ptcm ayarlarını değiştirerek ayarlanabilir ve genellikle donanım ölçüm penceresinin başından itibaren ~ 2 NS olarak ayarlanır. Sistemin ilk karakterizasyonu sonra, genellikle yakın ideal görüntüleme koşulları altında gerçekleştirilen (örneğin, görüntüleme 5 μM floresan çözeltisi), hem SPC aralığı ve t0 belirli bir donanım yapılandırması sabit parametreler olarak ayarlanır. Ömür boyu parlaklık minimum eşik, yalnızca toplam foton sayımı olan piksellerin görüntü ve analizlere eşit veya daha yüksek eşik değerine dahil edilmesini sağlayacak şekilde ayarlanır. Bu, arka plan foton sayılarının nedeniyle paraziti etkili bir şekilde azaltır, otomatik yağlanma, ortam ışığı ve spontan PMT karanlık sayıları dahil. Bu eşik ampirik olarak belirlenir.
İn vivo 2pFLIM görüntüleme için başarılı FRET-flıtm sensörleri en az üç ortak özelliği vardır. İlk olarak, fluorophores seçimi ile ilgili olarak, foton toplama verimliliği genellikle şiddetli ışık saçılma beyin dokusu nedeniyle kısmen zorlu in vivo görüntüleme ortamı altında düşüktür. Aynı zamanda, yüksek sayıda algılanan fotonların arzu edilen bir SNR elde etmek için gereklidir (≥ 1.000 fotonlar bir ΔLT/LT0 IÇIN 1 SNR elde etmek için gerekli olacaktır 0,03; bkz: denklemler 2 ve 3). Bu nedenle, yüksek foton bütçeli bir donör fluorophore (yani, bir fluorophore önce algılanabilir fotonların maksimal sayısı ağartılmış) tercih edilir. Şu anda, iki foton uyarma altında foton bütçesi açısından farklı donör fluorophores sistematik bir karşılaştırma yoktur. Ampirik olarak, eGFP nispeten parlak iken daha fazla photostable yeşil/sarı spektrumunda diğer birçok fluorophores karşılaştırıldığında, bu FRET-FLIM sensörleri in vivo kullanımı için büyük bir donör fluorophore yapma. Buna ek olarak, FRET optimum ölçmek için, donör fluorophores tek üstel floresans ömür boyu çürüme ile tercih edilir. ECFP gibi onay görüntüleme için yaygın olarak kullanılan birçok donör floresan proteinleri, fluorophorlerin karışık popülasyonlarından oluşmasına işaret eden çok üstel floresan ömür boyu çökmektedir. Bu floresan proteinleri bu nedenle FRET-FLıTM21için ideal değildir. Donör fluorophore aksine, alıcı fluorophore düşük kuantum verim FRET-FLıTM sensörleri için yararlı olabilir. "Karanlık" düşük-irradiant fluorophore sREACh tAKARs için kullanılır. Alıcı fluorophore düşük kuantum verim donör fluorophore emisyon spektrumunda foton kontaminasyonu en aza indirir ve kırmızı spektrumunda ikinci bir floresan sensör veya morfoloji Marker eşzamanlı görüntüleme için bir floresan algılama kanalı serbest bırakır tAKARα durumunda.
İkinci olarak, bağlayıcı kesir aralığında yeterli SNR elde etmek için, ~ 0.5 − 0.7 ' nin optimum FRET verimliliği21tercih edilir. Sinyal, yani, belirli bir donör-alıcı bağlayıcı oranı değişikliği altında ortalama ömür değişimi, FRET verimliliği bağlıdır. FRET verimlilik ve ortalama ömür değişim arasındaki bu ilişki, ancak, doğrusal olmayan. FRET verimliliği bir yaklaşırsa, bağlı-Devlet donör fluorophores etkili neredeyse hiçbir fotonları yayan vardır. Bu nedenle, bağlayıcı oranı% 100 olmadıkça (hiçbir Acceptor fluorophore% 100 için olgunlaşır çünkü bu durum asla) ortalama ömür, açık devlet içinde donör fluorophore ömrü yaklaşımlar ve bağlı Devlet sensörleri tespit yeteneği Azalır. TAKARα için FRET-verimlilik olumlu aralığı içinde, ~ 0,7 olduğu tahmin edilir.
Üçüncü olarak, FRET-FLıTM sensörleri hayvan fizyolojisi ile ilgili bir duyarlılık ve kinetik sinyalleri bildirmelidir. Sensör hassasiyeti ve kinetiği, in vivo olarak kullanımından önce yaygın olarak test edilmelidir ve gerekirse substrat bağlama etki alanı benzeşimi ve kinetik, bağlayıcı optimizasyonu ve alt hücresel ayarlama gibi çeşitli yaklaşımlar kullanılarak ayarlanabilir. hedefliyoruz. Önceki çalışma, bu tAKARα endojen dopamin bültenleri tarafından ortaya çıkılan PKA etkinliğini algılayabilir kuruldu, ve kinetik ve sensörün hassasiyeti bilinen bir PKA bağımlı biyolojik süreç ile hizalanır, hangi norepinefrin kaynaklı yavaş hiperpolarizasyon akımı17' nin inaktivasyonu. Ayrıca, takarα ifadesi Elektrofizyoloji17 ve bireysel dikenler (yayınlanmamış gözlemler) yapısal Plastisite ölçümü tarafından belirtildiği gibi, nöronal fonksiyonları değiştirmek için görünmüyor.
2pFLIM görüntüleme geçerli teknik sınırlamaları veri işleme ve foton sayım yolları ile ilgilidir. İlk olarak, FLM her piksel için foton varış süreleri depolama gerektirir. PTCM bellek boyutu elde edilebilir piksel çözünürlüğü sınırlar. Burada açıklanan PCTM için, 64-nokta zaman çözünürlüğü ile görüntü çerçevesi başına 256 x 256 piksele kadar elde edilebilir. Buna ek olarak, pano 'dan bilgisayar depolamaya FLIM görüntü verilerinin aktarım hızı, çözünürlük ve örnekleme frekansına pratik sınırlar koyarak nispeten yavaştır. Bellek kapasitesi ve veri işleme sürekli teknolojik iyileştirme gelecekte bu sınırlamaları çözebilir. Ikinci, yaygın olarak kullanılan PTCMs analog-dijital sistemler ve onların foton algılama sıfırlama süreleri ile sınırlıdır (yani, "ölü zaman"). Bu bir foton algılandıktan sonra ptcm sonraki 100 − 125 NS18,21için herhangi bir sonraki foton (s) geliş kayıt olmayacaktır anlamına gelir. Ayrıca, ömür boyu ölçüm bir lazer Pulse sonra ilk geldi foton doğru önyargılı ("kazık-up" denir). Bunlar, foton sayım oranlarını, s başına < 107 fotonlara sınırlar. Çoğu tipik iki foton görüntüleme rejiminde bu önemli bir sorun değildir rağmen, bakım foton sayma oranı sınırlarını aşmamak alınmalıdır. Daha kısa ölü zaman veya bir gigahertz sürekli veri edinme sistemi olan yeni PTCMs bu sınırlama hafifletebilir (ikincisi için görmek Yellen ve MONGEON18).
Kamp/PKA, AKT/PKB, PKC ve erk gibi sinyalizasyon yolları için floresan sensörler sürekli olarak oluşturulan ve optimize16,35. Mevcut sensörlerin çoğu için, zorlu in vivo görüntüleme ortamında daha fazla karakterize ve optimizasyona ihtiyaç vardır. Özellikle, sinyal amplitüte herhangi bir artış kare bir ilişki ile foton bütçeleri talep azaltır olarak, artan sinyal genliği önemlidir. TAKARα için, norepinefrin gibi endojen nöromodüller için yanıt genliği, önceki en iyi sensör ile karşılaştırıldığında 2,7-kat tarafından geliştirilmiştir. Bu, gerekli fotonların ~ 7 kat düşüşe çevrildi. Uygulamada, bu büyük ölçüde yanlış negatiflerin sayısını azalttı (yani, müdahale etmeyen) hayvanlar davranış sırasında17. Gözlenen maksimum tAKARα sinyali ~% 30 ' dır (ΔLT/LT0). Bugüne kadar, bu FRET sensörleri benzer sınıflar için bildirilen en büyük FLIM sinyalidir. Ayrıca, FHA 'nın alıcı fluorophore ve benzerlerini fosforilated threonine optimize ederek daha da iyileştirme mümkün olabilir. Buna ek olarak, aynı sinyalizasyon yolunun farklı yönlerini izleyen sensörlerin kullanımı, in vivo sinyalizasyon yollarının düzenlenmesini mekanik olarak araştırmak için güçlü bir yaklaşım sağlayabilir. Gelecekte, FLM sensörlerinin nöromodüller sinyalizasyon yollarını görselleştirmek için başarılı bir şekilde uygulanması, nöromodüller gibi davranan farelerin bozulmamış nöronal ağlarda nerede ve ne zaman gerçekleşeceği konusunda önemli Öngörüler sağlayacaktır.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Biz MS. Tess J. Lameyer, Bayan Ruth Frank, ve Dr Michael A. Muniak düzenlemeler ve yorumlar için, ve Dr Ryohei Yasuda Max Planck Florida 2pFLIM edinme yazılımı için teşekkür ederiz. Bu çalışma iki beyın girişimi Ödülleri U01NS094247 (H.Z. ve Me) ve R01NS104944 (H.Z. ve tum), bir R01 Grant R01NS081071 (tum) ve bir R21 Grant R21NS097856 (H.Z.) tarafından destekleniyordu. Tüm ödüller Ulusal nörolojik hastalıklar Enstitüsü ve Stroke, Amerika Birleşik Devletleri vardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 μm cellulose acetate syringe filter | Nalgene | 190-2520 | Step 3.2.2. |
| 16x 0.8 NA water-immersion objective | Nikon | MRP07220 | Step 5.5. |
| 3-pin cable | US digital | CA-MIC3-SH-NC | Step 2.5. To connect rotation sensor to the DAQ input of the microscope |
| Aluminum bread board | Thorlabs | MB1012 | Step 2.5. |
| AnimalTracker MATLAB software | N/A | N/A | Step 2.5 and sections 5 - 6. Will be provided upon request to the lead author |
| Band-pass barrier filter | Chroma | ET500-40m | Step 1.4. |
| Cage plate | Thorlabs | CP01 | Step 2.4. Used as mount for rotation sensor |
| Carbon steel burrs for micro drill, 0.5 mm tip diameter | FST | 19007-05 | Steps 3.2.3. and 4.4. |
| Circular coverslip (5 mm diameter) | VWR | 101413-528 | Step 4.5. |
| Custom-made injection needle holder | N/A | N/A | Step 3.2.4. Technical details provided upon request to the lead author |
| Dental acrylic | Yates Motloid | 44114 | Steps 4.3. and 4.5. |
| Dental drill; Microtorque ii | Ram products | 66699 | Steps 3.2.3. and 4.4. |
| Dowsil transparent polymer | The Dow Chemical Company | 3-4680 | Step 4.5. Artificial dura |
| Electroporation electrode | Bex | LF650P5 | Step 3.1.4. |
| Electroporator | Bex | CUY21 | Step 3.1.4. |
| Fast green FCF | Sigma-aldrich | F7258-25G | Step 3.1.1. |
| FLIMimage MATLAB software | N/A | N/A | Section 5. Kindly provided by Dr. Ryohei Yasuda, Max Planck Florida |
| FLIMview MATLAB software | N/A | N/A | Sections 5. and 6. Will be provided upon request to the lead author |
| Foam-compatible glue (Gorilla White Glue) | Gorilla | 5201204 | Step 2.3. |
| Headplate | N/A | N/A | Step 4.3. Technical details provided upon request to the lead author |
| Headplate holder | N/A | N/A | Step 2.6. Technical details provided upon request lead author, used in combination with mounting post bracket and right-angled bracket |
| Hydraulic micromanipulator | Narishige | MO-10 | Step 3.2.4. |
| Krazy glue | Krazy glue | KG82648R | Step 4.3. Cyanoacrylate-based glue |
| Low-noise fast photomultiplier tube | Hamamatsu | H7422PA-40 or H10769PA-40 | Step 1.3. |
| MATLAB 2012b | Mathworks | N/A | Steps 2.6, and sections 5, and 6. Used to run microscope acquisition and data analysis software |
| Motor | Zhengke | ZGA37RG | Step 2.4. |
| Motor speed controller | Elenker | EK-G00015A1-1 | Step 2.5. |
| Motorized micromanipulator | Sutter | MP-285 | Step 3.2.4. |
| Mounting base | Thorlabs | BA1S | Step 2.5. Used for posts for motor and sensor in combination with PH4 and TR2 |
| Mounting post | Thorlabs | P14 | Step 2.6. Used for headplate holder post in combination with PB2 |
| Mounting post base | Thorlabs | PB2 | Step 2.6. Used for headplate holder post in combination with P14 |
| Mounting post bracket | Thorlabs | C1515 | Step 2.6. Used in combination with right-angle bracket and headplate holder |
| Optical post | Thorlabs | TR2 | Step 2.5. Used for posts for motor and sensor in combination with BA1S and PH4 |
| Phosphate-buffered saline | Ν/Α | Ν/Α | Step 3.2.2. Protocol: Cold Spring Harbor Protocols 2006, doi: 10.1101/pbd.rec8247 |
| Photodiode | Thorlabs | FDS010 | Step 1.2. |
| Photon timing counting module | Becker and Hickl | SPC-150 | Step 1.1. |
| Plasmid: tAKARα (CAG-tAKARα-WPRE) | Addgene | 119913 | Step 3.1.3. |
| Post holder | Thorlabs | PH4 | Step 2.5. Used for posts for motor and sensor in combination with BA1S and TR2 |
| Right-angle bracket | Thorlabs | AB90 | Step 2.6 Used in combination with mounting post bracket and headplate holder |
| Rotation encoder | US digital | MA3-A10-250-N | Step 2.4. |
| Rubber mat | Rubber-Cal | B01DCR5LUG | Step 2.1. |
| Shaft coupling (1/4 inch x 1/4 inch) | McMaster | 6208K433 | Steps 2.3. and 2.4. |
| ScanImage 3.6 | Svoboda Lab/Vidrio Technology | N/A | Steps 5.9. and 6.1. |
| Signal splitter | Becker and Hickl | HPM-CON-02 | Step 1.3.1. |
| Stainless steel axle (diameter 1/4 inch, L = 12 inch) | McMaster | 1327K66 | Step 2.3. |
| Stereotaxic alignment systsem | David kopf | 1900 | Steps 3.2. and 4.1. modified; Sutter micromanipulator, custom-made injection needle holder, hydraulic micromanipulator |
| Two-photon microscope | N/A | N/A | Section 5. Built based on Modular in vivo multiphoton microscopy system (MIMMS) from HHMI Janelia Research Campus (https://www.janelia.org/open-science/mimms) |
| Vetbond tissue adhesive | 3M | 14006 | Step 3.2.6. |
| Virus: tAKARα (AAV2/1 hSyn-tAKARα-WPRE) | Addgene | 119921 | Step 3.2.2. |
| White PE foam roller (8 inch x 12 inch) | Fabrication enterprises INC. | 30-2261 | Step 2.1.1. |
| White polystyrene fom ball halves | GrahamSweet | 200mm diameter 2 hollow halves | Step 2.1.1. |
| Zipkicker | PACER | PT29 | Step 4.3. Hardening accelerator |
Referanslar
- Greengard, P. The Neurobiology of Slow Synaptic Transmission. Science. 294 (5544), 1024-1030 (2001).
- Petersen, S. E., Posner, M. I. The attention system of the human brain: 20 years after. Annual Review of Neuroscience. 35 (2), 73-89 (2012).
- Sun, Y., Hunt, S., Sah, P. Norepinephrine and Corticotropin-Releasing Hormone: Partners in the Neural Circuits that Underpin Stress and Anxiety. Neuron. 87 (3), 468-470 (2015).
- Berke, J. D. What does dopamine mean?. Nature Neuroscience. 21 (6), 787-793 (2018).
- Chen, Y., et al. Endogenous Gαq-Coupled Neuromodulator Receptors Activate Protein Kinase A. Neuron. 96 (5), 1070-1083 (2017).
- Madison, D. V., Nicoll, R. A. Cyclic adenosine 3’,5’-monophosphate mediates beta-receptor actions of noradrenaline in rat hippocampal pyramidal cells. The Journal of Physiology. 372 (1), 245-259 (1986).
- Yasuda, H., Barth, A. L., Stellwagen, D., Malenka, R. C. A developmental switch in the signaling cascades for LTP induction. Nature Neuroscience. 6 (1), 15-16 (2003).
- Pedarzani, P., Storm, J. F. PKA mediates the effects of monoamine transmitters on the K+ current underlying the slow spike frequency adaptation in hippocampal neurons. Neuron. 11 (6), 1023-1035 (1993).
- Brandon, E. P., Idzerda, R. L., McKnight, G. S. PKA isoforms, neural pathways, and behaviour: making the connection. Current Opinion in Neurobiology. 7 (3), 397-403 (1997).
- Radnikow, G., Feldmeyer, D. Layer- and Cell Type-Specific Modulation of Excitatory Neuronal Activity in the Neocortex. Frontiers in Neuroanatomy. 12 (January), (2018).
- Kennedy, R. T. Emerging trends in in vivo neurochemical monitoring by microdialysis. Current Opinion in Chemical Biology. 17 (5), 860-867 (2013).
- Rodeberg, N. T., Sandberg, S. G., Johnson, J. A., Phillips, P. E. M., Wightman, R. M. Hitchhiker’s Guide to Voltammetry: Acute and Chronic Electrodes for In Vivo Fast-Scan Cyclic Voltammetry. ACS Chemical Neuroscience. 8 (2), 221-234 (2017).
- Hamel, E. J. O., Grewe, B. F., Parker, J. G., Schnitzer, M. J. Cellular level brain imaging in behaving mammals: An engineering approach. Neuron. 86 (1), 140-159 (2015).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochemical and Biophysical Research Communications. 348 (2), 716-721 (2006).
- Zhang, J., Ma, Y., Taylor, S. S., Tsien, R. Y. Genetically encoded reporters of protein kinase A activity reveal impact of substrate tethering. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14997-15002 (2001).
- Chen, Y., Saulnier, J. L., Yellen, G., Sabatini, B. L. A PKA activity sensor for quantitative analysis of endogenous GPCR signaling via 2-photon FRET-FLIM imaging. Frontiers in Pharmacology. 5 (April), 1-12 (2014).
- Ma, L., et al. A Highly Sensitive A-Kinase Activity Reporter for Imaging Neuromodulatory Events in Awake Mice. Neuron. 99 (4), 665-679 (2018).
- Yellen, G., Mongeon, R. Quantitative two-photon imaging of fluorescent biosensors. Current Opinion in Chemical Biology. 27, 24-30 (2015).
- Tang, S., Yasuda, R. Imaging ERK and PKA Activation in Single Dendritic Spines during Structural Plasticity. Neuron. 93 (6), 1315-1324 (2017).
- Tillo, S. E., et al. Liberated PKA Catalytic Subunits Associate with the Membrane via Myristoylation to Preferentially Phosphorylate Membrane Substrates. Cell Reports. 19 (3), 617-629 (2017).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16 (5), 551-561 (2006).
- Theurkauf, W. E., Vallee, R. B. Molecular characterization of the cAMP-dependent protein kinase bound to microtubule-associated protein 2. Journal of Biological Chemistry. 257 (6), 3284-3290 (1982).
- Zhong, H., et al. Subcellular dynamics of type II PKA in neurons. Neuron. 62 (3), 363-374 (2009).
- Borrell, V., Yoshimura, Y., Callaway, E. M. Targeted gene delivery to telencephalic inhibitory neurons by directional in utero electroporation. Journal of Neuroscience Methods. 143 (2), 151-158 (2005).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-, Lateral Septal Nucleus- and Striatum-specific In utero Electroporation in the C57BL/6 Mouse. Journal of Visualized Experiments. (107), e53303 (2016).
- Lowery, R. L., Majewska, A. K. Intracranial Injection of Adeno-associated Viral Vectors. Journal of Visualized Experiments. (45), 1-4 (2010).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), 18-19 (2008).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Murakoshi, H., Lee, S. J., Yasuda, R. Highly sensitive and quantitative FRET-FLIM imaging in single dendritic spines using improved non-radiative YFP. Brain Cell Biology. 36 (1-4), 31-42 (2008).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 1-11 (2015).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS ONE. 9 (2), (2014).
- Yu, K., et al. The central amygdala controls learning in the lateral amygdala. Nature Neuroscience. 20 (12), 1680-1685 (2017).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Yasuda, R. Imaging intracellular signaling using two-photon fluorescent lifetime imaging microscopy. Cold Spring Harbor Protocols. 7 (11), 1121-1128 (2012).
- Mehta, S., et al. Single-fluorophore biosensors for sensitive and multiplexed detection of signalling activities. Nature Cell Biology. 20 (10), 1215-1225 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır