Method Article
可视化蛋白质激酶 在头部固定行为小鼠中使用 Vivo 双光子荧光寿命成像显微镜的活性
摘要
提出了一个程序,以可视化蛋白激酶A活动在头部固定,行为小鼠。改进的A-激酶活动报告器tAKAR®在皮质神经元中表达,并通过颅窗口进行成像。双光子荧光寿命成像显微镜用于在强制运动期间可视化体内的PKA活动。
摘要
神经调节对大脑功能有强大的控制作用。神经调节系统功能障碍导致神经和精神疾病。尽管技术非常重要,但用细胞分辨率跟踪神经调节事件的技术才刚刚开始出现。神经调节剂,如多巴胺、去甲肾上腺素、乙酰胆碱和血清素,通过各自的G蛋白耦合受体触发细胞内信号事件,以调节神经元兴奋性、突触通信和其他神经元功能,从而调节神经元网络中的信息处理。上述神经调节器收敛到cAMP/蛋白激酶A(PKA)通路。因此,在体内,具有单细胞分辨率的PKA成像被开发为神经调节事件的读出,其方式类似于神经元电活动的钙成像。在此,提出一种方法,在头部固定行为小鼠皮层的各个神经元水平上可视化PKA活动。为此,使用了一个改进的A-激酶活动报告器(AKAR),称为tAKAR®,它基于Fürster共振能量转移(FRET)。这种基因编码的PKA传感器通过DNA质粒的子宫电穿孔(IUE)或腺相关病毒(AAV)的立体注射引入运动皮层。FRET 变化使用双光子荧光寿命成像显微镜 (2pFLIM) 进行成像,该显微镜比比例 FRET 测量具有优势,用于量化光散射脑组织中的 FRET 信号。为了研究强迫运动期间的PKA活动,tAKAR®通过清醒、头部固定的小鼠皮层上方的慢性颅窗成像,这些小鼠在速度控制的电动跑步机上运行或休息。这种成像方法将适用于许多其他大脑区域,以研究相应的行为诱导的PKA活动和其他基于FLIM的传感器进行体内成像。
引言
神经调节,也称为缓慢突触传输,在不同的行为状态(如压力、觉醒、注意力和运动1、2、3)期间对大脑功能施加强有力的控制。4.尽管其重要性,神经调节事件发生的时间和地点的研究仍处于起步阶段。神经调节剂,包括乙酰胆碱、多巴胺、肾上腺素、血清素和许多神经肽,激活G蛋白耦合受体(GPCRs),进而触发细胞内第二信使通路,时间范围很宽从秒到小时。虽然每个神经调节器触发一组不同的信号事件,cAMP/蛋白质激酶A(PKA)通路是许多神经调节器1,5的常见下游通路。cAMP/PKA通路调节神经元兴奋性、突触性传播和可塑性6,7,8,9,因此,调节神经元网络动力学。由于不同的神经元或神经元类型表达不同类型或水平的神经调节器受体10,同一细胞外神经调节器的细胞内效应可能是异质的,因此,必须研究与细胞分辨率。迄今为止,在行为过程中监测体内单个神经元的神经调节事件仍然具有挑战性。
为了研究神经调节的时空动力学,需要一种合适的记录方式。微透析和快速扫描循环伏特经常用于研究神经调节器的释放,但它们缺乏监测细胞事件11、12的空间分辨率。PKA成像与钙动力学一样,在群体成像13中用作神经元电活动的代理,PKA成像可用于以细胞分辨率读取神经元群中的神经调节事件。本协议描述了使用改进的A-激酶活动报告器(AKAR)来监测动物行为期间体内的PKA活动。此处描述的方法允许以亚细胞分辨率同时成像神经元群,其时间分辨率可跟踪生理神经调节事件。
AKAR由一个供体和接受荧光蛋白组成,由PKA磷酸化基质肽和叉头相关(FHA)域连接,与基质14、15的磷酸化丝氨酸或三甲氨酸结合。PKA通路激活后,AKAR的基质肽被磷酸化。因此,FHA 域与磷酸化基质肽结合,从而使两个荧光苷酸接近,称为 AKAR 的闭合状态。磷酸化AKAR的封闭状态导致供体和受体荧光量之间增加Fürster共振能量转移(FRET)。由于磷酸化ARNA的比例与PKA活性16的水平有关,生物样品中的FRET量可用于量化PKA活性16、17、18的含量。 19,20.
早期版本的AKARs主要设计为双色比例成像14。当成像深入到脑组织,比例法遭受信号失真,由于波长依赖光散射17,18,21。如下所述,荧光寿命成像显微镜(FLIM)消除了这个问题,因为FLIM只测量供体荧光量18、21发出的光子。因此,FRET 的 FLIM 定量不受组织深度17的影响。此外,可以使用接受器荧光的"暗"(即低量子收率[QY])变体。这释放了一个颜色通道,以方便通过同步成像第二个传感器或形态标记17,19,20的正交神经元属性的多路测量。
FLIM成像量化荧光在兴奋状态下花费的时间,即荧光寿命18。荧光回到地面状态,从而结束兴奋状态,通常伴随光子的发射。虽然单个兴奋分子的光子发射是随机的,但在人群中,平均荧光寿命是该特定荧光的特性。当纯荧光群同时激发时,产生的荧光将跟随单个指数衰变。此指数衰减的时间常数对应于荧光蛋白的平均荧光寿命,荧光蛋白通常为 1 到 4 纳秒。FRET 也可以将兴奋的供体荧光剂返回到地面状态。在FRET的存在下,供体荧光的荧光寿命缩短。非磷酸化的AVR表现出相对较长的供体荧光寿命。在PKA的磷酸化后,传感器的寿命较短,因为供体和受体的荧光量彼此靠近,FRET增加。因此,在AKARs的种群中荧光寿命的量化代表PKA活性水平。
早期版本的AKARs尚未成功用于单细胞分辨率的体内成像。这主要是由于AKAR传感器对生理活化信号振幅低。最近,通过系统地比较两光子荧光寿命成像显微镜(2pFLIM)的可用AKAR传感器,发现一种名为FLIM-AKAR的传感器性能优于替代传感器。此外,还开发了一系列称为靶向AKARs(tAKARs)的FLIM-AKAR变体,以可视化特定亚细胞位置的PKA活性:微管(tAKAR®)、细胞醇(tAKAR®)、活性素(tAKAR®)、丝状活性素(tAKAR®)、膜(tAKARé)、膜(tAKARé)、微管(tAKAR®)、细胞醇(tAKAR®)、活性素(tAKAR®)、膜(tAKARé)、膜(tAKARé)、微管(tAKAR®)、细胞源性活性素(tAKAR®)、活性剂(tAKAR®)。(tAKAR®),和鼻后密度(tAKAR*)。在tAKARs中,tAKAR®将去甲肾上腺素引起的信号振幅提高了2.7倍。这与神经元中的大多数PKA固定在静止状态22、23的微管上的知识是一致的。tAKAR® 是现有 2pFLIM 的 AVR 中表现最好的。此外,tAKAR®检测到由多个神经调节剂引起的与生理相关的PKA活性,tAKAR®的表达并没有改变神经元功能17。
最近,tAKAR®成功地用于可视化头固定行为小鼠17中的PKA活动。结果表明,强制运动触发了运动、桶和视觉皮质中表层神经元(第1层至3层,距离pia深度为+300μm)的PA活性。运动触发的PKA活性部分依赖于通过β-肾上腺素受体和D1多巴胺受体的信号,但不受D2多巴胺受体拮抗剂的影响。这项工作说明了tAARs使用2pFLIM跟踪体内神经调节事件的能力。
在当前协议中,在强制运动范式期间,在头部固定的醒小鼠中进行 PKA 活动成像的整个方法用六个步骤来描述。首先,在传统的双光子显微镜中增加2pFLIM功能(图1)。第二,建造电动跑步机(图2)。第三,通过子宫电穿孔(IUE)的DNA质粒,或对腺相关病毒(AAV)的立体注射,在小鼠皮层中表达tAKAR®传感器。IUE24、25和立体注射病毒颗粒26的出色手术方案已经发表。我们使用的关键参数如下所述。第四,安装一个颅窗。优秀的方案已经发表颅窗手术27,28。介绍了从标准协议修改的几个步骤。第五,在体内表演2pFLIM。第六,分析2pFLIM图像(图3和图4)。这种方法应该很容易适用于许多其他头部固定的行为范式和大脑区域。
研究方案
这里描述的所有方法都已获得俄勒冈健康与科学大学的机构动物护理和使用委员会(IACUC)的批准。
1. 2pFLIM 显微镜设置
- 安装光子定时计数模块(PTCM,材料表),并根据制造商手册连接到计算机(图1)。
注:PTCM 通常是接收激光脉冲计时的"同步"输入和来自光电倍增管 (PMT) 的光子输入的计算机板。它还从双光子成像控制软件接收像素、线条和帧的时钟计时。PTCM 使用时钟信号将单个光子分离到不同的像素和帧中。 - 添加具有 >200 MHz 带宽的光电二极管,以测量激光定时。在光道中放置一个标准玻璃盖玻片,将激光的一小部分反射到垂直于光路的光电二极管中(图1)。将光电二极管输出连接到 PTCM 的"同步"输入。
注:许多现代激光器也输出激光正时。对于这些激光器,光电二极管是不必要的,可以直接将激光正时输出连接到PTCM的同步输入。 -
在 tAKAR® 的情况下,使用低噪声、快速 GaAsP PMT 交换 PMT(图 1)。将 PMT 输出连接到 PTCM 的信号输入。
- 如果需要通过传统的双光子成像通道同时采集强度,则添加可选的信号分路器(图1)。将 PMT 输出连接到信号分路器,并将分路器输出连接到 PTCM 和传统的双光子成像模块。
注:GaAsP PMT 提供比传统双碱 PMT 更快的单光子信号,并允许更精确地确定光子定时。某些型号的 GaAsP PMT 可冷却到环境温度以下的 10~35 °C,从而将暗数抑制到每秒几百以下(通常为 ±200 计数/秒)。这种低噪声水平对于精确测量荧光寿命非常重要,因为噪声光子计数无法从荧光寿命曲线中轻松区分或减去。
- 如果需要通过传统的双光子成像通道同时采集强度,则添加可选的信号分路器(图1)。将 PMT 输出连接到信号分路器,并将分路器输出连接到 PTCM 和传统的双光子成像模块。
- 添加带通荧光发射过滤器,将接受荧光剂的光谱污染(如果有)降至最低。例如,对于 tAKAR®,用于绿色通道的 500 nm × 20 nm 阻隔过滤器用于减少接受器 sREACh 的污染,这是一种深色 (QY =0.07) 黄色荧光蛋白 (YFP)29、30。与控制软件(PTCM 用户手册中所述)连接计时信号,如单个图像像素、线和帧的时钟。安装适当的数据控制和采集软件。
注:一些PTCM制造商 (材料表) 提供其 2pFLIM 成像软件.在这里,使用称为FLIMimage的定制软件,这是由Yasuda实验室(马克斯普朗克佛罗里达州,通过个人沟通)开发的。该软件作为某些双光子采集软件(材料表)的附加用户功能。它在双光子成像过程中以适当的时间控制和与PTCM通信,以获取2pFLIM图像。
2. 建造电动跑步机
注:定制电动跑步机的设计如图2所示。
- 使用精细的锯子将泡沫辊 (Φ = 200 mm) 切割至 150 mm 的长度。或者,将泡沫球的两半粘在一起,将胶带放在接缝上。可选择在滚轮上粘附轮廓的橡胶垫,以增加滚子的牵引力。
- 在滚子平侧的滚子中心钻一个直径为 1/4 英寸的孔,或者在使用泡沫球时,在球的中间钻一个直径为 1/4 英寸的孔。
-
通过孔安装直径为 1/4 英寸的钢轴。使用与泡沫兼容的胶水将泡沫滚轮/球粘附到轴上。或者,修改两个柔性轴联轴联轴(1/4 英寸内径),以加强轴与泡沫辊/球的耦合。
注:请注意,许多常见的胶水可能会溶解泡沫。- 对于每个轴联轴器,将轴联轴放在其平面和矩形金属板的中心(0.7 mm x 15 mm x 76 mm)。将板焊接到轴联轴器上。在板的中心钻一个 1/4 英寸的孔,以便将修改后的轴联轴安装到轴上,并将两个螺钉孔从中心侧向安装到金属板上。
- 将轴联轴接头安装在轴上,与泡沫滚轮/球进行连接。如果使用后者,则稍微弯曲板以适合球的曲率。将螺钉放入侧孔以固定轴上的滚子/球。
- 钻取和敲击笼板中心的 3/8-32 螺纹,然后安装旋转编码器。将螺钉孔钻入直角电机支架的底座,以便将电机连接到柱架上。使用灵活的轴联轴将旋转编码器和电机连接到轴末端。
- 使用电机和旋转编码器的柱子将组装的跑步机安装在铝面包板上(图2)。将电机输入连接到速度控制器,并将旋转编码器输出连接到计算机数据采集 (DAQ) 板的模拟输入。
注:旋转角度速度由旋转编码器编码为电压,并使用名为"动物跟踪器"的自定义软件进行数字化,该软件名为"动物跟踪器",用 MATLAB 编写。 - 将头板兼容支架安装到右角支架上。在跑步机前面的面包板上安装一个实心支架,并将装配的头板支架与右角支架安装在支架上(图2)。确保头板支架杆与车轴对齐,以便鼠标可以在跑步机上采用适当且舒适的行走位置(图 2C)。
3. 在小鼠皮质中表达 tAKAR® 传感器
-
在子宫电穿孔
- 在质粒DNA(3⁄4 μg/μL)中加入0.2%的快速绿色染料的最终浓度(用于注射期间的可视化),为IUE制备DNA溶液;传感器结构包含CAG前动、传感器序列和木丘克肝炎病毒转录后反应元件[WPRE]转化增强剂)溶于/稀释在水中或Tris-EDTA中。
- 在 E1624为 IUE 准备一只有时位怀孕的雌性小鼠(例如 C57BL/6)。用异构体麻醉小鼠(4%用于诱导,1.5%用于维护,在95%O2与5%CO 2)上,并应用皮下注射,包括5毫克/千克Meloxicam和4mg/kgBupivacaine。用手术刀和剪刀切开腹腔,小心地露出子宫角。
- 如前所述,在一个半球的侧心室中注射每个胚胎的1μLDNA溶液。
- 将正电极端脚置于皮层,并在 1 Hz 处使用 5 个 100 ms 方脉冲 (38 V),使用电波器,对皮质神经元执行常规 IUE24。
注: 通过改变电极端脚相对于侧心室的位置,可以针对不同的皮质区域进行电穿孔。
-
立体注射
- 准备在产后第30天进行老鼠立体手术26。如步骤3.1.2所述,麻醉小鼠,并应用皮下注射含有5毫克/千克卡洛芬的术前镇痛药。
- 稀释 AAV 血清型 2/1 (AAV2/1) 将 hSyn-tAKAR®-WPRE 表达到经验测定的定位子 (+1 x 109+1 x10 10 基因组/μL) 注射器过滤 (0.2 μm 纤维素醋酸酯膜) 磷酸盐缓冲盐水。
- 在运动皮层的以下坐标下,使用手持钻头在立体显微镜下钻一个直径为 ±500 μm 的孔:0.5 mm 前向布雷格马,1.2 mm 横向到中线。
- 将喷油器(例如,带定制柱塞/玻璃移液器支架的油液压操纵器)安装到电动操纵器上。将注射针置于相对于布雷格玛-兰布达平面的 15° 角处。分别沿前后轴和背向轴对角线移动,等效于 700 μm 和 200 μm 的步数。
注:为避免对正上方目标成像场上方的组织造成损伤,AAV 粒子以相对于布雷格玛-兰布达平面的角度注入。 - 将注射针的尖端置于钻孔中心的 pia 处,然后缓慢执行上述对角线运动(±25 μm/s)。此过程将注射中心定位在 1.2 mm 前向布雷格马,1.2 mm 横向到中线,0.2 mm 低于 pia。
- 注射20 nL稀释的病毒颗粒(±10 nL/min)。等待至少 10 分钟,然后慢慢缩回注射针(±12.5 μm/s)。
- 完成立体注射程序,并粘合/缝合皮肤26。
4. 颅窗的安装
- 在产后30至60天,通过IUE(第3.1节)或病毒颗粒的立体注射(第3.2节)对表达tAKAR®的小鼠进行颅状窗口的放置。对于感染病毒颗粒的小鼠,在病毒注射后至少两周实施颅窗口。安装颅窗,如前所述27,28,与以下细节。如步骤3.1.2所述,麻醉小鼠,并在4mg/kg下注射术前镇痛药0.075mg/kgBuprenex和抗炎剂Dexamethasone。
- 取出穿孔并缩回颈部肌肉。用组织粘合剂将皮肤边缘粘附到头骨上,以避免手术后颈部肌肉暴露。
- 使用手术刀轻轻刮擦,干燥并去除颅骨上的任何骨膜。放置成像头板(8 mm 内径)以环绕预定的成像场。使用氰丙烯酸酯胶水将头板粘到头骨上,然后是牙科丙烯酸水泥。为获得最佳附着力,请确保头板位于裸露和干燥的头骨上。胶水加速器可用于加速硬化。
- 使用牙科钻头在预定成像场上方绘制一个直径为 5 mm 的圆(步骤 3.2.3 中指定的坐标),并露出 Dura 母体。
- 在杜拉表面涂上一层薄薄的透明聚合物(也称为人造杜拉)以覆盖整个颅面。聚合物将保护和稳定杜拉母体。在杜拉垫上放置无菌圆形盖玻片(直径 5 mm)。用氰丙烯酸胶固定在窗边上,然后涂上牙科丙烯酸水泥。
5. 在 Vivo 双光子荧光寿命成像显微镜
- 在颅窗安装后2周或2周以上开始2pFLIM成像(第4节)。在开始成像研究之前,通过频繁处理和擦伤小鼠来适应小鼠,以尽量减少由于压力引起的实验干扰。
- 使用控制双光子激光的软件将双光子激发激光波长设置为 960 nm。
- 使用 4% 的异常胶对鼠标进行麻醉。通过尾部捏合和观察呼吸速率确认适当的麻醉。也就是说,不应对尾部捏合有反应,呼吸速率应降至每秒±1次。为了尽量减少不必要的程序时间,并且麻醉只持续两到三分钟,不使用眼部润滑剂。
- 将麻醉鼠标转移到电动跑步机(图2C),并将鼠标的表板安装到跑步机设置的头板支架上(详情见图2)。用 70% 乙醇清洁鼠标上的颅面窗盖玻片表面。
- 将装有鼠标的电动跑步机置于 2pFLIM 目标下。在颅窗盖玻片和目标之间涂抹一滴蒸馏水。
- 让装载的鼠标从麻醉中醒来,在跑步机和显微镜环境中适应至少10分钟。
- 导航到外光照明下的喷射位置。在明景下记录基准特征(即血管),以帮助在后续成像过程中对同一感兴趣区域 (ROI) 进行成像。
- 除脑组织发出的光外,消除任何入射光。关闭外光光源并关闭 2pFLIM 钻机的外壳。通过打开硬件命令电压控制来激活 2pFLIM PMT。
- 使用 2pFLIM 采集软件 FLIMimage 获取 z-stack 2pFLIM 图像,并采用以下推荐设置,用于在醒着的小鼠中成像 tAKAR® 阳性 somata。将平均帧设置为 3 帧,扫描速度设置为 2 ms/线,图像大小设置为 128 x 128 像素,将视野设置为 90*100 μm。根据准备和硬件配置调整映像设置。
-
在 FLIMview 中检查获取的图像(内部开发的自定义软件;请参阅第 6 节)。在步骤 5.9 之后调整成像设置,以优化光子计数并最大限度地减少光漂白。
注:根据特定刺激产生的信号振幅,在 ROI 中,一个可行的集成光子计数,用于对体内 tAKAR® 阳性体进行终生成像,其值为 ±1,000~10,000 光子。- 必要时,使用视野减少、扫描速度降低、激光功率增加和平均帧数增加,以增加集成光子计数并减少寿命估计误差。同时,请务必使用最小的基本激光功率、帧平均和扫描速度,以尽量减少光漂白。
- 使用步骤 5.10 中确定的设置重复 z 堆栈采集,以常规时间间隔(例如,每 30-60 秒)进行映像。在零跑步机速度下获取基线 2pFLIM 图像至少 15 分钟。
- 将跑步机转速设置为 ±15 cm/s 15 分钟,同时获取 2pFLIM 图像。关闭跑步机旋转后,继续成像 20 分钟,以评估强制运动停止后 PKA 活动的持续时间。
6. 分析 2pFLIM 图像
-
在 FLIMview 中打开获取的图像,并在 FLIMview 中设置以下参数。
注:参数详细信息在讨论中描述。- 单击 FLIMview 中的单个光子计数 (SPC) 最小和最大范围字段。输入适当的最小值和最大 SPC 范围值,通常分别介于 1.2⁄2 和 10*12 ns 之间。
- 单击 FLIMview 中的 t0值字段并输入 t0值(通常为 ±2 ns)。单击 FLIMview 中的生存期亮度最小阈值值字段,并将所需的阈值输入 5±30 光子。
- 单击新的组按钮 (N) 并指定实验组名称。这将生成一个组合来自每个添加的 FLIM 图像的数据的组。
- 单击 FLIMview 的ROI 控制模块中的ROI按钮,并围绕 tAKAR® 阳性索马绘制 ROI。通过在 FLIMview 中的 z 堆栈控制滑块中移动z-stack 控制滑块的下限和上限,减小 z 堆栈范围,以尽量减少来自其他 z 深度背景光子的信号污染。
- 单击+按钮将 FLIM 图像添加到组中(步骤 6.2)。单击Calc按钮以计算 ROI 和生存期估计误差 (*) 的平均寿命(LT,也称为平均光子发射时间 [MPET])。
- 打开慢性 2pFLIM 成像系列中的下一个文件。重复步骤 6.4。请务必调整 ROI 和 z 堆栈范围的位置,以测量相同的 tAKAR® 阳性索马随时间推移,因为随着时间的推移,组织可能会漂移。
- 在组控制模块的下拉菜单中选择增量MPET/MPET0。 单击"基线+"字段并输入索引(例如,对于步骤 6.3 中创建的组中的前五个图像,索引为 1 2 3 4 5)。这将定义用于计算基准生存期 (LT0) 的图像。
- 单击绘图以生成包含 tAKAR® 的 FLIM 响应 ([LT/LT0) 的图形。"通过相应的基准生存期 (LT 0) 对单个 ROI 的生存期(+LT) 进行规范化更改,可以比较不同 ROI 在运动期间的 PKA 活动。
结果
FRET-FLIM 传感器允许可视化许多不同的信号通路,包括神经调节中涉及的 cAMP/PKA 通路。当前协议利用最近开发的 takaR® 传感器与 2pFLIM 相结合,在头部固定行为小鼠中可视化 PKA 活动。大多数现有的双光子显微镜可以通过添加三到四个组件来升级,如图 1所示(另请参阅第 1 节)。为了在2pFLIM采集的图像中可视化FRET,对每像素收集的光子计时的直方图图进行了平均寿命的量化(图3A,B)。使用伪彩色图像可视化平均生存期,其中高(冷色)和低(暖色)均值分别表示低和高 PKA 活动,因为 PKA 激活会导致寿命缩短。必须注意正确设置 SPC 范围;此范围应在激光脉冲间隔内设置(例如,脉冲速率为 80 MHz 的 12.5 ns),并尽可能减少硬件边缘伪影(另请参阅第 6 节和讨论)。通过组合给定 ROI 内所有像素的 LT(图 3C,D),计算了 ROI 中的 PKA 活动。在头固定清醒小鼠的基础寿命范围在1.3至1.8 ns之间(图3E)。在头部固定的醒小鼠的运动皮层中对tAKAR®进行成像,允许在基底和强制运动期间用细胞分辨率实时定量PKA活动(图4)。实验可以重复几天和几个月。强制运动触发PKA活动在小鼠运动皮层17表面层的神经元群中。这种PKA活性依赖于神经调节通过激活β-肾上腺素和D1受体17。
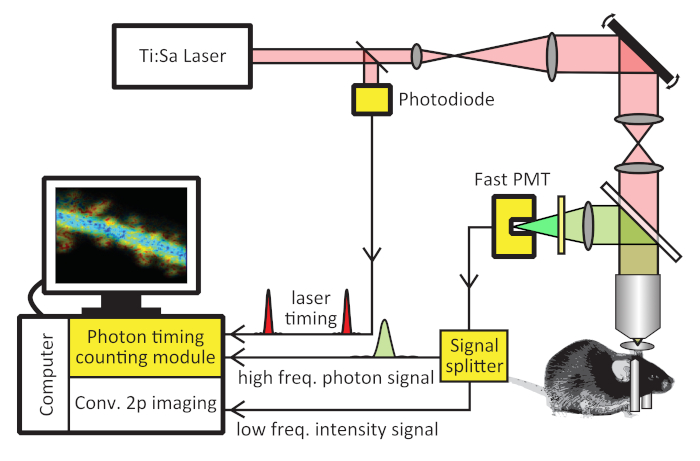
图 1:2pFLIM 系统的架构图。2pFLIM 可通过添加黄色突出显示的硬件组件在传统的双光子显微镜上实现:光子定时计数模块、低噪声快速光电倍增管 (PMT)、光电二极管(仅当激光没有激光定时输出信令),以及可选的信号分路器。这个数字已由马等人17日修改。请点击此处查看此图的较大版本。
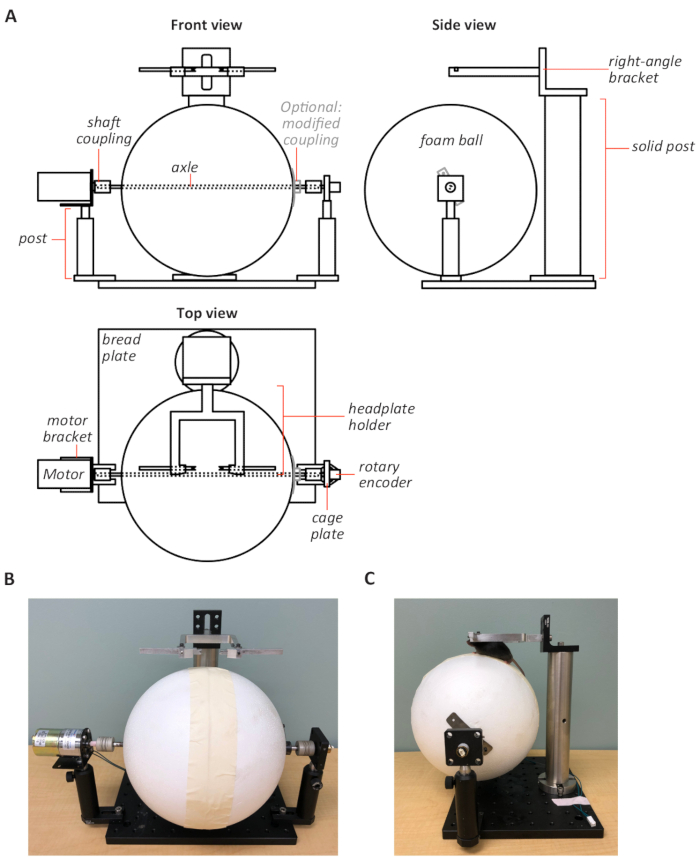
图2:定制电动跑步机的设计。(A) 跑步机设计的图式,从正面(左上)、侧面(右上)和顶部视图(左下)。跑步机(泡沫球)轴连接到旋转编码器和电机,它们共同安装在一个坚固的铝面包板上的两个柱子上。右角支架上的头板兼容支架固定在实心柱上,并位于跑步机上方。原理图不能缩放。正面 (B) 和侧面 (C) 查看跑步机的照片.在C面板中显示了鼠标在跑步机上的正确定位。 请点击此处查看此图的较大版本。
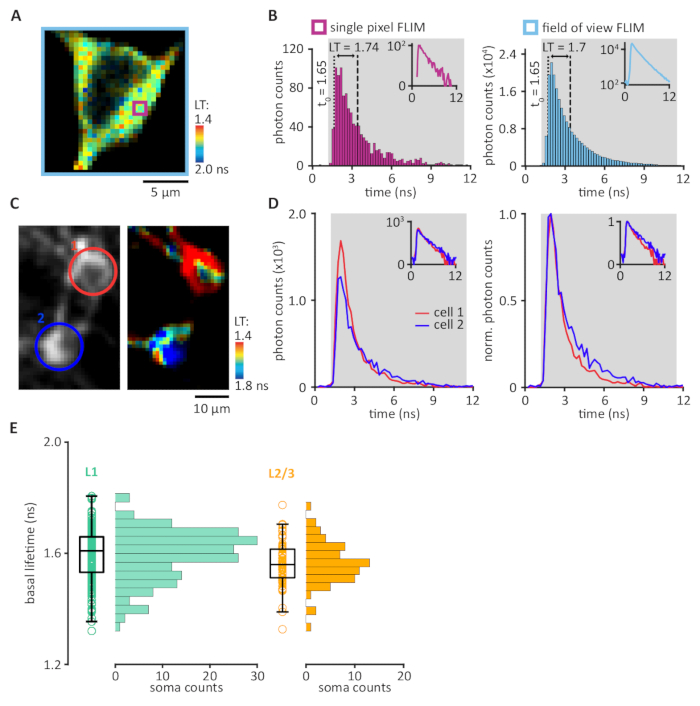
图3:2pFLIM数据的量化。(A) 每个像素呈伪色的 FLIM 图像,表示该像素中所有光子的平均寿命 (LT)相对于激光时向值。(B) 单个像素内的光子到达时间(面板A中的紫色正方形)绘制在直方图(左面板)中。集成边界设置为确定单个光子计数范围(SPC、灰色)。在 SPC 范围内,光子计时的积分除以光子的总数,然后减去 t 0(1.65 ns,虚线),从而得出 1.74 ns 的平均寿命(LT、虚线和虚线之间的距离)。 整个视场的平均寿命(面板A中的浅蓝色正方形)的量化涉及在所有像素(右面板)中收集的光子计时的集成,从而得出 1.7 ns 的平均寿命。内展在半日志比例中显示相同的数据。(C和D)每个感兴趣区域的平均寿命量化 (ROI)。(C) 2pFLIM 图像的代表示例。在运动皮层的第2/3层中,围绕两个索马塔绘制了两个ROI。(D) 光子时序分布集成在每个 ROI 中的所有像素(左面板)。细胞ROIs被颜色编码(如面板C所示)红色,单元格1;蓝色,单元格 2。标准化光子计数允许比较两个ROIs之间的光子时序分布(右面板,平均寿命;单元格1,1.33 ns;单元格2,1.73 ns)。内展在半日志比例中显示相同的数据。(E) 运动皮层表面层中 254 个图像细胞的平均基底寿命分布图。L1细胞(n = 186细胞/11动物,左面板),驻留在100μm以下的皮亚,在AAV2/1-hSyn-tAKAR®-WPRE的立体注射后表示tAKAR®,和L2/3金字塔细胞(n = 68细胞/4个动物,右面板),驻留至少150μm以下的pia,在 CAG-tAKAR®-WPRE DNA构造的 IUE 后表示 tAKAR®。请点击此处查看此图的较大版本。
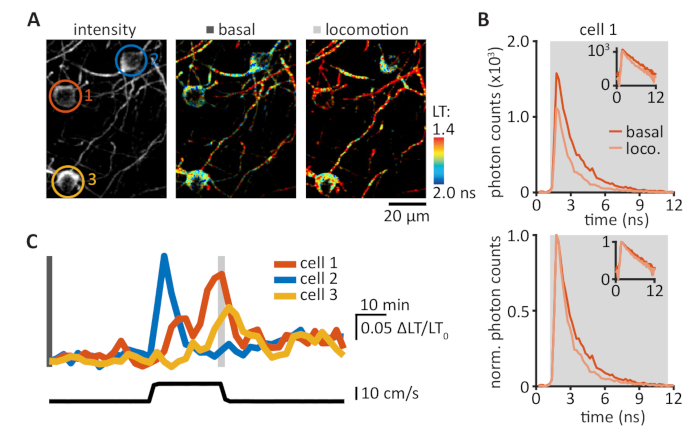
图4:tAKAR®跟踪运动皮层中由运动引起的PKA活动。(A) 运动皮层中三个 L1 细胞的代表性强度(左面板)和寿命(中面板和右面板)图像。细胞ROIs的颜色编码:橙色,单元格1;蓝色,单元格 2;黄色,单元格 3。(B) 在基底条件下以单元 1(上面板)测量的光子时序分布(橙色痕迹,在中间面板α中测量)和强制运动(loco.,浅橙色轨迹,右面板A中测量)。标准化光子计数允许直接比较光子时序分布(下面板,平均寿命:基底,1.72 ns;运动,1.42 ns)。内展在半日志比例中显示相同的数据。(C) = 寿命/寿命0 (+LT/LT0) 相应单元的轨迹(上面板,见面板A),具有强制运动速度(下面板)。请点击此处查看此图的较大版本。
讨论
该协议演示了使用 FRET-FLIM 传感器 tAKAR® 来可视化头部固定行为小鼠的神经调节触发的 PKA 活动。此应用基于 TAKAR® 体外和体内的广泛测试和表征,以证明获得的 FLIM 信号与生理神经调节事件17相关。在这里,一个在体内的应用,运动诱导的PKA活动在运动皮层,用于描述程序,提供传感器到大脑,动物手术成像,硬件和软件要求的行为和成像数据采集,用于成像数据分析的软件和算法。
TAKAR®传感器通过DNA质粒的IUE或AAV粒子的立体注射引入皮层。根据电穿孔参数和DNA浓度,IUE在皮层25相对较大的区域产生皮质神经元的各种标记密度。使用 IUE 标记的皮质层由手术时的胚胎阶段确定。当AAV粒子需要成像定义的大脑分区域内的许多细胞时,将使用AAV粒子的立体注入。它通常导致在注射中心有密集标记的神经元,并且离中心越来越稀疏。重要的是,大脑中细胞的感染效率取决于所使用的AAV血清型。AAV2/1在皮质、丘质和纹状神经元中具有相对较低的逆行标记活性,具有极高的效率。建议从经验上确定哪种AAV血清型对目标脑区和细胞类型最有效。两种转染方法都成功地表达了tAKAR®。表达水平的"最佳点"是经验决定的。
强制运动导致运动皮层第2/3层神经元的PKA活动增加。目前,2pFLIM 限制了由于鼠标头部固定而导致的可测试行为范围。然而,在这个约束下,越来越多的行为范式列表已经成功实施,从报告去/不走任务中的刺激到虚拟现实中的空间定位 31、32、33.此外,改进的方法可以通过针状梯度指数(GRIN)透镜13(未发表的观察)在深脑区域(如纹状体、杏仁核和海马)进行成像。因此,本协议详细说明了使用takaR®和2pFLIM进行神经调节事件的体内可视化,在头部固定行为范式的上下文中,应能随时适用于许多大脑区域。
使用曲线拟合计算每像素寿命或 ROI 是计算耗时的,并且每个像素的有限总光子计数通常会导致拟合误差。因此,平均寿命 (LT) 以算术计算为生存期的近似值 (+)17,34:
 (公式 1)
(公式 1)
其中 SPC最小值和 SPC最大值是测量窗口 (SPC) 边框,F(t) 是荧光寿命衰减曲线。换句话说,对于每个计算的体积(像素或 ROI,图 3A),光子时序分布绘制在直方图中(图 3B)。在 SPC 范围内,此分布的加权积分(以时间为权重)除以总光子计数,得出平均发射时间。然后更正此时间为 t0。要生成生存期图像 (图 3A), 此过程针对每个像素执行,而每个 ROI 的生存期计算 (图 3C,D) 集成了 ROI 体积内高于阈值的所有像素的所有光子。使用集成强度(N光子:总光子计数)计算寿命估计误差 (*):
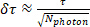 (公式 2)
(公式 2)
为了将寿命估计误差降至最低,α, 并产生正确的信号检测 FRET-FLIM 需要每个 ROI 采集足够的光子。为了实现所需的信噪比 (SNR),* 还必须满足以下等式:
 (公式 3)
(公式 3)
例如,运动皮层神经元躯体运动期间的典型测量(LT = 1.57 ns,N光子= 9075,μLT = 0.15 ns;图 4,单元格 1) 产生一个生存期估计误差:
± 

 0.016 ns (公式 4)
0.016 ns (公式 4)
导致信噪比:
SNR 

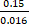
 = 9.4 (公式 5)
= 9.4 (公式 5)
如果所需的 SNR 仅为 5,则允许使用 [LT = 0.15 ns] :

这需要最小总光子计数:

如上所述,寿命量化需要适当设置多个参数,如 SPC 范围、t0和寿命亮度最小阈值。SPC 范围确定硬件测量窗口内发射光子的测量窗口(公式 1;硬件测量窗口通常为 0±12.5 ns,因为激光在 80 MHz 下重复)。这是必要的,因为此协议中使用的 PTCM 具有边缘伪影。SPC 范围设置为合并大多数捐赠光子生存期分布,而不包括边缘伪影。为了计算平均寿命,测量窗口的平均光子时序减去t 0,这对应于窗口内激光脉冲的时序(公式1,图3A,B)17,34。 t0可以通过更改信号电缆长度或 PTCM 设置进行调整,并且通常从硬件测量窗口开始调整为 ±2 ns。在系统初始特性表征后(通常在接近理想的成像条件下执行(例如,成像 5 μM 荧光酶溶液时),SPC 范围和 t0均设置为给定硬件配置的固定参数。设置寿命亮度最小阈值,以便显示和分析中仅包含总光子计数等于或高于阈值的像素。这有效地降低了背景光子计数(包括自荧光、环境光和自发 PMT 暗计数)造成的噪声。此阈值是经验确定的。
成功的 FRET-FLIM 传感器用于体内 2pFLIM 成像至少具有三个常见功能。首先,在荧光光道的选择方面,光子收集效率通常较低,在具有挑战性的体内成像环境中,部分是由于脑组织严重光散射。同时,需要大量检测到的光子才能实现所需的SNR(对于0.03的+LT/LT0,需要1,000个光子才能达到1个SNR;参见公式2和3)。因此,具有高光子预算的供体荧光团(即,在荧光团漂白之前可检测到的光子的最大数量)受到青睐。目前,在双光子激发下,不同供体荧光量预算方面没有系统比较。从经验上讲,eGFP相对明亮,同时与绿色/黄色光谱中的许多其他荧光荧光道相比,具有更稳定的光稳定性,使其成为在体内使用FRET-FLIM传感器的一个很好的供体荧光。此外,为了对FRET进行最佳定量,有利于具有单指数荧光寿命衰减的供体荧光。许多用于比例成像的常用供体荧光蛋白(如 eCFP)具有多指数荧光寿命衰减,这表明它们由混合的荧光群组成。因此,这些荧光蛋白对FRET-FLIM21来说并不理想。与供体荧光磷相反,受体荧光酸的低量子收率对FRET-FLIM传感器有益。"暗"低辐射荧光酸sREACh用于tAKARs。受体荧光荧光的量子收率低,最大限度地减少了供体荧光荧光量发射光谱中的光子污染,并释放了一个荧光检测通道,用于同时成像红光谱中的第二个荧光传感器或形态标记在tAKAR_的情况下。
其次,为了在结合分数范围内获得足够的SNR,±0.5±0.7的最佳FRET效率被看好21。信号,即给定供体-接受方绑定比变化下的平均寿命变化,取决于FRET的效率。然而,FRET 效率和平均寿命变化之间的关系是非线性的。如果FRET效率接近,则约束状态的供体荧光量实际上不会发射光子。因此,除非结合比为100%(这从来不是这种情况,因为没有接受荧光酸成熟到100%29),平均寿命接近开放状态供体荧光的使用寿命,以及检测约束状态传感器的能力减少。tAKAR® 的 FRET 效率估计为 ±0.7,在有利的范围内。
第三,FRET-FLIM 传感器应报告具有与动物生理学相关的灵敏度和动力学信号。传感器灵敏度和动力学在体内使用之前应在体外进行广泛测试,如有必要,可以使用多种方法进行调整,例如调整基板结合域亲和力和动力学、链接器优化和亚细胞传感器的定位。在以前的工作中,确定tAKAR®可以检测由内源性多巴胺释放引起的PKA活性,并且传感器的动力学和灵敏度与已知的依赖PKA的生物过程一致,这是去甲肾上腺素引起的失活缓慢的后超极化电流17。此外,tAKAR®的表达似乎不会改变神经元功能,如电生理学17和单个脊柱结构可塑性的测量(未发表的观察)所测定的。
目前 2pFLIM 成像的技术限制与数据处理和光子计数吞吐量有关。首先,FLIM 要求存储每个像素的光子到达时间。PTCM 的内存大小限制了可获得的像素分辨率。对于此处描述的 PCTM,每个图像帧最多可达到 256 x 256 像素,时间分辨率为 64 点。此外,FLIM图像数据从板存储到计算机存储的传输速度相对较慢,再次对分辨率和采样频率施加了实际限制。持续的技术改进内存容量和数据处理可以解决这些限制。其次,常用的 PTCM 是模拟到数字系统,受光子检测复位时间(即"死区时间")的限制。这意味着,在检测到一个光子后,PTCM 将不会为下一个 100–125 ns18、21注册任何后续光子的到来。此外,寿命测量偏向激光脉冲(称为"堆积")后的第一个到达光子。这些限制光子计数速率为 <10 7 光子/s。虽然在大多数典型的双光子成像系统中,这不是一个主要问题,但应注意不要超过光子计数速率限制。具有较短死机时间或千兆赫连续数据采集系统的较新的 PTC 可以缓解这一限制(对于后者,请参阅 Yellen 和 Mongeon18)。
信号通路的荧光传感器,如cAMP/PKA、Akt/PKB、PKC和ERK,正在不断生成和优化16、35 。对于大多数当前传感器,需要进一步的特性和优化,才能在具有挑战性的活体成像环境中脱颖而出。特别是,增加信号振幅很重要,因为信号振幅的任何增加都减少了对具有平方关系的光子预算的需求。对于 tAKAR®,其对内源性神经调节器(如去甲肾上腺素)的反应振幅比之前的最佳传感器提高了 2.7 倍。这转化为所需光子减少约 7 倍。在实践中,这大大减少了行为17期间动物的假阴性(即非应答者)的数量。观测到的最大 tAKAR® 信号为 ±30% ([LT/LT0)迄今为止,这是为类似类别的FRET传感器报告的最大FLIM信号。通过优化接受荧光酸和FHA与磷酸化三酮的亲和力,还可以进一步改善。此外,使用传感器来监测同一信令通路的不同方面,可以为机械地研究体内信号通路的调控提供强有力的方法。将来,FLIM传感器的成功应用,在体内可视化神经调节信号通路,将为神经调节在行为小鼠的完整神经元网络中发生的位置和时间提供重要的见解。
披露声明
作者没有什么可透露的。
致谢
我们感谢苔丝·拉迈耶女士、露丝·弗兰克女士和迈克尔·穆尼亚克博士的编辑和评论,以及佛罗里达州马克斯·普朗克的Ryohei Yasuda博士对2pFLIM采集软件的介绍。这项工作得到了两个BRAIN倡议奖U01NS094247(H.Z.和T.M.)和R01NS104944(H.Z.和T.M.)的支持,一个R01授予R01NS081071(T.M.),以及R21授予R21NS097856(H.Z.)。所有奖项均来自美国国家神经疾病和中风研究所。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 μm cellulose acetate syringe filter | Nalgene | 190-2520 | Step 3.2.2. |
| 16x 0.8 NA water-immersion objective | Nikon | MRP07220 | Step 5.5. |
| 3-pin cable | US digital | CA-MIC3-SH-NC | Step 2.5. To connect rotation sensor to the DAQ input of the microscope |
| Aluminum bread board | Thorlabs | MB1012 | Step 2.5. |
| AnimalTracker MATLAB software | N/A | N/A | Step 2.5 and sections 5 - 6. Will be provided upon request to the lead author |
| Band-pass barrier filter | Chroma | ET500-40m | Step 1.4. |
| Cage plate | Thorlabs | CP01 | Step 2.4. Used as mount for rotation sensor |
| Carbon steel burrs for micro drill, 0.5 mm tip diameter | FST | 19007-05 | Steps 3.2.3. and 4.4. |
| Circular coverslip (5 mm diameter) | VWR | 101413-528 | Step 4.5. |
| Custom-made injection needle holder | N/A | N/A | Step 3.2.4. Technical details provided upon request to the lead author |
| Dental acrylic | Yates Motloid | 44114 | Steps 4.3. and 4.5. |
| Dental drill; Microtorque ii | Ram products | 66699 | Steps 3.2.3. and 4.4. |
| Dowsil transparent polymer | The Dow Chemical Company | 3-4680 | Step 4.5. Artificial dura |
| Electroporation electrode | Bex | LF650P5 | Step 3.1.4. |
| Electroporator | Bex | CUY21 | Step 3.1.4. |
| Fast green FCF | Sigma-aldrich | F7258-25G | Step 3.1.1. |
| FLIMimage MATLAB software | N/A | N/A | Section 5. Kindly provided by Dr. Ryohei Yasuda, Max Planck Florida |
| FLIMview MATLAB software | N/A | N/A | Sections 5. and 6. Will be provided upon request to the lead author |
| Foam-compatible glue (Gorilla White Glue) | Gorilla | 5201204 | Step 2.3. |
| Headplate | N/A | N/A | Step 4.3. Technical details provided upon request to the lead author |
| Headplate holder | N/A | N/A | Step 2.6. Technical details provided upon request lead author, used in combination with mounting post bracket and right-angled bracket |
| Hydraulic micromanipulator | Narishige | MO-10 | Step 3.2.4. |
| Krazy glue | Krazy glue | KG82648R | Step 4.3. Cyanoacrylate-based glue |
| Low-noise fast photomultiplier tube | Hamamatsu | H7422PA-40 or H10769PA-40 | Step 1.3. |
| MATLAB 2012b | Mathworks | N/A | Steps 2.6, and sections 5, and 6. Used to run microscope acquisition and data analysis software |
| Motor | Zhengke | ZGA37RG | Step 2.4. |
| Motor speed controller | Elenker | EK-G00015A1-1 | Step 2.5. |
| Motorized micromanipulator | Sutter | MP-285 | Step 3.2.4. |
| Mounting base | Thorlabs | BA1S | Step 2.5. Used for posts for motor and sensor in combination with PH4 and TR2 |
| Mounting post | Thorlabs | P14 | Step 2.6. Used for headplate holder post in combination with PB2 |
| Mounting post base | Thorlabs | PB2 | Step 2.6. Used for headplate holder post in combination with P14 |
| Mounting post bracket | Thorlabs | C1515 | Step 2.6. Used in combination with right-angle bracket and headplate holder |
| Optical post | Thorlabs | TR2 | Step 2.5. Used for posts for motor and sensor in combination with BA1S and PH4 |
| Phosphate-buffered saline | Ν/Α | Ν/Α | Step 3.2.2. Protocol: Cold Spring Harbor Protocols 2006, doi: 10.1101/pbd.rec8247 |
| Photodiode | Thorlabs | FDS010 | Step 1.2. |
| Photon timing counting module | Becker and Hickl | SPC-150 | Step 1.1. |
| Plasmid: tAKARα (CAG-tAKARα-WPRE) | Addgene | 119913 | Step 3.1.3. |
| Post holder | Thorlabs | PH4 | Step 2.5. Used for posts for motor and sensor in combination with BA1S and TR2 |
| Right-angle bracket | Thorlabs | AB90 | Step 2.6 Used in combination with mounting post bracket and headplate holder |
| Rotation encoder | US digital | MA3-A10-250-N | Step 2.4. |
| Rubber mat | Rubber-Cal | B01DCR5LUG | Step 2.1. |
| Shaft coupling (1/4 inch x 1/4 inch) | McMaster | 6208K433 | Steps 2.3. and 2.4. |
| ScanImage 3.6 | Svoboda Lab/Vidrio Technology | N/A | Steps 5.9. and 6.1. |
| Signal splitter | Becker and Hickl | HPM-CON-02 | Step 1.3.1. |
| Stainless steel axle (diameter 1/4 inch, L = 12 inch) | McMaster | 1327K66 | Step 2.3. |
| Stereotaxic alignment systsem | David kopf | 1900 | Steps 3.2. and 4.1. modified; Sutter micromanipulator, custom-made injection needle holder, hydraulic micromanipulator |
| Two-photon microscope | N/A | N/A | Section 5. Built based on Modular in vivo multiphoton microscopy system (MIMMS) from HHMI Janelia Research Campus (https://www.janelia.org/open-science/mimms) |
| Vetbond tissue adhesive | 3M | 14006 | Step 3.2.6. |
| Virus: tAKARα (AAV2/1 hSyn-tAKARα-WPRE) | Addgene | 119921 | Step 3.2.2. |
| White PE foam roller (8 inch x 12 inch) | Fabrication enterprises INC. | 30-2261 | Step 2.1.1. |
| White polystyrene fom ball halves | GrahamSweet | 200mm diameter 2 hollow halves | Step 2.1.1. |
| Zipkicker | PACER | PT29 | Step 4.3. Hardening accelerator |
参考文献
- Greengard, P. The Neurobiology of Slow Synaptic Transmission. Science. 294 (5544), 1024-1030 (2001).
- Petersen, S. E., Posner, M. I. The attention system of the human brain: 20 years after. Annual Review of Neuroscience. 35 (2), 73-89 (2012).
- Sun, Y., Hunt, S., Sah, P. Norepinephrine and Corticotropin-Releasing Hormone: Partners in the Neural Circuits that Underpin Stress and Anxiety. Neuron. 87 (3), 468-470 (2015).
- Berke, J. D. What does dopamine mean?. Nature Neuroscience. 21 (6), 787-793 (2018).
- Chen, Y., et al. Endogenous Gαq-Coupled Neuromodulator Receptors Activate Protein Kinase A. Neuron. 96 (5), 1070-1083 (2017).
- Madison, D. V., Nicoll, R. A. Cyclic adenosine 3’,5’-monophosphate mediates beta-receptor actions of noradrenaline in rat hippocampal pyramidal cells. The Journal of Physiology. 372 (1), 245-259 (1986).
- Yasuda, H., Barth, A. L., Stellwagen, D., Malenka, R. C. A developmental switch in the signaling cascades for LTP induction. Nature Neuroscience. 6 (1), 15-16 (2003).
- Pedarzani, P., Storm, J. F. PKA mediates the effects of monoamine transmitters on the K+ current underlying the slow spike frequency adaptation in hippocampal neurons. Neuron. 11 (6), 1023-1035 (1993).
- Brandon, E. P., Idzerda, R. L., McKnight, G. S. PKA isoforms, neural pathways, and behaviour: making the connection. Current Opinion in Neurobiology. 7 (3), 397-403 (1997).
- Radnikow, G., Feldmeyer, D. Layer- and Cell Type-Specific Modulation of Excitatory Neuronal Activity in the Neocortex. Frontiers in Neuroanatomy. 12 (January), (2018).
- Kennedy, R. T. Emerging trends in in vivo neurochemical monitoring by microdialysis. Current Opinion in Chemical Biology. 17 (5), 860-867 (2013).
- Rodeberg, N. T., Sandberg, S. G., Johnson, J. A., Phillips, P. E. M., Wightman, R. M. Hitchhiker’s Guide to Voltammetry: Acute and Chronic Electrodes for In Vivo Fast-Scan Cyclic Voltammetry. ACS Chemical Neuroscience. 8 (2), 221-234 (2017).
- Hamel, E. J. O., Grewe, B. F., Parker, J. G., Schnitzer, M. J. Cellular level brain imaging in behaving mammals: An engineering approach. Neuron. 86 (1), 140-159 (2015).
- Allen, M. D., Zhang, J. Subcellular dynamics of protein kinase A activity visualized by FRET-based reporters. Biochemical and Biophysical Research Communications. 348 (2), 716-721 (2006).
- Zhang, J., Ma, Y., Taylor, S. S., Tsien, R. Y. Genetically encoded reporters of protein kinase A activity reveal impact of substrate tethering. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 14997-15002 (2001).
- Chen, Y., Saulnier, J. L., Yellen, G., Sabatini, B. L. A PKA activity sensor for quantitative analysis of endogenous GPCR signaling via 2-photon FRET-FLIM imaging. Frontiers in Pharmacology. 5 (April), 1-12 (2014).
- Ma, L., et al. A Highly Sensitive A-Kinase Activity Reporter for Imaging Neuromodulatory Events in Awake Mice. Neuron. 99 (4), 665-679 (2018).
- Yellen, G., Mongeon, R. Quantitative two-photon imaging of fluorescent biosensors. Current Opinion in Chemical Biology. 27, 24-30 (2015).
- Tang, S., Yasuda, R. Imaging ERK and PKA Activation in Single Dendritic Spines during Structural Plasticity. Neuron. 93 (6), 1315-1324 (2017).
- Tillo, S. E., et al. Liberated PKA Catalytic Subunits Associate with the Membrane via Myristoylation to Preferentially Phosphorylate Membrane Substrates. Cell Reports. 19 (3), 617-629 (2017).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16 (5), 551-561 (2006).
- Theurkauf, W. E., Vallee, R. B. Molecular characterization of the cAMP-dependent protein kinase bound to microtubule-associated protein 2. Journal of Biological Chemistry. 257 (6), 3284-3290 (1982).
- Zhong, H., et al. Subcellular dynamics of type II PKA in neurons. Neuron. 62 (3), 363-374 (2009).
- Borrell, V., Yoshimura, Y., Callaway, E. M. Targeted gene delivery to telencephalic inhibitory neurons by directional in utero electroporation. Journal of Neuroscience Methods. 143 (2), 151-158 (2005).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-, Lateral Septal Nucleus- and Striatum-specific In utero Electroporation in the C57BL/6 Mouse. Journal of Visualized Experiments. (107), e53303 (2016).
- Lowery, R. L., Majewska, A. K. Intracranial Injection of Adeno-associated Viral Vectors. Journal of Visualized Experiments. (45), 1-4 (2010).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. Journal of Visualized Experiments. (12), 18-19 (2008).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Murakoshi, H., Lee, S. J., Yasuda, R. Highly sensitive and quantitative FRET-FLIM imaging in single dendritic spines using improved non-radiative YFP. Brain Cell Biology. 36 (1-4), 31-42 (2008).
- Murakoshi, H., Shibata, A. C. E., Nakahata, Y., Nabekura, J. A dark green fluorescent protein as an acceptor for measurement of Förster resonance energy transfer. Scientific Reports. 5, 1-11 (2015).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS ONE. 9 (2), (2014).
- Yu, K., et al. The central amygdala controls learning in the lateral amygdala. Nature Neuroscience. 20 (12), 1680-1685 (2017).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461 (7266), 941-946 (2009).
- Yasuda, R. Imaging intracellular signaling using two-photon fluorescent lifetime imaging microscopy. Cold Spring Harbor Protocols. 7 (11), 1121-1128 (2012).
- Mehta, S., et al. Single-fluorophore biosensors for sensitive and multiplexed detection of signalling activities. Nature Cell Biology. 20 (10), 1215-1225 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。