Method Article
Azot kavitasyon ve diferansiyel Santrifüjü sağlar periferik membran proteinlerinin kültürlü hücrelerdeki dağılımını izlemek için
Bu Makalede
Özet
Burada iletişim kuralları için deterjan-Alerjik homojenizasyon kültürlü memeli hücrelerinin azot kavitasyon ve sonraki sitozolik ve membran bağlı proteinler ayrılması ultrasantrifüj tarafından dayalı mevcut. Bu yöntem periferik membran proteinlerinin çözünür arasındaki bölümleme izlemek için idealdir ve membran kesirler.
Özet
Kültürlü hücrelerin periferik zar proteinleri de dahil olmak üzere proteinlerin hücre altı dağıtım eğitimi için yararlıdır. Genetik olarak kodlanmış fluorescently tagged proteinler hücre altı protein dağıtım çalışmanın devrim. Ancak, özellikle proteinler kısmen sitozolik olduğunda floresan mikroskopisi, dağılımıyla ölçmek zordur. Ayrıca, bu kez endojen proteinler çalışma önemlidir. İmmunoblots miktar protein dağıtım sonra hücre altı ayırma için altın standart kalır gibi biyokimyasal deneyleri. Sitozolik veya belirli membran kesirler ayırma amacı ticari kitleri olmakla birlikte, bu kitleri çoğunu ayıklama membranlar kolayca ayıklanır periferik membran proteinlerinin eğitim için uygun olmayan deterjanlar ile temel alır. Burada bir deterjan-Alerjik protokol hücresel homojenizasyon için azot kavitasyon ve sonraki ayrılması sitozolik ve membran bağlı proteinler tarafından ultrasantrifüj tarafından mevcut. Biz hücre altı organelleri çözünür içinde ayrılması ve Pelet kesirler farklı hücre türleri arasında onaylayın ve protein ayıklama birkaç ortak mekanik homojenizasyon deterjan tabanlı olmayan yöntemler arasında karşılaştırın. Azot birkaç avantajları arasında kavitasyon hassas organelleri en az fiziksel ve kimyasal zarar ile hücresel bozulma üstün verimliliği olduğunu. Ultrasantrifüj ile birlikte, azot kavitasyon sitozolik arasındaki periferik membran proteinlerinin kayma incelemek için mükemmel bir yöntem olduğunu ve membran kesirler.
Giriş
Hücresel proteinler iki sınıfa ayrılabilir: membranlar ve olmayanlar ile ilişkili olan o. Sigara-membran ilişkili proteinler sitozol, nucleoplasm ve endoplazmik retikulum (ER) gibi organellerin lumina bulunur. Membran ilişkili proteinler, integral ve periferik iki sınıf vardır. Bir veya daha fazla parçadan polipeptid zinciri yayıldığı için membran, genellikle bir α-helix hidrofobik amino asitleri oluşur olarak integral membran proteinlerinin transmembran proteinler da verilir. Transmembran proteinler membran onların sentezi sırasında co-translationally takılan ve onlar catabolized kadar çok yapılandırılmış kalır. Periferik membran proteinlerinin ikincil olarak membranlar, genellikle bir sonucu olarak post-translational değişiklik lipidler hidrofobik moleküllerin ile tahrik edilmektedir. İntegral membran proteinlerinin, aksine periferik membran proteinlerinin dernek hücresel membranlar ile geri alınabilir ve düzenlenmiş olması. Birçok çevresel membran proteinleri işlev sinyal yolları ve membranlar ile düzenlenmiş Derneği etkinleştirme veya inhibe bir yol için bir mekanizmadır. Periferik membran proteinidir bir sinyal molekülü küçük GTPazlar, RAS örneğidir. Bir dizi değişiklik ile farnesyl lipid içeren translasyonel modifikasyonlar sonra değiştirilmiş C-terminus olgun bir RAS protein hücre membran sitoplazmik broşürü ekler. Özellikle, plazma zarı nerede onun aşağı akım efektör RAF1 RAS yürütmektedir olduğunu. Mitojenle-aktive protein kinaz (MAPK) aktivasyonu bünye önlemek için birden çok düzeyde denetimler RAS yerdesiniz. RAS etkin olmayan GTP GSYİH hidrolize tarafından render yanı sıra, etkin RAS da plazma zarı antenler, deðiþiklikler veya amil-e doğru sinyal inhibe çözücü ile etkileşimler tarafından azat edilebilir. Floresan canlı görüntüleme hücre biyologları protein öğesini floresan periferik membran protein1hücre altı lokalizasyonu gözlemlemek için fırsat tanıyor olsa da, orada kalır membran Derneği değerlendirmek için kritik bir ihtiyaç basit biyokimyasal yaklaşımlarla yarı kantitatif endojen proteinler.
Membran ve çözünür kesirler arasında protein bölümleme doğru biyokimyasal değerlendirme eleştirel iki faktöre bağlıdır: hücresel homojenizasyon ve membran ve çözünür kesirler verimli ayrılması. En yaygın olarak kullanılan ticari kitleri dahil olmak üzere bazı iletişim kuralları üzerinde deterjan tabanlı cep homojenizasyon bağlı olsa da, bu yöntemlerin çözünür aşama2membran proteinlerinin ayıklayarak analiz karartmak. Buna göre deterjan bazlı, mekanik yöntemler hücre bozulma temiz sonuçlar sağlar. Hücre kültüründe yetiştirilen veya kan ya da organ hasat mekanik bozulma birkaç yöntem vardır. Bu Dounce Homojenizasyon, ince iğne bozulma, rulman Homojenizasyon, sonication ve azot kavitasyon içerir. Burada azot kavitasyon değerlendirmek ve diğer yöntemler için karşılaştırın. Azot kavitasyon yüksek basınç altında hücre sitoplazma içinde çözünmüş azot kullanır. Öyle ki onların coşku bir sonucu olarak hücre açık gözyaşı sitoplazmada azot kabarcıklar oluşur denge sonra hücre süspansiyon aniden atmosferik basınca maruz kalmaktadır. Basınç yeterince yüksek ise azot neşesinden çekirdeği3 bozabilir ve membran organelleri gibi organellerin4bağlı. Ancak, eğer basınç yeterince düşük tutulur, dekompresyon plazma zarı ve ER ama değil diğer organelleri böylece sitozol ve bozulmamış sitoplazmik organelleri cavitate5atanır homogenate dökülüp, bölebilir. Bu nedenle, azot kavitasyon organelleri gibi organellerin ve mitokondri izole için tercih yöntemdir.
Ancak, membran ve çözünür kesirler kolayca ayrılabilen bir homogenate hazırlama mükemmel bir şekilde de öyle. Bir tank ve bir çıkış bağlantı noktası bir Ayarlanabilir deşarj Vana ile azot gazı teslimi için bir giriş ile yüksek basınç dayanıklı kalın paslanmaz çelik kasa, kavitasyon sırasında kullanılan (bundan böyle "bomba" olarak da adlandırılır) basınç gemi oluşur.
Azot kavitasyon hücre homojenizasyon 1960'larda6beri kullanılmaktadır. 1961 yılında, avcı ve Commerfold7 memeli doku bozulması için uygun bir seçenek olarak azot kavitasyon kurdu. O zamandan beri araştırmacılar çeşitli hücre ve dokulara başarı ile tekniği adapte olması ve azot kavitasyon membran hazırlık8,9, çekirdek ve organel dahil olmak üzere birden çok uygulama bir elyaf haline gelmiştir Hazırlık10,11ve değişken biyokimyasal çıkarma. Şu anda, hücre biyologları daha sık hücre homojenizasyon diğer yöntemleri azot homojenizasyon faydaları değil yaygın olarak reklamı, azot bomba pahalıdır ve hücre nispeten büyük bir sayıdır bir yanlış anlaşılma olduğunu çünkü istihdam Gerekli. Boş hücre homogenates olduğu gibi çekirdek ile elde etmek azot kavitasyon protokollerde yayınlanmadı ve en Yayınlanan değerlendirme hücre süspansiyon, 20 mL hacimli kullanılmıştır. Küçük ölçekli örnekler ile çalışma geçerli uygun için klasik bu tekniği adapte, azot kavitasyon kültürlü hücreler için özel olarak tasarlanmış değiştirilmiş bir protokol mevcut. Azot kavitasyon sonra homogenate çözünür (S) ve membran (P) kesirler fark Santrifüjü tarafından ilk çekirdeği ve kesilen hücreleri kaldırmak için bir düşük hızlı spin ile ve sonra bir yüksek hızlı spin ile ayrılır (> 100.000 x g) ayırmak için membranlar çözünür kesir üzerinden. Biz immunoblots ile ayırma verimliliğini analiz ve azot kavitasyon diğer mekanik bozulma teknikleri ile karşılaştırın. Azot kavitasyon sırasında Ayrıca homojenizasyon arabellek ozmotik etkisini araştırmak.
Protokol
1. tampon ve ekipman ürünleri
- 4'te 45 mL hücre bozulma bomba, 15 mL tüpler ve ultrasantrifüj tüpler Chill ° C.
- Hazırla ve chill başına 2 x 10 7 hücreleri 4 ° C. Ekle bir proteaz inhibitörü tablet kullanmadan önce homojenizasyon arabellek 25 mL.
Not: Hücre içi tuz kompozisyon NaCl daha iyi yansıtmak yerine homojenizasyon arabellekleri genellikle KCl içerir. Bu protokol için kullanılan homojenizasyon arabellek 10 mM HEPES pH 7.4, 10 mM KCl ve 1.5 mM MgCl 2 (aşağıda Hipotonik homojenizasyon arabellek anılacaktır) oluşur. Çoğu arabellekleri azot kavitasyon için adapte edilebilir (konuya bakın). - Hazırla ve 6 mL 1 x 4 ° C. Ekle proteaz inhibitörü tablet kullanmadan önce yeni, örnek başına Phosphate-Buffered serum fizyolojik (PBS) arabellek chill.
Not: Bu protokol için kullanılan PBS arabellek 10 mM Na 2 HPO 4 pH 7.4, 1.8 mM KH 2 PO 4, 137 mM NaCl ve 2.7 mM KCl oluşur. - Hazırla ve chill solubilization arabellek 4 ° C. Ekle bir proteaz inhibitörü tablet kullanmadan önce örnek başına 4 mL.
Not: Bu protokol için kullanılan Solubilization arabellek 25 mM Tris pH 7.4, 150 mM NaCl, % 0,1 SDS, % 0.5 sodyum deoxycholate ve % 1'oluşur 1 x Radioimmunoprecipitation tahlil (RIPA) arabellek olduğunu NP-40. 4.6 Not bkz.
2. Hücre hasat
- Grow 2 x 10 7 -10 x 10 9 doku kültürü hücreleri ile önerilen kültür medya hücre türü için. Genellikle, bir 15 cm çanak 2 x 10 7 DMEM içinde % 90 confluency ( şekil 1) kültürlü HEK-293 hücreleri verimleri.
- Vakum tarafından büyüme orta kaldırmak.
- Yapışık hücreleri için kültür yemekleri Buza koyun, kültür yemekleri yavaşça soğutulmuş homojenizasyon arabellek iki kez (15 cm çanak yıkama başına başına 10 mL arabellek) ile doğrudan hücrelerdeyse yıkama ve uygun bir hacmine büyük hücreli sıyırıcı ile hücre hasat homojenizasyon arabellek; Süspansiyon hücreleri, toplar ve hücre Pelet soğutulmuş homojenizasyon arabellek iki kez (50 mL kültür yıkama başına başına 10 mL arabellek) 500 x g spin 5 min için 4 ° C'de ile yıkayın ve yıkanmış hücre Pelet homojenizasyon arabellek buz üzerinde uygun bir hacmine resuspend.
Not: birim hücre bozulma bomba içinde izin verilen en az/en büyük birim yanı sıra hedeflenen deneyler protein konsantrasyonu için gereksinimleri temel almalıdır. Genel bir kılavuz 2-10 x 10 7 hücre/mL, ya da yaklaşık 10 birim hücrenin cips. Bu iletişim kuralı homojenizasyon arabelleğinin 2 mL HEK-293 hücrelerinin üç 15 cm yemekler için optimize edilmiştir.
3. Azot kavitasyon
- bir heyecan transferinde hücre süspansiyon bir buz banyosu temiz ve soğutulmuş bomba için plaka.
Dikkat: Bomba vardır yüksek basınç, düşük sıcaklık, azot gazı – uygun kişisel korumak . - Bir mikro manyetik heyecan bar içinde bomba yerleştirin ve süspansiyon homojenliği korumak için heyecan plaka açın.
- Bir proteaz inhibitörü tablet için süspansiyon ekleyin ve üretici başına bomba yakın ' s eğitimi.
- Yavaş yavaş bomba bir azot gaz tank üreticisi başı ile sıkmak ' s öğretim bomba basınç göstergesi kadar 300-600 PSI okur. Bütün vanaları kapatın ve azot tankı çıkarın.
Not: gerekli basınç ile hücre türü değişebilir. Burada HEK-293, NIH 3T3 ve Jurkat hücreler için 350-400 psi, kavitasyon gerçekleştirilen. - Azot dağıtılması ve denge hücrelerindeki ulaşmak izin vermek 20 dk bekleyin.
- Bir bez havlu kullanarak boşaltma vanası çevresinde aşırı su kaldırın. Yavaşça homogenate dropwise bir sürümü elde etmek ve bir önceden soğutulmuş 15 mL tüp içinde toplamak için deşarj Vanayı aç.
Not: koleksiyon sonuna yakın orada-ecek var olmak homogenate bir hamle ve gaz tıslayan ses ile ortaya çıkacak. Gaz değil emin olun daha önce toplanan neden cavitate tüp dışında ateş (1,5 mL tüpler yerine 15 mL kullanımı bu nedenle tüpler). Olağanüstü çaba başladı mı, deşarj vanayı kapat ve aniden bombayı basıncını ve kavitasyon bomba kalan hücreleri elde etmek için azot giriş Vanayı aç. Açık bombayı cavitate kurtarma ve derinlemesine temizlik.
Not: Son cavitate üstüne köpük ile sütlü bir görünüm olması gerekir. Santrifüjü önce çökmek köpük izin vermek için bir pipet ucu ile hafifçe karıştırın.
Not: cavitate faz kontrast mikroskobu tarafından homojenizasyon etkinliğini belirlemek için inceleyin. Bir 15 µL damla eklemek bir mikroskobu slayt ve bir coverslip ile kapak yüzeyine cavitate. 3.4-3.6 Eğer sadece çok fazla kırılmamış hücreleri bir 20 X amacı ile algılanır adımı yineleyin.
Not: homojenizasyon arabellek EDTA veya EGTA içermiyorsa, eklemek için toplanan bu 1 mM 5 dk içinde son bir konsantrasyon deşarj sonra cavitate.
4. Cytosolic ve membran kesirler ayrılması
- santrifüj cavitate 500 x g 4 ° C'de kırılmamış hücreleri ve hücre çekirdeği kaldırmak için 10 dk için.
Not: hiçbir görünür Pelet üretilen kadar aralıklarla tekrarlayın ve üstte yüzer köpük kaçınırken Post nükleer süpernatant (PNS) toplamak. Daha fazla toplamak ve PNS, birleştirmek için köpük gerekirse yeniden santrifüj kapasitesi ( şekil 1). - PNS kesirler ilgi elde etmek için istediğiniz gibi işlemek. Sitozolik ayıran ve membran kesirler, amacıyla bir ultracentrifuge tüp PNS aktarmak ve ultrasantrifüj istediğiniz gibi gerçekleştirin. Bu iletişim kuralı için optimize edilmiş bir < 3,5 mL örnek bir polikarbonat ultracentrifuge tüp ve ultrasantrifüj 350.000 x g 4 1 h için de için ° C.
- 1 mL pipet kullanarak süpernatant (S kesir) toplamak.
- Dikkatli bir şekilde rahatsız etmeden Pelet 3 mL soğuk PBS ile yıkayın. PBS tarafından vakum kaldırmak.
Not: 3 ml soğuk PBS ve re-ultracentrifuge olduğu gibi adım 4.2 Pelet membran kısmı tarafından sitozolik protein kontaminasyonu örnek kaybı daha büyük bir endişe ise, resuspend. PBS tarafından vakum kaldırmak. - Pelet tam olarak uygun birimlere deterjan içeren solubilization arabellek tercih resuspend. Hücre denklik elde etmek için aynı birimin solubilization arabelleği sitozolik kesir olarak kullanın.
Not: 1 x RIPA tampon solubilization tampon olarak verimli membran protein çıkarma için kullanmanızı öneririz. Aşağı akım yok tahlil membran kesir için gerekliyse, maksimal membran protein ayıklama için 1 x laemmli örnek arabellek kullanın.
Not: Biz kekii ve 4 ° C maksimal membran protein çıkarılması için bir tüp rotator temiz bir tüp içinde solubilization tampon Pelet aktarılması öneririz.
Not: Pelet (th verimli kaldırılacak çok yapışkan çok fazla lipidler) isee ultracentrifuge tüp solubilization arabelleği ek öneririz Pelet sıvı azot içinde dondurma ve ultracentrifuge tüp pelet pelet Tammy'nin önce bir mini metal spatula ile hızlı bir şekilde kekii.
Not: Alternatif olarak, membran granül olabilir sadece resuspended ve çözündürüldükten membran vezikül süspansiyon Santrifüjü adım içinde 4,6 durumda gerekli değildir, bir P kısmını üretmek için bir deterjan içeren arabellekte değil. Böyle P kesirler membran Derneği üzerinde bağımlı enzim aktiviteleri gibi fonksiyonlar soruşturma sırasında yararlıdır. - Tamamen çözündürüldükten Pelet süspansiyon adım 4.5 20.000 x g masa üstü bir santrifüj 10 dk içinde de 4'te santrifüj kapasitesi ° C. 1 mL pipet (P kesir) kullanarak süpernatant toplamak ve Pelet (çözünmez lipidler) atın.
- Gerçekleştirmek istenen deneyleri Batı sitozolik ve/veya membran kesirler ile kurutma gibi veya ileride kullanmak üzere-80 ° C'de kaydedin.
Sonuçlar
Şekil 2 hücresel PNS çözünür sitozolik kesir (S) veya membran Pelet kesir (P) proteinler bölümleme gösterir. Biz farklı hücre türleri üç temsilcisi hücre satırlarından muayene: HEK-293 (epitel), NIH-3T3 (fibroblast) ve Jurkat (lenfosit). Rho guanin ayrılma inhibitörü (RhoGDI) ve katyon bağımsız mannoz-6-fosfat reseptör (CIMPR) için pozitif kontrol olarak kullanılan sitozolik ve membran kesirler, anılan sıraya göre. Azot kavitasyon sonra sitozol ve membran ayırma verimli doğruladık ~ Hipotonik arabellek içinde 350 psi ultrasantrifüj 350.000 x g 1 h için de izledi. Toplam protein kurtarıldı S ve P kesirler sonra işaretleri ile acil servis, endosomes ve organellerin, mitokondri, Golgi ve diğer organelleri için analiz edildi. Sadece, Na+de dahil olmak üzere tüm transmembran proteinler membran kesir mevcut /K+ ATPaz ve epidermal büyüme faktörü reseptörü (EGFR) plazma membran, calnexin ER, ilişkili lizozomal membran proteini 1 (LAMP1) dan gelen organellerin, F0dan-ATPaz mitokondri ve Golgin 97 trans Golgi ağ üzerinden. Beklendiği gibi gevşek membran ile ilişkili, hem sitozolik ve membran kesirler değişen derecelerde de mevcut olan birçok çevresel membran protein. Önemli örnekler erken endosome antijen 1 (EEA1), Rab7/9 (geç endosomes) ve hexokinase 1 (dış mitokondri zar). Bu çevresel proteinler membran Derneği gücünü değerlendirilmesi Bu teknikte yarar gösterir. Bizim laboratuvar birkaç sinyal molekülleri5,12,13,14membran Derneği durumunu incelemek için bu kavitasyon teknik avantajı ele geçirdi. İlginçtir, calregulin neredeyse sadece çözünür kesir telkin ER membranlar oluşturulan microsomes da azot kavitasyon sırasında kesintiye ve proteinler arasında ER Lümen çözünür kesir piyasaya bulduk. Buna ek olarak, mitokondri kavitasyon sonra bütünlüğünü hücre türüne bağlıdır. Biz F1gözlenen-ATPaz, kısmen HEK-293 ve Jurkat hücreleri için ~ %35 %2 NIH 3T3 hücreler için arasında değişen sitozolik kesir bir iç mitokondri periferik protein. Bu o azot gösterir kavitasyon Hipotonik arabellek 350 PSI, mitokondrial bütünlüğü sağlamak değil. Rağmen üç devir 500 x g spin PNS cavitate oluşturmak için tüm çekirdekleri kaldırıldı. Histon deacetylase 1 (HDAC1) nucleoplasm ve fibrillarin çekirdekçik üzerinden PNS ve Pelet hem de bulunmuştur. Pelet ve süpernatant HDAC1 varlığı PNS kavitasyon sırasında nükleer bozulma yerine çekirdek ile kontamine olduğunu göstermektedir. Hipotonik arabellek kullanımı çekirdek kırılgan, sonraki bölümde açıklandığı gibi hale gelebilir, ancak bu bomba 350 psi basınçlandırma çekirdeklerin olduğu gibi10, yaprakları raporları ile tutarlıdır.
Azot kavitasyon homojenizasyon verimliliği bu diğer ortak fiziksel bozulma yöntemleri ile karşılaştırıldığında. Jurkat hücreler eşit miktarda aynı Hipotonik homojenizasyon arabellekte askıya ve farklı bozulması yöntemlerini için tabi. Tespit Dounce homojenizasyon ve azot kavitasyon (her iki durumda yaklaşık % 5-10 az hacmi toplanır) örneklerinde kaybı oldu. Ancak, azot kavitasyon en yüksek protein ayıklama verimliliği verdi; iğne geçit ve Dounce sadece % 60 kadar protein (şekil 3) vermiştir. Merakla, kurtarma immunoblot tarafından belirlenen bazı proteinlerin farklı mekanik bozulma yöntemleri arasında anlamlı bir fark yoktu. Ancak, bazı çevresel membran proteinlerinin hexokinase 1 ve RAS gibi verim azot kavitasyon ile hazırlanan örneklerinde yüksekti. Bu destekler o azot kavitasyon periferik membran proteinlerinin soruşturma homojenizasyon için en uygun olabilir. HDAC1 proteinleri azot kavitasyon tarafından kurtarılması çekirdeklerin her koşulda korunacak düşündüren başka yöntemler karşılaştırılabilir. Böylece, şekil 3 ' deki verilerinizi bu nitrojen kavitasyon üstün homojenizasyon sonuçlar sunuyor kanıtlıyor.
Ardından, homojenizasyon verimliliği Hipotonik tampon ve aynı tampon arasında karşılaştırıldığında ama Sükroz veya Sodyum Klorür (şekil 4) ile izotonik yaptı. Benzer miktarda protein sonra kavitasyon 350 psi adlı izotonik NaCl arabellek karşı Hipotonik arabellekte homojenize Jurkat hücrelerden ele geçirildi. Buna ek olarak, daha az protein Sükroz ile izotonik yapılan tampon bozulur hücreleri PNS kurtarıldı. En bireysel proteinler tarafından immunoblot incelendiğinde bu model uygun. Nispeten izotonik arabellekte oluşturulan PNS zenginleştirilmiş fibrillarin bir istisnaydı.
Bizim iletişim kuralı periferik membran proteinlerinin çözünür arasındaki bölümleme araştırmak için istihdam Eğer belirlemek için ve membran kesirler, biz göre desen bayrak öğesini NRAS vahşi görünüm ve onun prenilasyon eksikliği mutant, C186S () bölümleme Şekil 5). Sabit devlet, vahşi türü NRAS mevcut sitozol ve membranlar, çözünür kesir kurtarılan bölümü diğer RAS proteinler14için daha büyük olmasına rağmen en periferik membran proteinlerinin için benzer. NRAS onun prenyl modifikasyonu yoksun membranlar ile ilişkilendirme yeteneği kaybeder ve tamamen sitozolik olur. NRAS beklenen bölümleme şekillerinin bizim protokol periferik membran proteinlerinin membran arasındaki sitozol bölümleme dinamiklerini incelemek için güvenilir bir seçenek olduğunu doğruladı.
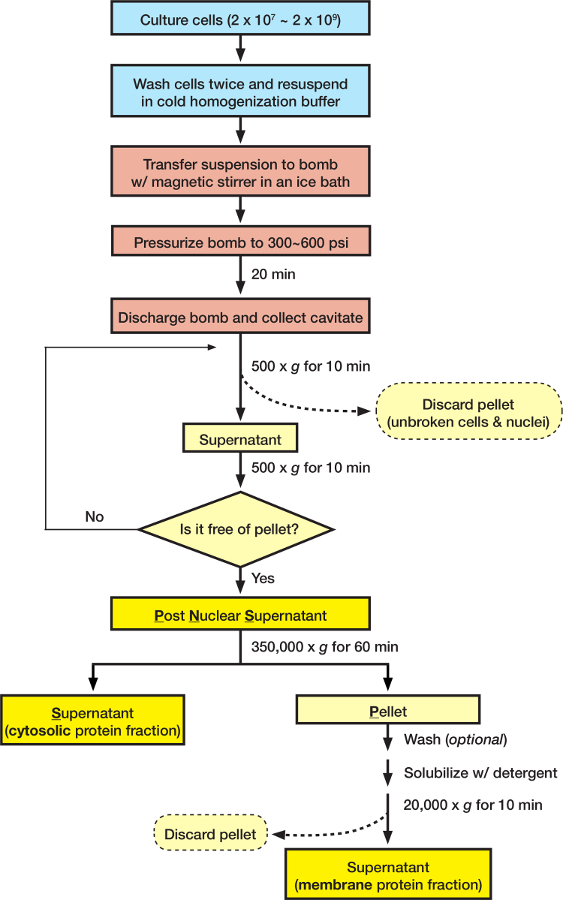
Şekil 1: adım 2 (mavi), adım 3 (kırmızı) ve adım 4 (sarı) Protokolü'nün özetleme akış çizelgesi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
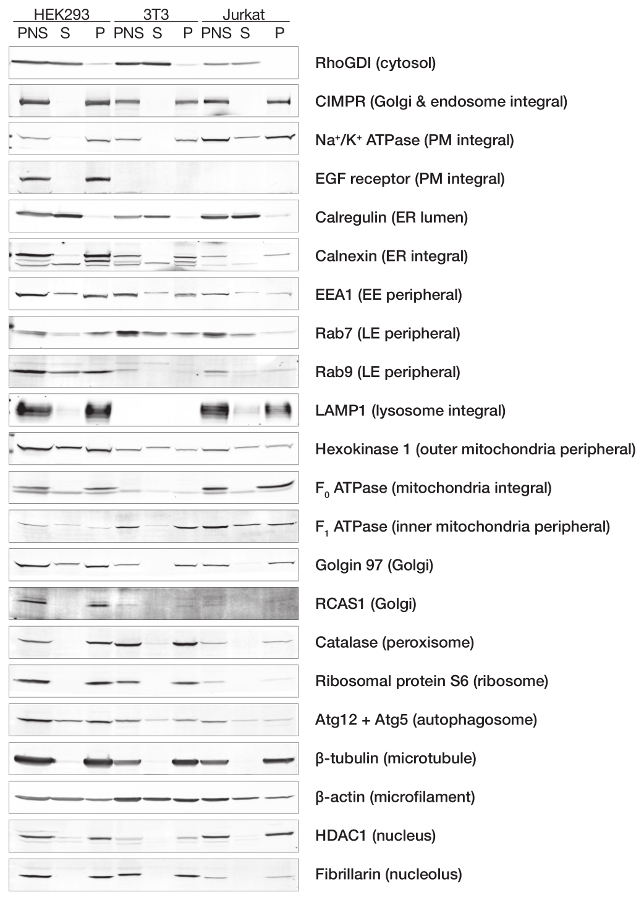
Şekil 2: Protein sitozolik ve membran kesirler bölümleme. HEK-293, NIH 3T3 ve Jurkat hücreleri azot kavitasyon (20 dk, Hipotonik homojenizasyon arabellekte askıya için ~ 350 PSI) ve ultrasantrifüj (1 h için ~ 350.000 x g) protokol açıklandığı gibi tabi tutuldu. Endojen protein düzeyleri farklı kesirler immunoblot tarafından analiz edildi. PNS: Reseptör-bağlama kanser antijen SiSo hücreleri (RCAS üzerinde), nükleer süpernatant, S: süpernatant, P: Pelet dile getirdi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3: farklı mekanik bozulma teknikleri karşılaştırılması. Jurkat hücreler eşit miktarda Hipotonik arabellekte askıya ve donma-çözülme (3 kür), geçiş (5 geçer, 28G½ iğne), Dounce homojenizasyon (15 geçerse, Kontes 2 mL Dounce tüp bir doku eziyet havaneli, boşluk ile iğne için tabi 0,01 0,06 mm) veya azot kavitasyon (20 dk için ~ 350 PSI). PNS endojen proteinlerin göreli düzeyleri immunoblot her yöntem için tarafından analiz edildi. PNS toplam protein konsantrasyonları BCA assa tarafından sayısaly ve azot kavitasyon tarafından hazırlanan PNS değeri için normalleştirilmiş. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: azot kavitasyon sırasında kullanılan Hipotonik ve izotonik arabellekleri karşılaştırılması. Hücreler Hipotonik arabellek veya Hipotonik arabellek askıya alındı Jurkat eşdeğer miktarda %8,5 Sükroz veya 150 mM NaCl ile desteklenmiş ve azot kavitasyon (20 dk için ~ 350 PSI) tabi. PNS endojen proteinlerin göreli düzeyleri için her arabellek immunoblot tarafından analiz edildi. PNS toplam protein konsantrasyonları BCA tahlil tarafından sayısal ve Hipotonik arabellekte hazırlanan PNS değeri için normalleştirilmiş. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 5: Farnesylated NRAS bölümleri P ve S kesirler. HEK-293 hücreleri geçici bayrak öğesini NRAS vahşi türü veya C186S mutant ifade yönetmenlik Plasmid'ler ile transfected. Şekil 2 ' de açıklandığı gibi protein bölümleme gerçekleştirilmiş ve belirtilen protein düzeyleri immunoblot tarafından analiz edildi. (Zhou, M ve ark., 2016. izniyle çoğaltılamaz Aslında Günlük hücre biyolojisiyayınlandı. https://doi-org.remotexs.ntu.edu.sg/10.1083/JCB.201604061). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Manifold gibi diğer yöntemler üzerinde azot kavitasyon mekanik bozulma avantajları vardır. Belki de en önemli yararı yavaşça henüz verimli bir şekilde numuneler homojenize yeteneğidir. Dekompresyon cools örnekleri oluşturma Yerel Isıtma hasar yerine fiziksel prensipleri Ultrasonik gibi ve sürtünme/kesme teknikleri dayalı. Kavitasyon Ayrıca son derece plazma zarı bozan etkilidir. Azot kabarcıklar dekompresyon, kavitasyon işleminin üzerine tek tek her hücre içinde oluşturulan sınırlı olduğundan hücre boyutuyla daha az boyutu örnek veya konsantrasyon örnek. Bu nedenle Dounce izni tabanlı veya iğne geçit homojenizasyon ek avantaj sunar. Azot kavitasyon da aynı şekilde örnek uygulanan aynı yıkıcı güç aynı baskılar ile çoğaltılamaz gibi daha tutarlı sonuçlar sunuyor. Ayrıca, her hücre yalnızca bozulma süreci için tek bir kez deneyimleri. ve hücre altı bileşenleri bu nedenle, değil sürekli değişken yıkıcı güçleri maruz kalır. Bu organelleri artefactual parçalanma sınırlar. Değişken hücresel bileşenleri tarafından yol açtı oksidasyonunu için endişe azot hücre süspansiyon doyurmak için kullanıldığı gibi Ayrıca, hafifletilmiş ve oksijen desteği ücretsizdir. Azot kavitasyon tarafından dayatılan yasak fiziksel ve kimyasal stresleri değişken enzimler ve kırılgan organelleri ve tekrarlanabilirlik bu homojenizasyon teknik eğitim için ideal bir tekniği de miktar için uygun yapar.
Azot kavitasyon örnek boyutu, homojenizasyon oluşturulanSQL kompozisyonu ve organel bütünlük derecesi açısından önemli esneklik sunuyor. Homojenizasyon kadar ölçeklemek için bir Basit Basınçlı kaplar bir daha büyük kapasite, hız, kolaylık veya dekompresyon verimliliğini ödün vermeden dağıtmak gerekiyor. Herhangi bir homojenizasyon arabellek azot kavitasyon için kullanılabilir; Arabellek seçim her deney şartları ile uyumluluk için uygun olabilir. Bir hücre içi sıvısı (örneğin, yüksek potasyum ve düşük sodyum) değişiklikleri en aza indirmek için organelleri içinde eşleşen bir homojenizasyon arabellek tasarlayabilirsiniz. Örneğin, ex vivo aktin polimerizasyon en aza indirir ve böylece sağlam sitoplazmik veziküller granülosit5toplama konusunda yardımcı olur, "gevşeme" arabellek geliştirdik. Arabellek ozmotik ve iyonik özellikleri hücre homojenizasyon derecesini kontrol etmek için de değiştirilebilir. Ayrıca, hücresel bozulma saldırganlık azot basıncı ayarlayarak denetlenebilir. Orta basınç yüksek basınç bu organelleri bozan iken nükleuslar, mitokondri ve diğer organelleri sağlam bir durumda korumak için yıkıcı gücü azaltır. Brock ve ark. çoğu çekirdeği Hipotonik arabellek10geçerli bizim protokolünde kullanılan azot basıncı temelini, 350 PSI, olduğu gibi koruyarak sıçan bazofilik lösemi hücrelerinin bozulma ile başarı bildirdi.
Azot kavitasyon sınırlamaları gerçeği homojenizasyon örnekleri üniforma ve farklı membran yapılar veziküller benzer boyutlarda üretebilir içerir; Bu oran bölgeli yoğunluk gradient Santrifüjü tarafından daha fazla ayırma plazma zarı, düzgün microsomes, endosomes ve Golgi membranlar karmaşık hale getirebilir. Organelleri homojenizasyon içinden kopması nedeniyle sonra nispeten kırılgan hale başka bir husustur. Bu nedenle, bu yöntem sonraki manipülasyonlar organel kırılma önlemek için dikkatli optimizasyonu gerektirir. Bu çalışmada bu sorunlardan bazılarının adres amaçladık.
Sitozolik ayrılması ve membran kesirler Santrifüjü tarafından sınırlı raporlarında protein kesirler protein işaretleri15,16bir avuç bölümleme ayrıntılı araştırılmalıdır. Bizim yöntem çözünür ve membran bağlı protein ham bir ayırma oluşturur ve özel organelleri yalıtım anlamına gelmez. Ancak, hala farklı membranlar kavitasyon tarafından üretilen homojen veziküller ultrasantrifüj tarafından ayrılık verimliliğini etkileyebilir geçerli bir endişe olduğunu. Biz immunoblots tecrit ve sonra bizim protokolü ile ayırma ortak hücre altı organelleri bölümleme tarafından kapsamlı bir anket sundu. Beklendiği gibi tamamen sitozolik RhoGDI gibi sadece proteinlerdir çözünür kesir ve EGFR ve Na+gibi plazma zarı (PM) üzerinde transmembran proteinler /K+ ATPaz, iyileşti Pelet sadece. ER, mitokondri, Golgi ve organellerin gibi organellerin üzerinde transmembran proteinler de integral membran proteinlerinin farklı membranlar ve organelleri başarıyla çözünür proteinler ile üzerinden ayrılmış teyit Pelet, ele geçirildi bizim yöntem. Bu temel doğrulama amacı, bu iletişim kuralı olan periferik membran proteinlerinin, daha fazla çözümleme için çok önemlidir.
Periferik membran proteinlerinin çoğunu hem sitozolik ve membran kesirler adlı biri yok. Bu kez onların yerelleştirme gerçek bir temsili olmasına rağmen bu bazı durumlarda bu proteinlerin artefactual yeniden dağıtım sitoplazmik membran yüzeyden çözünür kesir homojenizasyon işlemi sırasında beri temsil edebilir Onların dernek membranlar ile gücünü bu integral membran proteinlerinin olarak kadar güçlü değil. Bir kerelik, yumuşak bozulma hücrelere açarak azot kavitasyon potansiyel yeniden dağıtım en aza indirir rağmen bir böyle eserler biyokimyasal ayırma ve proteinler arasında sitozolik bölümleme değişiklikler odaklanmak dikkatli olmalıdır ve membran kesirler deneysel koşullar karşısında. Yine de, periferik membran proteinlerinin incelenmesi endosomal olgunlaşma çeşitli aşamalarında bu yöntemle mümkündür. EEA1, clathrin kaplı veziküller erken endosomes için yerleştirme aracılık eder bir Rab5 efektör erken endosomes sitoplazmik yüzeye yerelleştirir ve öncelikle Pelet kesir kurtarıldı. Endosome ile ilgili geç Rab7 ve Rab9 da Pelet kesir proteinlerdir. Ancak, Rab7/9 kayda değer bir miktar sitozol içinde kalır. RabGDI prenylated Rabs ile etkileşim ve bu başka türlü çözünmez proteinler sitozolik işlemek mümkün olduğundan, Rab proteinler diğer endosome ile ilgili çevresel membran proteinlerinin daha fazla sitozolik olma eğilimindedirler.
Homojenizasyon nükleer ve organel bütünlüğüyle azot kavitasyon tarafından karakterize etmek için biz immunoblotted luminal ve sitoplazmik salonlar için izole kesirler. Bu analizde, calregulin ER formu microsomes bozulur ve böylece luminal içerik sızıntısı gösteren çözünür kesir tam olarak yayımlanır. Bunu göz önüne alındığında ökaryotik hücre membran ümumi sahəsi yarısı acil servis labirent alanlarda içine alır, geniş ağını sac benzeri veya tübüler yapısının azot kabarcıklar genişleme sırasında bozulmadan kalması başarısız unsurprising. Öte yandan, mitokondrial bütünlük kavitasyon sonra bizim analiz hücre tipi açık bağımlılığı biz F1gözlenen gösterir-ATPaz, periferik sitozolik kesir mitokondri iç membran ile ilişkili bir protein farklı derecelerde (~ %35 HEK-293 ve Jurkat için NIH 3T3 için % 2). Bu o azot gösterir kavitasyon Hipotonik arabellek 350 PSI, mitokondrial bütünlüğü garanti etmez. Gerçekten de, diğerleri mitokondri korumak için kavitasyon baskılar 150 psi17düşük, gerçekleştirilmesi gerektiğini bildirdi. Buna karşılık, biz bu katalaz Peroksizomların Lümen içinde kalır bulundu. Çoğu intriguingly konularda, nükleer proteinler PNS ve Pelet kesirler gözlenir. Özellikle, HDAC1, Histon deacetylase nucleoplasm mevcut yoktur nükleer bütünlük atılmamasını gösteren çözünür kesir. Bir HDAC1 yayın solub içine beklendiği gibi bu nükleer zarf kavitasyon tarafından yırtıldı değil göstermektedirBu senaryoda Le kesir. Çekirdeklerin PNS hazırlama işlemi sırasında tamamen kaldırılmaz ve protein Pelet ultrasantrifüj sonra kalır muhtemel kalır. Bu büyük olasılıkla daha fazla hiçbir DNA sızıntı çözünür kesir algılanır Aslında tarafından desteklenir. Bu nedenle, kavitasyon ~ 350 PSI Mg2 + ek de sırasında Hipotonik homojenizasyon arabellek kullanarak birden çok hücre hatlarında nükleer bütünlüğünün korunması mümkün olduğu sonucuna varıldı.
Bizim sonuçları da ribozomlara ER membranlar ilişkisiz hatta ücretsiz ribozomlara sitoplazmada-ebilmek var olmak tamamen sonra Sükroz yastık arabellekte posalı düşündüren tamamen membran Pelet kesir, toplamak göstermektedir Santrifüjü 350.000 x g 1 h. Likewise, tanımlaması autophagy kaynaklı protein 12 (Atg12) için de-Atg5 eşlenik autophagosomes, işaretleyici olarak Pelet kesirler için sıkı ayrımı ortaya koymaktadır. Sitozol varlığını kovalent-eki Atg12 ve Atg5 autophagosomes oluşumu öncesinde olgu tarafından neden olabilir. Hücre iskeleti proteinleri ex vivo polimerizasyon nedeniyle değerlendirmek zordur. Bu fenomen bir gevşeme arabellek ile en aza indirilebilir ama burada açıklanan protokolünde tübülin büyük olasılıkla polimerli ex vivo şelasyon kalsiyum 18 üzerine olduğunu. Hazırlıklarımız içinde tübülin aktin P ve S kesirler bulunur, ancak polimerizasyon düşündüren Pelet bulunur.
Azot kavitasyon potansiyel avantajları homojenizasyon verimliliği karakterize etmek için ortak bazı mekanik bozulma teknikleri gözden geçirdim. Blender veya harç/havaneli gibi doku örnekleri için en iyileştirilmiş yöntemleri değerlendirildi değil. İç organelleri sağlam tutarken yüzey membran bozmaya zor olduğu gibi sonication da dışarıda bırakıldı. Analizimizi aşağıdaki yöntemleri üzerinde duruldu: donma-çözülme, iğne geçit ve Dounce Homojenizasyon, onlar için kolay olarak gerçekleştirmek ve rulman homogenizer gibi özel ekipman gerektirmez. Jurkat hücreleri bu analizde onları verimli bir şekilde geçiş izni, iğne geçiş ve Dounce gibi bağlı geleneksel sıvı kesme teknikleri ile homojenize zor işleyen küçük boyutlarından dolayı kullanılmıştır. Kurtarılan toplam protein konsantrasyonu tarafından değerlendirilecektir, azot kavitasyon ve donma-çözülme gibi hücre boyutu bağımsız bozulma yöntemleri gerçekten üstün protein ayıklama verimliliğini göstermek bulundu. Azot kavitasyon test alternatif fiziksel yöntemler için (veri gösterilmez) hala üstün olmasına rağmen daha büyük boyutlarda hücrelerle benzer analiz homojenizasyon verimliliği, daha küçük farklılıkları ortaya koydu.
Birçok sitozolik, endosomal ve sitoiskeleti proteinlerin verimli bir şekilde tüm test yöntemleri ile ele geçmiştir. Buna ek olarak, ER ve Golgi proteinlerin en iyi şekilde azot kavitasyon kullanarak ele geçirildi. Biraz daha düşük verim F1-ATPaz azot kavitasyon diğer yöntemlere göre mitokondri kavitasyon sırasında bozulmadan kalması olasılığı vardır ve bu nedenle daha verimli bir şekilde yavaş hız spin çıkarmak için kullanılan gerçeği yansıtabilir PNS oluşturmak. Gözlem bu hexokinase 1, periferik membran protein sitozol ikisinde buldum ve F1göre ters moda davrandım dış mitokondrial membran ile ilişkili-ATPaz büyük olasılıkla yansıtır Derneği lability hexokinase 1 göre F1-ATPaz, mitokondri içinde münzevi. Önemlisi, karşılaştırılabilir verimliliği hücrelerle engellemeden yeteneğine rağmen alternatif mekanik bozulması yöntemlerini belirli çevresel zar proteinleri (hexokinase 1 ve RAS) nispeten yoksul kurtarılması verdi. Böylece, kavitasyon periferik membran proteinlerinin bölümünü araştırılması amacıyla seçim bizim homojenizasyon tekniğidir. Dounce homojenizasyon sağlam çekirdeği hazırlamak için yaygın olarak kullanıldığından, biz Dounce bir kriter olarak diğer mekanik bozulma yöntemleri arasında nükleer bütünlüğünü değerlendirmek için kullanılır. Bizim analizi, benzer düzeyde iyileşme HDAC1 proteinlerin hücre çekirdeği içinde azot kavitasyon, Hipotonik arabellek ~ 350 PSI tarafından hazırlanan Jurkat homogenates korunacak onaylayın.
Azot kavitasyon sırasında kullanılan homojenizasyon arabellek bozulma verimliliği ve organel bütünlüğü önemli ölçüde etkileyebilir belirgin oldu. Homojenizasyon arabellek bileşimi amaçlanan uygulama gereksinimleri için optimize edilmiş iken, bu hayvan dokuların azot dekompresyon gerçekleştirme araştırmacılar arabellek düşük osmotik basınç ile nükleer ayıklamak için kullanın dikkati çekiyor içeriği. Şişme çekirdekleri ve çözümleri seyreltik yaşındayken rüptürü ve çekirdek koruma (ki her iki inorganik Sodyum Klorür veya organik solutes gibi tuzlar gibi ekleyerek elde edilebilir izotonik çözümleri7 kullanırken avcı ve Commerford gösterdi Sükroz veya gliserol). Memeli hücrelerinin çekirdekleri dışında hücre altı organelleri yalıtmak için kullanılan standart izotonik arabellek 1 mM EDTA içeren 0.25 M sukroz ve Tris, HEPES veya Tricine ile pH 7,0 7,6 arabelleğe alınmış. Ama tüm kültür hücreleri verimli izotonik arabellekleri birinde homojenize. Hipotonik arabellek (genellikle 10 mM Tris, HEPES, vb) kez gerekli ozmotik stres tam homojenizasyon elde etmek için belirli hücre tipleri sağlamak için kullanılır. Ancak, daha önce belirtildiği gibi Hipotonik arabellekleri EDTA dahil edildiğinde çekirdeklerin kırılgan ve DNA'ın sızıntı eğilimli render eğilimindedir. Nükleer bütünlük teşvik etmek, EDTA KCl ve düşük konsantrasyonlarda MgCl2 veya MgSO4gibi divalent katyonlar ile değiştiririz. İkincisi bazı phospholipases ve proteaz etkinleştirmek çünkü olabilir ve RNA polimeraz inhibe Mg2 + Ca2 + üzerinde genellikle tercih edilir. Kavitasyon işlemi bittiğinde, EDTA veya EGTA geri homogenates için katyon şelasyon yapın metalloproteases etkisizleştirmek için gerekirse ilave edilebilir.
Jurkat hücreleri görüntülemek nükleer bütünlük çalışmaya bir ideal hücre kültürünü geliştirmelerde nispeten büyük bir çekirdek sitoplazma oranı. Hipotonik arabellek kullanarak homojenizasyon verimlilik artış izotonik NaCl ile desteklenmiş arabelleğine karşılaştırırken en az düzeydedir. Ancak, kavitasyon Sükroz ile desteklenmiş bir izotonik arabellekte bir Hipotonik arabellek muadili kullanarak çıkarılan yaklaşık yarım proteinler kurtarır. Bu isotonicity doğrudan bir sonucu olması pek mümkün olup NaCl ve isotonicity ulaşmak için Sükroz kullanırken arasında tutarsızlık daha fazla araştırma gerektirir. Sükroz değil ise tuz proteinler arasındaki Elektrostatik etkileşimler bozan tek mantıklı açıklaması bu. Böylece, aynı tonicity hatta, NaCl Sükroz yoksun protein ayıklama ilgili etkinlik vardır. Wi. konuda nükleer bütünlüğünü korumak için artan fibrillarin proteinler ile izotonik arabellekleri teorik olarak çekirdekleri daha koruyucu olmak rağmen izotonik tampon kurtarılan bulduk. Merakla, mitokondrial kesir izotonik NaCl, düşük tuz koşulları mitokondri çıkarma için suboptimal olabilir düşündüren ile takıma arabelleği ile daha verimli bir şekilde ayıklandı. Hipotonik arabelleği ile kavitasyon homojenizasyon verimlilik ve nükleer bütünlüğü arasında en iyi dengeyi elde göz önüne alındığında, Hipotonik arabellek arabellek seçim bizim protokolünün, kavitasyon olur. Ancak, biz okuyucuların arabellek yok en iyi homojenizasyon sonuçlarının bir garantidir dikkat. Bizim iletişim kuralı en iyi duruma getirme için bir şablon olarak hizmet etmeli ve pilot ile istenilen arabellekler test, faiz ve diğer değişkenler (basınç, arabellek oluşturma, vb) hücre hatları en iyi sonuçlar için oluşturulmalıdır.
Açıklamalar
Yazarlar onlar rakip hiçbir mali çıkarları var bildirin.
Teşekkürler
Bu eser, GM055279, CA116034 ve CA163489 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell Disruption Vessel (45 mL) | Parr Instrument | 4639 | Nitrogen cavitation Bomb |
| Dounce homogenizer (2 mL) | Kontes | 885300-0002 | Dounce pestle and tube |
| U-100 Insulin Syringe 28G½ | Becton Dickinson | 329461 | Needle |
| Atg12 antibody | Santa Cruz | 271688 | Mouse antibody, use at 1:1000 dilution |
| β-actin antibody | Santa Cruz | 47778 | Mouse antibody, use at 1:1000 dilution |
| β-tubulin antibody | DSHB | E7-s | Mouse antibody, use at 1:5000 dilution |
| Calnexin antibody | Santa Cruz | 23954 | Mouse antibody, use at 1:1000 dilution |
| Calregulin antibody | Santa Cruz | 373863 | Mouse antibody, use at 1:1000 dilution |
| Catalase antibody | Santa Cruz | 271803 | Mouse antibody, use at 1:1000 dilution |
| CIMPR antibody | Abcam | 124767 | Rabbit antibody, use at 1:1000 dilution |
| EEA1 antibody | Santa Cruz | 137130 | Mouse antibody, use at 1:1000 dilution |
| EGFR antibody | Santa Cruz | 373746 | Mouse antibody, use at 1:1000 dilution |
| F0-ATPase antibody | Santa Cruz | 514419 | Mouse antibody, use at 1:1000 dilution |
| F1-ATPase antibody | Santa Cruz | 55597 | Mouse antibody, use at 1:1000 dilution |
| Fibrillarin antibody | Santa Cruz | 374022 | Mouse antibody, use at 1:200 dilution |
| Golgin 97 antibody | Santa Cruz | 59820 | Mouse antibody, use at 1:1000 dilution |
| HDAC1 antibody | Santa Cruz | 81598 | Mouse antibody, use at 1:1000 dilution |
| Hexokinase 1 antibody | Cell Signaling Technology | 2024S | Rabbit antibody, use at 1:1000 dilution |
| Lamin A/C antibody | Santa Cruz | 376248 | Mouse antibody, use at 1:1000 dilution |
| LAMP1 antibody | DSHB | H4A3-c | Mouse antibody, use at 1:1000 dilution |
| Na+/K+ ATPase antibody | Santa Cruz | 48345 | Mouse antibody, use at 1:1000 dilution |
| Rab7 antibody | Abcam | 137029 | Rabbit antibody, use at 1:1000 dilution |
| Rab9 antibody | Thermo | MA3-067 | Mouse antibody, use at 1:1000 dilution |
| RCAS1 antibody | Santa Cruz | 398052 | Mouse antibody, use at 1:1000 dilution |
| RhoGDI antibody | Santa Cruz | 360 | Rabbit antibody, use at 1:3000 dilution |
| Ribosomal protein S6 antibody | Santa Cruz | 74459 | Mouse antibody, use at 1:1000 dilution |
| Sec61a antibody | Santa Cruz | 12322 | Goat antibody, use at 1:1000 dilution |
| Thickwall Polycarbonate ultracentrifuge tube | Beckman Coulter | 349622 | Sample tube for ultracentrifugation |
| TLK-100.3 rotor | Beckman Coulter | 349481 | rotor for ultracentrifugation |
| Optima MAX High-Capacity Personal Ultracentrifuge | Beckman Coulter | 364300 | ultracentrifuge |
| cOmplete protease inhibitor cocktail tablets | Roche | 11697498001 | protease inhibitors |
| Cell Scrapers with 25cm Handle and 3.0cm Blade | Corning | 353089 | large cell scraper |
| Magnetic Stir Bar | Fisher Scientific | 14-513-57SIX | micro stir bar |
| Ceramic-Top Magnetic Stirrer | Fisher Scientific | S504501AS | magnetic stirrer |
Referanslar
- Miyawaki, A. Proteins on the move: insights gained from fluorescent protein technologies. Nat Rev Mol Cell Biol. 12 (10), 656-668 (2011).
- Bunger, S., Roblick, U. J., Habermann, J. K. Comparison of five commercial extraction kits for subsequent membrane protein profiling. Cytotechnology. 61 (3), 153-159 (2009).
- Simpson, R. J. Disruption of cultured cells by nitrogen cavitation. Cold Spring Harb Protoc. (11), (2010).
- Klempner, M. S., Mikkelsen, R. B., Corfman, D. H., Andre-Schwartz, J. Neutrophil plasma membranes. I. High-yield purification of human neutrophil plasma membrane vesicles by nitrogen cavitation and differential centrifugation. J Cell Biol. 86 (1), 21-28 (1980).
- Philips, M. R., et al. Low molecular weight GTP-binding proteins in human neutrophil granule membranes. Journal of Biological Chemistry. 266, 1289-1298 (1991).
- Wallach, D. F., Soderberg, J., Bricker, L. The phospholipides of Ehrlich ascites carcinoma cells: composition and intracellular distribution. Cancer Res. 20, 397-402 (1960).
- Hunter, M. J., Commerford, S. L. Pressure homogenization of mammalian tissues. Biochim Biophys Acta. 47, 580-586 (1961).
- Wallach, D. F., Kamat, V. B. Plasma and Cytoplasmic Membrane Fragments from Ehrlich Ascites Carcinoma. Proc Natl Acad Sci U S A. 52, 721-728 (1964).
- Birckbichler, P. J. Preperation of plasma membrane vesicles by nitrogen cavitation. TCA manual / Tissue Culture Association. 3 (3), 653-654 (1977).
- Brock, T. G., Paine, R., Peters-Golden, M. Localization of 5-lipoxygenase to the nucleus of unstimulated rat basophilic leukemia cells. J Biol Chem. 269 (35), 22059-22066 (1994).
- Dowben, R. M., Gaffey, A., Lynch, P. M. Isolation of liver and muscle polyribosomes in high yield after cell disruption by nitrogen cavitation. FEBS Letters. 2 (1), (1968).
- Dai, Q., et al. Mammalian prenylcysteine carboxyl methyltransferase is in the endoplasmic reticulum. J Biol Chem. 273 (24), 15030-15034 (1998).
- Wynne, J. P., et al. Rap1-interacting adapter molecule (RIAM) associates with the plasma membrane via a proximity detector. J Cell Biol. , (2012).
- Zhou, M., et al. VPS35 binds farnesylated N-Ras in the cytosol to regulate N-Ras trafficking. J Cell Biol. 214 (4), 445-458 (2016).
- Sim, D. S., Dilks, J. R., Flaumenhaft, R. Platelets possess and require an active protein palmitoylation pathway for agonist-mediated activation and in vivo thrombus formation. Arterioscler Thromb Vasc Biol. 27 (6), 1478-1485 (2007).
- Pace, P. E., Peskin, A. V., Han, M. H., Hampton, M. B., Winterbourn, C. C. Hyperoxidized peroxiredoxin 2 interacts with the protein disulfide- isomerase ERp46. Biochem J. 453 (3), 475-485 (2013).
- Annis, M. G., et al. Endoplasmic reticulum localized Bcl-2 prevents apoptosis when redistribution of cytochrome c is a late event. Oncogene. 20 (16), 1939-1952 (2001).
- Berkowitz, S. A., Wolff, J. Intrinsic calcium sensitivity of tubulin polymerization. The contributions of temperature, tubulin concentration, and associated proteins. J Biol Chem. 256 (21), 11216-11223 (1981).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır