Method Article
Kantitatif Kütle Spektrometresi Analiz lipid Damlacık izolasyonu
Bu Makalede
Özet
Lipid damlacıkları Hepatit C virüsü (HCV), dahil olmak üzere çeşitli patojenlere replikasyonu için önemli organellerdir. Bu ilişkili proteinler kantitatif kütle spektrometresi için lipid damlacıkları izole edilmesi için bir yöntem tarif; bu tür virüs enfeksiyonu, çevresel stres veya ilaç tedavisi gibi koşullar, çeşitli altında kullanılabilir.
Özet
Lipid damlacıkları viryon morfojenezinin varsayımsal bir site olarak, farklı patojenlerin, en belirgin Hepatit C Virüsü (HCV) replikasyonu için hayati önem taşır. Kantitatif lipit damla proteom analizi lokalize ya da virüs enfeksiyonları gibi koşullar altında lipid damlacıkları yer değiştirir proteinleri tanımlamak üzere kullanılabilir. Burada başarılı HCV enfeksiyonu takiben lipid damlacığı proteomu değişiklikleri karakterize etmek için kullanılan edilmiş bir protokol açıklar. Bu hücre kültürü (SILAC) Amino Asitler ile kararlı İzotop Etiketleme kullanmakta ve böylece, kütle spektrometresi ile proteinlerin miktarını belirlemek için "ağır" amino asitler ile hücreler popülasyonu tamamen Proteomun etiketleyin. 1 ve hipotonik tampon maddesi içinde mekanik olarak parçalanmıştır: lipit damla izolasyonu için, iki hücre popülasyonları (örneğin, HCV ile enfekte olmuş / "hafif" terimi, amino asitler ve enfekte olmamış kontrol / "ağır" amino asit) 1 karışımı karıştırılır. çekirdek ve hücre d çıkarılmasından sonradüşük hızlı santrifüjleme ile ebris lipit damla bağlı proteinler, izotonik tampon içinde üç yıkama safhası ile takip iki ardışık ultrasantrifügasyon adımlarla zenginleştirilmiştir. lipit damla fraksiyonların saflığı farklı hücre içi bölmelere tanıyan antikorlar ile Western blot ile analiz edilir. Lipit damlacık ilişkili Bundan sonra proteinler Coomassie boyama ile takip edilen SDS-poliakrilamid jel elektroforezi (SDS-PAGE) ile ayrılır. triptik sindiriminin sonra, peptidler, sıvı kromatografisi-elektrosprey iyonizasyon tandem kütle spektrometresi (LC-ESI-MS / MS) ile kantifiye edilir. Bu yöntemi kullanarak, biz yanlısı veya antiviral konak faktörleri temsil edebilir HCV enfeksiyonu üzerine lipid damlacıkları ile işe proteinleri belirledi. Önerilen yöntem, bu tür patojen ile enfeksiyonu, çevresel stres veya ilaç tedavisi gibi çeşitli hücreler ve kültür koşulları, çeşitli uygulanabilir.
Giriş
Lipid damlacıkları oldukça nötr lipidlerin bir çekirdekten oluşan dinamik sitoplazmik (ve nükleer) hücre organelleri (trigliserit (TG) ve kolesterol ester (CE)) gömülü protein 1 ile birlikte fosfolipitlerin bir tek tabaka ile kaplanır. Tüm hücre tipleri lipid damlacıkları üretmek, ancak, ebat, lipid bileşimi ve protein dekorasyon değişir. Lipid damlacıkları enerji ve membran ön-madde rezervuar ya da protein birikintilerinin olarak hizmet dahil olmak üzere çeşitli fonksiyonları yerine getirirler. Buna ek olarak, lipid alımı ile, bu sinyal molekülleri lipotoksisite hücreleri, salma lipidler korumak ve protein bozulması ve endoplazmik retikulum (ER), stres tepkileri 2 katılmaktadırlar. Bu şekilde, bir protein konakçı lipid damlacıkları bağlanan ve diğer organellere ile üretimi, bozulma, ticareti ve etkileşimi idare. Bunlar arasında (PLIN1-5) iyi niyetli lipit damlacığı bağlayıcı proteinlerin perilipin ailesidirf "> 3.
Lipit damlacık biogenesis muhtemelen nötr lipidlerin bir lens, son maya 4 güzel görselleştirilmiştir bir oluşturma yöntemi, ER-yerleşik enzimler membran çift katman içinde birikir nötral lipidlerin sentezini katalize eden ER, başlar. Bükme Membran ve yüksek fosfatidik asit ve diasilgliserol seviyeleri daha sonra lipit damlacık oluşturma 5 için gerekli olan temel nötral lipitler ve koruyucu fosfolipidlerin eşzamanlı sentezi, fosfolipid biyosentezinde yer alan proteinleri çekmek için düşünülmektedir. ER ikamet transmembran etki barındıran enzimler bu işlemi katalize eder. büyük lipid damlacıkları Genişleme bir amfipatik heliks liman ve böylece lipid damlacıkları ER'den hareket edebilir lipid sentezleyen enzimlerin farklı sınıfının aktivitesini gerektirir. lipid damlacıkları lipidlerin harekete trigliserit lokal aktivasyonu yoluyla meydana gelirE ve diasilgliserol lipazlar yağ trigliserit lipaz (ATGL) hormona duyarlı lipaz (HSL) veya makro ve microlipophagy veya farklı otofajik yollar ile otofajiyi 6 dolayımlı şaperon. Lipid damlacıkları ve ER (beta-oksidasyon ve lipid sentezi için) olarak mitokondri gibi diğer hücresel organeller, etkileşime girmez, fakat (lipid sentezi ve protein göçünü gibi) da lizozomun endozomlarda, ve hücre içi bakteri 7 ile uyarılan vakuollü. Gerçekten de bakteri, virüs ve hatta parazitler, bunların HCV 8 arasında replikasyon ve kalıcılığı için lipid damlacıkları hedefler.
HCV enfeksiyonu yılı 9 başına yaklaşık 0,5 milyon ölüme muhasebe dünya çapında karaciğer ile ilişkili morbidite ve mortalitenin önde gelen nedenlerinden biridir. HCV enfeksiyonlarının gerçek sayı bilinmiyor, ancak son tahminler 130 düşündürmektedir - 150 milyon insan kronik olarak enfekte olmaktadır. hiçbir vaccinE var, ancak son zamanlarda onaylanmış direkt etkili antiviraller büyük ölçüde standart interferon-bazlı terapi ile karşılaştırıldığında tedavi edici müdahalelerin artırılması. Ancak, dünya çapında hastaların tedavi olasılığı nedeniyle yeni tedavilerin son derece yüksek maliyetlere sınırlandırılacaktır. Tüm bireylerde yaklaşık yarısı kronik karaciğer yağlanması hastalığı (steatoz), hepatositlerde lipid damlaları aşırı birikimi ile karakterize edilen bir durum geliştirme HCV ile enfekte edilmiştir. İlgi çekici bir lipid damlacıkları farazi viral montaj alanlarında 10, 11 olarak işlev gören, HCV replikasyonu için hayati hücresel organellere ortaya çıktı.
HCV ile enfekte olmuş hücrelerde viral protein çekirdek ve NS5A diasilgliserol asiltransferaz-1 (DGAT1) inhibitörleri olarak, trigliserid biyosentezi üzerinde bağlı olan bir süreç içinde lipid damlacıkları lokalize lipid damlacıkları ve daha sonra, HCV partikül üretimi 12 kaçakçılığı zarar >, 13, 14, 15. Buna ek olarak, iç kısmın veya NS5A ya lipit damla bağlayıcı bölgeleri mutasyonlar HCV düzeneğinin 16, 17 bastırır. Çekirdek ve NS5A sonra yakından 16 damlacıklar lipit bağlantılı zarlara, diğer viral proteinler, ve aynı zamanda viral RNA replikasyon komplekslerinin işe. Tüm viral proteinlerin bir uyumlu eylem enfeksiyöz viral döl 10, 11 başarılı üretimi için gereklidir. yapısal proteinler viryonların parçasıdır ve yapısal olmayan proteinleri, bu işlem için gerekli protein-protein etkileşimlerini kolaylaştırmak. İlgi çekici hakiki lipit damla bağlayıcı protein PLIN3 / TIP47 hem HCV RNA replikasyonu ve virionlar 18 serbest bırakılması, 19 için gerekli olan 20. Bu son gelişmelere rağmen, özellikle HCV replikasyonu geç evrelerinde virüs konak etkileşimlerin mekanik detayları, düzensiz sınırlı kalır ve lipit damlacıklarının kesin işlevi bilinmemektedir.
Burada, ilişkili proteinlerin kantitatif kütle spektrometresi için lipid damlacıkları izole etmek için bir yöntem açıklanmaktadır. Bu yöntemi kullanarak, lipid damlalarıyla-böler co ve etkili HCV olgunlaşması 21 için gerekli olan bir konakçı proteini olarak, HCV enfeksiyonu sırasında lipit damla proteomu derin değişiklikler ve tanımlanan anneksin A3 bulundu.
Protokol
Hücre Kültüründe Amino Asitler ile Kararlı İzotop Etiketleme (SILAC) için Medya 1. Hazırlık
Not: Burada, SILAC protein kantitasyonu Takımı - DMEM SILAC etiketlenmesi için kullanılmıştır 13 C6 L-Arginin-HCl 50 mg ile takviye edilmiştir. diyalize edilmiş fetal dana serumu (FCS) SILAC protein kantitasyonu Kit ile sağlanır.
- DMEM ortamı her bir şişeden 50 mL çıkarın ve diyaliz edilmiş FCS, 50 ml.
- 13C 6 L-Lizin-2HCI 50 mg ve ortamın 1 mL 13 C6 L-Arginin-HCl, 50 mg çözülür. İyice karıştırın ve DEM + FCS ortamı için amino asitler ekleyin.
- 1x Kalem / Strep ve 1x L-glutamin yerine ekleyin. Steril-filtre, bir 0.45 um filtre kullanılarak ortam. "Ağır" SILAC aracı olarak şişe etiketleyin.
- L-Arginin-HCl, 50 mg L-Lizin-2HCI 50 mg ile 1.3 - "hafif" orta hazırlamak için, tekrar 1.1 adımları tekrarlayın. "Şeklinde şişe etiketleyinışık" SILAC ortamı.
2. SILAC-etiketleme ve amino asit eklenmesi kontrol
- Hücreleri tripsinize edin (1x Tripsin-EDTA) ve bölünmüş, 1 x 10 orta 2 mL, iyi "ağır" SILAC ortamı ile bir ve "ışık" ile bir ihtiva eden bir 6-yuvalı kültür plakasının 2 kuyulara 5 Huh7.5 hücreleri SILAC ortamı.
- Kültür en az 6 geçiş için hücreler (bölünme oranı: 1: 6); 6 geçişinden sonra, "ağır" terimi, amino asitlerin dahil edilmesi,% 95'ten fazla olmalıdır.
- Hasat "ağır" 1 x 10 6 hücre - ve "hafif" -etiketli hücre popülasyonu dahil etkinliğini analiz etmek için. 1x PBS hücrelerin yıkayın ve 160 x g'de 5 dakika 4 ° C'de santrifüj ile pelet hücreleri.
- MS-tamponu (150 mM NaCI, 1 x proteaz inhibitör kokteyli ile takviye edilmiş 50 mM Tris-HCI, pH 7.4 ve 1 mM EDTA) tampon maddesi içinde 150 uL hücre pelet yeniden süspanse edildi ve 30 dakika süreyle buz üzerinde hücrelerin inkübe. Parçalayıcı c4 ° C'de sonikasyon ile arşın.
NOT: Aşağıdaki Burada kullanılan ultrasonik titreşim ayarları şunlardır: zamanlayıcı, tutun; çıkış kontrolü, 8; görev çevrimi,% 80; ve 2 x 30 sinyal. - 11.000 x g'de 4 ° C'de 10 dakika için santrifüjleme ile hücre debrisini uzaklaştırmak. yeni bir tüpe süpernatant aktarın ve bu, deterjan-uyumlu bir protein deneyi ile protein konsantrasyonu belirlenir.
- 95 ° 'de 6x numune tamponu (375 mM Tris-HCI, pH 6.8,% 25.8, gliserol, 123 mg / ml SDS, mavi 600 ug / mL bromofenol ve 60 uL / ml β-mersaptoetanol), kaynatın ile proteinin 75 ug karıştırın Cı 5 dakika ve yaklaşık olarak 1 saat süre ile tampona 180 V de (3.02 g / L Tris baz, 18.8 g / L glisin, ve 1 g / L SDS) çalışan veya üreticilerine göre SDS içinde SDS-PAGE ile protein ayırmak 'talimatlar.
- Coomassie boyama çözeltisi içine jel aktarın. Her kuşaktan gelen aynı protein bandı keser. tripsin ile protein sindirimi ve MS analizi sırasında dahil edilmesi etkinliğini analizs, olarak 22 tanımlanan.
SILAC etiketli Huh7.5 Hücreleri 3. lipid Damlacık İzolasyonu
- Hücrelerin bir popülasyonunu enfekte (yani, "hafif," amino asitler ile işaretlenmiş olan) (örneğin, Jc1 NS5AB-mKO2 BSD, MOI 1), 37 ° C'de 4 saat boyunca, 21 açıklandığı gibi virüs stokları ile inkübe edilerek bir HCV raportör virüsü ile .
NOT: Jc1 NS5AB-mKO2-BSD 21 daha önce açıklanan, bir yinelenen NS5A NS5B bölünme bölgesi arasında Blastisidin Direnç geninin (BSD) izledi enfeksiyon oranlarını izlemek için bir floresan muhabir (monomerik Kusabira Portakal 2, mKO2) taşıyan bir HCV virüsü, 23. HCV ile çalışmak BSL2 + (ABD) ya da S3 ** (Almanya) biyogüvenlik düzeyi çevreleme ve uygulamalarını gerektirir. Bunun yerine HCV ile enfeksiyon, hücreler farklı patojenler ile enfekte edilebilir. - HCV ile enfekte olmuş "hafif" hücreleri olan ve olmayan & # Expand34;. Ağır" hücresi kültürlerinin pasajlayarak sırasında PBS içinde% 4 paraformaldehit (PFA) ile bir kısım düzeltmek ve 21 tarif edildiği gibi floresan markör proteinin akış sitometrisi (örneğin, mKO2) ile HCV enfeksiyonu oranlarını belirlemek; . Jc1 NS5AB-mKO2 BSD HCV ırkı kullanılarak olması halinde, HCV-pozitif hücreleri seçmek için "hafif" ortama 10 ug / ml blastisidin S ekleyin: enfeksiyon oranları lipit damla izolasyon NOT% 90'dan daha fazla olmalıdır.
- lipit damla izolasyonundan önce, 1 d, PBS, trypsinize, "hafif" ve "ağır" ortam içinde tekrar süspansiyon hücreleri yıkayın ve bir Neubauer sayım odası kullanarak hücreleri sayın. Tohum 150 cm2 hücre kültürü çanağı içinde, her bir popülasyonda 7 x 10 6 hücre. "Hafif" ve "ağır" hücre nüfus başına en az 5 yemekleri hazırlayın. Kültür ortamı / bulaşık O / N 30 mL hücreleri.
- Ortamı çıkarın ve 1 x PBS içinde hücreleri yıkayın. 1x hücreleri AyırPBS, bir hücre kazıyıcı kullanılarak.
- Bir Neubauer sayım odası kullanılarak her iki hücre popülasyonları sayın ve bir 50 mL santrifüj tüpüne eşit hücre sayısını havuz. 160 x g'de 5 dakika 4 ° C'de santrifüj ile pelet hücreleri.
- PBS çıkarın ve sukroz tamponu (0.25 M sukroz, 1 mM EDTA, 1 mM DTT, proteaz inhibitör kokteyli ile takviye edilmiş), 1 mL hücre pelletini. Bir dar Dounce homojenizatör hücre süspansiyonu aktarın ve buz üzerinde 200 vuruş ile hücreleri lize.
NOT: tripan mavisi boyama kullanarak komple hücre parçalanmasını onaylayın. - 1.5 ml mikrofüj tüpüne lizat transferi ve 1000 x g'de 4 ° C'de 10 dakika için çekirdek ve hücre artıkları aşağı doğru döndürün.
- Santrifüj işleminden sonra, bir giriş kontrol olarak -20 ° C'de post-nükleusunun 25 uL (PNS) ait bir kısım saklayın.
- 3 mL santrifüj tüpüne (11 x 60 mm) altındaki PNS fraksiyonunun geri kalan yerleştirin ve ~ lipit damla yıkama tamponu ile (Bindirme; 4 mL total) (50 mM potasyum fosfat tamponu pH 7.4, 100 mM potasyum klorür, 1 mM EDTA ve 1 mM fenilmetansülfonil florit).
- 100,000 x g'de 2 saat ve 4 ° C'de santrifüje. (- lipid damlacıkları miktarına bağlı olarak 500 uL, yaklaşık 250) borunun tepesinden itibaren bir bükülmüş, küt kanül kullanılarak yüzer lipit damla fraksiyonu hasat. bir santrifüj tüpüne (11 x 60 mm) lipid damlacık fraksiyonu koyun, yağ damlacık yıkama tamponu (~ 3.5 mL, 4 mL toplam) ile bindirme ve santrifüj adımı tekrarlayın.
- tüpün üst kısmından bir bükülmüş, küt kanül kullanılarak yüzer lipit damla fraksiyonu Hasat ve yeni bir 1.5 mL mikro santrifüj tüpüne lipid damlacıkları aktarın. 21.000 x g'de 4 ° C'de 20 dakika boyunca lipit damla yıkama tamponu ve spin 500 uL ekleyin.
NOT: lipid damlacıkları tampon üstünde yüzen beyaz bir bant olarak görünür. - Bir jel yükleme pipet kullanarak onun altında bulunan yıkama tamponunu çıkarın ve bu yıkama adımı üç kez tekrarlayın.
- Bir jel yükleme pipet ucu kullanılarak yıkama tamponu nihai uzaklaştırıldıktan sonra, NP-40 liziz tamponu 10 uL (50 mM Tris-HCI, pH 7.4, 150 mM NaCI,% 1 NP-40, 5 uL lipit damla fraksiyonlarının karıştırın ,) proteaz inhibitör kokteyli ile takviye edilmiştir. enfeksiyöz madde ile çalışan halinde virüsü etkisizleştirmek için 1 saat boyunca buz üzerinde inkübe örnek. Bir deterjan uyumlu protein deneyi ile, protein seviyesini tespit etmek; proteinin en az 35 ug, MS-analizi için gereklidir.
- -20 ° C'de yağ damlacık fraksiyonları saklayın.
- 4x yükleme boyası ile lipit damla fraksiyonunun gelen miktarda karıştırın. Bulaşıcı malzeme ile çalışıyorsanız virüsü inaktive 1 saat buz üzerinde inkübe edin. 5 dakika boyunca 95 ° C'de kaynatılır.
- üreticinin protokolüne göre SDS-PAGE kullanılarak proteinleri ayırın. Coomassie boyama çözeltisi içine jel aktarın. jelden tüm protein bantlarını keser. Triptik içinde jel sindirim 24 / Sup>, numune buharlaşması ve% 0.1 formik asit bunları çözülür. LC-MS / MS ile analiz edin.
Not: Burada, LC-MS / MS kuadropol-Time-of-flight kütle spektrometre (Q-TOF) ya da bir doğrusal Trap kuadropol (LTQ) Orbitrap kütle spektrometresi üzerinde gerçekleştirilmiştir. Her iki alet, bir nano UPLC sistemi için bir ESI-kaynakla birleştirilmiştir. Veri analizi ve LC-MS / MS 21, 22 tarif edilen şekilde gerçekleştirilmiştir Q-TOF ve Orbitrap kütle spektrometresinde analiz eder. insan keratin ile numuneyi kontamine etmemeye büyük özen gösteriyoruz. Her zaman keratin içermeyen pipet uçları ve tüpler kullanın. Keratin içermeyen kimyasallarla laminer bir akış hunisi altına tamponlar hazırlayın. Kullanmadan önce, damıtılmış su ve etanol ile tüm yüzeyleri ve cihazlarını temizlemek. Her zaman eldiven ve bir laboratuvar önlüğü giyerler.
Lipit Damlacık Saflık 4. analizi
- lipit damla fraksiyonları 1 hacimde seyreltik: 2 ve giriş fraksiyonları NP-40 lys 1:10 (adım 3.9)tampondur. enfeksiyöz madde ile çalışan halinde virüsü etkisizleştirmek için 1 saat boyunca buz üzerinde inkübe edin. Bir deterjan uyumlu protein deneyi protein seviyesini belirler.
- 6x numune tamponu ile proteinin eşit miktarlarını karıştırın ve enfeksiyöz madde ile çalışan halinde virüsü etkisizleştirmek için 1 saat boyunca buz üzerinde örneklerin inkübe edin. SDS-PAGE ile devam edildi ve 90 dakika boyunca 80 V tank lekeleme ile nitroselüloz zarı üzerine proteinleri aktarın.
Not: tampon (TBS-T (10 mM Tris-HCI, pH 7.6, 150 mM NaCI ve% 0.05 Tween 20) içinde% 5 yağsız kurutulmuş süt tozu) bloke edilmesini, membranın bloke edildikten sonra (lipit damla belirteçleri karşı yönlendirilmiş antikorlar ile inkübe örn , PLIN1, PLIN2 veya PLIN3) ve diğer alt-hücresel kompartımanlara (belirteçleri, örneğin sekonder ve HRP ile birleştirilmiş antikorlar ardından CALR, MnSOD veya tübülin). Proteinlerin tespit edilmesi için, kimyasal ışıl ısı kullanın.
Sonuçlar
Lipid damlacıkları virionların toplanması farazi siteleri gibi HCV enfeksiyonu için hayati önem taşıyan fakat morfojenez ve virionlarına dışarı çıkması moleküler mekanizmalar tam olarak bilinmemektedir. Bu süreçte yer alan yeni bir ana bağımlılık faktörlerini tanımlamak için, HCV ile enfekte olmuş hücrelerin 21 (Şekil 1A) kantitatif lipit damla proteom analizi yapıldı. Biz, lipid damlacıkları saflaştırılması için bir protokol kurulmuş ve rutin lipit damla bağlayıcı proteinler PLIN2 / ADRP ve PLIN3 / TIP47 ve mitokondri için mikrotübül böyle β-tubulin gibi diğer hücre bölmeleri belirteçleri, bir tükenmesi, MnSOD güçlü bir zenginleştirme tespit ya da ER (Şekil 1B, C) kalretikülin / calnexin. Biz, izotop işaretlemesi kullanıldığında, özel olarak alınırlar tanımlanmış bulunan proteinleri güvenilir Huh7.5 hücreleri (Şekil 1D) ve lipid damlacıkları ile cofractionate proteinlerin bir listesi derlenirya da HCV ile enfekte olmuş hücreleri (Şekil 1 E) lipid damlaları yer değiştirir. Sonuçlarımız HCV düzenli metabolik fonksiyonu ve / veya yönetmelik gelen lipit damlacıkları bağlantısını keser belirtmek ve varsayılan ana bilgisayar bağımlılığı ve kısıtlama faktörleri belirlemek.
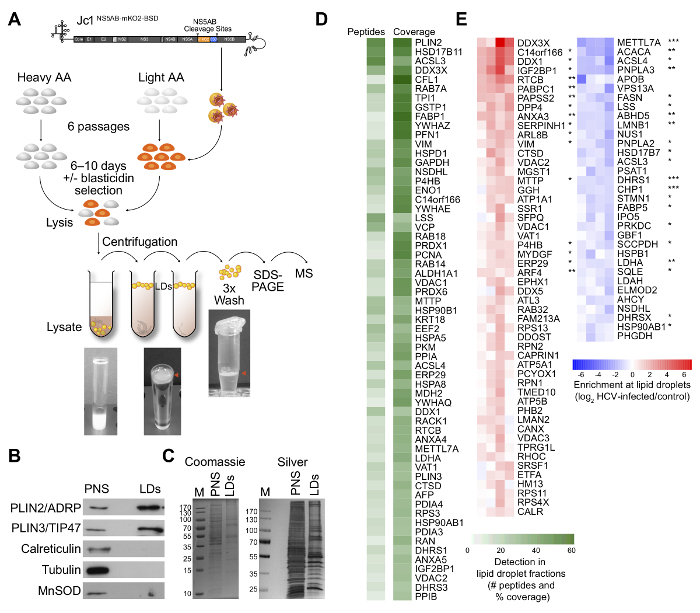
Şekil 1: Deney (A) Şema. Saf Huh7.5 hücreler "ağır" amino asitler ya da "ışık" terimi, amino asitler ile etiketlenmiştir. "Hafif" amino asit taşıyan hücreler bir HCV raportör virüsü (Jc1 NS5AB-mKO2-BSD) ile enfekte edilmiştir. "Light" ve "ağır" bir amino asit etiketli popülasyonlar karıştırılır ve lipid damlacıkları, SDS-PAGE ile ayrılmış iki ardışık ultrasantrifüj ve üç kez yıkandıktan, ile izole edildi, ve LC-ESI-MS / MS ile analiz edildi. ultracentrifugati sonra yüzen beyaz lipit damlacık fraksiyonu (kırmızı ok) Not ve yıkama mikrofüj tüplerinde. (B), post-nükleer ve lipit damla fraksiyonların Western blot analizi, lipit damla fraksiyonları lipid damlacık markör proteinlerin zenginleştirme ve diğer hücre bölmeleri belirteçleri bir tükenmesi gösterir. Post-nükleer süpernatan (PNS) ve SDS-PAGE ile ayrılmış lipit damla fraksiyonları (C), Coomassie mavi ve gümüş boyama. Gümüş boyama sadece görselleştirme için sunulmuştur. (D), peptidler ve Huh7.5 hücrelerin lipid damlacık fraksiyonları tanımlanan proteinlerin protein kapsama yüzdesi sayısı İlgi haritası (kesme: ≥5 peptidler ve ≥20% kapsar). (E) İlgi haritası olarak zenginleştirilmiş ya da HCV ile enfeksiyondan sonra lipit damla ilişkili proteinler tüketilmiş gösteren (medyan, 1.5 kat kesme normalize * p <0.05, ** p <0.01, *** P <0.001). 21'den Modifiye.et = "_ blank"> bu rakamın büyük halini görmek için lütfen buraya tıklayın.
Tartışmalar
Burada, örneğin viral enfeksiyonlar gibi çeşitli kültür koşulları altında, lipid damlacıkları ile bağlantılı proteinlerin zenginleştirme ve tükenmesi karşılaştırma kantitatif lipit damla proteom analizi için lipid damlacıkları izole etmek için bir protokol açıklar. Alternatif bir yöntem olarak, proteom analizi toplam pik yoğunluklarına dayalı etiket içermeyen sayımsal ile gerçekleştirilebilir. Bu yöntem dinamik aralık sınırlaması vardır ve metabolik sorunları önler. SILAC yaklaşımın avantajı Numuneler lipit damla izolasyon havuzlanır ve bu nedenle sonuç sindirmek, numune hazırlama hataları bağımsızdır, ve LC-MS / MS analizi olmasıdır. Biz çok nicel lipit damlacık proteom analizi için bu yaklaşımı öneriyoruz.
Bir indüksiyon veya protein ekspresyonunun baskı, quantitativ ifade düzeylerinin analiz yansıtıyor olabilir zenginleştirme veya MS analizi gözlenen lipit damla ilişkili proteinlerin tükenmesi gibi,e RT-PCR (tercihen) Western lekeleme tavsiye edilir. Western blotting ve BODIPY veya LD540, tarif edilen 21 olarak leke lipid damlacıkları gibi lipofilik boyalar ile immünoflüoresans analizi ile takip lipit damla izolasyonu: Buna ek olarak, iki yöntem, lipid damlacıkları içerisinde zenginleştirme veya spesifik proteinlerin hücrelerin azalmasını teyid etmek için kullanılabilir.
"Ağır" amino asitler ile etiketleme protein ekspresyonu ya da lipid damlacık lokalizasyonunu etkilememektedir ve "hafif", orta ve çevresel kaynaklardan protein kirlilikleri tespit etmek sağlamak için takas etiketleme koşulları deneyleri. Protein tespiti, arama peptid ve protein seviyesinde hem de 0.01 yanlış keşif oranı (FDR) ile yapılmalıdır. Farklı geçitler ve farklı virüs stok hazırlıklarından hücrelerle, 4 bağımsız deneyler - yüksek güven sonuçları sağlamak için, en az 3 performans öneriyoruz. m bağlıDeğişimin agnitude, daha bağımsız deneyler gerekli olabilir.
Nicel MS verilerinin normalleştirilmesi için her tespit proteinlerin medyan ile bölünmesi ile takas etiketleme koşullarında, "ağır" peptidler, ya da tam tersi üzerinde "hafif" tespit oranlarına merkezi, hücre sayısı ya da lipid damlacıkları biraz farklı düzeltmek için olarak 25 tanımlanan. lipid damlacıkları miktarı numuneleri arasında anlamlı farklılık olması durumunda, örneğin PLIN2 lipid damlacık işaretleyici proteinlerin, normalizasyon, tavsiye edilebilir. Biz PLIN2 seviyelere bizim MS verilerini normalleştirmek, biz biz medyan normalleştirmek olduğu gibi benzer sonuçlar bulmak (analiz gösterilmemiştir). Unutmayın ki, kullandığımız hücre kültürü koşulları altında, biz HCV enfeksiyonu üzerine önemli lipid damlacığı birikimi algılamaz.
Lipid damlacıkları diğer hücresel organellerin, en önemlisi mitokondri ve ER ile yakın temas içindedir. Bu nedenle, protein from bu bölmeler izolasyonu sırasında lipit damlacıkları ile birlikte damıtmak edebilirsiniz. böyle bir "kirletici" protein enfeksiyon veya tedaviye yanıt olarak bolca değiştirilmemiş ise, karşılaştırmalı lipit damlacık proteom analizi etkilemez. Bazı durumlarda, lipit damlacıkları ve diğer organelleri arasındaki temas değişmiş olabileceğini, ancak, dikkat edilmelidir. Örneğin, lipolitik koşullar altında, mitokondriyal protein bazal koşullar 26 ile karşılaştırıldığında lipolitik uyarılmış 3T3-L1 adipositlerden lipit damla fraksiyonları daha yüksek frekanslarda tespit edilir. Uyarılmış karboanhidraz'ı, diğer taraftan, ER ile gelişmiş dernek yol açabilir. Bu değişiklikler daha sonra saf lipit damlacık yerelleştirme yansıtıcı bile değil, çeşitli uyarıcılar ile yol organel etkileşim değişiklikleri yansıtmak ve ilginç olabilir.
Geniş bir kantitatif lipit damlacık proteom için bu protokolü kullanılırHCV ile enfekte olmuş, karşılık, enfekte olmamış kontrol hücrelerinin E analizi, HCV enfeksiyonunun neden olduğu düzensizlikler ortaya çıkarmak için ve HCV replikasyonu 21 regülatörlerini tespit etmek. hepatoma hücre hattı Huh7.5, rutin ~ ile lipit damlacık fraksiyonları içinde 2.900 proteinleri, her deneyde çok peptitler ile belirlenen 300 proteinleri tespit etmiştir. HCV enfeksiyonu takiben, hem işe alınıp konak proteinlerin tükenmesine gözlemledi. Yüksek HCV ile enfekte olmuş hücrelerin lipid damlacıkları olarak zenginleşmiş olarak belirlenen birkaç protein, daha önce (HCV ana faktör olarak yayınlanmış, örneğin, DEAD kutusu proteinleri 1 ve 3 (DDX1, DDX3) ya da insülin benzeri büyüme faktörü-II protein 1 (mRNA bağlayıcı edilmiştir IGF2BP1)), SILAC yaklaşımı 27, 28, 29 güvenilirliğini gösteren. Buna ek olarak, işe proteinler genellikle, viral RNA REPLIC arasında sıkı bir bağlantı sağlar vurgulama, RNA bağlayıcı proteinler için açıklamalılipit damla fraksiyonları ile asyon kompleksleri. Bunun aksine, yağ damlacıklardan tükenmiş proteinler esas olarak, HCV, normal metabolik düzenleme ve fonksiyonundan lipid damlacıkları çıkarmak için protein bileşimi bozan gösteren lipit metabolik süreçler için bilgi notları eklendi.
Biz tarif protokol farklı hücre hatları ve kültür koşullarına iyileştirilebilir ve replikasyon için lipid damlacıkları bağlıdır farklı patojenlerin yaşam döngüsü lipid damlacıkları işlevini çözmekte yardımcı olabilir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz JFH1 inşa T. Wakita (Ulusal Enstitüsü Jc1 yapılar için R. Bartenschlager (Heidelberg Üniversitesi), Huh7.5 hücreleri için CM Rice (Rockefeller Üniversitesi), J. McLauchlan (Medical Research Council Viroloji Birimi) thank HCVcc raportör yapılan için Enfeksiyon Hastalıkları, JFH1 için Japonya) ve B. Webster ve WC Greene (Viroloji Gladstone Enstitüsü ve İmmünoloji). Bu çalışma DFG gelen fonlarla desteklenmiştir (HE 6889 / 2-1 (EH), 337 / 15-1 2013 ANİ ve ANİ 337 / 16-1 2013 (HS)). Heinrich Pette Enstitüsü, Deneysel Viroloji Leibniz Enstitüsü Free ve Hamburg Hansa Şehri ve Federal Sağlık Bakanlığı tarafından desteklenmektedir. Maliyeciler, çalışma tasarımı, veri toplama ve analiz, yayımlama kararı, ya da yazının hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SILAC Protein Quantitation Kit - DMEM | Thermo Fisher | 89983 | |
| 13C6 L-Arginine-HCl 50 mg | Thermo Fisher | 88210 | |
| Roti-Load 1 | Roth GmbH | K929.1 | |
| Roti-Blue 5x Concentrate | Roth GmbH | A152.2 | |
| 10x SDS-Tris-Glycine - Buffer | Geyer Th. GmbH & Co.KG | A1415,0250 | |
| GlutaMAX (100x) | Life Technologies GmbH | 350500038 | |
| Penicillin/Streptomycin Solution for Cell Culture | Sigma-Aldrich Chemie GmbH | P4333-100ml | |
| DPBS 1x Dulbecco's Phosphate-buffered Saline | Sigma-Aldrich Chemie GmbH | D8537 | |
| Trypsin-EDTA | Sigma-Aldrich Chemie GmbH | T3924-100ML | |
| Sodium Chloride BioChemica | AppliChem GmbH | A1149,1000 | |
| Tris Ultrapure | AppliChem GmbH | A1086,5000A | |
| EDTA BioChemica | AppliChem GmbH | A1103,0250 | |
| Protease Inhibitor Cocktail 5 mL | Sigma-Aldrich Chemie GmbH | P8340-5ML | |
| D(+)-Sucrose BioChemica | AppliChem GmbH | A3935,1000 | |
| Hydrochloric acid (HCl) 37% pure Ph. Eur., NF | AppliChem GmbH | A0625 | |
| DC Protein Assay | Bio-Rad Laboratoris GmbH | 500-0116 | |
| Glycerol | AppliChem GmbH | 151339 | |
| SDS Ultrapure | AppliChem GmbH | A1112 | |
| Bromophenol blue | AppliChem GmbH | A2331 | |
| β-Mercaptoethanol | AppliChem GmbH | A4338 | |
| Blasticidin | Invivogen | ant-bl-1 | |
| Potassium Chloride | AppliChem GmbH | A1039 | |
| Phenylmethanesulfonyl Fluoride | AppliChem GmbH | A0999 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich Chemie GmbH | 221309 | |
| Dipotassium Hydrogenphosphate | Sigma-Aldrich Chemie GmbH | P3786 | |
| DTT | AppliChem GmbH | A2948 | |
| NP-40 | AppliChem | A1694 | |
| TWEEN 20 | AppliChem | A4974 | |
| Nonfat dried milk powder | AppliChem | A0830 | |
| Anti-ADFP/ ADRP | abcam | ab52355 | |
| M6PRB1/TIP47 100 µg | abcam | ab47639 | |
| Calreticulin, pAb 200 µg | Enzo Life Science GmbH | ADI-SPA-600-F | |
| Anti-β-Tubulin | Sigma-Aldrich Chemie GmbH | T6074 200µl | |
| Ethanol absolute (EtOH) | Geyer Th. GmbH & Co.KG | A3678,0250 | |
| Anti-MnSOD | Enzo Life Science GmbH | ADI-SOD-110-F | |
| Anti-mouse HRP | Thermo Fisher Pierce | 32430 | |
| Anti-rabbit HRP | Thermo Fisher Pierce | 32460 | |
| Amersham Hyperfilm ECL | GE Healthcare | 28906836 | |
| Lumi-Light Western Blotting Substrate | Sigma-Aldrich Chemie GmbH | 12015196001 | |
| 96-Well Cell Culture Plate | Greiner Bio-One GmbH | 655 180 | |
| Terumo Syringe 1 mL | Terumo | SS-01T | |
| Filtropur BT 50, 500 mL, 0.45 µm | SARSTEDT | 83.1823.100 | |
| Mini-PROTEAN TGX Precast Gels, Any kD resolving gel | Bio-Rad Laboratoris GmbH | 456-9034 | |
| 6-Well Cell Culture Plate | Greiner Bio-One GmbH | 657160 | |
| Dishes Nunclon 150/20 | Fisher Scientific GmbH | 10098720 - 168381 | |
| Cell Scraper | neoLab Migge GmbH | C-8120 | |
| Tube, 50 mL | Greiner Bio-One GmbH | 227261 | |
| SafeSeal Tube RNase-free | SARSTEDT | 72.706.400 | |
| Ultra Clear Centrifuge Tubes 11 x 60 mm | Beckman Coulter GmbH | 344062 | |
| Suction Needles | Transcodent | 6482 | |
| Biosphere Fil. Tip 1000 | SARSTEDT | 70.762.211 | |
| Biosphere Fil. Tip 200 | SARSTEDT | 70.760.211 | |
| Biosphere Fil. Tip 10 | SARSTEDT | 70.1130.210 | |
| Dounce Tissue Grinder | Fisher Scientific GmbH | 11883722 | |
| Pestles For Dounce All-Glass Tissue Grinders | Fisher Scientific GmbH | 10389444 | |
| Orbitrap Fusion | |||
| Branson Sonifier 450 | |||
| Thermomixer comfort, with Thermoblock 1.5 mL | Eppendorf | 5355 000.127 | |
| Mini-PROTEAN Tetra Cell, Mini Trans-Blot Module, and PowerPac Basic Power Supply, | BioRad | 165-8033 | |
| Mini-PROTEAN 3 Multi-Casting Chamber | BioRad | 165-4110 | |
| PowerPac HC Power Supply | Biorad | 164-5052 | |
| Centrifuge | Eppendorf | 5424R | |
| Centrifuge | Eppendorf | 5424 | |
| Optima L-90K | Beckman Coulter GmbH | 365670 | |
| SW 60 Ti Rotor | Beckman Coulter GmbH | 335649 | |
| Infinite M1000 PRO | Tecan |
Referanslar
- Thiam, A. R., Farese, R. V. Jr, Walther, T. C. The biophysics and cell biology of lipid droplets. Nat Rev Mol Cell Biol. 14 (12), 775-786 (2013).
- Welte, M. A. Expanding roles for lipid droplets. Curr Biol. 25 (11), R470-R481 (2015).
- Brasaemle, D. L. Thematic review series: adipocyte biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis. J Lipid Res. 48 (12), 2547-2559 (2007).
- Choudhary, V., Ojha, N., Golden, A., Prinz, W. A. A conserved family of proteins facilitates nascent lipid droplet budding from the ER. J Cell Biol. 211 (2), 261-271 (2015).
- Kory, N., Farese, R. V. Jr, Walther, T. C. Targeting Fat: Mechanisms of Protein Localization to Lipid Droplets. Trends Cell Biol. 26 (7), 535-546 (2016).
- Hashemi, H. F., Goodman, J. M. The life cycle of lipid droplets. Curr Opin Cell Biol. 33, 119-124 (2015).
- Gao, Q., Goodman, J. M. The lipid droplet-a well-connected organelle. Front Cell Dev Biol. 3, 49(2015).
- Herker, E., Ott, M. Emerging role of lipid droplets in host/pathogen interactions. J Biol Chem. 287 (4), 2280-2287 (2012).
- Wedemeyer, H., Dore, G. J., Ward, J. W. Estimates on HCV disease burden worldwide - filling the gaps. J Viral Hepat. 22 Suppl 1, 1-5 (2015).
- Paul, D., Madan, V., Bartenschlager, R. Hepatitis C virus RNA replication and assembly: living on the fat of the land. Cell Host Microbe. 16 (5), 569-579 (2014).
- Lindenbach, B. D., Rice, C. M. The ins and outs of hepatitis C virus entry and assembly. Nat Rev Microbiol. 11 (10), 688-700 (2013).
- Barba, G., et al. Hepatitis C virus core protein shows a cytoplasmic localization and associates to cellular lipid storage droplets. Proc Natl Acad Sci U S A. 94 (4), 1200-1205 (1997).
- Shi, S. T., et al. Hepatitis C virus NS5A colocalizes with the core protein on lipid droplets and interacts with apolipoproteins. Virology. 292 (2), 198-210 (2002).
- Herker, E., et al. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat Med. 16 (11), 1295-1298 (2010).
- Camus, G., et al. Diacylglycerol acyltransferase-1 localizes hepatitis C virus NS5A protein to lipid droplets and enhances NS5A interaction with the viral capsid core. J Biol Chem. 288 (14), 9915-9923 (2013).
- Miyanari, Y., et al. The lipid droplet is an important organelle for hepatitis C virus production. Nat Cell Biol. 9 (9), 1089-1097 (2007).
- Boulant, S., Targett-Adams, P., McLauchlan, J. Disrupting the association of hepatitis C virus core protein with lipid droplets correlates with a loss in production of infectious virus. J Gen Virol. 88 (Pt 8), 2204-2213 (2007).
- Vogt, D. A., et al. Lipid droplet-binding protein TIP47 regulates hepatitis C Virus RNA replication through interaction with the viral NS5A protein. PLoS Pathog. 9 (4), e1003302(2013).
- Ploen, D., et al. TIP47 plays a crucial role in the life cycle of hepatitis C virus. J Hepatol. 58 (6), 1081-1088 (2013).
- Ploen, D., et al. TIP47 is associated with the hepatitis C virus and its interaction with Rab9 is required for release of viral particles. Eur J Cell Biol. 92 (12), 374-382 (2013).
- Rosch, K., et al. Quantitative Lipid Droplet Proteome Analysis Identifies Annexin A3 as a Cofactor for HCV Particle Production. Cell Rep. 16 (12), 3219-3231 (2016).
- Kwiatkowski, M., et al. Ultrafast extraction of proteins from tissues using desorption by impulsive vibrational excitation. Angew Chem Int Ed Engl. 54 (1), 285-288 (2015).
- Webster, B., Ott, M., Greene, W. C. Evasion of superinfection exclusion and elimination of primary viral RNA by an adapted strain of hepatitis C virus. J Virol. 87 (24), 13354-13369 (2013).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nat Protoc. 1 (6), 2856-2860 (2006).
- Ting, L., et al. Normalization and statistical analysis of quantitative proteomics data generated by metabolic labeling. Mol Cell Proteomics. 8 (10), 2227-2242 (2009).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J Biol Chem. 279 (45), 46835-46842 (2004).
- Tingting, P., Caiyun, F., Zhigang, Y., Pengyuan, Y., Zhenghong, Y. Subproteomic analysis of the cellular proteins associated with the 3' untranslated region of the hepatitis C virus genome in human liver cells. Biochem Biophys Res Commun. 347 (3), 683-691 (2006).
- Ariumi, Y., et al. DDX3 DEAD-box RNA helicase is required for hepatitis C virus RNA replication. J Virol. 81 (24), 13922-13926 (2007).
- Weinlich, S., et al. IGF2BP1 enhances HCV IRES-mediated translation initiation via the 3'UTR. RNA. 15 (8), 1528-1542 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır