Method Article
Lipid Droplet Isolierung für die quantitative Massenspektrometrie-Analyse
In diesem Artikel
Zusammenfassung
Lipidtröpfchen sind wichtige Organellen für die Replikation von mehreren Erregern, einschließlich der Hepatitis C-Virus (HCV). Wir beschreiben ein Verfahren für die quantitative Lipidtröpfchen-Massenspektrometrie assoziierter Proteine zu isolieren; es kann unter einer Vielzahl von Bedingungen, wie zum Beispiel Virusinfektion, Umweltstress, oder medikamentöse Behandlung verwendet werden.
Zusammenfassung
Lipidtröpfchen sind entscheidend für die Replikation von einer Vielzahl von verschiedenen Krankheitserregern, am deutlichsten der Hepatitis-C-Virus (HCV), als die mutmaßliche Stelle Virionmorphogenese. Quantitative Lipidtropfen Proteomanalyse kann verwendet werden, um Proteine zu identifizieren, zu lokalisieren oder von Lipidtröpfchen unter Bedingungen, wie Virusinfektionen verdrängt. Hier beschreiben wir ein Protokoll, das mit HCV erfolgreich eingesetzt, um die Änderungen in den Lipidtröpfchen Proteom zu charakterisieren nach der Infektion wurde. Wir verwenden Markierung mit stabilen Isotopen mit Aminosäuren in Zellkultur (SILAC) und damit die vollständige Proteom einer Population von Zellen, die mit „schweren“ Aminosäuren bezeichnen, die die Proteine durch Massenspektrometrie quantitativ zu bestimmen. Für Lipidtröpfchen Isolation, die beiden Zellpopulationen (dh HCV-infizierten / „Licht“ Aminosäuren und nicht infizierten Kontroll / „schwere“ Aminosäuren) sind 1: 1 gemischt und mechanisch in hypotonischen Puffer lysiert. Nachdem die Kerne und Zell d Entfernenebris durch Zentrifugation bei niedriger Geschwindigkeit, Lipidtröpfchen-assoziierte Proteine werden durch zwei aufeinanderfolgende Schritte Ultrazentrifugation durch drei Waschschritte in isotonischem Puffer angereichert folgte. Die Reinheit der Fraktionen wird Lipidtröpfchen durch Western-Blotting mit Antikörpern, die unterschiedlichen subzellulären Kompartimenten analysiert. Lipidtropfen-assoziierte Proteine werden dann durch SDS-Polyacrylamid-Gelelektrophorese (SDS-PAGE), gefolgt von Coomassie-Färbung aufgetrennt. Nach tryptischen Verdaus werden die Peptide durch Flüssigchromatographie-Elektrospray-Ionisations-Tandem-Massenspektrometrie (LC-ESI-MS / MS) quantifiziert. Mit dieser Methode identifizierten wir Proteine rekrutiert Lipidtröpfchen auf HCV-Infektion, die pro- oder antivirale Wirtsfaktoren darstellen könnten. Unsere Methode kann mit Krankheitserregern, Umweltstress, oder medikamentöser Behandlung zu einer Vielzahl von verschiedenen Zellen und Kulturbedingungen, wie Infektionen angewandt werden.
Einleitung
Lipidtröpfchen sind sehr dynamisch cytoplasmatischen (und nuklear) Zellorganellen , bestehend aus einem Kern aus neutralen Lipiden (Triglyceriden (TG) und Cholesterinester (CE)) durch eine Monoschicht von Phospholipiden mit eingebetteten Proteinen 1 umschlossen. Alle Zelltypen produzieren Lipidtröpfchen, aber sie unterscheiden sich in Größe, Lipidzusammensetzung und Protein Dekoration. Lipidtröpfchen erfüllen verschiedene Funktionen, unter anderem als Energie und Membranvorläufer Reservoire oder als Proteinablagerungen. Darüber hinaus wird durch die Aufnahme von Lipiden, schützen sie Zellen vor Lipotoxizität, Trenn Lipide als Signalmoleküle, und sind in den Proteinabbau und endoplasmatischen Retikulum (ER) 2 Stressantworten beteiligt. Als solche bindet eine Vielzahl von Proteinen an Lipidtröpfchen und regelt ihre Generation, Abbau, handelt, und die Interaktion mit anderen Organellen. Unter ihnen sind die perilipin Familie von bona fide Lipidtröpfchen bindende Proteine (PLIN1-5)f "> 3.
Lipidtropfen Biogenese beginnt wahrscheinlich am IHN, in dem ER-resident Enzyme die Synthese von Neutrallipiden katalysieren , die innerhalb der Membran - Doppelschicht ansammeln, eine Linse aus neutralen Lipiden gebildet wird , ein Verfahren , das in letzter Zeit in Hefe gut 4 sichtbar gemacht wurde. Membran Biegen und erhöhter Phosphatidsäure und Diacylglycerin Ebenen werden dann gedacht Proteine in Phospholipid - Biosynthese, wie die gleichzeitige Synthese der Kern neutralen Lipiden und Phospholipiden die Abschirmung für Lipidtröpfchenerzeugung 5 erforderlich beteiligt zu gewinnen. Enzyme beherbergen Transmembran- Domänen, die an der ER residieren katalysieren diesen Prozess. Expansion zu großen Lipidtröpfchen erfordert die Aktivität einer anderen Klasse von Lipid-synthetisierende Enzyme, die eine amphipathische Helix Hafen und kann somit aus dem ER zum Lipidtröpfchen reisen. Die Mobilisierung von Lipiden aus Lipidtröpfchen erfolgt durch die lokale Aktivierung des Triglyceride und Diacylglycerin Lipasen adipose Triglycerid - Lipase (ATGL) und hormonsensitive Lipase (HSL) , oder durch verschiedene Wege autophagischen wie Makro- und microlipophagy oder Chaperon-vermittelte autophagy 6. Lipidtröpfchen der Interaktion mit anderen Zellorganellen, wie Mitochondrien (zur beta-Oxidation und Lipid - Synthese) und ER (für die Lipid - Synthese und Proteintransport), sondern auch mit Lysosomen, Endosomen und den durch intrazelluläre Bakterien 7 induzierten Vakuolen. Tatsächlich Bakterien, Viren, Parasiten und sogar Ziellipidtröpfchen für die Replikation und Persistenz, darunter HCV 8.
HCV - Infektion ist eine der führenden Ursachen für Leberbedingte Morbidität und Mortalität weltweit, 9 für etwa 0,5 Millionen Todesfälle pro Jahr ausmacht. Die tatsächliche Zahl der HCV-Infektionen ist nicht bekannt, aber die jüngsten Schätzungen deuten darauf hin, dass 130-150000000 Menschen chronisch infiziert sind. kein vaccine existiert, aber die kürzlich genehmigten direkt wirkenden antiviralen Medikamente therapeutische Reaktionen drastisch erhöhen im Vergleich zur Standard-Interferon-basierten Therapie. Doch weltweit wird wahrscheinlich die Behandlung von Patienten beschränkt werden aufgrund der extrem hohen Kosten der neuen Therapeutika. Etwa die Hälfte aller Menschen chronisch mit HCV entwickeln Fettlebererkrankung (Steatose) infiziert sind, eine durch die übermäßige Ansammlung von Fetttröpfchen in Hepatozyten gekennzeichnet ist. Intriguingly, Lipidtröpfchen entstanden auch als vital Zellorganellen für die HCV - Replikation, mutmaßlich viral als Montagestellen dienenden 10, 11.
In HCV-infizierten Zellen, der virale Proteinkern und NS5A lokalisieren zu Lipidtröpfchen in einem Prozess, der auf Triglycerid - Biosynthese - 12, als Inhibitoren der Diacylglycerol - Acyltransferase-1 (DGAT1) beeinträchtigt Handel Lipidtröpfchen und nachfolgenden HCV Partikelproduktion hängt >, 13, 14, 15. Darüber hinaus können Mutationen in den Lipidtröpfchen-Bindungsdomänen von entweder Kern oder NS5A unterdrücken HCV - Anordnung 16, 17 auf . Kern und NS5A dann alle anderen viralen Proteine rekrutieren, sowie virale RNA - Replikationskomplexe zu Membranen eng mit Lipid assoziierten Tröpfchen 16. Eine konzertierte Aktion aller viralen Proteine ist für die erfolgreiche Produktion von infektiösen Virusnachkommen 10, 11 erforderlich. Die Strukturproteine sind Teil der Virionen und die nicht-strukturellen Proteine fördern, um die Protein-Protein-Wechselwirkungen für dieses Verfahren erforderlich. Erstaunlicherweise wird die bona fide Lipidtröpfchen-bindendes Protein PLIN3 / TIP47 sowohl für HCV - RNA - Replikation erforderlich ist und die Freisetzung von Virionen 18, 19 20. Trotz dieser jüngsten Fortschritte, die mechanistischen Details, vor allem von Virus-Wirt-Interaktionen während der späten Stadien der HCV-Replikation, bleiben schlecht definiert, und die genaue Funktion der Lipidtröpfchen ist nicht bekannt.
Hier beschreiben wir ein Verfahren Lipidtröpfchen für die quantitative Massenspektrometrie assoziierter Proteine zu isolieren. Mit dieser Methode fanden wir grundlegende Veränderungen in den Lipidtröpfchen Proteom während eines HCV - Infektion und identifiziert Annexin A3 als Wirt Protein , das mit Lipidtröpfchen zusammen fraktioniert und ist für eine effiziente HCV Reifung 21 erforderlich.
Protokoll
1. Herstellung von Medien für die Markierung mit stabilen Isotopen mit Aminosäuren in Zellkultur (SILAC)
HINWEIS: Hier wird das SILAC Protein Quantifizierungs Kit - DMEM , das mit 50 mg 13 C 6 L-Arginin-HCl wurde für SILAC Kennzeichnung verwendet. Die dialysierte Fetale Kälberserum (FCS) mit den SILAC Protein Quantifizierungs Kit zur Verfügung gestellt.
- Entfernen Sie 50 ml aus jeder Flasche DMEM-Medium und 50 ml dialysiertes FCS.
- Man löst 50 mg 13 C 6 L-Lysine-2HCl und 50 mg 13 C 6 L-Arginin-HCl in 1 ml Medium. Gründlich mischen und fügen Sie die Aminosäuren an das DMEM + FCS-Medium.
- In 1x Pen / Strep und 1x L-Glutamin Ersatz. Sterile Filter das Medium einen 0,45 um-Filter. Beschriften Sie die Flasche als „schwer“ SILAC Medium.
- Um das "light" Medium herzustellen, wiederholen Sie die Schritte von 1,1 bis 1,3 unter Verwendung von 50 mg L-Arginin-HCl und 50 mg L-Lysine-2HCl. Beschriften Sie die Flasche als "light“SILAC Medium.
2. SILAC-Kennzeichnung und Aminosäure-Incorporation Kontrolle
- Trypsinize Zellen (1x Trypsin-EDTA) und Split 1 x 10 5 Zellen in 2 Huh7.5 Wells einer 6-Well - Kulturplatte , die 2 ml Medium, einem gut mit dem "schweren" SILAC Medium und eine mit dem "Licht" SILAC Medium.
- Kultur die Zellen für mindestens 6 Passagen (Split-Verhältnis: 1: 6); nach 6 Durchgängen sollte die Einarbeitung der „schweren“ Aminosäuren mehr als 95% betragen.
- Ernte 1 x 10 6 Zellen der „schweren“ - und „Licht“ -markierten Zellpopulation der Inkorporation Wirksamkeit zu analysieren. die Zellen in 1x PBS waschen und die Zellen durch Zentrifugation für 5 min bei 160 × g und 4 ° C pelletieren.
- für 30 min Resuspendieren der Zellpellets in 150 & mgr; l MS-Puffer (150 mM NaCl, 50 mM Tris-HCl pH 7,4 und 1 mM EDTA 1x-Protease-Inhibitor-Cocktail, ergänzt mit) und den Zellen auf Eis inkubieren. Lyse der cells durch Beschallung bei 4 ° C.
HINWEIS: Im Folgenden werden die Beschallungs Einstellungen verwendet hier: Timer, halten; Ausgabesteuerung, 8; Tastgrad, 80%; und 2 x 30 Impulse. - Entfernen der Zelldebris durch Zentrifugation für 10 min bei 11.000 xg und 4 ° C. Den Überstand in ein neues Röhrchen und bestimmen, um die Proteinkonzentration mit einem Detergens-kompatiblen Protein-Assay.
- Mischen Sie 75 & mgr; g Protein mit 6x-Probenpuffer (375 mM Tris-HCl, pH 6,8, 25,8% Glycerin, 123 mg / ml SDS, 600 ug / ml Bromphenolblau und 60 & mgr; l / ml β-Mercaptoethanol), Kochen bei 95 ° C für 5 min, und die Trennung der Proteine durch SDS-PAGE in SDS-Laufpuffer (3,02 g / l Tris-Base, 18,8 g / l Glycin und 1 g / l SDS) bei 180 V für etwa 1 h oder nach Herstellern 'Anweisungen.
- Übertragen Sie das Gel in kolloidalen Coomassiefärbung Lösung. Auszuschneiden die gleiche Proteinbande von jeder Spur. Verdauen der Proteine mit Trypsin und analysieren, um die Inkorporation Wirksamkeit von MS analysis, wie beschrieben 22.
3. Lipid Droplet Isolierung von SILAC-markierten Zellen Huh7.5
- Infizieren eine Population von Zellen (dh jene mit "Licht" Aminosäuren markiert) mit einem HCV - Reporter Virus durch mit Virusstock Inkubieren (zB Jc1 NS5AB-mKO2-BSD, MOI 1) für 4 h bei 37 ° C, wie in 21 beschrieben , .
HINWEIS: Jc1 NS5AB-mKO2-BSD ist ein HCV - Virus einen Fluoreszenz - Reporters (monomer Kusabira Orange 2, mKO2) tragenden Infektionsraten durch eine Blasticidin - Resistenzgen (BSD) zwischen einer duplizierten NS5A-NS5B - Spaltungsstelle, zuvor beschriebenen 21, gefolgt zu überwachen 23. Die Arbeit mit HCV erfordert BSL2 + (USA) oder S3 ** (Deutschland) Biosicherheit Ebene Haltung und Praktiken. Statt einer Infektion mit HCV, können Zellen mit verschiedenen Krankheitserregern infiziert werden. - Erweitern HCV-infizierten „Licht“ Zellen und nicht infizierten & #34;. Heavy“Zellen während der Passagierung der Kulturen, fixieren ein Aliquot mit 4% Paraformaldehyd (PFA) in PBS und die HCV - Infektionsraten durch Durchflusszytometrie des fluoreszierenden Markerproteins (zB mKO2) bestimmen, wie in 21 beschrieben, der Infektionsraten sollte höher als 90% sein , für die Lipidtröpfchen Isolierung . Hinweis: der Jc1 NS5AB-mKO2 BSD-HCV - Stamm Bei der Verwendung, mit 10 & mgr; g / ml Blasticidin S auf die „light“ Medium für HCV-positive Zellen zu selektieren.
- 1 d vor der Lipidtröpfchen Isolierung, Waschen der Zellen mit PBS, Trypsinisieren, Resuspendieren in „Licht“ und „schweren“ mittel und zählten die Zellen eines Neubauer-Zählkammer verwenden. Seed 7 x 10 6 Zellen jeder Population in einer 150 cm 2 Zellkulturschale. Bereiten Sie mindestens 5 Gerichte pro „Licht“ und „schwere“ Zellpopulation. Kultur, um die Zellen in 30 ml Medium / Schale O / N.
- Entfernen Sie das Medium und die Zellen werden in 1x PBS. Lösen Sie die Zellen in 1xPBS mit einem Zellschaber.
- Zählen beiden Zellpopulationen unter Verwendung eines Neubauer-Zählkammer und Pool gleiche Zellzahlen in einem 50 ml-Zentrifugenröhrchen. Pelletieren Sie die Zellen durch Zentrifugation für 5 min bei 160 × g und 4 ° C.
- Entfernen Sie die PBS und Resuspendieren des Zellpellets in 1 ml Saccharosepuffer (0,25 M Saccharose, 1 mM EDTA und 1 mM DTT, mit Protease-Inhibitor-Cocktail ergänzt). Übertragen Sie die Zellsuspension auf eine eng anliegende Dounce Homogenisator und Lyse der Zellen mit 200 Hüben auf Eis.
HINWEIS: Überprüfen Sie vollständige Zelllyse unter Verwendung von Trypanblau-Färbung. - Übertragen des Lysats in ein 1,5 ml Mikrozentrifugenröhrchen und drehen, um die Zellkerne und Zelltrümmer 10 Minuten bei 1000 xg und 4 ° C.
- Nach der Zentrifugation speichert eine Aliquot von 25 & mgr; l der post-nukleären Fraktion (PNS) bei -20 ° C als Eingabesteuerung.
- Platzieren Sie den Rest der PNS Fraktion am Boden des Zentrifugenröhrchens (11 x 60 mm) und Überlagerung mit Lipidtröpfchen Waschpuffern (~ 3 ml, 4 ml gesal) (50 mM Kaliumphosphatpuffer pH 7,4, 100 mM Kaliumchlorid, 1 mM EDTA und 1 mM Phenylmethansulfonylfluorid).
- Zentrifuge für 2 h bei 100.000 xg und 4 ° C. Ernte der schwimmenden Lipidtröpfchen Fraktion unter Verwendung eines gebogenen, stumpfe Kanüle von der Spitze des Rohres (etwa 250 bis 500 & mgr; l, abhängig von der Menge an Lipidtröpfchen). Platzieren Sie die Lipidtröpfchen Fraktion in ein Zentrifugenröhrchen (11 x 60 mm), Überlagerung mit Lipidtröpfchen Waschpuffer (~ 3,5 ml; 4 ml insgesamt), und wiederholen Sie den Zentrifugationsschritt.
- Ernte der schwimmenden Lipidtröpfchen Fraktion unter Verwendung eines gebogenen, stumpfen Kanüle von der Spitze des Rohrs und übertragen die Lipidtröpfchen in ein neues 1,5 ml-Mikrozentrifugenröhrchen. Fügen 500 ul Waschpuffer Lipidtröpfchen und Schleuder für 20 min bei 21.000 × g und 4 ° C.
HINWEIS: Lipidtröpfchen als weiße Band erscheinen schwimmend auf der Oberseite des Puffers. - Entfernen der darunterliegenden Waschpuffer eine Gel-Beladungs-Pipettenspitze und wiederhole diesen Waschschritt drei Mal.
- Nach dem endgültigen Entfernen des Waschpuffers einer Gel-Beladungs-Pipettenspitze verwendet wird, mischten 5 ul Lipidtröpfchen Fraktionen mit 10 & mgr; l NP-40-Lysepuffer (50 mM Tris-HCl pH 7,4, 150 mM NaCl und 1% NP-40 mit Protease-Inhibitor-Cocktail ergänzt). Inkubieren Sie die Probe auf Eis für 1 h zur Inaktivierung des Virus, wenn sie mit infektiösem Material arbeiten. Bestimmen der Proteinebene mit einem Detergens-kompatiblen Protein-Assay; mindestens 35 & mgr; g Protein ist für die MS-Analyse benötigt.
- Lagern Sie die Lipidtröpfchen Fraktionen bei -20 ° C.
- Mischen Sie die entsprechenden Volumen der Lipidtröpfchen Fraktion mit 4x Ladefarbstoff. Inkubieren auf Eis für 1 h zur Inaktivierung des Virus, wenn sie mit infektiösem Material arbeiten. Siedet bei 95 ° C für 5 min.
- Trennt die Proteine SDS-PAGE nach dem Herstellerprotokoll verwendet. Übertragen Sie das Gel in kolloidalen Coomassiefärbung Lösung. Auszuschneiden alle Proteinbanden aus dem Gel. Nach tryptischen In-Gel - Verdauung 24 </ Sup>, um die Proben verdampfen und sie in 0,1% Ameisensäure auflösen. Analyse mittels LC-MS / MS.
HINWEIS: Hier LC-MS / MS wurde auf einem Quadrupol-Time-of-Flight-Massenspektrometer (Q-TOF) oder auf einer Linear-Trap-Quadrupol (LTQ) Orbitrap-Massenspektrometer analysiert. Beide Instrumente wurden mit einer ESI-Quelle zu einem Nano UPLC System gekoppelt. Datenanalysen und LC-MS / MS - Analysen auf dem Q-TOF und den Orbitrap - Massenspektrometer durchgeführt wurden , wie in 21 beschrieben, 22. Achten Sie unbedingt auf die Probe nicht mit menschlicher Keratin zu verunreinigen. Verwenden Sie immer Keratin freie Pipettenspitzen und Rohren. Bereiten Puffer unter laminaren Strömungshaube mit Keratin freien Chemikalien. Vor dem Gebrauch reinigen alle Oberflächen und Geräte mit destilliertem Wasser und Ethanol. Tragen Sie immer Handschuhe und einen Laborkittel.
4. Analyse der Lipid-Tröpfchen Reinheit
- Verdünnte Aliquots von Lipidtröpfchen Fraktionen 1: 2 und Eingang Fraktionen (siehe Schritt 3.9) im Verhältnis 1:10 mit NP-40 lysPuffer ist. Inkubieren Sie die Proben auf Eis für 1 h zur Inaktivierung des Virus, wenn sie mit infektiösem Material arbeiten. Bestimmen der Proteinebene mit einem Detergens-kompatiblen Protein-Assay.
- Mix gleiche Mengen an Protein mit 6x-Probenpuffer und inkubiere die Proben auf Eis für 1 h, das Virus zu inaktivieren, wenn mit infektiösem Material zu arbeiten. Weiter mit SDS-PAGE und Transfer der Proteine auf eine Nitrocellulosemembran durch Blotting Tank bei 80 V für 90 min.
Anmerkung: Nachdem die Membran blockiert in Blockierungspuffer (5% Nicht - Fett - Trockenmilchpulver in TBS-T (10 mM Tris-HCl pH 7,6, 150 mM NaCl, und 0,05% Tween20)), inkubieren mit gegen Lipid Antikörper Tröpfchens Marker (zB , PLIN1, PLIN2 oder PLIN3) und Marker von anderen subzellulären Kompartimenten (zB CALR, MnSOD oder Tubulin), gefolgt von HRP-gekoppelten sekundären Antikörper verfolgt wird . Verwenden Chemilumineszenz zum Nachweis von Proteinen.
Ergebnisse
Lipidtröpfchen sind entscheidend für eine HCV-Infektion als die mutmaßlichen Stellen von Virionen, aber die molekularen Mechanismen der Morphogenese und Austritt von Virionen sind weitgehend unbekannt. Neue Host - Abhängigkeitsfaktoren in diesem Prozess beteiligt zu identifizieren, führten wir quantitative Lipidtröpfchen Proteomanalyse von HCV-infizierten Zellen 21 (Abbildung 1A). Wir haben ein Protokoll für die Lipidtröpfchen Reinigung und routinemäßig eine starke Anreicherung der Lipidtröpfchen-bindenden Proteine PLIN2 / ADRP und PLIN3 / TIP47 und eine Verarmung von Markern von anderen zellulären Kompartimenten, wie beispielsweise β-Tubulin für Mikrotubuli, MnSOD für Mitochondrien detektiert, oder Calreticulin / Calnexin für die ER (1B, C). Wir kompilierte eine Liste von Proteinen , die zuverlässig mit Lipidtröpfchen in cofractionate Huh7.5 Zellen (1D) und Isotopenmarkierung verwendet wird , die spezifisch identifizierten Proteine rekrutierenoder HCV-infizierte Zellen (1E) versetzt von Lipidtröpfchen in. Unsere Ergebnisse zeigen, dass HCV Lipidtröpfchen aus ihrer regulären Stoffwechsel-Funktion trennt und / oder Regelung und mutmaßliche Host-Abhängigkeits und Restriktionsfaktoren identifizieren.
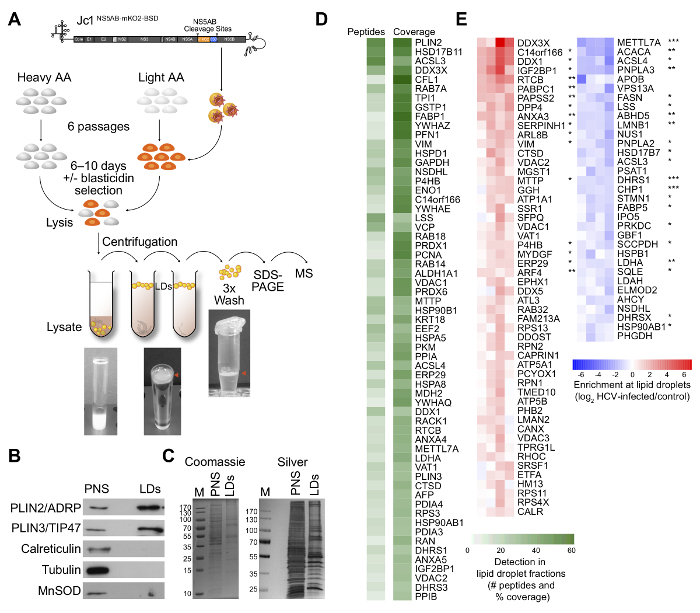
Abbildung 1: (A) Schema des Experiments. Huh7.5 naive Zellen wurden mit „schweren“ Aminosäuren oder „Licht“ Aminosäuren markiert. Zellen "Licht" Aminosäuren tragen , wurden mit einem HCV - Reporter - Virus (Jc1 NS5AB-mKO2-BSD) infiziert. „Licht“ und „schwere“ Aminosäure-markierten Populationen wurden gemischt und Lipidtröpfchen wurden durch zwei anschließende Ultrazentrifugation und drei Waschschritte, getrennt durch SDS-PAGE, und analysiert durch LC-ESI-MS / MS isoliert. Man beachte die schwimmende weiße Lipidtröpfchenfraktion (roter Pfeil) nach ultracentrifugati auf und Waschen in Mikrozentrifugenröhrchen. (B) Western - Blot - Analyse von post-nuklearen und Lipidtröpfchen Fraktionen zeigt eine Anreicherung von Lipidtröpfchen Markerproteinen in Lipidtröpfchen Fraktionen und eine Verarmungs von Markern von anderen zellulären Kompartimenten. (C) Coomassie Blau und Silber - Färbung von post-nuklearem Überstand (PNS) und Lipidtröpfchen Fraktionen aufgetrennt durch SDS-PAGE. Die Silberfärbung ist nur für die Visualisierung vorgestellt. (D) Bewegungsradius der Anzahl von Peptiden und dem Prozentsatz des Protein Abdeckung von Proteinen in Lipidtröpfchen Fraktionen Huh7.5 Zellen identifiziert (Cutoff: ≥5 Peptide und ≥20% Abdeckung). (E) Heatmap angereicherter darstellend oder abgereichertes Lipidtröpfchen-assoziierte Proteine nach Infektion mit HCV (dem Median normalisiert, 1,5-fach Abschneide, * p <0,05, ** p <0,01 *** p <0,001). Geändert von 21.et = „_ blank“> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Hier beschreiben wir ein Protokoll Lipidtröpfchen für quantitative Lipidtröpfchen Proteomanalyse zu isolieren, die An- und Abreicherung von Proteinen mit Lipidtröpfchen unter verschiedenen Kulturbedingungen, wie virale Infektionen zu vergleichen. bezogen auf das Gesamtspitzenintensitäten Als alternatives Verfahren kann die Proteomanalyse mit markierungsfreien Quantifizierungen durchgeführt werden. Dieses Verfahren hat keine dynamische Bereichsbegrenzung und vermeidet metabolische Probleme. Der Vorteil des SILAC Ansatzes ist, dass die Proben vor Lipidtröpfchen Isolierung gepoolt werden, und daher sind die Ergebnisse sind unabhängig von Fehlern bei der Probenvorbereitung, verdauen und LC-MS / MS-Analyse. Wir empfehlen, diesen Ansatz sehr für quantitative Lipidtröpfchen Proteomanalyse.
Da die Anreicherung oder Verarmung der Lipid-Tröpfchen-assoziierten Proteine in der MS-Analyse beobachtet, konnte eine Induktion oder Repression der Proteinexpression, die Analyse der Expressionsniveaus von quantitativ widerspiegelne RT-PCR und (vorzugsweise) Western-Blot wird empfohlen. Darüber hinaus können zwei Verfahren verwendet werden , um die Anreicherung oder Abreicherung von spezifischen Proteinen in Lipidtröpfchen zu überprüfen: Lipidtröpfchen Isolierung durch Western - Blotting und Immunfluoreszenz - Analyse mit lipophilen Farbstoffen, wie BODIPY oder LD540, das Fleckenlipidtröpfchen 21 , wie beschrieben , gefolgt.
Führen Sie Experimente mit Markierungsbedingungen ausgetauscht, um sicherzustellen, dass die Kennzeichnung mit „schweren“ Aminosäuren, die nicht der Proteinexpression oder Lipidtröpfchen Lokalisation beeinflusst und Proteinverunreinigungen aus der „Licht“ mittel und Umweltquellen zu identifizieren. Zur Proteinidentifizierung, soll die Suche mit einer falschen Entdeckungsrate (FDR) von 0,01 sowohl auf den Peptid und Proteinebene durchgeführt werden. Um ein hohes Vertrauen Ergebnisse zu gewährleisten, empfehlen wir die Durchführung mindestens 3 bis 4 unabhängige Experimente mit Zellen aus verschiedenen Passagen und verschiedenen Virusstammpräparaten. Je nach magnitude des Wandels, könnte mehr unabhängige Experimente erforderlich.
Zur quantitativen MS-Daten Normalisieren für leicht unterschiedliche Zellzahlen oder Lipidtröpfchen, zentrieren die Erkennungsverhältnisse des „Licht“ in den „schweren“ Peptide, oder umgekehrt, vertauscht Markierungsbedingungen zu korrigieren, indem durch den Median aller identifizierten Proteine Dividieren wie beschrieben 25. Wenn die Menge an Lipidtröpfchen signifikant zwischen den Proben unterscheidet, Normalisieren auf Lipidtropfen Markerproteine, wie PLIN2 könnte ratsam sein. Wenn wir unsere MS-Daten zu PLIN2 Ebenen normalisieren, so finden wir ähnliche Ergebnisse wie wenn wir auf die mittlere normalisieren (Analyse nicht gezeigt). Bemerkenswert ist, wir unter Zellkulturbedingungen verwenden, nicht erkennen wir nicht signifikante Lipidtröpfchen Akkumulation bei HCV-Infektion.
Lipidtröpfchen sind in engen Kontakt mit anderen Zellorganellen, insbesondere Mitochondrien und ER. Daher Proteine fROM Diese Kompartimente können mit Lipidtröpfchen während der Isolierung zusammen fraktionieren. Wenn eine solche „Verunreinigung“ Protein in Hülle und Fülle in Reaktion auf eine Infektion oder Behandlung unverändert ist, wird es nicht die vergleichende Lipidtröpfchen Proteomanalyse beeinflussen. Es muss darauf hingewiesen werden, jedoch, dass unter bestimmten Umständen der Kontakt zwischen Lipidtröpfchen und anderen Organellen könnte geändert werden. Beispielsweise unter lipolytische Bedingungen werden mitochondriale Proteine bei höheren Frequenzen in Lipidtröpfchen Fraktionen aus lipolytisch stimulierte 3T3-L1 Adipozyten Vergleich zu Basalbedingungen 26 detektiert. Angeregt de novo Lipogenese, auf der anderen Seite könnte mit dem ER zu einer verstärkten Assoziation führen. Diese Änderungen spiegeln Änderungen dann in Organell Wechselwirkung durch die verschiedenen Stimuli induziert und interessant sein könnte, wenn auch nicht reflektiven reinen Lipidtröpfchen Lokalisierung.
Wir haben dieses Protokoll für eine umfassende quantitative Lipidtröpfchen Proteome - Analyse von HCV-infizierte, im Vergleich zu nicht - infizierten Kontrollzellen , die Störungen durch HCV - Infektion verursacht zu offenbaren und Regulator der HCV - Replikation 21 zu identifizieren. In der Hepatom-Zelllinie Huh7.5 identifizierten wir routinemßig bis zu 2.900 Proteine in Lipidtröpfchen Fraktionen, mit ~ 300 Proteinen mit mehreren Peptiden, die in jedem Experiment identifiziert. Nach der Infektion mit HCV, beobachteten wir die beide Rekrutierung und Abreicherung von Wirtsproteinen. Mehrere Proteine wie hoch zuvor bei Lipidtröpfchen von HCV-infizierten Zellen angereichert wurden identifiziert als HCV - Wirtsfaktoren (zB DEAD - Box - Proteine 1 und 3 (DDX1, DDX3) oder Insulin-ähnlichen Wachstumsfaktor-II mRNA-bindendes Protein 1 veröffentlicht ( IGF2BP1)), was die Zuverlässigkeit des SILAC Ansatz 27, 28, 29. Darüber hinaus werden rekrutiert Proteine oft für RNA-bindenden Proteine mit Anmerkungen versehen, die enge Assoziation der viralen RNA replic Hervorhebungation Komplexe mit Lipidtröpfchen Fraktionen. Im Gegensatz dazu verarmten Proteine aus Lipidtröpfchen wurden in erster Linie für die Lipid-Stoffwechselvorgänge mit Anmerkungen versehen, die anzeigt, dass HCV die Proteinzusammensetzung stört die Lipidtröpfchen aus ihrer normalen metabolischen Regulation und Funktion zu trennen.
Das Protokoll wir beschreiben, ist abänderbar zu verschiedenen Zelllinien und Kulturbedingungen und bei der Entschlüsselung die Funktion von Lipidtröpfchen im Lebenszyklus von verschiedenen Krankheitserregern, die auf Lipidtröpfchen für die Replikation abhängig helfen könnte.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken R. Bartenschlager (Universität Heidelberg) für die Jc1 Konstrukte, CM Rice (Rockefeller University) für die Huh7.5 Zellen, J. McLauchlan (Medical Research Council Virology Unit) für die JFH1 konstruieren, T. Wakita (National Institute of Infectious Diseases, Japan) für die JFH1 und B. Webster und WC Greene (Gladstone Institut für Virologie und Immunologie) für die HCVcc Reporterkonstrukte. Diese Arbeit wird durch Mittel der DFG (HE 6889 / 2-1 (EH), INST 337 / 15-1 2013 und INST 337 / 16-1 2013 (HS)) unterstützt wurde. Das Heinrich-Pette-Institut, Leibniz-Institut für Experimentelle Virologie wird von den Freien und Hansestadt Hamburg und das Bundesministerium für Gesundheit unterstützt. Die Geldgeber hatten keine Rolle in Studiendesign, Datenerhebung und Analyse, Entscheidung oder Vorbereitung des Manuskripts zu veröffentlichen.
Materialien
| Name | Company | Catalog Number | Comments |
| SILAC Protein Quantitation Kit - DMEM | Thermo Fisher | 89983 | |
| 13C6 L-Arginine-HCl 50 mg | Thermo Fisher | 88210 | |
| Roti-Load 1 | Roth GmbH | K929.1 | |
| Roti-Blue 5x Concentrate | Roth GmbH | A152.2 | |
| 10x SDS-Tris-Glycine - Buffer | Geyer Th. GmbH & Co.KG | A1415,0250 | |
| GlutaMAX (100x) | Life Technologies GmbH | 350500038 | |
| Penicillin/Streptomycin Solution for Cell Culture | Sigma-Aldrich Chemie GmbH | P4333-100ml | |
| DPBS 1x Dulbecco's Phosphate-buffered Saline | Sigma-Aldrich Chemie GmbH | D8537 | |
| Trypsin-EDTA | Sigma-Aldrich Chemie GmbH | T3924-100ML | |
| Sodium Chloride BioChemica | AppliChem GmbH | A1149,1000 | |
| Tris Ultrapure | AppliChem GmbH | A1086,5000A | |
| EDTA BioChemica | AppliChem GmbH | A1103,0250 | |
| Protease Inhibitor Cocktail 5 mL | Sigma-Aldrich Chemie GmbH | P8340-5ML | |
| D(+)-Sucrose BioChemica | AppliChem GmbH | A3935,1000 | |
| Hydrochloric acid (HCl) 37% pure Ph. Eur., NF | AppliChem GmbH | A0625 | |
| DC Protein Assay | Bio-Rad Laboratoris GmbH | 500-0116 | |
| Glycerol | AppliChem GmbH | 151339 | |
| SDS Ultrapure | AppliChem GmbH | A1112 | |
| Bromophenol blue | AppliChem GmbH | A2331 | |
| β-Mercaptoethanol | AppliChem GmbH | A4338 | |
| Blasticidin | Invivogen | ant-bl-1 | |
| Potassium Chloride | AppliChem GmbH | A1039 | |
| Phenylmethanesulfonyl Fluoride | AppliChem GmbH | A0999 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich Chemie GmbH | 221309 | |
| Dipotassium Hydrogenphosphate | Sigma-Aldrich Chemie GmbH | P3786 | |
| DTT | AppliChem GmbH | A2948 | |
| NP-40 | AppliChem | A1694 | |
| TWEEN 20 | AppliChem | A4974 | |
| Nonfat dried milk powder | AppliChem | A0830 | |
| Anti-ADFP/ ADRP | abcam | ab52355 | |
| M6PRB1/TIP47 100 µg | abcam | ab47639 | |
| Calreticulin, pAb 200 µg | Enzo Life Science GmbH | ADI-SPA-600-F | |
| Anti-β-Tubulin | Sigma-Aldrich Chemie GmbH | T6074 200µl | |
| Ethanol absolute (EtOH) | Geyer Th. GmbH & Co.KG | A3678,0250 | |
| Anti-MnSOD | Enzo Life Science GmbH | ADI-SOD-110-F | |
| Anti-mouse HRP | Thermo Fisher Pierce | 32430 | |
| Anti-rabbit HRP | Thermo Fisher Pierce | 32460 | |
| Amersham Hyperfilm ECL | GE Healthcare | 28906836 | |
| Lumi-Light Western Blotting Substrate | Sigma-Aldrich Chemie GmbH | 12015196001 | |
| 96-Well Cell Culture Plate | Greiner Bio-One GmbH | 655 180 | |
| Terumo Syringe 1 mL | Terumo | SS-01T | |
| Filtropur BT 50, 500 mL, 0.45 µm | SARSTEDT | 83.1823.100 | |
| Mini-PROTEAN TGX Precast Gels, Any kD resolving gel | Bio-Rad Laboratoris GmbH | 456-9034 | |
| 6-Well Cell Culture Plate | Greiner Bio-One GmbH | 657160 | |
| Dishes Nunclon 150/20 | Fisher Scientific GmbH | 10098720 - 168381 | |
| Cell Scraper | neoLab Migge GmbH | C-8120 | |
| Tube, 50 mL | Greiner Bio-One GmbH | 227261 | |
| SafeSeal Tube RNase-free | SARSTEDT | 72.706.400 | |
| Ultra Clear Centrifuge Tubes 11 x 60 mm | Beckman Coulter GmbH | 344062 | |
| Suction Needles | Transcodent | 6482 | |
| Biosphere Fil. Tip 1000 | SARSTEDT | 70.762.211 | |
| Biosphere Fil. Tip 200 | SARSTEDT | 70.760.211 | |
| Biosphere Fil. Tip 10 | SARSTEDT | 70.1130.210 | |
| Dounce Tissue Grinder | Fisher Scientific GmbH | 11883722 | |
| Pestles For Dounce All-Glass Tissue Grinders | Fisher Scientific GmbH | 10389444 | |
| Orbitrap Fusion | |||
| Branson Sonifier 450 | |||
| Thermomixer comfort, with Thermoblock 1.5 mL | Eppendorf | 5355 000.127 | |
| Mini-PROTEAN Tetra Cell, Mini Trans-Blot Module, and PowerPac Basic Power Supply, | BioRad | 165-8033 | |
| Mini-PROTEAN 3 Multi-Casting Chamber | BioRad | 165-4110 | |
| PowerPac HC Power Supply | Biorad | 164-5052 | |
| Centrifuge | Eppendorf | 5424R | |
| Centrifuge | Eppendorf | 5424 | |
| Optima L-90K | Beckman Coulter GmbH | 365670 | |
| SW 60 Ti Rotor | Beckman Coulter GmbH | 335649 | |
| Infinite M1000 PRO | Tecan |
Referenzen
- Thiam, A. R., Farese, R. V. Jr, Walther, T. C. The biophysics and cell biology of lipid droplets. Nat Rev Mol Cell Biol. 14 (12), 775-786 (2013).
- Welte, M. A. Expanding roles for lipid droplets. Curr Biol. 25 (11), R470-R481 (2015).
- Brasaemle, D. L. Thematic review series: adipocyte biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis. J Lipid Res. 48 (12), 2547-2559 (2007).
- Choudhary, V., Ojha, N., Golden, A., Prinz, W. A. A conserved family of proteins facilitates nascent lipid droplet budding from the ER. J Cell Biol. 211 (2), 261-271 (2015).
- Kory, N., Farese, R. V. Jr, Walther, T. C. Targeting Fat: Mechanisms of Protein Localization to Lipid Droplets. Trends Cell Biol. 26 (7), 535-546 (2016).
- Hashemi, H. F., Goodman, J. M. The life cycle of lipid droplets. Curr Opin Cell Biol. 33, 119-124 (2015).
- Gao, Q., Goodman, J. M. The lipid droplet-a well-connected organelle. Front Cell Dev Biol. 3, 49(2015).
- Herker, E., Ott, M. Emerging role of lipid droplets in host/pathogen interactions. J Biol Chem. 287 (4), 2280-2287 (2012).
- Wedemeyer, H., Dore, G. J., Ward, J. W. Estimates on HCV disease burden worldwide - filling the gaps. J Viral Hepat. 22 Suppl 1, 1-5 (2015).
- Paul, D., Madan, V., Bartenschlager, R. Hepatitis C virus RNA replication and assembly: living on the fat of the land. Cell Host Microbe. 16 (5), 569-579 (2014).
- Lindenbach, B. D., Rice, C. M. The ins and outs of hepatitis C virus entry and assembly. Nat Rev Microbiol. 11 (10), 688-700 (2013).
- Barba, G., et al. Hepatitis C virus core protein shows a cytoplasmic localization and associates to cellular lipid storage droplets. Proc Natl Acad Sci U S A. 94 (4), 1200-1205 (1997).
- Shi, S. T., et al. Hepatitis C virus NS5A colocalizes with the core protein on lipid droplets and interacts with apolipoproteins. Virology. 292 (2), 198-210 (2002).
- Herker, E., et al. Efficient hepatitis C virus particle formation requires diacylglycerol acyltransferase-1. Nat Med. 16 (11), 1295-1298 (2010).
- Camus, G., et al. Diacylglycerol acyltransferase-1 localizes hepatitis C virus NS5A protein to lipid droplets and enhances NS5A interaction with the viral capsid core. J Biol Chem. 288 (14), 9915-9923 (2013).
- Miyanari, Y., et al. The lipid droplet is an important organelle for hepatitis C virus production. Nat Cell Biol. 9 (9), 1089-1097 (2007).
- Boulant, S., Targett-Adams, P., McLauchlan, J. Disrupting the association of hepatitis C virus core protein with lipid droplets correlates with a loss in production of infectious virus. J Gen Virol. 88 (Pt 8), 2204-2213 (2007).
- Vogt, D. A., et al. Lipid droplet-binding protein TIP47 regulates hepatitis C Virus RNA replication through interaction with the viral NS5A protein. PLoS Pathog. 9 (4), e1003302(2013).
- Ploen, D., et al. TIP47 plays a crucial role in the life cycle of hepatitis C virus. J Hepatol. 58 (6), 1081-1088 (2013).
- Ploen, D., et al. TIP47 is associated with the hepatitis C virus and its interaction with Rab9 is required for release of viral particles. Eur J Cell Biol. 92 (12), 374-382 (2013).
- Rosch, K., et al. Quantitative Lipid Droplet Proteome Analysis Identifies Annexin A3 as a Cofactor for HCV Particle Production. Cell Rep. 16 (12), 3219-3231 (2016).
- Kwiatkowski, M., et al. Ultrafast extraction of proteins from tissues using desorption by impulsive vibrational excitation. Angew Chem Int Ed Engl. 54 (1), 285-288 (2015).
- Webster, B., Ott, M., Greene, W. C. Evasion of superinfection exclusion and elimination of primary viral RNA by an adapted strain of hepatitis C virus. J Virol. 87 (24), 13354-13369 (2013).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nat Protoc. 1 (6), 2856-2860 (2006).
- Ting, L., et al. Normalization and statistical analysis of quantitative proteomics data generated by metabolic labeling. Mol Cell Proteomics. 8 (10), 2227-2242 (2009).
- Brasaemle, D. L., Dolios, G., Shapiro, L., Wang, R. Proteomic analysis of proteins associated with lipid droplets of basal and lipolytically stimulated 3T3-L1 adipocytes. J Biol Chem. 279 (45), 46835-46842 (2004).
- Tingting, P., Caiyun, F., Zhigang, Y., Pengyuan, Y., Zhenghong, Y. Subproteomic analysis of the cellular proteins associated with the 3' untranslated region of the hepatitis C virus genome in human liver cells. Biochem Biophys Res Commun. 347 (3), 683-691 (2006).
- Ariumi, Y., et al. DDX3 DEAD-box RNA helicase is required for hepatitis C virus RNA replication. J Virol. 81 (24), 13922-13926 (2007).
- Weinlich, S., et al. IGF2BP1 enhances HCV IRES-mediated translation initiation via the 3'UTR. RNA. 15 (8), 1528-1542 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten