Method Article
Farelerin Meme Fat Pad içine Meme Kanseri Hücreleri Ortotopik Enjeksiyon Tümör Büyüme Eğitim için.
Bu Makalede
Özet
Kanser tümörü çevreleyen dokunun hem de yerel pro- ve anti-inflamatuar aracılar tarafından etkilenir kompleks bir hastalıktır. Bu nedenle, daha çok deri altı modellere göre ortotrop enjeksiyon modelleri, bir şekilde daha iyi taklit eden insan patoloji kanser ilerlemesinin incelemek için yararlı olabilir.
Özet
Meme kanseri büyüme modelini bir bolluk kullanılarak farelerde incelenebilir. Meme kanseri hücrelerinin genetik manipülasyon yeni tümör bastırıcılarının keşfetmek için onkojenik ilerlemesi veya yardım katılan proteinlerin fonksiyonları içgörüler sağlayabilir. Buna ek olarak, farklı genotipleri olan farelere kanser hücreleri enjekte stromal bölmesinde öneminin daha iyi anlaşılmasını sağlayabilir. Birçok model hastalığın ilerlemesi bazı yönlerini araştırmak için yararlı olabilir ama tüm kanser sürecini özetlemek yok. Buna karşılık, meme kanseri hücrelerinin daha iyi farelerin meme yağ tabanına kadar engraftmınt hastalığı ve uygun stromal bölmesinde varlığı ve bu nedenle daha iyi taklit eden, insan kanser hastalığı yerini tartışıldı. Bu makalede, biz orthotopically farelere meme kanseri hücrelerini implante ve analiz etmek dokuları toplamak için nasıl açıklamak için nasıl açıklamak: 14px; line-height:. 28px; "> tümör çevre ve uzak organlara metastaz bu modeli kullanarak, birçok kanser yönleri (büyüme, anjiyogenez ve metastaz) tümör hücrelerinin büyümesi için uygun bir ortam sağlayarak basit incelenebilir.
Giriş
Kanser yüzyıllar boyunca için çalışmalara konu olmuştur çok karmaşık bir hastalıktır. Meme kanseri en sık görülen kanser türüdür; kadınlarda görülür, ancak düzensiz de erkeklerde 27 oluşabilir. hastalığın başlıca olarak vücuttaki hücrelerin sonsuz büyümesine yol açar kontrol mekanizması yönetim hücre bölünmesi kaybına neden olur. Bu arızalar çeşitli mekanizmalarla neden olabilir: Birincisi, sağlıklı hücreler kanser hücrelerinin kendi büyüme faktörlerini yapmak ve böylece daha yüksek bir çoğalma hızı 1 elde büyüme faktörü reseptörlerinin ifadesini artırmak ise çoğalmaya için çevredeki hücrelerden büyüme sinyalleri gerekir; ikinci olarak, kanser hücreleri, anti-proliferatif sinyaller 8 daha az duyarlı olan; üçüncü olarak, aynı zamanda gerekli olan vücut hücre ölümü, hücre sayısını dengelemeye; Bununla birlikte, kanser hücreleri, programlanmış hücre ölümü kaçmak apoptoz 14 olarak adlandırılan; Dördüncü, hücreler, hücre dışı matrislerin bağlısırayla hayatta ama tümör hücreleri bağlanma ihtiyacı olmadan büyüme ve anoikis 19 direnç gösterebilir; Beşinci, telomeraz aktivasyonu telomer kısalması circumvents ve replikatif yaşlılıkla 21 önler; son ama en az değil, değişmiş genetik içeriği 15,16 mitoz sonuçları takiben DNA kalite kontrol atlama. Bu deregüle çoğalmasında bir rol oynar onkojenlerinin veya tümör bastırıcıları tespit etmek amacıyla, farelerde tümör büyümesi deneyler çok önemlidir.
Primer tümör büyümesi genellikle ana ölüm nedeni değildir. Bir ikincil site birincil siteden kanser hücrelerinin göçü, metastaz denir, çoğu kanser hastalarında 22 önde gelen ölüm nedenidir. Metastaz ikincil site bağışıklık saldırı, ekstravazasyon ve büyümeyi kaçınarak, dolaşımı yoluyla seyahat, tümör hücresi istilasını, intravasation gerektirir. Mezenkimal geçiş (EMT) epitel önemli bir süreç olduğunumetastaz ve metastaz hücresinin 12 için ön koşul olan yüksek motilite ve invaziv hücreleri, verimli gen ifadesi profilleri bir anahtar içerir. Kanserli süreci kanser hücreleri, stromal hücreler ve pro- ve anti-enflamatuar hücreler arasında karşılıklı etkileşimler de dahil olmak üzere çeşitli işlemlerden oluşan bir kombinasyonun elde edilen gibi, kanser için bir in vitro yaklaşım, genellikle, kanserli süreci içine tam fikir vermez. Benzer şekilde, tümör damar sistemini etkileyen anti-kanser tedavileri, genellikle bu şekilde in vivo kullanımı yaklaşımları kaçınılmazdır, in vitro incelenmiştir edilemez.
Meme kanseri ilerlemesini incelemek için, farklı deneysel yöntemler geliştirilmiştir. En yaygın olarak kullanılan model, farelerde 5 içine, göğüs kanseri hücrelerinin deri altına enjeksiyondur. Bu deney düzeneğinde, araştırmacı, in vitro olarak bir seçim hücre hattına değişiklikler geniş bir katabilmektedir (örnuyarılması, proteinlerin aşağı doğru düzenleme) ile deri altına hücreleri enjekte edilir. Bu yöntem basittir ve enjeksiyon işlemi fareler üzerinde ameliyat gerek kalmadan basit olmasına rağmen, tümör enjekte edildiği de site meme kanseri gelişimi ile sonuçlanabilir yerel meme tümörü çevre ve bu ortamda olmadığını temsil etmez insan patolojisinde gözlenenden farklıdır. İkincisi, genetiği fareler meme kanseri ilerlemesini incelemek için bir in vivo aracı olarak sıkça kullanılır. Bu modelde, Oncogene (yani PyMT, Neu) sentezleme spontan meme tümör s oluşumuna yol açan, bir göğüs doku spesifik promotör ile tahrik edilir. Bu deneysel kurulum süresi 3 tümör boyutu kontrol ederken uyuşturucu veya antikorlar enjekte ederek hastalığın tedavi yönünü incelemek için yararlıdır. Ancak, eksik veya ayrıca ins verebilir ilgi bir gen mutasyona diğer fare suşları ile bu farelerin üremememe tümör büyümesi 24 farklı proteinlerin rolünü içine ights. Bu modelin olumsuz tümör boyutu ve sayısının varyasyon eğilimli olmasıdır. Ayrıca, transgen ekspresyonu seviyesi, genomu içinde entegre yeri değişir ve başka bir 4 bir fare suşundan değiştirebilir. Insan hastalıklarında, hücrelerinin sadece bir alt popülasyonu onkojenini ifade eden tümör baskılayıcı seviyeleri 26 üretimini azalttığı ise, bu modelde, transgenin ifadesi epitelyal kökenli tüm hücreler tarafından elde edilebilir. Metastazı araştırmak için göğüs kanseri hücreleri de damar içine enjekte edilebilir 25 (model deneysel metastaz olarak da adlandırılır). Ancak, bu yaklaşım sadece kısmen metastatik süreci özetlediği; Bu tümör hücreleri istila eder ve intravasate için gereksinimi önlediği, ve tümör hücreleri hali hazırda dolaşımda mevcut olduğu noktadan başlar.
Bizim çalışmamızda, biz ortotopik Inject kullanıniyon modeli meme kanseri ilerlemesinde 13 ilgi genleri çalışma. İnsan meme kanseri hücrelerinde protein aşırı ifade eden ve NOD / SCID y (NTG) farelerin meme yağ pedi içine enjekte edilir. Enjekte hücre hattında çok hızlı ve farklı genetik değişiklikler, bu patolojik ilgili sitelere de metastaz birincil tümör büyümesi meme kanseri ilerlemesinde tüm süreci kapsayan izin verir, ve aynı zamanda iyi bir deneysel model sunar: Bu yöntem birçok yönden avantajlıdır Hastalığın erken ya da geç aşamalarında terapötik tedavilerin etkisini incelemek için. Ayrıca, bu model birini kullanarak genetiği değiştirilmiş fareler veya hücreleri kullanılarak hastalığın ilerlemesinde kanser hücresi kaynaklı proteinlerin karşı stromal rolünü araştırmak. Deri altı enjeksiyonlar, uygulaması daha kolay olmakla birlikte, ortotopik modeller daha tümörijenik daha metastatik kanser hücre popülasyonuna neden olmaktadır. Böylece sonuçlar, deri altına enjeksiyon vasıtasıyla eldes yalancı negatif ya da tümör büyümesini incelemek için ortotopik modellerin kullanımını teşvik 6,17 yalancı pozitif ya olabilir.
Protokol
Hayvan deneyleri Leiden Üniversitesi Tıp Merkezi (LUMC) hayvan koruma kurulu tarafından onaylanmıştır.
Hücreler, Aletleri ve Fareler 1. Hazırlık
- Operasyondan önce bir gün, orta hatta dördüncü meme ucundan NOD / SCID gama (NTG) fareler tıraş ve tüm fareler kabaca karşılaştırılabilir ağırlıklara sahip olduğunu doğrulamak için fareler tartmak.
- İki cımbız ve iki düz sivrisinek forseps (Şekil 1A) bir makas otoklavlayın.
- Işlem gününde, insan göğüs adenokarsinomu (MDA-MB-231), fosfat tamponlu tuzlu su (PBS) ile bir kez enjekte edilecek hücreler, pH değeri 7.4 yıkama ve Hücreleri tripsinize edin. Hücrelerin üzerine 10 mi, serum ihtiva eden DMEM ortamı eklenerek tripsin söndürüldü. Serumsuz PBS içinde ya da ortam içinde ya da yeniden süspansiyona alınmasıyla serumun ayrılması için oda sıcaklığında, 7 dakika için 1200 rpm'de hücreleri santrifüjleyin. Tamamen serum izlerini kaldırmak için tekrar santrifüj. PBS hücrelerin tekrar ya daMedya.
- Bir hemasitometre ile hücre sayımı ve hücre miktarını hesaplamak. Fazla 150 ul 500.000 hücre / fareyi kullanın. PBS veya medya İsteğe, matrigel hücreleri tekrar süspansiyon.
NOT: kullanılan hücre türüne bağımlı olarak hücre miktarını belirlemek. - Steril bir mikrosantrifüj tüpleri hücreleri koyun ve buz üzerinde saklayın.
- 35, PBS, pH 7.4 ml% 70 etanol ile bir 50 ml konik santrifüj tüpüne sahip bir 50 ml konik santrifüj tüpü doldurun. Her tüpe pamuk bezlerden bekletin.
2. Ortotopik Enjeksiyon
- Steril bir ortam sağlamak için steril bir kaput içinde ameliyat. / Kg vücut ağırlığı ila 100 mg, sırasıyla 10 mg / kg, arasında bir dozda Xylazin / Ketamin karışımı enjekte deri altından ile fare anestezisi. Bir ısıtma yastığı üzerinde fare Fix. Ayak tutam tepki eksikliği anestezi başarısını onaylayın.
NOT: Bir cerrahi girişimler ile çok aşina değilse, cerrahi daha uzun sürebilir. Düzenlemekanestezi buna göre doz. - Kurumasını önlemek için gözleri, farelerin gözleri oftalmik merhem sürün.
- Adım 1.6 hazırlanan etanol içine batırılmış pamuklu çubukla kullanarak traş alanı temizleyin. Planlanan kesi uzak dönen dairesel bir şekilde betadin ve alkol üç kez kullanarak scrubs Alternatif yapılmalıdır. Alternatif olarak, bir dezenfektan olarak iyonoforu kullanın.
- Bir makas ile dördüncü meme başı ve orta hatta arasında küçük bir kesi yapmak ve PBS pH 7.4 ile nemlendirilmiş pamuklu çubukla takarak bir cep yapmak.
- Meme yağ yastığı ortaya çıkarmak için bir cımbız kullanın. Beyaz renk ile yağ yastığı gözlemleyin.
- Kendi tabanından diğer cımbız ile yağ yastığı sıkıştırın; Bu yaparak, tam kolayca enjeksiyonları gerçekleştirmek için yağ yastığı (Şekil 1B) maruz kalmaktadır.
- Yukarı ve aşağı pipetleme hücre homojen bir karışım. Yavaşça bir insülin şırınga içine hücre süspansiyonu 50 ul aspire ve içine enjekteyatay iğne tutarak meme yağ yastığı. Yağ yastığı şişme kontrol ederek başarılı bir enjeksiyon onaylayın.
- Yavaşça yağ yastığı bırakın.
- Bir iğne sürücüsünü kullanarak kesi sütür. Üç saat yönünde, saat yönünün tersine ve saat yönünde iğne sürücü etrafında dikiş çevirerek atar olun. Dikiş başına iki düğüm kullanılmalıdır.
NOT: knot aksi fareler sütür açabilirsiniz sıkı olduğundan emin olun. - Ameliyattan sonra, ağrıyı dindirmek amacıyla 0.05-0.1 mg / kg vücut ağırlığı, deri altından böyle Temgesic gibi, bir analjezik enjekte.
- Onlar bilinci kazanmak ve sternum recumbence korumak kadar sahipsiz hayvanlar bırakmayın. Onlar tamamen iyileşti kadar farklı kafeslere içine tüm hayvanları yerleştirin.
- , Sterilite korumak Otoklavlanmış kafesleri ve su kullanın. Temiz bir atmosfer tutmak için her üç günde kafesleri değiştirin.
Analiz için 3. Hasat Organları
- AtHasat gün, 8 hafta hücrelerinin implante edilmesinden sonra, her bir fare için 3 mi Bouin çözeltisi ile 15 ml konik santrifüj tüpleri doldurun. Buna ek olarak, fare başına 5 ml formalin çözeltisi ile doldurulmuş iki adet 15 ml tüpler kullanmaktadır.
- 10 mg'lık bir dozda, Xylazin /, ketamin enjekte edilerek hayvanlar anestezi / 100 mg / kg vücut ağırlığı deri altına kg. Hayvan ayak tutam çekilme refleksi kaybeder kadar bekleyin.
- Bir baz iğne ile hayvan Fix. Makasla uzun, dikey orta hat kesi olun. Sağ ön bacak altında ve arka bacak üzerinde iki yatay kesiler yapmak. Tabanına cilt iğneleyerek tümörü Açığa. Bir kumpas kullanarak tümör hacmini ölçün.
- Makas kullanılarak cilt tümörü ayırmak. Ek Bileşen RNA izolasyonu için sıvı azot içinde bir tümör parçası dondurma. Parafine aşağıdaki immunohistokimyasal gerçekleştirmek için formalin ile dolu konik santrifüj tüpüne, diğer kısmı koyun.
- Yavaşça akciğerleri çıkar. YerleştirinBouin solüsyonu içine akciğer bıraktı. 3 gün boyunca çözelti içinde akciğer tutun. Çıplak gözle açıkça yüzeysel metastatik odaklar gözlemleyin. İsteğe bağlı olarak, hematoksilen ve eozin (H & E) boyama kullanarak Mikrometastaz doğrulamak için formalin içine doğru akciğer yerleştirin.
NOT: Akciğer metastazı meme kanseri sık görülen rağmen, bir de metastaz analiz etmek kemik, karaciğer, beyin ve dalak toplamak isteyebilirsiniz. metastatik alanda hücreler yoğun ve morfolojik olarak farklı olan ve bu nedenle, akciğer dokusundan kolayca ayırt edilebilir. - Bir gün hasattan sonra, 15 ml tüpler gelen formalin solüsyonu aspire ve% 70 etanol ile değiştirin. Parafin dokuları embed ve immunohistokimyasal çalışmalar yapmak.
- Kan analizi için, makasla göğüs boşluğuna açılır. Kalp delinerek 450 ul kan çekiniz. % 3.2 sodyum sitrat 50 ul ihtiva eden bir mikrosantrifüj tüpü içinde kan örneği yerleştirin. Kan toplandıktan sonra, 10 mi 2,000 xg'de uydurmayın. Bir sonraki kullanıma kadar -20 ° C 'de plazma numuneleri saklayın.
NOT: Orada yaygın uygulamada 20 kullanılan birçok diğer kan toplama teknikleri ve kullanılması gereken tekniği deney düzeneği ve bilim seçimine bağlıdır. Kan örneği gerekli değilse, hayvan protokolü veya kurum kurallarına göre göre hayvan euthanize.
Sonuçlar
"Ortotopik meme kanseri modeli" başarılı bir şekilde uygulanması, memenin yağlı pedine hücrelerin uygun enjeksiyon dayanmaktadır. Bu tür hücreler ya da sızıntı kesin aşılama gibi deneysel hatalar tümör boyutu veya kontrol tamponu (Şekil 2A) ile enjekte edilmiş bir meme yağ tabanına benzeyen bir yapının oluşumuna yol açar, bir tümörün da yokluğunda varyasyonlara neden olabilir. Tümör büyüme oranı enjekte edilen hücre çizgisinin doğasına bağlı olduğu, ve genel olarak, farelerde (Şekil 2B), deri yoluyla gözlenebilir. In vitro deneylerde farklı olarak, tümör hücrelerinin büyüme oranı, in vivo olarak bir süre (Şekil 2C) içinde sabit olmayabilir. Hipoksi ve besin eksikliği nedeniyle, nekrotik bölgeler meydana getirebilirler ve bu alanlar tümörün (Şekil 2B) büyüme oranını etkiler. Buna ek olarak, ilgi konusu gen, belirli bir fazını etkileyebilirKanser ilerlemesi (erken veya geç), böylece deney düzeneği bağlı, tümör büyümesi hızlı başlar ama sonunda ya da tam tersi yavaşlatabilir.
Bakım tümörün çıkarılması işlemi sırasında alınmalıdır; titiz işleme tümörün yapısını etkileyen ve immünohistokimyasal analiz sorunlara yol açar olabilir. tümör çevresi vasküler yeniden ortaya çıkan büyük damarları görüntüleyebilir. Bu gemiler atık malzemelerden temizleyen önemli bir rol oynamaktadır ve böylece tümör büyümesini (Şekil 2B) kolaylaştıran besin ve oksijen ile tümör dokusu kaynağı. Neovesellerin (anjiyogenez) oluşumu neoveseller belirteçleri için tümör boyanarak incelenmiştir edilebilir (yani CD31, CD34).
Bouin solüsyonu akciğerlerin Koleksiyon akciğerler üzerinde yüzeysel metastatik odaklar (Şekil 3A) görselleştirmek için yardımcı olur. odaklar soluk renkli olup, buna göre, akciğer dokusundan ayırt edilebilirD18 tespit etmek kolaydır. Metastaz akciğer yüzeyi üzerinde oluşturulmuş odaklarının sayısı olarak da ifade edilebilir. Bununla birlikte, odak oluşumu hücre çizgisi bağlıdır; agresif olmayan hücreler sadece mikrometastazın veya hiç metastaz doğuran. Mikro metastaz kolayca parafin akciğer dokusunda (Şekil 3C) bir haematoksilin / eozin boyama ile tespit edilebilir.
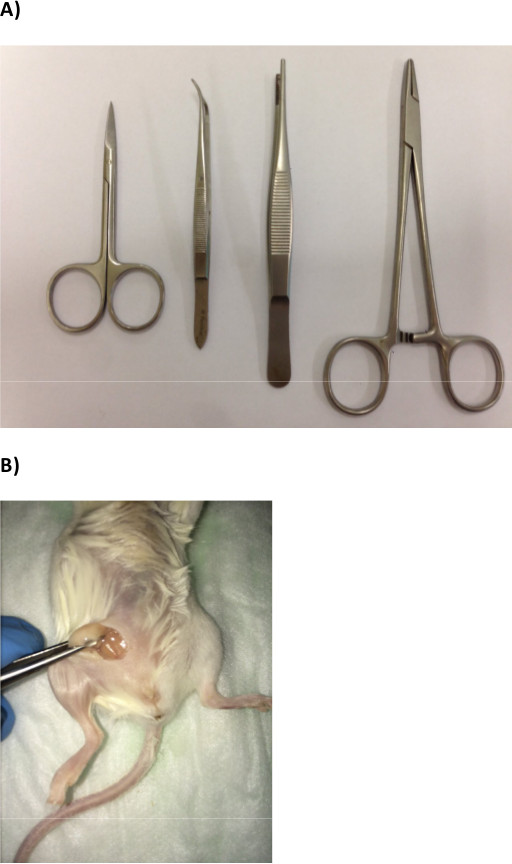
Şekil 1:. Meme yağ yastığı içine meme kanseri hücrelerinin enjeksiyon için gerekli malzemeler ve Yöntemler (A) Cerrahi ekipmanları (B) meme yağ yastığı pozlama gösteren Temsilcisi görüntü..
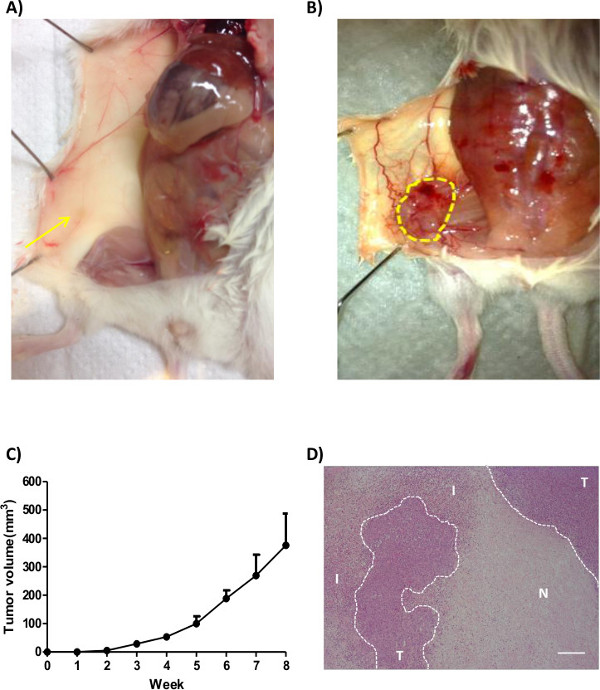
Şekil 2:. Farelerde ortotopik meme tümör büyümesinin Bakış (A) Medya kontrol veya (B) İnsan göğüs kanseri hücrelerinin (MDA-MB-231), bir kadın NTG fare meme yağ tabanına enjekte edilir. Fareler öldürüldü ve fotoğraf çekildi. Tümörler kesikli daire ile gösterilir. ok meme yağ yastığı gösterir (C) Tümör hacmi aşağıdaki formülü kullanarak kumpas ile ölçüldü.:. Tümör hacmi = 0.5 x Uzunluk x Genişlik x Genişlik (D) tümör Genel morfolojisi H & E boyama ile analiz edilir. Ben sızmış hücreler için standları, T tümör hücrelerini gösterir ve N nekrotik alan için duruyor. (Ölçek çubuğu = 200 mikron)
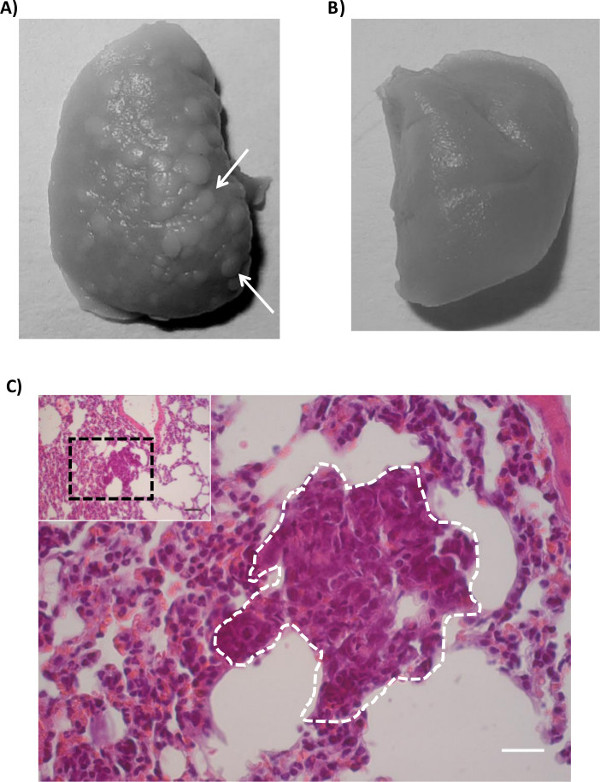
Şekil 3: akciğerlere tümör metastaz (A) 'ortotopikal tümör hücrelerinin (MDA-MB-231), enjekte edilmiş farelerin akciğerleri.. Bouin çözeltisi içinde akciğer inkübasyonu akciğerde metastaz odaklarının ortaya koyar., Kontrol farelerinden (B) AkciğerlerBu kontrol medyanın ortotopik enjeksiyon yapıldı. Açık bir şekilde görüleceği gibi, bu kontrol akciğerleri makroskopik metastaz göstermemiştir. (C), H & E boyama akciğer dokusunda metastatik bölgesini gösterir. insert metastatik odak içeren akciğer dokusunun düşük büyütme genel bakışını gösterir. prospektüste siyah kesik dikdörtgen büyük panelde temsil edilmektedir. Tümör hücreleri, beyaz kesikli çizgi ile gösterilir; büyük ve yoğun çekirdekleri not. (Siyah ölçek çubuğu = 100 mikron, beyaz ölçek çubuğu = 20 mikron)
Tartışmalar
Meme kanseri hücrelerinin Ortotopik enjeksiyon kanser büyüme tüm yönleriyle incelemek için güçlü bir modeldir. Farelerin meme yağ tabanına bu hücrelerin implantasyonu dikkatli bir şekilde tümör büyümesi değişimi önlemek için gerçekleştirilmelidir. En önemlisi, her bir fare için hücreler ile aynı miktarda enjekte önemlidir. Bunu yapmak için, bir titizlikle hücrelerin canlılığını etkileyen hücrelere trypsinize gerekir. Cansız hücreler canlı hücre sayısının belirlenmesi için yararlı olabilir ölü ve canlı hücreler arasında ayrım yapmak için yardımcı hücre sayımı ve reaktiflerin (tripan mavi) içinde göz ardı edilmelidir. Hücre kümeleri oluşumu hücre topaklarının oluşumu, hücre sayımı sırasında sorunlara neden olarak yukarı ve aşağı hücreleri pipetleme kaçınılması ve hücre sayısı yanlış hesap neden olmalıdır. Dikkate alınması gereken bir diğer önemli yönü hücrelerin kendileri hacmidir. Protokol bölümü, hücre içinde tarif edildiği gibi,s PBS ya da ortam içinde askıya almak için pelet haline getirildi. PBS veya ortam eklemeden önce, hücre hacmi farklı ortam hacmi ile doldurulmuş tüpler pelet kıyaslanması sureti ile tahmin edilebilir. Daha sonra hücre hacmi aşağıdaki formüle göre, üretilen ortam hacmi çıkartılmıştır edilebilir:
Eklenecek = Hesaplanan hacmi ihtiyacı medya Hacim - Hücre hacmi
Deneyin sonucunu etkileyebilir protokolde kullanılan Reaktifler; Bu nedenle protokol araştırma sorusu bağlı olarak buna göre ayarlanmalıdır. Deney Tümör ilerlemesinde bir zar proteini rolünü ortaya konmasıdır Örneğin, tripsinizasyon zar proteininin sindirime yol açabilir ve eşyalar 9 neden olabilir. Bu bir endişe ise tamponlu EDTA çözeltisi kullanarak veya hücreleri kazıma hücreleri ayırmak için bir alternatiftir. Yukarıda sözü edildiği gibi, hücreler, ortam, PBS veya matrigel fo yeniden süspansiyon haline edilebilirenjeksiyonla. Matrigel böylece fatpad dışarı sızdıran hücreleri minimize, yağ yastığı polimerize olarak Bunlardan, matrigel uygun bir seçenektir. Buna ek olarak, matrigel mevcudiyetinde melezleşmesi meme kanseri hücre soyu MDA-MB-435 2, insan submandibuler karsinoma A253, insan epidermoid karsinom KB ve fare melanoma B16F10 hücrelerinin 7 tümör büyümesi ve belirli hücre çizgilerinin metastatik potansiyelini arttırabilir. Bazı matrigel hazırlıkları potansiyel deney sonuçlarını etkileyen büyüme faktörleri içerdiğini fark edin. Ancak, büyüme faktörü-tükenmiş matrigel çeşitli tedarikçilerden temin edilebilir. Ayrıca, matrigel bir hücre dışı matriks (ECM) gibi davranır ve integrin alt kümeleri geçirir. Araştırma sorusu tümör büyümesi integrin fonksiyonu rolünü içermektedir Böylece, eğer, bir göğüs kanseri hücreleri için bir taşıyıcı olarak ortam veya PBS kullanmalıdır.
Bizim deneysel kurulum olarak, içine insan göğüs kanseri hücrelerinin (MDA-MB-231), enjekteNTG farelerin meme yağ pedi. bağışık yetmezliği farelerin kullanılması Açıkçası zor kanser gelişiminde immünoregülatör genleri çalışma yapar. Bununla birlikte, enjekte gereken hücrelerinin fare kökenli 23 varsa, bu teknik, aynı zamanda sağlam bir bağışıklık sistemine sahip fare kullanılabilir dikkat etmek önemlidir. Buna ek olarak, MDA-MB-231 hücre hattı, bu nedenle, meme kanseri geliştirme hormonların etki eksik Östrojen Reseptör negatif (ER) 'dir. Yine de, daha önceki çalışmalar, bu teknik, aynı zamanda, MCF-7 13 gibi, ER + meme kanseri hücreleri için uygun olduğunu göstermiştir. Yaygın olarak kullanılan meme kanseri hücre hatları, tümör büyümesini incelemek için bu yöntemi kullanan kağıtlar aşağıda listelenmiştir:
prosedür kendisi de bazı kritik adımlar içermektedir. Deri altı enjeksiyonlar aksine, ortotopik enjeksiyonlar fareler üzerinde cerrahi prosedürleri içerir. Bu nedenle, cerrahi aletler, iyi temizlenmiş ve otoklava gerekir. Not, insan hücrelerinin implantasyonu içindememe yağ pedleri bağışıklık yetersizliği olan farelerde (örneğin, NOD / SCID) kullanımını gerektirir. Bu nedenle, enjeksiyonlar, tercihen steril aletler kullanarak, biyolojik bir güvenlik kabini içinde yapılmalıdır. Ayrıca, enjeksiyon sırasında iğne yukarı bakacak şekilde iğne açıklığı ile dik açı ile tutulmalıdır. Bu konumda iğne tutma sızmasını azaltan ve bu şekilde başarılı enjeksiyon meme yağ tabanına şişmesi gözlemlenerek teyit edilebilir. Ameliyat yaparken ek olarak, tümör büyümesi ile yara iyileşme sürecinin bir girişimi engellemek için bazı mesafe uzaklıkta meme yağ yastığı bir kesi yapmak için çok önemlidir. Ancak, yarık zor olabilir meme yağ pedi ortaya koyar, ya da meme yağ pedi çok uzak yapılmamalıdır.
Prosedür izlenerek, hayvanlar düzenli olarak kontrol edilmelidir. Nedeniyle anestezi için cerrahi ve maruz kalma, fareler bile önemli bir rahatsızlık veya karşılaşabilirsinizdie. Bu nedenle, işlem sonrası ilk hafta kritiktir ve fareler dikkatle izlenmelidir. Implante edilen hücre büyüme oranına bağlı olarak, tümör hacmi, haftada 4 kez kadar ölçülebilir. enjekte edilen hücrelerin, aynı zamanda, bir ışığa duyarlı kamera kullanılarak primer ve metastatik tümör hücrelerinin izleme sağlayan, bir flüoresan protein veya lusiferaz ile etiketlenmiş olabilir. Tümörler ülserasyonlar bu Zarar tümör dokusu oluşabilir son derece büyük boyutlara ulaşması asla izin verilmemeli. Bu tümör dokusunun uygun immünohistokimyasal analizler engel olabilir. Tümör hasat edildikten sonra, tek bir tümör kıyma ve ebeveyn arasındaki farkları araştırmak ve yağ yastığı geçen (MFP) hücre çizgileri 11 mammay için yeni bir meme kanseri hücre hattı oluşturmak için disperse tümör hücrelerinin kültür düşünebilir.
Sonuç olarak, biz bu makalede özetlenen ortotopik meme kanseri implantasyon kanseri ile ilgili süreçleri incelemek için çok yararlı bir araçtır. Bir caN ya da ekspresyonunun düzenlenmesi ile enjekte edilen hücrelerin genomu işlemek veya ilgi duyulan geni aşağı ayarlayabilen ve primer tümör büyümesi, anjiyojenez veya metastaz üzerindeki etkisini kontrol edin. Bu yaklaşım, proto-onkojenlerinin, tümör SUPRESSORS veya EMT katılan genleri incelemek faydalı olacaktır. Buna ek olarak, hücre çizgileri kanser gelişimi stromal bölmesinde etkisini incelemek üzere genetik olarak tadil edilmiş farelere enjekte edilebilir. Önemle nedeniyle patofizyolojik sürecin yüksek tekrarlama yukarıda belirtilen meme kanseri modelleri üzerinde ortotopik enjeksiyon tekniği kullanımını teşvik ediyoruz.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The authors would like to acknowledge the Netherlands Organization for Scientific Research (NWO, grant 17.106.329)
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bouin's solution | Sigma-Aldrich | HT10132 | Used for investigating the metastasis on lungs |
| Formalin solution | Sigma-Aldrich | HT501128 | Used to fix the tissues |
| Matrigel, growth factor reduced | Corning | 356230 | Cells can be resuspended in matrigel for injection |
| Mosquito forceps | Fine Science Tools | 13008-12 | Used for stiching |
| Angled forceps | Electron microscopy sciences | 72991-4c | These make the exposure of mammary fat pad easier |
| Scissors | B Braun Medicals | BC056R | Used to cut open the mice |
| Straight forceps | B Braun Medicals | BD025R | This is used to open up the skin to expose mammary fat pad |
| NOD scid gamma mice | Charles River | 005557 | Experimental animal used for experiment |
| MDA-MB-231 | Sigma-Aldrich | 92020424 | Experimental cells used for injections |
| Oculentum simplex | Teva Pharmachemie | Opthalmic ointment used to prevent drying out of eyes | |
| Betadine | Fischer Scientific | 19-898-859 | Ionophore, used to disinfect the surgical area |
| Xylazin/Ketamine | Sigma-Aldrich | X1251, K2753 | Use injected anesthesia as 10mg/kg and 100mg/kg body weight respectively |
| Temgesic | Schering-Plough | Use the painkiller as 0.05-0.1 mg/kg body weight | |
| DMEM | Life sciences | 11995 | For trypsin neutralization,use media with serum(FBS:media 1:10 volume); for injection, use media with no serum |
| Buffered sodium citrate | Aniara | A12-8480-10 | Use the volume ratio as citrate:blood; 1:9 |
Referanslar
- Aaronson, S. A. Growth factors and cancer. Science. 254 (5035), 1146-1153 (1991).
- Bao, L., Matsumura, Y., Baban, D., Sun, Y., Tarin, D. Effects of inoculation site and Matrigel on growth and metastasis of human breast cancer cells. Br. J. Cancer. 70 (2), 228-232 (1994).
- Brouxhon, S. M., et al. Monoclonal antibody against the ectodomain of E-cadherin (DECMA-1) suppresses breast carcinogenesis: involvement of the HER/PI3K/Akt/mTOR and IAP pathways. Clin. Cancer Res. 19 (12), 3234-3246 (2013).
- Dobie, K. W., et al. Variegated transgene expression in mouse mammary gland is determined by the transgene integration locus. Proc. Natl. Acad. Sci. U S A. 93 (13), 6659-6664 (1996).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. Anticancer Res. 25 (6B), 3905-3915 (2005).
- Fidler, I. J., Naito, S., Pathak, S. Orthotopic implantation is essential for the selection, growth and metastasis of human renal cell cancer in nude mice [corrected. Cancer Metastasis Rev. 9 (2), 149-165 (1990).
- Fridman, R., et al. Enhanced tumor growth of both primary and established human and murine tumor cells in athymic mice after coinjection with Matrigel. J. Natl. Cancer Inst. 83 (11), 769-774 (1991).
- Fynan, T. M., Reiss, M. Resistance to inhibition of cell growth by transforming growth factor-beta and its role in oncogenesis. Crit Rev. Oncog. 4 (5), 493-540 (1993).
- Huang, H. L., et al. Trypsin-induced proteome alteration during cell subculture in mammalian cells. J. Biomed. Sci. 17, 36 (2010).
- Iorns, E., et al. A new mouse model for the study of human breast cancer metastasis. PLoS. One. 7 (10), e47995 (2012).
- Jessani, N., Niessen, S., Mueller, B. M., Cravatt, B. F. Breast cancer cell lines grown in vivo: what goes in isn't always the same as what comes out. Cell Cycle. 4 (2), 253-255 (2005).
- Kalluri, R., Weinberg, R. A. The basics of epithelial-mesenchymal transition. J. Clin. Invest. 119 (6), 1420-1428 (2009).
- Kocaturk, B., et al. Alternatively spliced tissue factor promotes breast cancer growth in a beta1 integrin-dependent manner. Proc. Natl. Acad. Sci. U S A. 110, 11517-11522 (2013).
- Lowe, S. W., Lin, A. W. Apoptosis in cancer. Carcinogenesis. 21 (3), 485-495 (2000).
- Meek, D. W. The p53 response to DNA damage. DNA Repair (Amst). 3 (8-9), 1049-1056 (2004).
- Meek, D. W. Tumor suppression by p53: a role for the DNA damage response). Nat. Rev. Cancer. 9 (10), 714-723 (2009).
- Miller, F. R., Medina, D., Heppner, G. H. Preferential growth of mammary tumors in intact mammary fatpads. Cancer Res. 41 (10), 3863-3867 (1981).
- Mueller, B. M., Ruf, W. Requirement for binding of catalytically active factor VIIa in tissue factor-dependent experimental metastasis. J. Clin. Invest. 101 (7), 1372-1378 (1998).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochim. Biophys. Acta. 1833 (12), 3481-3498 (2013).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J. Pharmacol. Pharmacother. 1 (2), 87-93 (2010).
- Shay, J. W., Zou, Y., Hiyama, E., Qright, W. E. Telomerase and cancer. Hum. Mol. Genet.. 10 (7), 677-685 (2001).
- Sporn, M. B. The war on cancer. Lancet. 347 (9012), 1377-1381 (1996).
- Tao, K., Fang, M., Alroy, J., Sahagian, G. G. Imagable 4T1 model for the study of late stage breast cancer. BMC. Cancer. 8, 228 (2008).
- Versteeg, H. H., et al. Protease-activated receptor (PAR) 2, but not PAR1, signaling promotes the development of mammary adenocarcinoma in polyoma middle T mice. Cancer Res. 68 (17), 7219-7227 (2008).
- Versteeg, H. H., et al. Inhibition of tissue factor signaling suppresses tumor growth. Blood. 111 (1), 190-199 (2008).
- Wagner, K. U. Models of breast cancer: quo vadis, animal modeling?. Breast Cancer Res. 6 (1), 31-38 (2004).
- Weigelt, B., Peterse, J. L., van't Veer, L. J. Breast cancer metastasis: markers and models. Nat. Rev. Cancer. 5 (8), 591-602 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır