Method Article
Orthotopische Injektion von Brustkrebszellen in das Brustfettpolster von Mäusen, das Tumorwachstum zu studieren.
In diesem Artikel
Zusammenfassung
Krebs ist eine komplexe Erkrankung, die durch den den Tumor umgebenden Gewebes sowie lokale pro- und anti-inflammatorischen Mediatoren beeinflusst wird. Daher kann orthotrope Pritzer, anstatt subkutanen Modellen nützlich sein, um Krebsprogression in einer Weise, dass eine bessere ahmt menschlichen Pathologie studieren.
Zusammenfassung
Das Wachstum von Brustkrebs in Mäusen mit einer Vielzahl von Modellen untersucht werden. Genetische Manipulation von Brustkrebszellen können Einblicke in die Funktion von Proteinen in onkogenen Progression oder consequat liefern neue Tumorsuppressoren entdecken. Zusätzlich Injektion von Krebszellen in Mäusen, die mit verschiedenen Genotypen liefern ein besseres Verständnis der Bedeutung der Stroma. Viele Modelle nützlich, um bestimmte Aspekte der Progression der Erkrankung untersucht, aber nicht die gesamte Krebsprozess wiederholen. Im Gegensatz dazu Brustkrebszellen Transplantation in die Brustfettpolster von Mäusen besser rekapituliert den Ort der Erkrankung und die Präsenz der richtigen Stromatumoren Fach und daher besser imitiert menschliche Krebserkrankung. In diesem Artikel, wie Sie Brustkrebszellen orthotop in Mäuse implantiert werden und erklären, wie man Gewebe, um die Analyse zu sammeln beschreiben wir: 14px; line-height:. 28px; "> Tumormilieu und Metastasierung in entfernte Organe Unter Verwendung dieses Modells vielen Aspekten (Wachstum, Angiogenese und Metastasierung) von Krebs kann einfach durch eine günstige Umgebung für die Tumorzellen wachsen untersucht werden.
Einleitung
Krebs ist eine sehr komplexe Krankheit, die seit über Jahrhunderte zogen worden Studien. Brustkrebs ist die häufigste Krebsart; sie tritt vorwiegend bei Frauen, kann aber vereinzelt auch bei Männern 27 auftreten. Die Erkrankung wird hauptsächlich durch den Verlust der Kontrolle der Zellteilung Verfahren gesteuert, die wiederum führt zu einer unendlichen Wachstum von Zellen im Körper verursacht. Diese Störungen können durch verschiedene Mechanismen verursacht werden: Zunächst müssen die gesunden Zellen Wachstumssignale aus den umliegenden Zellen, um sich zu vermehren, während Krebszellen ihre eigenen Wachstumsfaktoren und erhöhen die Expression von Wachstumsfaktor-Rezeptoren somit eine höhere Proliferationsrate 1 erhalten wird; zweitens sind die Krebszellen weniger anfällig für anti-proliferative Signale 8; drittens, um die Anzahl der Zellen im Körper Zelltod ist auch erforderlich, auszugleichen; aber Krebszellen Flucht aus den programmierten Zelltod, die Apoptose bezeichnet 14; vierten, Zellen an extrazelluläre Matrix haftenUm zu überleben, aber Tumorzellen ohne die Notwendigkeit von Befestigungs wachsen und zeigen Beständigkeit gegen anoikis 19; fünften, Aktivierung der Telomerase umgeht die Verkürzung der Telomere und verhindert die replikative Seneszenz 21; nicht zuletzt, das Überspringen von DNA-Qualitätskontrolle nach der Mitose resultiert eine neue genetische Inhalt 15,16. Um Onkogenen oder Tumorsuppressoren, die eine Rolle in dieser deregulierten Proliferation spielen zu identifizieren, sind Tumorwachstum Experimenten an Mäusen entscheidend.
Primäre Tumorwachstum ist im allgemeinen nicht der Hauptgrund für den Tod. Migration von Krebszellen aus dem Primärstandort zu einer sekundären Seite, bezeichnet als Metastasen ist die häufigste Todesursache in den meisten Krebspatienten 22. Metastasen bringt Tumorzellinvasion, intravasation, sich durch den Kreislauf vermieden Immunangriff, Extravasation und das Wachstum an der Sekundärstation. Epithelial zu mesenchymale Transition (EMT) ist ein Schlüsselprozess inMetastasierung und beinhaltet einen Schalter in Genexpressionsprofile ergeben Zellen mit höheren Motilität und Invasivität, die Voraussetzungen für die metastasierenden Zelle 12 sind. Denn Krebsprozesses ist die Resultierende aus einer Kombination von verschiedenen Maßnahmen, einschließlich der gegenseitigen Wechselwirkungen zwischen Tumorzellen, Stromazellen und pro- und anti-inflammatorischen Zellen, ein in vitro Ansatz zur Krebs verleiht häufig keinen vollständigen Einblick in die Krebsprozess. Ähnlich Krebsbehandlungen beeinflussen die Tumorvaskulatur oft nicht in vitro untersucht werden, wodurch die Verwendung von in vivo-Ansätzen ist unvermeidlich.
Um Brustkrebs Progression zu studieren, wurden verschiedene experimentelle Methoden entwickelt. Das am häufigsten verwendete Modell ist die subkutane Injektion von Brustkrebszellen in Mäuse 5. In diesem Versuchsaufbau kann der Forscher eine Vielzahl von Änderungen an einer Zelllinie der Wahl in vitro eingeführt (dhHochregulierung, die Herunterregulierung von Proteinen) und injizieren die Zellen unter die Haut. Dieses Verfahren ist zwar einfach und der Einspritzvorgang ist einfach, ohne dass eine Operation an den Mäusen durchgeführt, wird die Stelle, an der der Tumor injiziert nicht die lokale Mammatumorumgebung und das Fehlen dieser Umwelt darstellen kann in der Entwicklung von Brustkrebs Ergebnis, dass unterscheidet sich von dem in der menschlichen Pathologie beobachtet. Zweitens werden gentechnisch veränderte Mäuse häufig als in vivo Werkzeug Brustkrebsprogression Studie verwendet. In diesem Modell wird Onkogen (dh PyMT, Neu) Expression von einem Brustgewebe spezifischen Promotor, der zur Bildung von spontanen Brusttumor s angetrieben. Diese Versuchsanordnung ist nützlich, um die Behandlung Aspekt der Krankheit, die durch Injektion von Medikamenten oder Antikörper während der Überprüfung der Tumorgröße in der Zeit 3 studieren. Allerdings Zucht dieser Mäuse mit anderen Mausstämme mangelhaft oder in einem Gen von Interesse kann auch geben Ins mutiertights in die Rolle von verschiedenen Proteinen in Brusttumorwachstum 24. Der Nachteil dieses Modells ist, dass es anfällig für Schwankungen der Tumorgröße und Anzahl ist. Außerdem ist das Niveau der Expression des Transgens hängt von der Integrationsstelle im Genom und können von einem Mausstamm auf einen anderen 4 ändern. In diesem Modell kann die Expression des Transgens durch alle Zellen mit epithelialem Ursprung erreicht werden, während bei menschlichen Krankheiten, nur eine Subpopulation der Zellen das Onkogen oder herunterregulieren Tumorsuppressor Ebenen 26. Um Metastasen studieren kann Brustkrebszellen auch intravenös injiziert werden (ein Modell bezeichnet experimentelle Metastasierung) 25. Dieser Ansatz rekapituliert nur die metastatischen Prozess teilweise; er umgeht das Erfordernis für die Tumorzellen eindringen und intravasate und beginnt ab dem Punkt, an dem die Tumorzellen leicht in dem Blutkreislauf vor.
In unserer Arbeit verwenden wir eine orthotope spritzenIonen-Modell, um die Beteiligung der Gene von Interesse bei Brustkrebs Progression 13 zu studieren. Wir überexprimieren das Protein in menschlichen Brustkrebszellen und injizieren sie in das Brustfettpolster von NOD / SCID gamma (NSG) Mäusen. Dieses Verfahren ist vorteilhaft in vielerlei Hinsicht: Sie ermöglicht sehr schnelle und vielfältige genetische Veränderungen in der injizierten Zelllinie deckt es den gesamten Prozess von Brustkrebs Progression von Primärtumorwachstum zur Metastasierung bei pathologisch relevanten Websites, und es bietet auch eine gute Versuchsmodell zur Untersuchung der Wirkung von therapeutischen Behandlungen zu frühen oder späten Stadien der Erkrankung. Zusätzlich unter Verwendung dieses Modells kann man die Rolle der Stromazellen gegen Krebszellen stammenden Proteinen in den Krankheitsverlauf unter Verwendung gentechnisch veränderten Mäusen oder Zellen zu untersuchen. Obwohl subkutane Injektionen sind einfacher durchzuführen, geben orthotope Modellen aber zu einer tumorigenen und metastatischen Krebszellpopulation. Somit wird mittels der subkutanen Injektion erhaltenen Ergebnisses kann entweder falsch-negative oder falsch-positive 6,17 Förderung der Verwendung von orthotopen Modelle, die das Tumorwachstum zu studieren.
Protokoll
Tierversuche wurden von der Tierschutzausschusses des Leiden University Medical Center (LUMC) zugelassen.
1. Herstellung der Zellen, Instrumente und Mäuse
- Einen Tag vor der Operation, rasieren die NOD / SCID-gamma (NSG) Mäuse aus dem vierten Brustwarze bis zur Mittellinie und wiegen die Mäuse, um zu überprüfen, dass alle Mäuse haben in etwa vergleichbar Gewichte.
- Autoklavieren eine Schere, zwei Pinzetten und zwei gerade Moskito Pinzette (Abbildung 1A).
- Am Tag der Operation, wäscht den menschlichen Brustadenokarzinom (MDA-MB-231-Zellen), die einmal mit phosphatgepufferter Salzlösung (PBS) injiziert wird, pH 7,4 und trypsinize die Zellen. Quenche die Trypsin durch Zugabe von 10 ml Serum enthaltendem DMEM-Medium auf die Oberseite der Zellen. Zentrifugieren Sie die Zellen bei 1200 rpm für 7 Minuten bei Raumtemperatur, um das Serum durch Resuspendieren der Zellen entweder in PBS oder in Medium ohne Serum zu entfernen. Zentrifugieren wieder um Spuren von Serum vollständig zu entfernen. Resuspendieren der Zellen in PBS oderMedien.
- Zähle die Zellen mit einem Hämozytometer und berechnet die Menge von Zellen. Verwenden 500.000 Zellen / Maus in nicht mehr als 150 & mgr; l. Optional zu PBS oder Medien, die Zellen werden in Matrigel.
HINWEIS: Bestimmen Sie die Anzahl der Zellen in Abhängigkeit von der verwendeten Zelltyp. - Zeigen Zellen in ein steriles Mikrozentrifugenröhrchen und halten sie auf Eis.
- Füllen einer 50 ml konischen Zentrifugenröhrchen mit 35 ml PBS pH 7.4 und einem weiteren 50 ml konischen Zentrifugenröhrchen mit 70% Ethanol. Genießen Wattestäbchen in jedes Röhrchen.
2. Orthotopische Injection
- Führen Sie die Operation in einer sterilen Haube, um eine sterile Atmosphäre zu erhalten. Anesthetize die Maus durch subkutane Injektion von Xylazin / Ketamin-Mischung bei einer Dosis von 10 mg / kg, 100 mg / kg Körpergewicht auf. Befestigen Sie die Maus auf einem Heizkissen. Bestätigen den Erfolg der Anästhesie durch den Mangel an Reaktion auf Zehe Prise.
HINWEIS: Wenn man nicht sehr vertraut mit chirurgischen Eingriffen, kann eine Operation länger dauern. Vereinbarendie Anästhesie Dosis entsprechend. - Anwenden Augensalbe für die Augen von Mäusen, um die Augen vor dem Austrocknen zu schützen.
- Reinigen Sie die rasierte Fläche mit der Wattestäbchen in Ethanol in Schritt 1.6 vorbereitet getaucht. Wechselnde Peelings mit Betadin und Alkohol dreimal im Kreis dreht weg von der geplanten Einschnittstelle durchgeführt werden. Alternativ Ionophor verwendet als Desinfektionsmittel.
- Machen Sie einen kleinen Schnitt zwischen dem vierten Brustwarze und der Mittellinie mit einer Schere und eine Tasche, indem Sie das Wattestäbchen mit PBS, pH 7,4, befeuchtet.
- Verwenden Sie eine Pinzette, um das Brustfettpolster aus. Beachten Sie die Fettpolster durch ihre weiße Farbe.
- Drücken Sie die Fettpolster mit der anderen Pinzette von ihrer Basis; durch diese Weise voll setzen die Fettpolster (1B), um Injektionen leicht durchführen.
- Homogenisieren des Zellgemisch durch Auf- und Abpipettieren. Vorsichtig aspirieren 50 ul der Zellsuspension in einem Insulin Spritze aufgezogen und indas Brustfettpolster, indem Sie die Nadel horizontal. Bestätigen erfolgreiche Injektion, indem Sie für Schwellungen der Fettpolster.
- Lassen Sie die Fettpolster sanft.
- Naht der Einschnitt unter Verwendung einer Nadeltreiber. Make drei Würfe durch Drehen des Fadens um den Nadeltreiber im Uhrzeigersinn, gegen den Uhrzeigersinn und im Uhrzeigersinn. Zwei Knoten pro Naht verwendet werden.
HINWEIS: Sicherstellen, dass die Äste dicht sind anders Mäusen eröffnen können die Nähte. - Nach der Operation injiziert ein Analgetikum, wie Temgesic bei 0,05-0,1 mg / kg Körpergewicht subkutan, um die Schmerzen zu lindern.
- Die Tiere nicht unbeaufsichtigt lassen, bis sie das Bewusstsein gewinnen und zu erhalten sternalen recumbence. Zeigen alle Tiere in verschiedenen Käfigen, bis sie vollständig wiederhergestellt werden.
- Um die Sterilität zu gewährleisten, verwenden autoklaviertem Käfigen und Wasser. Ändern Sie die Käfige alle drei Tage, um die Atmosphäre zu reinigen.
3. Organraub für Analysis
- An derTag der Ernte, 8 Wochen nach der Implantation der Zellen zu füllen 15 ml konischen Zentrifugenröhrchen mit 3 ml Bouin-Lösung für jede Maus. Darüber hinaus verwenden Sie zwei 15-ml-Röhrchen mit 5 ml Formalin-Lösung pro Maus gefüllt.
- Betäuben der Tiere durch Injektion von Xylazin / Ketamin, bei einer Dosis von 10 mg / kg, 100 mg / kg Körpergewicht subkutan. Warten Sie, bis das Tier verliert toe Prise Rückzug Reflex.
- Befestigen Sie das Tier mit Nadeln auf einem Sockel. Machen Sie einen langen, vertikalen Mittelschnitt mit einer Schere. Machen Sie zwei horizontale Schnitte direkt unter dem Vorderbein und über dem hinteren Bein. Setzen Sie den Tumor durch Pinning die Haut an der Basis. Messen des Tumorvolumens mit Hilfe einer Schieblehre.
- Distanzieren, den Tumor von der Haut mit einer Schere. Schnellfrost einen Teil des Tumors in flüssigem Stickstoff für die RNA-Isolierung. Legen Sie das andere Teil, in den konischen Zentrifugenröhrchen mit Formalin gefüllten Immunhistochemie folgenden Paraffineinbettung durchzuführen.
- Vorsichtig nehmen Sie in die Lunge. Platzieren Sie dielinke Lunge in Bouin-Lösung. Halten Sie die Lunge in Lösung für 3 Tage. Beachten oberflächliche Metastasenherde deutlich mit bloßem Auge. Wahlweise legen Sie die rechte Lunge in Formalin auf Mikrometastasen mit Hämatoxylin und Eosin (H & E) Färbung zu überprüfen.
Hinweis: Obwohl, Lungenmetastasen häufig bei Brustkrebs beobachtet, könnte man auch wünschen Knochen, Leber, Hirn und Milz sammeln, um Metastasen zu analysieren. Die Zellen an der metastatischen Bereich dichter und morphologisch verschieden sind und daher leicht von Lungengewebe zu unterscheiden. - Einen Tag nach der Ernte, saugen Sie den Formalin-Lösung von 15 ml-Röhrchen und ersetzen mit 70% Ethanol. Betten Sie das Gewebe in Paraffin und führen Immunhistochemie Studien.
- Für Blutanalyse, die Öffnung des Brustkorbes mit einer Schere. Ziehen Sie 450 ul Blut über Herzpunktion. Platzieren Blutprobe in ein Mikrozentrifugenröhrchen, das 50 & mgr; l 3,2% Natriumcitrat. Nach dem Blut gesammelt, drehen Sie es bei 2.000 × g für 10 kmn. Speichern die Plasmaproben bei -20 ° C bis zur weiteren Verwendung.
HINWEIS: Es gibt mehrere andere Blutentnahme Techniken, die üblicherweise in der Praxis 20 verwendet, und die Technik, die verwendet werden muss, hängt von Versuchsaufbau und Wahl Wissenschaftlers. Wenn Blutprobe nicht erforderlich ist, das Tier einzuschläfern gemäß der Tier Protokoll oder gemäß den Richtlinien Institution.
Ergebnisse
Erfolgreiche Anwendung des "orthotopen Brustkrebsmodell" auf ordnungsgemäße Injektion von Zellen in das Brustfettpolster basieren. Experimentelle Fehler wie ungenaue Inokulation von Zellen oder undicht sein, um Variationen in der Größe des Tumors oder sogar die Abwesenheit eines Tumors, der zur Bildung einer Struktur führt sucht ähnlich einer Brustfettpolster mit einem Steuerungspuffer (2A) injiziert führen. Die Wachstumsrate des Tumors ist abhängig von der Art des injizierten Zelllinie und im allgemeinen wird durch die Haut der Mäuse (2B) beobachtet werden. Anders als in-vitro-Experimenten kann die Wachstumsrate der Tumorzellen nicht in der Zeit in vivo (Abbildung 2C) konstant sein. Aufgrund Hypoxie und Nährstoffmangel kann nekrotische Bereiche bilden und diese Bereiche wird die Wachstumsrate des Tumors (2D) beeinflussen. Außerdem könnte das Gen von Interesse eine bestimmte Phase auswirkender Tumorprogression (früh oder spät), damit je nach Versuchsaufbau, das Tumorwachstum beginnen könnte schnell, aber verlangsamen, am Ende oder umgekehrt.
Vorsicht ist bei der Entfernung Verfahren des Tumors entnommen werden; strengen Handhabung kann die Struktur des Tumors beeinträchtigen und führt zu Problemen in immunhistochemische Analyse. Das Gebiet um den Tumor kann große Schiffe, die unter Gefässumbau entstehen anzuzeigen. Diese Gefäße spielen eine entscheidende Rolle bei der Entfernung von Abfallprodukten und liefern das Tumorgewebe mit Nährstoffen und Sauerstoff, wodurch das Tumorwachstum (2B) zu erleichtern. Bildung neovessels (Angiogenese) kann durch Färbung des Tumors für neovessel Marker untersucht werden (zB CD31, CD34).
Sammlung der Lunge in Bouin-Lösung hilft, oberflächliche Metastasenherde in den Lungen (3A) zu visualisieren. Die Schwerpunkte können aus Lungengewebe durch die blasse Farbe eine zu unterscheidend sind leicht zu erkennen 18. Metastasierung kann als die Anzahl von Foci auf der Lungenoberfläche gebildet ausgedrückt werden. Ist die Bildung von Foci jedoch Zellinie abhängig; nicht aggressive Zellen führen zu Mikrometastasen nur oder ohne Metastasen überhaupt. Mikrometastasen kann leicht mit einem Hämatoxylin / Eosin-Färbung bei in Paraffin eingebetteten Lungengewebe (3C) identifiziert werden.
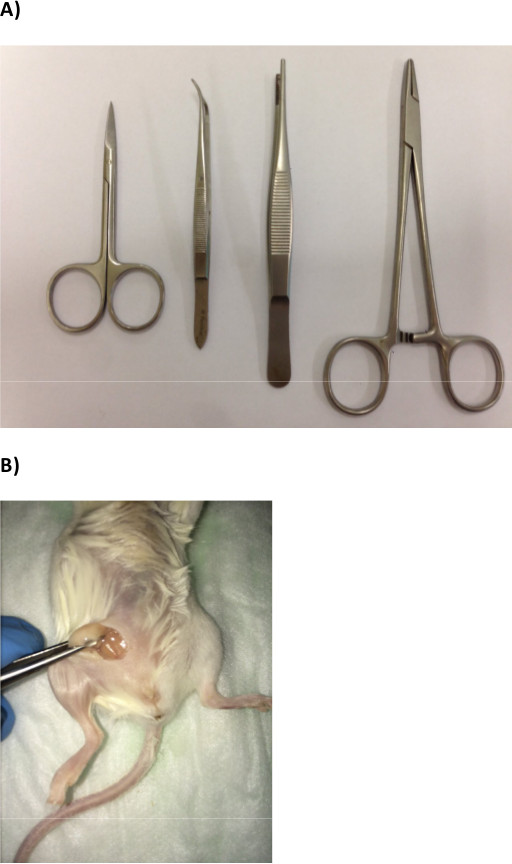
Abb. 1: Materialien und Methoden (A) OP-Ausrüstung für die Injektion von Brustkrebszellen in das Brustfettpolster erforderlich (B) Vertreter Aufnahme, die die Exposition der Brustfettpolster..
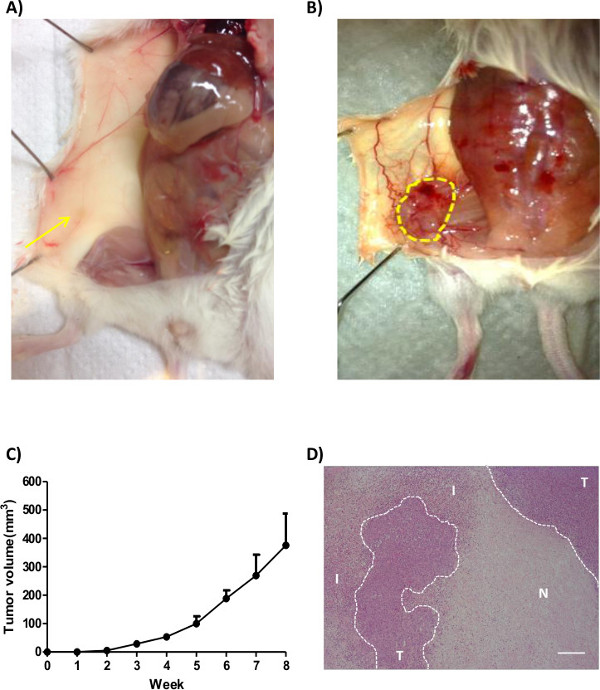
Fig. 2: Übersicht über die orthotope Brusttumorwachstum in Mäusen (A) Medium-Steuerung oder (B) menschlichen Brustkrebszellen (MDA-MB-231) in das Brustfettpolster weiblicher NSG Maus injiziert. Die Mäuse wurden getötet und Bilder aufgenommen wurden. Tumore werden durch die gestrichelten Kreis angedeutet. Der Pfeil zeigt die Brustfettpolster (C) Das Tumorvolumen wurde mit einer Schieblehre mit Hilfe der folgenden Formel gemessen:.. Tumorvolumen = 0,5 x Länge x Breite x Breite (D) Gesamt Morphologie des Tumors wird mit H & E-Färbung analysiert. I steht für infiltrierten Zellen, zeigt T Tumorzellen und N steht für nekrotischen Bereich. (Maßstabsbalken = 200 & mgr; m)
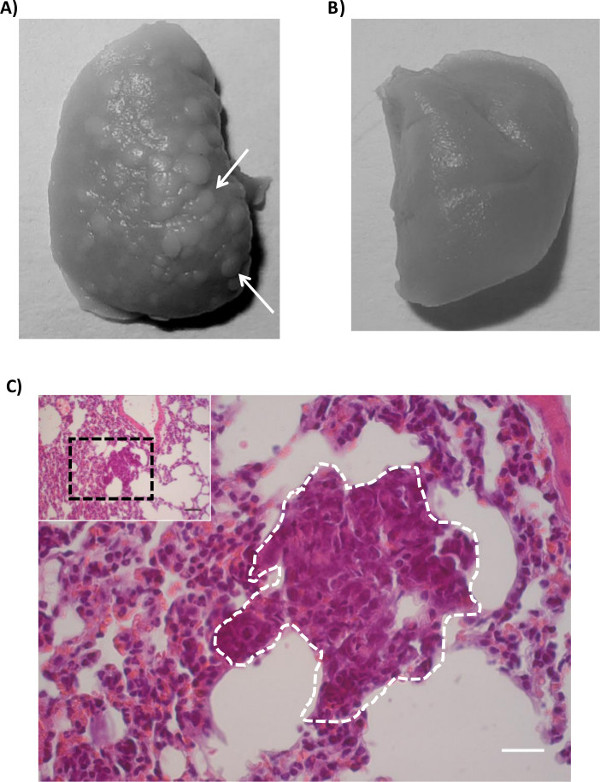
Abbildung 3: Tumormetastasierung zu den Lungen (A) Lungen von Mäusen, die orthotopisch mit Tumorzellen (MDA-MB-231) injiziert.. Inkubation der Lunge in Bouin-Lösung macht die Metastasenherde auf Lunge. (B) Die Lungen von Kontrollmäusendass unterzog orthotopen Injektion von Steuer Medien. Wie deutlich zu sehen ist, sind diese Steuer Lungen nicht makroskopischen Metastasen. (C), H & E-Färbung zeigt die metastatischen Region im Lungengewebe. Das Insert zeigt eine geringe Vergrößerung Sicht des Lungengewebes, das die metastatische Fokus. Die schwarze gestricheltes Rechteck in dem Einsatz in der Großtafel dargestellt. Tumorzellen werden durch die weiße gestrichelte Linie angedeutet; beachten Sie die größere und dichtere Kernen. (Black Balken = 100 um, weiße Balken = 20 & mgr; m)
Diskussion
Orthotopische Injektion von Brustkrebszellen ist ein leistungsfähiges Modell, alle Aspekte der Krebswachstum zu studieren. Implantation der Zellen in den Brustfettpolster der Mäuse sollte sorgfältig ausgewählt, um Variation in das Tumorwachstum zu verhindern durchgeführt werden. Am wichtigsten ist, ist entscheidend Injektion der gleichen Menge von Zellen jeder Maus. Um dies zu tun, sollte man die Zellen trypsinieren konsequent, ohne die Lebensfähigkeit der Zellen. Nicht lebensfähigen Zellen sollten bei der Zellzählung und Reagenzien (dh Trypanblau), die helfen, zwischen toten und lebenden Zellen unterscheiden kann nützlich für die Bestimmung der Lebendzellzahl werden nicht berücksichtigt. Bildung von Zellklumpen sollten von dem Pipettieren der Zellen nach oben und unten vermieden werden, da die Bildung von Zellklumpen Probleme während Zellzählung führen und führt zu fehlerhaften Berechnung der Zellzahl. Ein weiterer wichtiger Aspekt, der berücksichtigt werden sollte, ist das Volumen der Zellen selbst. Wie in dem Protokollabschnitt, Cells sind, um sie in PBS oder Medium auszusetzen pelletiert. Vor Zugabe PBS oder Medium, werden das Volumen der Zellen durch Vergleichen des Pellets mit Rohren mit unterschiedlichen Volumina von Medien gefüllt abschätzen. Anschließend wurde das Zellvolumen kann von dem beabsichtigten Datenträger nach folgender Formel subtrahiert werden:
Volume von Medien, die hinzugefügt werden = Berechnete Volumen muss - Zellvolumen
Reagenzien, die in dem Protokoll verwendet werden, können die Ergebnisse des Experiments zu beeinflussen; Daher sollte das Protokoll entsprechend abhängig von der Fragestellung angepasst werden. Zum Beispiel, wenn das Experiment mit dem die Rolle eines Membranproteins in Tumorprogressions aufzuklären Trypsinisierung kann bei der Verdauung des Membranproteins verursachen und eine Artefakte 9. Wenn dies ein Problem ist, mit gepufferten EDTA-Lösung oder Abschaben der Zellen ist eine Alternative, um die Zellen abzulösen. Wie oben erwähnt, können die Zellen in Medien, PBS oder Matrigel fo resuspendiertr Injektion. Unter diesen ist Matrigel eine bequeme Option Matrigel polymerisiert in das Fettpolster und minimiert so Zellen Austreten der Fettpolster. Darüber hinaus kann die Transplantation in Gegenwart Matrigel Tumorwachstum und Metastasenpotential von bestimmten Zelllinien entwickelt wie die Brustkrebs-Zelllinie MDA-MB-435-2, human submandibular Karzinom A253, menschliche Epidermoid Karzinom Kb und B16F10-Maus-Melanomzellen 7. Bitte beachten Sie, dass einige Matrigel Präparate enthalten Wachstumsfaktoren, die möglicherweise die Versuchsergebnisse beeinflussen. Jedoch ist Wachstumsfaktor verarmte Matrigel von verschiedenen Anbietern erhältlich. Zusätzlich wirkt Matrigel als extrazelluläre Matrix (ECM) und aktiviert Integrin Untermengen. Wenn also die Fragestellung betrifft die Rolle von Integrin-Funktion in Tumorwachstum, sollte Medium oder PBS als Träger für Brustkrebszellen verwendet.
In unserem Versuchsaufbau eingespritzt menschlichen Brustkrebszellen (MDA-MB-231) indas Brustfettpolster von NSG-Mäusen. Die Verwendung von immundefizienten Mäusen offensichtlich macht es schwieriger, die Beteiligung von immun Gene bei der Krebsentstehung zu studieren. Jedoch ist es wichtig zu beachten, dass diese Technik auch in Mäusen mit intaktem Immunsystem verwendet werden, wenn die Zellen, die injiziert werden muss, müssen Maus stammt. 23 Darüber hinaus ist MDA-MB-231 Zelllinie Östrogenrezeptor-negativ (ER-) daher, die Auswirkungen der Hormone bei Brustkrebs Entwicklung fehlt. Dennoch unserer früheren Arbeit zeigten, daß diese Technik auch denkbar, ER + Brustkrebszellen, wie MCF-7 13. Papiere unter Verwendung dieses Verfahrens, das Tumorwachstum von üblicherweise verwendeten Brustkrebs-Zelllinien sind nachstehend aufgeführt:
Das Verfahren selbst enthält einige wichtige Schritte als auch. Anders als subkutane Injektionen, orthotopen Injektionen beinhalten chirurgische Eingriffe an Mäusen. Daher sollten chirurgische Instrumente gut gereinigt und sterilisiert werden. Der Hinweis, der Implantation von menschlichen Zellen inBrustfettpolster erfordert die Verwendung von immundefizienten Mäusen (zB NOD / SCID). Daher Injektionen sollte vorzugsweise in einem biologischen Sicherheitswerkbank durchgeführt werden, mit sterilen Instrumenten. Außerdem wird während der Injektion die Nadel im rechten Winkel mit der Nadelöffnung nach oben gehalten werden. Halten der Nadel in dieser Position vermindert Auslaufen und auf diese Weise erfolgreich Injektion durch Beobachtung Anschwellen des Brustfettpolster verifiziert werden. Zusätzlich wird, wenn die Durchführung der Operation ist es entscheidend, um einen Einschnitt in einiger Entfernung von der Brustfettpolster, um Störungen der Wundheilung mit Tumorwachstum zu vermeiden. Aber der Schnitt sollte nicht zu weit entfernt von der Brustfettpolster entweder vorgenommen werden, da Freilegung der Brustfettpolster schwierig sein könnte.
Nach dem Verfahren sollten die Tiere regelmäßig überprüft werden. Durch die Operation und die Belastung durch die Narkose, können Mäuse erheblichen Unbehagen oder sogar erlebensterben. Somit ist in der ersten Woche nach dem Eingriff kritisch und Mäusen sollte sorgfältig überwacht werden. In Abhängigkeit von der Wachstumsrate der implantierten Zellen können Tumorvolumen bis zu 4-mal pro Woche gemessen werden. Die injizierten Zellen können auch mit einem fluoreszierenden Protein oder Luciferase markiert werden, so dass Tracking von primären und metastatischen Tumorzellen, unter Verwendung eines lichtempfindlichen Kamera. Tumoren sollte nie erlaubt werden, extrem großen Größen zu erreichen, wie Ulzerationen kann das Tumorgewebe eintreten, die Schäden. Da dies die immunhistochemischen Analysen des Tumorgewebes zu behindern. Sobald der Tumor geerntet könnte beispiels Zerkleinern des Tumors und das Kultivieren der dispergierten Tumorzellen, um einen neuen Brustkrebszelllinie, um Unterschiede zwischen elterlichen untersuchen und mammay Fettpolster geleitet (mfp) Zelllinien 11 zu schaffen.
Im Ergebnis der orthotopen Brustkrebs Implantation, die wir in diesem Papier dargelegt ist ein sehr nützliches Werkzeug, um die Krebsbezogenen Prozesse zu studieren. Eine can Manipulation des Genoms der injizierten Zellen entweder durch Hochregulieren oder Herunterregulieren des Gens von Interesse und zur Überprüfung seiner Wirkung auf Primärtumorwachstum, Angiogenese und Metastasierung. Diese Vorgehensweise ist hilfreich, Proto-Onkogene, Tumor supressors oder Gene, die in EMT involviert sind zu studieren. Zusätzlich können die Zelllinien, genetisch veränderte Mäuse injiziert werden, um die Wirkung von Stroma in der Tumorprogression zu untersuchen. Wir ermutigen die Verwendung des orthotopen Injektionstechnik über oben genannte Brustkrebs-Modelle aufgrund seiner hohen Rekapitulation pathophysiologischen Prozess.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
The authors would like to acknowledge the Netherlands Organization for Scientific Research (NWO, grant 17.106.329)
Materialien
| Name | Company | Catalog Number | Comments |
| Bouin's solution | Sigma-Aldrich | HT10132 | Used for investigating the metastasis on lungs |
| Formalin solution | Sigma-Aldrich | HT501128 | Used to fix the tissues |
| Matrigel, growth factor reduced | Corning | 356230 | Cells can be resuspended in matrigel for injection |
| Mosquito forceps | Fine Science Tools | 13008-12 | Used for stiching |
| Angled forceps | Electron microscopy sciences | 72991-4c | These make the exposure of mammary fat pad easier |
| Scissors | B Braun Medicals | BC056R | Used to cut open the mice |
| Straight forceps | B Braun Medicals | BD025R | This is used to open up the skin to expose mammary fat pad |
| NOD scid gamma mice | Charles River | 005557 | Experimental animal used for experiment |
| MDA-MB-231 | Sigma-Aldrich | 92020424 | Experimental cells used for injections |
| Oculentum simplex | Teva Pharmachemie | Opthalmic ointment used to prevent drying out of eyes | |
| Betadine | Fischer Scientific | 19-898-859 | Ionophore, used to disinfect the surgical area |
| Xylazin/Ketamine | Sigma-Aldrich | X1251, K2753 | Use injected anesthesia as 10mg/kg and 100mg/kg body weight respectively |
| Temgesic | Schering-Plough | Use the painkiller as 0.05-0.1 mg/kg body weight | |
| DMEM | Life sciences | 11995 | For trypsin neutralization,use media with serum(FBS:media 1:10 volume); for injection, use media with no serum |
| Buffered sodium citrate | Aniara | A12-8480-10 | Use the volume ratio as citrate:blood; 1:9 |
Referenzen
- Aaronson, S. A. Growth factors and cancer. Science. 254 (5035), 1146-1153 (1991).
- Bao, L., Matsumura, Y., Baban, D., Sun, Y., Tarin, D. Effects of inoculation site and Matrigel on growth and metastasis of human breast cancer cells. Br. J. Cancer. 70 (2), 228-232 (1994).
- Brouxhon, S. M., et al. Monoclonal antibody against the ectodomain of E-cadherin (DECMA-1) suppresses breast carcinogenesis: involvement of the HER/PI3K/Akt/mTOR and IAP pathways. Clin. Cancer Res. 19 (12), 3234-3246 (2013).
- Dobie, K. W., et al. Variegated transgene expression in mouse mammary gland is determined by the transgene integration locus. Proc. Natl. Acad. Sci. U S A. 93 (13), 6659-6664 (1996).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. Anticancer Res. 25 (6B), 3905-3915 (2005).
- Fidler, I. J., Naito, S., Pathak, S. Orthotopic implantation is essential for the selection, growth and metastasis of human renal cell cancer in nude mice [corrected. Cancer Metastasis Rev. 9 (2), 149-165 (1990).
- Fridman, R., et al. Enhanced tumor growth of both primary and established human and murine tumor cells in athymic mice after coinjection with Matrigel. J. Natl. Cancer Inst. 83 (11), 769-774 (1991).
- Fynan, T. M., Reiss, M. Resistance to inhibition of cell growth by transforming growth factor-beta and its role in oncogenesis. Crit Rev. Oncog. 4 (5), 493-540 (1993).
- Huang, H. L., et al. Trypsin-induced proteome alteration during cell subculture in mammalian cells. J. Biomed. Sci. 17, 36 (2010).
- Iorns, E., et al. A new mouse model for the study of human breast cancer metastasis. PLoS. One. 7 (10), e47995 (2012).
- Jessani, N., Niessen, S., Mueller, B. M., Cravatt, B. F. Breast cancer cell lines grown in vivo: what goes in isn't always the same as what comes out. Cell Cycle. 4 (2), 253-255 (2005).
- Kalluri, R., Weinberg, R. A. The basics of epithelial-mesenchymal transition. J. Clin. Invest. 119 (6), 1420-1428 (2009).
- Kocaturk, B., et al. Alternatively spliced tissue factor promotes breast cancer growth in a beta1 integrin-dependent manner. Proc. Natl. Acad. Sci. U S A. 110, 11517-11522 (2013).
- Lowe, S. W., Lin, A. W. Apoptosis in cancer. Carcinogenesis. 21 (3), 485-495 (2000).
- Meek, D. W. The p53 response to DNA damage. DNA Repair (Amst). 3 (8-9), 1049-1056 (2004).
- Meek, D. W. Tumor suppression by p53: a role for the DNA damage response). Nat. Rev. Cancer. 9 (10), 714-723 (2009).
- Miller, F. R., Medina, D., Heppner, G. H. Preferential growth of mammary tumors in intact mammary fatpads. Cancer Res. 41 (10), 3863-3867 (1981).
- Mueller, B. M., Ruf, W. Requirement for binding of catalytically active factor VIIa in tissue factor-dependent experimental metastasis. J. Clin. Invest. 101 (7), 1372-1378 (1998).
- Paoli, P., Giannoni, E., Chiarugi, P. Anoikis molecular pathways and its role in cancer progression. Biochim. Biophys. Acta. 1833 (12), 3481-3498 (2013).
- Parasuraman, S., Raveendran, R., Kesavan, R. Blood sample collection in small laboratory animals. J. Pharmacol. Pharmacother. 1 (2), 87-93 (2010).
- Shay, J. W., Zou, Y., Hiyama, E., Qright, W. E. Telomerase and cancer. Hum. Mol. Genet.. 10 (7), 677-685 (2001).
- Sporn, M. B. The war on cancer. Lancet. 347 (9012), 1377-1381 (1996).
- Tao, K., Fang, M., Alroy, J., Sahagian, G. G. Imagable 4T1 model for the study of late stage breast cancer. BMC. Cancer. 8, 228 (2008).
- Versteeg, H. H., et al. Protease-activated receptor (PAR) 2, but not PAR1, signaling promotes the development of mammary adenocarcinoma in polyoma middle T mice. Cancer Res. 68 (17), 7219-7227 (2008).
- Versteeg, H. H., et al. Inhibition of tissue factor signaling suppresses tumor growth. Blood. 111 (1), 190-199 (2008).
- Wagner, K. U. Models of breast cancer: quo vadis, animal modeling?. Breast Cancer Res. 6 (1), 31-38 (2004).
- Weigelt, B., Peterse, J. L., van't Veer, L. J. Breast cancer metastasis: markers and models. Nat. Rev. Cancer. 5 (8), 591-602 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten