Method Article
MACS Saflaştırılmış Fotoreceptör Öncü Hücrelerinin Yetişkin Fare Retinasına Subretinal Transplantasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Hücre nakli fotoreceptör kaybı ile karakterize retina dejenerasyonu tedavisi için bir stratejiyi temsil eder. Burada, nakledilebilir fotoreceptörlerin zenginleştirilmesi ve yetişkin farelere alt deri nakli için bir yöntem açıklıyoruz.
Özet
Retinanın ışık algılayan hücrelerinin, yani fotoreceptörlerin kaybına bağlı görme bozukluğu ve körlük, sanayileşmiş ülkelerde temel engellilik nedenini temsil eder. Dejenere fotoreceptörlerin hücre nakli ile değiştirilmesi, gelecekteki klinik uygulamalarda olası bir tedavi seçeneğini temsil etmektedir. Nitekim, son preklinik çalışmalar, doğum sonrası 4. günde yenidoğan fare retinasından izole edilen olgunlaşmamış fotoreceptörlerin subretinal transplantasyondan sonra yetişkin fare retinasına entegre olma potansiyeline sahip olduğunu göstermiştir. Donör hücreler, iç ve dış segmentler, dış nükleer tabakada bulunan yuvarlak bir hücre gövdesi ve endojen bipolar hücrelere yakın sinaptik terminaller dahil olmak üzere olgun bir fotoreceptör morfolojisi oluşturdu. Nitekim, son raporlar donör fotoreceptörlerin konak farelerin sinir devrelerine işlevsel olarak entegre olduğunu göstermiştir. Bu tür hücre değiştirme yaklaşımının gelecekteki bir klinik uygulaması için, tercih edilen hücrelerin saflaştırılmış süspansiyonlarının üretilmesi ve göze uygun entegrasyon için doğru konuma yerleştirilmesi gerekir. Fotoreceptör öncüllerinin zenginleştirilmesi için, donör hücrelerin genetik muhabir modifikasyonunun önlenmesi için sıralama belirli hücre yüzeyi antijenlerine dayanmalıdır. Burada manyetik ilişkili hücre sıralamasını (MACS) gösteriyoruz - hücre yüzeyi işaretleyici CD73'e dayanarak fotoreceptöre özgü muhabir farelerin yenidoğan retinasından izole edilen nakledilebilir çubuk fotoreceptör öncüllerinin zenginleştirilmesi. Anti-CD73 antikorları ile inkübasyon ve ardından mikro boncuk konjuge sekonder antikorlar, çubuk fotoreceptör öncüllerinin MACS tarafından zenginleştirilmesini yaklaşık% 90'a kadar sağladı. Akış sitometrisine kıyasla MACS, GMP standartlarına daha kolay uygulanabilmesi ve yüksek miktarda hücrenin nispeten kısa zaman periyotlarında sıralanabilmesi avantajına sahiptir. Zenginleştirilmiş hücre süspansiyonlarının yetişkin vahşi tip farelerin alt alanına enjekte etmesi, sıralanmamış hücre süspansiyonlarına kıyasla 3 kat daha yüksek entegrasyon oranına neden oldu.
Giriş
Görme, insanların en önemli duyularından biridir. Bu duygunun bozulması ve körlük, sanayileşmiş ülkelerde engelliliğin başlıca nedenlerinden biridir. Görme bozukluğu veya körlüğün baskın nedeni, makula dejenerasyonu, retinitis pigmentosa, koni-çubuk distrofisi ve diğer durumlarda gözlenebildiği gibi fotoreceptör hücre kaybı ile karakterize retina dejenerasyonudur. Bugüne kadar, kayıp görüşü geri yüklemek için etkili bir tedavi mevcut değildir. 2006 ve 2008'de birbirinden bağımsız iki farklı laboratuvar rapor edildi, çubuk fotoreceptör öncül hücrelerinin yetişkin vahşi tip fare retinalarına başarılı bir şekilde nakli1,2. Böylece, fotoreceptör öncüsü hücre nakli olasılığının da dejenere bir retinaya dönüşmesi, dejenere fotoreceptörlerin yerini alması ve görmeyi geri kazanma olasılığı ortaya çıkmıştır. Nitekim, son zamanlarda gösterilmiştir. bu tür nakledilen fotoreceptör öncül hücrelerin, düzgün bir şekilde geliştirilen dış segmentler3, endojen bipolar hücrelere yakın sinaptik terminaller ve dış nükleer katman2-4'tebulunan yuvarlak bir hücre gövdesi gibi olgun vahşi tip fotoreceptörlerin morfolojik kriterlerini ortaya çıkardığı ve ayrıca5-7ana sinir devresine işlevsel olarak entegre olma yeteneği . Bu stratejinin ana ilkelerinden biri, doğum sonrası 4. gün (PN 4, PN0 doğum günü olarak tanımlanır) genç fare retinalarının kullanılmasıdır ve bu da transplantasyon için farklı hücre tiplerinin bir karışımı ile sonuçlanır. Gelecekteki bir terapötik uygulamanın arka planında, bu karışımın fotoreceptör öncül hücreler için saflaştırılması gerekir. CD73 retina8-10genç fotoreceptörler için özel ilk hücre yüzey belirteci olarak tanımlanmıştır. Burada, bu hücre yüzeyi işaretleyicisine dayanan ve manyetik ilişkili hücre sıralama (MACS) tekniğinin kullanıldığı bir fotoreceptör öncül hücre temizleme yöntemini gösteriyoruz. MACS, hızlı sıralama süreleri ve GMP koşullarına daha kolay uyum sağladığı için floresanla etkinleştirilen hücre sıralama tekniklerine kıyasla avantajlara sahip olabilir. Zenginleştirilmiş popülasyonu yetişkin vahşi tip retinalarda alt alana nakledirken ~%90 zenginleştirme ve 3 kata kadar daha yüksek entegrasyon oranı gösterebiliriz. Bu nedenle, MACS tabanlı fotoreceptör öncül hücre zenginleştirme ve subretinal transplantasyon, retina dejenerasyonu tedavisi için rejeneratif terapötik stratejinin geliştirilmesi için güvenilir ve umut verici tekniklerdir.
Protokol
Hayvanların etik kullanımı ve bakımı beyanı:
Tüm hayvan deneyleri Avrupa Birliği ve Alman yasalarına (Tierschutzgesetz) sıkı bir şekilde uygun olarak gerçekleştirildi ve ARVO Oftalmik ve Vizyon Araştırmalarında Hayvanların Kullanımı Beyanı'na bağlı kaldı. Tüm hayvan deneyleri TU Dresden ve Landesdirektion Dresden hayvan etik komitesi tarafından onaylanmıştır (onay numarası: 24D-9168.11-1/2008-33).
1. Hücre Ayrıştırma ve Hücre Sıralamaya Başlamadan Önce
- Üç 15 ml reaksiyon tüpünü şu şekilde etiketle: Yıkama (W), Pozitif fraksiyon (+) ve Negatif fraksiyon (-).
2. Retina Ayrışması
- Bir makas kullanarak PN 4 yavrularının kafasını koparın.
- Yavruların başını kısa bir süre içinde% 70 etanolde durulayın ve ardından PBS'de yıkayın.
- Başı soğuk HBSS'ye aktarın ve gözü enükle edin (bu adımı tüm kafalar için tekrarlayın). Enükle etmek için göz kapaklarını açın ve gözü optik sinir bölgesinde kavisli tokmaklarla sabitlayın. Sonra gözü dikkatlice yörüngeden çıkarın.
- Tüm gözleri kaplattıktan sonra retinayı izole edin: optik sinire kapalı bir makas sokun ve bıçakları açın. Peal RPE/chorid dışarı. Kavisli kümesleri kullanarak lensleri ve kan damarlarını çıkarın.
- İzole retinaları papain çözeltisini içeren 1,5 ml reaksiyon tüpüne aktarın (papain ayrışma kiti tarafından sağlanır).
- Retinaları papain çözeltisinde 37 °C'de bir su banyosunda veya çalkalayıcıda (400 rpm) 30-60 dakika kuluçkaya yatırın.
- Retinalar papain çözeltisinde kuluçkaya yatarken, pipet 15 ml reaksiyon tüpüne (etiket "1") 1 ml ovomucoid çözeltisi.
- 15 ml reaksiyon tüpüne (etiket "2") 60 μl DNase I (10 mg/ml) + 60 μl ovomucoid çözeltisi (kit tarafından sağlanır) + 520 μl EBSS ekleyin.
- Papain inkübasyonundan sonra, kısmen sindirilmiş retinaları içeren papain çözeltisini reaksiyon tüpü "2"ye aktarın.
- Yangın cilalı pipet kullanarak mekanik ayrışma (10x yukarı ve aşağı) gerçekleştirin.
- Pipet tek hücre süspansiyon reaksiyon tüpü "1". Hücre süspansiyonu ovomucoid çözeltisinin üzerine hafifçe katlayarak 2 katman oluşturmaya çalışın.
- 300 x g'da (yaklaşık 1.300 rpm) 5 dakika santrifüj.
- Üstnatant atın ve hücreleri 500 μl MACS tamponunda yeniden biriktirin.
3. Manyetik İlişkili Hücre Sıralama (MACS) Kullanarak Hücre Sıralama
- 10 μg/ ml'lik son konsantrasyonu elde etmek için 500 μl'ye X μl sıçan anti-CD73 antikoru ekleyin.
- Buzda 5 dakika kuluçkaya yaslanın.
- 15 ml reaksiyon tüpünü MACS tamponu ile 10 ml'ye doldurun ve 300 x g hızında 5 dakika santrifüj edin.
- Üsttekini çıkarın.
- Peleti 480 μl MACS tamponunda yeniden sakla ve 120 μl keçi anti-sıçan IgG mikrobead ekleyin.
- Buz üzerinde 15 dakika kuluçkaya yatır; karıştırmayın, sallamayın veya karıştırmayın.
- 15 ml reaksiyon tüpünü MACS tamponu ile 5 ml'ye doldurun ve 300 x g'da 5 dakika santrifüj edin.
- Reaksiyon tüpü santrifüjlendikçe:
- LS Sütununu manyetik standa ayarlayın.
- Önsezi filtresini LS Sütunu'nun üstüne yerleştirin.
- Önsezim filtresini ve LS Sütununu 3 ml MACS tamponu ile nemlendirin ve MACS tamponunu yıkama (W) tüpüne toplayın.
- Üsttekini çıkarın.
- Peletin 500 μl MACS tamponunda yeniden süzülür.
- 500 μl hücre süspansiyonunu filtreye yükleyin, ardından filtreye 1 ml MACS tamponu ekleyin ve negatif fraksiyonu negatif fraksiyon (-) reaksiyon tüpüne toplayın.
- Ardından, sütuna bağlı olmayan hücreleri yıkamak için sütuna 3 x 3 ml MACS arabelleği ekleyin
- Bu 9 ml LS Sütunundan geçtikten sonra, sütunu manyetik standdan çıkarın ve pozitif fraksiyon (+) reaksiyon tüpünün üzerine takın.
- LS Sütununa hızlı bir şekilde 5 ml MACS arabelleği yükleyin ve pistonu LS Sütununa koyun ve tüm arabellek sütundan geçene kadar bastırın.
- Pozitif fraksiyonu içeren reaksiyon tüpünü 300 x g'da 5 dakika santrifüj edin.
- Üst düğmeyi çıkarın, 500 μl MACS tamponunda yeniden dirilin ve 4 °C'de tutun.
- Ortak bir hücre sayma aygıtı kullanarak toplam hücre miktarını sayın.
- MACS tamponunda 2 x 105 hücre/μl içeren pozitif sıralanmış fraksiyondan bir hücre süspansiyonu hazırlayın ve 4 °C'de tutun
4. MAC sıralı Fotoreceptör Öncü Hücrelerin Fare Retinasına Nakli
- Aşağıdaki çözümlerin tümünde hazır olduğundan emin olun: 1 ml steril PBS veya HBSS, 10 μl DNASE I, 1-2 ml steril deiyonize H2O, hücre süspansiyon fraksiyonlarının aliquots 4 °C.
- Yetişkin fareyi(yani 2-4 aylık) medetomidin hidroklorür intraperitoneal enjeksiyonu (0.01 mg/10 g vücut ağırlığı), ketamin (0.75 mg/10 g vücut ağırlığı) ile uyuşturun. Daha sonra ağrı kesici için buprenorfin (0.05 mg / kg vücut ağırlığı) deri altı enjeksiyonu yapın.
- Fenilofilin düşüşü olan genişlemiş gözbebekleri %2.5-Tropicamid %0.5.
- Fareyi fare başı tutucusuna sabitle ve stereo mikroskop altına yerleştirin.
- Gözün kurumasını önlemek için bir damla Vizidik jel uygulayın.
- İğnede steril 30 G 1/2 kullanarak sklera ve kornea (sırasıyla ora serrata)arasındaki sınırda küçük bir delik açın.
- Ortak bir kapak kaydıramasını elmas bir kalem kullanarak küçük (yaklaşık 5 mm x 5 mm) parçalar halinde kesin, bu parçalardan birini korneanın üzerine yerleştirin ve retinanın doğrudan görselleştirilmesini sağlar.
- Presterilize mikroliter şırıngasını deiyonize su ile birkaç kez yıkayın.
- Mikroliter şırıngayı 1 μl hücre süspansiyonu ile yükleyin, konjonktiva ve sklera yoluyla teğetsel olarak doğrudan iğne yapın ve retinanın burun yarısında görsel kontrol altına yerleştirin.
- Alt alana ulaşana kadar retinaya hafifçe bir delik açın, hücre süspansiyonu alt alana enjekte edin.
- Retina alanının yaklaşık 1/4'lerini kanama olmadan kaplayan, düzgün olması gereken retinanın büllöz kopuşunun gözlemlenmesi.
- Şırındıcı nazikçe çekin, retina deliği otomatik olarak kapanır.
- Mikroliter şırıngasını deiyonize suyla birkaç kez yıkayın.
- Fareyi baş tutucudan serbest bırakın.
- Medetomidin hidroklorür etkisinin tersine çevrilmesi için atipamozol hidroklorür enjekte ederek fareyi uyandırın.
- Uyanma süresi için fareyi sıcak karanlık odaya (yaklaşık 25 °C) yerleştirin.
- Transplantasyondan sonraki 2 gün sonra, Ağrı kesici için sabah ve öğleden sonra deri altı enjeksiyonu ile Buprenorfin (0.05 mg/kg vücut ağırlığı) uygulanmalıdır.
Sonuçlar
Çubuk fotoreseptörlerin fare retinasına entegre olma yeteneğini değerlendirmek için, GFP'nin nöral retina lösin fermuarı (Nrl, Nrl-GFP) promotörü11tarafından yönlendirildiği bir fare muhabir hattı kullanılmıştır. Nrl, yetişkinlik boyunca E12.5'te ekspresyonunu başlatan ve donör çubuk fotoreceptör hücrelerinin belirli bir şekilde etiketlenebilmesini sağlayan çubuk fotoreceptörlerin en erken belirtecidir.
PN 4 Nrl-GFP yavrularının kafası kesildi ve gözler enükle edildi. Retinalar daha sonra yukarıda açıklanan yöntem kullanılarak izole edildi ve ayrıştırıldı. Elde edilen hücre süspansiyonu daha sonra CD73 tabanlı MACS (Şekil 1 ve 2)kullanılarak sıralandı. MAC sıralamasını takiben, bu prosedür sırasında elde edilen zenginleştirmeyi analiz ettik.
Şekil 3A'dagösterildiği gibi, ilk hücre süspansiyonu (Giriş) % 30,4 GFP pozitif hücreler içeriyordu, yani. çubuk fotoreceptörler. CD73 tabanlı MAC sıralamanın ardından akış sitometrisi ile CD73 pozitif fraksiyonda (CD73+) %86,9'a varan bir zenginleşme gözlendi. CD73-negatif fraksiyonda (CD73-) tüm hücrelerin sadece% 9.9'u GFP için pozitif olarak tespit edildi (Şekil 3A). CD73 tabanlı MACS'i takiben Nrl-GFP pozitif hücrelerinin zenginleştirilmesi ayrıca in vitro kaplamadan sonra görselleştirilir (Şekil 3B).
MAC-tasnif edildikten sonra, CD73 pozitif fraksiyondaki donör hücreler aşağı doğru döndürüldü ve 200.000 hücre/μl'lik son konsantrasyona geri çağrıldı. Bu hücre süspansiyonu ayrıca vahşi tip konak retinaların alt alanına nakil için kullanılmıştır (Şekil 4). Transplantasyondan üç ila dört hafta sonra konak retinalar sabitlendi, izole edildi ve bölümlendi. Konakçıların dış nükleer tabakasına entegre edilen ve dış nükleer tabakada hücre gövdesinin lokalizasyonu ve sinaptik sferüllerin ve iç segmentlerin oluşumu ile olgun fotoreceptörlerin morfolojisini edinmiş çeşitli donör hücreler (Şekil 5). Daha önce grubumuz3,8 tarafından, diğer gruplar tarafından retina barındırmak için nakledilen FAC sıralı hücrelerle karşılaştırılabilir bir sonuç gösteren ayrıntılı resimler yayınlanmıştır4,6,10. Tüm bu çalışmalarda tutarlı olan, nakledilen hücrelerin büllöz müstakil konak retina tarafından tanımlanan enjeksiyon yerinde kalması ve göç etmemeleridir. Bazıları konak retinaya(yani dış nükleer katmana) entegre edilir ve bazıları alt alanda kalır3. Ek olarak, donör hücrelerin entegrasyon yerindeki dağılımının kullanılan fare modelinin türüne bağlı olduğu gösterilmiştir5. C57BL/6J fareler arasındaki transplantasyonlarda akut konakçı/greft ret belirtisi saptanmedi.
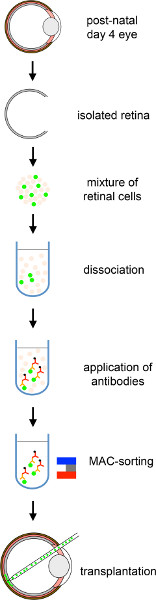
Şekil 1. MACS saflaştırılmış fotoreceptör öncüllerinin yetişkin fare retinasına subretinal transplantasyonunun genel şeması. PN 4 Nrl-GFP yavrularından gelen donör hücreler izole edilir, ardından CD73 tabanlı MAC-sıralama ve fare konak retinalarının alt alanına nakledilir. Daha büyük bir rakam görüntülemek için burayı tıklatın.
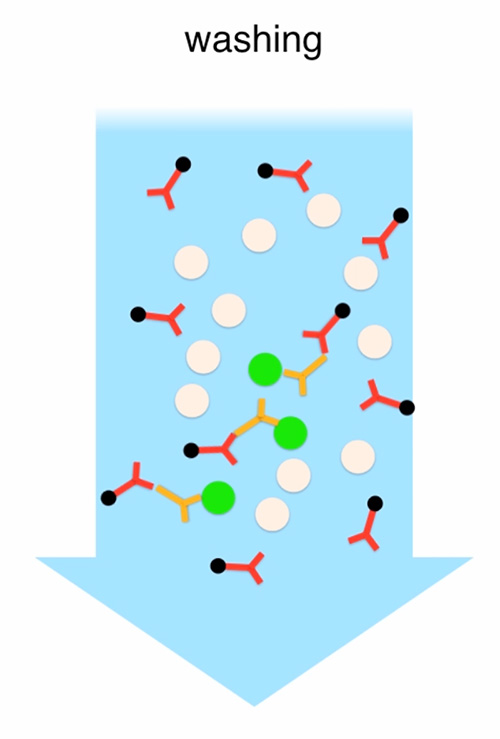
Şekil 2. MacS tarafından nakledilebilir fotoreceptörlerin zenginleştirilmesi. Toplanan tüm PN4 retinalardan üretilen hücre süspansiyonu, birincil sıçan anti-CD73 antikorları ile inkübe edilir ve ardından mikrobeadlarla konjuge edilen anti-sıçan antikorları ile yıkama ve inkübasyon yapılır. İlişkisiz antikorlar yıkanır. Hücre süspansiyonu manyetik bir standla bağlı bir LS sütunundan geçirilir. Antikorlara bağlı hücreler sütuna bağlı kalırken, kalan hücreler eluted ve toplanır (CD73-negatif fraksiyon). Son olarak, LS sütunu manyetik standdan çıkarılır ve kalan hücreler elde edilir ve toplanır (CD73-pozitif fraksiyon). Filmin tamamını görüntülemek için burayı tıklatın.

Şekil 3. CD73 tabanlı MAC sıralamasını takiben Nrl-GFP pozitif hücre zenginleştirme analizi. (A) Sıralamadan önce, donör hücrelerin ilk popülasyonu Nrl-GFP pozitif hücrelerinin% 30.4'ünü içeriyordu. MAC sıralamasını takiben, CD73+ fraksiyonunda (%86,9) GFP pozitif hücrelerin zenginleştirilmesi tespit edilebilir CD73 fraksiyonu sadece düşük miktarda GFP+ hücresi (%9,9) içeriyordu. (B) PN4 Nrl-GFP hücrelerinin CD73 tabanlı MAC sıralama sonucunu gösteren temsili görüntü. Her fraksiyondan 1 milyon hücre laminin kaplı kapaklar üzerine kaplandı. Hücreler 10 dakika boyunca % 4 PFA ile kaplandıktan sonra 4 saat sabitlendi. Hücreler DAPI ile boyandı (4',6-diamidino-2-fenilindole, 1:20.000). Cd73+ fraksiyonunda GFP pozitif hücrelerin önemli bir zenginleşmesi, giriş fraksiyonu veya CD73 fraksiyonu ile karşılaştırıldığında gözlendi. Daha büyük bir rakam görüntülemek için burayı tıklatın.

Şekil 4. Subretinal enjeksiyon. Transplantasyon işleminin yetişkin fare retinasına şematik çizimi. İğne ora serratadakibir delikten yerleştirilir , lense dokunmaktan kaçınarak vitreal alanda gezinilir ve görsel kontrol altında retinaya yerleştirilir. Hafifçe itilerek, iğne retinadan geçirilir ve alt alana yerleştirilir. Sonunda, hücre süspansiyonu, ayırma işlemi değerlendirilerek görsel kontrol altında dikkatlice enjekte edilir.
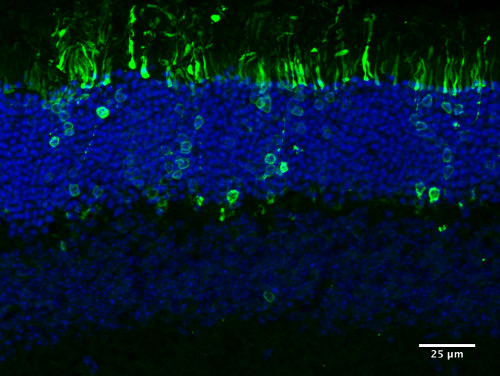
Şekil 5. Nakledilen fotoreceptör hücrelerinin entegrasyonu. Entegre CD73 tabanlı MACS'i gösteren temsili resim, yetişkin fare retinasına naklin ardından PN4 Nrl-GFP hücrelerini sıraladı. Nakledilen fotoreceptör öncülleri dış nükleer katmana (ONL) doğru bir şekilde entegre olur ve olgun fotoreceptör morfolojisi oluşturur.
Tartışmalar
Fotoreceptör öncül hücrelerin subretinal nakli, bu ışığa duyarlı hücrelerin ana bilgisayar retinalarına önemli sayılarda entegrasyonunu sağlamak için güvenilir bir aracı temsil eder1,2. Bu, gelecekte retina dejeneratif hastalıkların tedavisi için bir hücre tedavisi kurulmasına izin verebilir6. Şu anda PN 4 retinalarından izole edilmiş olan hücrelerin donör popülasyonu, subretinal enjeksiyondan sonra sadece fotoreceptör öncül hücrelerin entegre olduğu farklı hücre türlerinin bir karışımıdır. CD73 tabanlı MAC sıralama kullanılarak, donör hücre süspansiyonu içindeki fotoreceptörlerin oranı% 90'≈ yükseltilebilir, bu da sıralanmamış hücre popülasyonu ile karşılaştırıldığında vahşi tip konak retinalarda yaklaşık 3 kat daha yüksek bir entegrasyon oranı sağlar8. Akış sitometrisine kıyasla, MACS hızlı bir sıralama prosedürü avantajına sahiptir ve GMP standartlarına nispeten kolay uygulanabilir. Nakledilebilir fotoreceptörlerin saflaştırılması, pluripotent kök hücrelerden fotoreceptörlerin in vitro üretimi için son avantajlar ışığında özel ilgi çekicidir12-14. Farklılaştırılmış pluripotent kök hücre kültürleri, belirli sıralama prosedürlerinin kullanılabilirliğini hücre nakli tedavilerinde gelecekteki kullanımları için önemli bir ön koşul haline getiren çeşitli hücre türlerinden oluşur.
MACS temizleme prosedürüne göre, birkaç nokta dikkat çekicidir ve büyük rahatsızlıklar olmadan bir iş akışı sağlar. Sıralanacak retina sayısı ne kadar yüksek olursa, sindirimleri için o kadar fazla zamana ihtiyaç vardır. Sindirimden sonra, sıralama prosedürü sırasında, hücrelerin toplanmasından kaçınılmalıdır. Bu tercihen ikincil antikorun eklenmesinden önce ve inkübasyonu sırasında meydana gelir. Bu durumda, agrega derhal bir pipetle çıkarılmalıdır. MACS negatif fraksiyonunu toplarken MACS tamponunun elüasyonu sırasında, sütuna 3 ml'den fazla eklememek kesinlikle gereklidir. 3 ml'den fazla arabellek eklenirse arabelleğin sütuna baskısı çok yüksek olacaktır. Bu, antikorun hücrelere bağlanmasını bozacak ve sıralama verimliliğini düşürecektir. MACS pozitif fraksiyonu toplamaya başlamak için sütunu manyetik standdan çıkarırken, bu adımın hızlı bir şekilde yapılması gerekir. 5 ml MACS arabelleği sütuna mümkün olduğunca hızlı eklenmelidir. Ayrıca, dalma, tüm arabellek sütundan geçene kadar hızlı bir şekilde konulmalı ve bastırılmalıdır. Uygulanan basınç hakkında endişelenmenize gerek yoktur. MACS tamponu izotoniktir ve değiştirilebilir. FACS arabelleği, hücre kültürü ortamı, PBS, EBSS veya HBSS kullanmak mümkündür. Tamponun sterilitesi 0,4 μm filtre zarı ile filtre edilerek elde edilebilir.
MACS ile zenginleştikten sonra aşağıdaki noktalar göz önünde bulundurularak donör hücrelerin alt mektinaya başarılı bir şekilde nakli sağlanabilir. Fotoreceptör hücreleri tedavi ex vivo için çok hassas göründüğünden, onları gerektiğinden daha uzun süre 4 ° C'de tutmanız tavsiye edilmez. Mümkün olduğunca çabuk transplantasyona devam edin. Enjeksiyon iğnesini göz küresine yerleştirirken, nispeten keskin metal iğne lense zarar verebileceğinden lense dokunmaktan kaçınmak önemlidir ve bu da lens kaynaklı üveit indüksiyonuna neden olabilir. Alt bölüm uzayı yolundaki son adım, retinanın penetrasyonu çok önemlidir. Subretinal alana ulaşılıp ulaşılmadığı görsel olarak gözlemlenemediğinden, doğru itme basıncı ve doku direnci için bir his geliştirmek önemlidir. Test etmek için, iğne kafası doğru yerleştirilirse, küçük bir hacim uygulanabilir ve iğne başındaki retinanın kopması dikkatlice gözlemlenmelidir. Kanama olmadan yuvarlak, büllöz bir kopma oluşuyorsa, pozisyon doğrudur ve çözeltinin geri kalanı dikkatlice uygulanabilir. Enjeksiyon sırasında, dokuya daha fazla zarar vermemek için iğne yerinde kalmalıdır. Enjeksiyon iğnesi tarafından oluşturulan retina deliği, iğne yavaşça geri çekilirse kendiliğinden kapatılır. Tüm prosedür, daha fazla stres ve hayvana zarar vermemek için mümkün olan en az sürede yapılmalıdır. Transplantasyon sırasında hücre süspansiyonu mikroliter şırıngasını topaklama ve engelleme eğilimindedir. Bu durumda, steril PBS veya HBSS kullanılarak hücre süspansiyonunun seyreltilmesi önerilir. Bu sorunun üstesinden gelmek için başka bir olasılık, hücre süspansiyonuna 1 μl DNASE I eklemek, canlı hücreleri birbirine yapıştırma eğiliminde olan ölü hücrelerden DNA kümelerini çözmektir.
Bu protokol hücrelerin manyetik sıralama ile sınırlıdır. Bu nedenle, hücreler sıralama turu başına yalnızca bir işaretleyici için sıralanabilir. Hücrelerin aynı anda farklı belirteçler (fizyolojik özellikler ve farklı hücre yüzey belirteçleri dahil) kullanılarak sıralanabildiği akış sitometrisine kıyasla, bu tekniğin önemli bir dezavantajıdır. Kısa bir süre içinde farklı işaretçiler için sıralama gerektiğinde, akış sitometrisi daha iyi bir çözüm olabilir. Ayrıca, transgenik olarak ifade edilen GFP veya diğer yaşam hücresi belirteçleri gibi hücrelerin floresan özellikleri için sıralama bu teknikle mümkün değildir. Şu anda manyetik boncuklarla eşlenebilen hücre yüzeyi antikorlarının kullanımı ile sınırlıdır. Bununla birlikte, bu teknik kullanılan teknik ekipmana göre ölçeklendirilebilir.
Miltenyi Biotec şu anda manyetik hücre sıralama araçlarının tek sağlayıcısı olduğundan, bugüne kadar mevcut bir alternatif yoktur. Hücre ayrışması için papain(yani tripsin) dışında başka enzimler de kullanılabilir. Not olarak, laboratuvarımız papain ile en iyi sonuçları elde etti, çünkü bu elimizdeki en nazik ayrışma enzimi gibi görünüyor. Papain sindiriminin zaman aralığı (30-60 dk) değişkendir. Bu süre zarfında laboratuvarımızda optimal sindirim sağlandı. Numune boyutuna, numune kalitesine ve kullanılan enzime bağlı olarak daha kısa veya daha uzun kuluçka süresi gerekebilir. Bireysel test önerilir.
Tek adımlı MACS'in akış sitometrisi kadar yüksek saflık seviyelerine ulaşmadığı göz önüne alındığında, bu tekniğin olası bir uygulaması istenmeyen ve potansiyel zararlı hücrelerin negatif olarak sıralanabilir. Orada, belirli bir hücre yüzeyi işaretçisi için pozitif olan ancak ilgilenmeyen hücre fraksiyonu sıralanabilir ve ilginin kesirini akışta yalıtılabilir. Bu, önceden veya olumlu bir sıralama adımından sonra yapılabilir ve farklı hücre yüzey belirteçleri kullanan hücrelerin daha fazla ayırt edilmesine ve besleyici katman hücreleri veya farklılaşmamış hücreler gibi istenmeyen hücrelerin potansiyel tümörojenik riskleriyle pluripotent kök hücre kültürlerinden uzaklaştırılmasına izin verir. Bu nedenle MACS, yüksek miktarda kültürlü hücrenin saflaştırılması için nazik, hızlı ve basit bir tedaviyi temsil ettiği için gelecekteki olası terapötik uygulamalarda fotoreceptörlerin ES veya iPS hücre kültürlerinden arındırılması için uygun olabilir. Macs, GMP koşullarına kolayca uygulanabilir, çünkü sıralama adımlarının ayrıntıları, yani mekanik, sıvılar ve prosedürler akış sitometrisine kıyasla azalır. MACS'in kan veya kemik iliği hücrelerinin zenginleştirilmesi için klinik çalışmalarda zaten rutin olarak kullanılması dikkat çekicidir. İlginçtir ki, MACS, uygun bir hücre yüzeyi işaretçisi olmadığında hücrelere bile uygulanabilir, hücreleri sonraki manyetik hücre sıralama adımları için "yetkin" hale getirmek için genetik olarak bir yüzey işaretleyicisi tanıtarak15.
Özetle MACS, transplantasyon çalışmaları için hücre yüzey belirteçlerini kullanarak fotoreceptör öncül hücrelerini zenginleştirmek için güvenilir ve hızlı bir aracı temsil etmektedir. Ayrıca, GMP koşulları gerektiren gelecekteki klinik uygulamalar için kolayca değiştirilebilir bir yöntemdir.
Açıklamalar
Yazarlar rakip finansal çıkarlar beyan etmemektedir.
Teşekkürler
Nrl-GFP fareleri sağladığı için Anand Swaroop'a, teknik destek için Jochen Haas'a ve hayvancılık için Sindy Böhme ve Emely Lessmann'a teşekkür ederiz.
Bu çalışma Deutsche Forschungsgemeinschaft (DFG) tarafından desteklenmiştir: FZT 111 - Rejeneratif Terapiler Merkezi Dresden, CRTD Tohum Hibe Programı, SFB 655 ve ProRetina e.V. vakıf, DIGS-BB Lisansüstü Programı Dresden ve Fundação para a Ciência e Tecnologia (SFRH/BD/60787/2009)
Malzemeler
| Name | Company | Catalog Number | Comments |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | supplied DNase I is not used in the method |
| Purified rat anti-mouse CD73, clone TY/23 | BD Pharmingen | 550738 | Stock concentration 0.5 mg/ml |
| Goat Anti-Rat IgG MicroBeads | Miltenyi | 130-048-501 | Total volume of 2 ml |
| PBS | Gibco | 10010-015 | Used to count the total number of cells |
| DNase I | Sigma | D5025-150KU | |
| HBSS | Gibco | 14025050 | Used for dissociation of the retinas |
| Trypan blue | Sigma | Fluka93595 | Used to count the total number of cells |
| Vidisic | Dr. Mann Pharma / Andreae-Noris Zahn AG | ||
| Domitor | Pfizer | 76579 | |
| Ketamine 10% | Ratiopharm | 7538843 | |
| Antisedan | Pfizer | 76590 | |
| Phenylephrin 2.5%-Tropicamid 0.5% | University Clinics Dresden Pharmacy | ||
| Preseparation Filters | Miltenyi | 130-041-407 | |
| LS Columns | Miltenyi | 130-042-401 | |
| MACS MultiStand | Miltenyi | 130-042-303 | |
| QuadroMACS Separator | Miltenyi | 130-090-976 | |
| Fire polish glass Pasteur pipette | Brand | 74777 20 | The pipette’s tips need to be fire-polished and autoclaved. |
| MACS 15 ml tube rack | Miltenyi | 130-091-052 | |
| Cell count chamber | Carl Roth | T728.1 | |
| Sterile 15 ml tubes | Greiner Bio-One | 188271 | |
| Leica M651 MSD | Leica | M651 MSD | can be used instead of Olympus SZX10 |
| Olympus SZX10 | Olympus | SZX10 | can be used instead of Leica M651 MSD |
| Olympus inverted stereo microscope CKX41 | Olympus | CKX41 | |
| Cell culture hood Thermo Scientific MSC-Advance | Thermo Scientific | 51025411 | |
| 1.5 ml Reaction tube | Sarstedt | 727706400 | |
| 2 ml Reaction tube | Sarstedt | 72695 | |
| Eppendorf Centrifuge 5702 | VWR (Eppendorf) | 521-0733 | |
| Mouse head holder | myNeurolab | 471030 | |
| BD Microlance 3 30 G 1/2 in | BD Pharmingen | 304000 | |
| Hamilton microliter syringe 5 µl, 75RN | Hamilton | 065-7634-01 | delivered without needles |
| Hamilton RN special needle 34 G | Hamilton | 065-207434 | Blunt, 12 mm length |
| Vannas-Tübingen Spring Scissors - 5 mm Blades Straight | Fine Science Tools | 15003-08 | |
| Dumont #7 Forceps - Titanium Biologie | Fine Science Tools | 11272-40 | |
| Diamond pen | Tools-tech | ||
| 15 mm x 15 mm Cover slips | Sparks | MIC3366 |
Referanslar
- Bartsch, U., et al. Retinal cells integrate into the outer nuclear layer and differentiate into mature photoreceptors after subretinal transplantation into adult mice. Exp. Eye Res. 86, 691-700 (2008).
- MacLaren, R. E., et al. Retinal repair by transplantation of photoreceptor precursors. Nature. 444, 203-207 (2006).
- Eberle, D., et al. Outer segment formation of transplanted photoreceptor precursor cells. PLoS One. 7, (2012).
- Lakowski, J., et al. Cone and rod photoreceptor transplantation in models of the childhood retinopathy Leber congenital amaurosis using flow-sorted Crx-positive donor cells. Hum. Mol. Genet. 19, 4545-4559 (2010).
- Barber, A. C., et al. Repair of the degenerate retina by photoreceptor transplantation. Proc. Natl. Acad. Sci. U.S.A. 110, 354-359 (2013).
- Pearson, R. A., et al. Restoration of vision after transplantation of photoreceptors. Nature. , (2012).
- Singh, M. S., et al. Reversal of end-stage retinal degeneration and restoration of visual function by photoreceptor transplantation. Proc. Natl. Acad. Sci. U.S.A. 110, (2013).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Invest. Ophthalmol. Vis. Sci. 52, 6462-6471 (2011).
- Koso, H., et al. CD73, a novel cell surface antigen that characterizes retinal photoreceptor precursor cells. Invest. Ophthalmol. Vis. Sci. 50, 5411-5418 (2009).
- Lakowski, J., et al. Effective transplantation of photoreceptor precursor cells selected via cell surface antigen expression. Stem Cells. 29, 1391-1404 (2011).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proc. Natl. Acad. Sci. U.S.A. 103, 3890-3895 (2006).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Osakada, F., et al. Toward the generation of rod and cone photoreceptors from mouse, monkey and human embryonic stem cells. Nat. Biotechnol. 26, 215-224 (2008).
- Lee, M. Y., Lufkin, T. Development of the "Three-step MACS": a novel strategy for isolating rare cell populations in the absence of known cell surface markers from complex animal tissue. J. Biomol. Tech. 23, 69-77 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır