Method Article
MACS纯化光感受器前体细胞的亚视移植到成年小鼠视网膜中
摘要
细胞移植是治疗视网膜退化的一种策略,其特征是光感受器丧失。在这里,我们描述了一种丰富可移植光感受器及其亚视移植到成年小鼠的方法。
摘要
视网膜光感细胞( 即 光感受器)的丧失导致视力障碍和失明,是工业化国家残疾的主要原因。通过细胞移植取代退化的光感受器是未来临床应用中一种可能的治疗选择。事实上,最近的临床前研究表明,在产后第4天从新生儿小鼠视网膜中分离出来的不成熟的光感受器,在亚视网膜移植后有可能融入成年小鼠视网膜。供体细胞产生成熟的光感受器形态,包括内段和外段、位于外核层的圆形细胞体和靠近内源性双极细胞的突触终端。事实上,最近的报告显示,供体光感受器在功能上融入宿主小鼠的神经回路。对于这种细胞替代方法的未来临床应用,必须生成选择细胞的纯化悬浮,并放置在正确的位置,以便正确地融入眼睛。对于光感受器前体的丰富,排序应基于特定的细胞表面抗原,以避免遗传报告器对供体细胞进行改造。在这里,我们显示磁相关细胞分拣 (MACS) - 丰富可移植棒光感受器前体分离出的新生儿网膜的光感受器特异性记者小鼠基于细胞表面标记CD73。与抗CD73抗体的孵化,以及微珠结合的二次抗体,使MACS的棒光感受器前体的丰富度接近90%。与流动细胞学相比,MACS 的优势在于它可以更容易地应用于 GMP 标准,并且可以在相对较短的时间内对大量细胞进行排序。将富集细胞悬浮液注入成年野生型小鼠的亚视空间,与未分类的细胞悬浮相比,整合率高3倍。
引言
视觉是人类的主要感觉之一。这种意识的损害和失明是工业化国家残疾的主要原因之一。视力障碍或失明的主要原因是视网膜退化,其特征是光感受器细胞丧失,因为它可以在黄斑变性、视网膜炎色素瘤、锥形杆营养不良和其他疾病中观察到。迄今为止,还没有有效的治疗方法来恢复视力丧失。2006年和2008年,两个不同的实验室分别报告,成功将杆光感受器前体细胞移植到成年野生型小鼠视网膜1,2。因此,产生光感受器前体细胞移植的可能性也到退化视网膜,以取代退化的光感受器和恢复视力。事实上,最近已经证明,这种移植的光感受器前体细胞引起成熟野生型光感受器的形态学标准,如正确开发的外段3、靠近内源性双极细胞的突触终端和位于外核层2-4的圆形细胞体,以及功能集成到主动脉电路5-7的能力。这一策略的主要原则之一是使用产后第4天(PN 4,PN0定义为出生日)幼鼠视网膜,从而产生不同细胞类型的混合移植。在未来治疗应用的背景下,这种混合物必须纯化为光感受器前体细胞。CD73被描述为第一个细胞表面标记,专门为年轻的光感受器在网膜8-10。在这里,我们演示了基于此细胞表面标记的光感知器前体细胞净化方法,并采用了磁相关细胞分拣 (MACS) 技术。与荧光激活的细胞分拣技术相比,MACS 可能有优势,因为分拣时间快,对 GMP 条件的调整也更容易。当将富集的人口移植到成人野生型视网膜的亚视网膜空间时,我们可以证明其富足度为 90%,融合率高达 3 倍。因此,基于MACS的光感受器前体细胞富集和亚视网膜移植,是开发视网膜退化治疗再生治疗策略的可靠和有前途的技术。
研究方案
动物的道德使用和护理声明:
所有动物实验都是严格按照欧盟和德国法律进行的,并遵守了《关于在眼科和视觉研究中使用动物的ARVO声明》。所有动物实验均得到德累斯顿和德累斯顿陆地动物伦理委员会的批准(批准编号:24D-9168.11-1/2008-33)。
1. 在开始细胞分离和细胞排序之前
- 标记三个 15 毫升反应管:洗涤 (W)、正分 (+) 和负分数 (-)。
2. 视网膜分离
- 用剪刀斩首PN 4幼崽。
- 不久后用70%的乙醇冲洗幼崽的头部,然后用PBS清洗。
- 将头部转移到寒冷的 HBSS 并诱导眼睛(为所有头部重复此步骤)。要进行诱导,打开眼睑,在视神经区域用弯曲的钳子固定眼睛。然后小心地把眼睛从轨道上拉出来。
- 在诱导所有眼睛后,隔离视网膜:将封闭的剪刀引入视神经并打开刀片。将 RPE/乔里德剔除。使用弯曲的钳子取出镜片和血管。
- 将分离的视网膜转移到含有木瓜溶液的 1.5 毫升反应管中(由帕帕因分离套件提供)。
- 在37°C的水浴或摇床(400 rpm)中将视网膜孵化在木瓜溶液中30-60分钟。
- 当视网膜在帕潘溶液中孵化时,移液器 1 毫升卵巢状溶液到 15 毫升反应管(标签"1")。
- 将 60μl 的 DNase I (10 毫克/毫升) = 60μl 的卵巢溶液(由套件提供) + 520 μl 的 EBSS 添加到 15 毫升反应管(标签"2")。
- 在木瓜孵育后,将含有部分消化视网膜的木瓜溶液转移到反应管"2"。
- 使用火抛光移液器,执行机械分离(上下 10 倍)。
- 派珀特单细胞悬架反应管"1"。尝试通过将细胞悬架轻轻分层到卵巢溶液顶部来生成 2 层。
- 离心机在300 x g(约1,300 rpm)下5分钟。
- 丢弃超自然物,在 500 μl 的 MACS 缓冲器中重新补充细胞。
3. 使用磁相关细胞排序 (MACS) 的单元格排序
- 将 X μl 大鼠抗 CD73 抗体添加到 500 μl 中,以达到 10 μg/ml 的最终浓度。
- 在冰上孵化5分钟。
- 用 MACS 缓冲器将 15 毫升反应管填充到 10 毫升,以 300 x g 的速度将其离心机进行 5 分钟。
- 去除超自然。
- 将颗粒重新插入 480μl MACS 缓冲区,并添加 120 μl 山羊抗鼠 IgG 微珠。
- 在冰上孵化15分钟;不要搅拌、摇动或混合。
- 将 15 毫升反应管填充到 5 毫升,用 MACS 缓冲器和离心机在 300 x g 下进行 5 分钟。
- 由于反应管已离心:
- 将LS柱调整到磁性支架中。
- 将预分离过滤器放在 LS 列的顶部。
- 用 3 毫升 MACS 缓冲器将预分离滤镜和 LS 柱水合,并将 MACS 缓冲器收集到洗涤 (W) 管中。
- 去除超自然。
- 将颗粒重新喷入 500μl MACS 缓冲区。
- 将 500 μl 细胞悬架加载到过滤器中,然后将 1 毫升 MACS 缓冲器添加到过滤器中,并将负分数收集到负分数 (-) 反应管中。
- 接下来,在列中添加 3 x 3 毫升 MACS 缓冲器,以洗掉不绑定到列的单元
- 一旦这 9 毫升通过 LS 列,从磁性支架上取出列并将其安装在正分 (+) 反应管的顶部。
- 快速将 5 毫升 MACS 缓冲器加载到 LS 列中,并将柱塞放入 LS 列中,并按下它,直到整个缓冲区通过柱。
- 在 300 x g 下,将包含正分的反应管离心 5 分钟。
- 取出超自然,在 500 μl 的 MACS 缓冲器中重新喷出,并保持在 4 °C。
- 使用普通的细胞计数设备计算细胞总量。
- 准备从MACS缓冲区中含有2 x 105 个细胞/μl的正分拣分数的细胞悬架,并保持在4°C
4. 将MAC排序的光感受器前体细胞移植到小鼠网膜中
- 请务必准备好以下所有解决方案:1 毫升无菌 PBS 或 HBSS,10 μl DNAse I,1-2 毫升无菌除离子 H2O,细胞悬浮分数在 4 °C 的别名。
- 麻醉成年小鼠(即2-4个月大),注射盐酸甲基二胺(0.01毫克/10克体重),氯胺酮(0.75毫克/10克体重)。然后做皮下注射丁丙诺啡(0.05毫克/公斤体重)以减轻疼痛。
- 扩张学生与苯甲肾上腺素下降 2.5% - 热带 0.5% 。
- 将鼠标固定在鼠标头架中,放在立体显微镜下。
- 涂抹一滴维西迪凝胶,防止眼睛干燥。
- 使用无菌的30G 1/2针在硬膜和角膜(分别 奥拉塞拉塔)之间的边界上打一个小洞。
- 使用钻石笔将普通盖滑成小块(约 5 mm x 5 mm),将其中一块放在角膜顶部,从而可直接可视视视。
- 用除离子水多次冲洗预制的微滑器注射器。
- 用1μl的细胞悬浮加载微升注射器,通过结膜和硬膜直接针头切线,并在视网膜的鼻部置于视觉控制之下。
- 轻轻将一个孔打入视网膜,直到到达亚视网膜空间,将细胞悬浮注入子视网膜空间。
- 观察视网膜的牛皮分离,这应该是均匀的,覆盖大约1/4的视网膜空间,没有任何出血。
- 轻轻取出注射器,视网膜孔自动密封。
- 用除离子水多次冲洗微滑器注射器。
- 从头架上释放鼠标。
- 通过注射盐酸甲酰胺唤醒小鼠,以逆转盐酸甲基二甲基二甲烷的作用。
- 将鼠标置于温暖的暗室(约 25 °C)中,以唤醒时间。
- 移植后2天,布丙诺啡(0.05毫克/千克体重)应在上午和下午进行皮下注射,以缓解疼痛。
结果
为了评估棒光感受器集成到小鼠网状网膜的能力,使用了鼠标报告线,其中GFP由神经网状网膜白素拉链(Nrl,Nrl-GFP)促进器11驱动。Nrl 是杆光感受器的最早标记,在整个成年期间从 E12.5 开始表达,允许对供体杆光感受器细胞进行特定标记。
PN 4 Nrl-GFP幼崽被斩首,眼睛被引诱。然后,使用上述方法隔离和分离视网膜。然后使用基于 CD73 的 MACS(图 1和2)对由此产生的细胞悬架进行排序。在 MAC 排序之后,我们分析了在此过程中实现的丰富性。
如 图3A所示,初始细胞悬浮(输入)包含30.4%的GFP阳性细胞, 即棒光感受器。在基于 CD73 的 MAC 排序之后,通过流动细胞测量观察到 CD73 正分(CD73+)中高达 86.9% 的丰富度。在CD73阴性分数(CD73-)中,只有9.9%的细胞被检测到GFP(图3A)。基于 CD73 的 MACS 之后,Nrl-GFP 正细胞的富集 在体外 电镀后进一步可视化 (图 3B)。
MAC排序后,CD73阳性部分的供体细胞被剥离并重新吸收到200,000个细胞/μl的最终浓度。这种细胞悬浮进一步用于移植到野生型宿主视网膜的亚视网膜空间(图4)。移植后三到四周,宿主视网膜被固定、隔离和分割。几个供体细胞集成到宿主的外核层中,并获得了成熟光感受器的形态,使细胞体在外核层中定位,并形成突触球和内段(图5)。详细的图片已经公布之前,我们的组3,8 显示的结果可与FAC排序的细胞移植到主机视网膜由其他组4,6,10。在所有这些研究中,一致是,移植的细胞停留在注射部位,由牛皮分离的宿主网膜定义,并且不会迁移。有的集成到宿主视网膜(即 外层核层),有的留在亚视网膜空间3。此外,已经表明,在整合部位的供体细胞的分布取决于使用的鼠标模型的类型5。在C57BL/6J小鼠之间的移植中未发现急性宿主/移植排斥迹象。
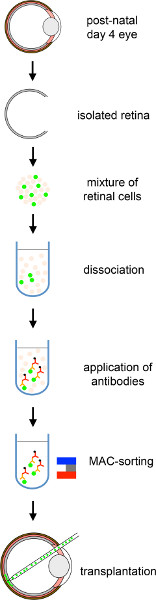
图1。MACS纯化光感受器前体移植到成年小鼠视网膜的整体方案。来自PN 4 Nrl-GFP幼崽的供体细胞被分离,然后进行基于CD73的MAC分类,并移植到小鼠宿主视网膜的亚视网膜空间中。单击此处查看较大的图。
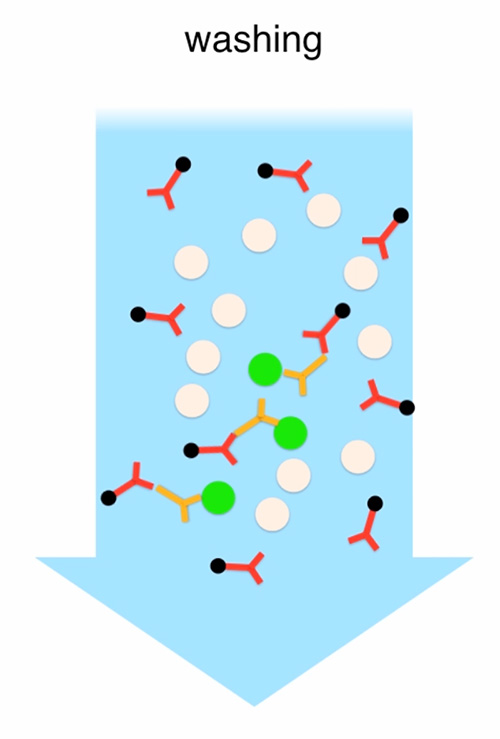
图2。MACS 对可移植光感受器的丰富性。 所有收集的PN4视网膜产生的细胞悬浮与原发性大鼠抗CD73抗体一起孵育,然后用与微珠结合的抗鼠抗体进行洗涤和孵化。未绑定抗体被冲走。细胞悬架通过与磁性支架相连的 LS 柱。受抗体约束的细胞保持附着在柱子上,而剩余的细胞则被稀释并收集(CD73阴性分数)。最后,LS 柱从磁性支架上移除,其余细胞被稀释并收集(CD73 正分)。 点击这里查看完整的电影。

图3。基于 CD73 的 MAC 排序后对 Nrl-GFP 正细胞浓缩的分析。(A) 在分类之前,供体细胞的初始种群中含有30.4%的Nrl-GFP正细胞。在 MAC 排序之后,可以在 CD73+ 分数(86.9%) 中检测到 GFP 阳性细胞的丰富性而CD73部分只包含少量的GFP®细胞(9.9%)。(B) 代表图像,演示基于 CD73 的 PN4 Nrl-GFP 单元的 MAC 排序结果。每个部分的100万个细胞被镀在层压膜上。细胞在电镀4%PFA 10分钟后4小时固定。细胞沾染了DAPI(4',6-迪亚米迪诺-2-苯林多,1:20,000)。与输入分数或CD73-分数相比,观察到CD73+分数中GFP阳性细胞的显著浓缩。单击此处查看较大的图。

图4。亚视注射。 将移植过程的原理图绘制到成年小鼠网膜中。针头通过 奥拉塞拉塔的一个孔插入,通过小视空间导航,避免触摸镜头,并放置在视网膜的视觉控制下。通过轻轻推挤,针头被打穿视网膜,并放置在亚视网膜空间。最终,通过评估分离过程,在视觉控制下仔细注射细胞悬架。
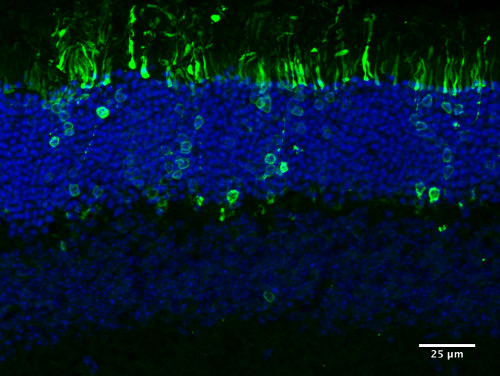
图5。移植的光感受细胞的整合。 代表图片描绘了集成的CD73为基础的MACS排序PN4 Nrl-GFP细胞移植到成年小鼠网膜后。移植的光感受器前体正确集成到外核层(ONL)中,产生成熟的光感受器形态。
讨论
光感受器前体细胞的亚视移植是实现这些光敏细胞在大量1,2中融入宿主视网膜的可靠工具。这可能使建立一个细胞疗法,用于治疗视网膜退行性疾病在未来6。细胞的供体群,目前从PN 4视网膜分离,是不同细胞类型的混合物,只有光感受器前体细胞在亚视网膜注射后整合。通过使用基于CD73的MAC排序,供体细胞悬架中的光感受器比例可以增加到≈90%,与未分类的细胞群8相比,野生型宿主视网膜的整合率提高了约3倍。与流动细胞学相比,MACS 具有快速分拣程序的优势,并且相对容易应用于 GMP 标准。鉴于多能干细胞12-14的体外生成光感受器最近具有优势,移植光感受器的纯化具有特殊意义。差异化多能干细胞的培养由多种细胞类型组成,因此特定分拣程序的可得性是它们将来用于细胞移植疗法的基本先决条件。
根据 MACS 净化程序,有几个点值得注意,确保工作流程不会受到重大干扰。待分类的视网膜数量越多,消化视网膜所需的时间就越多。消化后,在分拣过程中,必须避免细胞聚集。最好在添加二次抗体之前及其潜伏期间发生这种情况。在这种情况下,必须立即用移液器移除聚合物。在 MACS 缓冲器的洗除过程中,在收集 MACS 负分时,绝对有必要在列中添加超过 3 毫升。如果添加超过 3 毫升的缓冲区,缓冲区对柱子的压力将过高。这将干扰抗体与细胞的结合,降低分拣效率。当从磁性支架上取下列以开始收集 MACS 正分时,必须快速完成此步骤。应尽快将 5 毫升 MACS 缓冲器添加到列中。此外,应快速放置和按压,直到整个缓冲区通过列。没有必要担心施加的压力。MACS 缓冲器是异构的,可以多样化。可以使用 FACS 缓冲器、细胞培养介质、PBS、EBSS 或 HBSS。通过过滤 0.4 μm 滤膜,可以实现缓冲区不育。
在 MACS 浓缩后,可以通过记住以下几点来成功地将供体细胞移植到亚视空间。由于光感受细胞似乎对治疗前活体非常敏感,因此不建议将它们保持在 4 °C 上的时间比必要时间长。尽快进行移植。将注射针插入眼球时,避免接触镜头很重要,因为相对锋利的金属针可能会损坏镜头,导致透镜引起的尿炎诱导。进入亚视网膜空间的最后一步,视网膜的渗透,是至关重要的。由于它无法直观地观察亚视空间是否到达,因此培养一种对右推压和组织阻力的感觉非常重要。要测试,如果针头放置正确,可以应用少量,并应仔细观察针头的直膜分离。如果形成一个没有出血的圆形、牛皮状的分离,位置是正确的,并且可以仔细应用其余的解决方案。注射期间,针头应保持其位置,以避免对组织造成进一步损伤。注射针产生的视网膜孔如果慢慢缩回,将自行密封。整个过程应在尽可能短的时间内完成,以避免进一步的压力和对动物的损害。在移植过程中,细胞悬架倾向于团块和阻塞微滑剂注射器。如果发生这种情况,建议使用无菌 PBS 或 HBSS 稀释细胞悬架。克服这个问题的另一种可能性是在细胞悬浮中加入1μl的DNAAse I,溶解死细胞中的DNA团块,这些细胞往往将活细胞粘合在一起。
此协议仅限于细胞的磁性排序。因此,每个分拣回合只能对细胞进行一个标记排序。与流动细胞学相比,细胞可以同时使用不同的标记(包括生理特性以及不同的细胞表面标记)进行排序,这是这项技术的一个主要缺点。每当需要在短时间内对不同的标记进行排序时,流动细胞测量可能是更好的解决方案。此外,这种技术还无法对细胞的荧光特性进行排序,如转基因表达的GFP或其他生命细胞标记。它目前仅限于使用可与磁珠结合的细胞表面抗体。然而,这种技术可以根据所使用的技术设备进行扩展。
由于米尔泰尼生物tec是目前唯一的磁细胞分拣工具供应商,因此迄今别无选择。对于细胞分离,可以使用除木瓜素(即 三普辛)以外的其他酶。值得注意的是,我们的实验室取得了最好的结果与帕潘,因为这似乎是我们手中最温和的分离酶。帕平消化的时间窗口(30-60分钟)是可变的。在此期间,我们的实验室实现了最佳消化。根据样品大小、样品质量和使用的酶,可能需要更短或更长的潜伏时间。建议进行个人测试。
鉴于单步 MACS 的纯度水平不如流细胞测量值高,此技术的进一步应用可能是对不需要的和潜在的有害细胞进行负分拣。在那里,给定细胞表面标记的细胞分数为正数,但不感兴趣,可以整理出来,使兴趣分数在流经中孤立。这可以提前或在积极的排序步骤后完成,并允许使用不同的细胞表面标记进一步区分细胞,以及去除不需要的细胞,如支线层细胞或来自多能干细胞培养的未分化细胞,其潜在的肿瘤风险。因此,MACS 可能适合在将来可能的治疗应用中纯化来自 ES 或 iPS 细胞培养的光感受器,因为它代表着一种温和、快速和简单的治疗方法,用于纯化大量培养细胞。MACS 可以很容易地应用于 GMP 条件,因为与流式细胞测量相比,分拣步骤(即力学、流体和程序)的细节会减少。值得注意的是,MACS已经经常用于临床试验,以丰富血液或骨髓中的细胞。有趣的是,MACS甚至可以在没有合适的细胞表面标记时应用于细胞,通过基因引入表面标记,使细胞"有能力"用于随后的磁细胞分拣步骤15。
总之,MACS 是一种可靠且快速的工具,用于利用细胞表面标记来丰富光感受器前体细胞进行移植研究。此外,它是一种易于使用的方法,用于未来需要 GMP 条件的临床应用。
披露声明
作者声明没有相互竞争的经济利益。
致谢
我们要感谢阿南德·斯瓦鲁普为Nrl-GFP小鼠、乔琴·哈斯提供技术支持,以及辛迪·布姆和埃米利·莱斯曼提供畜牧业。
这项工作得到了德国福松斯格梅因沙夫特(DFG):FZT 111 - 德累斯顿再生疗法中心、CRTD种子赠款计划、SFB 655和普罗雷蒂娜e.V.的支持。 基金会、DIGS-BB德累斯顿研究生课程和特克诺洛尼亚基金会(SFRH/BD/60787/2009)
材料
| Name | Company | Catalog Number | Comments |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | supplied DNase I is not used in the method |
| Purified rat anti-mouse CD73, clone TY/23 | BD Pharmingen | 550738 | Stock concentration 0.5 mg/ml |
| Goat Anti-Rat IgG MicroBeads | Miltenyi | 130-048-501 | Total volume of 2 ml |
| PBS | Gibco | 10010-015 | Used to count the total number of cells |
| DNase I | Sigma | D5025-150KU | |
| HBSS | Gibco | 14025050 | Used for dissociation of the retinas |
| Trypan blue | Sigma | Fluka93595 | Used to count the total number of cells |
| Vidisic | Dr. Mann Pharma / Andreae-Noris Zahn AG | ||
| Domitor | Pfizer | 76579 | |
| Ketamine 10% | Ratiopharm | 7538843 | |
| Antisedan | Pfizer | 76590 | |
| Phenylephrin 2.5%-Tropicamid 0.5% | University Clinics Dresden Pharmacy | ||
| Preseparation Filters | Miltenyi | 130-041-407 | |
| LS Columns | Miltenyi | 130-042-401 | |
| MACS MultiStand | Miltenyi | 130-042-303 | |
| QuadroMACS Separator | Miltenyi | 130-090-976 | |
| Fire polish glass Pasteur pipette | Brand | 74777 20 | The pipette’s tips need to be fire-polished and autoclaved. |
| MACS 15 ml tube rack | Miltenyi | 130-091-052 | |
| Cell count chamber | Carl Roth | T728.1 | |
| Sterile 15 ml tubes | Greiner Bio-One | 188271 | |
| Leica M651 MSD | Leica | M651 MSD | can be used instead of Olympus SZX10 |
| Olympus SZX10 | Olympus | SZX10 | can be used instead of Leica M651 MSD |
| Olympus inverted stereo microscope CKX41 | Olympus | CKX41 | |
| Cell culture hood Thermo Scientific MSC-Advance | Thermo Scientific | 51025411 | |
| 1.5 ml Reaction tube | Sarstedt | 727706400 | |
| 2 ml Reaction tube | Sarstedt | 72695 | |
| Eppendorf Centrifuge 5702 | VWR (Eppendorf) | 521-0733 | |
| Mouse head holder | myNeurolab | 471030 | |
| BD Microlance 3 30 G 1/2 in | BD Pharmingen | 304000 | |
| Hamilton microliter syringe 5 µl, 75RN | Hamilton | 065-7634-01 | delivered without needles |
| Hamilton RN special needle 34 G | Hamilton | 065-207434 | Blunt, 12 mm length |
| Vannas-Tübingen Spring Scissors - 5 mm Blades Straight | Fine Science Tools | 15003-08 | |
| Dumont #7 Forceps - Titanium Biologie | Fine Science Tools | 11272-40 | |
| Diamond pen | Tools-tech | ||
| 15 mm x 15 mm Cover slips | Sparks | MIC3366 |
参考文献
- Bartsch, U., et al. Retinal cells integrate into the outer nuclear layer and differentiate into mature photoreceptors after subretinal transplantation into adult mice. Exp. Eye Res. 86, 691-700 (2008).
- MacLaren, R. E., et al. Retinal repair by transplantation of photoreceptor precursors. Nature. 444, 203-207 (2006).
- Eberle, D., et al. Outer segment formation of transplanted photoreceptor precursor cells. PLoS One. 7, (2012).
- Lakowski, J., et al. Cone and rod photoreceptor transplantation in models of the childhood retinopathy Leber congenital amaurosis using flow-sorted Crx-positive donor cells. Hum. Mol. Genet. 19, 4545-4559 (2010).
- Barber, A. C., et al. Repair of the degenerate retina by photoreceptor transplantation. Proc. Natl. Acad. Sci. U.S.A. 110, 354-359 (2013).
- Pearson, R. A., et al. Restoration of vision after transplantation of photoreceptors. Nature. , (2012).
- Singh, M. S., et al. Reversal of end-stage retinal degeneration and restoration of visual function by photoreceptor transplantation. Proc. Natl. Acad. Sci. U.S.A. 110, (2013).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Invest. Ophthalmol. Vis. Sci. 52, 6462-6471 (2011).
- Koso, H., et al. CD73, a novel cell surface antigen that characterizes retinal photoreceptor precursor cells. Invest. Ophthalmol. Vis. Sci. 50, 5411-5418 (2009).
- Lakowski, J., et al. Effective transplantation of photoreceptor precursor cells selected via cell surface antigen expression. Stem Cells. 29, 1391-1404 (2011).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proc. Natl. Acad. Sci. U.S.A. 103, 3890-3895 (2006).
- Eiraku, M., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Nakano, T., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Osakada, F., et al. Toward the generation of rod and cone photoreceptors from mouse, monkey and human embryonic stem cells. Nat. Biotechnol. 26, 215-224 (2008).
- Lee, M. Y., Lufkin, T. Development of the "Three-step MACS": a novel strategy for isolating rare cell populations in the absence of known cell surface markers from complex animal tissue. J. Biomol. Tech. 23, 69-77 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。