Method Article
İki Boyutlu Gabor Filtreler dayanarak Optik Scatter Mikroskopi
Bu Makalede
Özet
Biz Gabor gibi tek bir canlı hücre içinde hücre içi dinamiklerini ölçmek için filtreleme dayalı bir karanlık alan mikroskobu yöntemi göstermektedir. Teknik mitokondriyal parçalanma gibi organellerin yapısında değişiklikler, duyarlı.
Özet
Biz lekesiz canlı hücrelerin içinde organel morfolojisi ve organizasyon kaynaklanan hücre içi doku ölçebilirsiniz mikroskopik bir enstrüman ortaya koymaktadır. Önerilen araç organel boyut ve şekil nanoölçekli değişiklikleri, etiket optik mikroskopi hassasiyet uzanır ve programlanmış hücre ölümü ya da hücresel organel dinamikleri altında yatan temel biyolojik süreçlere ilişkin yapı-işlev ilişkisi çalışmada, hızlandırmak için kullanılabilir farklılaşması. Mikroskop kolayca mevcut mikroskopi platformlarda uygulanacak ve bu nedenle, bilim adamları, uygulamak ve sınırsız erişim ile önerilen yöntemler kullanabilirsiniz bireysel laboratuarlar, dissemine olabilir.
Önerilen tekniği iki boyutlu optik Gabor filtreleri yoluyla hücre gözlemleyerek ve hücre içi yapısını karakterize etmek mümkün. Bu filtreler anlamda nano ölçekli (10 nm) hassasiyet, boyutu ve yönü olmayan küresel hücre içi organelleri ile ilgili spesifik morfolojik özellikleri ile ayarlanmış olabilir. Elastik saçılma tarafından oluşturulan kontrast dayalı, teknik, detaylı bir ters saçılma modeli veya Mie teorisi üzerine morfometrik ölçümler ayıklamak için güvenmeye gelmez. Bu teknik, bu yüzden kesin bir teorik dağılım açıklamasına kolayca verilmez için küresel olmayan organelleri ve fonksiyonunu değerlendirmek için lekesiz canlı hücrelerin içinde elde edilebilir ayırt edici morfometrik parametreler sağlar. Discretized nesnenin yoğunluğu yerine dönüşümü doğrudan nesne alanında faaliyet gösterdiği dijital görüntü işleme tekniği göre avantajlıdır. Yüksek görüntü örnekleme oranları dayalı değildir ve bu nedenle oldukça büyütülmüş dijital görüntüler floresan konfokal mikroskopi tek tek organel segmentasyon ve yeniden yapılanma ötesine böylece büyük ölçüde organel yapısı çalışmanın kolaylaştırılması, hızla bir seferde yüzlerce hücre içinde morfolojik aktivite ekranı için kullanılabilir sınırlı görüş alanları.
Bu gösteriye metodoloji göstermek için bir deniz diatom veri göstermektedir. Biz de ilgili bir biyolojik bağlamda yöntem nasıl uygulanabilir bir fikir vermek için canlı hücreler alınan ön veriler göstermektedir.
Protokol
1. Hücrelerin hazırlanıyor
- Gerekir önce mitokondri floresan görüntüleme için Mitotracker yeşil etiketli olmak için gün kaplanmış hücre.
- 100 mcM stok solüsyonu Mitotracker DMSO yeşil önceden yapılmış, 4 ° C derin dondurucu ve el ile oda sıcaklığına çıkarın. Ayrıca, sığır aort endotel hücreleri (BAEC) ° C benchtop su banyosunda 37 de önceden hazırlanmış ve sıcak hücre kültür ortamı çıkarın.
- Mitotracker ve kültür ortamı ısındı sonra, eldivenli elleri ve% 70 etanol çözeltisi ile konteyner tüm dış yüzeyleri sterilize etmek için emin olun kaputu bu yerde. Floresan etiket ışığa karşı hassastır ve hızlı bir şekilde ortam ışığında photobleach, kaput ışığı açmayın.
- Mitokondriyal etiketlenmesi için doğru konsantrasyon çok önemlidir. Çok Mitotracker toksik etkileri olabilir, çok az mitokondri etkili bir etiket değil. Hücreleri ile 45 dakika inkübe Mitotracker 100 nM bir konsantrasyon iyi çalışır. 15 mL tüp içinde 10 ml kültür ortamı Mitotracker stokunun 100 mcL ekleyerek bu konsantrasyon hazırlayın. Bu deney için en az bir bol yapacak.
- Vakum hattına bağlı bir Pasteur pipeti ile eski orta emerek etiketli orta mevcut orta değiştirin. 6 plaka Sonra hemen her işgal altındaki kültür etiketli orta 2 mL ekleyin.
- Floresan etiket ışığa duyarlı olduğundan, doğrudan oda ışığına maruz kalmadan hızlı bir şekilde inkübatör hücrelerin yerine. Kapsayan elleri ile 6 plaka, bunun için iyi çalışır. Hücreleri için 45 dakika inkübatör kalacak.
2. Optik kurulum hazırlanıyor
- Hücrelerin inkübatör beklerken, biz optik kurulum çevirmek zorunda. Optik oda, ilk olarak, bilgisayar, mikroskop, kameralar ve lazer, civa ark lambası açmak. Sonra dijital micromirror cihazı (DMD) ve iplik difüzör takın.
- Optik lansman görüş alanında parlak bir lazer ışığı ile aydınlatılmış olmasını sağlamak için mikroskop mercek aracılığıyla bakarak uyumlu olduğundan emin olmak için kontrol edin.
- Tek parça sıkı bir kare içine lens kağıt katlama hedefi temizleyin ve bir hemostat sıkıca kavramak. Mercek kağıdı, kağıt içine küçük bir miktar absorbe amonyak içermeyen cam temizleme solüsyonu içine batırın. Rap ücretsiz birkaç kez el hemostat fazlalıkları kaldırın. Sıkıca ortasında lensin üzerinden, diğer bir ucundan objektif karşısında temiz, sürekli tokatlamak uygulayarak amacı silin. Yeniden tokatlamak ya da fırçalayın. Kullanılan kağıt atın.
- Örnek yüklemek için, 63x immersiyon yağı hedefi üzerinde graticule hedefi aşağı tüm yol ise amaç üzerinde 1-2 küçük bir damla immersiyon yağı bırakarak yerleştirin. Ardından sahne graticule yerleştirin. Sonra yağ örnek "kapmak" böylece hedefi yükseltmek. Mercekten örnek odaklanın.
- Kondenser hizalamak için, kondenser alanının stop altıgen kenar odaklanarak, merkezi Kohler aydınlatma hizalanacak şekilde kondenser yükseklik ayarı. Merkezi kondenser alan kondansatör merkezleme düğmeleri çevirerek gerektiğinde görüş alanın üzerine durdurun. Kondansatör diyafram durağı kapatılmış olmalıdır.
- RoperScientific Cascade 512 fotoğraf makinesini çalıştırmak için IPlab program ve giriş ayarları başlayın. Kamera transfer modu kare için ayarlanmış olduğundan emin olun. "Focus Edinme" komutunu çalıştırarak canlı önizleme başlayın. Dizin önek ve dosya konumu olan görüntüleri kaydedilir ayarlayın.
- CoolSnap programı çalıştırmak için RSImage programı ve giriş ayarları başlayın. Clocking modu normal olarak ayarlanmış olmalıdır.
- DMD yazılımını başlatın ve komut menüsünden takip karanlık alan iris, yer, "Yük ve Reset" komutu ve komut dosyasını çalıştırın.
- DMD ve Cascade 512 kamera LSM mikroskop optovar ve viewport ayarlayarak ışık gönder. Bu DF görüntü CCD üzerine projelendirme, DMD ve hizalı optik üzerinden göndermek. Karanlık alan (DF) görüntü IPlab zaten devam canlı önizleme görünmelidir. Gerekli olan canlı önizleme görüntü odak mikroskop ince odağı ayarlayın.
- "Tek elde" komutunu kullanarak görünümü alanında bir anlık görüntü alabilir. Maruz kalma süresi en az 10000 sayar görüntü sinyal sağlamak için yeterince yüksek ayarlayın. Satın alınmasından sonra, diske görüntü kaydetmek için "endeksli kaydet" komutunu kullanabilirsiniz. Graticule Bu görüntü view (FOV) alanın boyutu ölçer.
- Şimdi, sadece arka plan görünür graticule FOV ötesinde böylece graticule örnek hareket ettirin. Alan bir arka plan görüntü elde.5000 sayıları en az sinyal elde olduğundan emin olmak için yeterince uzun bir pozlama süresi. Bu görüntü, filtrelenmemiş görüntülerin arka plan çıkartılması konusunda yardımcı olacaktır.
3. Süzgeç Yükleme ve kurulum süzülmüş-arka plan görüntüleri elde etmek için kullanarak
- Şimdi, arka plan Gabor filtreden görüntüler elde etmek gerekir. Gabor filtre bankası script DMD kontrol yazılımı yükleyin. DMD dahili bellek için filtreleri arabellek tüm komut dosyasını çalıştırın; bu birkaç dakika sürebilir.
- Tüm betik tamponlu sonra, şimdi arka plan filtrelenmiş görüntü elde edebilirsiniz. Başlangıç kullanın ve bir defada bir Gabor gibi filtre ile ilgili filtreler sadece bir set yüklemek için DMD talimat DMD yazılım içinde belirteçleri durdurmak ve komut dosyasını çalıştırın. O filtre için filtrelenmiş bir görüntü canlı görüntü önizlemesi karanlık alan değiştirmek gerekir.
- Diskten IPlab satın komut dosyası açın. 2000 sayıları en az sinyal elde ediliyor sağlamak için maruz kalma süresi ayarlayın. DMD komut dosyası çalıştırarak, IPlab canlı önizleme iptal ve satın komut dosyasını çalıştırın. Bu otomatik olarak algılamak, indeks ve filtrelenmiş bir görüntü diske kaydetmek.
- Sonra ilk görüntü elde edilir, DMD yazılımı çalıştıran komut dosyası durdurmak ve komut dosyası kullanılmış komutları silin. Sonraki filtre seti başında ve sonunda başlangıç ve bitiş belirteçlerinin değiştirin. IPlab satın tekrarlayın.
- Tüm Süzgeç kullanılan ve tüm filtre görüntüleri elde kaydedildi kadar 3.4 adımı tekrarlayın.
4. Hücreleri Kaplama
- Artık, hücreler, yakında deney için plaka hazır olacak. Laboratuar benchtop havyanızla takın. 37 ° C'ye kadar L15 inceleyen orta ve ısı çıkarın Bir kağıt havlu ile bir iş istasyonu ve bir Kimwipe olun. Yırtılma ve twirling Kimwipes çeşitli fitiller olun. Fitiller ve hücre tabak sıvı transferi yardımcı olacaktır.
- Bundan sonra, biz örnek plaka gerekir. Biz, metal plaka arasına bir "lamel sandviç" hücreleri plaka işlenmiş metal örnek tutucuları kullanın. Her tarafta oluk uçlarında yaklaşık yarım uzanan metal plaka deliğin üst çevre etrafında bir şırınga ince bir boncuk vakum gres yağı uygulayın. Nazik bir şekilde temiz bir basın. 1 yağ üzerine lamel. Plakayı ters çevirin ve deliğin etrafındaki gres sürün. Odanın lambalarını kapatın.
- Şimdi inkübatör içeriği% 70 etanol ile sterilize nitril sınav eldiven ile işleme, inkübatör hücreleri olsun. Nefesinizi tutarak inkübatör kapı açıkken, inkübatör hücre plaka çıkarın. Oda ışığına maruz kalma en aza indirmek için dikkatli olun.
- Iyi yüzü yukarı hücreleri bağlı yan tarafında olduğunu belirterek, altı plaka deney için kullanılacak olan lamel çıkarın. Lamel yan hücreleri parça hangi tutarken, neredeyse tamamen kuruyana kadar her iki tarafta lamel dikkatlice kurutun. Daha sonra herhangi bir yağ tabakası içinde hava boşlukları kalması emin olmak için, görüntüleme delik üzerine yağlanmış metal plaka, aşağı lamel, hücre yan basın. Yağ, su geçirmez bir mühür formu bize L15 orta hücrelerin yüklemek için izin gerekir. Bu belli, plaka üzerinden geri çevirin.
- Üst lamel ve metal plaka arasındaki oluk yoluyla sıvı zorlayarak kaplı hücrelerin içine L15 orta Pipet. Bir seferde 200 mcL Pipetleme iyi çalışır. Ilk hacmi pipet sıvı ile diğer tarafta oluk neredeyse uzanan lamelleri arasında sıkışmış boşluğu doldurmak gerekir.
- Kaplama hücrelerin içine orta bir başka 200 mcL Pipet, ama bu sefer, bir orta, bir taraftan diğerine doğru akar ve böylece karşı koru fitil tutun. Bu hücreler yıkar ve eski orta izlerini kaldırır. Bu adım sırasında sıvı içinde oluşan herhangi bir kabarcıklarını engellemek için dikkatli olun. Bu sürecin her durulama için yeni bir fitil kullanılarak 2-3 kez tekrarlayın.
- Biz takılı havyanızla hatırlıyor musun? Şimdi kullanılan alır. Bu sıvı, hücre rezervuar içinde sıkışıp ve damlayabilir olamaz kenarlarından plaka destekleyen bir kez daha ters plaka çevirin. Havyanızla valap beher içine batırın. Bu hızla, sonra havyanızla ucu tutunacaktır valap bazı eriyecek. Havyanızla ucu bir aplikatör kullanarak alt lamel (şimdi yukarı bakacak şekilde) kenarlarında erimiş valap dikkatlice uygulayın. Lamel metal plaka sızdırmazlık, lamel çevresinde bir gidene kadar tüm yol daldırma ve uygulayarak devam edin.
- Hücrelerin alt lamel üzerinde büyüyen, ve maruz kalan tarafta kurutulmuş kadar orta kalıntı olabilir. Kimwipe ve dezenfeksiyon kadar balling lamel yüzeyinden herhangi bir kalıntı temizleying çok objektif temizleme gibi tek bir kayan hareket lamel. Bu lamel görülecektir merkezinde temiz olmasını sağlar.
- Havyanızla çıkarın ve aynı çevreleme ve sterilite prosedürleri gözlemleyerek inkübatör 6 plaka dönüş. Adımları 2.4 ve 2.5 'de açıklandığı gibi objektif optik laboratuar ve montajı kaplı hücreler alın.
5. Deney yaparak
- Sağlıklı görünümlü hücreler güzel bir alanını bulun.
- Görüş alanında karanlık bir alan görüntü elde. Diferansiyel girişim kontrast (DIC) mikroskop hizalayın ve DIC bir görüntü elde. Pozlama süreleri, bu sinyali yeterli olduğundan emin olmak için yeterince uzun olduğundan emin olun.
- Şimdi, diğer kamera floresan görüntüleri elde etmek için var. CoolSnap DIC görüntüleri almak için, mavi bir yerine ve gerektiğinde çıkarmadan, kondansatör bağlı LED kullanır. Mikroskop hala DIC uyumlu iken,% 100 dürbün 1.0x ve viewport mikroskop optovar ayarı CoolSnap ışık gönder. Mercek kamera görüntü aktar. LED alanında aydınlatmak ve RSimage FOV önizleme ve gerekirse ince odak ayarlamak için kondansatör üzerinde yerleştirin. DIC bir görüntü elde etme ve diskinize kaydedin. FOV Cascade kameradan elde edilen farklı nasıl unutmayın. Bu görüntüler deney sonucunda analiz aşamasında kayıtlı olması.
- Floresein filtercube filtre küp ayarlayarak bir floresan görüntü elde edin. Kısaca mikroskop kullanılarak floresans uyarma çevirerek bir görüntü elde etme ve satın alma tamamlandıktan sonra en kısa sürede kapatmak. DIC odaklı örnek beri, floresan görüntü yine iyi odaklanmış. Bu böylece photobleaching yavaşlatmadan, floresan maruz kalma süresi kaydeder. Diske floresan görüntü kaydetme.
- Şimdi filtrelenmiş görüntüler elde etmek için var. Karanlık alan mikroskobu sıfırlayın ve 2.9 olarak LSM bağlantı noktası üzerinden ışığında yeniden gönderin.
- 3,3-3,5 gibi tüm Gabor Süzgeç komut dosyasını çalıştırın. Biz şimdi bir zaman noktası için veri toplama tamamladık.
6. Staurosporine (STS) hücreleri ortaya çıkarmak için orta açma ve deney boyunca orta korumak
- Hücreleri hala sahnede ve görüş alanı bozmadan, aynı DMSO STS 4 mM stok çözüm yapılan STS 1 mcM çözüm içeren düzenli L-15 orta geçin. Medya geçiş adımları 4.6 açıklanan esneklik yöntemi kullanın.
- Şimdi, daha sonraki zaman noktalarında adımları 5,2-5,6 tekrarlayın. Deney tamamlanana kadar bu işlemi tekrarlayın.
- Deney sırasında, daha fazla orta örnek birbirinden ayrılacak şekilde eklenmesi gerekmektedir. Bu hücre plaka koru aşamasından çıkarmadan ve FOV bozmadan orta pipetleme tarafından gerçekleştirilir.
7. Temsilcisi Sonuçlar
Deney bitiminde, toplanan veriler, çok sayıda hücre içi yapısal veri ayıklamak için işlenmesi gereken süzülmüş görüntüleri yer alacak. İki örnek filtre dönemde S = 0.95μm, Gauss zarf standart sapma s = S / 2 = 0.45μm ve yönelimleri Φ = 0 ° 'ye kadar Φ = 160 ° 20 9 Gabor gibi filtreler oluşan bir optik filtre banka için gösterilir ° 'lik artışlarla. ([1] Daha fazla ayrıntı için bakınız).
Örnek 1: Deniz Diyatom
Önce karanlık alan (DF) görüntüleme (Şekil 1) açıkça görülüyordu odaklı özelliklere sahip bir deniz diatom örneği (Carolina Biyolojik Supply Company) yönlendirme hassas filtre banka uygulanır. Optik süzülmüş görüntüleri filtrelenmemiş görüntünün yanında, karşılaştırma için örnek gösterilmiştir.

Şekil 1: Koyu alan (DF) ve deniz diatom optik filtrelenmiş bir görüntü çıkar. Biz görüntü (en sol panelinde beyaz ok) sağ alt diatom analiz edecektir.
Diatom dokuz Gabor filtreden görüntüleri seti, nesne yönelimi ve yuvarlaklık için piksel-piksel işlendi. İşleme (1), böylece yanıt önemi kodlama sinyal yanıt genel büyüklüğünü belirlemek için her pikselin Gabor filtreden dokuz görüntüleri ölçülen tepkiler toplayarak, ve (2) Gabor filtresi yönünü bulma oluşuyordu, Φ, hangi yanıtı maksimize eden ve böylece her pikselin nesneleri tercih edilen bir yönelim var ölçüde kodlama tüm açılardan bu maksimal yanıt oranı ortalama yanıt alınması. Oryantasyon derecesi parçacık geometrik boy oranına yakından ilişkilidir. Şekil. 2B, incie filtre banka (parametre 1) ve yönelim ya da en-boy oranı (parametre 2) derecesi piksel genel yanıt sırasıyla, renk doygunluğu ve renk tonu olarak kodlanmış. Büyük değerler (kırmızı) daha yüksek bir tercih açısı yanıt mevcut olduğu alanlarda gösterir yakın bir boy oranı 1 (mavi), tercih edilen hiçbir yanıt açısı var olduğu alanlarda mevcut. Altyapı parçacık yönü her satırı yakından filtrelenmemiş karanlık alan (Şekil 2A) görünür altta yatan bir yerel nesne yönelimi ile mutabık kalınan bir sadak arsa (Şekil 2C), kodlanır.

Şekil 2: A: diatom Karanlık saha görüntüsü. B: Nesne yönelim görüntü. Parlaklık toplam Gabor filtre yanıt önemi kodlar çalışırken renk skalası oryantasyon derecesi (en boy oranı) gösterir. C: yanıt yoğunluk ≥% 10 maksimum nesneleri Yönlendirme. Çizgi segment ilgili yapının uzun ekseni gösterir.
Örnek 2: Apoptotik hücreleri
İşte biz, diatom olarak aynı şekilde işlendi staurosporine (STS) ile tedavi edilen sığır endotel hücreleri filtre görüntüleri göstermek. Şekil 3 T anında dokuz süzülmüş görüntüleri =- 180 dakika ile birlikte hücrelerin filtrelenmemiş bir karanlık alan (DF) görüntü gösterir. STS tedavi öncesinde.
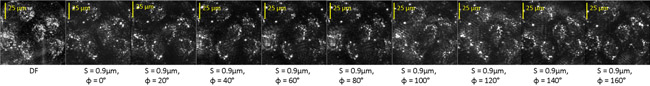
Şekil 3: birkaç yaşam endotel hücreleri içeren bir alanın Karanlık saha (DF) ve optik süzülmüş görüntüleri.
Süzülmüş görüntüleri sonradan STS tedavi sonrası üç saatlik bir süre boyunca her 20 dakikada elde edildi. Şekil 4a, zamanın bir fonksiyonu olarak hücrelerin bir boy oranı haritasını gösterir. Bu durumda, renk tonu, renk tonu için Şekil olarak oryantasyon derecesi (etiketli odaklığı) temsil eder. Yukarıda 2b. Ancak, en-boy oranı parlaklığı ortalama filtre cevabı ağırlıklı değildi. (Şekil 4b) etiketli bu hücrelerde mitokondri floresan görüntüleri ile boy oranı haritaları kayıt olarak, ölçülen boy oranı düşüşü mitokondri içeren hücresel bölgelerde sınırlı olduğunu belirledi ve doğrudan görülebiliyor mitokondriyal parçalanma ile eş zamanlı aynı hücrelerin floresans görüntüler. Şekil 5 tasvir zaman araziler hücrelerde apoptozis geçiren zamanın bir fonksiyonu olarak en-boy oranı değişiklik gösterir. = 60-100 floresan mitokondri kayıt bölgelerde dakika değil, loş bir arka plan floresan alanları ile kayıt bölgelerde her bir hücrenin içinde, T-boy oranı bir düşüş var.
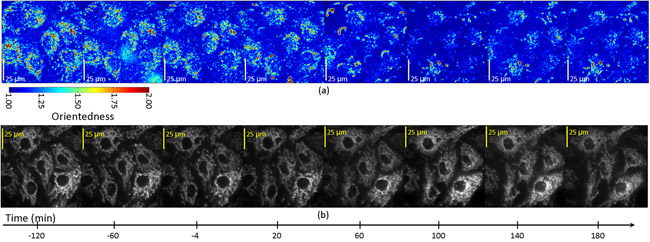
Şekil 4: En-boy oranı (a) ve floresan (b) endotel hücreleri apopitoz indükleyen staurosporine ile tedavi edilen görüntüler .
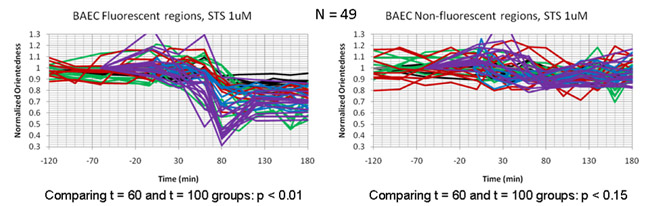
Şekil 5: staurosporine ile tedavi edilen endotel hücreleri parçacık boy oranı (odaklığı) azalma karşılaştırarak Zaman araziler. Bireysel izleri tek hücre zaman içinde araziler temsil eder. Odaklığı içinde damla floresan mitokondri (sol panel) hücreleri ile kayıt bölgeleri ile sınırlı kalan eşiğe bölgede (sağ panel) yoktur.
Şimdi en-boy oranı düşüşü mitokondriyal parçalanma karşılık geldiğini tespit ettik, biz, bu hücrelerin apoptoz neden hücreleri etiket kalmadan optik dağılım yöntemi kullanılarak parçalanma ölçmek ve bu farklı genetik ve deneysel koşullar etkisinin araştırılması dinamik.
Tartışmalar
Bu yöntem, örneğin parçacık boyutunu veya yönünü kodlamak nesnenin verim morfometrik haritalar yukarıda açıklanan. Bu yapısal bilgiler çeşitli şekillerde kullanılabilir:
- Bu, belirli bir tedavisi sırasında değiştirilmiş ve daha sonra bu bölgelerde spesifik moleküler ve biyokimyasal testlerin analiz doku veya hücre bölgeleri belirlemek için bir başlangıç ekranı olarak kullanılabilir.
- Bu hücrelerin hücre içi yapısı (bu yöntemle) kantitatif karakterizasyonu ile moleküler aktivitenin eş zamanlı anlayış (floresan) bir araya multimodal analiz verim floresan ile birlikte kullanılabilir.
- Bir zamanlar belirli bir yapısal yanıt, belirli bir biyolojik süreç (örneğin apoptosis), belirli bir organel aktivite ile ilişkili olduğu, bu yapısal yanıt etkileyen farklı genetik ve deneysel koşulları için ekranın herhangi bir floresan etiketler yöntemi olarak kullanılabilir.
Bugüne kadar biz yöntemi 30-50 nm [2] sırasına partikül boyutu farklılıklar duyarlı olduğunu göstermiştir. Biz yöntemi parçacık yönelim ve en boy oranı değişikliklerine duyarlı olduğunu göstermiştir [3] ve apoptozisi indüklediği mitokondriyal parçalanma (yukarıda Şekil 4-5) ile tutarlı bir parçacık-boy oranı azaltmak için.
Örneğin 2 sonuç bizim yöntemi, belirli bir organel fonksiyonu açısından yorumlanabilir ve floresan etiket veya eksojen boyalar olmadan toplanan olabilir hücresel fonksiyonları dinamik ölçümler izin verdiğini göstermektedir. Ancak, özellikle etiketli organeller karşı ölçülen tepkiler ilk doğrulama gerekli oldu. Bu ilk doğrulama tamamlandıktan sonra, organel dinamikleri etiket yöntemi ile doğrudan probed olabilir.
Yöntemi uygularken, birden fazla hücre koşulları ve mitokondri ile yaptı, farklı hücre içindeki organellerin konumu ile dinamik bir yapısal ölçüm ilişkilendirerek dinamik yapısal davranışları, benzersiz (spesifik hücresel devletler karakterize bir kütüphane, sonuçta yol açabilir örneğin, apoptozis, oksidatif ve metabolik stres, inflamatuar yanıt, vb.) .. Bu bilgi, daha fazla klinik hücre analizi ilaç keşfi de dahil olmak üzere çeşitli uygulamalarda kullanılan bir "hücre devlet analizörü" içine dahil olabilir.
Burada özetlenen yöntem mikroskopik görüntüleme sistemi ile elde edilen optik dağılım verileri belirli Subselüler dinamiklerini ayıklamak için kullanılabilecek genel bir yaklaşımı temsil ettiğini not etmek önemlidir. Bununla birlikte, kullanılan özel enstrümantasyon önemli ölçüde geliştirilmiş olabilir. Özellikle, mekansal filtreleme için mekansal ışık modülatör mevcut seçimi, veri toplama verimliliği, uzamsal frekans çözünürlüğü ve optik sinyal verim en üst düzeye çıkarmak için en uygun olmayabilir. [3] Burada kullanılan dijital mikro ayna cihazı ile ilişkili Kromatik ve geometrik sapmaları tartışılmıştır. Biz şu anda bu sorunları azaltmak için DMD yerde bir state-of-the-art likit kristal cihazın potansiyel avantajları ve dezavantajları araştırıyoruz. Buna ek olarak, veri toplama cihaz, mekansal filtreleme ve mikroskop kontrolü ayrı ayrı insan kullanıcı tarafından harekete geçirilir. Bu süzülmüş çok sayıda görüntü işlemeden önce toplanması gerekir alma süresi büyük ölçüde sınırlar. Böylece, kurulum otomasyonu alma süresi 10 filtrelenmiş bir görüntü başına milisaniye gürültü sinyal yeterli ulaşması bekleniyor CCD pozlama, süresi ile orantılı olmak şarttır. Temporal çözünürlük Bu artış aynı zamanda daha doğrusu bizi canlı hücre içindeki organellerin yapısal dinamikleri karakterize etmek için izin verecektir. Bu nedenle, etkin bir donanım kontrolü birleştirmek mikroskop kontrolü, CCD görüntü elde etme ve mekansal ışık modülatör optik filtreleme de dahil olmak üzere bileşenleri, harekete geçirme ve düzene özelleştirilmiş bir grafik kullanıcı arayüzü geliştirme üzerinde çalışıyoruz.
Açıklamalar
Teşekkürler
Bu araştırma mikro ayna cihazı, N. Boustany, Whitaker Vakfı Hibe RG-02-0682 tarafından finanse edildi. Devam eden işler N. Boustany NSF DBI-0852857 hibe tarafından finanse edilmektedir. RM Pasternack kısmen Rutgers Cumhurbaşkanlığı Yüksek Lisans Bursu ile desteklenmiştir. Biz de yararlı bir tartışma için optik filtreleme stratejileri ile ilgili çalışmalar ve Dr. DN Metaxas kullanılan iBMK hücreler için Dr. E. Beyaz teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | Low glucose DMEM | |
| Liebowitz L15 medium | Invitrogen | Without phenol red | |
| L-glutamine | Invitrogen | ||
| Mitotracker Green | Invitrogen | ||
| Bovine Brain Extract | Clonetics | ||
| Fetal Bovine Serum | Gemini Bio Products | ||
| Heparin | Sigma-Aldrich | ||
| Staurosporine | Sigma-Aldrich | ||
| Dymethylsulfoxide | Sigma-Aldrich | ||
| Inverted microscope | Carl Zeiss, Inc. | Axiovert 200M | |
| DMD | Texas Instruments | TI 0.7 XGA DMD 1100 | |
| CCD | Roper Scientific | Cascase 512B | High (16 bit) dynamic range CCD |
| CCD | Roper Scientific | Coolsnap cf |
Referanslar
- Pasternack, R. M., Qian, Z., Zheng, J. -Y., Metaxas, D. N., White, E., Boustany, N. N. Measurement of Subcellular Texture by Optical Gabor-Like Filtering with a Digitial Micromirror Device. Optics Letters. 33 (19), 2209-2211 (2008).
- Pasternack, R. M., Qian, Z., Zheng, J. -Y., Metaxas, D. N., Boustany, N. N. Highly sensitive size discrimination of submicron objects using optical Fourier filtering based on two-dimensional Gabor filters. Optics Express. 17 (14), 12001-12012 (2009).
- Zheng, J. -Y., Pasternack, R. M., Boustany, N. N. Optical scatter imaging with a digital micromirror device. Optics Express. 17 (22), 20401-20414 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.